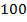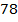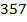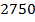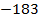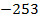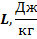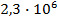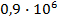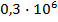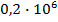Что такое удельная теплота парообразования и как ее определить. Парообразование воды
Физическая величина: теплота парообразования воды
Всем знакома картина: на кухонной плите на огне стоит кастрюля с водой. Вода из холодной постепенно становится горячей, вот на её поверхности появляются первые пузырьки, и вскоре уже вся она весело бурлит. Что такое теплота парообразования воды? Кое-кто из нас помнит из школьной программы, что температура воды при естественном атмосферном давлении не может превышать 100 °C. А кто не помнит или не верит, может воспользоваться соответствующим термометром и убедиться, соблюдая меры безопасности.

Но как такое может быть? Ведь под кастрюлей по-прежнему горит огонь, он отдаёт свою энергию жидкости, и куда же она девается, если не нагревает воду? Ответ: энергия расходуется на превращение воды в пар.
Куда же уходит энергия
В обычной жизни мы привыкли к трём состояниям окружающей нас материи: твёрдому, жидкости и газам. В твёрдом состоянии молекулы жёстко фиксированы в кристаллической решётке. Но это не обозначает их полной неподвижности, при любой температуре, лишь бы она была хоть на градус выше −273 °C (это абсолютный ноль), молекулы вибрируют. Причём амплитуда вибрации зависит от температуры. При нагреве энергия передаётся частичкам вещества, и эти хаотичные движения становятся интенсивнее, а затем достигают в определённый момент такой силы, что молекулы покидают гнёзда решётки – вещество становится жидкостью.
В жидком состоянии молекулы тесно связаны между собой силой притяжения, хотя и не фиксированы в определённой точке пространства. При дальнейшем накоплении веществом тепла хаотичные вибрации части молекул становятся так велики, что сила притяжения молекул друг к другу преодолевается, и они разлетаются. Температура вещества перестаёт расти, вся энергия передаётся теперь следующим и следующим партиям частичек, и так, шаг за шагом, вся водичка из кастрюли заполняет кухню в виде пара.

Каждое вещество требует определённой энергии для осуществления этого процесса. Теплота парообразования воды, как и других жидкостей, конечна и имеет конкретные значения.
В каких единицах измеряется
Любая энергия (хоть движения, хоть теплоты) измеряется в джоулях. Джоуль (Дж) назван так в честь знаменитого учёного Джеймса Джоуля. Численно энергию в 1 Дж можно получить, если на расстояние 1 метр толкать некое тело с усилием в 1 Ньютон.
Ранее для измерения теплоты использовали такое понятие, как «калория». Считалось, что тепло – эта такая физическая субстанция, которая может втекать или вытекать из любого тела. Чем больше «натекло» её в физическое тело, тем оно горячее. В старых учебниках ещё можно встретить эту физическую величину. Но её несложно перевести в джоули, достаточно умножить на 4,19.
Энергия же, необходимая для превращения жидкостей в газы, именуется удельной теплотой парообразования. Но как её подсчитать? Одно дело превратить в пар пробирку воды и другое дело – бак парового двигателя огромного судна.
Поэтому, к примеру, для Н2О, в теплотехнике оперируют понятием "удельная теплота парообразования воды" (Дж/кг - единица измерения). И ключевое слово тут «удельная». Считается то количество энергии, которое необходимо для превращения в пар 1 кг жидкой субстанции.
Обозначается величина латинским литером L. Меряется величина в джоулях на 1 кг.
Сколько энергии требует вода
Удельная теплота парообразования воды измеряется так: в ёмкость наливается количество N, доводится до кипения. Энергия, затраченная на парообразование литра воды, и будет искомым значением.

Измерив, чему равна удельная теплота парообразования воды, учёные были слегка удивлены. Для превращения в газ вода требует энергии больше, чем все распространённые на Земле жидкости: вся линейка спиртов, сжиженные газы и даже больше, чем такие металлы, как ртуть и свинец.
Итак, теплота парообразования воды оказалось равной 2,26 мДж/кг. Для сравнения:
- у ртути - 0,282 мДж/кг;
- у свинца - 0,855 мДж/кг.
А что если наоборот?
А что происходит, если обратить процесс вспять, заставить жидкость конденсироваться? Ничего особенного, происходит подтверждение закона сохранения энергии: при конденсации одного килограмма жидкости из пара выделяется ровно такое же количество тепла, какое требуется затратить на превращение её обратно в пар. Поэтому чаще в справочных таблицах встречается термин «удельная теплота парообразования и конденсации».

Кстати, тот факт, что при испарении теплота поглощается, с успехом используется в бытовой и промышленной технике для создания искусственного холода.
fb.ru
Процесс парообразования | Парообразование воды
Здравствуйте! В природе вода встречается в виде жидкости, и для того чтобы получить ее в газообразном состоянии, то есть превратить в пар, необходимо затратить тепловую энергию. Этот процесс называется парообразованием. В процессе кипения жидкости при постоянном давлении образуется пар, находящийся в состоянии термодинамического равновесия с жидкостью. При этом температура пара и жидкости равна температуре парообразования (насыщения). Температура насыщения пара зависит от давления: Tн=f (p). Чем выше давление р пара, тем больше температура насыщения Тн. Если давление постоянно, то процесс парообразования происходит при постоянной температуре.
Насыщенный пар может быть сухим или влажным. Сухой насыщенный пар не содержит жидкой фазы. Влажный насыщенный пар представляет собой смесь сухого насыщенного пара и жидкости, которая находится во взвешенном состоянии в виде мелких капелек кипящей воды. Благодаря этому влажный пар всегда можно увидеть. Для характеристики влажного насыщенного пара вводят понятие степени сухости х пара. Степень сухости— это отношение массы сухого насыщенного пара ко всей массе влажного пара.
Если температура пара выше температуры насыщения, то пар называют перегретым. Такой пар не может находиться в равновесном состоянии с жидкостью и получается путем нагревания сухого насыщенного пара в объеме, где жидкость отсутствует. Отвод теплоты от перегретого пара приводит к снижению его температуры, тогда как отвод теплоты от насыщенного пара приводит к конденсации определенной его части.
Рассмотрим на pυ-диаграмме процесс парообразования в условиях, когда переход жидкости в пар осуществляется при постоянном давлении. Такой процесс широко применяется в различных установках, предназначенных для производства пара. Например, в котельных агрегатах, в которых получается основная масса пара для энергетических и технических целей, производится пар, имеющий определенное, постоянное для данного агрегата давление.
Процесс получения пара при постоянном давлении p1 показан на рис. 1. Этому процессу соответствует изобара ad. Точка а характеризует начальное состояние жидкости, а отрезок ab — увеличение объема при нагревании жидкости до температуры парообразования. В точке b температура жидкости равна температуре парообразования. На участке bс происходит процесс парообразования при постоянной температуре, сопровождающийся значительным увеличением объема вещества.
При этом вещество представляет собой двухфазную систему из жидкости и насыщенного пара. На отрезке Ьс пар является влажным насыщенным (х<1). Когда испарится вся жидкость, взвешенная в паре, он станет сухим насыщенным (точка с). Дальнейший подвод теплоты приводит к перегреву насыщенного пара и сопровождается увеличением его объема и температуры (отрезок cd на рис. 1).
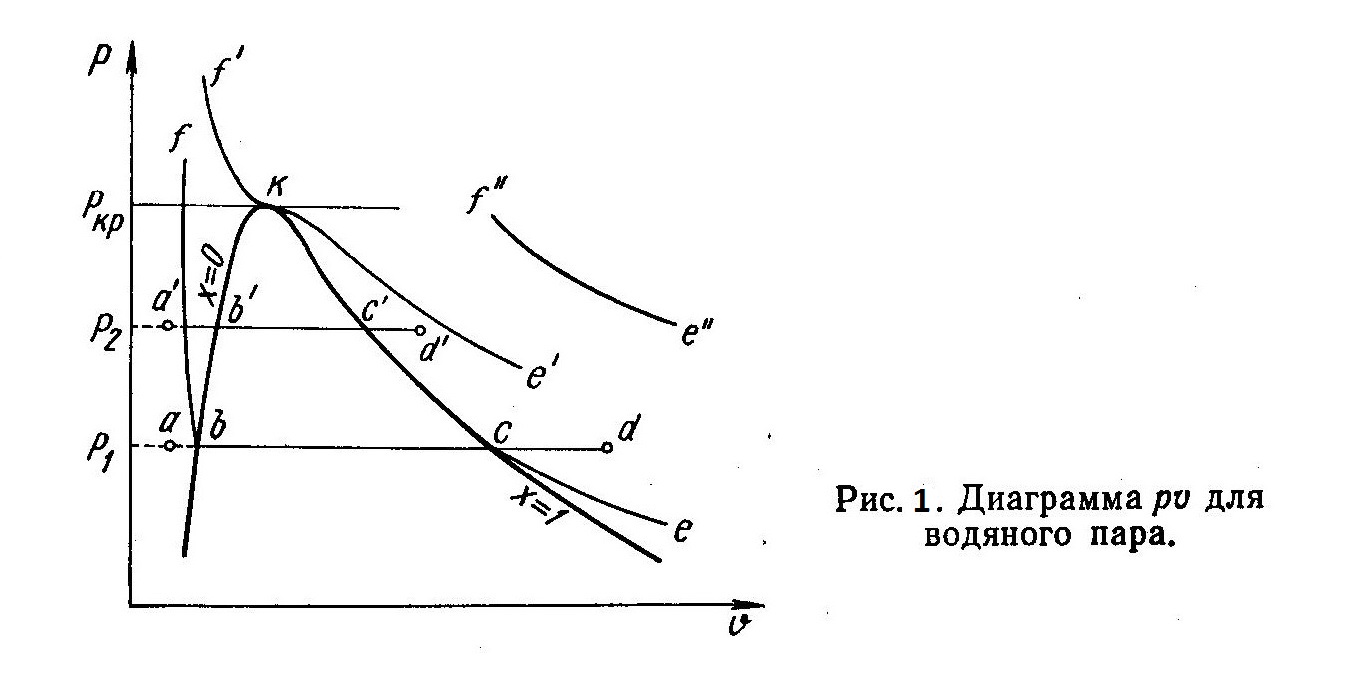
Правее точки с пар находится в перегретом состоянии. Процессу парообразования при другом, более высоком давлении р на pυ-диаграмме соответствует изобара a'd'. Объем жидкости при температуре кипения в точке b' больше объема в точке b. Точка с' характеризующая состояние сухого насыщенного пара, расположена левее точки с, так как более высокому давлению соответствует меньший удельный объем пара.
С увеличением давления точки, которые изображают состояние воды при температуре парообразования, смещаются вправо, а точки, характеризующие состояние сухого насыщенного пара, располагаются левее. Если соединить точки, соответствующие одинаковым состояниям вещества, то на диаграмме получатся две кривые bb'К и сс'К. Кривую bb'К, определяющую состояние жидкости при температуре кипения, называют пограничной кривой жидкости, а кривую сс'К, которая соответствует состоянию сухого насыщенного пара,— пограничной кривой пара. На этой линии степень сухости пара х= 1.
Пограничные кривые пара и жидкости соединяются в точке К, которая называется критической (для воды параметры критической точки равны tкр = 374,15°C и ркр= = 22,13 МПа). При давлениях, больших, чем в точке К, исчезает различие между свойствами жидкости и пара, так как при высоких давлениях плотность пара становится равной плотности жидкости. Область диаграммы, которая расположена выше изобары ркр, проходящей через точку К, называется сверхкритической областью.
Существование для каждого вещества критической точки и сверхкритических состояний впервые было установлено в 1861 г. Д. И. Менделеевым. Процесс получения пара в сверхкритической области происходит без подвода теплоты и увеличения объема вещества, то есть без образования свободной поверхности жидкости.
Левее линии bК находится область жидкости. Между пограничными кривыми пара и жидкости расположена область влажного насыщенного пара. Изотерма fbce, пересекающая эту область, совпадает с участком bс изобары. Через точку К проходит критическая изотерма f'Ke', которая имеет характерный излом и касается линии bКс.
Правее линии Кс находится область перегретого пара. Изотермы в этой области с увеличением температуры приближаются к равносторонним гиперболам (изотерма f‘‘e‘‘), т. е. свойства пара приближаются к свойствам идеального газа.
В сверхкритической области невозможно изотермическим сжатием превратить пар в жидкость, так как изотермы не пересекают пограничных кривых. В процессе кипения к жидкости подводится теплота парообразования. Удельная теплота парообразования характеризует количество теплоты, которую необходимо подвести к 1 кг жидкости, нагретой до температуры Тн, для превращения ее в пар (измеряется в Дж/кг и обозначается r). Величина r уменьшается с ростом давления и в критической точке К равна нулю. Исп. литература: 1) Основы теплоэнергетики, А.М.Литвин, Москва, Госэнергоиздат, 1958. 2)Теплотехника, Бондарев В.А., Процкий А.Е., Гринкевич Р.Н. Минск, изд. 2-е,"Вышейшая школа", 1976.
teplosniks.ru
Кипение. Удельная теплота парообразования и конденсации
Тема: Агрегатные состояния вещества
Урок: Кипение. Удельная теплота парообразования и конденсации
На прошлом уроке мы уже рассмотрели один из видов парообразования – испарение – и выделили свойства этого процесса. Сегодня мы обсудим такой вид парообразования, как процесс кипения, и введем величину, которая численно характеризует процесс парообразования – удельная теплота парообразования и конденсации.
Определение.Кипение (рис. 1) – это процесс интенсивного перехода жидкости в газообразное состояние, сопровождающийся образованием пузырьков пара и происходящий по всему объему жидкости при определенной температуре, которую называют температурой кипения.

Рис. 1. Кипение (Источник)
Сравним два вида парообразования между собой. Процесс кипения более интенсивен, чем процесс испарения. Кроме того, как мы помним, процесс испарения протекает при любой температуре выше температуры плавления, а процесс кипения – строго при определенной температуре, которая является различной для каждого из веществ и называется температурой кипения. Еще следует отметить, что испарение происходит только со свободной поверхности жидкости, т. е. с области, разграничивающей ее с окружающими газами, а кипение – сразу со всего объема.
Более подробно рассмотрим протекание процесса кипения. Представим ситуацию, с которой многие из нас неоднократно сталкивались, – это нагревание и кипячение воды в некотором сосуде, например, в кастрюле. В ходе нагревания воде будет передаваться определенное количество теплоты, что будет приводить к увеличению ее внутренней энергии и увеличению активности движения молекул. Этот процесс будет протекать до определенного этапа, пока энергия движения молекул не станет достаточной для начала кипения.
В воде присутствуют растворенные газы (или другие примеси), которые выделяются в ее структуре, что приводит к так называемому возникновению центров парообразования. Т. е. именно в этих центрах начинает происходить выделение пара, и по всему объему воды образовываются пузырьки, которые наблюдаются при кипении. Важно понимать, что в этих пузырьках находится не воздух, а именно пар, который образовывается в процессе кипения. После образования пузырьков количество пара в них растет, и они начинают увеличиваться в размерах. Зачастую, изначально пузырьки образуются вблизи стенок сосуда и не сразу поднимаются на поверхность; сначала они, увеличиваясь в размерах, оказываются под воздействием нарастающей силы Архимеда, а затем отрываются от стенки и поднимаются на поверхность, где лопаются и высвобождают порцию пара.
Стоит отметить, что далеко не сразу все пузырьки пара достигают свободной поверхности воды. В начале процесса кипения вода прогрета еще далеко не равномерно и нижние слои, вблизи которых происходит непосредственно процесс теплопередачи, еще горячее верхних, даже с учетом процесса конвекции. Это приводит к тому, что поднимающиеся снизу пузырьки пара схлопываются из-за явления поверхностного натяжения, еще не доходя до свободной поверхности воды. При этом пар, который находился внутри пузырьков, переходит в воду, тем самым дополнительно нагревая ее и ускоряя процесс равномерного прогрева воды по всему объему. В результате, когда вода прогревается практически равномерно, почти все пузырьки пара начинают достигать поверхности воды и начинается процесс интенсивного парообразования.
Важно выделить тот факт, что температура, при которой проходит процесс кипения, остается неизменной даже в том случае, если увеличивать интенсивность подвода тепла к жидкости. Простыми словами, если в процессе кипения прибавить газ на конфорке, которая разогревает кастрюлю с водой, то это приведет только к увеличению интенсивности кипения, а не к увеличению температуры жидкости. Если углубляться более серьезно в процесс кипения, то стоит отметить, что в воде возникают области, в которых она может быть перегрета выше температуры кипения, но величина такого перегрева, как правило, не превышает одного-пары градусов и незначительна в общем объеме жидкости. Температура кипения воды при нормальном давлении составляет 100°С.
В процессе кипения воды можно заметить, что он сопровождается характерными звуками так называемого бурления. Эти звуки возникают как раз из-за описанного процесса схлопывания пузырьков пара.
Процессы кипения других жидкостей протекают аналогичным образом, что и кипение воды. Основное отличие в этих процессах составляют различные температуры кипения веществ, которые при нормальном атмосферном давлении являются уже измеренными табличными величинами. Укажем основные значения этих температур в таблице.
|
Вещество |
|
|
Вода |
|
|
Спирт |
|
|
Ртуть |
|
|
Железо |
|
|
Кислород |
|
|
Водород |
|
Интересен тот факт, что температура кипения жидкостей зависит от величины атмосферного давления, поэтому мы и указывали, что все значения в таблице приведены при нормальном атмосферном давлении. При возрастании давления воздуха возрастает и температура кипения жидкости, при уменьшении, наоборот, уменьшается.
На этой зависимости температуры кипения от давления окружающей среды основан принцип работы такого известного кухонного прибора, как скороварка (рис. 2). Она представляет собой кастрюлю с плотно закрывающейся крышкой, под которой в процессе парообразования воды давление воздуха с паром достигает значения до 2 атмосферных давлений, что приводит к увеличению температуры кипения воды в ней до 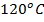 . Из-за этого вода с продуктами в ней имеют возможность нагреться до температуры выше, чем обычно (
. Из-за этого вода с продуктами в ней имеют возможность нагреться до температуры выше, чем обычно (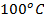 ), и процесс приготовления ускоряется. Из-за такого эффекта устройство и получило свое название.
), и процесс приготовления ускоряется. Из-за такого эффекта устройство и получило свое название.

Рис. 2. Скороварка (Источник)
Ситуация с уменьшением температуры кипения жидкости с понижением атмосферного давления также имеет пример из жизни, но уже не повседневной для многих людей. Относится такой пример к путешествиям альпинистов в высокогорных районах. Оказывается, что в местности, находящейся на высоте 3000–5000 м, температура кипения воды из-за уменьшения атмосферного давления снижается до 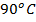 и более низких значений, что приводит к сложностям при приготовлении пищи в походах, т. к. для эффективной термической обработки продуктов в таком случае требуется значительно большее время, чем при нормальных условиях. На высотах около 7000 м температура кипения воды доходит до
и более низких значений, что приводит к сложностям при приготовлении пищи в походах, т. к. для эффективной термической обработки продуктов в таком случае требуется значительно большее время, чем при нормальных условиях. На высотах около 7000 м температура кипения воды доходит до 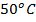 , что приводит к невозможности приготовления многих продуктов в таких условиях.
, что приводит к невозможности приготовления многих продуктов в таких условиях.
На том, что температуры кипения различных веществ отличаются, основаны некоторые технологии разделения веществ. Например, если рассматривать нагревание нефти, которая представляет собой сложную жидкость, состоящую из множества компонентов, то в процессе кипения ее можно будет разделить на несколько различных веществ. В данном случае, благодаря тому, что температуры кипения керосина, бензина, лигроина и мазута различны, их можно отделить друг от друга путем парообразования и конденсации при различных температурах. Такой процесс, как правило, называют разделением на фракции (рис. 3).
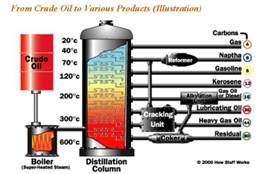
Рис. 3 Разделение нефти на фракции (Источник)
Как и любой физический процесс, кипение необходимо характеризовать с помощью какой-то численной величины, такую величину называют удельной теплотой парообразования.
Для того чтобы понять физический смысл этой величины, рассмотрим следующий пример: возьмем 1 кг воды и доведем ее до температуры кипения, затем замерим, какое количество теплоты необходимо для того, чтобы полностью испарить эту воду (без учета тепловых потерь) – эта величина и будет равна удельной теплоте парообразования воды. Для другого вещества это значение теплоты будет другим и будет являться удельной теплотой парообразования этого вещества.
Удельная теплота парообразования оказывается очень важной характеристикой в современных технологиях производства металлов. Оказывается, что, например, при плавлении и испарении железа с его последующей конденсацией и затвердеванием образуется кристаллическая решетка с такой структурой, которая обеспечивает более высокую прочность, чем исходный образец.
Обозначение: 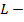 удельная теплота парообразования и конденсации (иногда обозначается
удельная теплота парообразования и конденсации (иногда обозначается 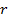 ).
).
Единица измерения: 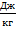 .
.
Удельная теплота парообразования веществ определяется с помощью экспериментов в лабораторных условиях, и ее значения для основных веществ занесены в соответствующую таблицу.
|
Вещество |
|
|
Вода |
|
|
Спирт |
|
|
Ртуть |
|
|
Воздух (жидкий) |
|
Если известно, что вещество находится при температуре кипения, то для вычисления количества теплоты, необходимого для превращения его в газообразное состояние используют следующую формулу:
Обозначения:
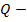 количество теплоты парообразования, Дж;
количество теплоты парообразования, Дж;
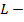 удельная теплота парообразования и конденсации,
удельная теплота парообразования и конденсации, 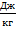 ;
;
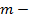 масса вещества, кг.
масса вещества, кг.
В случае рассмотрения процесса конденсации вещества формула, описывающая количество теплоты, остается такой же, но берется со знаком минус, что подчеркивает выделение тепла в процессе конденсации, в отличие от поглощения тепла в процессе кипения, однако, зачастую этот минус не учитывается, если находится модуль количества теплоты.
На следующем уроке мы уделим внимание решению задач.
Список литературы
- Генденштейн Л. Э, Кайдалов А. Б., Кожевников В. Б. Физика 8 / Под ред. Орлова В. А., Ройзена И. И. – М.: Мнемозина.
- Перышкин А. В. Физика 8. – М.: Дрофа, 2010.
- Фадеева А. А., Засов А. В., Киселев Д. Ф. Физика 8. – М.: Просвещение.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Классная физика (Источник).
- YouTube (Источник).
- YouTube (Источник).
- YouTube (Источник).
Домашнее задание
- Стр. 45: вопросы № 1–3; стр. 51: вопросы № 1–5, упражнение № 10. Перышкин А. В. Физика 8. – М.: Дрофа, 2010.
- Какое количество теплоты нужно затратить для превращения в пар 100 г воды, 50 г спирта, 12 г эфира? Жидкости находятся при температуре кипения.
- Любое кипение одновременно является парообразованием, а всякое ли парообразование является кипением? Какое явление встречается чаще?
- В кастрюлю налито 2 л воды при температуре
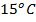 . После закипания в кастрюле оказалось на 200 г меньше воды, чем в начале нагревания. Сколько тепла получила вода в кастрюле?
. После закипания в кастрюле оказалось на 200 г меньше воды, чем в начале нагревания. Сколько тепла получила вода в кастрюле? - В открытой кастрюле с гладкими стенками и дном можно, осторожно нагревая, довести чистую воду (без крупинок и растворенного воздуха) до температуры свыше
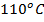 . Но почему вода не закипает?
. Но почему вода не закипает?
interneturok.ru
Парообразование и испарение воды
На Изображении 1 показано потребление газа в процессе доведения воды до состояния кипения и испарения.
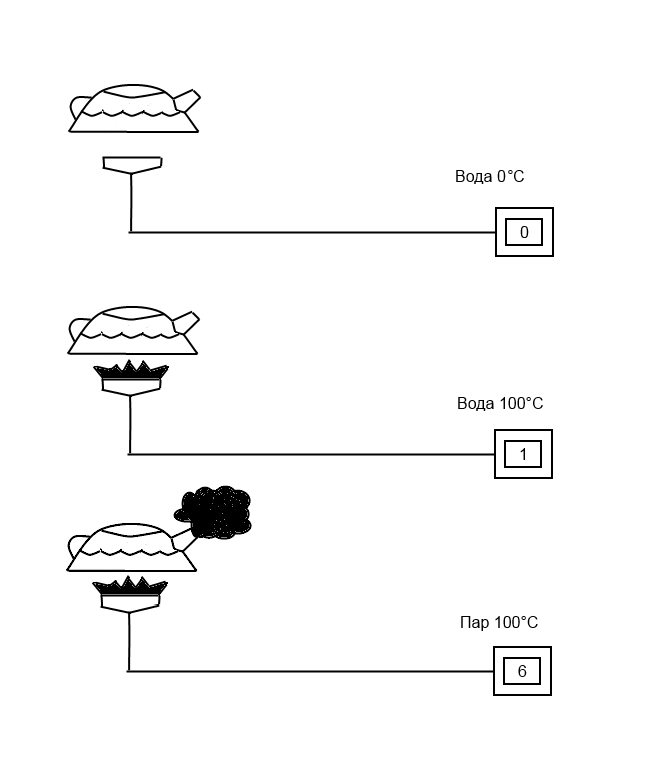 |
| Изображение 1: Чайник и счетчик газа |
В начале измерения счетчик газа находится в положении ноль. В момент нагрева воды до температуры 100оС показание счетчика составляет «1 относительных единиц газа». Для полного испарения воды было затрачено около 6 относительных единиц газа. Это значит, что для испарения воды требуется примерно в 6 раз больше энергии, чем для доведения ее до состояния кипения. Или иначе говоря:
1 кг пара при температуре 100оС содержит примерно в 6 раз больше тепловой энергии, чем 1 кг воды при температуре 100оС. Если пар с температурой 100оС отдает тепловую энергию, то образуется конденсат с температурой 100оС. В процессе конденсирования из 1 кг пара с температурой 100оС высвобождается примерно в 6 раз больше тепловой энергии, чем содержится в воде того же количества и той же температуры.
Изображение 2 а отображает количество энергии, которое потребляется для нагрева и испарения 1 кг воды при атмосферных условиях. Удельная теплоемкость воды составляет 4,18 или около 4,2 кДж/кг х К. Чтобы перегреть 1 кг воды с 0оС до 100оС требуется 100х4,2=420 кДж тепловой энергии (h’). Количество теплоты парообразования (r), которая требуется для нагрева 1 кг воды от 100оС до полного испарения составляет 2258 кДж/кг и может быть определено по таблице насыщенного пара (см. Таблицу насыщенного пара).
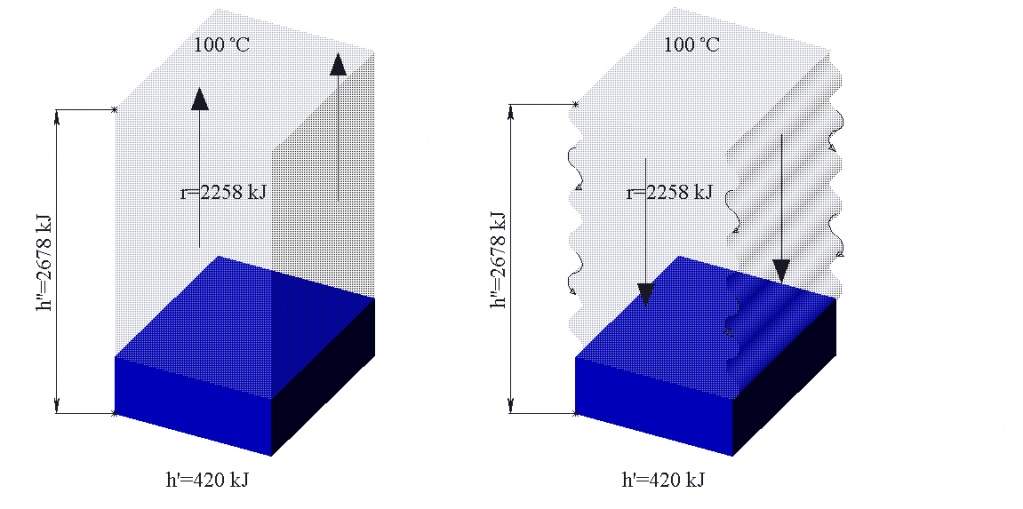 | |
| Изображение 2а: Испарение | Изображение 2b: Конденсация |
Для того, чтобы довести 1 кг воды при 0оС и атмосферных условиях до состояния полного испарения, необходимо затратить тепловую энергию в количестве (h” = h’ + r) 420 + 2258 = 2678 кДж. В процессе передачи тепла от пара к продукту или в теплообменном аппарате пар конденсируется. Тепловая энергия, которая при этом высвобождается, это тепловая энергия конденсации. Если тепловая энергия при атмосферном давлении от пара отбирается, то высвобождается 2258 кДж/кг тепловой энергии конденсации, при этом остаточное теплосодержание конденсата составляет 420 кДж/кг при 100оС, см Изображение 2b
В замкнутом пространстве температура кипения увеличивается.
Тепловая энергия парообразования – это количество теплоты, которое выделяется в процессе конденсирования пара. Полученный при этом конденсат имеет такую же температуру, как и пар, из которого он образовался.
Процессы, в которых давление пара составляет 1 бар, встречаются достаточно редко, поскольку давление пара зависит от требуемой температуры процесса.
- Каждому значению давления пара соответствует свое значение температуры насыщения.
- Насыщенный пар давлением 10 бар имеет температуру насыщения 180оС, 5 бар – 152оС и 30 бар – 234оС и т.д.
Кроме температуры насыщения также и другие параметры пара зависят от давления, как например тепловая энергия насыщения и парообразования, энтальпия и удельный объем. Их значения приведены в таблице насыщенного пара.
Источник: "Рекомендации по применению оборудования ARI. Практическое руководство по пару и конденсату. Требования и условия безопасной эксплуатации. Изд. ARI-Armaturen GmbH & Co. KG 2010"
Получить консультацию и приобрести оборудование для паро-конденсатных систем можно по телефону (495) 268-0-242.
nomitech.ru
Удельная теплота парообразования воды
Физический смысл величины
Для кипения требуется энергия. Большая ее часть используется для разрыва химических связей между атомами и молекулами, в результате чего образуются пузырьки пара, а меньшая идет на расширение пара, то есть на то, чтобы образовавшиеся пузырьки могли лопнуть и выпустить его. Так как жидкость всю энергию вкладывает в переход в газообразное состояние, ее «силы» иссякают. Для постоянного возобновления энергии и продления кипения нужно подводить к емкости с жидкостью все новое и новое тепло. Обеспечить его приток может кипятильник, газовая горелка либо любой другой нагревательный прибор. Во время кипения температура жидкости не растет, идет процесс образования пара такой же температуры.
Разным жидкостям требуется разное количество теплоты для перехода в пар. Какое именно – показывает удельная теплота парообразования.
Понять, как определяется эта величина, можно из примера. Берем 1 л воды и доводим ее до кипения. Затем замеряем количество тепла, понадобившегося для выпаривания всей жидкости, и получаем значение удельной теплоты парообразования для воды. Для других химических соединений этот показатель будет другим.
В физике удельная теплота парообразования обозначается латинской буквой L. Измеряется она в джоулях на килограмм (Дж/кг). Вывести ее можно путем деления теплоты, израсходованной на испарение, на массу жидкости:
L =Q/m.
Данная величина очень важна для производственных процессов на основе современных технологий. Например, на нее ориентируются при производстве металлов. Оказалось, что если железо расплавить, а потом сконденсировать, при дальнейшем затвердении образуется более прочная кристаллическая решетка.
Чему равна
Значение удельной теплоты для различных веществ (r) определили в ходе лабораторных исследований. Вода при нормальном атмосферном давлении закипает при 100 °C, а теплота испарения воды составляет 2258,2 кДж/кг. Данный показатель для некоторых других веществ приведен в таблице:
| Азот | -196 | 198 |
| Гелий | -268,94 | 20,6 |
| Водород | -253 | 454 |
| Кислород | -183 | 213 |
| Углерод | 4350 | 50000 |
| Фосфор | 280 | 400 |
| Метан | -162 | 510 |
| Пентан | 36 | 360 |
| Железо | 2735 | 6340 |
| Медь | 2590 | 4790 |
| Олово | 2430 | 2450 |
| Свинец | 1750 | 8600 |
| Цинк | 907 | 1755 |
| Ртуть | 357 | 285 |
| Золото | 2 700 | 1 650 |
| Этиловый спирт | 78 | 840 |
| Метиловый спирт | 65 | 1100 |
| Хлороформ | 61 | 279 |
Однако этот показатель может изменяться под действием определенных факторов:
- Температура. При ее повышении теплота испарения уменьшается и может быть равной нулю.
t, °Cr, кДж/кг 2500 10 2477 20 2453 50 2380 80 2308 100 2258 200 1940 300 1405 374 115 374,15 - Давление. С понижением давления теплота парообразования растет, и наоборот. Температура кипения же прямо пропорциональна давлению и может достигать критического значения 374 °C.
p, Паt кип., °Cr, кДж/кг 0,0123 10 2477 0,1234 50 2380 1 100 2258 2 120 2202 5 152 2014 10 180 1889 20 112 1638 50 264 1638 100 311 1316 200 366 585 220 373,7 184,8 Критическое 221,29 374,15 - - Масса вещества. Количество задействованной в процессе теплоты прямо пропорционально массе образовавшегося пара.
Соотношение испарения и конденсации
Физики выяснили, что на обратный испарению процесс – конденсацию – пар тратит ровно столько же энергии, сколько пошло на его образование. Это наблюдение подтверждает закон сохранения энергии.
В противном случае было бы возможно создание установки, в которой жидкость испарялась бы, а потом конденсировалась. Разница между теплотой, необходимой для испарения, и теплотой, достаточной для конденсации, приводила бы к накоплению энергии, которая могла бы быть использована для других целей. По сути, был бы создан вечный двигатель. Но это противоречит физическим законам, а значит, невозможно.
Как измеряется
- Удельная теплота испарения воды измеряется в физических лабораториях экспериментальным путем. Для этого используют калориметры. Процедура выглядит следующим образом:
- Определенное количество жидкости заливают в калориметр.
- Измеряют температуру воды.
- В калориметр осторожно пропускают пар исследуемого вещества из кипятильника (колба, подогреваемая снизу горелкой). Чтобы в прибор не попали капельки жидкости, используют сухопарник, в котором они собираются.
- Повторно измеряют температуру воды.
- Для вычисления массы сконденсированного пара калориметр периодически взвешивают.
Удельная теплота парообразования: Видео
vseowode.ru
Кипение. Удельная теплота парообразования :: Класс!ная физика
КИПЕНИЕ
Кипение - это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и внутри неё. 
Кипение происходит с поглощением теплоты.Большая часть подводимой теплоты расходуется на разрыв связей между частицами вещества, остальная часть - на работу, совершаемую при расширении пара.В результате энергия взаимодействия между частицами пара становится больше, чем между частицами жидкости, поэтому внутренняя энергия пара больше, чем внутренняя энергия жидкости при той же температуре. Количество теплоты, необходимое для перевода жидкости в пар в процессе кипения можно расчитать по формуле:
. где m - масса жидкости (кг),L - удельная теплота парообразования.
где m - масса жидкости (кг),L - удельная теплота парообразования.
Удельная теплота парообразования показывает, какое количество теплоты необходимо, чтобы превратитъ в пар 1 кг данного вещества при температуре кипения. Единица удельной теплоты парообразования в системе СИ: [ L ] = 1 Дж/ кг С ростом давления температура кипения жидкости повышается, а удельная теплота парообразования уменьшается и наоборот.

Во время кипения температура жидкости не меняется..Температура кипения зависит от давления, оказываемого на жидкость.Каждое вещество при одном и том же давлении имеет свою температуру кипения. При увеличением атмосферного давления кипение начинается при более высокой температуре, при уменьшении давления - наоборот..Так, например, вода кипит при 100 °С лишь при нормальном атмосферном давлении.
ЧТО ЖЕ ПРОИСХОДИТ ВНУТРИ ЖИДКОСТИ ПРИ КИПЕНИИ ?

Кипение представляет собой переход жидкости в пар с непрерывным образованием и ростом в жидкости пузырьков пара, внутрь которых происходит испарение жидкости. В начале нагревания вода насыщена воздухом и имеет комнатную температуру. При нагревании воды, растворенный в ней газ выделяется на дне и стенках сосуда, образуя воздушные пузырьки. Они начинают появляться задолго до кипения. В эти пузырьки испаряется вода. Пузырек, наполненный паром, при достаточно высокой температуре начинает раздуваться.

Достигнув определенных размеров он отрывается от дна, поднимается к поверхности воды и лопается. При этом пар покидает жидкость. Если вода прогрета недостаточно, то пузырек пара, поднимаясь в холодные слои, схлопывается. Возникающие при этом колебания воды приводят к появлению во всем объеме воды огромного количества мелких пузырьков воздуха: так называемый "белый ключ".

На воздушный пузырек объемом на дне сосуда действует подъемная сила:Fпод = Fархимеда - FтяжестиПузырек прижат ко дну, поскольку на нижнюю поверхность силы давления не действуют. При нагреве пузырек увеличивается за счет выделения в него газа и отрывается от дна, когда подъемная сила будет немного больше прижимающей. Размер пузырька, способного оторваться от дна, зависит от его формы. Форма пузырьков на дне определяется смачиваемостью дна сосуда.

Неоднородность смачивания и слияние пузырьков на дне приводили к увеличению их размеров. При больших размерах пузырька при подъеме сзади него образуются пустоты, разрывы и завихрения.

Когда пузырек лопается, вся окружающая его жидкость устремляется внутрь, и возникает кольцевая волна. Смыкаясь, она выбрасывает вверх столбик воды.
При схлопывании лопающихся пузырьков в жидкости распространяются ударные волны ультразвуковых частот, сопровождаемые слышимым шумом. Для начальных стадий кипения характерны самые громкие и высокие звуки (на стадии "белого ключа" чайник "поет").
(источник: virlib.eunnet.net)
ТЕМПЕРАТУРНЫЙ ГРАФИК ИЗМЕНЕНИЯ АГРЕГАТНЫХ СОСТОЯНИЙ ВОДЫ

ЗАГЛЯНИ НА КНИЖНУЮ ПОЛКУ!

ВАУ, ИНТЕРЕСНЫЕ ЯВЛЕНИЯ !
ИНТЕРЕСНО?

Зачем в крышке чайника делают дырочку?Для выхода пара. Без дырочки в крышке пар может выплеснуть воду через носик чайника.___
Продолжительность варки картофеля, начиная с момента кипения, не зависит от мощности нагревателя. Продолжительность определяется временем пребывания продукта при температуре кипения.Мощность нагревателя не влияет на температуру кипения, а влияет только на скорость испарения воды.

Кипением можнозаставить воду замерзнуть. Для этого надо производить откачку воздуха и водяного пара из сосуда, где находится вода, так, чтобы вода все время кипела.
УДИВИСЬ!
«Горшки легко закипают через край – к ненастью!»Падение атмосферного давления, сопровождающее ухудшение погоды, является причиной того, что молоко быстрее «убегает».___
Очень горячий кипяток можно получить на дне глубоких шахт, где давление воздуха значительно больше, чем на поверхности Земли. Так на глубине 300 м вода закипит при 101 ͦ С. При давлении воздуха в 14 атмосфер вода закипает при 200 ͦ С.Под колоколом воздушного насоса можно получить «кипяток» при 20 ͦ С.На Марсе мы пили бы «кипяток» при 45 ͦ С. Соленая вода кипит при температуре выше 100 ͦ C. ___
В горных районах на значительной высоте при пониженном атмосферном давлении вода кипит при температурах ниже, чем 100 ͦ Цельсия.

Ждать, пока сварится такой обед, приходится дольше.
ОПЫТ
Польем холодненькой… и закипит!!!
Обычно вода кипит при 100 градусах Цельсия. Нагреем воду в колбе на горелке до кипения. Погасим горелку. Вода перестает кипеть. Закроем колбу пробкой и начнем осторожно лить на пробку струйкой холодную воду. Каково? Вода опять закипела!
 ...............
............... ...............
...............
Под струей холодной воды водичка в колбе, а вместе с ней и водяные пары начинают остывать. Объем паров уменьшается, и давление над поверхностью воды меняется ... А как ты думаешь, в какую сторону? . ... Температура кипения воды при пониженном давлении меньше 100 градусов, и вода в колбе вскипает вновь!____
При приготовлении пищи давление внутри кастрюли - "скороварки" - около 200 кПа, и суп в такой кастрюле сварится значительно быстрее.

Можно набрать в шприц воду примерно до половины, закрыть той же пробочкой и резко потянуть за поршень . В воде возникнет масса пузырьков, говорящих, что начался процесс кипения воды(и это при комнатной температуре!).___
При переходе вещества в газообразное состояние его плотность уменьшается примерно в 1000 раз.___
У первых электрочайников нагреватели находились под донышком. Вода не вступала в контакт с нагревателем и закипала очень долго. В 1923 году Артур Лардж сделал открытие: он поместил нагреватель в особую медную трубку и поместил её внутрь чайника. Вода быстро закипала.

В США разработаны самоохлаждающиеся банки для прохладительных напитков. В банку вмонтирован отсек с легкокипящей жидкостью. Если в жаркий день раздавить капсулу, жидкость начнет бурно кипеть, отнимая тепло у содержимого банки, и за 90 секунд температура напитка понижается на 20–25 градусов Цельсия.
НУ, ПОЧЕМУ ЖЕ ?
А как ты думаешь, можно ли сварить яйцо вкрутую, если вода закипает при температуре ниже, чем 100 градусов Цельсия ?____
Будет ли кипеть вода в кастрюле, которая плавает в другой кастрюле с кипящей водой?Почему?___
Можно ли заставить кипеть воду, не нагревая ее?

Другие страницы по темам физики за 8 класс:
К 1 сентября! Проверочный тестТепловое движение. Температура Внутренняя энергия. Способы изменения внутренней энергии Теплопередача. Теплопроводность Конвекция Излучение Теплопередача в природе и технике Количество теплоты Нагревание и охлаждение телЭнергия топлива Агрегатные состояния вещества Плавление кристаллических тел Отвердевание кристаллических тел Парообразование. Испарение Кипение Конденсация Влажность воздуха Работа газа и пара при расширении. ДВС Паровая турбина. КПД теплового двигателяДва рода зарядов. Электроскоп Проводники и диэлектрикиЭлектрическое поле Источники тока Электрические цепи Действия электрического тока Сила тока Напряжение Измерения силы тока и напряжения Электрическое сопротивление Закон Ома для участка цепи Соединение проводников Работа и мощность электрического тока Короткое замыкание. Предохранители Магнитное полеМагнитное поле прямого проводника. Магнитные линииМагнитное поле катушки с током. ЭлектромагнитПостоянные магнитыМагнитное поле Земли Действие магнитного поля на проводник с током. Электродвигатель Плоское зеркало
class-fizika.narod.ru
Температура кипения воды. Удивительные свойства привычного вещества
С процессом кипения воды человеку приходится сталкиваться ежедневно. Оксид водорода является чуть ли не самым востребованным веществом в нашей жизни, но всё ли мы знаем о его свойствах? Что же происходит с соединением, которое в количестве восьмидесяти процентов входит в состав человеческого организма, во время, когда обжигающие пузырьки наполняют чашку, и Вы в предвкушении приятного чаепития готовите всё для этой церемонии.
Вспоминая школьный курс физики, мы можем легко дать объяснение, как лёд превращается в жидкость, и как появляется пар. Но вот о различии кипения и испарения ответить с ходу сможет не каждый. А ведь ответ на этот вопрос лежит на поверхности. Его простота и даже какой-то глубинный смысл заставляют в очередной раз отдать дань разумности Природы.
Испарение и конденсирование жидкости происходит непрерывно и постоянно. Но вот, когда температура достигает определённой критической точки, упоминаемой в литературе, как температура кипения воды, процесс приобретает высокую интенсивность. Во время кипения молекулы воды переходят в состояние пара не только с поверхности, но и по всему объёму жидкости. Визуально мы наблюдаем, как пузырьки пара образуются внутри чайника и быстро устремляются вверх.
Для каждого вещества этой критической точке соответствует своя температура при определённом давлении. Нормальными условиями на уровне моря считается давление в 100 кПа, температура кипения воды в данных условиях достигает классических показателей в 100° С. Поднявшись вверх на 4000 м мы переходим в условия, когда давление падает и его величина достигает 60 кПа. Температура кипения воды в горах ниже, чем у её подножия, а для условий, указанных в примере, она достигает около 85° С.
Туристы, отправляясь в продолжительное путешествие в горы, оставляют внизу привычные чайники и кастрюли. С собой они берут специальные «скороварки». Замкнутое пространство провоцирует повышение давления за счёт избытка давления пара, в результате повышается температура кипения воды, и можно смело готовить привычные продукты.
Оказывает влияние на физические свойства вещества его чистота. Наличие примесей приводит к изменению температуры закипания. Когда в жидкости растворяется летучее вещество, температура кипения воды сползает вниз, в противном случае вода закипает при более высокой температуре.
Существует множество интересных и необычных свойств воды, о которых мы даже и не догадывались. Эксперименты с кипяченой и обычной водой приводят к интересным результатам. Так весьма парадоксально звучит, но остаётся признанным фактом то, что кипяток замёрзнет быстрее, чем обычная вода. Также быстрее закипает вода, ранее поддавшаяся кипячению, не значительно, но влияет на температуру кипения (замерзания) наличие в воде поваренной соли.
Каждый из вышеуказанных фактов можно проверить в условиях обычной кухни, оборудованной газовой плитой и холодильником. Совсем другое дело определить, чему равна температура кипения воды в вакууме, опытным путём. Ведь теоретически в условиях вакуума вода закипит при комнатной температуре.
А ведь для проведения этого эксперимента потребуется совсем несложное оборудование. Запасёмся обычным одноразовым шприцом и кусочком пластилина. Мероприятия по подготовке к проведению опыта потребуют произвести несложную манипуляцию с иглой. Резким, уверенным движением обламываем стальную её часть, образовавшееся отверстие затыкаем пластилином. Заливаем в шприц воды на десятую часть объёма, удаляем воздух и одеваем подготовленную иголку на своё «штатное место», установка для опытов с вакуумом готова.
Если резко отдёрнуть поршень назад, то часть воды превратится в пар с интенсивностью полноценного кипения, и это в условиях комнаты с температурой воздуха около 20° С. Подавая поршень вперёд, мы можем наблюдать, как пар превращается в жидкость.
На примере свойств воды мы ещё раз убеждаемся, сколько интересного и необычного могут хранить самые обыденные явления природы.
fb.ru