Коллоидные растворы: методы получения и использование. Вода коллоидная
Коллоидные растворы. | Очистка воды
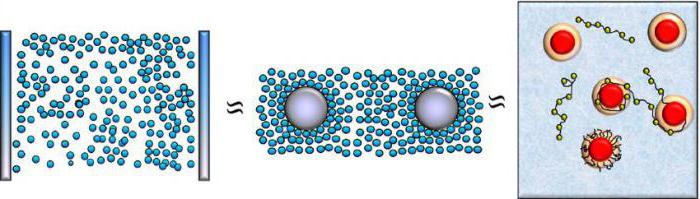
Холодный утренний туман, оседающий на землю, столб дыма над костром, взвешенные частицы в воде рек и озер — все это мы видели множество раз.Нас постоянно окружают дисперсные системы
Понимание коллоидных систем важно для общего понимания образования гидроокиси железа в водоочистке и принципов фильтрации. Этот старый советский обучающий фильм отлично рассказывает о том, что такое коллоиды, как они образуются и взаимодействуют с окружающей средой. СМОТРИМ! Если смотреть не получается — читаем.
https://youtu.be/JR6qi6MuyLk
Они состоят из вещества в мелкораздробленом состоянии — дисперсной фазы и среды в которой эта фаза распределеа и которую называют дисперсионной средой.
Величина частиц и степень их дисперсности может быть различной. Сравнительно большие размеры частиц имеют грубодисперсные системы — взвеси и эмульсии.
В истинных растворах вещество находится в виде молекул или оинов распределенных равномерно среди молекул растворителя.
Частицы грубодисперсных систем хорошо видны в микроскоп. Например, молоко, представляющее эмульсию капелек жира в сыворотке, дым — это множество твердых частиц, взвешенных в воздухе.
Грубодисперсные системы неустойчивы и со временем дисперсная фаза отделяется от дисперсионной среды (выпадает в осадок).
По размеру частиц промежуточной положение между истинными растворами и взвесями занимают коллоидные растворы — золи.
Коллоидные частицы очень малы. И все же они могут состоять из сотен и тысяч молекул.
Свойства коллоидных растворов
Коллоидные частицы настолько малы, что не видны в обычный микроскоп. По внешнему виду коллоидный раствор нельзя отличить от истинного. Однако, если на освещенный коллоидный раствор посмотреть сбоку, то свет луча будет виден, как светлая дорожка, образовавшаяся от рассеивания света частицами. Это явление используют для распознавания коллоидных растворов.
В истинном растворе свет луча не виден, так как молекулы и ионы истинного раствора слишком малы и не рассеивают его.
В коллоидном — свет хорошо заметен. Он образует так называемый конус Тиндаля. Частицы коллоидных растворов под уадарами молекул растворителя совершают непрерывные хаотические перемещения. Это явление носит название Броуновского движения.
Из-за очень малых размеров коллоидные частицы имеют огромную суммарную поверхность.
Поверхность кубика с длинной ребра в 1 см составляет всего 6 квадратных сантиметров.. Но если 1 кубический сантиметр вещества раздробить на части объемом в 1 кубический микрон, то общая их поверхность увеличится в 10 тысяч раз. Поэтому и поглотительные свойства у коллоидных частиц проявляются значительно сильнее, чем у нераздробленного вещества.
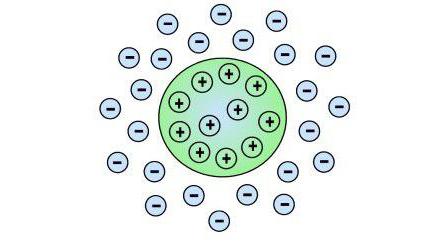
Коллоидные частицы адсорбируют на своей поверхности катионы или анионы из окружающей среды. Адсорбированые ионы сообщают коллоидным частицам положительный или отрицательный заряд. В электрическом поле заряженные частицы коллоидных растворов приобретают направленное движение к полюсу противоположного знака. Это явление называют электрофарезом.Одноименный заряд коллоидных частиц препятствует слипанию их друг с другом и придает коллоидному раствору относительную устойчивость.
Если в коллоидную систему добавить электролит, то заряд нейтрализуется ионами противоположного знака. Лишенные заряда коллоидные частицы слипаются в более крупные образования. Происходит коагуляция коллоида, которая обычно сопровождается выпадением осадка. Некоторые коллоиды при коагуляции дают осадки, удерживающие большое количество воды. Их называют гидрофильными. Другие, осаждаются в видео порошков, почти не увлекая за собой воду. Они называются гидрофобными.Способы получения коллоидных систем
Коллоидные системы можно получать различными способами. При конденсационном способе молекулы нерастворимого вещества, например хлористого серебра (NaCl+AgNO3) слипаются, конденсируются в более крупные образования — коллоидные частицы. Другой пример — наливая раствор хлорного железа в горячую воду (FeCl3+3h3O) получаем золь гидроокиси железа Fe(OH)3+3HCl.
Дисперсионные способы получения коллоидов осуществляют размельчением вещества на различных дробилках, шаровых и других мельницах.
Коллоидные растворы можно получать и при помощи электрической други. Металл превращается в пар, а в результате конденсации образуются коллоидные частицы.
Макромолекулы
Некоторыми свойствами коллоидов обладают растворы высокомолекулярных веществ — белка, каучука, полиэтелена и многих другах. Они диспергируют до отдельных молекул, как вещества в истинных растворах, но сами эти молекулы настолько велики, что вполне соизмеримы с коллоидными частицами.
Такие молекулярные коллоиды могут быть получены непосредственным растворением. Растворению высокомолекулярных веществ предшествует набухание и образование студнеобразной массы — геля. При набухании студни поглощают ту или иную жидкость из окружающей среды и сильно увеличиваются в объеме, что приводит к огромному повышению давления на стенки сосуда.
Студни обладают рядом свойств твердого тела. Они легко режутся, сохраняя первоначальную форму.
В студнях химические реакции протекают своеобразно. Нерастворимые продукты реакции осаждаются не сплошной массой, а в виде концентрических колец. Так называемых колец Лизеганга.
Дисперсные системы в природе и технике
Вещества в коллоидном состоянии являются основой органической жизни на земле. Протоплазма любой живой клетки — это сложная коллоидная система. Мышечные ткани, хрящи, клеточные ткани растений, оболочки эритроцитов — тоже разновидности студней.
Коллоиды почвы играют большую роль в корневом питании растений. Адсорбированные на поверхности частиц почвы ионы калия, кальция и других элементов, в результате ионного обмена переходят в почвенный раствор и всасываются корневой системой.
Вещества в коллоидном состоянии принимают участие в образовании многих минералов:
- агата
- малахита
- мрамора
Некоторые драгоцнные камни, например жемчуг представляют собой колоидную систему, где дисперсионной средой является твердое тело — углекислый кальций, а дисперсной фазой — капельки воды. Окраска драгоценных камней: рубинов, изумрудов, сапфиров зависит от присуствия в них небольших количеств золей тяжелых металлов.
Еще в глубокой древности человек использовал коллоидные процессы. Египтяне забивали в щели скал деревянные клинья. Поливали их водой. Древесина набухала, создавалось огромное давление, которое разрушало самые твердые скальные породы.
Процессы коагуляции коллоидов применяют для очистки природной воды. В бассейн отстойник добавляют электролит и коллоиды осаждаются в виде хлопьев, которые задерживает песчаный фильтр.
Мели и наносы в устьях рек образуются под действием морской воды, приводящие к коагуляции коллоидных частиц, находящихся в реке.
Сегодня с коллоидными процессами связаны важнейшие отрасли химической промышленности:
- производство искусственного волокна
- раличных клеящих веществ
- синтетического каучука
- и многих других химических продуктов
Знакомые уже нам явления электрофареза используют в работе электрофильтров — дымоуловителей.
Адсорбционные свойства коллоидных частиц положены в основу процесса флотационного обогащения руд. Частицы пустой породы гидрофильны, то есть удерживают на своей поверхности молекулы воды, а частицы руды при добавлении некоторых химических веществ приобретают гидрофобные — водоотталкивающие свойства. При продувании через эту смесь воздуха несмачиваемые частички руды поднимаются на поверхность, а пустая порода опускается на дно.
Важные пищевые продукты:
- простокваша
- кефир
- творог
- желе
- джемы
- и другие
тоже коллоидные системы — студни. Большинство окружающих нас предметов:
- бумага,
- сплавы металлов,
- цветные стекла,
- пластмассы,
- натуральные и искусственные ткани
содержат вещества в коллоидном состоянии.
Широко распространены и грубодисперсные системы — эмульсии:
- пены
- суспензии
- аэрозоли
Системы состоящие из двух взаимнонесмешивающихся жидкостей, например воды и какого-либо масла при тщательном и длительном перемешивании образуют эмульсии.
Эмульсии широко распространены в природе. Это и сырая нефть и млечный сок растений — каучуконосов и многое другое.
Если дисперсная среда — жидкость, а дисперсная фаза — газ образуется дисперсная система, называемая пеной. Устойчивость пен зависит от прочности пленок, разделящих пузырьки газа. При затвердевании пленок образуются устойчивые твердые пены: пемза, вулканическтий туф.К твердым пенам относятся и такие искусственные материалы, как пенопласт, поролон, микропористая резина.
Устойчивые пены применяют и при тушении пожаров. Пена, содержащая углекислый газ плотно окутывает горящий предмет, преграждая доступ кислороду. Горение прекращается.
Дисперсной фазой могут быть и твердые вещества. Такие системы называют суспензиями. К ним относят различные краски, цементный раствор, бетон.
Облака, туманы, представляют собой аэрозоли. Дисперсные системы образованные жидкими или твердыми частицами. Аэрозоли нашли широкое применение в быту и технике. Например, топливо в цилиндре двигателя внутреннего сгорания подается в виде аэрозоля — смеси мельчайших капелек бензина с воздухом.
От степени дисперсности вещества зависит скорость протекания химических реакций. При обжиге мелкораздробленное вещество удерживает во взвешенном состоянии поток воздуха. Образуется кипящий слой, в котором газ омывает каждую частицу со всех сторон, а это ускоряет реакцию во много раз.
Как видим дисперсные системы широко распространены в природе, имеют большое значение в народном хозяйстве и нашей повседневной жизни. Их огромное множество. Мы же сейчас познакомились лишь с некоторыми из них.
Рассказать друзьям
ochistkavodi.ru
Коллоидно-связанная вода - Большая Энциклопедия Нефти и Газа, статья, страница 1
Коллоидно-связанная вода
Cтраница 1
Коллоидно-связанная вода входит в состав коллоидных структур осадка и удаляется из него только после термической обработки. Гигроскопически-связанная вода не удаляется даже при термической сушке осадка. [1]
Коллоидно-связанная вода, или просто связанная вода, удаляется из осадка с большим трудом, что, несомненно, затрудняет обработку осадков. [2]
Коллоидно-связанная вода находится в осадке в основном в виде гидратной оболочки твердых частиц. Разрушение этой оболочки возможно лишь с помощью коагуляции или кратковременной термической, обработки. Полное удаление всей коллоидно-связанной воды достигается лишь сушкой при повышенных температурах. Гигроскопическая вода не удаляется даже при термической сушке. [3]
Остающаяся коллоидно-связанная вода в присутствии оксида пропилена способствует расщеплению макромолекулы лигносульфонатов на стадии термовоздействия, что приводит к повышению степени этерификации. [4]
Понижение степени гидратации коллоидов, увеличение количества свободной и снижение количества коллоидно-связанной воды в листьях в начале вегетации свидетельствует о пониженной устойчивости растений к изменяющимся условиям среды в этот период. [6]
Это в известной мере условный предел, так как различные по степени полимеризации частицы удерживают и различное количество коллоидно-связанной воды. Но он все же с достаточной степенью достоверности характеризует состояние полидисперсной коллоидной системы. [7]
СС, состоит из мелких кристаллов ( диаметр2 - Зим), объединенных во вторичные частички ( хлопья), содержащие большое количество коллоидно-связанной воды. Последняя удерживается гидратом очень прочно и удаляется только в результате сушки при 110 - 130 С. Порошок бемита, высушенный при 110СС при замешивании с водой снова образует пластичную массу. Реологические свойства бемита позволяют использовать разнообразные способы формовки с получением после прокаливания прочного оксида алюминия. [8]
Активный ил как коллоидная система обладает высокой структурообразующей способностью, вследствие чего его уплотнение приводит к иммобилизации свободной воды, т.е. с увеличением концентрации активного ила часть свободной воды переходит в коллоидно-связанную воду, что в свою очередь приводит к ухудшению водоотдачи ила. [10]
Механическому обезвоживанию водопроводного осадка, как правило, предшествует их кондиционирование, цель которого состоит в снижении остаточного заряда структурообразующих частиц и в количественном перераспределении различных форм связи воды с твердым веществом, с переводом части коллоидно-связанной воды в свободное состояние. Кондиционирование может осуществляться с применением реагентов, флокулян-тов, методов замораживания-оттаивания, радиационной обработки, магнитной обработки и электрокоагуляции. [11]
Освобожденная при этом вода легче фильтруется или отжимается. Полное удаление всей коллоидно-связанной воды из осадков достигается лишь сушкой при повышенных температурах. Интересно отметить свойство необратимости осадка, как коллоида, которое заключается в том, что если однажды обезводить его до 40 - 50 %, то в дальнейшем, при повторных расжижениях, он перестает разбухать и удерживать воду. [12]
Термическая переработка топлива начинается его подсушкой. Так как в топливе кроме гигроскопической имеется коллоидно-связанная вода, то подсушка заканчивается при температуре выше 100 С. У некоторых видов топлива ( торф, лигниты) окончательное выделение этой коллоидно-связанной воды заканчивается при температуре около1 НО-115 С. С, Разложение топлива при процессе подсушки проявляется в слабой степени, в виде едва заметного газовыделения. [13]
Полукоксование - термический процесс переработки угля, который начинается с подсушки. Так как в угле кроме гигроскопической воды присутствует коллоидно-связанная вода, то подсушку заканчивают при температуре я 160 С. Разложение топлива в процессе подсушки проявляется в слабой степени - в виде едва заметного газовыделения. Сушка топлива в атмосфере воздуха сопровождается окислением. [14]
Проведенные анализы растений показали, что кобальт повышает содержание хлорофилла и количество коллоидно-связанной воды в листьях, усиливает восстановительную активность тканей и увеличивает содержание редуцирующих са-харов в листьях сахарной свеклы. [15]
Страницы: 1 2
www.ngpedia.ru
методы получения и использование :: SYL.ru
Многие люди, не имеющие дело с химией, слыша словосочетание «коллоидные растворы», представляют что-то наподобие геля, вязкой смеси. Дело в том, что изначально такое название произошло от греческого слова, в переводе означающего «клеевидные». При нарушении сбалансированности системы золи дают осадок, напоминающий студень.
Как правило, коллоидные растворы представляют собой абсолютно прозрачную жидкость. В зависимости от состава, она может быть бесцветной или окрашенной. На первый взгляд золи ничем не отличаются от истинных растворов. Изучением подобного рода субстанций занимается целый раздел – коллоидная химия.

Общая характеристика
Любой раствор представляет собой однофазную систему, включающую два компонента или более. В отличие от него, суспензия или эмульсия менее устойчивы. В жидких растворах при хранении может выпасть осадок, если, например, они помещены в негерметично закрытую тару и происходит испарение жидкости. В остальных случаях это инертная система, где компоненты не вступают в реакцию друг с другом, и поэтому она может оставаться неизменной в течение длительного времени.
Свойства коллоидных растворов

Молекулы вещества равномерно распределяются по всему растворителю, однако они постоянно совершают броуновское (колебательное) движение. Вследствие этого происходит полное перемешивание компонентов системы. Свойства коллоидных растворов в данном процессе немного другие. Частицы такой системы называются мицеллами. Они диффундируют из одного слоя жидкости в другой медленнее (в 100 раз). Причиной низкой скорости является больший объем мицелл по сравнению с молекулами истинных растворов.
В зависимости от размера частиц, их количества, коллоидные растворы отличаются по вязкости. Часто встречаются системы, переходящие в гелеобразное состояние при понижении температуры. Наличие слишком крупных мицелл и превышение предела растворимости приводит к помутнению.
Частицы коллоида, в отличие от молекул, имеют более крупные размеры и поэтому способны рассеивать свет. Таким образом, можно отличить эти растворы от истинных. При прохождении через такую систему пучок света будет виден.
Структура мицелл
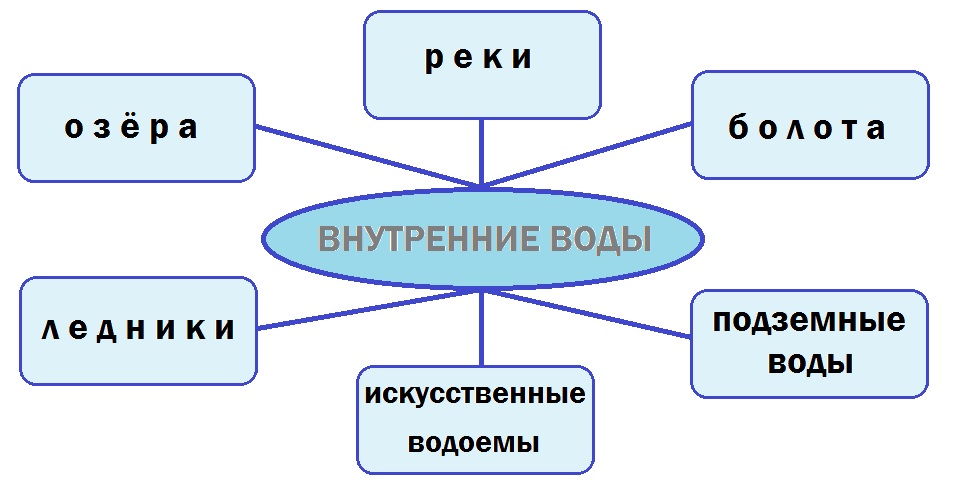
Получение коллоидных растворов зиждется на образовании мицелл, которые должны пребывать для сохранения свойств системы в стабильном состоянии. Частица имеет сложную структуру, состоит из ядра, которое образуется малорастворимым веществом. Вокруг него распределяется слой потенциалоопределяющих ионов. Обычно они являются такими же, что и в малорастворимом веществе, расположенном в центре мицеллы (правило Панета–Фаянса). Такие ионы определяют заряд ядра.
Например, при взаимодействии иодида калия и нитрата серебра образуются мицеллы. Ядром таких частиц является иодид серебра (AgI). Если преобладает второй компонент, то потенциалоопределяющими ионами будут Ag+, если первый - I-. Следующим слоем являются противоионы того вещества, которое было взято в избытке. Они образуют две зоны. Первая расположена близко к поверхности ядра, входит в состав адсорбированного слоя. Вторая входит в состав диффузионного слоя, состоит из ионов, свободно перемещающихся вблизи поверхности.
Коллоидной частицей называется ядро с адсорбированным слоем, который включает потенциалопределяющие ионы и противоионы. Данное образование имеет заряд. Мицелла включает коллоидную частицу и диффузионный слой противоионов и является нейтральной.
Как происходит образование мицеллы
Любые методы получения коллоидных растворов основаны на взаимодействии молекул труднорастворимого соединения с электролитом. Например, AgNO3 (нитрат серебра) с KI (иодидом калия). В результате реакции получается AgI и KNO3 (нитрат калия). Структуру мицеллы можно изобразить схематически. Есть 2 варианта образования коллоидных частиц из вышеуказанных соединений:
- При избытке AgNO3 -{n(AgI) mAg+ (m-x)NO3¯} xNO3¯.
- При избытке KI - {n(AgI) mI¯ (m-x)K+} xK+.
Вначале указывается ядро, потом потенциалоопределяющие ионы и противоионы адсорбированного и диффузионного слоя. Электрокинетический потенциал, который определяет заряд коллоидной частицы, обозначается буквой "x". Он возникает в силу разницы поверхностной энергии ядра частицы с потенциалоопределяющими ионами.
Стабильность

Коллоидные растворы способны сохраняться в неизменном состоянии достаточно долго. Стабильность таких систем является следствием одноименности зарядов мицелл, что приводит к их отталкиванию друг от друга. Однако при слишком больших размерах и высокой концентрации частицы могут сталкиваться и объединяться. Устойчивость коллоидных растворов – относительное понятие. Они могут храниться в неизменном состоянии достаточно долго.
Коагуляция коллоидных растворов представляет собой процесс слипания мицелл друг с другом. При стабильном состоянии системы данное явление происходит медленно, что позволяет ей сохраняться длительное (до 100 лет) время в однофазном состоянии. Такое явление получило название агрегативная неустойчивость.
Скорость коагуляции
Скорость агрегации частиц и, как следствие, разделения фаз зависит от многих факторов, в том числе от размера и концентрации мицелл, температуры хранения. К ускорению процесса коагуляции приводит добавление электролита. Данное явление наблюдается в гидрофильных системах. Известны методы замедления процесса агрегации частиц. Например, смешение липофильного коллоида с гидрофильным. На утрату стабильного состояния золей может повлиять нагрев или охлаждение, механическое воздействие.
Коагуляция коллоидных растворов с помощью электролитов
Существуют определенные закономерности влияния электролитов на коллоидный раствор. Так, для начала процесса нужна определенная концентрация последнего, не ниже определенного уровня - порог коагуляции. Электролит – вещество, способное проводить электрический ток в результате диссоциации в растворе или расплава на ионы. На состояние коллоидного раствора влияет ион, заряд которого противоположен таковому у мицеллы. Действие усиливается со степенью заряда (правило Шульце-Гарди).
Другой фактор, определяющий степень влияния ионов, – их гидратируемость. Частицы с одноименным зарядом оказывают разный уровень действия на процесс коагуляции. При разделении коллоидного раствора ионы, вызвавшие коагуляцию, присутствуют в осадке. При добавлении смеси электролитов ее компоненты могут ослаблять действие друг друга (антагонизм) или, наоборот, усиливать (синергизм). Реже наблюдается независимое (аддитивное) влияние.
Способы получения

Методы получения коллоидных растворов сводятся к двум. Одним из вариантов является диспергирование (измельчение) крупных частиц до размеров, соответствующих коллоидным. Такой процесс можно осуществлять, например, с использованием ультразвуковых приборов (механическое измельчение). Разновидностью дисперсных методов является формирование коллоидных частиц в результате добавления электролитов, которые адсорбируются на поверхности коллоидных ядер и переводят частицы в растворенное состояние.
Противоположным дисперсионному методу является конденсационный, заключающийся в агрегации мелких частиц в более крупные. Такое явление происходит, например, при замене растворителя. Каким образом можно добиться такого эффекта? Наблюдается резкое снижение растворимости в силу изменения среды. Далее вещество образует коллоидную частицу. В ее формировании участвуют молекулы растворителя, с которым оно лучше смешивается. Такой эффект, например, достигается при постепенном добавлении канифоли, растворенной в этаноле, к воде.
Различного рода конденсационные реакции, в том числе описанные выше, также относятся к методам агрегации. Другими примерами может являться гидролиз солей металлов, в частности хлорида железа (FeCl3), реакция нейтрализации в результате взаимодействия гидроксида бария (Ba(OH)2) с серной кислотой (h3SO4).
Солюбилизация
Значение коллоидных растворов в жизни человека велико в связи со способностью поверхностно-активных веществ повышать растворение гидрофобных соединений в воде. Такое явление получило название "солюбилизация". По своей сути данный процесс представляет растворение соединений в мицеллах. Благодаря этому явлению порошки способны удалять загрязнение с тканей, получаются устойчивые эмульсии углеводородов и красителей в воде.
Солюбилизация может проходить разными способами. Так, неполярные углеводороды проникают в ядро мицеллы, в то время как соединения, имеющие гидрофильную и гидрофобную часть (амины, спирты), встраиваются так, что первая находится снаружи, а вторая уходит вглубь коллоидной частицы. Существует также такое явление, как обратная солюбилизация, заключающаяся в растворении воды в маслах. В случае неионогенных ПАВов выделяют еще один способ повышения растворимости гидрофобных соединений – прикрепление к поверхности мицеллы посредством химических связей (водородных в частности).
Повсеместное распространение
Коллоидные растворы присутствуют неизменно внутри человека и вокруг него. К ним относятся кровь, лимфа, часто используемые в различных строительных и отделочных работах клеи и краски. Из коллоидных растворов в результате коагуляции и осаждения получают гели. К таковым можно, например, отнести холодец, мармелад, агар-агар, желатин, каррагинаны. Последние используются для улучшения структуры продуктов, в частности паштетов. Везде в организме человека присутствуют коллоидные растворы, обогащенные белками.
Использование в медицине

В медицине коллоидные растворы применяются повсеместно. Вот несколько примеров их использования. Коллоидное серебро, представляющее собой мелкие частицы металла, диспергированные в воде, применяется при лечении ожогов, язвенных болезней желудка и двенадцатиперстной кишки, для промывания слизистой носа в целях предотвращения распространения вирусных инфекций.
Фармацевтическая промышленность предлагает большой выбор коллоидных растворов для различных целей. Среди них встречают универсальные средства, которые можно применять как ранозаживляющие при ожогах, геморрое; противовоспалительные – при насморке, ангине, гайморите; анальгетики – для снятия зубной боли и не только. К таковым относится коллоидный раствор «Миллениум». В состав геля входит алоэ, белок пшеницы, женьшень, витамин Е и прочие полезные добавки. Многие фармацевтические средства для наружного применения на самом деле являют собой коллоидный раствор. Для суставов, например, используется "Артро Комплекс", содержащий такой полезный компонент, как акулий хрящ.
Применение в быту и промышленности
Коллоидные растворы составляют основу моющих и чистящих ПАВов. Загрязнения проникают внутрь мицеллы и таким образом удаляются с поверхности.
Другой важный аспект применения мицеллообразующих ПАВов – производство полимеров, в частности латексов, поливинилового спирта, клеев растительного происхождения. Различные пластмассы, кожзаменители получены на основе эмульсии. ПАВы применяются также при очистке сточных вод и питьевой воды.
Преимущества косметики на основе коллоидных растворов заключаются в проникновении действующих веществ через кожные покровы человека и структуру волос. Такие средства эффективно используются против старения. К ним относится, в частности, гель «Миллениум Нео». Коллоидный раствор помогает содержащимся в нем компонентам достичь глубоких слоев кожи, минуя эпидермис.
www.syl.ru
определение, особенности, виды и свойства
Основной темой данной статьи будет коллоидная частица. Здесь мы рассмотрим понятие коллоидного раствора и мицеллы. А также ознакомимся с основным видовым разнообразием частиц, относящихся, к коллоидным. Отдельно остановимся на различных особенностях изучаемого термина, некоторых отдельных понятиях и многом другом.
Введение
Понятие коллоидной частицы тесно связано с различными растворами. В своей совокупности они могут образовывать разнообразные системы микрогетерогенного и дисперсного характера. Частички, образующие такие системы, по размерам обычно лежат в пределах от одного до ста мкм. Помимо наличия поверхности с четко разделенными границами между дисперсной средой и фазой, коллоидные частицы характеризуются свойством малой устойчивости, а сами растворы образоваться самопроизвольно не могут. Наличие большого разнообразия в строении внутренней структуры и размерах вызывает создание большого числа методов получения частиц.
Понятие коллоидной системы
В коллоидных растворах частицы во всей своей совокупности образуют системы дисперсоного типа, которые являются промежуточными между растворами, которые определяют как истинные и грубодисперсные. В данных растворах капли, частички и даже пузырьки, образующие дисперсную фазу, обладают размером от одного до тысячи нм. Они распределяются в толще дисперсной среды, как правило, непрерывной, и отличаются от исходной системы составом и/или агрегатным состоянием. Чтобы лучше понять значение такой терминологической единицы, лучше рассмотреть ее на фоне систем, которые она образует.
Определение свойств
Среди свойств коллоидных растворов основными можно определить:
- Образующие частички не мешают прохождению света.
- Прозрачные коллоиды обладают свойством, позволяющим рассеивать световые лучи. Это явление называют эффектом Тиндаля.
- Заряд коллоидной частицы является одинаковым для дисперсных систем, вследствие чего они не могут встречаться в растворе. В Броуновском движении дисперсные частички не могут выпадать в осадок, что обуславливается их поддержанием в состоянии полета.
Главные типы
Основные классификационные единицы коллоидных растворов:
- Взвесь частичек твердого типа в газах называют дымом.
- Взвесь частичек жидкости в газах называют туманом.
- Из мелких частичек твердого или жидкого типа, взвешенных в среде газа, образуется аэрозоль.
- Газовую взвесь в жидкостях или твердых телах называют пеной.
- Эмульсия – это жидкостная взвесь в жидкости.
- Золь – это дисперсная система ультрамикрогетерогенного типа.
- Гелем называются взвесь из 2 компонентов. Первый создает каркас трехмерного характера, пустоты которого будут заполнены различными низкомолекулярными растворителями.
- Взвесь частичек твердого типа в жидкостях называют суспензией.

Во всех этих коллоидных системах размеры частиц могут сильно отличаться в зависимости от своей природы происхождения и агрегатного состояния. Но даже несмотря на такое крайне разнообразное количество систем, обладающих разной структурой, все они относятся к коллоидным.
Видовое разнообразие частиц
Первичные частицы, имеющие коллоидные размеры, по типу внутренней структуры делятся на следующие виды:
- Суспензоиды. Их также называют необратимыми коллоидами, что не способны самостоятельно существовать в длинных промежутках времени.
- Коллоиды мицеллярного типа, или, как их еще называют, полуколлоиды.
- Коллоиды обратимого типа (молекулярные).
Процессы образования данных структур очень различаются между собой, что усложняет процесс понимания их на детальном уровне, на уровне химии и физики. Коллоидные частицы, из которых образуются такие виды растворов, имеют крайне разную форму и условия протекания процесса образования цельной системы.
Определение суспензоидов
Суспензоидами называют растворы с элементами металлов и их вариациями в форме оксида, гидроксида, сульфида и прочих солей.
Все образующие частицы вышеупомянутых веществ обладают молекулярной или ионной кристаллической решеткой. Они формируют фазу дисперсного типа вещества – суспензоида.
Отличительной чертой, позволяющей отличать их от суспензий, является наличие более высокого показателя дисперсности. Но они связаны между собой отсутствием механизма стабилизации для дисперсности.
Необратимость суспензоидов объясняется тем, что осадок процесса их впаривания не дает человеку получить вновь золи посредством создания контакта между самим осадком и дисперсной средой. Все суспензоиды являются лиофобными. В подобных растворах называются коллоидными частицы, относящиеся к металлам и производным солям, которые были измельчены или конденсированы.
Методика получения ничем не отличается от тех двух способов, которыми всегда создают дисперсные системы:
- Получение путем диспергирования (измельчения крупных тел).
- Методом конденсации ионно- и молекулярнорастворенных веществ.
Определение мицелярных коллоидов
Мицелярные коллоиды также именуют полуколлоидами. Частички, из которых они создаются, возникать могут при наличии достаточного уровня концентрации молекул дифильного типа. Такие молекулы могут образовать только низкомолекулярные вещества посредством их ассоциирования в агрегат молекулы – мицеллу.
Молекулы дифильной природы – это структуры, состоящие из углеводородного радикала, параметрами и свойствами сходного с неполярным растворителем и гидрофильной группой, которую также называют полярной.
Мицеллы – это особые скопления правильно расставленных молекул, которые удерживаются преимущественно посредством использования дисперсных сил. Мицеллы образуются, например, в водных растворах моющих средств.
Определение молекулярных коллоидов
Молекулярными коллоидами называют высокомолекулярные соединения как природного, так и синтетического происхождения. Молекулярный вес может колебаться от 10.000 до нескольких миллионов. Молекулярные фрагменты подобных веществ обладают размером коллоидной частицы. Сами молекулы именуют макромолекулами.
Соединения высокомолекулярного типа, подверженные разбавлению, называют истинными, гомогенными. Они, в случае предельного разведения, начинают подчиняться общему ряду законов для разбавленных составов.
Получение коллоидных растворов молекулярного типа является довольно простым заданием. Достаточно заставить контактировать сухое вещество и соответствующий растворитель.
Неполярная форма макромолекул растворяться может в углеводородах, а полярная - в полярных растворителях. Примером последнего может послужить растворение различных белков в растворе воды и соли.
Обратимыми эти вещества называют в связи с тем, что подвергание их выпариванию с добавлением новых порций сухих остатков заставляет молекулярные коллоидные частицы принимать форму раствора. Процесс их растворения должен проходить через стадию, на которой он набухает. Она является характерной чертой, выделяющей молекулярные коллоиды, на фоне других систем, которые были рассмотрены выше.
В процессе набухания молекулы, образующие растворитель, проникают в твердую толщу полимера и тем самым расталкивают макромолекулы. Последние в связи со своими большими размерами начинают медленно диффундировать в растворы. Внешне это можно наблюдать при увеличении объемной величины полимеров.
Устройство мицеллы
Мицеллы коллоидной системы и их строение будет проще изучить, если рассмотреть образующий процесс. Возьмем для примера частицу AgI. В данном случае частицы коллоидного типа будут образоваться в ходе следующей реакции:
AgNO3+KI à AgI↓+KNO3
Молекулы иодида серебра (AgI) образуют практически нерастворимые частички, внутри которых кристаллическая решетка будет образована катионами серебра и анионами иода.
Образующиеся частицы поначалу имеют строение аморфного типа, однако далее, по мере протекания их постепенной кристаллизации, приобретают постоянное устройство внешнего вида.
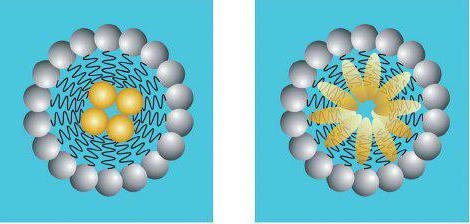
Если взять AgNO3 и KI в соответственных эквивалентах, то кристаллические частицы будут расти и достигать значительных размеров, превосходящих даже величину самой коллоидной частицы, а далее быстро выпадать в осадок.
Если взять одно из веществ с избытком, то можно искусственно сделать из него стабилизатор, который будет сообщать об устойчивости коллоидных частиц иодида серебра. В случае чрезмерного количества AgNO3 раствор будет содержать в себе больше положительных ионов серебра и NO3-. Важно знать о том, что процесс формирования кристаллических решеток AgI подчиняется правилу Панета-Фаянса. Следовательно, он способен протекать только в случае наличия ионов, входящих в состав данного вещества, которые в данном растворе представлены катионами серебра (Ag+).
Положительные ионы аргентума будут продолжать достраиваться на уровне формирования кристаллической решетки ядра, прочно входящего в структуру мицеллы и сообщающего об электрическом потенциале. Именно по этой причине ионы, которые используются для достройки ядерной решетки, называют потенциалопределяющими ионами. В ходе образования коллоидной частицы – мицеллы – есть и другие особенности, обуславливающие то или иное течение процесса. Однако здесь было рассмотрено все на примере с упоминанием важнейших элементов.
Некоторые понятия
Термин коллоидной частички тесно связан с адсорбционным слоем, который образуется одновременно с ионами потенциалопределяющего типа, в ходе адсорбции общего количества противоионов.
Гранула – это структура, образованная ядром и адсорбционным слоем. Она обладает электрическим потенциалом такого же знака, которым наделен Е-потенциал, однако его величина будет меньшей и зависит от исходной величины противоионов в слое адсорбции.
Слипание коллоидных частиц является процессом, который именуют коагуляцией. В дисперсных системах она приводит к образованию из мелких частичек более крупных. Процесс характеризуется сцеплением между маленькими структурными компонентами с образованием коагуляционных структур.
fb.ru
Коллоидные растворы - Знаешь как
Страницы Список страниц 10 11 12 13 14 · · · 45
§ 34 Коллоидные растворы
Коллоидные растворы рассматривают особо, потому что их свойства существенно отличаются от свойств истинных растворов и грубодисперсных систем. Примерами коллоидного раствора могут служить растворы белка, клея, желатины и пр.Отличить коллоидный раствор от истинного можно на следующем опыте. Если взять банку без дна, затянуть отверстие пергаментом, налить в нее раствор поваренной соли и опустить в сосуд с водой (рис. 18), то очень скоро вода в сосуде станет соленой. Если же вместо раствора поваренной соли налить раствор белка, то в сосуде с водой белка не обнаружится .Следовательно, коллоидный раствор белка не проникает через полупроницаемую перегородку. Этим свойством пользуются для очистки коллоидного раствора от примеси растворимых солей. Описанный процесс называется диализом и осуществляется в диализа-торах.Если в темном помещении пропустить через коллоидной раствор узкий пучок света и наблюдать за ним сбоку, то в растворе очень хорошо будет заметен путь световых лучей (рис. 19). Если пропускать такой же пучок световых лучей через истинный раствор, то путь света не будет заметен, так как коллоидные частицы достаточно велики, чтобы рассеивать свет, а частицы молекулярных растворов слишком малы для этого. Это явление, характерна для коллоидных растворов, называется явлением Тиндаля.
■ 146. Как отделить коллоидный раствор от истинного? 147. Что такое явление Тиндаля и почему с его помощью можно отличить коллоидный раствор от истинных растворов и взвесей? (См. Ответ)
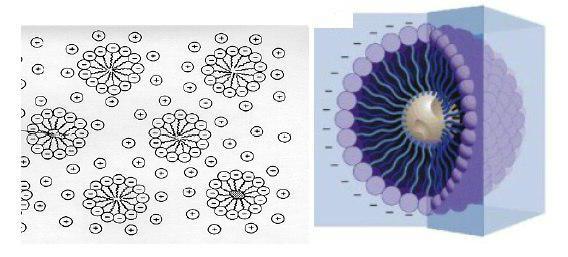
Коллоидные частицы, или, как их называют мицеллы, представляют собой либо отдельные крупные молекулы (например, молекулы белка, крахмала, либо группу молекул (например, мицеллы мыла или гидроокисей алюминия, железа).
Следует отметить, что большинство веществ может образовывать как коллоидные, так и истинные растворы в зависимости от растворителя. Например, мыло в воде дает коллоидный раствор, а в спирте истинный.Мы уже говорили о том, что из суспензий дисперсная фаза может с течением времени выделиться, так как частицы ее достаточно крупные; эмульсии также более или

Рис. 18. Простейший диализатор1- коллоидный раствор, 2- вода, 3- перепонка из пергамента
менее легко расслаиваются. Что касается коллоидных растворов, то они довольно устойчивы и могут храниться годами, но постепенно «стареют» и этим отличаются от истинных растворов, которые могут храниться бесконечно долго. Устойчивость коллоидных частиц объясняется тем, что последние обладают свойством адсорбции.

Рис 19. Явление Тиндаля.1 — истинный раствор;2 — коллоидный раствор;3 — световой конус в коллоидном растворе;4 — источник света.
Адсорбцией называется процесс концентрации молекул иди ионов из окружающей среды на поверхности частиц вещества, находящегося в этой среде, а само вещество называется адсорбентом.
• Запишите определение адсорбции.Поскольку в растворе всегда имеются ионы, коллоидные частицы адсорбируют их из раствора, причем коллоидные частицы обладают избирательным свойством. Они адсорбируют либо положительные, либо отрицательные ионы. Вокруг заряженных коллоидных частиц группируются ионы с противоположным зарядом — противо-ионы, образующие слой вокруг коллоидной частицы. В свою очередь вокруг противоионов образуется еще однаоболочка уже из молекул воды. Вся эта сложная система (рис. 20) и носит название мицеллы.В связи с тем, что коллоидные частицы заряжаются одноименно, это мешает им сталкиваться и укрупняться, чем и объясняется устойчивость коллоидных растворов. Однако изредка это может происходить.Тогда наблюдается постепенное «старение» коллоидных растворов.

Рис. 20. Схема строения мицеллы.1 — коллоидная частица; 2 — адсорбированные отрицательные ионы; 3 — положительные противоионы.
Для доказательства того, что коллоидные частицы имеют заряд, нужно пропустить через раствор постоянный электрический ток. В этом случае коллоидные частицы будут передвигаться к одному из электродов. Это явление называется электрофорезом. В настоящее время электрофорез находит широкое применение при клинических лабораторных исследованиях белковых фракций.
■ 148. Как образуется мицелла? 149. Почему коллоидные частицы всегда заряжены? 150. Что такое адсорбция? 151. Что такое «старение» коллоидных растворов? 152. Что такое электрофорез и где он применяется? (См. Ответ)
Коагуляция коллоидов. При нагревании коллоидного раствора, как обычно, происходит увеличение скорости движения коллоидных частиц и ионов. Кроме того, уменьшается адсорбция, так как происходит обратное явление— десорбция. Вследствие увеличения скорости движения коллоидных частиц и уменьшения их зарядности (от десорбции) увеличивается возможность столкновения коллоидных частиц, их слипания друг с другом и выпадения в осадок. Это процесс укрупнения частиц называется коагуляцией.Для того чтобы вызвать коагуляцию, проще всего снять заряд с коллоидной частицы, что достигается прибавлением какого-либо электролита к коллоидному раствору. Хотя при этом в раствор вводится одинаковое количество и одноименных зарядов, в непосредственно прилегающей к коллоидной частице ионной сфере увеличивается концентрация противоположно заряженных ионов, которые и нейтрализуют заряд коллоидной частицы. Коллоидные частицы разряжаются, сталкиваются, соединяются в более крупные частицы и коагулируют.Коллоидное вещество, находящееся в коллоидном растворе, называется золем, а вещество, подвергшееся коагуляции, гелем. Таким образом, процесс перехода золя в гель называется коагуляцией, а обратный переход геля в золь называется пептизацией. Процесс пептизации сопровождается набуханием коллоида, что играет очень большую роль в биологических процессах.
Коагуляция коллоидов вызывается и различными органическими веществами — спиртом, карболовой кислотой, формалином и т. д. Объясняется она сменой растворителя. Такие вещества, которые вызывают коагуляцию коллоидов, называются, коагулянтами.Коагулянтом может являться даже другой коллоидный раствор, если заряды их коллоидных частиц противоположны. Например, таким коагулянтом, как гидроокись алюминия Аl(ОН)3, широко пользуются для очистки питьевой воды от коллоидов. В природной воде всегда содержится большое количество коллоидов, которые прекрасно проходят сквозь фильтры и от которых нужно освободиться. Для этого в воду добавляют сульфат алюминия Al2(SО4)3 или квасцы KAl(SО4)2, которые гидролизуются водой, образуя гидроокись алюминия в виде коллоидного раствора с положительным зарядом. Этот коллоидный раствор и осаждает находящиеся в воде отрицательно заряженные коллоидные частицы.
■ 153. Запишите в тетрадь определения десорбции, коагуляции, пептизации, золя, геля, коагулянта. 154. Перечислите причины, которые могут вызвать коагуляцию раствора. (См. Ответ)
Способы получения коллоидных растворов.
Получить коллоидные растворы можно двумя путями. Первый путь — это путь укрупнения более мелких частиц, так называемый конденсационный путь. Например, чтобы получить рубиновое стекло, нужно приготовить коллоидный раствор золота в стеклянной массе. Для этого в расплавленное стекло добавляют соли золота, которые разлагаются с выделением атомов чистого металла. Атомы золота начинают группироваться в более крупные чаг стицы, а когда они достигнут нужных размеров, стекло охлаждают и укрупнение частиц прекращается.Второй путь — дисперсионный. При этом происходит дробление крупных частиц на более мелкие. Это осуществляется с помощью коллоидных мельниц или ультразвука.С коллоидами мы встречаемся повсеместно: любая растительная или животная клетка содержит белок в виде коллоидного раствора. Во многих отраслях промышленности (мыловаренная, маргариновая, фармацевтическая, производство искусственного волокна) специально изготовляются коллоиды. Для многих отраслей коллоиды служат сырьем, например для резиновой, кондитерской, бумажной, текстильной промышленности.
■ 155. Укажите способы получения коллоидных растворов. (См. Ответ)
12
11 13
13
znaesh-kak.com
Коллоидные частицы
Коллоидные примеси, находящиеся в природной воде, позволяют рассматривать ее как гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц — дисперсной фазой. Эти частицы представляют собой очень мелкие агрегаты кристаллического строения. Благодаря огромной удельной поверхности коллоидных частиц последние обладают весьма значительной поверхностной энергией, а следовательно, и высокой адсорбционной емкостью. Это обстоятельство имеет большое значение, так как основной процесс обработки воды — коагулирование — связан с адсорбцией на коллоидных частицах примесей, содержащихся в воде.[ ...]
Коллоидные системы. Дисперсные системы с размером частиц дисперсной фазы от 1 до 100 нм (10 9 -10-7 м) называются коллоидными. По размеру частиц они занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные системы являются ультрамикрогетерогенными системами. Для них характерно наличие высокоразвитой межфаз-яой поверхности, что в свою очередь обусловливает большой запас ■свободной поверхностной энергии. Это способствует тому, что коллоидные системы являются термодинамически неустойчивыми. В них сильно выражено стремление к уменьшению запаса свободной энергии. Реализация его возможна при уменьшении дисперсности частиц в результате их укрупнения или при адсорбции на их поверхности ионов или молекул, находящихся в дисперсионной среде. Особые свойства коллоидных систем обусловлены размером частиц. Коллоидные частицы настолько малы, что не задерживаются обычными фильтровальными материалами, не видны в обычный микроскоп, не оседают под действием силы тяжести. Устойчивость коллоидных растворов со временем снижается, т. е. они подвержены «старению».[ ...]
Коллоидные частицы довольно стабильны. Одна из причин этого состоит в следующем: благодаря малому размеру таких частиц броуновское движение молекул воды оказывает на них более сильное воздействие, чем силы гравитации. Кроме того, электростатические силы отталкивания, обусловленные поверхностным зарядом коллоидных частиц, предотвращают их коагуляцию и последующее осаждение.[ ...]
На частицы коллоидов действуют диффузионные силы, и частицы стремятся равномерно распределяться во всем объеме жидкой фазы. Наличие у частиц электрических зарядов одного знака вызывает их взаимное отталкивание. Одновременно между коллоидными частицами имеются молекулярные силы взаимного притяжения, которые проявляются лишь при небольших расстояниях между частицами. При снижении электрического заряда частиц, т. е. при уменьшении -потенциала, силы отталкивания уменьшаются и становится возможным слипание частиц — процесс коагуляции коллоида. Силы взаимного притяжения между коллоидными частицами начинают преобладать над электрическими силами отталкивания при -потенциале системы менее 0,03 В. При -потенциале, равном нулю, коагуляция проходит с максимальной интенсивностью, состояние коллоидной системы в этом случае носит название изо-электрического состояния, а величина pH называется изоэлектрической точкой системы.[ ...]
Если коллоидные частицы соединяются непосредственно поверхностями, то коагуляция будет необратимой. Если между соединяющимися частицами остаются небольшие сольватные оболочки или двойной электрический слой, образовавшийся осадок можно снова перевести в раствор. Такой процесс называется обратимой коагуляцией. Растворы высокомолекулярных соединений (ВМС) и некоторых органических веществ образуют на поверхности коллоидных частиц прочные адсорбционно-сольватные слои, способствующие повышению устойчивости коллоидного раствора, т. е. проявляют защитное действие. Стабилизирующее действие этих соединений способствует лиофилизации (гидрофилизации) дисперсных систем: по свойствам они становятся близкими к молекулярным коллоидам (обратимы, устойчивы). Если концентрация стабилизатора недостаточна для образования адсорбционно-сольватных слоев, его защитное действие резко снижается. При очистке воды содержащиеся в ней органические коллоиды замедляют процесс коагуляции, повышая устойчивость образующихся коллоидных растворов гидроксидов алюминия и железа.[ ...]
Ядро частицы составляет агрегат из т молекул кремниевой кислоты. Часть противоионов натрия (п—х) адсорбируется на частице и удерживается электростатическими силами притяжения потенциалопределяющих ионов. Не полностью компенсированный заряд потенциалопределяющих ионов вызывает появление отрицательного заряда у частицы кремниевой кислоты. В электрическом поле коллоидная частица вместе с адсорбционным слоем перемещается к одному полюсу, а ионы диффузного слоя — к противоположному. Если бы коллоидная частица перемещалась в электрическом поле только с потенциалопределяющими ионами, то электрокинетический потенциал должен быть равен термодинамическому потенциалу фо, возникающему между поверхностью частицы и раствором. Наличие в адсорбционном слое про-тивоинов снижает величину потенциала, и электрокинетический потенциал составляет часть полного потенциала. Если граница диффузного слоя совпадает с границей адсорбционного (%=0), то электрокинетический потенциал равен нулю. Такое состояние коллоидной частицы называется изоэлектрической точкой. В изоэлек-трической точке коллоидные частицы теряют устойчивость, укрупняются и выпадают в осадок.[ ...]
По отношению коллоидных частиц к растворителю коллоидные системы делятся на две группы. Одни из них образуют с растворителем устойчивые комплексы и называются лиофильными (1уо — растворяю, рЫ1ео — люблю), другие подобные комплексы с растворителем не образуют и называются лиофобными (рЬоЬоэ — страх).[ ...]
Для удаления коллоидных частиц используют физико-химические методы - флотацию, коагуляцию и флокуляцию, нарушающих кинетическую устойчивость этих частиц.[ ...]
Размеры этих частиц, называемых коллоидами, колеблются от 1 до 500 ¡нм; ¡¡при наблюдении под обычным микроскопом они невидимы. Дисперсная система, образованная коллоидными частицами, устойчива в воде, находящейся в покое, так как отдельные частицы имеют настолько большую поверхность относительно их веса, что силы тяжести не влияют на состояние такой системы. Коллоиды классифицируются на гидрофобные («не любящие воду») и гидрофильные («любящие воду»).[ ...]
Следовательно, коллоидные частицы состоят из весьма различного числа молекул. Например, в коллоидном растворе золота каждая коллоидная частица состоит из десятков, сотен и даже миллионов атомов. Каждая частица мыла в воде содержит около 50 молекул, а коллоидная частица высокомолекулярного соединения белка может состоять из одной молекулы.[ ...]
Тот факт, что между коллоидными частицами существуют силы притяжения, был установлен еще в начале этого столетия Смолуховским по кинетике коагуляции золей. В 1932 г. Кальман и Вильштеттер их приписали силам Ван-дер-Ваальса, действующим между атомами и молекулами. Как известно, эти силы состоят из ориентационной, индукционной и дисперсионной составляющих, причем все они убывают обратно седьмой (энергия — шестой) степени расстояния, т. е. действуют на очень малых расстояниях. Однако, как показали Де Бур и Га-макер, для макроскопических тел, например коллоидных частиц, состоящих из многих тысяч атомов (молекул), эти силы складываются, в результате чего суммарная энергия притяжения частиц изменяется гораздо медленнее — по кубическому или квадратичному закону. Иначе говоря, эти силы в определенных условиях достаточно велики и соизмеримы с силами отталкивания двойных электрических слоев. Основной вклад в молекулярное притяжение дисперсных тел вносят силы дисперсионного взаимодействия (лондоновские силы), так как ориентационные и индукционные эффекты отдельных молекул для достаточно большого ансамбля взаимно компенсируются.[ ...]
Воду, гидратирующую коллоидные частицы (прежде всего белки, называют коллоидпо-связанпой, а растворенные вещества (минеральные соли, сахара, органические кислоты и др.)—осмотически связаппой.[ ...]
Отстаивание крупных частиц осуществляется в непрерывнодействующих отстойниках большой емкости. От мелких частиц освобождаются фильтрацией. Для осаждения коллоидных частиц (мельчайших глинистых частиц и белковых веществ) их подвергают коагуляции путем добавки в воду коагулянтов - сульфатов или двойных солей алюминия (алюминиевые квасцы). Ион-коагулянт должен иметь заряд, противоположный заряду коллоидной частицы, чтобы он мог адсорбироваться на поверхности заряженной частицы; это приводит к коагуляции (слипанию) отдельных частиц и образованию осадка.[ ...]
Осмотическое давление коллоидных растворов значительно ниже, чем в истинных растворах той же концентрации. Объясняется это тем, что коллоидные частицы как по велйчине, так и по массе во много раз больше обычных молекул. Вследствие этого и количество их в коллоидном растворе во столько же раз меньше, чем в молекулярном растворе, а осмотическое давление коллоидов пропорционально числу частиц в единице объема.[ ...]
По степени дисперсности частиц коллоидные растворы располагаются между взвесями и истинными растворами. По внутренней структуре коллоидных частиц различают: суспензоиды и ассоциативные или мицеллярные коллоиды.[ ...]
Устойчивость и коагуляция коллоидных систем. Будучи термодинамически неустойчивыми, коллоидные системы под воздействием различных факторов могут разрушаться. Процесс соединения коллоидных частиц друг с другом, сопровождающийся образованием крупных агрегатов и разрушением коллоидной системы, называется коагуляцией. Она может происходить при введении в систему электролитов, золей с противоположным знаком заряда. Коагуляцию можно вызвать и изменением температуры, механическим воздействием, ионизирующим облучением.[ ...]
Иначе обстоит дело в случае коллоидных растворов. Коллоидные частицы — это сгустки большого числа молекул вещества. Ядро коллоидной частицы имеет кристаллическое строение. Наружный слой молекул этого ядра частично диссоциирован, причем ионы одного знака электрического заряда (например, положительного) находятся в окружающем ядро растворе, а ионы противоположного знака заряда прочно удерживаются поверхностью ядра (рис. 8).[ ...]
Двойной электрический слой. Частица суспензоида (мицелла) имеет сложное строение. В основе ее лежит нерастворимое в данной дисперсионной среде ядро. Поверхность ядра за счет свободной межфазной энергии адсорбирует из окружающей среды ионы в соответствии с правилом Фаянса . Эти ионы называются потенциалобразующими, так как сообщают частице определенный заряд. При адсорбции ионов снижается межфазная свободная энергия, что приводит систему в устойчивое состояние. Например, для золя гидроокиси железа потенциалобразующим ионом будет хлор-окись железа, образующаяся по уравнению Ре(ОН)3+НС1 ±: з= ;Ре0С1+2Н20. Хлорокись диссоциирует по уравнению РеОС1з= =г РеО++С1-. Катионы РеО+ избирательно адсорбируются на поверхности коллоидного ядра, заряжая его положительно. Если адсорбировалось п ионов РеО+, то в растворе находится п ионов С1 . Катион РеО+ сообщает коллоидной частице положительный заряд, а ее противоионами являются ионы хлора, находящиеся в растворе. Противоионы испытывают на себе две силы: электростатическую, притягивающую их к ядру коллоидной частицы, и диффузионную, стремящуюся рассеять их по раствору. В результате совместного действия указанных сил состояние отдельных анионов хлора неодинаково. Часть из них прочно связана с ядром коллоидной частицы, образуя на нем плотный адсорбционный слой (п—х). Другая часть образует диффузный слой х — ионную атмосферу частицы.[ ...]
Явление движения дисперсных частиц под влиянием электрического поля называется электрофорезом. Отличие электрофореза от электролиза состоит в том, что процессы электролиза подчинены закону Фарадея, т. е. количества выделившихся на электродах веществ пропорциональны их эквивалентам. При электрофорезе такая пропорциональность не наблюдается: образование коллоидной частицы не связано с химическим эквивалентом данного вещества.[ ...]
Золь — система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде. Если такой средой является вода, систему называют гидрозолем. Коллоидная частица золя гидроксида железа (III) состоит из ядра, образованного гидроксидом железа (III), адсорбционно связанных с ним потенциалообразующих водородных ионов (иН+) и некоторого количества ионов хлора [(и - >:)С1 меньшего, чем количество ионов водорода, в результате чего коллоидная частица имеет положительный заряд. Ионы водорода и входящие в состав частицы противоионы хлора образуют двойной электрический слой. Отдельные ионы хлора (хСГ) образуют диффузионный слой и вместе с коллоидной частицей составляют мицеллу золя гидроксида железа (III).[ ...]
Укажем также, что граница между коллоидной частицей и диффузионным слоем носит название границы или поверхности скольжения. Границы скольжения обозначают ту геометрическую поверхность, по которой происходит разделение («разрыв») мицеллы на коллоидную часть и диффузный слой в случае ее перемещения относительно дисперсионной среды.[ ...]
Это процесс укрупнения дисперсных частиц в результате их взаимодействия и объединения в агрегаты. В очистке сточных вод ее применяют для ускорения процесса осаждения тонкодисперсных примесей и эмульгированных веществ. Коагуляция наиболее эффективна для удаления из воды коллоидно-дисперсных частиц, т.е. частиц размером 1-100 мкм. Коагуляция может происходить самопроизвольно или под влиянием химических и физических процессов. В процессах очистки сточных вод коагуляция происходит под влиянием добавляемых к ним специальных веществ-коагулянтов. Коагулянты в воде образуют хлопья гидроксидов металлов, которые быстро оседают под действием силы тяжести. Хлопья обладают способностью улавливать коллоидные и взвешенные частицы и агрегировать их. Так как коллоидные частицы имеют слабый отрицательный заряд, а хлопья коагулянтов слабый положительный заряд, то между ними возникает взаимное притяжение.[ ...]
В сточной воде содержатся гидрофильные частицы — коллоидные частицы, проявляющие сильную тенденцию к связыванию или абсорбированию воды, и гидрофобные частицы — коллоидные частицы, отталкивающие воду. Весьма приближенно это можно представить так: органические коллоидные частицы являются гидрофильными, а неорганические — гидрофобными. Причина гид-рофильности органических частиц состоит в том, что на их поверхности существуют группы, способные связывать или адсорбировать воду, например аминогруппы (-1ЧН2), гидроксильные (-ОН) и карбоксильные группы (-СООН), см. рис. 10.5. Связывание или адсорбция воды происходит в результате образования так называемых водородных связей. В итоге гидрофильные частицы оказываются окруженными водной оболочкой, которая перемещается вместе с частицей. Эту оболочку называют «связанной» водой. Гидрофобные частицы подобной оболочки не имеют.[ ...]
По степени интенсивности взаимодействия коллоидных частиц с дисперсионной средой различают лиофильные и лиофобные системы. Если дисперсионной средой является вода, то они называются гидрофильными и гидрофобными. В лиофильных системах наблюдается значительное взаимодействие между дисперсионной средой и дисперсной фазой, сопровождающееся образованием сольватных (гидратных) слоев. В лиофобных системах это взаимодействие проявляется незначительно.[ ...]
Имеется много объяснений причин слипания коллоидных частиц до образования смолы. Наиболее распространено мнение, что причиной осаждения являются частицы грязи в суспензии, а также то, что первой ступенью является реакция свободных жирных кислот [53] с металлическими частичками аппарата, дающая легкоплавкие клейкие соли, которые вызывают дальнейшее слипание, поскольку они адсорбируются на волокнах слабее, чем натровые соли жирных и смоляных кислот.[ ...]
Коагуляция вод, содержащих мелкодисперсные и коллоидные частицы, может происходить при пропуске сточных вод через электролизер с анодом, изготовленным из алюминия и железа. Металл анода под действием постоянного тока ионизируется и переходит в сточную воду, а затем частицы загрязнений коагулируются образовавшимися труднорастворимыми гидрооксидами алюминия или железа. Растворение в воде 1 г алюминия эквивалентно введению 6,3 г Al2 (SO ) и 1 г железа - введению 2,9 г FeClß и 3,6 г Fe2(S0). Теоретический расход электроэнергии для растворения 1 г алюминия - 12 Вт.ч, а 1 г железа -2,9 Вт.ч. Плотность тока рекомендуется не более 10 А/м , расстояние между электродами - не более 20 мм, а скорость движения воды между электродами - не менее 0,5 м/с.[ ...]
Вода в почве удерживается также вокруг отдельных коллоидных частиц в виде тонкой прочной связанной пленки. Такую воду называют гигроскопической. Она адсорбируется за счет водородных связей на поверхности глины и кварца или на катионах, связанных с тинистыми минералами и гумусом. Гигроскопическая вода высвобождается только при температуре 105—110°С и физиологически практически недоступна растениям. Количество гигроскопической воды зависит от содержания в почве коллоидных частиц. В глинистых почвах ее содержится около 15%, в песчаных около 5% массы почвы. Она образует так называемый мертвый запас воды в почве.[ ...]
Иа потенциальной кривой 1 (см. рис. 34) на расстоянии Г частиц друг от друга существует минимум М. Для гидрофобных золей глубина его незначительна, но для сравнительно крупных асимметричных частиц, имеющих форму палочек или пластин, энергия взаимодействия в точке М превышает энергию теплового движения и происходит взаимное притяжение частиц с большого расстояния (порядка нескольких толщин двойного электрического слоя). Это явление способствует образованию геля, который легко разрушается при встряхивании системы. Тиксотропные структуры ¡возникают лишь при определенных концентрациях коллоидных частиц и электролитов. Количественная характеристика тикоотропии дается путем измерения кинетики самопроизвольного восстановления механических свойств (модуля упругости на сдвиг, прочности и др.) в зависимости от времени стояния системы.[ ...]
При миграции «двухфазных» (содержащих ионные и связные коллоидные формы радионуклидов) растворов в гетерогенных трещиновато-пористых средах происходит нарушение исходного физико-химического равновесия за счет дифузии из трещин в пористую матрицу. Это приводит к «потере» части радионуклидов коллоидными частицами («сорбционная» модель) или растворению части радиоколлоидов (модель «предельного насыщения»). И в том, и в другом случаях образовавшиеся свободные радионуклиды интенсивно сорбируются поверхностями трещин.[ ...]
Золи являются гетерогенными системами. Из-за малого размера коллоидных частиц дисперсная фаза золя имеет колоссальную развитую общую поверхность, на которой проявляется поверхностная энергия. Наличие этой энергии у коллоидных частиц — одно из главнейших отличительных свойств коллоидной системы.[ ...]
Большинство веществ, обусловливающих мутность и цветность природных вод, являются коллоидами. Наиболее часто обработка коагулянтами производится для очистки воды открытых водоемов. Коагулирование проводят для ускорения процесса осветления и обесцвечивания воды и увеличения его эффекта. Как известно, при простом отстаивании большая часть мелкодисперсных взвесей и коллоидных частиц вообще не выделяется из воды. При коагулировании эти частицы укрупняются в хлопья и выпадают в осадок.[ ...]
Значительно более сложные методы приходится применять для очистки воды от коллоидных и тем более растворенных частиц. В этих условиях используются различные химические, физические и физикохимические методы. Так, для удаления из воды коллоидных частиц требуются прежде всего нарушение их кинетической устойчивости и перевод в другое фазовое состояние. Это может быть достигнуто изменением электрического заряда, что приводит к агрегации и агломерации частиц.[ ...]
Во всех почвах часть анионов фосфорной кислоты адсорбируется положительно заряженными коллоидными частицами (в обмен на другие анионы, преимущественно НС03) и в этом состоянии остаются доступными растениям. Микроорганизмы почвы также связывают некоторое количество фосфатов, переводя их в состав плазмы клеток.[ ...]
Механизм действия флокулянтов основан на следующих явлениях: адсорбции молекул флокулянта на поверхности коллоидных частиц; ретикулядии (образование сетчатой структуры) молекул флокулянта; слипании коллоидных частиц за счет сил Ван-дер-Ваальса. При действии флокулянтов между коллоидными частицами образуются трехмерные структуры, способные к более быстрому и полному отделению от жидкой фазы. Причиной возникновения таких структур является адсорбция макромолекул флокулянта на нескольких частицах с образованием между ними полимерных мостиков. Коллоидные частицы заряжены отрицательно, что способствует процессу взаимной коагуляции с гидроксидом алюминия или железа. При добавлении активированного силиката увеличивается в 2-3 раза скорость осаждения и повышается эффект осветления.[ ...]
Диффузия — самопроизвольный процесс перемещения вещества в результате беспорядочного теплового движения частиц, вследствие которого происходит выравнивание концентрации раствора. Скорость диффузии зависит от формы и размеров частиц, температуры и вязкости среды. Скорость диффузии коллоидных частиц меньше скорости диффузии частиц в истинных растворах.[ ...]
Для молекул и ионов неорганических веществ в водной среде величина О равна приблизительно 1 ■ 10 6 см /сек, а для коллоидных частиц она ниже на 2—4 порядка. Скорость диффузии макромолекул высокомолекулярных веществ при одинаковых условиях близка к скорости диффузии коллоидных частиц.[ ...]
Молекула воды —диполь, поэтому в силу молекулярного притяжения молекулы легко образуют пленки вокруг мелких минеральных и коллоидных частиц в почве. Такая пленка толщиной 2—3 молекулы воды удерживается на поверхности частиц с большой силой, поэтому гигроскопическая (прочносвязанная) влага недоступна растениям. При засухе может возникать явление физиологической сухости почвы: влага в почве содержится, но только в гигроскопической, не извлекаемой растениями форме.[ ...]
Технологические схемы электродиализаторных установок (ЭДУ) состоят из следующих узлов: 1) аппаратов предварительной подготовки воды для очистки от взвешенных и коллоидных частиц; 2) собственно электродиализной установки; 3) кислотного хозяйства и системы сжатого воздуха; 4) фильтров, загруженных активированным углем, бактерицидных установок.[ ...]
Очистка сточных вод коагуляцией. В большинстве случаев производственные сточные воды представляют собой слабо-концентрированные эмульсии или суспензии, содержащие коллоидные частицы размером 0,001—0,1 мкм. Частицы такого размера имеют заряд в результате поглощения из водного раствора ионов.[ ...]
Один из наиболее дискуссионных вопросов, касающихся влияния магнитной обработки на кристаллизацию, это — является ли необходимым присутствие в растворе парамагнитных коллоидных частиц окислов железа. Результаты ряда экспериментов показывают, что изменение показателей кристаллизации происходит только тогда, когда в растворе присутствуют эти частицы. Наиболее четкие результаты получены в работе [65].[ ...]
Влияние содержания ПАВ в сточной воде на коагулируемость. сернистого железа исследовалось на примере диссольвана-неионогенного .ПАВ при концентрации 0,002%. Присутствие в пластовой воде ПАВ увеличивает устойчивость золя сернистого железа из-за гидрофилизации поверхности коллоидных частиц вследствие адсорбции на них молекул диссольвана.[ ...]
Помимо непосредственного отрицательного действия повышенной концентрации ионов водорода, кислотность почвы оказывает на растения многостороннее косвенное действие. Водород, вытесняя кальций из почвенного гумуса, повышает его дисперсность и подвижность, а насыщение водородом минеральных коллоидных частиц приводит к их постепенному разрушению. Этим объясняется небольшое содержание в кислых почвах коллоидной фракции, они имеют поэтому неблагоприятные физические свойства, плохую структуру, низкую емкость поглощения и слабую буферность. Полезные для растения микробиологические процессы в кислых почвах подавлены, образование доступных для растений форм питательных веществ протекает слабо.[ ...]
Многие наши попытки стабилизировать эффект магнитной обработки добавлением к воде железа (в разных формах) не дали положительных результатов. Об этом же говорит и В. И. Миненко. Известны случаи уменьшения отложения инкрустаций из кислых (pH 1—1,5) растворов, ненасыщенных по железу (например, отложений фосфогипса из фосфорной кислоты). Присутствие коллоидных частиц железа в таких растворах является маловероятным.[ ...]
Независимо от выделения нонов AI3 + и других катионов, в том числе и тяжелых металлов, изменение pH почвы может сказываться на ее свойствах и иным образом. Например, снижение pH препятствует развитию микроорганизмов так же, как это происходит в несозревших гумусовых почвах. К подобным организмам относятся, в частности, трибы Mykorrhiza, которые способствуют усвоению минеральных веществ корнями растений. Ощутимым результатом разрушения микроорганизмов в почве является нарушение ее нормального дыхания. Низкие значения pH способствуют присоединению анионов к железосодержащим коллоидным частицам в почве (рис. 4.1), так как протоны сообщают комплексам положительный заряд. У фосфатов возможен обмен их кислотных остатков с ОН-группами на поверхности коллоидных частиц, при этом фосфатные остатки связывается и дальнейшее усвоение фосфора растениями становится невозможным.[ ...]
ru-ecology.info
Коллоидная примесь - Большая Энциклопедия Нефти и Газа, статья, страница 1
Коллоидная примесь
Cтраница 1
Коллоидные примеси, вирусы, мелкие бактерии и высокомолекулярные соединения входят во вторую группу. Общим свойством для них является диаметр частиц. [1]
Коллоидные примеси в природной воде обладают очень большой седиментационной ( равномерным распределением примесей по объему воды), а также и агрегативной устойчивостью. Под последней следует понимать неизменяемость дисперсного состава в течение длительного времени. [2]
Коллоидные примеси представляют собой агломераты из большого числа молекул с наличием поверхности раздела между твердой фазой и водой. [3]
Коллоидные примеси ( кремневая кислота, гидроокись алюминия) также препятствуют обычному ходу определения, так как они закупоривают поры фильтра, в результате чего фильтрование и промывание прекращаются. [4]
Коллоидные примеси природных и промышленных сточных вод, частицы большинства суспензий заряжены отрицательно. Поэтому наиболее эффективными регуляторами устойчивости обычно встречающихся на практике дисперсий являются катионные флокулянты. [5]
Осаждение скоагулированных коллоидных примесей осуществляют обычно в больших резервуарах - отстойниках, после чего воду направляют на кварцевые фильтры. Во многих случаях процесс коагуляции совмещается с процессом отстаивания воды - на фильтре, куда подают вместе с осветляемой водой реагенты для коагуляции. Периодически фильтры очищают от шлама и грязи, промывая их водой снизу. [6]
Для коагуляции коллоидных примесей, содержащихся в воде, применяется также алюминат нафия NaA. Кроме коагулянтов, для коагуляции взвешенных в воде веществ часто применяют особую группу веществ - флокулянты - ускорители образования хлопьев. В качестве флокулянтов используется коллоидная кремнекислота, а также другие природные и синтетические полимеры. [7]
Для отделения коллоидных примесей к воде прибавляют коагулянты, например, сернокислый алюминий. Коллоиды коагулируют и оседают, увлекая органические примеси, в том числе и бактерии. Коагуляция производится до фильтрования или же после нее производят повторное фильтрование. [8]
Вторая группа объединяет гидрофильные и гидрофобные коллоидные примеси, находящиеся в воде в состоянии золей ( тонкодисперсных образований), а также высокомолекулярные вещества. Эти примеси имеют кристаллическое или аморфное строение. Высокомолекулярные вещества представлены линейными, спиральными и разветвленными макромолекулами различной степени гибкости. [9]
Очистка воды от коллоидных примесей ( масел) осуществляется с меньшей эффективностью ( около 102), а от газообразных и летучих веществ ( радиоактивные иод, ксенон, криптон, рутений) она равна нулю. Выпарные аппараты являются основным звеном технологических схем концентрирования радиоактивных отходов. Характеристики выпарных аппаратов, выполненных из стали 12Х18Н10Т, приведены ниже. [11]
Очистка воды от коллоидных примесей практически проводится при помощи ввода коагулянтов ( чаще А12 ( 5О4) з и FeSO. Однако в связи с возрастанием объема обрабатываемой воды ( в том числе и сточных вод) коагулянты становятся дефицитными реагентами. [12]
При невысоком содержании мелкодисперсных и коллоидных примесей в воде процесс коагуляции часто протекает неудовлетворительно. Образующиеся мелкие хлопья выносятся из отстойников вместе с осветленной водой. Происходит это вследствие недостаточного количества центров кристаллизации коагулянта и спонтанного зародышеобразования в объеме. Частицы порошков, наряду с частицами примесей воды, служат центрами зародышеобразования при кристаллизации коагулянта. В результате коагуляции получаются крупные хлопья, хорошо отделяющиеся от воды. [13]
Вторая группа веществ объединяет гидрофильные и гидрофобные коллоидные примеси, а также высокомолекулярные вещества и детергенты с величиной частиц 10 - 5 - 10-в см. Высокодисперсные гетерогенные системы существуют в виде дисперсий трех - или двухмерных кристаллических или аморфных структур; высокомолекулярные вещества могут быть представлены линейными ( гибкими и жесткими), спиральными и разветвленными макромолекулами. Межатомные связи в молекулах этих веществ - полярные, координационные, ковалентные. [14]
Вторая группа веществ объединяет гидрофильные и гидрофобные коллоидные примеси, а также высокомолекулярные вещества. Высокомолекулярные вещества могут быть представлены линейными ( гибкими и жесткими), спиральными и разветвленными макромолекулами. В эту группу входят минеральные и органоминеральные частицы почв и грунтов, недиссоцииро-ванные и нерастворимые формы гумусовых веществ, придающие воде окраску, а таже вирусы и другие организмы, приближающиеся по размерам к коллоидным частицам. Так как среди последних находятся болезнетворные ( патогенные) организмы, то удаление их из воды весьма ответственное мероприятие. [15]
Страницы: 1 2 3 4
www.ngpedia.ru