Хром, химический элемент: описание, свойства, формула и характеристика. Вода хром
Химические свойства
«Национальный исследовательский Томский политехнический Университет»

Институт природных ресурсов Геоэкология и геохимия
РЕФЕРАТ
Хром
по дисциплине:
Химия
Выполнил:
студент группы 2Г41 Ткачева Анастасия Владимировна 29.10.2014
Проверил:
преподаватель Стась Николай Федорович
Томск 2014
Положение в периодической системе
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr(лат. Chromium). Простое вещество хром — твёрдый металлголубовато-белого цвета. Хром иногда относят к чёрным металлам.
Строение атома
+17 Cl )2 )8 )7 - схема строения атома
1s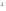 2s
2s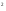 2p
2p 3s
3s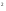 3p
3p - электронная формула
- электронная формула
Атом располагается в III периоде, и имеет три энергетических уровня
Атом располагается в VII в группе, в главной подгруппе – на внешнем энергетическом уровне 7 электронов
Свойства элемента
Физические свойства
Хром - белый блестящий металл с кубической объемно-центрированной решеткой, а = 0,28845 нм, отличающийся твердостью и хрупкостью, с плотностью 7,2 г/см3, один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану), с температурой плавления 1903 град. И с температурой кипения около 2570 град. С. На воздухе поверхность хрома покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления. Добавка углерода к хрому еще больше увеличивает его твердость.
Хром при обычных условиях – инертный металл, при нагревании становится довольно активным.
Взаимодействие с неметаллами
При нагревании выше 600°С хром сгорает в кислороде:
4Cr + 3O2 = 2Cr2O3.
С фтором реагирует при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления, образуя галогениды хрома (III):
2Cr + 3Cl2 = 2CrCl3.
С азотом реагирует при температуре выше 1000°С с образованием нитридов:
2Cr + N2 = 2CrN
или 4Cr + N2 = 2Cr2N.
Сера при температуре выше 300°С образует сульфиды от CrS до Cr5S8, например:
2Cr + 3S = Cr2S3.
Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов:
Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4),
2Cr + 3C = Cr2C3 (возможно образование Cr23C6, Cr7B3),
Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi).
С водородом непосредственно не взаимодействует.
Взаимодействие с водой
В тонкоизмельченном раскаленном состоянии хром реагирует с водой, образуя оксид хрома (III) и водород:
2Cr + 3h3O = Cr2O3 + 3h3
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов хром находится до водорода, он вытесняет водород из растворов неокисляющих кислот:
Cr + 2HCl = CrCl2 + h3;
Cr + h3SO4 = CrSO4 + h3.
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O.
Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты:
2Cr + 6h3SO4 = Cr2(SO4)3 + 3SO2 + 6h3O;
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3h3O.
Взаимодействие с щелочными реагентами
В водных растворах щелочей хром не растворяется, медленно реагирует с расплавами щелочей с образованием хромитов и выделением водорода:
2Cr + 6KOH = 2KCrO2 + 2K2O + 3h3.
Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + h3O.
Восстановление металлов из оксидов и солей
Хром – активный металл, способен вытеснять металлы из растворов их солей: 2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
Свойства простого вещества
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
2Cr
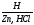 →2Cr
→2Cr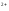
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(h3O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12h3O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Cr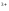 +3NH
+3NH +3h3O→Cr(OH)
+3h3O→Cr(OH) ↓+3NH
↓+3NH

Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Cr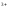 +3OH
+3OH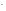 →Cr(OH)
→Cr(OH) ↓
↓
Cr(OH) +3OH
+3OH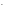 →[Cr(OH)
→[Cr(OH) ]
]
Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3+2NaOH→2NaCrO2+h3O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
Cr2O3+6HCl→2CrCl3+3h3O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na [Cr(OH)
[Cr(OH) ]+3H
]+3H O
O →2Na
→2Na CrO
CrO +2NaOH+8H
+2NaOH+8H O
O
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O
Соединения хрома (+4)[
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетикоми обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая h3CrO4 и двухромовая h3Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую h3CrO4, дихромовую h3Cr2O7 и другие изополикислоты с общей формулой h3CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2CrO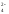
 +2H
+2H →Cr2O
→Cr2O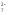 +h3O
+h3O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат K2CrO4:
Cr2O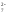 +2OH
+2OH →2CrO
→2CrO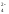 +H
+H O
O
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
h3CrnO3n+1→h3O+nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария, как к растворам хроматов, так и к растворам дихроматов:
Ba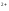 +CrO
+CrO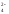 →BaCrO
→BaCrO ↓
↓
2Ba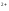 +Cr
+Cr O
O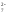 +h3O→2BaCrO
+h3O→2BaCrO ↓+2H
↓+2H
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7h3O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
studfiles.net
Хром — общая характеристика элемента, химические свойства хрома и его соединений
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета.

Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t° →2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3h3O → Cr2O3 + 3h3
Хром растворяется в разбавленных сильных кислотах (HCl, h3SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + h3
2Cr + 6HCl + O2 → 2CrCl3 + 2h3O + h3
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2h3O
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + h3
4Cr(OH)2 + O2 + 2h3O → 4Cr(OH)3
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°→ Cr2O3 + 3h3O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(Nh5)2Cr2O7 –t°→ Cr2O3 + N2+ 4h3O (реакция «вулканчик»)
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH → 2NaCrO2 + h3O
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Cr2O3 + 4KOH + KClO3 → 2K2CrO4+ KCl + 2h3O
Гидроксид хрома (III) Сr(ОН)3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3h3SO4 → Cr2(SO4)3 + 6h3O Сr(ОН)3 + ЗН+ = Сr3+ + 3h3O
Cr(OH)3 + KOH → K[Cr(OH)4] , Сr(ОН)3 + ЗОН— (конц.) = [Сr(ОН)6]3-
Cr(OH)3 + KOH → KCrO2+2h3O Сr(ОН)3 + МОН = МСrO2(зел.) + 2Н2O (300—400 °С, М = Li, Na)
Сr(ОН)3→(120oC –h3O) СrO(ОН) →(430-10000С –h3O) Cr2O3
2Сr(ОН)3 + 4NаОН(конц.) + ЗН2O2(конц.) =2Na2СrO4 + 8Н20
Получение: осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr3+ + 3(Nh4 Н2O) = Сr(ОН)3↓ + ЗNН4+
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓+ 3Na2SO4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 → 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8h3O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и h3SO4(конц.).
K2CrO4 + h3SO4 → CrO3 + K2SO4 + h3O
K2Cr2O7 + h3SO4 → 2CrO3 + K2SO4 + h3O
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + h3O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + h3SO4 → K2Cr2O7 + K2SO4 + h3O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH → 2K2CrO4 + h3O
Дихромат калия – окислитель в кислой среде:
К2Сr2O7 + 4h3SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4h3O
K2Cr2O7 + 4h3SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4h3O
K2Cr2O7 + 7h3SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7h3O
K2Cr2O7 + 7h3SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7h3O
Хромат калия К2 CrО4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K2CrO4+h3 SO4(30%)=K2Cr2O7 +K2SO4 +h3O
2K2CrO4(т)+16HCl(конц.,гор.) =2CrCl3+3Cl2↑+8h3O+4KCl
2K2CrO4+2h3O+3h3S=2Cr(OH)3↓+3S↓+4KOH
2K2CrO4+8h3O+3K2S=2K[Сr(ОН)6]+3S↓+4KOH
2K2CrO4+2AgNO3=KNO3+Ag2CrO4(красн.)↓
Качественная реакция:
К2СгO4 + ВаСl2 = 2КСl + ВаCrO4↓
2ВаСrO4(т)+ 2НСl (разб.) = ВаСr2O7(p)+ ВаС12 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Сr2Fe‖‖)O4 + 8К2CO3 + 7O2 = 8К2СrO4 + 2Fе2O3 + 8СO2 (1000 °С)
Дихромат калия K2Cr2O7 . Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr2O72- ). В щелочной среде образует К2CrO4 . Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н2O2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н2SO4 (конц.) — для мытья химической посуды.
Уравнения важнейших реакций:
4К2Cr2O7=4K2CrO4+2Cr2O3+3O2 (500-600o C)
K2Cr2O7(т)+14HCl (конц) =2CrCl3+3Cl2↑+7h3O+2KCl (кипячение)
K2Cr2O7(т)+2h3SO4(96%) ⇌2KHSO4+2CrO3+h3O (“хромовая смесь”)
K2Cr2O7+KOH (конц ) =h3O+2K2CrO4
Cr2O72- +14H+ +6I— =2Cr3+ +3I2↓+7h3O
Cr2O72- +2H+ +3SO2(г)=2Cr3+ +3SO42- +h3O
Cr2O72- +h3O +3h3S(г)=3S↓+2OH— +2Cr2(OH)3↓
Cr2O72- (конц )+2Ag+(разб.) =Ag2Cr2O7 (т. красный)↓
Cr2O72-(разб.) +h3O +Pb2+=2H+ + 2PbCrO4 (красный)↓
K2Cr2O7(т) +6HCl+8H0(Zn)=2CrCl2(син)+7h3O+2KCl
Получение: обработка К2СrO4 серной кислотой:
2К2СrO4 + Н2SO4(30%) = К2Cr2O7 + К2SO4 + Н2O

himege.ru
Хром и его соединения
Хром
Открытие хрома относится к периоду бурного развития химико-аналитических исследований солей и минералов. В России химики проявляли особый интерес к анализу минералов, найденных в Сибири и почти неизвестных в Западной Европе. Одним из таких минералов была сибирская красная свинцовая руда (крокоит), описанная еще Ломоносовым. Минерал исследовался, но ничего, кроме окислов свинца, железа и алюминия в нем не было найдено. Однако в 1797 году Вокелен, прокипятив тонко измельченный образец минерала с поташом и осадив карбонат свинца, получил раствор, окрашенный в оранжево – красный цвет. Из этого раствора он выкристаллизовал рубиново-красную соль, из которой выделили окисел и свободный металл, отличный от всех известных металлов. Вокелен назвал его Хром (Chrome) от греческого слова - окраска, цвет; правда здесь имелось в виду свойство не металла, а его ярко окрашенных солей.
Нахождение в природе.
Важнейшей рудой хрома, имеющей практическое значение, является хромит, приблизительный состав которого отвечает формуле FeCrO4.

Он встречается в Малой Азии, на Урале, в Северной Америке, на юге Африки. Техническое значение имеет также вышеназванный минерал крокоит – PbCrO4. В природе встречаются также оксид хрома (3) и некоторые другие его соединения. В земной коре содержание хрома в пересчете на металл составляет 0,03%. Хром обнаружен на Солнце, звездах, метеоритах.
Физические свойства.
Хром – белый, твердый и хрупкий металл, исключительно химически стойкий к воздействию кислот и щелочей. На воздухе он окисляется, имеет на поверхности тонкую прозрачную пленку оксида. Хром имеет плотность 7,1 г/см3 , его температура плавления составляет +18750С.
Получение.
При сильном нагреве хромистого железняка с углем происходит восстановление хрома и железа:
FeO * Cr2O3 + 4C = 2Cr + Fe + 4CO
В результате этой реакции образуется сплав хрома с железом, отличающийся высокой прочностью. Для получения чистого хрома, его восстанавливают из оксида хрома(3) алюминием:
Cr2O3 + 2Al = Al2O3 + 2Cr
В данном процессе обычно используют два оксида – Cr2O3 и CrO3
Химические свойства.
Благодаря тонкой защитной пленке оксида, покрывающей поверхность хрома, он весьма устойчив к воздействию агрессивных кислот и щелочей. Хром не реагирует с концентрированными азотной и серной кислотами, а также с фосфорной кислотой. Со щелочами хром вступает во взаимодействие при t = 600-700оC. Однако хром взаимодействует с разбавленными серной и соляной кислотами, вытесняя водород:
2Cr + 3h3SO4 = Cr2(SO4)3 + 3h32Cr + 6HCl = 2CrCl3 + 3h3
При высокой температуре хром горит в кислороде, образуя оксид(III).
Раскаленный хром реагирует с парами воды:
2Cr + 3h3O = Cr2O3 + 3h3
Хром при высокой температуре реагирует также с галогенами, галоген - водородами, серой, азотом, фосфором, углем, кремнием, бором, например:
Cr + 2HF = CrF2 + h32Cr + N2 = 2CrN2Cr + 3S = Cr2S3Cr + Si = CrSi
Вышеуказанные физические и химические свойства хрома нашли свое применение в различных областях науки и техники. Так, например, хром и его сплавы используются для получения высокопрочных, коррозионно-стойких покрытий в машиностроении. Сплавы в виде феррохрома используются в качестве металлорежущих инструментов. Хромированные сплавы нашли применение в медицинской технике, при изготовлении химического технологического оборудования.

Положение хрома в периодической системе химических элементов:
Хром возглавляет побочную подгруппу VI группы периодической системы элементов. Его электронная формула следующая:
+24Cr IS22S22P63S23P63d54S1
В заполнении орбиталей электронами у атома хрома нарушается закономерность, согласно которой сначала должна была бы заполнятся 4S – орбиталь до состояния 4S2. Однако, вследствие того, что 3d – орбиталь занимает в атоме хрома более выгодное энергетическое положение, происходит ее заполнение до значения 4d5. Такое явление наблюдается у атомов некоторых других элементов побочных подгрупп. Хром может проявлять степени окисления от +1 до +6. Наиболее устойчивыми являются cоединения хрома со степенями окисления +2, +3, +6.
Соединения двухвалентного хрома.
Оксид хрома (II) CrO – пирофорный черный порошок (пирофорность – способность в тонкораздробленном состоянии воспламенятся на воздухе). CrO растворяется в разбавленной соляной кислоте:
CrO + 2HCl = CrCl2 + h3O
На воздухе при нагревании свыше 1000С CrO превращается в Cr2O3.
Соли двухвалентного хрома образуются при растворении металлического хрома в кислотах. Эти реакции проходят в атмосфере малоактивного газа (например h3), т.к. в присутствии воздуха легко происходит окисление Cr(II) до Cr(III).
Гидроксид хрома получают в виде желтого осадка при действии раствора щелочи на хлорид хрома (II):
CrCl2 + 2NaOH = Cr(OH)2 + 2NaCl
Cr(OH)2 обладает основными свойствами, является восстановителем. Гидратированный ион Cr2+ окрашен в бледно – голубой цвет. Водный раствор CrCl2 имеет синюю окраску. На воздухе в водных растворах соединения Cr(II) переходят в соединения Cr(III). Особенно это ярко выражается у гидроксида Cr(II):
4Cr(OH)2 + 2h3O + O2 = 4Cr(OH)3
Соединения трехвалентного хрома.
Оксид хрома (III) Cr2O3 – тугоплавкий порошок зеленого цвета. По твердости близок к корунду. В лаборатории его можно получить нагреванием дихромата аммония:
(Nh5)2Cr2O7 = Cr2O3 + N2 + 4h3
Cr2O3 – амфотерный оксид, при сплавлении со щелочами образует хромиты: Cr2O3 + 2NaOH = 2NaCrO2 + h3O
Гидроксид хрома также является амфотерным соединением:
Cr(OH)3 + HCl = CrCl3 + 3h3OCr(OH)3 + NaOH = NaCrO2 + 2h3O
Безводный CrCl3 имеет вид листочков темно-фиолетового цвета, совершенно нерастворим в холодной воде, при кипячении он растворяется очень медленно. Безводный сульфат хрома (III) Cr2(SO4)3 розового цвета, также плохо растворим в воде. В присутствии восстановителей образует фиолетовый сульфат хрома Cr2(SO4)3*18h3O. Известны также зеленые гидраты сульфата хрома, содержащие меньшее количество воды. Хромовые квасцы KCr(SO4)2*12h3O выкристаллизовываются из растворов, содержащих фиолетовый сульфат хрома и сульфат калия. Раствор хромовых квасцов при нагревании становится зеленым благодаря образованию сульфатов.
Реакции с хромом и его соединениями
Почти все соединения хрома и их растворы интенсивно окрашены. Имея бесцветный раствор или белый осадок, мы можем с большой долей вероятности сделать вывод об отсутствии хрома.
- Сильно нагреем в пламени горелки на фарфоровой чашке такое количество бихромата калия, которое поместится на кончике ножа. Соль не выделит кристаллизационной воды, а расплавится при температуре около 4000С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде ( она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K2CrO4 и зеленый Cr2O3.
- Растворим 3г порошкообразного бихромата калия в 50мл воды. К одной части добавим немного карбоната калия. Он растворится с выделением CO2, а окраска раствора станет светло – желтой. Из бихромата калия образуется хромат. Если теперь по порциям добавить 50% раствор серной кислоты, то снова появится красно – желтая окраска бихромата.
- Нальем в пробирку 5мл. раствора бихромата калия, прокипятим с 3мл концентрированной соляной кислоты под тягой. Из раствора выделяется желто-зеленый ядовитый газообразный хлор, потому, что хромат окислит HCl до Cl2 и h3O. Сам хромат превратится в зеленый хлорид трехвалентного хрома. Его можно выделить выпариванием раствора, а потом, сплавив с содой и селитрой, перевести в хромат.
- При добавлении раствора нитрата свинца выпадает желтый хромат свинца; при взаимодействии с раствором нитрата серебра образуется красно – коричневый осадок хромата серебра.
- Добавим пероксид водорода к раствору бихромата калия и подкислим раствор серной кислотой. Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% - ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
Аналитические реакции на ионы хрома.
- К 3-4 каплям раствора хлорида хрома CrCl3 прибавьте 2М раствор NaOH до растворения первоначально выпавшего осадка. Обратите внимание на цвет образовавшегося хромита натрия. Нагрейте полученный раствор на водяно бане. Что при этом происходит?
- К 2-3 каплям р-ра CrCl3 прибавьте равный объем 8М раствора NaOH и 3-4 капли 3% р-ра h3O2. Нагрейте реакционную смесь на водяной бане. Что при этом происходит? Какой осадок образуется, если полученный окрашеный раствор нейтрализовать, добавить к нему Ch4COOH, а затем Pb(NO3)2?
- Налейте в пробирку по 4-5 капель растворов сульфата хрома Cr2(SO4)3, IMh3SO4 и KMnO4. Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано?
- К 3-4 каплям подкисленного азотной кислотой раствора K2Cr2O7 прибавьте 2-3 капли раствора h3O2 и перемешайте. Появляющиеся синее окрашивание раствора обусловлено возникновением надхромовой кислоты h3CrO6:
Cr2O72- + 4h3O2 + 2H+ = 2h3CrO6 + 3h3O
Обратите внимание на на быстрое разложение h3CrO6:
2h3CrO6 + 8H+ = 2Cr3+ + 3O2 + 6h3O синий цвет зеленый цвет
Надхромовая кислота значительно более устойчива в органических растворителях.
- К 3-4 каплям подкисленного азотной кислотой раствора K2Cr2O7 прибавьте 5 капель изоамилового спирта, 2-3 капли раствора h3O2 и взболтайте реакционную смесь. Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость h3CrO6 в органической и водных фазах.
- При взаимодействии CrO42- и ионами Ba2+ выпадает желтый осадок хромата бария BaCrO4.
- Нитрат серебра образует с ионами CrO42- осадок хромата серебра кирпично-красного цвета.
- Возьмите три пробирки. В одну из них поместите 5- 6 капель раствора K2Cr2O7, во вторую – такой же объем раствора K2CrO4, а в третью – по три капли обоих растворов. Затем добавте в каждую пробирку по три капли раствора иодида калия. Объясните полученный результат. Подкислите раствор во второй пробирке. Что при этом происходит? Почему?
Занимательные опыты с соединениями хрома
- Смесь CuSO4 и K2Cr2O7 при добавлении щелочи становится зеленой, а в присутствии кислоты становится желтой. Нагревая 2мг глицерина с небольшим количеством (Nh5)2Cr2O7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
- Поместить в центр консервной банки с термитом «рубиновую смесь» - тщательно растертый и помещенный в алюминиевую фольгу Al2O3 (4,75г) с добавкой Cr2O3(0,25г). Чтобы банка подольше не остывала, необходимо закопать под верхний обрез в песок, а после поджигания термита и начала реакции, накрыть ее железным листом и засыпать песком. Банку выкопать через сутки. В итоге образуется красно – рубиновый порошок.
- 10г бихромата калия растирают с 5г нитрата натрия или калия и 10г сахара. Смесь увлажняют и смешивают с коллодием. Если порошок спрессовать в стеклянной трубке, а затем вытолкнуть палочку и поджечь ее с торца, то начнет выползать «змея», сначала черная, а после охлаждения - зеленая. Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз.
- Если смешать растворы сульфата меди и дихромата калия и добавить немного раствора аммиака, то выпадет аморфный коричневый осадок состава 4СuCrO4 * 3Nh4 * 5h3O, который растворяется в соляной кислоте с образованием желтого раствора, а в избытке аммиака получается зеленый раствор. Если далее к этому раствору добавить спирт, то выпадет зеленый осадок, который после фильтрации становится синим, а после высушивания – сине-фиолетовым с красными блестками, хорошо видимыми при сильном освещении.
- Оставшийся после опытов «вулкан» или «фараоновы змеи» оксид хрома можно регенерировать. Для этого надо сплавить 8г Cr2O3 и 2г Na2CO3 и 2,5г KNO3 и обработать остывший сплав кипятком. Получается растворимый хромат, который можно превратить и в другие соединения Cr(II) и Cr(VI), в том числе и исходный дихромат аммония.
Примеры окислительно – восстановительных переходов с участием хрома и его соединений
1. Cr2O72- -- Cr2O3 -- CrO2- -- CrO42- -- Cr2O72-
a) (Nh5)2Cr2O7 = Cr2O3 + N2 + 4h3O б) Cr2O3 + 2NaOH = 2NaCrO2 + h3Oв) 2NaCrO2 + 3Br2 + 8NaOH = 6NaBr +2Na2CrO4 + 4h3Oг) 2Na2CrO4 + 2HCl = Na2Cr2O7 + 2NaCl + h3O
б) Cr2O3 + 2NaOH = 2NaCrO2 + h3Oв) 2NaCrO2 + 3Br2 + 8NaOH = 6NaBr +2Na2CrO4 + 4h3Oг) 2Na2CrO4 + 2HCl = Na2Cr2O7 + 2NaCl + h3O
2. Cr(OH)2 -- Cr(OH)3 -- CrCl3 -- Cr2O72- -- CrO42-
а) 2Cr(OH)2 + 1/2O2 + h3O = 2Cr(OH)3б) Cr(OH)3 + 3HCl = CrCl3 + 3h3Oв) 2CrCl3 + 2KMnO4 + 3h3O = K2Cr2O7 + 2Mn(OH)2 + 6HClг) K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
3. CrO -- Cr(OH)2 -- Cr(OH)3 -- Cr(NO3)3 -- Cr2O3 -- CrO-2 Cr2+
а) CrO + 2HCl = CrCl2 + h3Oб) CrO + h3O = Cr(OH)2в) Cr(OH)2 + 1/2O2 + h3O = 2Cr(OH)3г) Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3h3Oд) 4Сr(NO3)3 = 2Cr2O3 + 12NO2 + O2е) Cr2O3 + 2 NaOH = 2NaCrO2 + h3O
Элемент хром в роли художника
Химики довольно часто обращались к проблеме создания искусственных пигментов для живописи. В XVIII-XIXвв была разработана технология получения многих живописных материалов. Луи Никола Воклен в 1797г., обнаруживший в сибирской красной руде ранее неизвестный элемент хром, приготовил новую, замечательно устойчивую краску – хромовую зелень. Хромофором ее является водный оксид хрома (III). Под названием « изумрудная зеленая» ее начали выпускать в 1837 году. Позже Л.Вокелен предложил несколько новых красок: баритовую, цинковую и хромовые желтые. Со временем они были вытеснены более стойкими желтыми, оранжевыми пигментами на основе кадмия.
Зеленая хромовая – самая прочная и светостойкая краска, не поддающаяся воздействию атмосферных газов. Растертая на масле хромовая зелень обладает большой кроющей силой и способна к быстрому высыханию, поэтому с XIX в. ее широко применяют в живописи. Огромное значение она имеет в росписи фарфора. Дело в том, что фарфоровые изделия могут декорироваться как подглазурной, так и надглазурной росписью. В первом случае краски наносят на поверхность лишь слегка обожженного изделия, которое затем покрывают слоем глазури. Далее следует основной, высокотемпературный обжиг: для спекания фарфоровой массы и оплавления глазури изделия нагревают до 1350 – 14500С. Столь высокую температуру без химических изменений выдерживают очень немногие краски, а в старину таких вообще было только две – кобальтовая и хромовая. Черный оксид кобальта, нанесенный на поверхность фарфорового изделия, при обжиге сплавляется с глазурью, химически взаимодействуя с ней. В результате образуются ярко-синие силикаты кобальта. Такую декарированную кобальтом синюю фарфоровую посуду все хорошо знают. Оксид хрома (III) не взаимодействует химически с компонентами глазури и просто залегает между фарфоровыми черепками и прозрачной глазурью «глухим» слоем.
Помимо хромовой зелени художники применяют краски, полученные из волконскоита. Этот минерал из группы монтмориллонитов (глинистый минерал подкласса сложных силикатов Na(Mo,Al), Si4O10(OH)2 был обнаружен в 1830г. русским минералогом Кеммерером и назван в честь М.Н Волконской – дочери героя битвы при Бородино генерала Н.Н. Раевского, жены декабриста С.Г.Волконского. Волконскоит представляет собой глину, содержащую до 24% оксида хрома, а так же оксиды аллюминея и железа (III). Непостоянство состава минерала, встечающегося на Урале, в Пермской и Кировской областях, обусловливает его разнообразную окраску – от цвета зимней потемневшей пихты до ярко-зеленого цвета болотной лягушки.
Пабло Пикассо обращался к геологам нашей страны с просьбой изучить запасы волконскоита, дающего краску неповторимо свежего тона. В настоящее время разработан способ получения искусственного волконскоита. Интересно отметить, что по данным современных исследований, русские иконописцы использовали краски из этого материала еще в средние века, задолго до его «официального» открытия. Известной популярностью пользовалась у художников и зелень Гинье (создана в 1837г.), хромоформ которой является гидрат окиси хрома Cr2O3 * (2-3) h3O, где часть воды химически связана, а часть адсорбирована. Этот пигмент придает краске изумрудный оттенок.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
ВОДА и ЗДОРОВЬЕ - Для чего организму нужен хром?Дефицит хрома в организме. Хром в продуктах Кораллового клуба.

Дефицит хрома в организме. Хром в продуктах Кораллового клуба.
Бесспорно, хром занимает центральное место в метаболизме сахара. Хотя многие годы практики показывают, что ограничение потребления углеводов - это самый легкий, самый надежный способобщего оздоровления, позволяющий обойти болезнь стороной, лучшим средством для ее диетологического лечения является хром.При регулярном приеме этот микроэлемент оказывает значительное лечебное воздействие на целый спектр нарушений здоровья, которые вызывает или отягощает резистентность к инсулину - включая ожирение, гипогликемию (неустойчивый уровень сахара в крови), инсульт, гипертонию, болезнь Крона и колит, язвы, гастрит, рассеянный склероз, болезнь Миньера, мигрени, предменструальный синдром, эпилепсию и множество психических расстройств.
За исключением приема добавок, не существует достаточно хороших способов восстановления запасов хрома в организме. Правда, грибы, ячмень и цельнозерновые продукты содержат этот микроэлемент, но только в том случае, если они выращены на богатой хромом почве. Морепродукты и мясо тоже считаются хорошими пищевыми источниками, но опять же животные должны быть откормлены на богатом хромом рационе.
Помимо перехода на низкоуглеводную диету прием добавок с хромом - лучший способ, который надежно поможет вам избавиться от нежелательного жира.
Как показали исследования, хром действует по нескольким направлениям:Уменьшая тягу к сахару, хром позволяет легче придерживаться низкоуглеводного режима питания.Даже без соблюдения диеты минерал может увеличивать общую костно-мышечную массу тела, что, в свою очередь, ускоряет обмен веществ и сжигает лишний жир.Хром помогает предотвратить потерю мышечной ткани, если вы намеренно ограничиваете калорийность рациона.Минерал способствует сжиганию калорий в процессе упражнений, что еще более облегчает сбрасывание веса. Тренировки также повышают выброс хрома из организма, усиливая вашу потребность в приеме добавок.Включение хрома в программу питательных добавок помогает повысить в крови содержание ЛВП-холестерина, очищающего артерии, и одновременно понизить уровни ЛНП-холестерина и триглицеридов. Общая концентрация холестерина также уменьшается. Как сообщают исследователи, это снижение оказывается еще более впечатляющим, когда к хрому добавляют небольшое количество ниацина (никотиновой кислоты).
Терапевтическая ценность хрома в других областях не так твердо установлена, как в случаях диабета, сердечно-сосудистых заболеваний и гипертонии, однако она может распространяться и на многие другие заболевания. Например, он может облегчать хронические головные боли и помогать лечению угревой сыпи, которая, по-видимому, отчасти обусловлена нарушением обмена инсулина. Хром укрепляет кости, повышая уровень дегидроэпиандростерона (ДГЭА), и потому он может входить в программу лечения остеопороза. И хотя мы не можем утверждать, что хром предотвращает глаукому, он может (вместе с витамином С) сдерживать рост внутриглазного давления.
Более 90% американцев, например, испытывают дефицит хрома. И как часто бывает, меньше всего его у тех, кто в нем больше всего нуждается. Недостаточность хрома имеет самоподдерживающийся характер. Когда в вашем организме мало этого микроэлемента, вас сильнее тянет на сладкое.
Но чем больше сахара вы едите, тем в большей степени истощаются запасы хрома. Учитывая, что в наши дни средний американец ежегодно потребляет около 150 фунтов (68 кг) сахара и кукурузного сиропа, неудивительно, что проблемы резистентности к инсулину и дефицита хрома стали столь распространенными.
Если у вас лишний вес, весьма вероятно, что вы резистентны к инсулину. Ожирение является как причиной, так и последствием этого нарушения обмена веществ. Нарушения обмена инсулина и ожирение - равные факторы риска сердечных заболеваний.
Дефицит хрома тоже повышает вероятность развития болезней сердца.
Важнейшая биологическая роль микроэлемента хрома состоит в регуляции углеводного обмена и уровня глюкозы крови, поскольку хром является компонентом низкомолекулярного органического комплекса - "фактора толерантности к глюкозе" (Glucose Tolerance Factor, GTF). Он нормализует проницаемость клеточных мембран для глюкозы, процессы использования ее клетками и депонирования, и в этом плане функционирует совместно с инсулином. Предполагают, что они образуют комплекс, регулирующий уровень глюкозы в крови.
Хром увеличивает чувствительность клеточных рецепторов тканей к инсулину, облегчая их взаимодействие и уменьшая потребность организма в инсулине. Он способен усиливать действие инсулина во всех метаболических процессах, регулируемых этим гормоном. Поэтому хром необходим больным сахарным диабетом (прежде всего II типа), поскольку уровень его в крови у таких больных понижен. Более того, высокий дефицит этого микроэлемента может стать причиной диабетоподобного состояния. Уровень хрома снижается у женщин во время беременности и после рождения ребенка. Этим дефицитом хрома можно объяснить диабет у беременных, хотя эта причина едва ли единственная.
Дефицит хрома в организме, помимо повышения уровня глюкозы в крови, приводит к повышению триглицеридов и холестерина в плазме крови и в конечном итоге к атеросклерозу. Влияние хрома на липидный обмен также опосредуется его регулирующим действием на функционирование инсулина. В связи с изложенным, хром имеет большое значение для профилактики сахарного диабета и сердечно-сосудистых заболеваний.
Кроме того, в экспериментах на животных показано, что недостаток хрома приводит к задержке роста, вызывает нейропатии и нарушение высшей нервной деятельности, снижает оплодотворяющую способность сперматозоидов. Необходимо подчеркнуть, что злоупотребление сахаром увеличивает потребность в хроме и в тоже время его потерю с мочой.
Содержание хрома в продуктах Кораллового клуба.
БиошейпЭндуро-макс
ОЛЬГА БУТАКОВА. САХАРНЫЙ ДИАБЕТ.
()
corallinna.com
Очистка воды от хрома: несколько основных методов
Очистка воды от хрома – это одно из очень важных направлений водоподготовки. Специалисты по очистке воды имеют многолетний опыт, и их профессиональный подход позволяет производить на высоком уровне очистку воды углем от хрома, используя современные технологии, применяя различные методы водоочистки.
Важность этой процедуры неоспорима, и пренебрегать ею не стоит. Содержание хрома в воде, предназначенной для дальнейшего использования в производстве, строго регламентировано. Оно составляет 0.5 мг/л для трехвалентного хрома (Cr 3+) и 0.05 - 0.1 мг/л для шестивалентного хрома (Cr 6+). Очистка воды от этого элемента необходима потому, что избыток хрома в воде имеет пагубные последствия для здоровья человека, как и избыток соли. Поэтому очистка воды от солей - одно из основных направлений водоподготовки.
Хром – токсичный элемент периодической системы, он может вызывать дерматиты, быть причиной онкологических и некоторых других заболеваний. Пыль хрома раздражает легкие, нарушая их работу. Очистка воды от опасного вещества – это одно из основных мероприятий по водоочистке, и проводится наряду с удалением железа и марганца, очисткой воды от тяжелых металлов, хлора, аммиака, нитратов и прочих химических элементов.
Очистка воды от хрома обычно осуществляется способом электрокоагуляции. Данный способ очистки воды основан на электролизе раствора, который подвергается очистке, при котором через электролитический раствор проходят аноды из алюминия или железа. Этот же способ используется при очистке технической воды. Как и в процессе коагуляции, в ходе электрокоагуляции коллоидные и взвешенные вещества становятся крупными, и их можно отфильтровать. При этом происходят другие процессы.
Процедура очистки воды от хрома имеет следующий алгоритм. Вначале раствор подвергается электрофорезу. Затем при очистке воды от хрома производится катодное восстановление неорганических и органических веществ, являющихся примесями в очищаемой воде. Металлы катодов образуют осадок. Затем твердые эмульгированные частицы удаляют из воды методом флотации: катод выделяет водород, который в виде пузырьков заставляет твердые частицы подниматься вверх, на поверхность воды. Также возможна реагентная очистка сточных вод.
В завершение очистки воды от хрома производится сорбция молекул и ионов примесей на поверхности гидроксидами алюминия и железа, обладающими высокой сорбционной способностью.
Таким образом, электрокоагуляция, в отличие от фильтров механической очистки воды и коагуляции, позволяет производить очистку воды от хрома без обогащения ее хлоридами и сульфатами. Гальванокоагуляция – так называется еще одна разновидность метода очистки воды от хрома.
Оптимальным показателем pH для очистки воды от хрома равен 2,5-2,7. Хром из сточных вод извлекается в виде раствора серной кислоты. Очистка воды от хрома этим методом позволяет извлекать хром, содержащийся в воде в довольно высокой исходной концентрации: трехвалентный хром – 50-250 мг/л, а шестивалентный хром – до 200 мг/л.
Эта методика очистки воды от хрома отличается тем, что:
- при очистке воды от хрома в электрическом поле не возникает электростатической коагуляции;
- не используется ультрафильтрация, используется принципиально отличающийся метод введения ионов металлов.
При водоочистке от хрома применяют смесь железа, меди и кокса. В этом варианте образуется гальваническая пара, где железо является анодом, а смесь называется скрапом, то есть вторичным металлом или ломом. Через эту смесь в начале очистки воды от хрома пропускают воду с pH, равным 2-4. Из-за разности потенциалов железо, в двухвалентной форме, попадает в сток без наложения тока от внешнего источника. Двухвалентное железо, контактируя с кислородом воздуха, окисляется до трехвалентного. Двух и трехвалентное железо соединяются. Катодные реакции при очистке воды от хрома методом гальванокоагуляции выражаются в выделении пузырьков водорода и осаждении благородных металлов. Расход железа при очистке воды от хрома зависит от pH воды и колеблется в диапазоне от 200-1000 г. На 1 тонну воды приходится 1,5 кг железа.
Смотрите также:
www.bwt.ru
Очистка воды от хрома
Одно из важнейших направлений водоподготовки – это очистка воды от хрома.
Не следует пренебрегать важностью этой процедуры. Содержание хрома в воде строго регламентировано и составляет от 0.05 до 0.1 мг/л для Cr 6+ и до 0.5 мг/л для Cr 3+. Очистка воды от хрома необходима, в первую очередь, потому, что избыток этого вещества оказывает пагубное влияние на здоровье человека.
Хром токсичен, может вызывать дерматиты, онкологические и некоторые другие заболевания, хромовая пыль раздражает легкие и нарушает их работу. Поэтому очистка воды от хрома – это одно из главных мероприятий по водоочистке наряду с обезжелезиванием, деманганацией, очисткой воды от хлора, тяжелых металлов, аммиака, нитратов и проч.
Очистка как правило, осуществляется методом электрокоагуляции. Данный способ водоочистки основан на электролизе очищаемого раствора, при котором через электролитическое растворение проходят аноды алюминия или железа, и используется зачастую и при очистке технической воды.
Как и при коагуляции, в ходе электрокоагуляции происходит укрупнение коллоидных и взвешенных веществ, однако при этом осуществляются другие процессы. Алгоритм выглядит следующим образом. Прежде всего, раствор подвергается электрофорезу.
Кроме того, происходит катодное восстановление органических и неорганических веществ, которые находятся в воде в качестве примесей. Катодные металлы образуют осадок. Далее, происходит флотация твердых эмульгированных частиц: на катоде выделяется водород, и пузырьки этого газообразного вещества делают возможной флотацию. Так же наша компания занимается реагентной чисткой стоков.
В заключении процесса происходит сорбция ионов и молекул примесей на поверхности гидроксидов железа и алюминия, обладающих высокой сорбционной способностью.
Иначе говоря, при электрокоагуляции, в отличие от процесса коагуляции и механической очистки воды, вода не обогащается сульфатами и хлоридами. Разновидность метода, к которой прибегают, называется гальванокоагуляцией.Оптимальным pH для является 2.5-2.7, и из стоков это вещество извлекается в виде сернокислотного раствора. Очищение от хрома данным методом позволяет работать с высокими исходными концентрациями: для трехвалентного хрома – 50-250 мг/л, а для шестивалентного – до 200 мг/л.
Данный способ водоочистки отличается тем, что:
- наложение электрического поля электростатической коагуляции не возникает;- используется другой метод введения ионов металлов и не используется ультрафильтрация.
В ходе чистки используют смесь кокса, меди и железа. В этой гальванической паре железо является анодом, а сама смесь называется скрапом. Через скрап в начале очистки жидкости от хрома пропускают воду с pH 2-4, и, благодаря разности потенциалов, железо попадает в сток без наложения тока от внешнего источника в двухвалентной форме.
При контакте с кислородом воздуха двухвалентное железо окисляется до трехвалентного, и в очищаемом растворе образуются соединения двух- и трехвалентного железа. Катодные реакции в ходе очистки гальванокоагуляцией заключаются в выделении водорода и осаждении благородных металлов.
Расход железа при чистке зависит от показателя pH и варьируется в диапазоне от 200 г до 1 кг. При этом на тонну очищенной жидкости приходится порядка полутора килограммов железосодержащего отхода.
Гальванокоагуляция применяется не только для очистки жидкости от хрома, но и для удаления из раствора тяжелых металлов как при биологической очистке. Если необходима глубокая очистка, то гальванокоагуляцию подкрепляют обработкой жидкости известковым молоком. После применения электрокоагуляционного метода необходима многоэтапная последующая очищение от твердых частиц, которые плохо отстаиваются.
Рассчитайте стоимость системы
Наши инженеры оперативно подберут и рассчитают для вас подходящую систему водоочистки.
www.a-filter.ru
описание, свойства, формула и характеристика
Хром – химический элемент с атомным номером 24. Это твердый, блестящий, серо-стального цвета металл, который хорошо полируется и не тускнеет. Используется в сплавах, таких как нержавеющая сталь, и в качестве покрытия. Организму человека требуются небольшие количества трехвалентного хрома для метаболизма сахара, но Cr (VI) очень токсичен.
Различные соединения хрома, такие как окись хрома (III) и хромат свинца, ярко окрашены и используются в красках и пигментах. Красный цвет рубина обусловлен наличием этого химического элемента. Некоторые вещества, особенно бихромат калия и натрия, являются окислителями, используемыми для окисления органических соединений и (вместе с серной кислотой) для очистки лабораторной посуды. Кроме того, окись хрома (VI) применяется в производстве магнитной ленты.

Открытие и этимология
История открытия химического элемента хром такова. В 1761 году Иоганн Готлоб Леман нашел в Уральских горах оранжево-красный минерал и назвал его «сибирским красным свинцом». Хотя он ошибочно был идентифицирован как соединение свинца с селеном и железом, материал на самом деле являлся хроматом свинца с химической формулой PbCrO4. Сегодня он известен как минерал кроконт.
В 1770 году Петр Симон Паллас посетил то место, где Леман нашел красный свинцовый минерал, который имел очень полезные свойства пигмента в красках. Использование сибирского красного свинца в качестве краски получило быстрое развитие. Кроме того, ярко-желтый цвет из кроконта стал модным.
В 1797 году Николя-Луи Воклен получил образцы красной свинцовой руды. Путем смешивания кроконта с соляной кислотой он получил оксид CrO3. Хром как химический элемент был выделен в 1798 году. Воклен получил его при нагревании окисла с древесным углем. Он также смог обнаружить следы хрома в драгоценных камнях, таких как рубин и изумруд.
В 1800-х годах Cr в основном применялся в составе красок и кожевенных солей. Сегодня 85% металла используется в сплавах. Остальная часть применяется в химической промышленности, производстве огнеупорных материалов и литейной промышленности.
Произношение химического элемента хром соответствует греческому χρῶμα, что означает «цвет», из-за множества цветных соединений, которые из него можно получить.

Добыча и производство
Элемент производят из хромита (FeCr2O4). Примерно половина этой руды в мире добывается в Южной Африке. Кроме того, Казахстан, Индия и Турция являются его крупными производителями. Разведанных месторождений хромита достаточно, но географически они сконцентрированы в Казахстане и на юге Африки.
Залежи самородного металлического хрома встречаются редко, но они есть. Например, его добывают на шахте «Удачная» в России. Она является кимберлитовой трубкой, богатой алмазами, и восстановительная среда помогла образоваться чистому хрому и алмазам.
Для промышленного производства металла хромитовые руды обрабатывают расплавленной щелочью (едким натром, NaOH). При этом образуется хромат натрия (Na2CrO4), который восстанавливается углеродом до оксида Сг2O3. Металл получают при нагревании окисла в присутствии алюминия или кремния.
В 2000 году было добыто около 15 млн т хромитовой руды, которая была переработана в 4 млн т феррохрома, на 70% состоящего из сплава хрома с железом, приблизительная рыночная стоимость которых составила 2,5 млрд долларов США.

Основные характеристики
Характеристика химического элемента хрома обусловлена тем, что он является переходным металлом четвертого периода таблицы Менделеева и расположен между ванадием и марганцем. Входит в VI группу. Плавится при температуре 1907 °С. В присутствии кислорода хром быстро образует тонкий слой оксида, который защищает металл от дальнейшего взаимодействия с кислородом.
Как переходный элемент, он реагирует с веществами в различных соотношениях. Таким образом он образует соединения, в которых имеет различные степени окисления. Хром – химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Какого цвета хром? Химический элемент придает анодированному алюминию рубиновый оттенок. Сг2O3, используемый для полировки металла, также применяется в качестве пигмента под названием «хромовая зелень». Его соли окрашивают стекло в изумрудно-зеленый цвет. Хром – химический элемент, присутствие которого делает рубин красным. Поэтому он используется в производстве синтетических рубинов.

Изотопы
Изотопы хрома обладают атомным весом от 43 до 67. Обычно данный химический элемент состоит из трех стабильных форм: 52Cr, 53Cr и 54Cr. Из них наиболее распространен 52Cr (83,8% всего природного хрома). Кроме того, описаны 19 радиоизотопов, из которых наиболее стабильным является 50Cr с периодом полураспада, превышающим 1,8x1017 лет. У 51Cr период полураспада – 27,7 дней, а у всех остальных радиоактивных изотопов он не превышает 24 ч, причем у большинства из них он длится менее одной минуты. Элемент также имеет два метасостояния.
Изотопы хрома в земной коре, как правило, сопутствуют изотопам марганца, что находит применение в геологии. 53Cr образуется при радиоактивном распаде 53Mn. Соотношение изотопов Mn/Cr подкрепляет другие сведения о ранней истории Солнечной системы. Изменения в соотношениях 53Cr/52Cr и Mn/Cr из разных метеоритов доказывает то, что новых атомные ядра были созданы непосредственно перед формированием Солнечной системы.

Химический элемент хром: свойства, формула соединений
Оксид хрома (III) Сг2O3, также известный как полуторная окись, является одним из четырех окислов этого химического элемента. Его получают из хромита. Соединение зеленого цвета обычно называют «хромовой зеленью», когда используют в качестве пигмента для живописи по эмали и стеклу. Оксид может растворяться в кислотах, образуя соли, а в расплавленной щелочи – хромиты.
Бихромат калия
K2Cr2O7 является мощным окислителем и ему отдается предпочтение в качестве средства для очистки лабораторной посуды от органики. Для этого используется его насыщенный раствор в концентрированной серной кислоте. Иногда, однако, его заменяют бихроматом натрия, исходя из более высокой растворимости последнего. Кроме того, он может регулировать процесс окисления органических соединений, преобразуя первичный спирт в альдегид, а затем в углекислоту.
Бихромат калия способен вызвать хромовый дерматит. Хром, вероятно, является причиной сенсибилизации, ведущей к развитию дерматита, особенно рук и предплечий, который носит хронический характер и трудно излечим. Как и другие соединения Cr (VI), бихромат калия канцерогенен. С ним нужно обращаться в перчатках и соответствующими средствами защиты.

Хромовая кислота
Соединение обладает гипотетической структурой h3CrO4. Ни хромовая, ни дихромовая кислоты не встречаются в природе, но их анионы находят в различных веществах. «Хромовая кислота», которую можно встретить в продаже, на самом деле является ее кислотным ангидридом – триоксидом CrO3.
Хромат свинца (II)
PbCrO4 обладает ярко-желтой окраской и практически не растворим в воде. По этой причине он нашел применение в качестве красящего пигмента под названием «желтый крон».
Cr и пятивалентная связь
Хром отличается своей способностью образовывать пятивалентные связи. Соединение создается Cr (I) и углеводородным радикалом. Пятивалентная связь формируется между двумя атомами хрома. Его формула может быть записана как Ar–Cr–Cr–Ar, где Ar представляет собой специфическую ароматическую группу.

Применение
Хром – химический элемент, свойства которого обеспечили ему множество различных вариантов применения, некоторые из которых приведены ниже.
Металлам он придает устойчивость к коррозии и глянцевую поверхность. Поэтому хром входит в состав таких сплавов, как нержавеющая сталь, используемых, например, в столовых приборах. Он также применяется для нанесения хромированного покрытия.
Хром является катализатором различных реакций. Из него делают формы для обжига кирпича. Его солями дубят кожу. Бихромат калия применяют для окисления органических соединений, таких как спирты и альдегиды, а также для очистки лабораторной посуды. Он служит фиксирующим агентом для окрашивания ткани, а также используется в фотографии и фотопечати.
CrO3 применяется для изготовления магнитных лент (например, для аудиозаписи), которые обладают лучшими характеристиками, чем пленки с оксидом железа.
Роль в биологии
Трехвалентный хром – химический элемент, необходимый для метаболизма сахара в организме человека. Напротив, шестивалентный Cr очень токсичен.
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента – около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
Свойства элемента
Основные физические свойства хрома следующие:
- Атомное число: 24.
- Атомный вес: 51,996.
- Температура плавления: 1890 °C.
- Температура кипения: 2482 °C.
- Степень окисления: +2, +3, +6.
- Конфигурация электронов: [Ar]3d54s1.
fb.ru


















