Справочник химика 21. Вода этилен
Этилен - это... Что такое Этилен?
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2h5.
Является простейшим алкеном (олефином), изологом этана. При нормальных условиях — бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире[1]; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год[2]. Этилен обладает наркотическим действием. Класс опасности — четвёртый[3].Применение
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 80-х годов ХХ века в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений[4], среди прочего[5] отвечает за опадание иголок у хвойных.
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три сигма-связи с углеродом и двумя атомами водорода. Р-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости -связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Ch3=Ch3Основные химические свойства
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
- Галогенирование:
- Гидрирование:
- Гидрогалогенирование:
Примечания
 |
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 15 мая 2011. |
dic.academic.ru
Вода — этан — этилен
Целесообразность выбора рабочего вещества определяется его термодинамическими свойствами, а также экономическими и эксплуатационными показателями установки в целом. При выборе учитывают возможность использования технологических продуктов в качестве хладагентов. Наиболее распространены такие рабочие вещества, как аммиак, R12, R22, пропан, пропилен, этан, этилен и др. В качестве промежуточных хладоносителей используют воду, водные растворы хлористого натрия, хлористого кальция, кальциевой селитры, этиленгликоль, R30, R11. Около 20% искусственного холода в химической промышленности затрачивается на охлаждение воды. [c.259] Механизм термоокислительной деструкции поликарбоната. Для инициирования реакций деструкции поликарбоната на основе дифенилолпропана в отсутствие влаги требуется затрата значительной энергии на разрыв эфирных связей. Поэтому достаточно быстрая термическая деструкция этого полимера происходит при более высоких температурах (400—500°С), чем деструкция полиэтилентерефталата и других полиэфиров. При окислении поликарбоната в указанном температурном интервале обнаруживают [107, 112— 116] в основном те же продукты, что и прн термической деструкцип воду, окись углерода, двуокись углерода, водород, формальдегид, метан, этан, этилен, фенол, крезол, этилфенол, изопропепилфенол, дифенил-карбонат, дифенилолиропан, а также ацетон, бензол, толуол, этилбензол. При термоокислении начальные скорости образования и выход продуктов, как правило, существенно больще, чем при пиролизе. [c.91]Вода — этан — этилен [c.97]
Такие системы с водой образуют этан, этилен, ацетилен, пропан, пропилен, изобутан, диоксид углерода, сероводород, хлор, хлороформ, бром, криптон и некоторые другие вещества. [c.13]
Одним из клатратных соединений является газированный лед. Опыт показывает, что при охлаждении воды, насыщенный каким-либо газом под давлением, образуется лед, содержащий в своей кристаллической решетке молекулы газа. При этом молекулы Н2О посредством водородных связей образуют многогранники, полости внутри которых достаточно велики, чтобы молекула газа могла в них находиться почти свободно. Выйти из многогранника или войти в уже образовавшийся газо-гидрат молекула не может (рис, 5.21). Поэтому, несмотря на летучесть газов, эти соединения являются относительно устойчивыми. Молекулами-гостьями в гидратах могут быть углекислый газ, аргон, криптон, ксенон, метан, этан, этилен, пропан, циклопропан и др. Гидраты экономичны в смысле хранения газа. В 1 м газового гидрата около 200 м метана. Добыть газ из гидрата очень легко нагреванием. Существует предположение, что большие запасы природного газа хранятся в недрах Земли в форме газогидратов. [c.149]Все летучие полярные нитрилы нитросоединения, спирты альдегиды, этан, этилен, сернистые газы, СО2 в воздухе, ppm воды в газах [c.286]
Этан — этиленовая фракция состоит из двух компонентов этана и этилена. Этилен определяют поглощением в бромной воде этан определяют по разности. В точном анализе этилен определяют поглощением в кислом растворе сульфата ртути. [c.173]
Цеолит NaA адсорбирует компоненты промышленных газов, критический размер молекул которых не превышает 0,4 нм это — вода, сероводород, сероуглерод, оксид и диоксид углерода, аммиак,. метан, этан, этилен, метанол. Он не сорбирует пропан и органические соединения с числом атомов углерода более 3. [c.123]
При каталитическом крекинге потери водорода, ведущие к снижению выхода ценных продуктов — бензина и газойля, вызываются образованием легких газов (пропан, этан, этилен, метан, молекулярный водород) и воды (в результате сгорания в регенераторе). Водород может поступать из реактора в регенератор частично с углеводородами, прочно адсорбированными на катализаторе (кокс), или в виде жидких продуктов, механически увлекаемых или обратимо адсорбированных на катализаторе. Эффектив- [c.41]
С какими из перечисленных ниже веществ вода будет вступать во взаимодействие Вещества сера, литий, цезий, магний, кислород, хлор, азот, железо, оксид углерода (П углекислый газ, оксид меди (II), оксид кальция, оксид серы (IV), соляная кислота, серная кислота, гидроксид кальция, карбонат кальция, этан, этилен, этиловый эфир уксусной кислоты. Запишите уравнения реакций, укажите условия их протекания. [c.87]
Из решеточных клатратных соединений включения можно указать аддукты гидрохинона (см. том П) с SOg, С0-2, Оа, НС1, НВг, H.jS, с метанолом, ацетиленом и др. К типу клатратных соединений относятся также твердые гидраты таких газообразных веществ, как метан, этан, этилен, метилеихлорид, и некоторых простых соединений (например, хлороформа). В этих гидратах каркасную решетку образует вода, к которой включаемые вещества как раз не имеют никакого сродства. [c.845]
В результате реакции триэтилалюминия с четыреххлористым титаном в насыщенном растворе нелетучего углеводорода образуется смесь газов, содержащая этан, этилен, бутилен и водород. Черный осадок, образующийся одновременно, может быть разложен водой при этом выделяются газообразные продукты — водород, этан и к-бутан. [c.104]
В [111] рассмотрены различные модификации установок такого типа, включающие большее число каскадов, а также каскадных циклов с различными комбинациями хладагентов, например пропан—этан—метан или вода—аммиак— этилен— метан и др. [c.360]
Цеолит марки ЫаА, адсорбирует молекулы с критическими размерами меньше 4А. К таким веществам относятся вода, углекислый газ, сероводород, аммиак, этан, этилен, пропилен, низшие ацетиленовые углеводороды нормального строения. При более низких температурах в существенных количествах адсорбируются инертные газы (неон, аргон, криптон и ксенон), кислород азот, окись углерода и метан. Цеолит КаА не адсорбирует высшие нормальные парафины, начиная с пропана, парафины ызо-строения и бутены-2, высшие спирты и все соединения циклического строения. [c.428]
Существуют каскадные циклы, в которых в качестве хладоагентов используется смесь аммиак—этилен—метан (природный газ), а также циклы сжижения, включающие до семи каскадов — холодильных циклов на пропане, этане и метане. Можно использовать и такие комбинации хладоагентов, как вода—аммиак—этилен — метан или вода—пропан—этилен—метан—азот [61]. [c.36]
В процессе горячего отверждения эпоксидных покрытий при 180—220 °С протекает термоокислительная деструкция, которая сопровождается выделением вредных веществ. Так, термоокислительная деструкция эпоксидной смолы, отвержденной 30% малеинового ангидрида, начинается при 200 °С [264, 265]. При повыщении температуры (250 °С и выше) деструкция усиливается и характеризуется значительным газовыделением и образованием жидких и твердых продуктов деструкции. Среди газообразных продуктов деструкции обнаружены водород, окись углерода, метан, этан, этилен, пропан, пропилен, альдегиды, вода, а также эпихлоргидрин, дифенилолпропан, полиэтиленполиамин, л -фенилендиамин и гексаметилендиамин. По содержанию последних контролируется воздушная среда производственных и жилых помещений. [c.236]
Толуилендиизоцианат, пропилен, формальдегид, пропионовый альдегид, вода, двуокись углерода Толуилендиизоцианат, метан, этан, этилен, пропилен, пропиловый спирт, формальдегид, пропионовый альдегид, вода, двуокись углерода Толуилендиизоцианат, метан, этан, этилен, пропилен, метиловый и пропиловый спирты, формальдегид, пропионовый альдегид, окись углерода, двуокись углерода Толуилендиизоцианат, метан, этан, этилен, пропилен, а-бутилен, бутадиен-1,3, ацетилен, бензол, л-ксилол, стирол, бензонитрил, метиловый и пропиловый спирты, диэтиловый эфир, ацетон, формальдегид, пропионовый альдегид, окись углерода, двуокись углерода Этиловый и бутиловый спирты, окись углерода Толуилендиизоцианат, цианистый водород, окись углерода Цианистый водород [c.254]
При гомогенном окислении толуола в статических условиях добавки бромистого водорода увеличивают скорость превраще- ния исходного углеводорода [37]. В ходе реакции наряду с бензойной кислотой образуются продукты бромирования в ядро и боковую цепь (бензилбромид, моно- и дибромфенолы), а также продукты деалкилирования (фенол, бензол), крекинга (этан, этилен) и глубокого окисления (вода, окислы углерода). Выход их приведен в табл. 1. [c.17]
Среди продуктов присутствовали также метан, этан, этилен, пропан, пропилен, -бутилен, н-бутан, изоамилены, СО и СО2. Введение кислорода и паров воды в контактную зону существенно изменило селективность процесса выход бутадиена-1,3 и винил-циклогексена уменьшился с 35—43 до 0,5—4%, выход стирола возрос с 2 до 44%. [c.96]
Смесь свежего и рециркулирующего углеводорода с кислородом или воздухом подогревают до 350—370 °С и направляют в реакционный аппарат, не имеющий охлаждающих устройств. За счет выделяющегося при окислении тепла газы нагреваются до 430—450 °С и поступают в абсорбер, орошаемый водой, где их температура быстро. снижается до 70—90 °С. Одновременно из газа извлекаются формальдегид и малолетучие продукты (карбоновые кислоты и др.). В следующем абсорбере газ промывают избытком холодной воды и извлекают более летучие вещества (метанол, ацетальдегид, кетоны, ацетали). Остаточный газ содержит непревращенный парафин, СО, СО2, N2 и низшие углеводороды (метан, этан, этилен), образовавшиеся в результате крекинга. Иногда этот газ используют как топливо, но выгоднее осуществлять его рециркуляцию. В случае рециркуляции основное количество газа снова подают на реакцию, а оставшуюся часть очищают от примесей путем абсорбции углеводородов Сз—С4 маслом или их сжижением под давлением. Очищенный газ возвращают на реакцию, чем предотвращается чрезмерное накопление примесей в рециркулирующем газе. [c.447]
При прохождении скрубберов абсорбент поглощает из газа почти весь бутадиен и другие вещества, растворимые в спирте. В отходящем газе после скрубберов остаются водород, окислы углерода, предельные углеводороды (метан и этан), этилен, пропилен, воздух, некоторые количества спирта и бутадиена. После промывки водой с целью удаления спирта газ используют для топливных целей. [c.56]
Процесс проводят при 375—440° С. При этом основная реакция сопровождается рядом побочных. В результате наряду с дивинилом образуются и другие продукты. В газовой смеси на выходе из реактора содержится свыще 30 веществ в соизмеримых количествах. Теоретический выход бутадиена-1,3 из 100%-ного спирта составляет 58,7% (воды 39,1% и водорода 2,2%).. В качестве побочных продуктов при контактном разложении этилового спирта получаются водород, окись углерода, метан, этан, этилен, псевдобутилен, высшие олефины, толуол, ксилол, диэтиловый эфир и т. п., а также спирты, альдегиды, кетоны и углерод в виде сажи, отлагающейся в значительном количестве на катализаторе. При отщеплении воды и водорода в присутствии дегидратирующей и дегидрирующей частей катализатора соответственно получаются этилен и уксусный альдегид. Именно уксусный альдегид является основный промежуточным продуктом, из которого затем получается бутадиен-1,3. Действие катализатора в этом процессе заключается в селективном разложении этанола с образованием целевых конечных продуктов бутадиена, воды и водорода. В отсутствие катализатора при 450—500° С одновременно (и примерно с одинаковой скоростью) протекают реакции дегидрирования спирта с образованием уксусного альдегида [c.162]
Кроме того, в продуктах реакции содержатся в небольших ко- личествах метан, этан, этилен, азот, кислород, водород, окись и двуокись углерода, пары воды, углерод (сажа) и др. Количество этих примесей незначительно и зависит главным образом от чистоты [c.46]
Уже более столетия химикам известны комплексы воды с такими простыми молекулами, как молекулы хлора. Еще Деви обратил внимание на образование комплексов хлор- вода. Однако только в самое последнее время появился ряд работ (см., например, [10] — [12]), прояснивших вопрос о природе этих соединений, которые в настоящее время известны под названием газовые гидраты . К веществам, образующим эти последние, относятся аргон, криптон, ксенон, уже упоминавшийся хлор, закись азота, углекислый газ, метан, этан, этилен и целый ряд других. Оказалось, что эти образования относятся к обширному классу соединений, объединяемых под общим названием клатратные соединения включения или просто клатраты. [c.203]
Рис 89. Раиновесие жидкость — пар в системе вода—этан—этилен при 37,8 °С. Рис. 90. Равновесие жидкость—пар в системе вода—этан—этилен при 71,1 °С. [c.98]
При воздействии разрядов на масла различного происхождения независимо от газовой атмосферы (водород, азот, воздух) основным образующимся газом является водород [5.24]. Кроме того, в атмосфере водорода образуется метан, этан, этилен, ацетилен, пропан, пропилен и другие углеводородные газы [5.25]. В среде азота помимо этих газов возможно присутствие аминов [5.21] и аммиака [5.23]. Состав соединений, содержащих азот в газовой и жидкой фазах, изучен слабо. В атмосфере кислброда кроме водорода и углеводородных газов могут присутствовать летучие продукты окисления (пары воды, низкомолекулярные перекиси, альдегиды, спирты, кислоты, СОг, СО) и озон. [c.142]
Если не принять меры к удалению из отходящих газов моноокиси углерода и водорода (обычно это проделывают с помощью окиси меди), так же как и двуокиси углерода и воды, растворение кислорода после продолжительного окисления уменьшается настолько сильно, что это может вызвать ошибку при определении момента автозамедления. Посторонними газами, образующимися при окислении, являются метан, этан, этилен и пропилен. [c.82]
Уравнения для теплоотдачи при пленочном кипении, приведенные в этом ра.чделе, описывают совокупность экспериментальных данных, охватывающих различные жидкости, а именпо азот, кислород, вода, метан, этан, этилен, смеси этилена, пропан, п-бутан, метанол, этиловый спирт, бензол, четыреххлористый углерод, со средним стандартным отклонением 30—40%. Более полную информацию по этому вопросу можно найти в [43]. [c.378]
Компенсирующее изменение энтальпии отрицательно и зависит от возможности дисперсионных взаимодействий хозяина и гостя . Энтальпии образования клатратов гидрохинона с аргоном, криптоном, кислородом, азотом, метаном составляют 25,1 26,4 23,0 24,3 30,2 кДж/моль гостя соответственно . Молекулы гости не остаются неподвижными в своих клетках ( lathros — по-гречески клетка) исследования клатратов двухатомных молекул в гидрохиноне привели к заключению, что молекулы НС1, О2, НВг вращаются, а также совершают броуновские колебания в клетках. Несомненно, что в клатратах, содержащих молекулы гостей различных типов (например, молекулы азота и кислорода в гидрохиноне), существует слабое взаимодействие между гостями . Многочисленные клатраты образует вода (клатратные гидраты), причем и в этом случае решетка, типичная для клатратов, отличается от решетки льда. В клатратах гостями заполняются большие и малые полости. Крупные молекулы (этан, этилен, хлороформ) помещаются только в больших полостях, молекулы меньших размеров (метан, аргон) входят в малые и большие полости. Доказано вращательное движение молекул метильной группы ацетона, молекул окиси этилена, гексафторида серы и других в кла-тратных гидратах, где движутся не только молекулы — гости , но и (медленнее) молекулы хозяина , т. е. воды. [c.271]
В продуктах радиолиза этиленгликоля в зависимости от условий его проведения найдены альдегиды (муравьиный, уксусный, гликолевый, янтарный, глиоксаль), кислоты (уксусная, щавелевая, гликолевая, глиоксалевая), спирты (метиловый, этиловый, эритрит) и другие кислородсодержащие соединения (ацеталь, этилацетат, метилдиоксолан), а также газообразные продукты (водород, кислород, окись углерода, метан, этан, этилен). Кроме того, образуется и вода. [c.28]
Ловушка, охлаждаемая жидким азотом, эффективно удаляет пары воды, углекислый газ и относительно более тяжелые пары органических веществ. Однако такие газы, как этан, этилен, метан и окись углерода, имеют при темпе-затуре жидкого азота заметное давление пара и улавливаются не полностью. 1ри снижении давления над жидким азотом можно получить еще более низкие температуры, как это показано в табл. 23. [c.491]
Линии I — вода II — хлор 111—этан IV — этан (рециркуляция) V— винилхло-рид VI — этан, винилхлорид VII — хлорэтан, дихлорэтан VIII — хлорированные продукты IX — дихлорэтан X — хлористый этил XI — хлор XII — этан, этилен и хлорированные продукты XIII — трихлорэтан. [c.19]
Вода, метан, окись и двуокись углерода, этан, этилен Бутадиен, бутены, цик-лоиентадвены, гексадиены, пропилен, циклогексадиены Изобутилен, димер, тример и тетрамер [c.239]
Молекулы воды могут ориентироваться около молекулы метана так, что получается непрочный гидрат этого газа. Грозди молекул воды около молекулы метана получили название айсбергов — состояние воды в них имеет сходство с состоянием воды в кристаллах льда. Образование айсбергов наблюдалось и в других случаях с более сложными молекулами. Различные газы этан, этилен, хлор, двуокись серы и даже инертные газы (аргон, криптон) — образуют с водой гидраты, причем количество теплоты, выделяющееся при этом в расчете на моль газа, почти не зависит от его химической природы. Это выглядит несколько странно — казалось бы, если речь идет о химическом процессе, его энергетический эффект должен прежде всего зависеть от химической характеристики соединяющихся молекул. Фактически на моль газа выделяется во всех указанных случаях около 15 ккал/моль. Загадка разгадывается неожиданно просто. Молекулы газов попадают в пустоты, имеющиеся между молекулами воды молекулы, застрявшие в этих пустотах, стабилизируют окружающие группы молекул воды. В сущности, именно молекулы газов и сохраняют эти тонкие и хрупкие сетки, сплетенные из частиц воды. Предполагают, что в гидратах молекулы воды расположены по углам пятиугольников, а из пятиугольников строятся сложные многогранники (полиэдры), пустоты в которых и заполнены молекулами газов. Если удалить газы, то устойчивость всего каркаса уменьшается и он подвергается частичному или полному распаду и перестройке. Некоторые авторы (И. Клотц) считают, что, окружая углеводородные группы, входящие в состав белков, вода стабилизирует молекулы белка и, следовательно, те формы, в которых белковые молекулы находятся и функционируют в организмах, в значительной степени связаны с влиянием молекул воды. [c.38]
chem21.info
Вода — метан — этилен и вода — метан — пропилен — этилен
Этилен образуется из элементов (водорода и углерода) при атмосферном давлении и при очень высоких температурах (около 2000° С) 1141]. Кроме того, в большем или меньшем количестве он образуется наряду с другими углеводородами, главным образом метаном, этаном и пропиленом, нри всех высокотемпературных процессах расщепления насыщенных и ненасыщенных углеводородов и других органических соединений. По этой причине этилен всегда содержится в светильном газе [142], генераторном водяном газе и в других газообразных продуктах высокотемпературных процессов. Такие газовые смеси обычно не применяются для получения этилена из-за невысокого содержания в них этого углеводорода. Зато значи-гельным источником этилена являются газы, выделяющиеся при высокотемпературной переработке нефти и некоторых продуктов нефтяной промышленности. Особенно при газофазном крекинге (так называемый гиро-процесс ) [143], при котором пары нефти в смеси с парами воды пропускаются через контактную массу (в частности, через окись железа) при температуре 550—600°, в результате чего получается смесь газообразных углеводородов с содержанием этилена до 27% [144, 145]. Этилен образуется также в большом количестве при пиролизе природного газа. Па выход этилена большое влияние оказывают условия реакции. Реакционная смесь, получаемая путем пиролиза природного газа при 880°, содержит около 30% этилена [146]. [c.38] Толуилендиизоцианат, пропилен, формальдегид, пропионовый альдегид, вода, двуокись углерода Толуилендиизоцианат, метан, этан, этилен, пропилен, пропиловый спирт, формальдегид, пропионовый альдегид, вода, двуокись углерода Толуилендиизоцианат, метан, этан, этилен, пропилен, метиловый и пропиловый спирты, формальдегид, пропионовый альдегид, окись углерода, двуокись углерода Толуилендиизоцианат, метан, этан, этилен, пропилен, а-бутилен, бутадиен-1,3, ацетилен, бензол, л-ксилол, стирол, бензонитрил, метиловый и пропиловый спирты, диэтиловый эфир, ацетон, формальдегид, пропионовый альдегид, окись углерода, двуокись углерода Этиловый и бутиловый спирты, окись углерода Толуилендиизоцианат, цианистый водород, окись углерода Цианистый водород [c.254]В тройной системе, содержаш,ей воду, метан и этилен, и в четырехкомпонентной системе, включаюш,ей, кроме того, пропилен, были изучены условия образования гидрата. Из рис. 87 видно, при каких [c.96]
NaA -4 11,4 Вода, углекислый газ, сероводород, аммиак, метанол, этилен, пропилен, этан, метан Изобутан и другие изопарафины, изо-спирты, бензол и другие ароматические углеводороды вещества с размерами молекул больще 5 А [c.91]
КА 0,3 1,14 Вода, аммиак NaA 0,4 1,14 Вода, диоксид углерода, сероводород, аммиак, метанол, этилен, пропилен, этан, метан [c.124]
В качестве основного продукта образуется а-метилстирол, среди побочных продуктов найдены стирол, бензол, пропилен, метан, двуокись углерода и сухой остаток. Толуол и этилбензол в продуктах реакции не обнаружены. При длительном времени контакта и меньшем разбавлении парами воды изопропилбензола в продуктах реакции обнаруживается этилен. [c.245]
Цеолит марки ЫаА, адсорбирует молекулы с критическими размерами меньше 4А. К таким веществам относятся вода, углекислый газ, сероводород, аммиак, этан, этилен, пропилен, низшие ацетиленовые углеводороды нормального строения. При более низких температурах в существенных количествах адсорбируются инертные газы (неон, аргон, криптон и ксенон), кислород азот, окись углерода и метан. Цеолит КаА не адсорбирует высшие нормальные парафины, начиная с пропана, парафины ызо-строения и бутены-2, высшие спирты и все соединения циклического строения. [c.428]
В процессе горячего отверждения эпоксидных покрытий при 180—220 °С протекает термоокислительная деструкция, которая сопровождается выделением вредных веществ. Так, термоокислительная деструкция эпоксидной смолы, отвержденной 30% малеинового ангидрида, начинается при 200 °С [264, 265]. При повыщении температуры (250 °С и выше) деструкция усиливается и характеризуется значительным газовыделением и образованием жидких и твердых продуктов деструкции. Среди газообразных продуктов деструкции обнаружены водород, окись углерода, метан, этан, этилен, пропан, пропилен, альдегиды, вода, а также эпихлоргидрин, дифенилолпропан, полиэтиленполиамин, л -фенилендиамин и гексаметилендиамин. По содержанию последних контролируется воздушная среда производственных и жилых помещений. [c.236]
Среди продуктов присутствовали также метан, этан, этилен, пропан, пропилен, -бутилен, н-бутан, изоамилены, СО и СО2. Введение кислорода и паров воды в контактную зону существенно изменило селективность процесса выход бутадиена-1,3 и винил-циклогексена уменьшился с 35—43 до 0,5—4%, выход стирола возрос с 2 до 44%. [c.96]
В случае одной окиси магния при 400° и объемной скорости 60—65 значительное количество окиси этилена изомеризуется в ацетальдегид, кроме которого в конденсате было найдено до 20% ацеталя этиленгликоля. Однако наряду с изомеризацией и димеризацией окиси наблюдается ее распад с образованием воды и жидких углеводородов. В газах были обнаружены окись углерода, углекислый газ, кислород, водород, метан, формальдегид, этилен, пропилен и бутилены. Присутствие в газах пропилена указывает на радикальный механизм распада окиси этилена. [c.1675]
И, ВОЗМОЖНО, низкомолекулярные ГП (метила, этила и др.). Об этом свидетельствует сложный состав низкомолекулярных продуктов окисления полимера и распада ГП. Среди них обнаружены вода ацетон, ацетальдегид формальдегид метан этан, пропан, пропилен, этилен и др. Скорости образования этих продуктов пропорциональны концентрации гидроперекиси, т. е. все они образуются из гидроперекиси. [c.184]
Этиловый спирт поглощает из газа бутадиен и другие вещества, растворимые в спирте. В газе, выходящем из скруббера, остаются водород, кислород, метан, этан, этилен, пропилен, незначительное количество спирта и следы бутадиена. После отмывки спирта водой неабсорбированный газ (абгаз) направляется на сжигание в цех контактирования. [c.22]
Природные газы однородны по составу и содержат в основном метан попутные газы нефтяных месторождений содержат еще этан, пропан и бутан сжиженные газы —смесь пропана и бутана, а газы, получаемые на нефтеперерабатывающих заводах при термической переработке нефти, содержат кроме пропана и бутана еще этилен, пропилен и бутилен. Кроме горючих компонентов в природных газах содержатся в небольших количествах сероводород, кислород, азот, диоксид углерода, пары воды и механические примеси. [c.14]
Выходящие из сепаратора пары и газы поступают в колонну, в верху которой поддерживают температуру около ЮО С. В этой колонне разделяются жидкие продукты, конденсирующиеся в пределах 300—100°С высококипящие фракции, отбираемые с низа колонны, смешиваются с циркулирующим закалочным маслом. Тепло газа используется в котле-утилизаторе. Фракция с высоким содержанием нафталина выводится с тарелки посредине высоты колонны. Низкокипящие фракции отбирают с верха колонны вместе с газом и конденсируют в конденсаторе вместе с псевдоожи-жающим водяным паром. Легкая фракция, состоящая главным образом из легких ароматических углеводородов, отделяется от воды в сепараторе и возвращается в верх ректификационной колонны избыток ее отбирается в виде побочного продукта процесса. Ие-сконденсировавшийся газ направляется на газоразделительную установку, где при низкой температуре выделяются основные продукты пиролиза этилен, пропилен и фракция С4 с высоким содержанием бутадиена и побочные продукты водород, окись углерода и метан, идущие на производство синтез-газа. [c.223]
Этилен и пропилен для производства полимеров и сополиме ров должны быть исключительно чистыми, так как примеси (водород, окись углерода, метан, углеводороды С —С5, кислород, ацетилен и вода) ухудшают свойства полимеров и сополимеров. [c.168]
Метиловый спирт, формальдегид, муравьиная кислота, вода, окись углерода, двуокись углерода Метан, этан, бутан, этилен, пропилен, бутиловый спирт Водород, метан, этан, следы этилена [c.252]
При воздействии разрядов на масла различного происхождения независимо от газовой атмосферы (водород, азот, воздух) основным образующимся газом является водород [5.24]. Кроме того, в атмосфере водорода образуется метан, этан, этилен, ацетилен, пропан, пропилен и другие углеводородные газы [5.25]. В среде азота помимо этих газов возможно присутствие аминов [5.21] и аммиака [5.23]. Состав соединений, содержащих азот в газовой и жидкой фазах, изучен слабо. В атмосфере кислброда кроме водорода и углеводородных газов могут присутствовать летучие продукты окисления (пары воды, низкомолекулярные перекиси, альдегиды, спирты, кислоты, СОг, СО) и озон. [c.142]
Эпихлоргидрин, толуол Метан, этан, пропан, этилен, пропилен, вода, окись углерода, двуокись углерода Хлорорганические и эпоксисоединения (в том числе эпихлоргидрин) Эпихлоргидрин, анилин Эпихлоргидрин, диэтиленгликоль Фурфурол, ацетон, эпихлоргидрин [c.254]
Охлаждение сжатой газовой смеси осуществляется различными хладоагентами водой (до +5 °С), холодильным рассолом, получаемым на аммиачной холодильной установке (до —15 °С), кипящим в вакууме жидким аммиаком, получаемым на той же установке (до —50 °С), кипящими пропаном или пропиленом (до —40 °С), этаном (до —80 °С), этиленом (до —100 °С), метаном (от —120 до —150 °С), Охлаждение сжатых газов может привести (из-за уменьшения парциального давления с понижением температуры) к конденсации одного или нескольких компонентов или же к конденсации всей смеси газов. [c.34]
При прохождении скрубберов абсорбент поглощает из газа почти весь бутадиен и другие вещества, растворимые в спирте. В отходящем газе после скрубберов остаются водород, окислы углерода, предельные углеводороды (метан и этан), этилен, пропилен, воздух, некоторые количества спирта и бутадиена. После промывки водой с целью удаления спирта газ используют для топливных целей. [c.56]
I — сырье (бензин) II — вода III — водяной пар IV — жидкое топливо V — ка утили-газ IX — метан X — этан XI — этилен XII — пропан А ///— пропилен — бензин [c.86]
Если не принять меры к удалению из отходящих газов моноокиси углерода и водорода (обычно это проделывают с помощью окиси меди), так же как и двуокиси углерода и воды, растворение кислорода после продолжительного окисления уменьшается настолько сильно, что это может вызвать ошибку при определении момента автозамедления. Посторонними газами, образующимися при окислении, являются метан, этан, этилен и пропилен. [c.82]
Из схемы следует, что кроме а-метилстирола при протекании побочных реакций из кумола образуются бензол, толуол, стирол, метан, этилен, пропилен. Побочные продукты снижают селективность процесса. При высоких температурах (530-600 °С) на железооксидных катализаторах в условиях разбавления водой (соотношение водаггаз А. = 15- 20) протекает преимущественно реакция дегидрирования до а-метилстирола. Рассчитанные для этих условий равновесные (теоретически возможные) степень превращения и селективность соответственно равны = =0,99 и = 0,98. Конверсия кумола в действующем производстве достигает Хд = 0,5, а селективность по а-метилстиролу 5д = 0,9. Используя значения конверсии и селективности в действующем процессе и их предельные значения, можно определить коэффициент эффективности реакторного узла дегидрирования [c.231]
СаА 0,5 1,14 Вода, диоксид углерода, сероводород, аммиак, метанол, этилен, пропилен, этан, метан, спирты нормального строения, содержащие до 14 атомов углерода, метил- и этилмеркаптаны СаХ 0,8 1,19 Вода, диоксид углерода, сероводород, аммиак, метанол, этилен, пропилен, этан, метан, спирты нормального строения, содержащие до 14 атомов углерода, метилэтилмеркаптаны, изопара-финовые углеводороды, бензол, меркаптаны, толуол NaX 0,8—1,0 — Вода, диоксид углерода, сероводород, аммиак, метанол, этилен, пропилен, этан, метан, спирты нормального строения, содержащие до 14 атомов углерода, ме-тил- и этилмеркаптаны, изопара-финовые углеводороды, бензол, меркаптаны, толуол, высокомолекулярные нафтеновые и ароматические углеводороды [c.124]
В зависимости от выбранного сорбента и температурного поля могут быть проанализированы природный нефтяной газ и газы, сорбированные водой и породой (водород, метан, этан, пропан, бутап, пеитаи, гексан, гептан) рефлюкс пропановой и бутановой колонн (этап, этилен, пропан, пропилен, изобутан, бутан) сухой газ крекинга нефти (водород, метан, этап, этилен, пропан, пропилен, изобутан, бутан, бутилепы, пентан) низкокинящие газы (Нз, Не, СО, СН4, Аг). [c.311]
Вода, метан, окись и двуокись углерода, этан, этилен Бутадиен, бутены, цик-лоиентадвены, гексадиены, пропилен, циклогексадиены Изобутилен, димер, тример и тетрамер [c.239]
Вода—1иетан — этилен и вода — метан — пропилен — этилен [c.96]
Как известно, при получении этилена пиролизом пропана последний вместе с некоторым количеством водяного пара пропускают при 760° и времени пребывания в зоне реакции около 1 сек. через нечь пиролиза (рис. 35), где пропан распадается на этилен и метан или дегидрируется на пропилен и водород. Насыщенные парами воды газы после выхода из печи пиролиза подвергаются закалке (быстрому охлаждению), проходят водоотделитель и поступают в компрессор, где их сжимают в три ступени до 32 ат (здесь [c.168]
Диметилсульфид Бутилены (I) Диметилсульфоксид (I) Окислительн Дивинил (II), этилен, метан, пропилен, СО, СОа СгаОз проток, 1 бар, 50—150° С, время контакта 7,5 сек. Степень окисления 0,6—25,5%, избирательность по I —0,6—16,6% [334] ое дегидрирование Хром-кальций-никель-фосфагный безгради-ентный реактор, 450—580° С, 330 ч Выход 11 за 1 проход 33—38 мол.%, селективность 57,8— 76,6%, конверсия 42,8—58,6%. При 580—600° С, 400 ч выход И —42 мол.%, селективность 84-86% [335—337] К-16 (промышленный) проточно-циркуляционный метод, в присутствии паров воды, 560— 600° С. Оа 1 = 0,6 1,4, 1 Н,0 = 1 20 (мол.). Скорость подачи I — 500 ч [338, 339] СгзОз на кольцах Рашига в присутствии паров воды и НС1, 1 НаО 0 = 1 16 0.85 (мол.), С1 1=0,115 (мол.). Выход 11—35% 1340] [c.502]
Поли-4-метил- пентен-1 130. .. 170 С (кислород) Метан, этан, пропан, изобутан, этилен, пропилен, изобутилен, проппоно-вый альдегид, вода, метиловый, этиловый, изобутил овый, изопропиловый спирты, изомасля-ная, пропионовая, нзова-лерьяновая кислоты, двуокись углерода [c.275]
Но и в этане все водороды одинаково поставлены в отношении к углероду, и, следовательно, пропан № H Hs также один. Но бутанов С Н ° уже должно ждать и в действительности— два. В одном новый метил должно считать замещающим водород одного из метилов СН С№СН - СН , а в другом С№ должно считать замещающим Н в СН-, следо-тельно, в нем будет СН СНСН СН . Если угодно, это метан, в котором три водорода заменены тремя метилами. Если пойдем далее, то очевидно, что число возможных изомеров будет еще более. Но мы ограничимся лишь простейшими примерами, доказывающими возможность и действительное существование изомеров. С2Н или СН-СН , очевидно, один но углеводородов состава С Н должно быть и есть два пропилен и три-метилен. Первый есть этилен СН СН , в котором один вод од замещен метилом С№СНСН , а триметилен есть этан СН СН , только с заменою двух водородов от двух метилов метиленом, СН2СН" [c.264]
Олефины Сб, бутиловый и амиловый спирты, алифатические альдегиды, метилпропилкетон, бутилпропионат, уксусная, пропионовая и масляная кислоты, окись углерода Альдегиды, кислоты Низшие углеводороды, диизопро-пилциклопропан, формальдегид, ацетон, вода, окись углерода, двуокись углерода Метан, этан, пропан, этилен, пропилен, олигомеры поли-З-метилбуте-на-1 [c.244]
Метан, этан, пропан, изобутан, этилен, пропилен, изобутилен, про-пионоБЫЙ альдегид, вода Метиловый, этиловый, изобутило-вый и изопропиловый спирты, ацетон, акролеин, ацетальдегид, кротоновый, изовалериановый и изомасля-ный альдегиды, изомасляная, пропионовая, изовалериановая и щавелевая кислоты, вода, двуокись углерода [c.244]
I — бензин из хранилища II — дистиллятное топливо III — тяжелое топливо IV — раствор каустика V — вода для промывки VI — отработанная щелочь VII — водород VIII — метан IX — товарный этилен X — бензин пиролиза XI — фракция С4 XII — товарный пропан XIII — фракция Сз, сбрасываемая в топливо XIV — товарный пропилен. [c.127]
Охлаждение сжатой газовой смеси различными хладоаген-тами водой до +5°, холодильным рассолом (получаемым на аммиачной холодильной установке) до —15°, кипящим в вакууме жидким аммиаком (получаемым на той же установке) до —50°, кипящими углеводородами (пропаном или пропиленом до —40°, этаном до —80°, этиленом до —100°, метаном до —150°). При охлаждении понижается парциальное давление паров компонентов смеси, что вместе с предварительным сжатием газа может привести к сжижению (конденсации) части газов. [c.304]chem21.info
Этилен — Википедия
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой C2h5. Является простейшим алкеном (олефином), изологом этана. При нормальных условиях — бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире[1]; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год[2]. Этилен обладает наркотическим действием. Класс опасности — четвёртый[3].
Этилен стали широко применять в качестве мономера перед Второй мировой войной в связи с необходимостью получения высококачественного изоляционного материала, способного заменить поливинилхлорид. После разработки метода полимеризации этилена под высоким давлением и изучения диэлектрических свойств получаемого полиэтилена началось его производство сначала в Великобритании, а позднее и в других странах.
Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Реакция проводится в трубчатых печах при +800-950 °С и давлении 0,3 МПа. При использовании в качестве сырья прямогонного бензина выход этилена составляет примерно 30 %. Одновременно с этиленом образуется также значительное количество жидких углеводородов, в том числе и ароматических. При пиролизе газойля выход этилена составляет примерно 15-25 %. Наибольший выход этилена — до 50 % — достигается при использовании в качестве сырья насыщенных углеводородов: этана, пропана и бутана. Их пиролиз проводят в присутствии водяного пара.
При выпуске с производства, при товарно-учётных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 «Этилен и пропилен. Методы отбора проб». Отбор пробы этилена может производится и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Промышленно получаемый в России этилен должен соответствовать требованиям, изложенным в ГОСТ 25070-2013 «Этилен. Технические условия».
Структура производства[править]
В настоящее время в структуре производства этилена 64 % приходится на крупнотоннажные установки пиролиза, ~17 % — на малотоннажные установки газового пиролиза, ~11 % составляет пиролиз бензина и 8 % падает на пиролиз этана.
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 1980-х годов в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений[4], среди прочего[5] отвечает за опадание иголок у хвойных.
Электронное и пространственное строение молекулы[править]
Атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Ch3=Ch3Основные химические свойства[править]
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
- Галогенирование:
- Гидрирование:
- Гидрогалогенирование:
- Димеризация (В. Ш. Фельдблюм. Димеризация и диспропорционирование олефинов. М.: Химия, 1978
Биологическая роль[править]
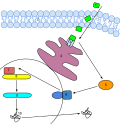 Сигнальный каскад этилена у растений. Этилен легко проникает сквозь клеточную мембрану и связывается с рецепторами, расположенными на эндоплазматическом ретикулуме. Рецепторы после активации высвобождают связанный EIN2. Это активирует каскад передачи сигнала, который приводит к активации экспрессии определённых генов и в конечном итоге к включению специфического ответа на этилен у данного растения в данной фазе созревания. Активированные участки ДНК считываются в мРНК, которая, в свою очередь, в рибосомах считывается в функционирующий белок фермента, который катализирует биосинтез этилена, тем самым продукция этилена в ответ на изначальный этиленовый же сигнал повышается до определённого уровня, запуская каскад реакций созревания растения.
Сигнальный каскад этилена у растений. Этилен легко проникает сквозь клеточную мембрану и связывается с рецепторами, расположенными на эндоплазматическом ретикулуме. Рецепторы после активации высвобождают связанный EIN2. Это активирует каскад передачи сигнала, который приводит к активации экспрессии определённых генов и в конечном итоге к включению специфического ответа на этилен у данного растения в данной фазе созревания. Активированные участки ДНК считываются в мРНК, которая, в свою очередь, в рибосомах считывается в функционирующий белок фермента, который катализирует биосинтез этилена, тем самым продукция этилена в ответ на изначальный этиленовый же сигнал повышается до определённого уровня, запуская каскад реакций созревания растения. Этилен — первый из обнаруженных газообразных растительных гормонов, обладающий очень широким спектром биологических эффектов.[7] Этилен выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов)[8], распускание бутонов (процесс цветения), старение и опадание листьев и цветков. Этилен называют также гормоном стресса, так как он участвует в реакции растений на биотический и абиотический стресс, и синтез его в органах растений усиливается в ответ на разного рода повреждения. Кроме того, являясь летучим газообразным веществом, этилен осуществляет быструю коммуникацию между разными органами растений и между растениями в популяции, что важно. в частности, при развитии стресс-устойчивости.[9]
К числу наиболее известных функций этилена относится развитие так называемого тройного ответа у этиолированных (выращенных в темноте) проростков при обработке этим гормоном. Тройной ответ включает в себя три реакции: укорочение и утолщение гипокотиля, укорочение корня и усиление апикального крючка (резкий изгиб верхней части гипокотиля). Ответ проростков на этилен крайне важен на первых этапах их развития, так как способствует пробивание ростков к свету.[9]
В коммерческом сборе плодов и фруктов используют специальные комнаты или камеры для дозревания плодов, в атмосферу которых этилен впрыскивается из специальных каталитических генераторов, производящих газообразный этилен из жидкого этанола. Обычно для стимулирования дозревания плодов используется концентрация газообразного этилена в атмосфере камеры от 500 до 2000 ppm в течение 24-48 часов. При более высокой температуре воздуха и более высокой концентрации этилена в воздухе дозревание плодов идёт быстрее. Важно, однако, при этом обеспечивать контроль содержания углекислого газа в атмосфере камеры, поскольку высокотемпературное созревание (при температуре выше 20 градусов Цельсия) или созревание при высокой концентрации этилена в воздухе камеры приводит к резкому повышению выделения углекислого газа быстро созревающими плодами, порой до 10 % углекислоты в воздухе спустя 24 часа от начала дозревания, что может привести к углекислотному отравлению как работников, убирающих уже дозревшие плоды, так и самих фруктов.[10]
Этилен использовался для стимулирования созревания плодов ещё в Древнем Египте. Древние египтяне намеренно царапали или слегка мяли, отбивали финики, фиги и другие плоды с целью стимулировать их созревание (повреждение тканей стимулирует образование этилена тканями растений). Древние китайцы сжигали деревянные ароматические палочки или ароматические свечи в закрытых помещениях с целью стимулировать созревание персиков (при сгорании свеч или дерева выделяется не только углекислый газ, но и недоокисленные промежуточные продукты горения, в том числе и этилен). В 1864 году было обнаружено, что утечка природного газа из уличных фонарей вызывает торможение роста близлежащих растений в длину, их скручивание, аномальное утолщение стеблей и корней и ускоренное созревание плодов.[7] В 1901 году русский учёный Дмитрий Нелюбов показал, что активным компонентом природного газа, вызывающим эти изменения, является не основной его компонент, метан, а присутствующий в нём в малых количествах этилен.[11] Позднее в 1917 году Сара Дубт доказала, что этилен стимулирует преждевременное опадание листьев.[12] Однако только в 1934 году Гейн обнаружил, что сами растения синтезируют эндогенный этилен.[13] В 1935 году Крокер предположил, что этилен является растительным гормоном, ответственным за физиологическое регулирование созревания плодов, а также за старение вегетативных тканей растения, опадание листьев и торможение роста.[14]

Этилен образуется практически во всех частях высших растений, включая листья, стебли, корни, цветки, мякоть и кожуру плодов и семена. Образование этилена регулируется множеством факторов, включая как внутренние факторы (например фазы развития растения), так и факторы внешней среды. В течение жизненного цикла растения, образование этилена стимулируется в ходе таких процессов, как оплодотворение (опыление), созревание плодов, опадание листьев и лепестков, старение и гибель растения. Образование этилена стимулируется также такими внешними факторами, как механическое повреждение или ранение, нападение паразитов (микроорганизмов, грибков, насекомых и др.), внешние стрессы и неблагоприятные условия развития, а также некоторыми эндогенными и экзогенными стимуляторами, такими, как ауксины и другие.[15]
Цикл биосинтеза этилена начинается с превращения аминокислоты метионина в S-аденозил-метионин (SAMe) при помощи фермента метионин-аденозилтрансферазы. Затем S-аденозил-метионин превращается в 1-аминоциклопропан-1-карбоксиловую кислоту (АЦК, ACC) при помощи фермента 1-аминоциклопропан-1-карбоксилат-синтетазы (АЦК-синтетазы). Активность АЦК-синтетазы лимитирует скорость всего цикла, поэтому регуляция активности этого фермента является ключевой в регуляции биосинтеза этилена у растений. Последняя стадия биосинтеза этилена требует наличия кислорода и происходит при действии фермента аминоциклопропанкарбоксилат-оксидазы (АЦК-оксидазы), ранее известной как этиленобразующий фермент. Биосинтез этилена у растений индуцируется как экзогенным, так и эндогенным этиленом (положительная обратная связь). Активность АЦК-синтетазы и, соответственно, образование этилена повышается также при высоких уровнях ауксинов, в особенности индолуксусной кислоты, и цитокининов.
Этиленовый сигнал у растений воспринимается минимум пятью различными семействами трансмембранных рецепторов, представляющих собой димеры белков. Известен, в частности, рецептор этилена ETR1 у арабидопсиса (Arabidopsis). Гены, кодирующие рецепторы для этилена, были клонированы у арабидопсиса и затем у томата. Этиленовые рецепторы кодируются множеством генов как в геноме арабидопсиса, так и в геноме томатов. Мутации в любом из семейства генов, которое состоит из пяти типов этиленовых рецепторов у арабидопсиса и минимум из шести типов рецепторов у томата, могут привести к нечувствительности растений к этилену и нарушениям процессов созревания, роста и увядания.[16] Последовательности ДНК, характерные для генов этиленовых рецепторов, были обнаружены также у многих других видов растений. Более того, этиленсвязывающий белок был найден даже у цианобактерий.[7]
Неблагоприятные внешние факторы, такие, как недостаточное содержание кислорода в атмосфере, наводнение, засуха, заморозки, механическое повреждение (ранение) растения, нападение патогенных микроорганизмов, грибков или насекомых, могут вызывать повышенное образование этилена в тканях растений. Так, например, при наводнении корни растения страдают от избытка воды и недостатка кислорода (гипоксии), что приводит к биосинтезу в них 1-аминоциклопропан-1-карбоксиловой кислоты. АЦК затем транспортируется по проводящим путям в стеблях вверх, до листьев, и в листьях окисляется до этилена. Образовавшийся этилен способствует эпинастическим движениям, приводящим к механическому стряхиванию воды с листьев, а также увяданию и опаданию листьев, лепестков цветков и плодов, что позволяет растению одновременно и избавиться от избытка воды в организме, и сократить потребность в кислороде за счёт сокращения общей массы тканей.[17]
Небольшие количества эндогенного этилена также образуются в клетках животных, включая человека, в процессе перекисного окисления липидов. Некоторое количество эндогенного этилена затем окисляется до этиленоксида, который обладает способностью алкилировать ДНК и белки, в том числе гемоглобин (формируя специфический аддукт с N-терминальным валином гемоглобина — N-гидроксиэтил-валин).[18] Эндогенный этиленоксид также может алкилировать гуаниновые основания ДНК, что приводит к образованию аддукта 7-(2-гидроксиэтил)-гуанина, и является одной из причин присущего всем живым существам риска эндогенного канцерогенеза.[19] Эндогенный этиленоксид также является мутагеном.[20][21] С другой стороны, существует гипотеза, что если бы не образование в организме небольших количеств эндогенного этилена и соответственно этиленоксида, то скорость возникновения спонтанных мутаций и соответственно скорость эволюции была бы значительно ниже.
- ↑ Devanney Michael T. Ethylene (англ.). SRI Consulting (September 2009). Архивировано из первоисточника 21 августа 2011.
- ↑ Ethylene (англ.). WP Report. SRI Consulting (January 2010). Архивировано из первоисточника 21 августа 2011.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ «Рост и развитие растений» В. В. Чуб
- ↑ «Delaying Christmas tree needle loss»
- ↑ Хомченко Г.П. §16.6. Этилен и его гомологи // Химия для поступающих в вузы. — 2-е изд. — М.: Высшая школа, 1993. — С. 345. — 447 с. — ISBN 5-06-002965-4.
- ↑ 7,07,17,2 Lin, Z.; Zhong, S.; Grierson, D. (2009). «Recent advances in ethylene research». J. Exp. Bot. 60 (12): 3311–36. DOI:10.1093/jxb/erp204. PMID 19567479.
- ↑ Ethylene and Fruit Ripening / J Plant Growth Regul (2007) 26:143-159 doi:10.1007/s00344-007-9002-y (англ.)
- ↑ 9,09,1 Лутова Л.А. Генетика развития растений / ред. С.Г. Инге-Вечтомов. — 2-е изд.. — Санкт-Петербург: Н-Л, 2010. — С. 432.
- ↑ External Link to More on Ethylene Gassing and Carbon Dioxide Control. ne-postharvest.com (недоступная ссылка с 06-06-2015 (931 день))
- ↑ Neljubov D. (1901). «Uber die horizontale Nutation der Stengel von Pisum sativum und einiger anderen Pflanzen». Beih Bot Zentralbl 10: 128–139.
- ↑ Doubt, Sarah L. (1917). «The Response of Plants to Illuminating Gas». Botanical Gazette 63 (3): 209–224. DOI:10.1086/332006.
- ↑ Gane R. (1934). «Production of ethylene by some fruits». Nature 134 (3400): 1008. DOI:10.1038/1341008a0. Bibcode: 1934Natur.134.1008G.
- ↑ Crocker W, Hitchcock AE, Zimmerman PW. (1935) «Similarities in the effects of ethlyene and the plant auxins». Contrib. Boyce Thompson Inst. 7. 231-48. Auxins Cytokinins IAA Growth substances, Ethylene
- ↑ Yang, S. F., and Hoffman N. E. (1984). «Ethylene biosynthesis and its regulation in higher plants». Ann. Rev. Plant Physiol. 35: 155–89. DOI:10.1146/annurev.pp.35.060184.001103.
- ↑ Bleecker A. B., Esch J. J., Hall A. E., Rodríguez F. I., Binder B. M. The ethylene-receptor family from Arabidopsis: structure and function. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 1998. — Vol. 353,. — P. 1405–1412. — DOI:10.1098/rstb.1998.0295. — PMID 9800203. исправить
- ↑ Explaining Epinasty. planthormones.inf
- ↑ (1992) «Pharmacokinetics of ethylene in man; body burden with ethylene oxide and hydroxyethylation of hemoglobin due to endogenous and environmental ethylene.». Arch Toxicol. 66 (3): 157-163. PMID 1303633.
- ↑ (1997) «A note on the physiological background of the ethylene oxide adduct 7-(2-hydroxyethyl)guanine in DNA from human blood.». Arch Toxicol. 71 (11): 719-721. PMID 9363847.
- ↑ (May 15, 2000) «A physiological toxicokinetic model for exogenous and endogenous ethylene and ethylene oxide in rat, mouse, and human: formation of 2-hydroxyethyl adducts with hemoglobin and DNA.». Toxicol Appl Pharmacol. 165 (1): 1-26. PMID 10814549.
- ↑ (Sep 2000) «Carcinogenicity and genotoxicity of ethylene oxide: new aspects and recent advances.». Crit Rev Toxicol. 30 (5): 595-608. PMID 11055837.
- Безуглова О. С. Этилен. Удобрения и стимуляторы роста. Проверено 22 февраля 2015.
wp.wiki-wiki.ru
Этилен воды гидратация - Справочник химика 21
Гидратация и гидролиз — реакции, протекающие с участием воды. Гидратацией называется присоединение воды к веществу с образованием нового химического соединения. Так, присоединением воды к ненасыщенному газообразному углеводороду — этилену — может быть получен этиловый спирт. Эту реакцию проводят в присутствии катализатора — концентрированной серной кисло- [c.19] Гидратация и гидролиз — реакции, протекающие с участием воды. Гидратацией называется присоединение воды к веществу с образованием нового химического соединения. Так, присоединением воды к ненасыщенному газообразному углеводороду — этилену — может быть ползучей этиловый спирт. Эту реакцию проводят в присутствии катализатора — концентрированной серной кислоты — при небольшом давлении этилена. Непроизводительный расход больших количеств серной кислоты является крупным недостатком этого процесса, требующего к тому же создания аппаратуры из кислотоупорных материалов. Для устранения этого недостатка разработаны методы так называемой прямой гидратации этилена, т. е. непосредственного взаимодействия этилена и воды в присутствии твердых катализаторов [c.17]Вследствие этого приводимые, нанример, Введенским и Фельдманом данные относительно степени превращения этилена — 53% нри 150° и 50 атм. в паровой фазе и при соотношении этилен вода = 1 1 — не реальны, так как при этих условиях будет иметь место конденсация водяных паров и, следовательно, невозможен процесс гидратации в паровой фазе без нарушения соотношения между исходными веществами. [c.83]
Непосредственное присоединение воды к этилену — прямая гидратация — весьма заманчивый способ получения этилового спирта. Эта реакция интересна в том отношении, что она дает возможность получать спирт непрерывным и одноступенчатым процессом, не требует для изготовления аппаратуры кислотоупорных материалов и не связана с необходимостью регенерации таких продуктов, как разбавленная серная кислота при сернокислотной гидратации. [c.99]
Комиссия, расследовавшая причины аварии, предложила заменить стальные литые переходы на трубопроводах этилена высокого давления переходами более надежной конструкции, улучшить крепление трубопроводов для снижения знакопеременных нагрузок, возникающих в опасных сечениях от вибрации и температурных изменений, а также создать более рациональную схему удаления воды из системы гидратации и определить порядок проверки проходимости системы перед началом подпитки ее этиленом. [c.256]В производствах довольно часто допускаются аварийные остановки, вызванные замерзанием воды или других жидкостей в аппаратуре и трубопроводах. Неполный слив воды после гидравлических испытаний и ошибки персонала при отогреве и последующем пуске оборудования в зимнее время могут привести к авариям. Так, на одном из предприятий при пуске после ремонта технологической установки для получения синтетического этилового спирта методом прямой гидратации этилена разорвался трубопровод, и этилен, находившийся в системе, был выброшен в помещение. [c.313]
Более прогрессивным и простым способом получения этилового спирта из этилена является прямая гидратация этилена, т. е. непосредственное присоединение воды к этилену с образованием этилового спирта. [c.223]
Прямая гидратация этилена с применением фосфорнокислого катализатора производится следующим образом (рис. 126). Реактор представляет собой колонну высотой 10 ж и диаметром 1,5 м. Чтобы предохранить от действия фосфорной кислоты стальной корпус колонны, она внутри футерована листовой красной медью, с которой эта кислота не реагирует. В колонну помещен катализатор, слой которого составляет 8,5 м. В верхнюю часть колонны под давлением 75—80 ат и при температуре 220—270° С подается смесь этилена и водяного пара. Эта смесь за счет выделяющегося при реакции тепла нагревается до 280—300° С и проходит сверху вниз через слой катализатора. Реакция с водой за один проход через слой катализатора происходит лишь частично, поэтому проводится многократная циркуляция смеси. В конечном итоге выход этилового спирта составляет 95% по отношению к использованному этилену. Из нижней части колонны получают водный раствор спирта концентрацией [c.328]
Основной химический процесс присоединение воды к этилену (гидратация) при 280—300 °С и давлении 7-10 —8-10 Па [c.191]
Прямая гидратация этилена. Реакцию непосредственного присоединения воды к этилену долгое время не удавалось осуществить. Однако применение катализаторов в этой реакции позволило получать этиловый спирт с хорошим выходом. В настоящее время метод прямой гидратации этилена освоен промышленностью и является очень перспективным. [c.104]
Реакцию прямого присоединения воды к этилену долго не удавалось осуществить с выходами, представляющими практический интерес. Основная трудность состояла в подыскании соответствующего катализатора. Начиная с 30-х годов, появились десятки патентов, предлагавших самые разнообразные вещества в качестве катализаторов реакции прямой гидратации этилена. [c.249]
Эти данные показывают, что по возможности гидратацию следует проводить при более низких температурах, высоких давлениях и большом молярном отношении воды к этилену. [c.252]
При изучении влияния температуры на процесс гидратации было установлено, что повышение температуры от 240 до 280° значительно увеличивает конверсию этилена в спирт. Так, при молярном отношении воды к этилену 0,65 1 и общем давлении 70 ат при объемной скорости 2000 час. конверсия этилена при 260° составляет 3%, а при 280° — 5% при объемной скорости 2700 час.конверсия соответственно увеличивается с 2,2 до 3,7%. [c.253]
Хотя увеличение молярного отношения воды к этилену является благоприятным фактором глубины конверсии этилена в процессе гидратации, однако одними термодинамическими данными нельзя руководствоваться при выборе оптимальных условий, а необходимо учитывать кислотный характер катализатора и роль концентрации кислоты на пленке на катализаторе. [c.254]
На разных предприятиях применяются различные методы очистки сточных вод. На нефтехимических комбинатах (при производстве синтетического спирта, фенола, ацетона, синтетических жирных кислот, каучука и др.) основными местами образования загрязненных сточных вод являются цехи пиролиза углеводородов, гидратации этилена и ректификации спирта. Сточные воды цеха пиролиза углеводородов содержат этилен, пропилен, бутан, изобутан, бензол, толуол, ксилол, нафталин. В сточных водах цеха гидратации этилена и ректификации спирта присутствуют спирты, ацетальдегид, продукты полимеризации, смола. При применении биологических методов очистки содержание органических веществ (бензола, толуола, ксилола, нафталина и др.) в сточных водах значительно снижается. [c.16]
В обеих технологиях используется доступное и дешевое сырье — этилен, они имеют высокую (95—98 %) селективность по целевому продукту. Оба технологических решения можно рассматривать как сопряженные технологии, поскольку образующийся технический эфир (диэтиловый или изопропиловый) выделяется в качестве товарного продукта. Однородная структура подсистемы разделения продуктов гидратации олефинов также характеризуется единством используемых принципов. В частности, обеспечивает полноту выделения продуктов из реакционной смеси (этиловый или изопропиловый спирты, соответствующие простые эфиры и вода). [c.438]
Гидратация этилена в этиловый спирт. Первоначально этилен с серной кислотой дает этилсерную кислоту, которая затем расщепляется водой на этиловый спирт и серную кислоту [c.116]
Существенным сдвигом в этом отношении являются исследования Борескова с сотрудниками [16], предложивших вольфрамовые катализаторы особого приготовления. В паровой фазе на этих катализаторах при 270°С, 80 атм, молярном отношении воды к этилену 0,9 1 и объемной скорости по этилену 2000 л1л-час конверсия этилена достигает 6% и съем спирта 220 г/л катализатора в час. В жидкой фазе конверсия этилена составляет 50—70% оптимальными условиями процесса являются температура 270°С и давление 120 атм. В табл. 1 приведены работы по гидратации олефинов в соответствующие спирты. [c.266]
Для химических реакций максимальное количество продукта определяется по уравнению реакции по основному исходному веществу. В качестве основного вещества принимается, как правило, наиболее ценный компонент реакционной смеси, который обычно присутствует в недостатке против стехиометрии. Так, для промышленной реакции 2SO2 + O2 —250з основным реагентом считают диоксид серы, так как второй реагент — кислород — поступает в составе воздуха и является менее ценным. То же относится ко всем многочисленным реакциям окисления при помощи кислорода воздуха, в которых кислород всегда поступает в избытке. При гидратации этилена СН2 = СН2 + Н20— -СгИбОН основным считают этилен. Воду, естественно, не принимают за основное исходное вещество и берут в избытке в большинстве процессов гидратации, гидролиза и конверсии с водяным паром. Для процессов межфаз-ной массопередачи (абсорбции, десорбции, испарения и др.) за максимальное принимается все количество вещества, которое имеется в отдающей фазе (например, в газе при абсорбции). Такой выход продукта применительно к химическим реакциям обычно называют степенью превращения. В процессах массопередачи такой выход называют степенью межфазного перехода, например степенью абсорбции, степенью десорбции и т. п. Степень превращения или межфазного перехода можно выражать (в соответствии с названием) отношением количества израсходованного основного вещества к общему его количеству в начале процесса Сн . [c.42]
Второй способ гидратации олефинов в спирты заключается в прямом каталитическом присоединении воды по олефиновой двойной связи. В этом процессе олефин (этилен) вместе с водяным наром при высоких температуре и давлении пропускается над соответствующим катализатором, напрпмер фосфорной 1Шслотой, нанесенной на кизельгур, активированный уголь или асбест. Процесс прямой каталитической гидратации представляет собой равновесный процесс, поэтому при однократном пропуске компонентов реакции через печь только небольшой процент олефинов превращается в спирты, так что требуется вести процесс с многократной циркуляцией реагирующих веществ, требующей довольно значительных затрат энерглп. Несмотря на это процесс прямой гидратации все же дешевле. [c.199]
Проблема получения спиртов из олефинов через алкилсерпые кислоты так же сложна, как и проблема непосредственной гидратации олефинов, особенно с технической стороны. Первая попытка организовать производство этилового спирта из этилена коксового газа сделана еще в 1862 г. на основе работ Вертело [36 . ГГроцесс получения этилового спирта из этилена через этилсерную кислоту состоит из двух основных реакций между этиленом и серной кислотой меисду э тилсерной кислотой и водой. Каждая из них имеет свои сло кности, которые отражаются на экономике процесса в целом. [c.21]
Пример. В промышленности этанол получают гидратацией этилена в присутствии Н3РО4 на кизельгуре при Г=473—523 К и Р=30—50X10 Па. В исходной реакционной смеси содержится этилен и вода в мольном отношении 1 1. [c.266]
С2Н4 (г) -Ь Н2О (п) С2Н5ОН (п) - ЛЯ АЯ = 45,6 кДж (а) Реакция гидратации катализируется кислыми и нейтральными катализаторами, из которых наиболее распространена фосфорная кислота на носителе кизельгуре или силикагеле. В присутствии фосфорной кислоты протекает электрофильное присоединение воды к этилену по схеме [c.274]
Однако, несмотря на ишрокую известность и несомненную общность, эти реакции (за исключением присоединения брома) в своем классическом виде не вошли в арсенал методов современной органической химии по очень простой причине — им не хватало именно чистоты. Так, например, даже простейшая реа1 ция гидратации — присоединение воды к этилену в присутствии серной кислоты — приводит к образованию пе только этилового спирта, но и диэтилового эфира, этилсульфата и ряда других продуктов. [c.63]
В немецком процессе [38] получившийся в результате реакции между этиленом, хлором и водой (стр. 185) 4—5%-ный водный раствор этиленхлоргидрина, содержавший некоторое количество дихлорэтана, смешивали с 10—20%-ным избытком горячей кашицы гашеной извести и подавали в верхнюю часть колонного реактора, откуда эта смесь стекала вниз, перетекая с полки на полку. В нижнюю часть колонны вводили острый пар с таким расчетом, чтобы жидкость в верхней части все время кипела. Выходящие из аппарата пары состояли из окиси этилена, дихлорэтана и воды. Больитую часть водяных паров конденсировали и возвращали обратно в реактор. Окись этилена отделяли от дихлорэтана и остатка водяных паров ректификацией под атмосферным давлением на двух колоннах непрерывного действия. В этом процессе потери окиси этилена за счет ее гидратации в этиленгликоль были незначительными. [c.188]
Гидратация алкенов - самьш доступный и широко используемый в больших масштабах способ. Полу игемые в г зомадных количества,ч олефины (и, прежде всего, этилен) легко превращаются в алканолы. Эту реакцию мы уже рассматривали. Она протекает через промежуточный карбокатион либо непосредственным присоединением к нему воды, либо сначала к карбокатнону присоединяется qэнaя кислота, а затем образовавшийся алкилсерный эфир гидролизуется [c.21]
Присоединение воды к этилену осуществляют в присутствии фосфорнокислого катализатора. По этому методу работают многие промышленные установки в СССР и за рубежом. Прямая гидратация пропилена может быть осуществлена в присутствии твердого вольфрамового катализатора, представляющего собой окислы вольфрама, промотнрованные окисью цинка и нанесенные на ак1Ивированный силикагель. [c.65]
Эта реакция была подробно изучена А. М. Бутлеровым и В. Горяйновым (1873). Разработан и внедрен в промышленность также метод прямой гидратации этилена пропусканием его в смеси с парами воды над твердыми катализаторами. Получение спирта из этилена очень экономично, так как этилен входит в состав газов крекинга и других промышленных газов и, следовательно, является широкодоступным сырьем. [c.117]
Наиболее современный способ получения этилового спирта основан на реакции гидратации этилена (см. 9.10). В этом способе воплотилась идея, высказанная А. Л1. Бутлеровым около ста лет тому назад. В одном из своих опытов Бутлеров пропускал этилен в концентрированную серную кислоту, надеясь вызвать уплотнение (полимеризацию) этилена. Вместо этого после разбавления водой в продуктах реакции обнаружился этиловый спирт, в связи с чем Бутлеров писал Удобное и быстрое поглощенне этилена концентрированной серной кислотой при температуре около 160 С составляет факт, обещающий приобрести со временем практическое значение если бы удалось открыть дешевый способ приготовления этилена, то он составил бы материал для добыва[1ия спирта . [c.286]
Этилен- и пропиленгликоли продукты находят широкое применение в качестве растворителей, антифризов и др. Мировой объем их производства превышает 15 млн. тонн в год [1]. В настоящее время гликолю получают путем некаталитической гидратации а-оксидов, которую осуществляют при 140-200°С и 20-40 ат, с использованием 8-10 кратного массового избытка воды по отношению к а-оксиду. Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при вьщелении гликолей из разбавленных (12-15%) водных растворов. Одним из основных путей повышения эффективности процесса гидратации является использование гетерогенных катализаторов [2-6]. [c.66]
Этилен- и пропиленгликоль находят широкое применение в качестве полупродуктов для синтеза полимерных материалов и антифризов. Мировой объем их производства превышает 15 млн т в год [1]. В настояшее время в основным промышленным способом получения гликолей является гфоцесс некаталитической гидратации а-оксидов, осуществляемый при 140-200°С и 20-40 атм, с использованием 8-10 кратного массового избытка воды по отношению к а-оксиду. Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при выделении гликолей из разбавленных (12-15%-х) водных растворов. В связи с этим актуальной задачей является разработка про- [c.139]
Практически оптимальное соотношение воды к этилену колеблется в зависимости от условий ведения процесса (температуры, общего давления в процессе гидратации, объемной скорости) от 0,6 до 0,7 НаО 1С2Н4. Для сохранения хороших выходов спирта при указанном интервале соотношения воды к этилену концентрация фосфорной кислоты на нленке катализатора должна быть в пределах 83—85%. [c.254]
На рис. 71 показана упрошенная технологическая схема получения этилового спирта методом прямой гидратации. Свежий и оборотный этилен компрессором 1 нагнетается в систему под давлением 70 ат и в смесителе 2 смешивается с водой (в соотношении НаО СаН4=0,65 -.1), подаваемой насосом высокого давления 3. В теплообменниках 4 и 5 смесь нагревается до 200 X за счет физического тепла продуктов реакции. В змеевиках трубчатой печи 6 с огневым нагревом паро-газовая смесь перегревается до 290 Х и проходит сверху вниз через слой находящегося в гидрататоре 7 фосфорнокислотного катализатора. Продукты реакции, содержащие этанол, из нижней части гидрататора поступают в тройник 8, где нейтрализуются щелочью и отделяются от образующихся солей [c.207]
Этиленгликоль (1,2-дигидроксиэтан) СН2(ОН)СН2(ОН) получают гидратацией этилен-оксида. Бесцветная вязкая жидкость, т.кип. 197,6°С смешивается с водой и органическими растворителями, имеет сладкий вкус. Из этиленгликоля получают диэтиленгликоль, диоксан, простые эфиры, глимы (используемые в качестве растворителей). Применяют в производстве полиэтилентерефталата, целлофана, полиуретанов входит в состав антифризов, тормозных и закалочных жидкостей. Т. самовоспл, 380 °С. [c.46]
Способ получения этилового спирта из этилена известен примерно с конца 20-х годов. В течение долгого времени (до 1940 г.) эту реакцию, по существу представляющую собой реакцию гидратации, проводили довольно сложным путем этилен пропускали через концентрированную серную кислоту при повышенной температуре для получения этилсерной кислоты, автокаталитически действующей на процесс, которая затем при взаимодействии с водой расщеплялась на серную кислоту (получавшуюся разбавленной) и этиловый спирт [1] [c.353]
В настоящее время процесс гидратации этилена реализуется в промышленности обычно при следующих условиях г = 280-300 °С / = 8,0мПа мольное соотношение пары воды этилен = 0,7-0,8 катализатор — фосфорная кислота и фосфаты на алюмосиликате или силикагеле при содержании ЩРО до 35 % в свободном состоянии, объемная скорость циркулирующего газа 1800-2000 ч , что соответствует продолжительности контакта 18-20 с и производительности 180—200 кг этанола с 1 м катализатора в 1 час. [c.429]
chem21.info
Окись этилена с водой - Справочник химика 21
Этилен, окись этилена Вода [c.533]Метилэтилкетон — вода Окись этилена — ацетон Окись этилен а — бензол Окись этилена — этанол Окись этилена — этилацетоацетат Треххлористый этилен — керосин Фосфорная кислота (дымящая) — вода Хлор — вода Хлористый водород — вода [c.420]
Хлорангидриды кислот (в том числе фосген), хлористый водород, перекисные соединения, альдегиды, окись углерода Терефталевая кислота, уксусный альдегид, ацетальдегид, этилен, вода, окись углерода, двуокись углерода [c.255]
Таким путем из этилена получают окись этилена — исключительно важный промежуточный продукт для промышленности алифатического синтеза. Реакцию этилена с хлорноватистой кислотой можно осуществлять также в условиях образования последней, пропуская одновременно хлор и этилен через воду (процесс Гомберга [16]). По уравнению [c.183]Первая реакция ведет к образованию окиси этилена, вторая является реакцией горения этилена до СО, и Н,0. Занумеруем компоненты в следующем по-))ядке 1 — этилен, 2 — окись этилена, 3 — кислород, 4 — вода, 5 — углекислый газ. [c.48]
Потоки С имеют следующий состав этилен (/ = 1), окись этилена а = 2), кислород ( = 3), вода (/ = 4), двуокись углерода (/ = 5), инерты (/ = 6). Некоторые из указанных компонентов в потоке могут отсутствовать, тогда соответствующее С) = 0 значения н С обозначают величины входных потоков этилена и воздуха. [c.211]
Примером этому служит развитие промышленности синтетических полимерных материалов, в частности полиэтилена. Исходным сырьем для изготовления полиэтилена является этилен и при том очень чистый. В этилене, идущем на изготовление полиэтилена, примесь таких веществ, как кислород, окись углерода, пары воды и других должна быть не более 10" %, т. е. не более одной-двух молекул на [c.302]
Из дозирующего устройства емкостью 10 мл откачивают воздух, затем промывают газом из реактора, откачивают остатки предыдущей пробы из системы и начинают подачу пробы (прибор установлен на последовательное течение). Через 5,5 мин прибор переключают на параллельное течение. В этот момент окись этилена и вода распределяются в первой колонке, а двуокись углерода п этилен — во второй. Регистрируют пик окиси этилена, за которым следует фронт воды. Окись этилена и воду выпускают в атмосферу, не пропуская их через вторую колонку. Затем изменяют полюсы мостика, вымывают двуокись углерода и этилен из второй колонки и регистрируют их пики. [c.137]
При разложении этиленхлоргидрина гидроокисью кальция в аппарате соответствующей конструкции (минимальное время пребывания жидкости в реакционной зоне и возможность быстрого отвода образующейся окиси этилена из этой зоны) выход окиси этилена может достигнуть 96%, считая на превращенный этилен-хлоргидрин . Выход окиси этилена зависит от качества извести, применяемой для разложения этиленхлоргидрина, и от условий ее гашения. Нежелательные примеси (глина, карбонат магния) замедляют гашение извести и ухудшают взаимодействие полученного известкового молока с этилен.хлоргидрином. Известковое молоко готовят путем гашения предварительно раздробленной извести горячей водой (80—85 °С) в специальных аппаратах-гасителях. Для приготовления медленно расслаивающегося и быстро реагирующего с этиленхлоргидрином известкового молока очень важно, чтобы известь была надлежащим образом обожжена. Понижение температуры обжига приводит к тому, что в извести остается необожженный известняк, так называемый недопал при слишком высокой температуре обжига получается пережженная окись кальция, трудно поддающаяся гашению. После гашения известковое молоко отделяется от шлама и стекает в емкости, в которых оно перемешивается во избежание расслаивания при хранении. [c.179]
Для уменьшения расхода водяного пара и воды на установке имеется теплообменник для нагревания холодного абсорбента, содержащего окись этилена, горячим тощим абсорбентом. Отгоняющиеся с верха десорбера 7 пары окиси этилена, содержащие некоторое количество водяного пара, двуокиси углерода и других примесей, компримируются и направляются на двухколонную систему ректификации. На отпарной колонне 9 отгоняется двуокись углерода и другие легколетучие компоненты (этилен, азот). В колонне 10 производится окончательная ректификация окиси этилена, причем в кубе остаются высококипящие примеси вода, ацетальдегид, этиленгликоль. Чистую окись этилена в жидком виде перекачивают в резервуары, где она хранится в атмосфере инертного газа. [c.230]
Линии I — этилен II—воздух III — вода 1У,—водяной пар V — окись этилена вода VI — вода (рециркуляция) VII — воздух, газы реакции VIII — окись этилена [c.372]
Полученное соединение представляет собою водную окись или гидрат окиси однозамещенного диаммония. Гидрата окиси, равно как и просто окиси самого аммония, мы не знаем, но их замещенные производные известны. Гидрат окиси этилен-диаммония легко теряет частицу воды и превращается в окись этилен-аммония. Отнять от последнего соединения частицу воды удается только с трудом, при действии безводной окиси бария. Таким образом, получается этилен-диамин [c.400]
В декабре 1803 г. и январе 1804 г. Дальтон прочитал об относительных атомных весах курс лекций в Королевском институте в Лондоне, а в последующие годы еще в большей степени разработал этот вопрос. В 1807 г. о теории Дальтона сообщил химикам его поклонник Томсон в своей Системе химии , а впоследствии обсудил ее также в Истории химии (1830—1831). Господин Дальтон сообщил лше, — писал Томсон , — что атомная теория созрела в ei"o уме во время исследований, которые он проводил над маслородным газом этиленом] и углеродистым водородом [метаном]... Из его опытов следует, что оба эти соединения состоят из углерода и водорода кроме того, он нашел, что углеродистый водород содержит ровно вдвое большее количество водорода, чем масло-родный газ. Это привело его к установлению численных отношений между двумя составными частями и к взгляду на маслородный газ как на соединение, образованное одним атомом углерода и одннм атомом водорода, и на углеродистый водород как на соедипение, образованное одним атомом углерода и двумя атомами водорода. Эта идея была распространена иа окись углерода, воду, аммиак и т. д. Дальтон оп])еделил из известных тогда наилучших анализов атомные веса кислорода, азота и т. д. . [c.169]
Линии I — кислород II — остаточный газ пиролиза III — нефтяная фракция IV — вода V — масло VI — остаточный газ VII — смола VIII — тяжелые ароматические углеводороды IX —легкие ароматические углеводороды X — окись углерода XI — чистый этилен XII — чистый ацетилен. [c.98]
Присоединение хлорноватистой кислоты к этилену с образованием этиленхлоргидрина — одна из наиболее важных химичес1 их реакций, с которых началось промышленное производство производных этилена в начале 1920 г. Лабораторный метод получения этиленхлоргидрина этим способом был описан Кариусом в 1863 г. С тех пор хорошо известна необыкновенная реакционная способность этого хлоргидрина и его почти количественное превращение в окись этилена, которая в настоящее время приобрела большое значение. Нефтяной газ с высоким содержанием этилена был известен и получался заводским путем из жиров уже с 1823 г., а из нефтяного газойля примерно с 1873 г. и до настоящего времени. Промышленное производство этиленовых производных в США никогда не базировалось в сколько-нибудь значительных размерах на исиользовании этилена, содержащегося в газах крекинга, получающихся как побочный продукт при производстве бензинов. Развитие этого направления использования этилена сильно ускорилось возможностями, появившимися вследствие открытия Гомбергом реакции этилена с разбавленной хлорноватистой кислотой в системе вода— хлор [c.370]
Окисленное серебро адсорбирует этилен и окись этилена, а также диоксид углерода и воду. Марцинковский и Берти [28] показали, что часть этилена адсорбируется на окисленной поверхности серебра обратимо, а часть — необратимо. Измерения были сделаны методом фронтальной хроматографии при ат- [c.228]
Технологическая схема процесса получения окиси этилена, разработанного фирмой S ientifi Design, изображена на рис. 6.24. Воздух, подаваемый компрессором У, смешивается с этиленом и циркулирующим реакционным газом и вводится в низ контактного аппарата 2, в трубки которого загружен катализатор. Температура окисления регулируется скоростью циркуляции теплоносителя. Реакционные газы охлаждаются в теплообменнике, нагревая циркулирующий газ, и в холодильнике, а затем компримируются дожимающим компрессором 3. Далее газ поступает в основной скруббер 4, где окись этилена улавливается водой. Большая часть выходящего газа направляется на смешение с исходной эти-лено-воздушной смесью, меньшая — в дополнительный контактный аппарат 5 для окисления непрореагировавшего этилена, а затем на промывку водой в дополнительный скруббер 6. Отходящий из скруббера газ выбрасывается в атмосферу. Водные растворы из скрубберов 4 и 6 смешиваются и поступают в десорбер 7. Из верхней части десорбера отводят окись этилена, пары воды и Oj. Они компримируются и направляются на двухступенчатую ректификацию. В колонне 9 выделяется этилен, Oj и другие легкокипящие компоненты. С верха колонны 10 отбирают окись этилена. В кубе этой колонны остаются высококипящие примеси (вода, ацетальдегид, этиленгликоль). [c.206]
Промышленное окисление пропана и бутанов проводится в США на заводе Бишеп (В1зсЬор). Проводится здесь также и промышленное окисление этилена в окись этилена. Катализатором является серебро на носителе температура реакции 200— 300° окись этилена из отходящего газа сорбируется водой. Этилен обычно берется сильно разведенный инертными газами или воздухом нередко к нему добавляются дихлорэтан или тетраэтилсвинец, как вещества, подавляющие детонацию. Имеется патент [20] на интересный метод окисления пропилена в акролеин. Пропилен при 50—60° пропускается через кислый раствор сульфата окиси ртути, около 20% пропилена при этом реагирует, образуя с хорошим выходом акролеин, выделяющийся при подогреве до 100" [c.465]
Лефорт первым установил, что этилен можно каталитически окислить в окись этилена [114]. В прежних работах по окислению этилена наблюдали только образование воды, углекислоты и альдегидов [115]. [c.396]
Взяв в качестве исходных продуктов окись углерода, этилен и иро-нионовую кислоту и ведя процесс при 205—225°, можно получить в отсутствие воды пропионовый ангидрид с выходом 90% [c.494]
В Германии этиленхлоргидрин получали непрерывным методом, пропуская в воду одновременно хлор и избыток этилена [34]. Процесс проводили в колоннах, выложенных внутри керамиковыми плитами и затем гуммированных. Не вступивший в реакцию этилен возвращали обратно в процесс, предварительно отмыв от него хлористый водород раствором едкого натра и удалив пары хлорированных углеводородов адсорбцией активированным углем. Выделяющегося при реакции тепла оказалось достаточно, чтобы нагревать до 45° продукты реакции, вытекающие из колонны. Был подобран такой режим процесса, чтобы получить 4—5%-ный раствор хлоргидрина, который без предварительных концентрирования и очистки перерабатывали непосредственно в окись этилена (стр. 188). По сравнению с периодическим методом при проведении непрерывного процесса приходится работать с меньшей степенью превращения, чтобы выдержать на том же уровне количество побочно образуюи1,егося дихлорэтана. [c.185]
В немецком процессе [38] получившийся в результате реакции между этиленом, хлором и водой (стр. 185) 4—5%-ный водный раствор этиленхлоргидрина, содержавший некоторое количество дихлорэтана, смешивали с 10—20%-ным избытком горячей кашицы гашеной извести и подавали в верхнюю часть колонного реактора, откуда эта смесь стекала вниз, перетекая с полки на полку. В нижнюю часть колонны вводили острый пар с таким расчетом, чтобы жидкость в верхней части все время кипела. Выходящие из аппарата пары состояли из окиси этилена, дихлорэтана и воды. Больитую часть водяных паров конденсировали и возвращали обратно в реактор. Окись этилена отделяли от дихлорэтана и остатка водяных паров ректификацией под атмосферным давлением на двух колоннах непрерывного действия. В этом процессе потери окиси этилена за счет ее гидратации в этиленгликоль были незначительными. [c.188]
И ПОД давлением 20—50 ата к продуктам реакции добавляли затем воду, чтобы выделить кислоту в свободном виде [11]. В дальнейшем было установлено, что окись углерода может присоединяться к олефинам в присутствии воды, спиртов, аминов и других соединений, образуя соответственно кислоты, стожные эфиры и амиды. Источником окиси углерода служат карбонилы металлов, выделяющие ее в присутствии кислот мож1ю также проводить каталитическую реакцию с газообразной окисью углерода, используя соль металла, способную в условиях процесса образовывать карбонил [12]. Больше всего внимания уделялось синтезу кислот в присутствии карбонила никеля процесс проводили при 200—300° и 150 ат. Этим способом можно превратить этилен в пропионовую кислоту или ее ангидрид. [c.197]
Выходящие из контактного аппарата газы содержат кроме окисн этилена пары воды, СОг и иепрореагировавший этилен. Пройдя теплообменник / и холодильник 4, образовавшаяся смесь направляется в абсорбциоииую колонну 5, в которой окись этилена извлекается из смеем каким-либо подходящим абсорбентом. Насыщенный абсорбент поступает в десорбциоппую колонну 7. В )1делившая-ся окись этилена направляется в сборник 10. [c.119]
Сжатые воздух и этилен и рециркулирующий газ смешиваются п поступают в контактный аппарат 1, охлаждаемый даутермом. Выходящие из контактного аппарата газы охлаждаются сперва в теплообменнике 2 за счет холодного рециркулирующего газа, а затем в водяном холодильнике 3, после чего насосом 4 подаются для сорбции окпси этплена в скруббер 5. Окись этилепа из контактных газов извлекается водой под давлением, равным давлению в контактном аппарате. [c.297]
Пробу вводят в прибор при последовательном соединении колонок. Приблизительно через 6 мин производят переключение на параллельное соединение колонок, чтобы не загрязнять водой и окисью этилена колонку с силикагелем, включаемую специально для разделения этилена и СО2. В этот момент окись этилена и вода находятся в первой колонке, заполненной целитом, содержащим и-октадекан, в то время как воздух уже вышел из прибора, а СО2 и этилен разделяются на газоадсорбционной колонке. В качестве детектора служит лишь один катарометр, к измерительной и сравнительной камерам которого присоединяется та или другая колонка. Для того чтобы пики записывались в одном направлении, производят переполюсовку детектора после прохождения фракции. [c.227]
Вода, окись этилена, окись пропилена, этилен-глпколь, пропиленгликоль Синахром 1.8X5 158 Водород 60 Катарометр [1] [c.151]
Ацетамидин, употребляемый в подавляющем числе синтезов пиримидинового компонента тиамина, может быть получен из ацетамида через ацето-иминоэфир. Ацетамид, с прекрасным выходом получаемый насыщением уксусного ангидрида или уксусной кислоты аммиаком или при отгонке воды из смеси уксусной кислоты и углекислого аммония 1205 ], дегидратируется при взаимодействии с хлорокисью фосфора при 100—150° С, образуя ацетонитрил. Его также получают непосредственно из уксусной кислоты и аммиака при пропускании смеси их паров над окисью алюминия или окисью тория при температуре 400—500° С [206], над селикагелем при 500° С с выходом 95% [207] или над смесью селикагеля и фосфорной кислоты при 280—300° С с выходом 87% [208]. Для получения ацетонитрила можно подвергнуть парофазной конденсации пентан и аммиак при 520° С над алю-момолибденовым катализатором (выход 43,8%) [209] или этилен и аммиак над окислами металлов, нанесенных на окись алюминия [210]. [c.399]
Этилен должен быть тщательно очищен, так как такие примеси, как вода, кислород, окись и двуокись углерода, являются ка-тализаторными ядами. [c.79]
В продуктах радиолиза этиленгликоля в зависимости от условий его проведения найдены альдегиды (муравьиный, уксусный, гликолевый, янтарный, глиоксаль), кислоты (уксусная, щавелевая, гликолевая, глиоксалевая), спирты (метиловый, этиловый, эритрит) и другие кислородсодержащие соединения (ацеталь, этилацетат, метилдиоксолан), а также газообразные продукты (водород, кислород, окись углерода, метан, этан, этилен). Кроме того, образуется и вода. [c.28]
Ог летим некоторое сходство отношения этилена и его окиси к воде, которое можно объяснить сходством строения их молекул. Валентное состояние углеродных атомов у этих соединений близко к триплетному . Этилен и окись этилена образуют с водой весьма близкие по составу кристаллогидраты. Состав кристаллогидрата этилена определяется формулой С2Н4-6Н20, теплота его образования составляет 15,4 ккал/моль. Окись этилена также способна образовывать с водой кристаллическое oeдинeниe . Очень легко образуется гидрат при сливании предварительно охлажденных окиси этилена и воды. Подробнее условия образования гидрата окиси этилена описаны на стр. 36 и 50. [c.92]
На рис. 43 показана одна из схем производства окиси этилена каталитическим окислением этилена. Очищенные от примесей воздух и этилен смешиваются с рециркулирующим газом и поступают в основной реактор 1 (реактор первой ступени). Выходящие горячие газы, пройдя теплообменник 5,нагревают рециркулирующие газы, сжимаются компрессором 8 и поступают в основной абсорбер 2 (абсорбер первой ступени), в котором окись этилена и образующиеся в качестве побочных продуктов незначительные количества ацетальдегида и часть двуокиси углерода поглощаются водой. После абсорбера 2 большая часть газов возвращается в цикл на смешение со свежим этиленом и воздухом, а остальные газы после нагревания в теплообменнике смешиваются с добавочным количеством воздуха и поступают в дополнительный реактор 3 (реактор второй ступени). Добавочное количество воздуха вводится для более полного окисления этилена в реакторе 3. Отвод образующегося тепла из обоих реактаров Производится циркулирующим теплоносителем, который, в свою очередь, отдает тепло кипящей воде. Таким образом, теплота реакции используется для получения водяного пара. [c.227]
На рис. 44 показана схема производства окиси этилена, разработанная фирмой S ientifi Design (США) Воздух сжимается компрессором /, смешивается с этиленом и рециркулирующим газом и вводится в низ трубчатого реактора 2. Температуру окисления регулируют циркуляцией органического теплоносителя. Газ, содержащий окись этилена, на выходе из реактора охлаждается сначала в теплообменнике, нагревая циркулирующий газ, а затем в водяном холодильнике, после чего сжимается циркуляционным компрессором, 3. Далее газ поступает в абсорбер 4, где окись этилена абсорбируется водой. [c.229]
chem21.info
Вода — этанол — этилен
Вода — этанол — этилен [c.99] При добавлении воды к этилену получается этанол. Переходите к чтению рубрики 15. [c.307]Совершенно верно. Реакция воды с этиленом широко используется в химической промышленности для многотоннажного синтеза этанола. [c.308]
Способ Лебедева широко применялся в СССР и США исходный этанол получался либо брожением, либо присоединением воды к этилену. [c.947]
Метафосфорную кислоту вносят в еще нагретом состоянии в круглодонную колбу (200. ил), в которую вставляют капельную воронку, термометр, погруженный в жидкость, и газоотводную трубку нагрев кислоту до 210—220°, по каплям приливают этанол. Этилен, получаемый таким путем, не очень чист. В нем содержатся примеси высокомолекулярных веществ. В аналогичных случаях можно работать тем жо методом. Преимуществом этого метода является то, что с помощью небольших количеств метафосфорной кислоты можно практически дегидратировать любые количества спирта, потому что образующаяся вода отгоняется. [c.346]
Действие каждого катализатора специфично он изменяет ско-юсть только одной реакции или группы определенных реакций. Наиример, в присутствии оксида алюминия этанол разлагается на воду и этилен, а в присутствии меди — на ацетальдегид и водород. [c.374]
В 1795 г. путем отщепления воды от этанола с помощью концентрированной серной кислоты был получен этилен [1], ставший первым соединением ряда олефинов. Благодаря способности образовывать с хлором жидкий продукт, он получил название масло голландских химиков [2], от которого впоследствии было образовано наименование всего ряда простых ненасыщенных алифатических углеводородов. [c.7]
Приведенная на рис. 7.6 схема очистки этанола, сочетающая гидрирование и экстрактивную дистилляцию, позволяет получать этанол высокого качества, удовлетворяющий требованиям для пищевого продукта. Водно-спиртовый конденсат из сепаратора высокого давления 6 и этанольного скруббера 7 поступает в колонну 10, где выделяются эфир и углеводороды, которые возвращаются в процесс вместе с рециркулирующим этиленом. Спирт укрепляется в колонне предварительной ректификации 11, а затем подается в реактор гидрирования 12 и в колонну экстрактивной дистилляции 13. Сверху из этой колонны выводятся примеси в виде полимерного масла, а снизу — спирт, который направляется в последнюю ректификационную колонну 14. Остатки легких примесей из колонны 14 сжигают чистый этанол отбирается в виде бокового потока, а вода выводится снизу и возвращается в процесс. [c.229]
Катализаторы отличаются селективностью. Это значит, что они действуют на процессы избирательно, направляя его в определенную сторону. Например, этанол при пропускании над оксидом алюминия при 350° С превращается в этилен и воду, а при 250° С над медью превращается в уксусный альдегид с выделением водорода. [c.200]
Пары воды смешали с этиленом в молярном отношении 3 1 при давлении 8 МПа и температуре 227 °С в замкнутом реакторе, предназначенном для синтеза этанола. После окончания процесса давление газов в реакторе при неизменной температуре уменьшилось на 5%. Определите объемную долю паров этанола в реакционной смеси и процент превращения этилена в этанол. [c.368]
Измерения с парами воды проводились при 110 °С, а с ацетоном, метанолом и этанолом — при 45 °С. Для всех прочих смесей данные получены при комнатной температуре. Максимумы теплопроводности характерны для бинарных смесей водяного пара с азотом, кислородом, а также, по-видимому, с оксидом углерода, ацетиленом, этиленом и этаном [16]. [c.201]
Этилен получают термической переработкой погонов нефти, его мировое производство достигает нескольких десятков миллионов тонн. Этилен - бесцветный газ со слабым запахом, незначительно растворим в воде, умеренно - в этаноле, хорошо - в диэтиловом эфире. Этилен служит важнейшим сырьевым источником основного органического синтеза. Его применяют для производства этиленгликоля, этиленоксида, этанола, акрилонитрила, диок-сана, ацетальдегида, уксусной кислоты, стирола, пропионового альдегида, 1-пропанола, винилхлорида, винилацетата, дихлорэтана, полиэтилена. Т. самовоспл. 540 °С. Обладает слабым наркотическим действием. ПДК 50 мг/м . [c.294]
Пропилен получают совместно с этиленом при пиролизе и крекинге нефтяного сырья различных видов. Пропилен - бесцветный газ со слабым запахом. Мало растворим в воде, хорошо - в этаноле и уксусной кислоте. Пропилен служит сырьем для получения 2-пропано-ла, ацетона, кумола, акрилонитрила, глицерина, изопрена, полипропилена. [c.294]
Фенолы, муравьиная и серная кислоты (возможен гидролиз ), трифторэтанол, бензиловый спирт (при нагревании), смеси фенолов с водой, бензолом, хлорированными углеводородами Кроме указанных выше — уксусная кислота, водный этанол, симм. тетрахлорэтан, этилен-хлоргидрин и др. [c.18]
Этанол (С2Н5ОН) традиционно получают из этилена, который вырабатывается из дистиллята или СНГ посредством парового крекинга (см. гл. 15). Основной технологической стадией является гидролиз, т. е. присоединение воды к этилену. В одном из основных промышленных процессов это достигается при проведении следующей реакции [c.232]
Бутплкетон/бутанол -f 2% воды Жидкий этилен (130 атм., 80°С) Метилэтилкетон - - бутанол (испарение растворителя) Бутилкетон/метанол (38° С) Толуол/петролейный эфир Этилацетат/этанол Бензол/метанол Хлороформ/метанол Толуол/метанол Бутилкетон/метанол Бутилкетон/этанол [c.68]
В производстве этанола этилен абсорбируют 94—98%-ной (по весу) серной кислотой при температуре 55—85 °С и давлении 2—3 МН/м2 (20—30 атм). Абсорбцию осуществляют путем барботирования этилена через подаваемую противотоком к нему серную кислоту (например, в аппарате колонного типа), которая поглощает 997о этилена. Реакционную массу, содержащую 0,3—0,4 вес. ч. этилена (в форме этилсульфатов) на 1 вес. ч. кислоты, разбавляют 1,0—1,4 вес. ч. воды и нагревают при атмосферном давлении до 60—80°С. В этих условиях гидролизуется диэтилсульфат гидролиз моноэтилсульфата осуществляют в следующем аппарате при температуре около 100 °С. Этанол отделяют от разбавленной кислоты дистилляцией, получая водный спирт с концентрацией 50—65% (по весу). Разбавленную кислоту, содержащую 35—65% (по весу) Н2504, концентрируют и возвращают на стадию абсорбции. Абсорбцию пропилена, который химически активнее этилена, проводят в более мягких условиях, используя 85%-ную серную кислоту и температуру 25—30 °С. В остальном процессы непрямой гидратации этилена и пропилена аналогичны друг другу. [c.187]
Этиловый спирт сн,—СН —ОН ( винный спирт , этанол). Этиловый спирт получают сбраживанием сахара, а также присоединением воды к этилену в присутствии катализатора. В промышленности его используют в качестве растворителя и в качестве составной части лекарств, парфюмерных изделий, косметических средств, тонизирующих препаратов и наружных растираний. При этом к нему обычно примешивают яды (денатурируют), которые очень трудно удалить. Это делается для того, чтобы предотвратить его использование в качестве напитка. Этиловый спирт отличается от других спиртов тем, что его можно употреблять в виде различных напитков. В организме имеются ферменты, которые быстро разрушают спирт, окисляя его. Представление об этиловом спирте как возбуждающем средстве возникло в результате того, что первое проявление его действия заключается в подавлении активности сдерживающих центров. Изопропиловый спирт СНз—сн—СН3. Изопропиловый сппрт [c.207]
Этилен Вода Этанол Альдегид Лиэтиловый эфир Продукт полимеризации l l A i, l l B j. 1 2 А 2-РьЭтанол Ацетальдегид и формальдегид Этилен Этилацетат 2 2 А 2 Р. Г Ч Х К У Ph 2 0,4 0,475 0.020 0.055 [c.136]
Этилен и воду нагревают в теплообменнике 1 за счет теплоты реакционной смеси, выходящей кз гидрататора 3. В печи 2 с огневым нагревом испаряют оставшееся количество воды и нагревают смесь до 280—290°С. Затем парогазовая смесь поступает в гидрататор 3. Выходящие из гидрататора реакционные газы содержат этилен, пары воды, этанол, диэтиловый эфир, фосфорную кислоту. Во избежание коррозии последующей аппаратуры проводят нейтрализацию фосфорной кислоты водным раствором щелочи (на схеме не показано). После того как горячие реакционные газы отдадут свою теплоту исходной смеси в теплообменнике 1, пары спирта и воды конденсируются в сборнике 4 и холодильнике 5. Полная промывка газа идет в промывочной колонне 6 с насадкой. Непрореагирбвавшпй этилен вновь возвращается после сжатия и нагревания в гидрататор. Водный раствор спирта направляют на ректификацию. [c.268]
Контактные газы после выхода из реактора смешиваются со щелочью для нейтрализации унесенной фосфорной кислоты и после солеотДелителя, подогревателя и холодильника поступают в сепаратор высокого давления. Здесь сконденсировавшиеся спирт п пары воды отделяются от циркуляционного газа, который направляется на всас циркуляционного компрессора. Спиртовод-пая смесь (15—20% спирта) проходит сепаратор низкого давления, где после дросселирования из нее выделяется растворенный этилен, затем она подогревается в теплообменнике и подается в отпар-пую колонну. Выделившийся спирт направляется на ректификацию. Этот процесс осуществляется в одной колонне и дает возможность получать технический этанол с содержанием альдегидов и эфиров мепее 2,5%. При необходимости синтетический этанол после соответствующей очистки и дистилляции может быть доведен до кондиций пищевого. [c.33]
Пример. В промышленности этанол получают гидратацией этилена в присутствии Н3РО4 на кизельгуре при Г=473—523 К и Р=30—50X10 Па. В исходной реакционной смеси содержится этилен и вода в мольном отношении 1 1. [c.266]
При 20 °С для газовой реакции С2Н5ОН = С2Н4 + HjO константа Кр = 30 торр. Найдите равновесный состав, если исходная газовая смесь содержала этилен - 120, вода - 10, этанол — 40 торр. Жидкую смесь считать идеальной. [c.35]
ЭТИЛБРОМИД (бромэтан) С2Н5ВГ, —119 С, i n 38,4 °С d ° 1,4555, 1,42386 раств. в сп., эф., ацетоне, бензоле плохо — в воде (0,914 г в 100 г при 20 °С) со сп. образует азеотроп (97% Э., кип 37,6 °С) КПВ 6—11%. Получ. взаимод. НВг с этиленом или этанолом. Этилирующий агент, фумигант, компонент огнетушащих составов и этиловой жидкости. Раздражает слизистые оболочки, обладает иаркотич. и анестезирующим действием (ПДК 5 мг/м ). [c.716]
Если пропускать этанол над окисью алюминия (дегидратирующий катализатор), нагретой до 375° С, образуется этилен и вода, но при 300° С дегидратация над АЬОд приводит к простому эфиру [c.120]
Для ингибирования коррозии политиоэфиры особенно эффективно использовать вместе с алифатическими аминами (диэтилентриамин, диамин С15-С18 на основе таллового масла) или ненасыщенными эфирами молекулярной массы 290...300 (содержание аминов и эфиров в растворе, ингибир тощем коррозию, составляет 0,001...0,100 % по объему, политиоэфира — 0,001...0,020 % по объему). В качестве растворителя применяют воду, рассол, углеводороды, спирты (этилен- или пропиленгликоль, метанол, этанол, пропанол, бутанол), при этом образованию защитной пленки способствуют ароматические углеводороды. Низкомолекулярные спирты используют для получения вододиспергируемых растворов. [c.334]
Бис(4-хлорфенил)этанол-1 мало устойчив и при взаимодействии с неорганическими кислотами легко отщепляет молекулу воды и переходит в 1,1-бис(4-хлорфенил)этилен. Реакция начинает проходить уже при комнатной температуре. С повышением температуры процесс разложения ускоряется. Гомологи этого соединения также обладают довольно высокой акарицидной активностью, однако бис (4-хлорфенил) метанол практически не действует на взрослых клещей, но токсичен для их яиц. При замене метильной группы на карбалкоксильную получаются активные акарициды — хлорбензилаты (18) [c.109]
НгО Вода 100 СгНгСЬ ( )-1,2-Дихлор- этилен 48,35 СзНбО Этанол 78,3 44,4 1,1 94,5 4,4 [c.594]
На рис. 71 показана упрошенная технологическая схема получения этилового спирта методом прямой гидратации. Свежий и оборотный этилен компрессором 1 нагнетается в систему под давлением 70 ат и в смесителе 2 смешивается с водой (в соотношении НаО СаН4=0,65 -.1), подаваемой насосом высокого давления 3. В теплообменниках 4 и 5 смесь нагревается до 200 X за счет физического тепла продуктов реакции. В змеевиках трубчатой печи 6 с огневым нагревом паро-газовая смесь перегревается до 290 Х и проходит сверху вниз через слой находящегося в гидрататоре 7 фосфорнокислотного катализатора. Продукты реакции, содержащие этанол, из нижней части гидрататора поступают в тройник 8, где нейтрализуются щелочью и отделяются от образующихся солей [c.207]
Отщепление воды от спиртов проводят нагреванием спирта при высокой температуре в присутствии сильных минеральных кислот (1-12804, Н3РО4). При этом сначала образуется сложный эфир, который наряду с этиленом дает молекулу кислоты. Дегидратацию этанола ведут при 180 °С. [c.240]
О °С и 72,8 кДж/моль при 100-200 °С, этилен на том же катализаторе — 50,2 к/ моль при 110-120 °С, вода на АЬОз — 75,3 кДж/моль при 220-440 °С, этанол на ТЬОг — 58,6 кДж/моль при 50-100 °С, N2 на СГ2О3 — 33,5 кДж/моль при О °С, О2 на СггОз — 209,2 кДж/моль при О °С [c.159]
Этилен (этен) — газ, мало растворим в воде. Широко использу-тся в промышленном органическом синтезе для получения разнооб-1азных органических соединений, таких, как галогенопроизводные, пирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота [c.87]
Данные работы [55, с. 44] подтверждают результаты, изложенные выше. На системах полиметилметакрилат — вода, гептан, этанол политетрафторэтилен — гептан политрифторхлор-этилен — гептан, ацетон показано возрастание сорбции жидкостей при увеличении растягивающих напряжений, прикладываемых к полимерам, что связано с увеличением дефектности исследованных полимеров (рис. И.26). [c.98]
chem21.info



















