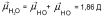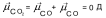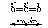Большая Энциклопедия Нефти и Газа. Полярность воды
Полярность - вода - Большая Энциклопедия Нефти и Газа, статья, страница 1
Полярность - вода
Cтраница 1
Полярность воды, как дальше будет показано, играет огромную роль н химических и электрохимических процессах. [1]
Полярность воды обусловливает возникновение водородных связей между атомами водорода одной молекулы воды и атомами кислорода соседних молекул ( рис. VII. [2]
Полярность этих растворителей ниже полярности воды, но выше полярности ОВ, плохо растворяющихся в воде. Хорошо смешиваясь с обоими компонентами, эти растворители способствуют смешению неполярного вещества с сильнополярным растворителем и являются как бы посредниками при растворении. [3]
Изменение плотно-родных связей является достаточная полярность сти воды с температурой, валентных связей водорода в исходных молекулах. [5]
По данным М. П. Гавриша, И. С. Галинкора и С. П. Малинина снижение полярности воды с ростом температуры способствует растворимости неполярных органических соединений. По мнению А. М. Блох, поверхностные силы минеральных частиц, как и температура, но еще более интенсивно снижают полярность связанной воды, тем самым существенно повышают растворимость УВ. Таким образом, поровые воды способны растворять огромные объемы жидких и газообразных УВ и тем самым обеспечивать их вынос из материнских пород. [6]
Поскольку неорганические полимеры - соединения, в которых ковалентная составляющая существенная, то полярности воды недостаточно и она как растворитель мало эффективна. Поэтому используют главным образом кислые или щелочные растворители, приводящие к разрыву связей М - О за счет протони-зации. [7]
Детектирование паров воды имеет свои трудности, связанные, в основном, с полярностью воды. Промышленный анализатор, предназначенный для определения НаО в концентрациях 0 - ДО-4 % в смеси с углеводородами [14], включал в себя хроматографическую колонку с по-лиэтиленликолем на флуоропаке 80, а в качестве детектора - электролитическую ячейку с PjOs. Предельная чувствительность к парам воды 5-ионизационного детектора составляет 5 - 10 - п моль / с [23], причем она возрастает при использовании в качестве газа-носителя неона и уменьшается в случае аргона. [8]
Причем положительный градиент концентрации наблюдается в случае растворов полярных и органических веществ, полярность которых меньше полярности воды, а отрицательный - в тех водных системах, где полярность растворенного вещества ( например, фенола) выше, чем воды. [9]
Жидкая вода состоит из короткоживущих скоплений ( кластеров) молекул, связанных друг с другом водородными связями. Полярность воды и сильно выраженная способность ее молекул образовывать водородные связи делает воду прекрасным растворителем для многих ионных соединений и других веществ, имеющих полярные молекулы. Вода диспергирует также амфипатические вещества, например мыла, с образованием агрегатов молекул, называемых мицеллами, в которых гидрофобные группы спрятаны внутри и не контактируют с водой, тогда как заряженные группы расположены на внешней поверхности. [10]
Неизбежным следствием этого является полярность молекул воды. Полярность воды делает понятным, почему ее молекулы ориентируются в электрическом поле, располагаясь положительными концами к отрицательному источнику поля, а отрицательными - к положительному источнику. Этим путем напряжение электрического поля понижается. Диэлектрическая постоянная является мерой этого понижающего действия и мерой полярности растворителя. [11]
Общий принцип, согласно которому структуры слоистого типа гораздо более обычны среди вновь образовавшихся минералов, специально рассматривался Андреаттой36; характерна тетраэдрическая координация ( RO4 ] для Si4 и А13 в алюмосиликатах. Сильная полярность воды и ее гидроксильных групп, очевидно, особенно благоприятствует образованию гексагональных и псевдогексагональных структур, в которых октаэдриче-ские группы [ ROm ( OH) n ] связываются ребрами октаэдров, в то время как образованные таким образом слои соединяются только вандерваальсовскими силами. Сперва образуются пластинчатые мицеллы, постепенно вырастающие до крипто -, микро - или даже макроскопических кристаллов. Ту же точку зрения, с которой Андре-атта рассматривал изменение полевых шпатов и фельд-шпатоидов во вновь образующиеся минералы слоистой структуры, можно также использовать и при изучении процесса превращения пироксенов либо амфиболов в соответствующие продукты. В последнем случае характерно образование минералов группы гетит - лепидокро-кит или в морской воде в условиях гальмиролиза глауконита, или, наконец, шамозита, тюрингита ( см. А. [12]
В последнее время в литературе начали появляться высказывания о пережатии пузырьков газа вследствие образования на границе раздела с нефтью плотных пленок ПАВ, препятствующих не только расширению газового пузырька при снижении давления, но и диффузии газа в пузырек. В эмульсиях этому способствует полярность воды, облегчающая адсорбцию ПАВ, Молекулы ПАВ ориентируются своими гидрофильными концами в сторону воды, образуя жидкие или твердые пленки. Наличием плотных пленок обусловливается стойкость водонефтяных эмульсий. Ко-гезионные силы молекул пленки ПАВ на границе жидкость - жидкость значительно слабее, чем на границе жидкость - газ. [13]
Установлено, что при 374 С взаимная растворимость УВ и воды становится неограниченной: образуется однородный водогазонефтяной раствор - флюиды находятся в надкритическом или близком к нему состоянии. Существенное повышение растворимости УВ с ростом давления и при снижении полярности воды делает реальным допущение, что состояние взаимной растворимости в системе поровая вода УВ наступает при более низкой температуре и, следовательно, на относительно небольших глубинах. Все это позволяет очень высоко оценивать роль водной эмиграции жидких и газообразных УВ в широком интервале глубин. [14]
Известно, что сверление и шлифовка металлов сильно облегчаются смачиванием водным раствором мыла и сапонина, а для стекла ту же роль играют растворы канифоли, камфоры и других поверхностно активных веществ в керосине. Эти факты находятся в полном согласии с вышеизложенным ( § 282 / полярность воды значительно выше полярности керосина, а полярность металлов значительно выше полярности воды. [15]
Страницы: 1 2
www.ngpedia.ru
Полярность воды - Справочник химика 21
| Рис. 2-3. Различные изображения полярности воды. |  |
ЧТО ДЛЯ ОЧИСТКИ некоторых веществ (например, бензойной кислоты), в молекулах которых содержатся способная к ассоциации полярная группировка и достаточно объемистый углеводородный радикал, могут быть использованы как растворители, обладающие весьма высокой полярностью (вода), так и неполярные (гексан). [c.19]
Углеводородная часть нефтешлама содержит, наряду с неполярными молекулами, высокомолекулярные соединения с гидрофильным строением. На границе с водной фазой она концентрирует дифильные молекулы, так как последние ориентируются гидрофильными участками в сторону полярной воды. [c.206]
В обшем случае неполярную жидкость называют маслом, а полярную -водой. [c.183]
Избирательное смачивание было исследовано П. А. Ребиндером. Рассмотрим это явление более подробно. Представим себе, что поверхность твердого тела находится в соприкосновении с полярной водой и каким-нибудь неполярным углеводородом. Тогда, если вода избирательно смачивает поверхность, т. е. если краевой угол 0, образуемый со стороны воды, О, поверхность называют гидрофильной. Согласно уравнению (VI, 9) этот случай имеет место при условии, когда аг, з > >01,3 или когда 02,3 — Ti, 3 > 0. Избирательное смачивание водой наблюдается обычно, когда разность полярностей между водой и твердым веществом меньше, чем между неполярным углеводородом и твердым веществом. К веществам с гидрофильной поверхностью относятся вещества с сильно выраженным межмолекулярным взаимодействием, например кварц, стекло, корунд, гипс, малахит, т. е. силикаты, карбонаты, сульфаты, а также окиси и гидраты окисей металлов. Из органических веществ в качестве веществ с гидрофильной поверхностью можно указать целлюлозу. [c.157]
Долгое время необычные свойства воды были загадкой для ученых. Выяснилось, что они в основном обусловлены тремя причинами полярным характером молекул, наличием неподеленных пар электронов у атомов кислорода и образованием водородных связей. Молекула воды (рис. X1V.2, а) может быть представлена в виде равнобедренного треугольника, в вершине которого расположен атом кислорода, а в основании — два протона (рис. XIV.2, б). Две пары электронов обобществлены между протонами и атомом кислорода, а две пары неподеленных электронов ориентированы по другую сторону кислорода. Длина связи О—И составляет 96 нм, а угол между связями 105°. Связь О—Н имеет полярный характер, молекула воды также полярна. Благодаря полярности вода хорошо растворяет полярные жидкости и соединения с ионными связями. Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода [c.371]
В эмульсиях I рода капельки неполярной жидкости (масла) распределены в полярной (воде). В эмульсиях [c.241]
Использованы значения д при со О, поскольку влияние релаксации существенно лишь на низких частотах. Как видно из рисунка, значения е ( ) для металлов выше, чем для полярной воды (кривая 3). При зтом отличия функций е (г ) для металлов и диэлектриков возрастает при переходе к более низким частотам. [c.86]
НО более низкой температуре. Неполярный метан кипит при —161,5 °С, а полярный аммиак — при —33 °С даже очень полярная вода имеет относительно низкую температуру кипения 100 °С. [c.31]
Из данных табл. 11 видно, что дисперсионный эффект является самым большим для всех молекул, кроме самой полярной — воды ориентационный вклад следует учитывать только для сильнополярных молекул, а индукционный эффект является незначительным для всех молекул. [c.280]
Поскольку неорганические полимеры — соединения, в которых ковалентная составляющая существенная, то полярности воды недостаточно и она как растворитель мало эффективна. Поэтому используют главным образом кислые или щелочные растворители, приводящие к разрыву связей М — О за счет протонизации. [c.13]
Характерной чертой эмульсионных систем является наличие развитой поверхности раздела между полярной (вода) и неполярной или слабополярной (мономер) фазами. Размеры, число и форма частиц, физико-химические свойства поверхности зависят от строения мономера, природы эмульгатора, его концентрации, соотношения фаз мономер—вода, pH водной фазы и наличия добавок. Поэтому прежде чем перейти к подробному анализу особенностей механизма и кинетики эмульсионной полимеризации, целесообразно рассмотреть различные типы эмульсионных полимери- [c.10]
Однако даже поверхностное ознакомление с фактами убеждает, что молекулярный вес является не единственным фактором, определяющим точку кипения. Так, например, метан, при молекулярном весе 16, кипит при —161 С, аммиак, при молекулярном весе 17, кипит при —33 С, а вода, при молекулярном весе 18, кипит при 100 С. Естественным объяснением этого противоречия является предположение, что силовые поля вокруг молекул имеют весьма разную интенсивность. Это явление обычно называют полярностью жидкости. Другими словами, неполярный метан со слабыми силовыми полями имеет низкую точку кипения, тогда как сильно полярная вода с высокой интенсивностью силовых полей кипит при абсолютной температуре втрое более высокой. Что эта картина верна, подтверждается параллелизмом, существующим в жидкостях одинакового молекулярного веса между точками кипения и диэлектрическими постоянными, которые являются прямой мерой интенсивности электрических сил вокруг молекулы. Сложность структуры молекулы также играет роль, на что указывает тот факт, что некоторые группы или радикалы, как, например, гидроксильная группа, всегда характеризуются высокой полярностью. Летучесть жидкости определяется, таким образом, в основном комбинированным действием молекулярного веса и полярности. [c.25]
Таким образом, по нашему мнению, свойства сорбированной воды и ее роль в процессах структурообразования в торфе не требует придания ей особых свойств. Высокие конформационная подвижность и гидрофильность макромолекул органической части торфа, широкий диапазон пор в нем, полярность воды вполне объясняют приведенные выше аномальные явления в торфяных системах. [c.53]
Хорошо известно, что именно эти взаимодействия в основном и определяют пространственную структуру белков [81]. Нативный белок существует в водной среде, и природа как бы решает оптимальную задачу — полярные аминокислоты располагаются на поверхности глобулы и взаимодействуют с водой, а неполярные — спрятаны внутрь глобулы и контактируют между собой. Аналогичная ситуация может возникнуть и в полипептидах если растворитель полярный (вода), то полярные аминокислоты стремятся оказаться снаружи в неполярных растворителях следует ожидать противоположного — неполярные аминокислоты будут стремиться оказаться на поверхности. [c.111]
И здесь действие мыла объясняется не только адсорбцией его на поверхности раздела, но и закономерной ориентировкой молекул и ионов мыла на этой поверхности. В этом случае на поверхности раздела между полярной водой и малополярным маслом молекулы мыла располагаются так, что своей гидрофильной полярной группой они обращены в сторону воды, а гидрофобной — углеводородным радикалом — в сторону масла. Такая закономерная ориентировка молекул сильно повышает прочность поверхностных слоев. [c.371]
В районе кромки, этой природной гра П ЦЫ, переохлажденные, покрытые льдами полярные воды соприкасаются с водами более теплыми. При таянии льдов верхний слой воды океана существенно опресняется, в результате изменяются гидрологические условия, возникают новые течения. Так ледники и айсберги вносят свой вклад в процессы циркуляции океанических толщ. [c.94]
Диоксан является универсальным растворителем отлично растворяет как полярные (воду), так и неполярные вещества (углеводороды). Техническое применение его ограничено вследствие токсичности. [c.488]
По характеру дисперсной фазы и дисперсной среды различают эмульсии двух типов эмульаш прямого типа - неполярной жидкости (например, нефти) в полярной воде (Н/В) и обратного типа - полярной жидкости в неполярной, например воды в нефти (В/Н). Устойчивые нефтяные эмульсии, образующиеся при добыче нефти и ее обессоливанин, как правило, относятся к эмульсиям лиофобньш, второго типа (В/Н). [c.16]
Кроме того, в кристаллах цеолитов высокое содержание воды, которая удаляется из кристаллов при нагревании их до 300 °С. В обезвоженном состоянии кристаллическая решетка цеолитов обладает высокой адсорбционной способностью по отношению к парам воды и газам. Сродство цеолитов к воде больше, чем к другим компонентам газа, так как решетка цеолита стремится восстановить максимальное содержание воды. Это объясняется сильной полярностью воды и щелочей в цеолито-вой решетке. Вследствие этого сильнее всего адсорбируются те компоненты газовой смеси, которые обладают наибольшим ди-польным моментом. Полярность при адсорбции является, таким образом, решающим фактором чем выше полярность компонентов газовой смеси, тем активнее он проникает в цеолито-вую решетку. Так, например, молекула воды по причине своей высокой полярности всегда вытесняет молекулы меркаптанов и сероводорода. То же самое можно сказать о диоксиде углерода и сероводороде сероводород способен вытеснять молекулы диоксида углерода вследствие более высокой полярности. Таким образом, в процессе адсорбции в адсорбере создается зона вода - меркаптаны - сероводород диоксид углерода, т.е. на цеолитах имеет место вытеснительная адсорбция. [c.65]
Мицеллы асфальтенов и нефтяных смол имеют структуру, точно противоположную структуре сферических мицелл мыла по Гартлею [81].В мицеллах мыла неполярные углеводородные группы молекул мыла направлены внутрь, а поляргтые руппы наружу. Мицеллы мыла сольватируются в полярной воде, коллоидные мицеллы битумов в неполярных маслах. В мицеллах асфальтенов и нефтяных смол полярные группы направлены внутрь мицелл, неполярные углеводородные остатки, напротив, наружу. Схема такой мицеллы представлена на рис.8. В мицеллах асфальтенов содержатся более полярные вещества, вплоть до неорганических солей, например, ЫаС1. К важр ым компонентам относятся соли металлов. Следует отметить, что среди веществ, находящихся внутри мицелл, можно обнаружить вещества, легко растворимые в воде. Это особенно удивительно потому, что нефти, из которых получен битум, целые геологические периоды контактируют с водой. Несмотря на это, вещества, легко растворимые в воде, не экстрагируются из мицелл, Они хорошо защищены в ми- [c.28]
Успехи органической химии привели к синтезу многих но-еых органических растворителей с большим диапазоном разнообразных свойств, а с развитием лабораторной техники появилась возможность работать с новыми неорганическими растворителями при повышенных и пониженных температурах и без-Доступа влаги. Все это позволило в некоторых случаях замедлить воду, являющуюся до сих пор универсальным растворителем. Особенно часто воду заменяют другими растворителями при кислотно-основноМ титровании. Причинами служат плохая растворимость некоторых веществ в воде, что особенно характерно для многих органических соединений мешающее влияние гидролиза, например, при титровании кислот в присутствии хлоридов или соответственно ангидридов кислот нивелирующий эффект растворителя, из-за которого невозможно Проводить дифференцированное титрование сильных кислот или оснований в их смеся х высокая полярность воды, что-исключает возможность диффренцированного титрования карбоновых кислот в их смесях. Применению неводных растворителей способствовало также создание чувствительных и надежных инструментальных методов индикации точки эквивалентности. [c.337]
В некоторых работах (5) для выделения дикарбоновых кислот из их смесей с монокарбоновымн используется избирательная экстракция в среде полярного растворителя или воднополярной среде (глико-ли, моно- и диэфиры гликолей, диоксан, формальдегид), нротивоточ-ное распределение между неполярным растворителем (петролейный эфир) и полярным (вода, гликоли). [c.137]
Следует отметить, что для паро-газовых смесей, образующихся при исследовании водных растворов органических веществ, применимы не все типы детекторов, так как пики полярной воды очень часто перекрывают пики других ингредиентов. Наиболее пригодны в данном случае детекторы, нечувствительные к водяным парам, например пламенно-нонизационный [59]. [c.74]
Вода поэтому — наиболее подходящий растворитель для проявления кислотных свойств не только потому, что обладает значительной основностью и легко. отнимает прттон от кислоты, но и из-за высокой диэлектрической постоянной (Z> = 78,5), способствующей диссоциации. В водном растворе кислоты типа НВ ионные пары В-Н3О+ практически отсутствуют из-за высокой полярности воды они полностью диссоциированы на В и HsO+. Однако [c.39]
Для определения коэффициента распределения в системах жидкость—пар в качестве растворителя можно использовать многие жидкости, которые, однако, не должны перекрывать при хроматографическом анализе зоны выхода определяемых компонентов. В случае слабополярных и полярных соединений предпочтение обычно целесообразно отдать полярным селективным растворителям, например, таким, как вода. Выбор воды в качестве растворителя для проведения хромато-распределительных опытов в системе жидкость—пар имеет также то преимущество, что вода не дает сигнала при использовании пламенно-ионизацион-ного детектора. Вода является очень полярным и селективным растворителем. Полярность воды, определенная нами по методу Роршнейдера, оказалась равной 115 единицам, т. е. вода значительно полярнее, чем р,Р -оксидинропионитрил, полярность которого равна 100 единицам (определение проводилось в статических условиях при 50° С для бензола и циклогексана). [c.58]
Напомним, что основной вклад в нелинейность изотермы адсорбции вносит гетерогенность поверхносш адсорбента. Поэтому основным способом повышения линейной емкости является подавление наиболее сильных адсорбционных центров, которые присутствуют на поверхности, как правило, в небольших концентрациях. Исключение сильных активных центров осуществляют обычно путем дезактивации адсорбента (полярного) водой или другими сильно адсорбируемыми дезактивирующими агентами, такими, как глицерин, диэтиленгликоль, метанол, которые могут быть использованы и для дезактивации неполярных адсорбентов типа активного угля. Вору или другой модификатор добавляют к адсорбенту в строго определенном количестве, так чтобы его было достаточно для полного покрытия наиболее [c.17]
Вода содержится в самых различных смесях. Вследствие полярности вода образует водородные связи, однако при этом во многих веществах не растворяется. Эти фак торы и определяют удерживание воды в хроматографи ческой колонке на различных жидких фазах. В том случае когда вода в жидкой фазе не растворяется, она выходит из колонки в самом начале, даже если последующие ком поненты кипят пр г более низкой температуре. Еслг применить в качестве газа-носителя азот, то пик воды записывается по другую сторону от нулевой линии, - ак как теплопроводность паров воды выше, чем у азота. Пик получается несимметричным и размытым. [c.156]
Применительно к процессу окисления изомеров ксилола изучены растворители различной природы и полярности (вода, водные щелочные растворы, жирные и ароматические кислоты, их нитрилы, алифатичеокие углеводороды, хлоропроизводные, ароматические углеводороды, нитро- и хлорогтроизводные ароматических углеводородов и др.). При 01жлении я-ксилола растворители в зависимости от их природы вдогут играть различную роль — инициировать процесс (кислотные полярные растворители) илц не принимать участия в реакционных превращениях и по существу выполнять функции разбавителя (неполярные растворители). На глубоких стадиях окисления, например,при окислении /г-толуиловой кислоты кислотные растворители (особенно бромуксусная кислота) заметно промотируют реакцию. [c.144]
chem21.info
Полярность
Ковалентная связь бывает полярной и неполярной.
Ковалентная неполярная связь образуется между атомами элементов с одинаковой электроотрицательностью (ЭО)1. В этом случае электронная плотность связи распределена симметрично вокруг ядер соединённых атомов.
Такая связь реализуется прежде всего в молекулах простых веществ: Н2, O2, Cl2, N2, а также между одинаковыми атомами в симметричных молекулах: Н3С–СН3 (этан), Н2С=СН2 (этилен), НО–ОН (пероксид водорода), h3N–Nh3 (гидразин).
Ковалентная полярная связь образуется между атомами разных элементов-неметаллов, отличающихся электроотрицательностью. В этом случае электронная плотность связи смещена к более электроотрицательному атому, что обуславливает наличие на нём частичного отрицательного заряда δ– 2, а на другом атоме - частично положительного заряда δ+, как, например в молекуле НСl. Такая молекула представляет собой диполь, так как центры распределения положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии l.
Мерой полярности ковалентной связи служит её дипольный момент μсв. = δ ∙ l, где δ – заряд полюса диполя, а l – длина диполя. 
Дипольный момент – величина векторная, причём за положительное направление обычно принимают направление от δ+ к δ–.
Единицей измерения полярности ковалентной связи является Дебай (Д или D): 1Д = 3,3 ∙ 10-30 Кл ∙ м.
Величины полярности некоторых ковалентных связей
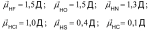
Следует различать полярность ковалентной связи и полярность молекулы. Полярность ковалентной связи зависит от величины электроотрицательности связанных атомов, а полярность молекулы - от полярности ковалентной связи и от геометрии молекулы.
Величина дипольного момента ковалентной связи является мерой полярности двухатомной молекулы.
Дипольный момент многоатомной молекулы равен векторной (геометрической) сумме дипольных моментов отдельных ковалентных связей.
| В молекуле h3O | В молекуле CO2 |
|
|
|
|
|
|
| Молекула воды полярна, т. к. образована с помощью двух ковалентных полярных связей Н-О и имеет угловую форму. Валентный угол Н-О-Н составляет 104,5˚, поэтому у атома кислорода с частичным отрицательным зарядом δ- и двумя неподелёнными электронными парами деформируется отрицательный полюс молекулы, а у атомов водорода с зарядом δ+ положительный. Молекула воды – диполь. | Связи С=О в молекуле углекислого газа полярны, а молекула не полярна, т. к. атом углерода находится в sp-гибридном состоянии, обуславливающем линейное строение молекулы. |
Молекула является полярной, если она содержит ковалентные полярные связи и имеет несимметричное строение, при котором центры расположения положительного и отрицательного зарядов не совпадают.
Дипольные моменты симметрично построенных молекул СО2 и SO3 равны нулю, хотя связи С=О и S=О полярны.
Значения дипольных моментов как ковалентной связи, так и молекулы в целом являются важными характеристиками реакционной способности веществ. Как правило, чем больше полярность системы, тем выше её реакционная способность. Вещества с сильнополярными ковалентными связями под действием полярных молекул растворителя способны к гетеролитическому разрыву с образованием противоположно заряженных ионов. Например, водный раствор хлороводорода является сильной кислотой, так как сильно полярные молекулы НСl в воде практически полностью распадаются на ионы (степень электролитической диссоциации α = 0,95 или 95 %):
HCl  H++ Cl¯.
H++ Cl¯.
Вещества, молекулы которых полярны, обычно имеют более высокие температуры плавления и кипения, чем вещества с приблизительно той же молярной массой, молекулы которых неполярны.
studfiles.net
Молекула воды, полярность - Справочник химика 21
Физические свойства. Чистая вода представляет собой бесцветную прозрачную жидкость без запаха и вкуса. Она существует в трех агрегатных состояниях твердое — лед, жидкое и газообразное — водяной пар. При О °С твердая и жидкая фазы находятся в состоянии динамического равновесия, поэтому температура плавления льда равна О °С. При 1(Ю °С в равновесии находятся жидкая и газообразная фазы. Температура кипения воды равна 100 °С. При - -4°С она имеет наибольшую плотность, равную 1 г/см . Выше или ниже этой температуры плотность воды меньше 1 г/см . Эта особенность отличает воду от всех других веществ, плотность которых с понижением температуры увеличивается. При переходе воды из жидкого в твердое состояние происходит увеличение объема и уменьшение плотности из 92 объемов жидкой воды образуется 100 объемов льда. Молекула воды полярна и построена по типу треугольника, в вершине которого находится электроотрицательный атом кислорода, а в углах оснований — водород. Валентный угол равен 104,5° (рис. 25). [c.162] Молекулы воды полярны. Что это значит [c.117]Молекулы Н О и СО2 каждая содержит по две полярных связи (Н—О—Н и соответственно 0=С=0). Почему молекула СО2 неполярна, а молекула воды полярна [c.56]
Дипольный момент молекул есть векторная сумма диполь-ных моментов связей. Если геометрия молекулы такова, что дипольные моменты связей компенсируют друг друга, то дипольный момент равен нулю и молекула неполярна даже при наличии в ней поляризованных связей (молекула 05). Молекула воды полярна (уголковая форма). [c.106]
ИОН-ДИПОЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ. Молекула воды полярна. Кислородный конец обогащен электронами по сравнению с водородным концом , так как электроотрицательность кислорода больше, чем водорода. Химик отметил бы это неравное распределение электронной плотности, написав символ б + у более положительного конца молекулы и символ б — [c.29]
Известно, что хорошим растворителем многих веществ является вода. Это объясняется тем, что молекулы воды полярны. Такая полярная частица — диполь, электростатически взаимодействуя с полярными частицами твердого тела, способствует отрыву последних от поверхности кристалла. [c.143]
Молекула воды — полярная молекула (рис. 6.24 следует обратить I внимание на то, что дипольный момент принято представлять в виде век- i тора, направленного от положительного заряда к отрицательному). [c.166]
Этот процесс можно представить следующим образом. Молекула воды полярна, а кристаллы соли, как известно, состоят из ионов. Молекулы воды будут притягиваться к ионам соли. Если сила этого взаимодействия достаточна, чтобы отделить ион от кристалла, то ион переходит в раствор. Так переходит в раствор ион за ионом. [c.129]
Таков же механизм связывания и иммобилизации молекул воды полярными группировками ряда высокомолекулярных веществ, в частности белков. [c.43]
В молекуле воды имеются две связи О—Н. Кислород сравнительно более электро-нофильный элемент, чем водород. В результате этого связь О—Н полярна, причем вектор полярности направлен от Н к О (рис. 5-8, а). Область молекулы HgO, где расположен кислород, приобретает частичный отрицательный заряд (26"), а у атомов водорода частичный заряд положителен (б+). Векторы полярности в молекуле воды расположены, как уже указывалось, под углом 104, 5°. Результирующий вектор молекулы HgO находим по правилу сложения векторов — строим параллелограмм (рнс. 5-8, б). Как видно из рисунка, молекула воды полярна, это диполь. Дипольный момент равен 1,84 Д. [c.94]
Какие из перечисленных факторов определяют более высокую по сравнению с кислородом и водородом температуру кипения воды молекула воды угловая, валентный угол равен 104,5° молекула воды полярна в молекуле воды две химические связи между молекулами воды образуются водородные связи молекула воды трехатомна [c.124]
Диссоциация воды становится понятной, если учесть, что связь между одним из атомов водорода и атомом кислорода в молекуле воды полярна. Диссоциация протекает по следующей схеме [c.96]
Распад веществ на ионы происходит с поглощением теплоты. Очевидно, в соответствии с принципом Ле Шателье, с повышением температуры раствора степень диссоциации увеличивается. Диссоциация электролитов на ионы происходит не только при их растворении в воде, но и в некоторых других растворителях, например в муравьиной кислоте, винном спирте и ацетоне, молекулы которых, как и молекулы воды, полярны. В веществах неполярных и малополярных, например в хлороформе, сероуглероде и эфире, ионизация электролитов не происходит. Об ионизирующем действии того или иного растворителя судят по его диэлектрической постоянной. [c.197]
Адсорбционная связь — истинная гидратация. В гидрофильных коллоидных системах она осуществляется путем связывания полярных молекул воды полярными группами высокополимеров. Процесс гидратации экзотермичен. Так, [c.353]
С практической точки зрения единственной целью изучения дисперсионных взаимодействий является вычисление энергий взаимодействия, вызываемых силами, действующими между растворенными веществами в воде. По мнению автора, в настоящее время невозможно производить надежные расчеты такого рода. Только недавно были проведены подробные расчеты в гораздо более простом случае взаимодействия насыщенных и ненасыщенных молекул известной геометрии и взаимной ориентации в отсутствие воды, и даже эти расчеты для проверки их состоятельности нуждаются в использовании результатов экспериментальных измерений и не могут претендовать на то, чтобы надежно предсказать ожидаемую силу взаимодействия между данными молекулами. В водном растворе проблема становится еще более трудной, так как здесь необходимо оценивать небольшую разность между энергиями взаимодействия вода — растворенное вещество, с одной стороны, и вода — вода, растворенное вещество — растворенное вещество — с другой. Дело осложняется еще и тем, что молекулы воды полярны и не имеют сферической формы. Вполне вероятно, что различные но своей геометрии и полярности растворенные вещества по-разному взаимодействуют с молекулами воды. Существующее положение можно проиллюстрировать сопоставлением следующих точек зрения 1) дисперсионные силы не должны вносить значительный вклад в энергию взаимодействия углеводородов в воде, так как поляризуемость на единицу объема очень близка для воды и гексана [54] 2) как отмечалось выше, дисперсионные силы должны вносить существенный вклад в энергию взаимодействия растворенных веществ между собой или с растворителем, молекулы которого больше по размеру молекул воды [48]. [c.317]
ВОДЫ связаны ковалентно, положительные и отрицательные заряды распределены в молекуле неравномерно. Неизбежным следствием этого является полярность молекул воды. Полярность воды делает понятным, почему ее молекулы ориентируются в электрическом поле, располагаясь положительными концами к отрицательному источнику поля, а отрицательными — к положительному источнику. Этим путем напряжение электрического поля понижается. Диэлектрическая постоянная является мерой этого понижающего действия и мерой полярности растворителя. Диэлектрическая постоянная воды 80, бензола 2. [c.28]
Наличие полярности молекул воды обусловлено тем, что атомы водорода в молекуле воды расположены не на одной прямой, а под углом 105° (фиг. 3). По этой причине в водных растворах ионы электролитов гидратируются, т. е. в результате электростатического притяжения заряженных ионов они присоединяют полярные молекулы воды. Полярность молекул воды заставляет их правильно ориентироваться в пространстве вокруг ионов, находящихся в растворе. [c.12]
Такое распределение аминокислот объясняется в основном свойствами воды. Молекулы воды полярны и образуют водородные связи как между собой, так и с другими полярными молекулами (гидратация молекул). Неполярные молекулы не гидратируются. С другой стороны, внедрение неполярной молекулы в среду молекул воды требует разрыва водородных связей между молекулами воды. Поэтому возникают силы, стремящиеся уменьшить поверхность раздела между водной и неполярной фазой, что и приводит к объединению неполярных молекул между собой, а в случае белков — к выжиманию гидрофобных радикалов из водной среды внутрь глобулы. [c.33]
Молекулы воды полярны. Они имеют не линейную, а треугольную форму, вследствие чего распределение заряда оказывается асимметричным. Ядро атома кислорода оттягивает электроны от атомов водорода, и вокруг последних возникает область с общим положительным зарядом. Если вокруг атома кислорода описать тетраэдр так, чтобы в двух его углах находились атомы водорода, то два других угла тетраэдра окажутся электроотрицательными. Таким образом, молекула воды представляет собой полярную структуру [c.125]
Адсорбционная связь — истинная гидратация. В гидрофильных коллоидных системах она осуществляется путем связывания полярных молекул воды полярными группами высокополимеров. Процесс гидратации экзотермичен. Так, А. В. Думанский отмечает, что при адсорбции 1 г воды любым адсорбентом (безразлично, органическим или неорганическим), выделяется около 75 шл тепла. При этом наибольший тепловой эффект дает первый адсорбционный сдой, последующие — во много раз меньший. [c.353]
Таким образом, молекулы типичных ПАВ, сочетая в себе одновременно полярные и неполярные свойства, являются д и ф и л ь и ы м и, т. е. проявляют сродство к воде (гид-рофильность) и к маслам (олеофильность, или липофиль-ность). Другими словами, в молекулах типичных ПАВ сочетаются две противоположные тенденции. Нерастворимый в воде углеводородный радикал стремится выйти в близкую по полярности фазу, выталкивается из воды. Этому способствует интенсивное взаимное притяжение полярных молекул воды друг к другу (силы когезии воды). Эти силы значительно больше, чем силы взаимодействия между углеводородными радикалами и молекулами воды. Полярная же группа определяет обратную тенденцию — растворимость ПАВ в воде. [c.6]
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Ее химическая формула Н2О. Молекулярная масса 28,016. По физическим свойствам вода значительно отличается от других веществ. Например, практически все вещества при охлаждений сужаются, а при нагревании расширяются. Вода же расширяется при замораживании и расширяется почти на 10%. Ядра атомов водорода и кислорода расположены в углах равнобедренного треугольника. Центры тяжести положительных и отрицательных зарядов не совпадают. Молекула воды полярна, наличие двух разноименных полюсов создает силовое поле в ее молекуле. Благодаря взаимодействию этих полей молекулы воды способны агрегироваться и образовывать дигидроли (Н20)г и тригидроли (Н20)з. [c.78]
Чем больше разность полярностей жидкостей, обра- зующих границу раздела, тем больше поверхностное натяжение. Например, молекулы бутилового спирта, так же как и молекулы воды, полярны. Соответственно этому величина поверхностного натяжения на границе раздела бутилового спирта с водой небольшая — 1,6 мН/м. Молекулы углеводородов неполярны, поэтому поверхностное натяжение на границе раздела воды с октаном, керосином, а также с нефтями сравнительно велико. [c.186]
Доти установил, что пластификация приводит к повышению величины lgDo и уменьшению отрицательных значений теплоты и энтропии растворения водяных паров в сополимере винилхлорида с винилацетатом (табл. 17). Повышение энтропии растворения водяного пара при пластификации полимера свидетельствует о том, что молекулы воды могут свободнее мигрировать в пластифицированном полимере в отличие от исходного, в котором наблюдается прочная фиксация молекул воды полярными группами полимера. [c.174]
Аналитическая (гигроскопическая) влага зависит от гигроскопичности топлива, его пористости, капиллярности и свойств поверхности. Поскольку молекулы воды полярны, то они удерживаются на внутренней поверхности ТГИ водородными связями и ван-дер-ваальсовыми силами. Влага ТГИ в значительной мере определяется их составом и степенью химической зрелости. [c.42]
Механизм обезвожршания и обессоливания нефти на установках ЭЛОУ заключается в следующем. Молекулы воды — полярные частицы ( с дипольный моментом 6,17 10 Кл м и диэлектрической проницаемостью 78,3 Д при 25 °С). В переменном электрическом поле частицы водной эмульсии вибррфуют, многократно меняя свою конфигурацию в соответствии с частотой переменного тока 50 Гц. Скорость колебаний возрастает при повышенной температуре, снижающей вязкость нефти. В результате столкновений частиц эмульсии, оболочка которых нарушена деэмульгатором, происходит их слияние, укрупнение и осаждение. Крупные кап- [c.696]
На нижней части рис. 7-2 изображен ряд противоположно заряженных ионов серебра и хлорид-ионов на поверхности частицы хлорида серебра. Если в маточном растворе присутствует изlбытo к ионов серебра, первичный адсорбированный слой будет состоять, как показано, из ионов серебра, и поверхность приобретает сум марный полож И-тельный заряд. Молекулы воды полярны, поэтому они могут быть [c.227]
Теория позволяет рассчитать интеграл кластерообразования, а также размеры кластеров каждого компонента. При рассмотрении связи теории образования кластеров с другими более ранними теориями растворов, например с классической теорией Флори—Хаггинса [3], Зимм и Ландберг отмечают, что наше рассмотрение, интерпретируя экспериментальные результаты на молекулярном уровне, не предполагает замену предыдущих теорий, а является дополнением к ним . Анализ, который будет пердставлен ниже, основан на одновременном использовании этих двух теорий. Сорбция воды неполярными полимерами (полиолефинами, полистиролом) очень низка и адекватно описывается в рамках общепринятой термодинамики растворов (теория Флори — Хаггинса). Для системы полярный полимер— вода возрастание сорбции с увеличением относительной влажности происходит значительно более резко, чем это следует из предсказания теории Флори. Такой эффект не удивителен, так как эта теория основана на предположении статистического распределения компонентов и не учитывает специфического связывания молекул воды полярными группами полимера, а также взаимодействия молекул воды между собой, обусловливающего неравномерное распределение низкомолекуляриого вещества. [c.420]
Реакции кислот и оснований в растворах - это в принципе ионные реакции. Ионы в растворах появляются в результате диссоциации ионных соединений или ионизации и диссоциации молекул с поляризованными ковалентными связями. Кристаллическая структура ионных соединений (образующих в твердом состоянии ионную кристаллическую решетку) разрушается при воздействии молекул воды — полярного растворителя — с образованием гидратированных ионов (аква-ионов), Ион, который в кристаллической решетке окружен другими ионами, в аква-ионе окружается молекулами растворителя. Такой процесс мы наблюдаем, например, при растворении Na l или NaOH. [c.9]
Раствор электролита мы представляей в виде ионов, расположенных среди молекул растворителя. Известно, Что молекулы воды полярны, т. е. один конец молекулы, представляемой в виде удлиненного тела, заряжен положительно, а другой несет равновеликий отрицательный заряд. Ионы электролита, находящиеся в воде, окружены оболочкой полярных молекул воды, т. е. гидратированы. Гидратация иона сопровождается освобождением определенного количества энергии, в случае дегидратации требуется затрата такого же количества энергии. [c.35]
Вода катализирует протекание многих реакций. Например, щелочные металлы взаимодействуют при комнатной температуре только в присутствии следов воды. Так как молекулы воды полярны, то они хорошо растворяют многие полярные и диссоциирующие на ионы соединения. В воде также хорошо растворимы вещества, образующие с водой водородные связи (SO2, Nh4, 2H5OH и др.). Растворимость в воде малополярных веществ низкая. [c.391]
В табл. 2.4 приведены данные по растворимости различных аминокислот в воде при нейтральных pH, которые дают возможность проверить наши полуинтуитивные рассуждения. Используя принцип подобное растворяется в подобном , а также то обстоятельство, что молекулы воды полярны, можно сказать, что большая часть представленных данных качественно согласуется с нашими выводами. Однако к этим данным не следует подходить с точными количественными мерками, так как в табл. 2.4 приводятся растворимости цвиттерионных форм аминокислот, тогда как нас интересуют свойства аминокислотных боковых групп как составных частей пептида. [c.52]
Молекула воды полярна и обладает определенным дипольным моментом. Вследствие этого молекулы воды соответствующим образом ориентируются по отношению друг к другу, образуя структурированную систему. Попадая в поле действия иона, молекулы воды образуют вокруг него гидратную оболочку. Указанное взаимодействие сопровождается разрушением структуры самой воды (эффект разупорядочения). Если вновь возникающая упорядоченность в расположении молекул воды вокруг иона меньше, чем в самой структурированной воде, то наблюдается так называемая отрицательная гидратация, заключающаяся в том, что молекулы воды вблизи иона обладают большей подвижностью, чем в чистой воде. В частности, отрицательная гидратация свойственна ионам К, КЬ, Св, С1 и I, а положительная—ионам Ка, и, Са и Ва. Аналогичные явления происходят также по катионным и анионным центрам органических молекул, в том числе и макромолекул. Таким образом, известная часть молекул воды в клетке находится в связанном состоянии за счет участия в процессах гвдратации. [c.432]
chem21.info
Полярность - вода - Большая Энциклопедия Нефти и Газа, статья, страница 2
Полярность - вода
Cтраница 2
Таким образом, по нашему мнению, свойства сорбированной воды и ее роль в процессах структурообразования в торфе не требует придания ей особых свойств. Высокие конформационная подвижность и гидрофильность макромолекул органической части торфа, широкий диапазон пор в нем, полярность воды вполне объясняют приведенные выше аномальные явления в торфяных системах. [16]
Известно, что сверление и шлифовка металлов сильно облегчаются смачиванием водным раствором мыла и сапонина, а для стекла ту же роль играют растворы канифоли, камфоры и других поверхностно активных веществ в керосине. Эти факты находятся в полном согласии с вышеизложенным ( § 282 / полярность воды значительно выше полярности керосина, а полярность металлов значительно выше полярности воды. [17]
В системе, образованной из полярных растворителя и растворенного вещества, вследствие сильного межмолекулярного взаимодействия между ними на поверхности мембраны сорбируется тот компонент смеси, полярность которого выше. Поэтому у таких систем градиент концентрации в связанном слое может быть как отрицательным ( рис. 5 - 11 6), так и положительным ( рис. 5 - 11, а) в зависимости от относительной полярности компонентов раствора. Причем положительный градиент наблюдается в тех растворах полярных и органических веществ, полярность которых меньше полярности воды, а отрицательный - в тех водных системах, где полярность растворенного вещества ( например, фенола) выше, чем воды. Поэтому для систем, у которых в связанном слое профиль изменения концентраций соответствует рис. 5 - 11, а, с увеличением давления селективность должна повышаться, а для систем, профиль концентрации которых соответствует рис. 5.11, б, - снижаться. [19]
Кроме того, в кристаллах цеолитов высокое содержание воды, которая удаляется из кристаллов при нагревании их до 300 С. В обезвоженном состоянии кристаллическая решетка цеолитов обладает высокой адсорбционной способностью по отношению к парам воды и газам. Сродство цеолитов к воде больше, чем к другим компонентам газа, так как решетка цеолита стремится восстановить максимальное содержание воды. Это объясняется сильной полярностью воды и щелочей в цеолито-вой решетке. Вследствие этого сильнее всего адсорбируются те компоненты газовой смеси, которые обладают наибольшим ди-польным моментом. Полярность при адсорбции является, таким образом, решающим фактором: чем выше полярность компонентов газовой смеси, тем активнее он проникает в цеолито-вую решетку. Так, например, молекула воды по причине своей высокой полярности всегда вытесняет молекулы меркаптанов и сероводорода. То же самое можно сказать о диоксиде углерода и сероводороде: сероводород способен вытеснять молекулы диоксида углерода вследствие более высокой полярности. Таким образом, в процессе адсорбции в адсорбере создается зона: вода - меркаптаны - сероводород - диоксид углерода, т.е. на цеолитах имеет место вытеснительная адсорбция. [20]
Гарди, Лангмюира и Гаркинса, адсорбция всегда связана с ориентацией адсорбирующихся молекул в пограничном слое. Поэтому типично поверхностно-активными являются вещества с полярными молекулами резко выраженной асим-метрич. Такие асимметричные молекулы ориентируются в пограничном слое, а следовательно и адсорбируются тем сильнее, чем больше разнссть полярностей обеих соприкасающихся фаз, причем адсорбция сопровождается уравниванием этой разности полярностей в пограничном слое, происходя поэтому обычно только тогда, когда полярность адсорбирующегося вещества лежит между полярностями обеих фаз системы. Этим правилом уравнивания полярно-с т е и объясняется то обстоятельство, что из водных растворов на поверхности раствор - воздух или раствор-пар адсорбируются поверхностно-активные растворенные вещества, полярность к-рых в чистом состоянии меньше полярности воды. Из газовых же сред на твердых адсорбентах адсорбируются, наоборот, наиболее полярные компоненты газовой смеси, т.к. твердые тела всегда полярнее окружающей их газовой среды. [21]
Наряду с высоким поровым давлением существенное влияние на вынос УВ из материнских толщ оказывают химически и физически связанные воды, переходящие в свободную фазу в процессе литогенеза. Связанная вода при выходе из поля воздействия поверхностных сил характеризуется повышенными агрессивностью и растворяющей способностью. По мнению В. Ф. Симоненко, структура отжимаемой воды, отличаясь от той, которая была ей свойственна в связанном состоянии, в то же время отличается от структуры свободной воды. В таком состоянии отжимаемая вода находится при фильтрации по капиллярной ( субкапиллярной) системе уплотняющихся глинистых пород. Для оценки роли связанной воды в эмиграции УВ В. Ф. Симоненко рассмотрена растворяющая способность воды в связи с изменением ее полярности. Как известно, в области низкой температуры ( 10 - 40 С) вода является популярным растворителем с очень высокой диэлектрической постоянной. В области высоких температур полярность воды невелика. [22]
Страницы: 1 2
www.ngpedia.ru
Полярность - молекула - вода
Полярность - молекула - вода
Cтраница 3
На положение таких центров оказывают влияние в основном величина зарядов и равномерность их распределения. Именно полярностью молекул воды в основном можно объяснить способность ее растворять многие вещества. [32]
Благодаря этой полярности молекулы воды стремятся сблизиться; возникающие между ними притяжения называют водородными связями. [33]
Согласно этим представлениям на ионы диссоциируют молекулы с ионной и полярной химической связью. Диссоциация обусловлена полярностью молекул воды. В целом молекула воды не заряжена. [34]
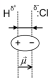
Принцип действия микроволновой печи заключается в использовании воды, содержащейся в самой пище В печи магнетроном ( I) испускаются микроволны. Микроволны, проникая в пищу, вследствие полярности молекул воды ( 2), вызывают ихвращение. Вращение молекул приводит к выделению энергии из-за силы трения, возникающей между молекулами воды и частицами пищи, Лечь хорошо изолирована 3 для предотвращения утечки микроволн. Вращающаяся тарелка ( 4J и лопасти ( 5), распределяющие микроволны, обеспечивают равномерное приготовление продуктов. Для рассеивания горячего воздуха, исходящего от пищи и магнетрона, служит вентилялюр ( 6), нагнетающий холодный воздух. [35]
Силы связи этой воды с поверхностью обусловлены поверхностной энергией твердого тела и полярностью молекул воды. Эта вода не растворяет солей, не передает гидростатического давления, не замерзает и не движется. [36]
Такие воздействия вследствие теплового движения частиц не сохраняются постоянными во времени, но постоянно меняются по интенсивности и по знаку. Под действием внешнего электрического поля ( создаваемого, например, соседним ионом) полярность молекул воды может существенно изменяться, в частности возрастать. Происходит дополнительная поляризация молекул. [37]
По экспериментальным определе-нйям дйг1ол - ьный момент молекул воды равен 1.86 D, что доказывает их высокую полярность. Под действием внешнего электрического поля ( создаваемого, например, соседним ионом) указанная полярность молекул воды может существенно изменяться, в частности, возрастать. Происходит дополнительная поляризация молекул. [39]
Объяснение представленных данных основано на следующих моментах. Во-первых, скорость нуклеации / на ионах ( любого знака) в определенных условиях превосходит величину / в паровой смеси без ионов. Во-вторых, в силу полярности молекул воды, на поверхности капель-зародышей, вне зависимости от знака их заряда Qs, образуется двойной электрический слой с внешним поверхностным отрицательным зарядом. И, в третьих можно показать, что при одинаковых напряжениях отрицательный коронный разряд характеризуется большей концентрацией ионов, чем положительный. Сам эффект электрической конденсации объясняется первым из указанных моментов ( ср. Взаимное же расположение кривых 1 и 2 связано с двумя другими процессами, действующими в одну сторону. [40]
Кислород является очень сильным электроотрицательным элементом и поэтому электроны, принадлежащие атомам водорода, смещены в молекуле воды к атому кислорода. В результате атомы водорода приобретают положительный заряд, а атом кислорода - отрицательный. Такие молекулы, у которых в одной части сконцентрирован отрицательный заряд, а в другой - положительный, называются полярными. Однако полярность молекул воды не является основной причиной их ассоциации. [42]
Ввиду широкой распространенности воды в природе вопрос о ее воздействии на прочность твердых тел имеет большое практическое значение. Молекула воды состоит из ядра атома кислорода, двух протЬнов и десяти электронов. Две вершины тетраэдра ( в которых находятся протоны) несут положительный заряд, а двум другим вершинам можно приписать отрицательный заряд. Ковалентная связь О - Н весьма прочна, ее энергия равна 109 ккал / моль. Исключительная полярность молекулы воды и наличие двух положительных водородных ионов ( протонов) Н объясняет многочисленные аномалии в поведении воды и ее способность к образованию довольно прочных соединений с другими полярными молекулами. Вследствие того, что у иона Н отсутствует электронная оболочка ( и потому его размеры в тысячи раз меньше, чем у всех остальных ионов), он притягивается электронами других молекул и может внедряться-в их электронные оболочки. Таким образом, водородная связь ослабляет связи, присутствующие в твердом теле; поэтому вода всегда уменьшает прочность твердых тел и способствует их разрушению. Энергия водородной связи для полярных молекул равна примерно 6 - 12 ккал / моль. [43]
Согласно современным представлениям, жидкая вода имеет постоянно изменяющуюся систему водородных связей между отдельными молекулами. Кислород - водородная связь очень полярна, и поэтому между отдельными молекулами спирта становится возможным образование водородной связи. Однако эта водородная связь не может образовываться в трех направлениях от одной молекулы, как это имеет место в молекуле воды ( фиг. Поэтому молекулы спирта связаны друг с другом не так прочно, как молекулы воды. И хотя молекулы спирта довольно полярны, их полярность меньше полярности молекул воды. [44]
Страницы: 1 2 3
www.ngpedia.ru
Полярность - молекула - вода
Полярность - молекула - вода
Cтраница 2
Как отмечалось в § 49, благодаря полярности молекул воды электролиты в ней диссоциируют на ионы. [16]
Как отмечалось в § 37, благодаря полярности молекул воды электролиты в ней диссоциируют на ионы. Это приводит к изменению плотности воды при указанных температурах. [17]
Указанное поведение увлажненных масел в электрическом поле связано с полярностью молекул воды. [18]
Диссоциация кислот, солей и оснований в водных растворах объясняется полярностью молекул воды. По современным представлениям, молекулы воды, состоящие из двух атомов Н и одного атома О, построены несимметрично, что и обусловливает их полярность. При растворении в водеэлектро-лита, молекулы которого состоят из противоположно заряженных ионов, молекулы воды располагаются вокруг молекул этого электролита. При этом к положительным ионам этих молекул молекулы воды оказываются обращенными своими отрицательными полюсами, а к отрицательным-положительными. [20]
Диссоциация кислот, солей и оснований в водных растворах объясняется полярностью молекул воды. По современным представлениям, молекулы воды, состоящие из двух атомов Н и одного атома О, построены несимметрично, что и обусловливает их полярность. При растворении в воде электролита, молекулы которого состоят из противоположно заряженных ионов, молекулы воды располагаются вокруг молекул этого электролита. При этом к положительным ионам этих молекул молекулы воды оказываются обращенными своими отрицательными полюсами, а к отрицательным - положительными. [22]
Диссоциация кислот, солей и оснований в водных растворах объясняется полярностью молекул воды. По современным представлениям, молекулы воды, состоящие из двух ионов Н и одного иона О, построены несимметрично, что и обусловливает их полярность. При растворении в воде электролита, молекулы которого состоят из противоположно заряженных ионов, молекулы воды располагаются вокруг молекул этого электролита. При этом к положительным ионам этих молекул молекулы воды оказываются обращенными своими отрицательными полюсами, а к отрицательным - положительными. [24]
Под действием внешнего электрического поля ( создаваемого, например, соседним ионом) полярность молекул воды может существенно изменяться, в частности возрастать. Происходит дополнительная поляризация молекул. [26]
Движение рыхлосвязанной ( пленочной) воды происходит очень медленно по поверхности твердых частиц; процесс перемещения подчиняется действию сил молекулярного притяжения, обусловленных, с одной стороны, наличием у частиц электрического заряда и двойного электрического слоя, а с другой - полярностью молекул воды. [27]
Вода, которую мы привыкли обозначать формулой НгО, имеет следующую структуру молекулы: атом кислорода и два атома водорода образуют у центрального атома кислорода угол 104 27, что приводит к неполной компенсации внутримолекулярных сил, избыток которых обусловливает асимметрию распределения зарядов, создающих полярность молекулы воды. Эта полярность у воды более значительная, чем у других веществ, определяет ее исключительную способность как растворителя. В природных водах обнаружена добрая половина всех известных нам химических элементов. Любое озеро и любая река, в сущности, является раствором. Главное, вода является инертным растворителем, так как сама химически не изменяется под воздействием большинства тех тысяч различных веществ, которые она растворяет. Это очень важно с биологической точки зрения. В природной воде могут быть растворены газы как атмосферного, так я подземного происхождения. Растворимость газов зависит не только от температуры и давления, но и от степени минерализации. При больших давлениях нарушается закон Генри. Одной из форм соединения газа с водой являются газо - или кристаллогидраты: смесь газа и воды в твердой фазе. Происхождение и роль кристаллогидратов, широко распространенных в природе, изучены недостаточно. [28]
Влияние полярности молекул на свойства веществ сказывается, в частности, в способности к электролитической диссоциации и в ассоциации. Полярностью молекул воды объясняется ряд специфических явлений, наблюдаемых в водных растворах ( стр. [29]
Поэтому молекула воды - диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы. [30]
Страницы: 1 2 3
www.ngpedia.ru