Круговорот воды, азота и углерода. Углерод вода
Круговорот воды, азота и углерода
«Ибо все в конце концов возвращается в море, в круговорот океана, в вечно текущую реку времени, у которой нет ни начала, ни конца.» Рэйчел Карсон
Вот уже больше четырех миллиардов лет, с тех пор как на Земле образовалась атмосфера, количество воды на нашей планете остается неизменным. Где-то царит засуха, где-то идут ливни, где-то лежат снега — и все это часть бесконечного цикла перемещения воды в природе.
Круговорот воды

Натуралист Эразм Дарвин, дед Чарльза Дарвина, одним из первых смог объяснить механизм обращения воды в природе
Без воды невозможно существование жизни, ведь она есть и в растениях, и в животных, где играет роль универсальной среды для всех химических реакций. Именно присутствие воды сделало нашу планету населенной — и поэтому уникальной. Вода может пребывать в трех состояниях: жидком — когда она является собственно водой, газообразном — когда происходит испарение и она превращается в пар, и твердом — когда вода замерзает и становится льдом и снегом. В одном из этих состояний вода покрывает три четверти земного шара, и эта водная оболочка называется гидросферой.
Каждая молекула воды является заядлой путешественницей. Ее можно обнаружить в море или океане, под землей, где текут грунтовые воды, и даже в небе, в составе дождевой тучи. Каким образом воде удается совершать такие грандиозные перемещения? Топливо для путешествий молекулы воды поставляет главная «батарейка» нашей планеты — Солнце.
Под воздействием солнечного тепла вода испаряется с поверхности морей, рек и океанов — превращается в пар и поднимается вверх. Надо отметить, что испарение воды происходит не только в водоемах: на суше тоже достаточно влаги. Водяной пар движется в атмосфере вместе с массами воздуха, пока не окажется в области низкой температуры, где из него формируются облака. Рано или поздно вода из облаков, в виде осадков, снова попадает на землю. Просачиваясь сквозь почву, она оказывается в подземных реках, которые выходят на поверхность, впадая в водоемы. И все начинается с начала.
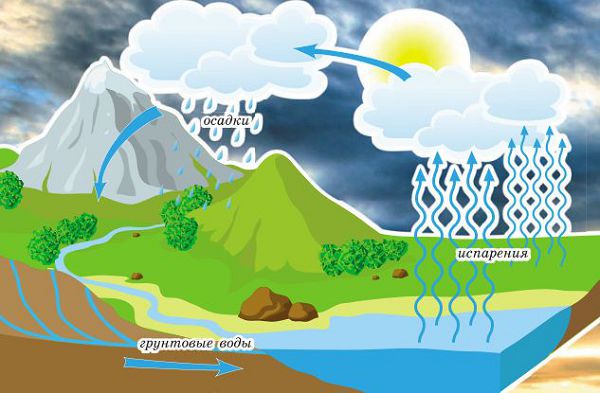
Круговорот воды в природе
Конечно, возможны разные варианты. Осадки могут выпасть в зоне вечной мерзлоты, и тогда вода надолго останется льдом. Но и льды испаряются или тают, так что и в этом случае движение продолжится.
Ученые подсчитали, что в озере среднего размера полное обновление воды происходит за 15–17 лет, в реке — за 20 дней, в ледниках — за 5–10 лет, а в океане — за 3000 летКруговорот углерода и азота
Круговорот воды в меньшей степени задействует живую природу, чем круговорот таких веществ, как углерод и азот. Начнем с углерода. Он присутствует в каждой живой молекуле на Земле, причем не просто присутствует, а служит одним из строительных материалов клетки. Кроме того, большое количество углерода находится в атмосфере и в мировом океане.
Из атмосферы атомы углерода попадают в растения, это происходит в процессе фотосинтеза. Когда растения погибают, углерод становится пищей организмов, содержащихся в почве, а потом возвращается в атмосферу вместе с углекислым газом. Если растения будут съедены животными, то углерод вернется в атмосферу частично в процессе дыхания, частично после гибели животного.
Примерно тоже самое происходит с углеродом, растворенным в океане. Он попадает в морские растения и животных, затем испаряется в атмосферу или откладывается на дне, в виде горных пород, и со временем снова растворяется водой.
Около 80% воздуха составляет азот. Этот элемент циркулирует в природе несколькими путями. Растения усваивают азот из почвы, животные — из растений. Продукты жизнедеятельности животных перерабатываются в почве микроорганизмами и снова становятся пищей для растений.
В атмосфере находится много свободного азота, но растения не могут усваивать его напрямую. Некоторые бактерии перерабатывают его и обогащают им почву. Часть атмосферного азота попадает в почву во время грозы, благодаря электрическим разрядам, которые нагревают атмосферу и меняют структуру молекул.
С тех пор как человечество вступило в эпоху технического прогресса, в циклы круговорота азота и углерода в природе включилась химическая промышленность. Она использует уголь и известняк (производные углерода) в виде топлива, а азот поставляет в почву в виде удобренийПоделиться ссылкой
sitekid.ru
Углерод взаимодействие с водой - Справочник химика 21
Окислительная регенерация закоксованных катализаторов представляет собой совокупность химических реакций, происходящих при взаимодействии кислорода с коксом, в результате которых кокс удаляется в виде газообразных продуктов окисления - оксидов углерода, паров воды, а в некоторых случаях и оксидов серы. К настоящему времени накоплены обширные сведения, указывающие на то, что окисление кокса на катализаторах протекает с образованием и разложением кислород-угле-родных комплексов, т. е. по стадийному механизму. В то же время кинетические закономерности отдельных продуктов окисления существенно различны для разных катализаторов. Это объясняется различием в свойствах удаляемого кокса, условиями выжига (содержание кокса, температура и состав газовой фазы). Кроме того, в большинстве случаев значительное влияние на закономерности удаления кокса оказывает поверхность регенерируемых катализаторов. [c.14] Муравьиную кислоту производят подкислением формиатов натрия или калия (полученных из едких щелочей и окиси углерода) или с помощью непосредственного взаимодействия воды и окиси углерода, проводимого при высоких давлении и температуре в присутствии кислотных катализаторов [c.333]Выделяющиеся при карбонизации из пропитки диоксид углерода и вода могут взаимодействовать с поверхностью волокна и снижать его прочность на 10-40% [10-17]. [c.639]
Запись данных опыта. Отметить наблюдаемые явления и написать уравнения реакции образования карбоната кальция при взаимодействии диоксида углерода с известковой водой и растворения карбоната кальция под действием диоксида углерода и воды с образованием гидрокарбоната. [c.258]
Акриловая кислота может быть получена взаимодействием ацетилена, окиси углерода и воды в присутствии катализатора. Составить уравнение данной реакции и вычислить а) количество акриловой кислоты, которое можно получить из 2 моль ацетилена, 260 г ацетилена б) объемное количество окиси углерода, необходимое для взаимодейст- [c.126]
Концентрированный раствор хлорида натрия насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка. При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония [c.412]
Участником этой реакции является хлорофилл — сложное органическое соединение, придающее растениям зеленый цвет. В этой реакции хлорофилл является сенсибилизатором. Под действием света он активируется, а затем содействует взаимодействию молекул диоксида углерода и воды. Для этой реакции 7 0,1. [c.314]
При взаимодействии карбоната калия с хлороводородом образуются хлорид калия, диоксид углерода и вода. Определите количество хлорида калия и объем диоксида углерода (при н.у ), которые образуются из 24,82 г хлороводорода. [c.240]
Газовые растворы. В газообразном состоянии частицы слабо взаимодействуют друг с другом, поэтому газовый раствор при обычном давлении можно считать смесью компонентов. Примером газового раствора служит воздух, состоящий из азота, кислорода, диоксида углерода, паров воды и других газов. [c.145]
Круговорот азота в природе. Почти весь азот почвы находится в форме недоступных растениям органических веществ, которые минерализуются, т. е. разлагаются под действием бактерий на более простые минеральные соединения — аммиак, оксид углерода (IV), воду, соли. Этот первоначальный процесс выделения аммиака называют аммонизацией. Далее аммиак, взаимодействуя с кислотами почвы, образует соли, усвояемые растениями. Но большая часть образовав- [c.353]
Взаимодействие непредельных углеводородов с окисью углерода и водой [c.147]
Так, например, при взаимодействии этилена с окисью углерода и водой при температуре 300—400° С и давлении около 100 ат в присутствии катализаторов (фосфор-ная кислота, фтористый бор и др.) образуется пропионовая кислота [c.147]
Тетрахлорид ССЦ представляет собой тяжелую, бесцветную и негорючую жидкость. Он не растворяется в воде, но хорошо растворяется в органических растворителях. Химически ССЦ весьма инертен. В обычных условиях он не горит, не гидролизуется, не взаимодействует с кислотами и щелочами. Однако при повышенной температуре во влажной атмосфере тетрахлорид углерода разлагается водой [c.363]
Так, при взаимодействии ацетилена с окисью углерода и водой образуется акриловая кислота, а в присутствии спирта — эфир акриловой кислоты меркаптаны и амины или карбоновые кислоты образуют соответствующие производные карбоновых кислот [c.554]
Графит стоек к водным растворам плавиковой и фосфорной кислот (при любых температурах) и щелочей любой концентрации, но взаимодействует с расплавами щелочей. Графит устойчив к действию растворов всех солей, кроме окисляющих, не взаимодействует с водой и водяным паром при температуре до 600 °С. Атомарный фтор и углерод вступают в реакцию присоединения с выделением значительной энергии даже при обычных температурах. Хлор непосредственно не взаимодействует с углеродом, за исключением условий электрической дуги. При высоких температурах углерод взаимодействует с металлами, образуя карбиды. [c.88]
Первичным процессом образования топлива является реакция взаимодействия между углекислым газом и водой с образованием так называемых углеводов, состоящих из углерода и воды. [c.11]
Гораздо более сложная, а часто и более важная задача переноса возникает тогда, когда конвективная текучая среда поглощает и излучает энергию, как это имеет место для аммиака, двуокиси углерода и воды. Такого рода связанные между собой процессы переноса, происходящие одновременно за счет излучения и естественной конвекции, возникают в печах, естественных водоемах, в пламенах и при пожарах, в коллекторах и накопителях солнечной энергии, в процессах роста кристаллов и задачах экологии. Эти процессы очень важны, и в указанной области были достигнуты весьма впечатляющие результаты (см., например, обзорные работы [5, 12, 15, 92, 93]). В ряде работ по исследованию пламен и процессов горения неизменно фигурируют также вопросы взаимодействия теплового излучения газов с естественной конвекцией (см., например, работы [1, 51 —53, 64]). Некоторые из этих работ упоминались в разд. 6.8. [c.485]
Адипиновую кислоту можно получать также взаимодействием тетрагидрофурана с окисью углерода и водой [c.647]
Фтор энергично реагирует с большинством химических соединений других элементов, а также почти со всеми органическими веществами. С окисью и двуокисью углерода фтор не взаимодействует. Воду он разлагает [c.305]
Набл. Продукт взаимодействия диоксида углерода с водой, pH раствора и тип среды в Пь Значения Кк- Продукты реакций П2 — Пе, Оп. 1 — Оп. 4. [c.176]
Амальгамированный алюминий реагирует со спиртом при нагревании, иногда с добавлением кристаллика иода или 1 мл четыреххлористого углерода образующийся этилат алюминия тотчас же взаимодействуете водой с образованием объемистого осадка гидрата окиси алюминия, нерастворимого в спирте. [c.47]
Реакции взаимодействия окиси углерода с водородом (V-15), (V-16) и (V-I7), приводящие к образованию элементарного углерода и воды, метана и углекислоты или метана и воды, в реальных условиях процесса термического разложения карбонила протекают достаточно глубоко, причем глубина превращения для реакций (V-16) и (V-17) существенно выше, чем для реакции (V-15). По-видимому, реакции (V-16) и (V-17) имеют место в действительности, когда процесс термического разложения пентакарбонила железа проводится в присутствии аммиака, обусловливая наличие в газе разложения весьма небольших примесей метана и воды. [c.68]
Концентр)1рован 1ЫЙ раствор хлорида натрия насыщают ам-маком, а з тем пропускают в него иод давлением диоксид угле-)да, нолу заемый обжигом известняка. При взаимодействии ам-иака, диоксида углерода и воды образуется гидрокарбонат и мои и я [c.441]
Реакция конверсии водяного газа. Реакция конверсии водяного газа была обнаружена как побочная реакция при кар-бонилировании метанола на родиевом катализаторе уже в ходе лабораторных исследований и разработки процесса [4, 16]. Она состоит во взаимодействии монооксида углерода и воды с образованием водорода и диоксида углерода. С умеренными скоростями она также протекает в растворе уксусной кислоты в отсутствие активных метильных групп в каталитической системе при условиях, близких к условиям карбонилирования метанола. Сотрудники Рочестерского университета наблюдали протекание этой реакции с измеримыми скоростями на данной каталитической системе при низкой температуре и давлении ниже атмосферного [17, 18]. Конверсия водяного газа — наиболее глубоко исследованная из побочных реакций, сопровождающих процесс карбонилирования метанола на родиевом катализаторе [19, 20]. [c.298]
Впервые нео-кислоты были синтезированы в 1955 г. Кохом взаимодействием олефинов с окисью углерода и водой в присутствии концентрированной серной кислоты. Позднее был найден ряд других кислых катализаторов — фтористый водород, фосфорная кислота, смесь трехфтористого бора с фтористым водородом, НзРО ВРз и др. Катализатор не должен содержать воду. Даже при использовании 90%-ной Н2504 выходы целевых кислот резко падают. По сравнению с Н2504 катализаторы, содержащие трехфтористый бор, обнаруживают более [c.267]
Оксосинтез. Процессы оксосинтеза включаются в схемы НХЗ для получения различных кислородсодержащих соединений — спиртов, альдегидов, кислот. В этих процессах используются реакции гидроформилирования — взаимодействия ненасыщенных соединений с окисью углерода и водородом в присутствии катализаторов, из которых в настоящее время наиболее широко используются карбонилы кобальта. Методом оксосинтеза, в СССР получают бутиловые спирты (через масляные альдегиды), спирты Су—Сд. Намечается организовать производство высших спиртов, пропионовой кислоты и других продуктов. Современные установки производства бутиловых спиртов методом оксосинтеза состоят из отделений приготовления катализатора (кобальти-зации), гидроформилирования, разложения и регенерации катализатора (декобальтизации), гидрирования альдегидов в спирты, ректификации. В состав установки включают также производство синтез-газа (смеси окиси углерода и водорода) на базе природного или нефтезаводского газа. Новыми направлениями развития оксосинтеза являются процессы гидрокарбоксилирова-ния олефинов (взаимодействия с окисью углерода и водой) с получением кислот, гидрокарбалкоксилирования олефинов (взаимо- [c.43]
Другим промышленным синтезом на основе окиси углерода является непосредственное получение кислот в результате взаимодействия между олефинами, окисью углерода и водой, которое было разработано в лабораториях фирмы Дюпон 10]. Эта реакция тоже требует больших давлений, но ее проводят при значительно более высокой температуре, чем оксосинтез. Обычно работают при давлении 200—1000 ат и 300—400°. Реакция протекает в присутствии кислотных катализаторов, что вызывает необходимость подыскать для изготовления аппаратуры материалы, которые бы были устойчивы к коррозии и одновременно выдерживали высокое давление. В патентах предлагается использовать для этой цели серебро и его сплавы. Из предложенных катализаторов следует упомянуть о фосфорной, соляной и серной кислотах. Этилен легко вступает в реакцию, образуя пропионовую кислоту из пропилена получается изомасляная кислота. Бутилен-2 претерпевает перегруппировку углеродного скелета и превращается в триме-тилуксусную кислоту. Все эти реакции могут быть выражены следующими уравнениями [c.196]
Соединения с кратными связями также могут вести себя подобно льюисовым кислотам. Например, реакцию диоксида углерода с водой, в результате которой образуется угольная кислота Н2СО3, можно изобразить как взаимодействие донора электронной пары, каким является молекула воды, с акцептором электронной пары, в роли которого выступает СО2 [c.100]
В отличие от галлия и индия таллий не стоек на воздухе — очень быстро темнеет и покрывается черной коркой, состоящей в основном из низшего окисла TlaO [155], которая в некоторой степени замедляет дальнейшее окисление. Таллий непосредственно реагирует с галогенами при комнатной температуре, а при нагревании — также с серой и фосфором. С водородом, азотом, аммиаком и сухой двуокисью углерода не взаимодействует. Вода, не содержащая растворенного кис- [c.325]
При взаимодействии непредельных углеводородов жирного ряда с окисью углерода под давлением около 200 ат образуются альдегиды, из которых гидрированием получают спирты. В конечном итоге, например, из этилена, окиси углерода и водорода получается нропиловый спирт [109, 71]. Взаимодействие под давлением циклогексена с окисью углерода, с окисью углерода и водой и с окисью углерода и этиловым спиртом приводит к образованию соответственно гексагидробензойной кислоты, этилгексагидробен-зоата и гексагидробензальдегида. [c.554]
При. высоких температурах углерод взаимодействует с металлами, образуя карбиды (см. также гл. 1). Все карбиды представляют собой твердые, хорошо кристаллизующиеся вещества. Они нелетучи и не растворяются ни в одном из известных растворителей. В связи с этим истинные молекулярные веса карбидов неизвестны и их обычно обозначают простейшими формулами. По отношению к воде и разбавленным кислотам все карбиды распадаются на две большие группы — разлагаемые этими веществами и не разлагаемые ими. Карбиды первого типа следует рассматривать как продукты замещения металлом атомов водорода в ацетилене. Эти карбиды образуют главным образом активные металлы. Общая формула их такова МегСг для одновалентного металла, МеСг —для двухвалентного и МегСв — для трехвалентного. Межатомное, расстояние (С—С) в карбиде кальция равно 1,19 А. [c.40]
Низкомолекуляриые полипропиленоксиды с концевыми гидроксильными группами можно использовать для приготовления пенопластов посредством реакций, родственных реакциям двух предыдущих примеров. Полимерный гликоль заставляют реагировать с избытком днизоцианата, а затем обрабатывают водей. Вспенивающим агентом является двуокись углерода, выделяющаяся прн взаимодействии воды со свободными изоцианатными группами [39]. Реакции- полимеризации этого вида используются ддя получения некоторы.х из широко примС няемых уретановых поропластов. [c.170]
Все химические реакции сопровождаются либо выделением энергии, либо поглощением ее. Обычно эта энергия имеет форму теплоты. Если при смешивании каких-либо веществ в сосуде происходит химическая реакция с выделением теплоты, то содержимое сосуда разогревается.. В другом случае, если между этими веществами происходит химическая реакция с поглощением теплоты, содержимое сосуда становится более холодным. Эти факты можно описать, приняв, что каждое вещество имеет некоторую энтальпию и что общая энтальпия продуктов реакции отличается от энтальпии взятых реагентов. В соответствии с законом сохранения энергии теллогареакг и равна разности энтальпий продуктов реакции и реагентов при стандартной температуре. Так, смесь бензина и кислорода имеет большую суммарную энтальпию, чем при той же температуре продукты их взаимодействия, которыми являются двуокись углерода и вода. Как следствие этого, при реакции выделяется некоторое количество тепла, продукты реакции нагреваются и находящиеся с ними в контакте материалы также нагреваются. [c.21]
Этиленгликоль получают окислением этилена с последующей гидратацией окиси этилена [21, 22] или путем взаимодействия формальдегида, окиси углерода и воды [23]. Перспективным способом является прямой синтез полиолов из окисй углерода и водорода, в результате которого получают смесь этиленгликоля, пропиленгликоля и глицерина. Этот одностадийны11 процесс недавно запатентован [24] американской фирмой Юнион Карбайд . [c.18]
Исследования показали, что значения коэффициентов бинарного взаимодействия вода - углеводород (азот, двуокись углерода, сероводород), вычислеппые по углеводородной и водной фазам, значительно отличаются. Для углеводородной фазы значения к у вода - углеводород мало чувствительны к изменению температуры и для большинства углеводородов находятся в пределах 0,5+0,05. [c.107]
Кинетика окисления этилена на серебряном катализаторе исследовалась в изотермическом режиме (при 218 °С) в безгра-диентном реакторе в широком интервале концентраций этилена, кислорода, окиси этилена, воды и двуокиси углеро-дд87, 88, 08, 110, 111 j pjj выводе кинетических уравнений было учтено стационарное течение процесса, использованы представления теории адсорбции Лангмюра и сделано несколько предположений относительно механизма процесса, близкого к иредлолмолекулярный кислород быстро распадается иа атомы, покрывающие большую часть поверхности катализатора. Затем атомарный кислород взаимодействует с этиленом, образуя одновременно окись этилена, двуокись углерода и воду. Эти продукты адсорбируются на поверхности катализатора и уменьшают каталитический эффект серебра. [c.285]
Приведенная схема не отражает взаимодействия катализатора с другими компонентами реакционной газовой смеси, кроме кислорода и этилена, а также различные гомогенные превращения в газовой фазе, так как для этого нет достаточных данных. Из этой схемы следует лишь, что каталитическое окисление идет по перекисному механизму с образованием активных промежуточных продуктов — супероксида серебра и органического перекис ного радикала [С2Н402-1. Повышение температуры должно оказывать отрицательное влияние — вызывать превращение радикала [С2Н4О ] в двуокись углерода и воду, а не в окись этилена. Но в то же время, ввиду тенденции катализатора к образованию плотноупакованной поверхности, повышение температуры должно способствовать образованию промежуточного супероксида серебра. [c.292]
chem21.info
формула, свойства и области применения :: SYL.ru
Диоксид углерода (углекислый газ) - часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения - гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так: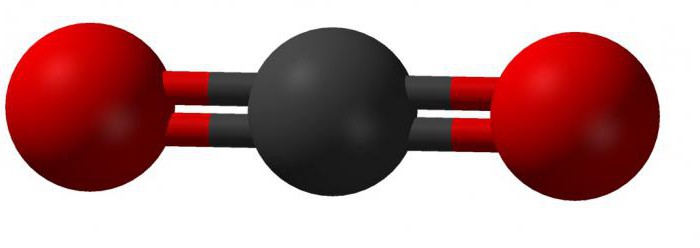
Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации - угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + h3O;
NaOH + CO2 = NaHCO3.
Угольная кислота и раствор СО2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
CO2 + h3O ↔ h3CO3.
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.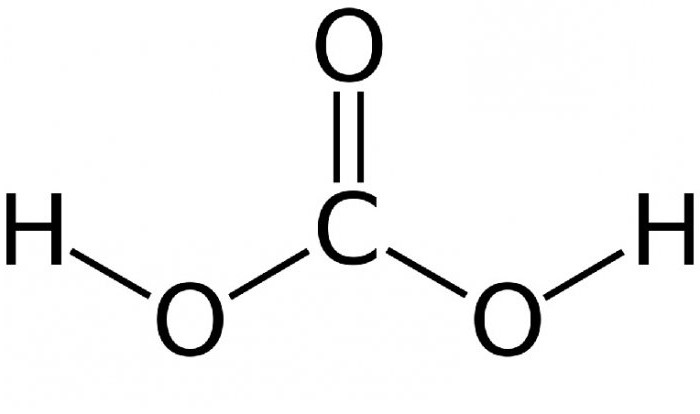
Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н+ и соединения НСО3- . В очень небольшом количестве образуются ионы СО3-.
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH)2 + CO2 = CaCO3↓ + h3O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO3 + h3O + CO2 = Ca(HCO3)2.
Получение диоксида углерода
Если требуется получить небольшое количество СО2,можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
CaCO3 + HCl = CaCl2 + h3O + CO2 ↑.
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН4 + 2О2 → 2h3O + CO2.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
CaCO3 = CaO + CO2 ↑.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
www.syl.ru
Углерод полное содержание в воде
В табл. 8.1 приведен состав продуктов сгорания твердотопливного двигателя ракеты «Шаттл» с учетом дожигания. Поскольку процесс дожигания зависит от температуры и плотности окружающего воздуха, состав продуктов сгорания приведен для трех слоев атмосферы: поверхностного пограничного, тропосферы и стратосферы. В табл. 8.1 приведено количество воды, образующейся только при сгорании твердого топлива. Одновременно с твердотопливным двигателем «Шаттла» работают и жидкостные двигатели орбитального блока (второй ступени), выделяющие 19 500 кг водяного пара у поверхности пограничного слоя (0—0,5 км), 62 200 кг в тропосфере (0,5—10 км) и 118 000 кг в стратосфере (10—50 км). Данные, приведенные в табл. 8.1, показывают, что происходит почти полное дожигание оксида углерода и, по-видимому, молекулярного водорода, содержание которого в исходных продуктах сгорания превышает 2 %. Необходимо особенно отметить, что при дожигании происходит окисление хлористого водорода с образованием свободного хлора (СЬ), который на свету быстро диссоциирует, образуя высокоактивные свободные атомы хлора. Различие порядка 10 % в общих массах оксида алюминия (А1203) между данными [91] и [178] в табл. 8.1 по-видимому, объясняются погрешностями использованной для расчета дожигания диффузионно-кинетической модели.[ ...]
В течение зимы ведут наблюдения за состоянием рыбы и условиями среды в зимовальных прудах: ежедневно измеряют температуру и контролируют проточность воды, раз в неделю проверяют содержание кислорода и диоксида углерода, не менее 3 раз берут пробы воды на полный гидрохимический анализ. Оптимальная температура воды для зимовки карповых рыб находится в пределах 0,5— 2 "С, содержание кислорода должно быть не менее 4 мг/л. При ухудшении газового режима принимают меры по повышению содержания кислорода в воде, применяя разные способы: увеличение проточности воды, устройство прорубей, аэрационных столиков, установка в прудах плавучих аэраторов и т. п.[ ...]
В Приложении 3 приведены результаты опытов по огневому обезвреживанию в циклонных реакторах некоторых видов сточных вод, кубовых остатков и водных растворов, содержащих хлорорганические соединения. В этих опытах в отходящих дымовых газах содержались НС1 и СЬ. По данным [253], органические соединения хлора в отходящих газах присутствуют при наличии в них оксида углерода и несгоревших углеводородов. В рассматриваемых опытах в дымовых газах обнаружены лишь следы СО, а углеводороды отсутствовали. Это дает основание считать, что содержание органического хлора в отходящих газах должно быть невысоким. В опыте на сточной воде производства дианата, проведенном при пониженных температурах (/0,г= 1000 °С), в отходящих газах содержалось 80— 160 мг/м3 органического хлора. Для полного окисления хлорорганических примесей температуру отходящих газов целесообразно поддерживать на уровне 1100°С при коэффициенте расхода воздуха 1,05—1,1.[ ...]
Чтобы полнее оценить содержание органического вещества в сточной воде, определяют химическое потребление кислорода. •Общее количество кислорода, необходимое для перевода углерода органических соединений в углекислоту, водорода в воду, азота в аммиак, серы в серный ангидрид, называется химической потребностью в кислороде и обозначается ХПК.[ ...]
Диоксид углерода — бесцветный газ кисловатых вкуса и запаха, растворим в воде (0,38 г/100 г жидкости). В общем он не относится к числу ядовитых, является естественным компонентом воздуха, однако в больших концентрациях опасен для жизни. При содержании в рабочей зоне 4-6% С02 дыхание и пульс учащаются, появляется шум в ушах, при концентрации 10% наступает обморочное состояние, а при 20-25% полное отравление организма достигается через несколько секунд. Возможность хронического отравления углекислым газом не показана. Полагают, что он в значительной степени ответственен за явление парникового эффекта (разд. 1.6.1).[ ...]
Практически полное устранение привкусов и запахов биологического происхождения достигалось при расходе 10—12 мг угля марки А. Проверка этой дозы в производственных условиях на очистных сооружениях киевской Днепровской водопроводной станции в период, когда вода Днепра имела отчетливый болотный запах интенсивностью до 3 баллов, показала, что в процессе углевания дозой 10 мг/л запахи и привкус воды постепенно уменьшались ; и при установившемся режиме окончательно исчезли (М. А. Шевченко, 1966).[ ...]
Показателем содержания органических примесей в сточных водах является величина ХПК. Окисление органических примесей осуществляется дихроматом калия в присутствии концентрированной серной кислоты. В качестве катализатора окисления для труд-ноокисляющихся веществ применяется сульфат серебра. При действии дихромата калия в сильнокислой среде происходит практически полное окисление растворимых, коллоидных и нерастворимых органических примесей. Конечные продукты окисления — диоксид углерода, вода, аммиак, фосфаты и сульфаты. Но и в этих условиях небольшая часть органических веществ остается полностью или частично неокисленной. Степень окисления органических веществ обычно составляет 95—98%. По данным определения ХПК можно рассчитать, зная состав органического соединения, его содержание в воде. И наоборот, величину ХПК можно вычислить для определенного соединения, используя уравнение реакции его окисления. Теоретическое ХПК обычно выше установленного анализом. Практически при определении ХПК не окисляются пиридин и некоторые другие азотсодержащие органические соединения, а также труднорастворимые углеводороды (бензол, нафталин, парафины). Максимально определяемая данным методом величина окисляемости составляет 104 мг 02/л.[ ...]
Определение углерода органических веществ очень важно для установления последних критериев и общего содержания органических примесей в воде. Методики прямого определения этого показателя основаны на измерении количества углекислого газа, выделяющегося при полном окислении органических соединений.[ ...]
Наряду с пробами воды на полный химический анализ для определения газового состава суммы тяжелых металлов из опорных водопунктов в стерильную посуду отбирают пробы для определения наличия и содержания углерод-окис-ляющих и сульфатредуцирующих микроорганизмов. Из поверхностных водотоков микробиологические пробы отбирают только в период зимней межени.[ ...]
Ход определения. В делительную воронку помещают 100—200 мл пробы, если надо, предварительно разбавляя ее или упаривая, чтобы содержание цинка в этом объеме оказалось в пределах 0,005— 0,03 мг, и прибавляют 1 мл концентрированной соляной кислоты ч. д. а., не содержащей цинка. Прибавляют раствор ацетата натрия до pH 5 (проверяют индикаторной бумажкой) и 20 мл маскирующего раствора. После перемешивания экстрагируют цинк 50,0 мл рабочего раствора дитизона. Встряхивают до тех пор, пока окраска раствора не перестанет изменяться. Если экстракт окрашен в интенсивно-фиолетовый или даже в красный цвет, экстракцию повторяют с меньшим объемом пробы. После полного разделения слоев сливают экстракт в другую делительную воронку, добавляют 10 мл промывного раствора, 15 мл дистиллированной воды и встряхивают до полного удаления дитизона из слоя четыреххлористого углерода (исчезновение зеленой окраски). После полного разделения слоев сливают слой органического растворителя в кювету (трубку делительной воронки предварительно высушивают фильтровальной бумагой). Если раствор четыреххлористого углерода окажется мутным, его фильтруют через маленький сухой бумажный фильтр. Первые 5 мл фильтрата отбрасывают, а остальные собирают в кювету и измеряют оптическую плотность. Одновременно проводят холостой опыт со 100 мл дистиллированной воды, вводят поправку и по калибровочной кривой находят содержание цинка.[ ...]
Методы, связанные с полным окислением всех органических веществ, содержащихся в водах, универсальны, имеют высокую чувствительность и воспроизводимость, однако, используя их в анализе вод на содержание нефтей и нефтепродуктов, следует учитывать возможное содержание как неорганического, карбонатного углерода, так и фонового органического углерода, в противном случае результаты будут сильно завышены.[ ...]
Для определения общего содержания серы прежде всего окисляют все содержащие этот элемент вещества; сера при этом превращается в сульфат-ионы, затем определяют содержание последних. Окисление, следовательно, должно быть полным, и проводить его надо в условиях, исключающих потерю серы в виде летучих соединений. Для этого требуется обработка пробы сильными окислителями, и обязательно в щелочной среде. Если содержание органических веществ в пробе невелико, то во многих случаях достаточно кипячения пробы после добавления к ней бромной воды. При высоком содержании органических веществ и в присутствии свободной серы и трудноокисляемых веществ обработку надо проводить бромом в присутствии хлороформа или тетрахлорида углерода (в которых растворяется как бром, так и большое число органических веществ и сера) и завершать окисление спеканием со смесью MgO -f Na2C03 сухого остатка после выпаривания.[ ...]
Состав органических веществ в промышленных сточных водах современного производства крайне разнообразен — это ароматические углеводороды, нефтепродукты, фенолы, масла, смолы, аминопродукты, пиридиновые основания, жирные кислоты, поверхностно-активные соединения синтетических моющих средств и многие другие. Несмотря на то что основными составляющими различных органических загрязнений являются одни и те же элементы (главным образом углерод, водород, кислород и азот), степень. вредности того или иного органического соединения зависит от формы нахождения, т. е. комбинации, этих элементов в воде. Поэтому для получения полной санитарно-гигиенической характеристики качества воды нужно знать содержание в воде определенных органических веществ. С помощью современных методов химического анализа, в том числе спектрографических, теоретически можно определить любую комбинацию элементов органических веществ в воде, но на практике при анализе природных и сточ- ных вод это ие делается из-за многообразия органических соединений в этих водах, а также вследствие сложности и громоздкости многих анализов. Содержание отдельных органических веществ — загрязнителей — устанавливается анализом, как отмечалось выше, только в тех случаях, когда имеются предположения о наличии именно этих веществ в воде.[ ...]
Значительными были изменения в газовом составе талых вод (рис. 5.16). Снижение содержания диоксида углерода в ТКМВ и ТД составляло соответственно 52 и 50%. Замораживание и оттаивание предварительно прокипяченной МВ, наоборот, приводило к резкому увеличению содержания диоксида углерода. Аналогичная зависимость наблюдалась и по отношению к растворенному кислороду. В ТКМВ и ТД уменьшение показателя равнялось 36 и 32%, тогда как в ТМВ содержалось на 10% больше растворенного кислорода. Повышенное насыщение предварительно кипяченой московской воды диоксидом углерода и кислородом при замораживании возможно связано с ее полной дегазацией и созданием более благоприятных условий для ее последующего насыщения газами.[ ...]
Для последних критериев, а также в целях общей характеристики содержания органических примесей в воде очень важным является быстрое определение углерода органических веществ. Методики прямого определения этого показателя основаны на измерении углекислого газа, выделяющегося при полном окислении органических соединений [34]. Быстрый экспресс-анализ по Некрасову [35] осуществляется без выпаривания пробы воды с применением в качестве окислителя 1-н. раствора бихромата калия с добавкой персульфата калия (40 г/л) и азотнокислого серебра или перманганата калия (1 г/л) кислая реакция среды создается смесью концентрированных кислот (двух частей серной и одной части фосфорной, по объему).[ ...]
Органические вещества содержат кроме углерода, азот, фосфор, калий, серу, хлорные соединения и пр. Количество биохимически окисляемых органических веществ характеризуется количеством кислорода, которое расходуется в определенный интервал времени (БПК в мг/л). Определяют их полное, 5-, 7- и 20-суточные значения (БПК„, БПКб, БПК7 и БПК20). БПК — один из основных показателей органической загрязненности бытовых сточных вод, а также сточных вод пищевой промышленности. Полное содержание органических веществ определяют химическим окислением и называют химической потребностью кислорода (ХПК), выраженной в мг/л. Отношение БПК/ХПК в зависимости от состава сточных вод меняется от 0,8 ...0,85 (бытовые стоки) до 0,1 ... 0,2 (стоки химической промышленности).[ ...]
Сравнение биологической очистки сточных вод от поверхностноактивных веществ и таких химических или физико-химических методов как фотоокислепие, пенная сепарация, экстракция растворителями, поглощение сорбентами и ионитами, показало, что биологическая очистка снижает ВПК, содержание органического углерода и ПАВ в сточной воде в среднем на 77%, при фотоокислепии эти показатели снижаются на 99%, при пенной сепарации — на 95—96%, при коагуляции, проводимой при pH 4—5, — на 90%. Экстракцией удаляют 50—60% ПАВ, ионным обменом н обратным осмосом 99% [41]. Таким образом, практически все перечисленные физико-химические методы позволяют достаточно полно извлекать ПАВ из сточных вод. Возможность их применения определяется тем, насколько отработана и совершенна технология использования того или иного метода и каковы грапнцы ее применимости в конкретных производственных условиях.[ ...]
Предварительные указания. Исходя из наличия в природных водах свободно и связанной С02 необходимо в обоих методах: а) определять сумму органического и неорганического углерода (суммарный углерод) и из полученной величины вычитать отдельно определенное в таком же объеме воды содержание неорганического, углерода или б) предварительно удалять свободную и связанную С02 путем продувки подкисленной пробы; азотом. Последний прием возможен лишь в том случае, если есть полная уверенность, что в воде нет легколетучих органических соединений.[ ...]
Универсального консервирующего вещества не существует. Для полного анализа воды обычно требуется отобрать пробу в несколько бутылей, в которых ее консервируют добавлением различных веществ. Для определения содержания некоторых компонентов, например сульфидов, сульфитов, агрессивной двуокиси углерода, следует брать пробы в отдельные бутыли для каждого из этих определений.[ ...]
Стремление к снижению влажности исходного угля обусловлено тем, что избыток воды приводит к непроизводительному расходу теплоты, обгару угля и потерям сорбционной емкости ПАУ. Так, при регенерации ПАУ в кипящем слое топочными газами при 675 °С угля снижение О0 от 1 до 0,5—0,33 г Н20/г ПАУ сократило потери угля в 1,5 раза и повысило сорбционную емкость продукта на 13—25% [147]. Те же исследования показали, что регенерация газовыми смесями, содержащими кислород и пары воды, менее выгодна, чем смесью окиси азота и двуокиси углерода 10% (об.) или топочными газами. Вызвано это тем, что абсолютные значения и рост потерь при термообработке ими ПАУ опережают восстановление сорбционной способности угля. Снижение температуры от 830 до 640—550 °С сокращает потери в 1,3—1,8 раза, при одновременном уменьшении Эд от 90 до 83%. Температура 830±30°С в большинстве случаев достаточна для полного восстановления сорбционных свойств ПАУ в печи с кипящим слоем угля за 15—30 мин. Причем увеличение времени термообработки в 5—10 раз вызывает лишь рост обгара угля [147]. Системы с малым временем термообработки (0,5—2,5 с) работают при больших температурах в рабочей зоне (890—910°С) и меньшем содержании кислорода в топочных газах: 0—1,6% (об.) —при большом количестве вводимого пара [148].[ ...]
При взаимодействии компонентов жидкого ракетного топлива образуются фотохимически малоактивные продукты полного сгорания — диоксид углерода, вода, молекулярный азот и небольшое количество свободных атомов (Н, О, Ы) и радикала гидроксила (ОН), появляющихся вследствие быстрого охлаждения («замораживания») равновесного состава продуктов сгорания при высокой температуре. В выбросах появляются также продукты неполного сгорания — оксид углерода и молекулярный водород. Определить содержание этих продуктов, как и свободных атомов водорода и азота, можно путем термохимических расчетов.[ ...]
Периодически ведут наблюдения за гидрохимическим режимом выростных прудов, проводя оперативный, текущий и полный анализы воды и осуществляя мероприятия по его нормализации. Особо важно строго контролировать температуру, pH воды, содержание в ней кислорода, диоксида углерода и другие показатели.[ ...]
Проведен теоретический анализ методов установления энергетических запасов органического вещества природных вод и почв. Выявлены и устранены причины, приводящие к рассогласованности результатов. В качестве меры биомассы и энергии ОВ рекомендуется использовать содержание органического, углерода. Приведены пересчетные коэффициенты для вычисления физиологической, физической и полной калорийности.[ ...]
Таким образом, обобщая эту часть исследований, можно отметить неблагоприятное влияние длительного кипячения московской водопроводной воды на ее физико-химические свойства, что выражалось в сдвиге pH в щелочную сторону, практически полной дегазации (уменьшении содержания в ней кислорода, диоксида углерода), повышении концентрации большинства солевых компонентов, уменьшении содержания кальция. При кипячении воды в течение 1 минуты негативные изменения показателей были минимальными и не выходили за пределы гигиенических нормативов.[ ...]
Определение БПК до сих пор производится весьма несовершенным методом разбавления [31]. Анализ этот трудоемок, а главное, длителен; данные о полной БПК можно получить только через 25 суток. Пятисуточная БПК (БПКб) далеко не всегда объективно характеризует ход дальнейшего окислительного процесса. При необходимости проследить кинетику БПК делают анализы через 2,5; 10; 15; 20 и 25 суток. В процессе анализа содержание кислорода определяется методом Винклера. Это означает, что при сильно цветных сточных водах (стоки целлюлозно-бумажного производства и т. п.) метод теряет необходимую точность. Многие исследователи пытались усовершенствовать метод разбавления или заменить его другим. Наибольшие успехи достигнуты при использовании объемно-манометрического метода газового анализа с целью определения скорости потребления кислорода и оценки органических веществ по органическому углероду.[ ...]
Растворенные органические соединения включают синтетические химикаты, а также многие вешества растительного и животного происхождения. Количество органических примесей в воде выражается, в оснвном, при помоши двух показателей: химической и биологической потребности в кислороде. Под химической потребностью в кислороде (ХПК) понимают количество кислорода (мг/л), необходимого для окисления органических вешеств, находящихся в сточной воде, до СС , Н2О и N0- . Для определения ХПК применяется стандартная методика, по которой в качестве окислителя используется бихромат калия К2 Сг20. Количество кислорода (мг/л), необходимое для биохимического окисления (разложения) органических соединений, содержащихся в сточной воде, называется биологической потребностью в кислороде (ВПК). В зависимости от продолжительности определения различают БПК (за пять суток), а также БПКполн (полное). Однако оба эти показателя являются несовершенными для определения содержания органических веществ в воде в силу ряда причин: неспособности к биоразложению ряда органических веществ, окисления некоторых неорганических веществ, находящихся в этой же воде и т.д. Поэтому существует еще один показатель для определения органических примесей в воде - содержание общего органического углерода (00У, мг/л), которое измеряется путем окисления всех органических веществ до диоксида углерода.[ ...]
После окисления избыток бихромата определяется титрованным раствором соли Мора; при устранении мешающего влияния неорганических восстановленных соединений бихроматная окисляемость дает почти полное представление о содержании органического вещества в исследуемой воде. Если имеются данные по содержанию в исследуемой воде валового органического углерода, то по отношению кислорода бихроматной окисляемости к органическому углероду можно судить о кислородном эквиваленте органического вещества и, в частности, об его «окисленности» или «восстановленное™» (при сравнении с кислородным эквивалентом углеводов). По величине отношения перманганатной окисляемости к бихроматной можно, получить примерную качественную оценку природы органического вещества. В случае преобладания окрашенных гумусовых соединений величина этого отношения 40% и при наличии значительного количества нестойкого органического вещества это отношение 40%.[ ...]
ru-ecology.info
Публикации
Добавлено: 05.02.2015
Углерод
Диоксид углерода
Важную роль в процессах, протекающих в воде искусственного водоёма, играет оксид углерода (IV) или, как его чаще называют, углекислый газ. Он представляет собой соединение углерода с кислородом; в молекуле вещества один атом углерода связан с двумя атомами кислорода — CO2. Углекислый газ влияет на гидрохимические параметры воды (жесткость, pH, содержание различных веществ), он действует на рыб и других водных животных и играет важнейшую роль в развитии аквариумных растений.
Диоксид углерода содержится в воде в основном в виде растворенных молекул CO2 и лишь малая часть его (около 1%) при взаимодействии с водой образует угольную кислоту:
CO2 + h3O <=> h3CO3
Диоксид углерода, гидрокарбонатные и карбонатные ионы являются основными компонентами карбонатной системы. В растворе между ними существует подвижное равновесие:
h3CO3 <=> Н+ + HCO3- <=> 2Н+ + CO32-
Соотношение между компонентами в значительной мере определяется величиной рН.
- При рН 4.5 и ниже из всех компонентов карбонатного равновесия в воде присутствует только свободная углекислота.
- В интервале рН=6-10 (pH водs в искусственном водоёме в нормальных условиях должен быть от 7.8 до 9) гидрокарбонатные ионы являются основной формой производных угольной кислоты (максимальное их содержание при рН=8.3-8.4).
- При рН более 10.5 главной формой существования угольной кислоты являются карбонатные ионы.
Главным источником поступления оксида углерода в воды искусственного водоёма являются процессы биохимического распада органических остатков, окисления органических веществ, дыхания водных организмов.
Одновременно с процессами поступления значительная часть диоксида углерода потребляется при фотосинтезе, а также расходуется на растворение карбонатов и химическое выветривание алюмосиликатов:
CaCO3 + CO2 + h3O <=> Ca(HCO3)2 HSiO3- + CO2 + h3O <=> h3SiO3 + HCO3-
Уменьшение диоксида углерода в воде происходит также в результате его выделения в атмосферу.
Концентрация диоксида углерода в природных водах колеблется от нескольких десятых долей до 3-4 мг/дм3, изредка достигая 10-20 мг/дм3.
Обычно весной и летом содержание диоксида углерода в водоеме понижается, а в конце зимы достигает максимума. Диоксид углерода имеет исключительно важное значение для растительных организмов населяющих искусственный водоём (как источник углерода).
Как известно, водные растения состоят из органических соединений, т. е. соединений, основу (скелет) которых составляет углерод. Нарастание биомассы растений связано с необходимостью подпитки их извне соединениями углерода. Основным веществом, служащим для питания растений является углекислый газ. Растения ассимилируют (поглощают) CO2, превращая его в органические соединения — глюкозу, крахмал и другие.
Поглощение CO2 связано с изменением pH воды искусственного водоёма: сдвигом его значения в щелочную сторону. Содержание углекислого газа в воде искусственного водоёма снижается при уменьшении жесткости и уменьшении кислотности воды. Поэтому очень мягкая и особенно щелочная вода неблагоприятны для водных растений. Многие растения прекращают рост даже в слабощелочной среде (при pH около 8).
Забирая углекислый газ из воды, водные растения сами ухудшают условия своего существования; для их улучшения необходим новый источник углерода. Некоторые водные растения могут использовать в процессе фотосинтеза только свободный CO2, растворенный в воде искусственного водоёма. Если весь углекислый газ израсходован, то процесс фотосинтеза прекращается, и рост растения останавливается.
В то же время повышенные концентрации CO2 угнетающе действуют на животные организмы обитающие в пруду. Углекислый газ в больших концентрациях токсичен для водных животных. При большом содержании CO2 в воде он попадает в кровь рыб, вызывая удушье. Для нормального функционирования аквасистемы концентрация CO2 в воде искусственного водоёма не должна превышать 4 мл/л.
При высоких концентрациях CO2 воды также становятся агрессивными по отношению к металлам и бетону в результате образования растворимых гидрокарбонатов, нарушающих структуру этих материалов.
Карбонаты
Важная роль углекислого газа в гидрохимии искусственного водоёма состоит в установлении так называемого углекислотно-известкового равновесия. Это равновесие определяется главным образом тремя параметрами; концентрацией CO2 в воде, значениями pH и карбонатной жесткости dKH.Карбонат кальция CaCO3 обладает очень плохой растворимостью в воде (7 мг в 1 л), что соответствует 2° жесткости. При растворении CO2 в воде карбонаты, которые практически всегда содержатся в грунте, начинают взаимодействовать с углекислым газом, с образованием гидрокарбонатов, которые хорошо растворимы в воде:
Основным источником гидрокарбонатных и карбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, мергелей, доломитов:
CaCO3 + CO2 + h3O <=> Сa2+ + 2HCO3- MgCO3 + CO2 + h3O <=> Mg2+ + 2HCO3-
Некоторая часть гидрокарбонатных ионов поступает с атмосферными осадками и грунтовыми водами. Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние могут выпадать в осадок:
Ca(HCO3)2 => CaCO3 + h3O + CO2 Сa2+ + CO32- => CaCO3
В речных водах содержание гидрокарбонатных и карбонатных ионов колеблется от 30 до 400 мг HCO3- /дм3, в озерах - от 1 до 500 мг HCO3-/дм3, в морской воде - от 100 до 200 мг/дм3, в атмосферных осадках - от 30 до 100 мг/дм3, в грунтовых - от 150 до 300 мг/дм3, в подземных водах - от 150 до 900 мг/дм3.
Однако кислотность и карбонатная жесткость не являются единственными факторами, определяющими углекислотно-известковое равновесие воды в искусственном водоёме. Это равновесие зависит от целого ряда факторов:
1.Объем искусственного водоёма. Как правило, в искусственных водоёмах большого объема равновесные процессы более устойчивы.
2.Геометрические размеры искусственного водоёма. В искусственном водоёме с большой площадью поверхности лучше осуществляется газообмен, с воздухом.
3.Количество рыб и других водных животных, выделяющих углекислый газ при дыхании.
4.Количество водных растений в искусственном водоёме, которые, в зависимости от освещенности, выделяют или поглощают углекислый газ.
5.Интенсивность освещения, влияющая на жизнедеятельность водных растений.
6.Химический состав воды, наливаемой в искусственный водоём. Наиболее важный фактор — карбонатная жесткость (dKH).
7.Режим кормления рыб. Разлагающийся избыточный корм становится источником углекислого газа.
8.Температура воды. Влияет на растворимость карбонатов, углекислого газа, на скорость всех химических реакций.
9.Грунт. От содержания карбонатов в грунте зависит гидрохимический состав воды.
10.Движение воды за счет фильтров, ручьев, каскадов, насосов и т. п. Влияет на насыщение воды углекислым газом из воздуха и растворимость карбонатов.
Все указанные факторы говорят о сложной зависимости равновесия от условий содержания искусственного водоёма: из-за такого большого комплекса факторов часто бывает невозможно предугадать направление смещения углекислотно-известкового равновесия и соответствующее ему изменение гидрохимического состава воды искусственного водоёма.
По материалам:
- сайта maxnimere.my1. ru
- Справочник по гидрохимии. Электронная версия.
shop.gidrologia.ru
Углерод — Мегаэнциклопедия Кирилла и Мефодия — статья
147N + 10n = 146C + 11H.
Углерод расположен в группе IVA, во втором периоде периодической системы. Конфигурация внешнего электронного слоя атома в основном состоянии 2s2p2. Важнейшие степени окисления +2 +4, –4, валентности IV и II. Радиус нейтрального атома углерода 0,077 нм. Радиус иона C4+ 0,029 нм (координационное число 4), 0,030 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома равны 11,260, 24,382, 47,883, 64,492 и 392,09 эВ. Электроотрицательность по Полингу 2,5.Углерод известен с глубокой древности. Древесный уголь использовали для восстановления металлов из руд, алмаз — как драгоценный камень. В 1789 французский химик А.Л. Лавуазье сделал вывод об элементарной природе углерода. Искусственные алмазы впервые были получены в 1953 шведскими исследователями, но результаты они не успели опубликовать. В декабре 1954 искусственные алмазы получили, а в начале 1955 опубликовали результаты сотрудники компании «Дженерал электрик».В СССР искусственные алмазы впервые были получены в 1960 группой ученых под руководством В. Н. Бакуля и Л. Ф. Верещагина. В 1961 группой советских химиков под руководством В. В. Коршака была синтезирована линейная модификация углерода — карбин. Вскоре карбин был обнаружен в метеоритном кратере Рис (Германия). В 1969 в СССР были синтезированы нитевидные кристаллы алмаза при обычном давлении, обладающие высокой прочностью и практически лишенные дефектов. В 1985 Г. Крото обнаружил новую форму углерода —фуллерены С60 и С70 в масс-спектре испаряемого при облучении лазером графита. При высоких давлениях получен лонсдейлит.Содержание в земной коре 0,48% по массе. Накапливается в биосфере: в живом веществе 18% угля, в древесине 50%, торфе 62%, природных горючих газах 75%, горючих сланцах 78%, каменном и буром угле 80%, нефти 85%, антраците 96%. Значительная часть угля литосферы сосредоточена в известняках и доломитах. Углерод в степени окисления +4 входит в состав карбонатных пород и минералов (мел, известняк, мрамор, доломиты). Углекислый газ CO2 (0,046% по массе) постоянный компонент атмосферного воздуха. Углекислый газ в растворенном виде всегда присутствует в воде рек, озер и морей. В атмосфере звезд, планет и в метеоритах обнаружены вещества, содержащие углерод.
С древности уголь получали при неполном сгорании древесины. В 19 веке древесный уголь в металлургии заменили каменным углем (коксом). В настоящее время для промышленного получения чистого углерода используют крекинг природного газа метана СН4:СН4 = С + 2Н2
Уголь для медицинских целей готовят сжиганием кожуры кокосовых орехов. Для лабораторных нужд чистый уголь, не содержащий несгораемых примесей, получают неполным сжиганием сахара.
Углерод — неметалл. Многообразие соединений углерода объясняется способностью его атомов связываться между собой, образуя объемные структуры, слои, цепи, циклы. Известны четыре аллотропические модификации углерода: алмаз, графит, карбин и фуллерит. Древесный уголь состоит из мельчайших кристалликов с неупорядоченной структурой графита. Его плотность 1,8-2,1 г/см3 . Сажа представляет собой сильно измельченный графит.
Алмаз — минерал с кубической гранецентрированной решеткой. Атомы С в алмазе находятся в sp3-гибридизованном состоянии. Каждый атом образует 4 ковалентные s-связи с четырьмя соседними атомами С, расположенными по вершинам тетраэдра, в центре которого находится атом С. Расстояния между атомами в тетраэдре 0,154 нм. Электронная проводимость отсутствует, ширина запрещенной зоны 5,7 эВ. Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема. Его плотность 3,51 г/см3.. Твердость по минералогической шкале Мооса принята за 10. Алмаз можно поцарапать только другим алмазом; но он хрупок и при ударе раскалывается на куски неправильной формы. Термодинамически устойчив лишь при высоких давлениях. Однако, при 1800 °C превращение алмаза в графит происходит быстро. Обратное превращение графита в алмаз происходит при 2700°C и давлении 11-12 ГПа.Графит — слоистое темно-серое вещество с гексагональной кристаллической решеткой. Термодинамически устойчив в широком интервале температур и давлений. Состоит из параллельных слоев, образованных правильными шестиугольниками из атомов С. Углеродные атомы каждого слоя расположены против центров шестиугольников, находящихся в соседних слоях; положение слоев повторяется через один, а каждый слой сдвинут относительно другого в горизонтальном направлении на 0,1418 нм. Внутри слоя связи между атомами ковалентные, образованы sp2-гибридными орбиталями. Связи между слоями осуществляются слабыми ван-дер-ваальсовыми силами, поэтому графит легко расслаивается. Такое состояние стабилизирует четвертая делокализованная π-связь. Графит обладает хорошей электрической проводимостью. Плотность графита 2,1-2,5 кг/дм3.Во всех аллотропических модификациях при обычных условиях углерод химически малоактивен. В химические реакции вступает только при нагревании. При этом химическая активность углерода убывает в ряду сажа—древесный уголь—графит—алмаз. Сажа на воздухе воспламеняется при нагревании до 300°C, алмаз — при 850-1000°C. При горении образуется углекислый газ СО2 и CO. Нагревая СО2 с углем, также получают оксид углерода (II) CО:
СО2+ С = 2СО
С + Н2О (перегретый пар) = СО +Н2
Синтезирован оксид углерода С2О3. СО2 — кислотный оксид, ему отвечает слабая неустойчивая, существующая только в сильно разбавленных холодных водных растворах угольная кислота Н2СО3. Соли угольной кислоты — карбонаты (К2СО3, СаСО3) и гидрокарбонаты (NaHCO3, Са(НСО3)2).С водородом графит и древесный уголь реагируют при температуре выше 1200°C, образуя смесь углеводородов. Реагируя со фтором при 900°C, образует смесь фторуглеродных соединений. Пропуская электрический разряд между угольными электродами в атмосфере азота, получают газ циан (CN)2; если в газовой смеси присутствует водород, образуется синильная кислота HCN. При очень высоких температурах графит реагирует с серой, кремнием, бором, образуя карбиды — CS2, SiC, В4С.Карбиды получают взаимодействием графита с металлами при высоких температурах: карбид натрия Na2C2, карбид кальция CaC2, карбид магния Mg2C3, карбид алюминия Al4C3. Эти карбиды легко разлагаются водой на гидроксид металла и соответствующий углеводород:
Al4C3 + 12Н2О = 4Al(ОН)3 + 3СН4
С переходными металлами углерод образует металлоподобные химически стойкие карбиды, например, карбид железа (цементит) Fe3C, карбид хрома Cr2C3, карбид вольфрама WС. Карбиды — кристаллические вещества, природа химической связи может быть различной. При нагревании уголь восстанавливает многие металлы из их оксидов:
FeO + C = Fe + CO,
2CuO+ C = 2Cu+ CO2
При нагревании восстанавливает серу(VI) до серы(IV) из концентрированной серной кислотой:
2h3SO4+ C = CO2+ 2SO2+ 2h3O
При 3500°C и нормальном давлении углерод сублимирует.
Свыше 90% всех первичных источников потребляемой в мире энергии приходится на органическое топливо. 10% добываемого топлива используется в качестве сырья для основного органического и нефтехимического синтеза, для получения пластмасс.
Углерод — важнейший биогенный элемент, является структурной единицей органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, витамины, гормоны, медиаторы и другие). Содержание углерода в живых организмах в расчете на сухое вещество составляет 34,5-40% у водных растений и животных, 45,4-46,5% у наземных растений и животных и 54% у бактерий. В процессе жизнедеятельности организмов происходит окислительный распад органических соединений с выделением во внешнюю среду CO2. Углекислый газ , растворенный в биологических жидкостях и природных водах, участвует в поддержании оптимальной для жизнедеятельности кислотности среды. В составе CaCO3 углерод образует наружный скелет многих беспозвоночных, содержится в кораллах, яичной скорлупе. При различных производственных процессах частицы угля, сажи, графита, алмаза попадают в атмосферу и находятся в ней в виде аэрозолей. ПДК для углеродной пыли в рабочих помещениях 4,0 мг/м3 , для каменного угля 10 мг/м3.- Сюняев З. И. Нефтяной углерод. М., 1980.
- Химия гиперкоординированного углерода. М., 1990.
- Углерод в лесном фонде и сельскохозяйственных угодьях России. - Москва: Товарищество научных изданий КМК, 2005.
- Морган Ричард. Видоизмененный углерод. - М.: АСТ: Люкс, 2005.
- Углерод: минералогия, геохимия и космохимия. - Сыктывкар: Геопринт, 2003.
- Фиалков А. С. Углерод, межслоевые соединения и композиты на его основе. - М.: Аспект-пресс, 1997.
- Фенелонов В. Б. Пористый углерод. - Новосибирск: Ин-т катализа, 1995.
megabook.ru
Публикации компании "Гидрология"
Добавлено: 05.02.2015
Углерод
Диоксид углерода
Важную роль в процессах, протекающих в воде искусственного водоёма, играет оксид углерода (IV) или, как его чаще называют, углекислый газ. Он представляет собой соединение углерода с кислородом; в молекуле вещества один атом углерода связан с двумя атомами кислорода — CO2. Углекислый газ влияет на гидрохимические параметры воды (жесткость, pH, содержание различных веществ), он действует на рыб и других водных животных и играет важнейшую роль в развитии аквариумных растений.
Диоксид углерода содержится в воде в основном в виде растворенных молекул CO2 и лишь малая часть его (около 1%) при взаимодействии с водой образует угольную кислоту:
CO2 + h3O <=> h3CO3
Диоксид углерода, гидрокарбонатные и карбонатные ионы являются основными компонентами карбонатной системы. В растворе между ними существует подвижное равновесие:
h3CO3 <=> Н+ + HCO3- <=> 2Н+ + CO32-
Соотношение между компонентами в значительной мере определяется величиной рН.
- При рН 4.5 и ниже из всех компонентов карбонатного равновесия в воде присутствует только свободная углекислота.
- В интервале рН=6-10 (pH водs в искусственном водоёме в нормальных условиях должен быть от 7.8 до 9) гидрокарбонатные ионы являются основной формой производных угольной кислоты (максимальное их содержание при рН=8.3-8.4).
- При рН более 10.5 главной формой существования угольной кислоты являются карбонатные ионы.
Главным источником поступления оксида углерода в воды искусственного водоёма являются процессы биохимического распада органических остатков, окисления органических веществ, дыхания водных организмов.
Одновременно с процессами поступления значительная часть диоксида углерода потребляется при фотосинтезе, а также расходуется на растворение карбонатов и химическое выветривание алюмосиликатов:
CaCO3 + CO2 + h3O <=> Ca(HCO3)2 HSiO3- + CO2 + h3O <=> h3SiO3 + HCO3-
Уменьшение диоксида углерода в воде происходит также в результате его выделения в атмосферу.
Концентрация диоксида углерода в природных водах колеблется от нескольких десятых долей до 3-4 мг/дм3, изредка достигая 10-20 мг/дм3.
Обычно весной и летом содержание диоксида углерода в водоеме понижается, а в конце зимы достигает максимума. Диоксид углерода имеет исключительно важное значение для растительных организмов населяющих искусственный водоём (как источник углерода).
Как известно, водные растения состоят из органических соединений, т. е. соединений, основу (скелет) которых составляет углерод. Нарастание биомассы растений связано с необходимостью подпитки их извне соединениями углерода. Основным веществом, служащим для питания растений является углекислый газ. Растения ассимилируют (поглощают) CO2, превращая его в органические соединения — глюкозу, крахмал и другие.
Поглощение CO2 связано с изменением pH воды искусственного водоёма: сдвигом его значения в щелочную сторону. Содержание углекислого газа в воде искусственного водоёма снижается при уменьшении жесткости и уменьшении кислотности воды. Поэтому очень мягкая и особенно щелочная вода неблагоприятны для водных растений. Многие растения прекращают рост даже в слабощелочной среде (при pH около 8).
Забирая углекислый газ из воды, водные растения сами ухудшают условия своего существования; для их улучшения необходим новый источник углерода. Некоторые водные растения могут использовать в процессе фотосинтеза только свободный CO2, растворенный в воде искусственного водоёма. Если весь углекислый газ израсходован, то процесс фотосинтеза прекращается, и рост растения останавливается.
В то же время повышенные концентрации CO2 угнетающе действуют на животные организмы обитающие в пруду. Углекислый газ в больших концентрациях токсичен для водных животных. При большом содержании CO2 в воде он попадает в кровь рыб, вызывая удушье. Для нормального функционирования аквасистемы концентрация CO2 в воде искусственного водоёма не должна превышать 4 мл/л.
При высоких концентрациях CO2 воды также становятся агрессивными по отношению к металлам и бетону в результате образования растворимых гидрокарбонатов, нарушающих структуру этих материалов.
Карбонаты
Важная роль углекислого газа в гидрохимии искусственного водоёма состоит в установлении так называемого углекислотно-известкового равновесия. Это равновесие определяется главным образом тремя параметрами; концентрацией CO2 в воде, значениями pH и карбонатной жесткости dKH.Карбонат кальция CaCO3 обладает очень плохой растворимостью в воде (7 мг в 1 л), что соответствует 2° жесткости. При растворении CO2 в воде карбонаты, которые практически всегда содержатся в грунте, начинают взаимодействовать с углекислым газом, с образованием гидрокарбонатов, которые хорошо растворимы в воде:
Основным источником гидрокарбонатных и карбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, мергелей, доломитов:
CaCO3 + CO2 + h3O <=> Сa2+ + 2HCO3- MgCO3 + CO2 + h3O <=> Mg2+ + 2HCO3-
Некоторая часть гидрокарбонатных ионов поступает с атмосферными осадками и грунтовыми водами. Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние могут выпадать в осадок:
Ca(HCO3)2 => CaCO3 + h3O + CO2 Сa2+ + CO32- => CaCO3
В речных водах содержание гидрокарбонатных и карбонатных ионов колеблется от 30 до 400 мг HCO3- /дм3, в озерах - от 1 до 500 мг HCO3-/дм3, в морской воде - от 100 до 200 мг/дм3, в атмосферных осадках - от 30 до 100 мг/дм3, в грунтовых - от 150 до 300 мг/дм3, в подземных водах - от 150 до 900 мг/дм3.
Однако кислотность и карбонатная жесткость не являются единственными факторами, определяющими углекислотно-известковое равновесие воды в искусственном водоёме. Это равновесие зависит от целого ряда факторов:
1.Объем искусственного водоёма. Как правило, в искусственных водоёмах большого объема равновесные процессы более устойчивы.
2.Геометрические размеры искусственного водоёма. В искусственном водоёме с большой площадью поверхности лучше осуществляется газообмен, с воздухом.
3.Количество рыб и других водных животных, выделяющих углекислый газ при дыхании.
4.Количество водных растений в искусственном водоёме, которые, в зависимости от освещенности, выделяют или поглощают углекислый газ.
5.Интенсивность освещения, влияющая на жизнедеятельность водных растений.
6.Химический состав воды, наливаемой в искусственный водоём. Наиболее важный фактор — карбонатная жесткость (dKH).
7.Режим кормления рыб. Разлагающийся избыточный корм становится источником углекислого газа.
8.Температура воды. Влияет на растворимость карбонатов, углекислого газа, на скорость всех химических реакций.
9.Грунт. От содержания карбонатов в грунте зависит гидрохимический состав воды.
10.Движение воды за счет фильтров, ручьев, каскадов, насосов и т. п. Влияет на насыщение воды углекислым газом из воздуха и растворимость карбонатов.
Все указанные факторы говорят о сложной зависимости равновесия от условий содержания искусственного водоёма: из-за такого большого комплекса факторов часто бывает невозможно предугадать направление смещения углекислотно-известкового равновесия и соответствующее ему изменение гидрохимического состава воды искусственного водоёма.
По материалам:
- сайта maxnimere.my1. ru
- Справочник по гидрохимии. Электронная версия.
gidrologia.ru



















