Содержание
2.2. Гибридизация атомных орбиталей
Изучение
таких молекул, как
ВеСI2,
BCI3
,
СН4
,
показало,
что все связи в них равноценны, несмотря
на то, что
в
образовании их участвуют различные
орбитали
центрального атома.
Слейтер и Полинг объяснили
это явление тем, что орбитали различной
симметрии, не сильно отличающиеся по
энергиям, образуют гибридные орбитали.
Гибридизация
—
это
процесс перераспределения электронных
плотностей
близких по энергии орбиталей, который
приводит к их полной
равноценности.
Число
гибридных орбиталей равно числу
орбиталей, участвующих в гибридизации.
Гибридные
орбитали более вытянуты в направлении
образования химических связей и поэтому
обусловливают
лучшее перекрывание электронных облаков.
По
числу участвующих в гибридизации атомных
орбиталей различают следующие, наиболее
распространенные типы гибридизации:
sp
—,
sр2
—
и
sр3.
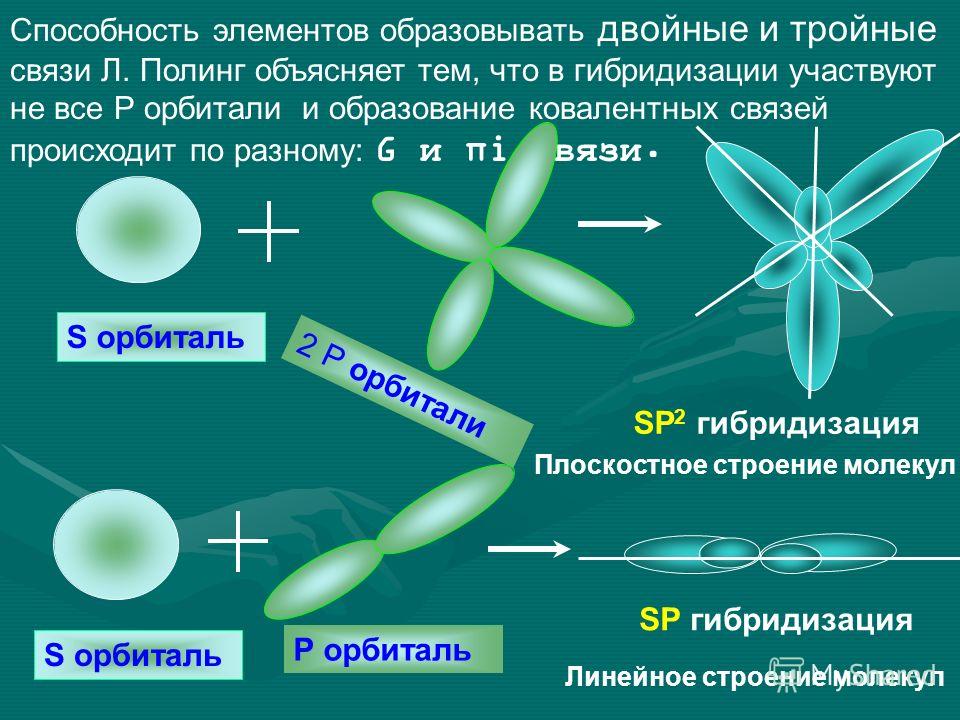
Гибридизация
одной s
—
и
одной р
-электронных
орбиталей приводит
к образованию двух гибридных
sp —
орбиталей
(рис. 9).
s
– орбиталь и
p —
орбиталь → 2 гибридные sp
-орбитали
Рис.
9. Образование sp
—
гибридных орбиталей
Относительно
друг
друга две гибридные sp
—
орбитали
расположены под углом 180°, поэтому
молекулы с таким видом гибридизации
линейны, две связи в них
расположены по прямой и противоположно
направлены
от ядра
(рис.
10).
Рис.
10.
sp
–
гибридизация
Гибридизация
одной s
— и
двух р
—
электронных орбиталей приводит
к образованию трех гибридных
sр2
—
орбиталей. Эти три гибридные
орбитали расположены в одной плоскости
и направлены в вершины равностороннего
треугольника; углы между осями sр2
–
гибридных орбиталей составляют 120°
(рис.
11).
Рис.
11. sp2
— гибридизация
Рис.
12. sp3
— гибридизация
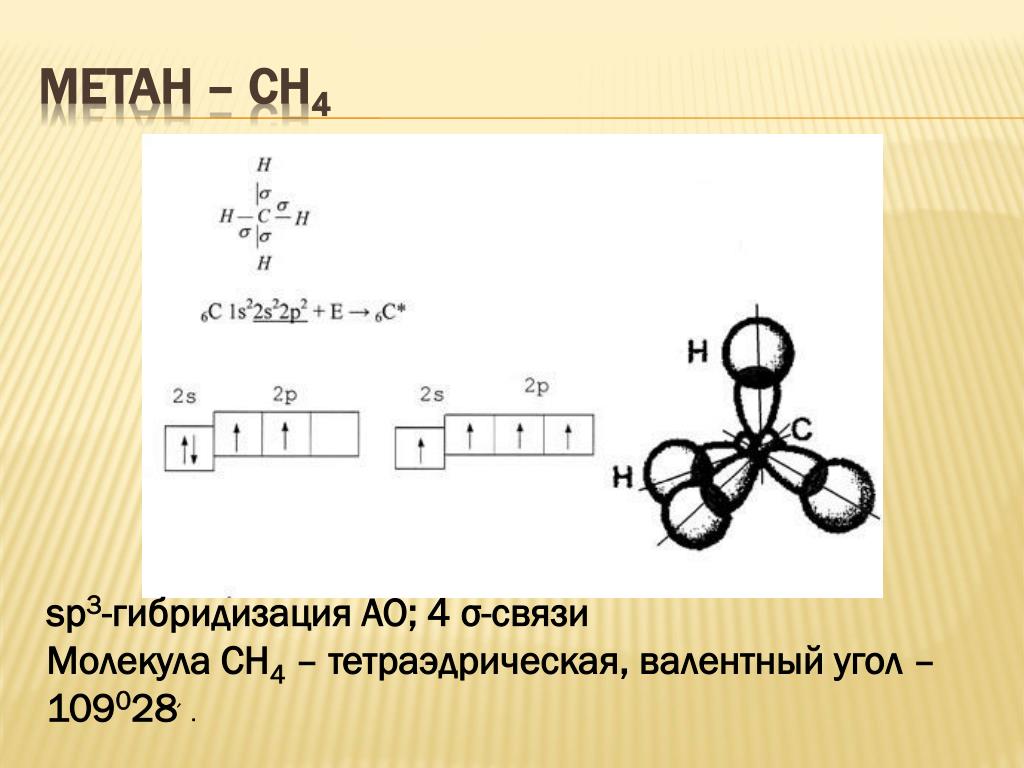
Гибридизация
одной s
— и
трех р
—
электронных орбиталей приводит
к образованию четырех гибридных sр3
—
орбиталей. В
этом случае
четыре гибридные орбитали имеют оси,
лежащие в пространстве под углами
109,5о;
они направлены к вершинам правильного
тетраэдра
(рис.
12).
Таким
образом, тип гибридизации определяется
видом и количеством
участвующих в гибридизации электронных
орбителей (см. табл.6).
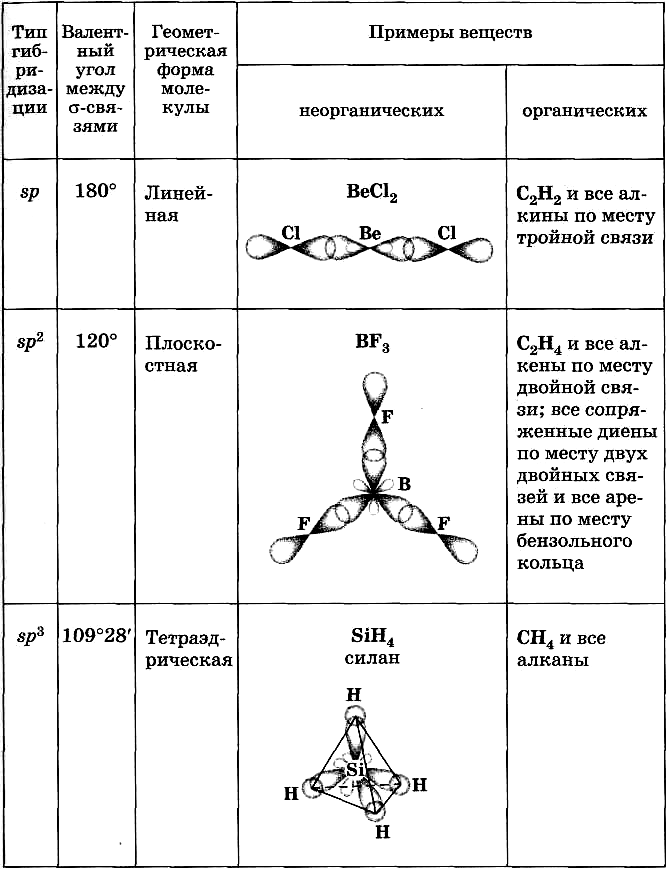
Таблица 6
Типы
гибридизации и геометрия молекул
Тип | Тип гибри-дизации | Число гибридных орбиталей атома | Геометрия молекул | Валент-ные углы | Примеры |
АВ2 | sp (s+p) | 2 | линейная | 180о | BeF2, CO2, C2H2 |
АВ3 | sp2 (s+2p) | 3 | плоская | 120о | BCl3, AlF3, C2H4 |
АВ4 | sp3 (s+3p) | 4 | тетраэдри-ческая | 109,5о | H2O, NH3, SiH4, CCl4, |
Пример
1.
Перекрывание sp
– гибридных орбиталей атома бериллия
с 1s
– АО двух атомов водорода приводит к
образованию линейной
молекулы гидрида бериллия BeH2;
валентный уголH-Be-H
в молекуле BeH2
равен 180о
(рис. 13 ).
Рис.
13. Пространственная конфигурация
молекулы BeH2
Пример
2.
Перекрывание sp2–
гибридных орбиталей атома бора с 1s
– АО трех атомов водорода приводит к
образованию треугольной
(тригональной) молекулы
гидрида бора BH3;
валентный уголH
– B – H в молекуле BH3
равен 120о
(рис. 14).
Рис.
14. Пространственная конфигурация
молекулы BH3
Пример
3.
Перекрывание sp3–
гибридных орбиталей атома кремния с 1s
– АО четырех атомов водорода приводит
к образованию тетраэдрической
молекулы
силана SiH4;
валентный уголH-Si-H
равен 109,5о
(рис.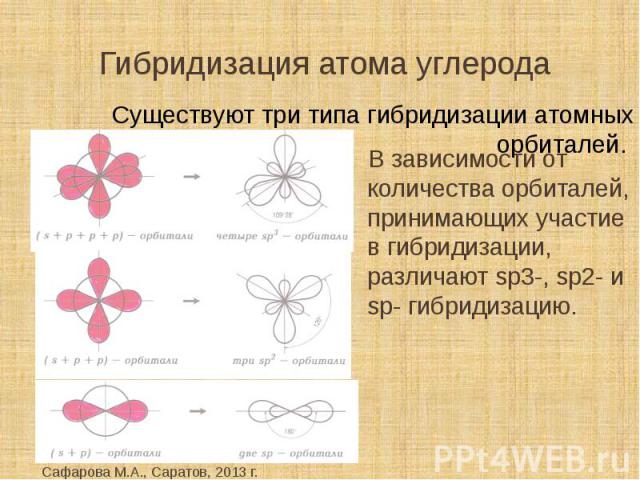 15).
15).
Рис.
15. Пространственная конфигурация
молекулы SiH4
Разные
по составу молекулы СН4,
NH3
и
H2O
имеют одинаковое пространственное
расположение связей. Этот факт
подтверждает гибридизацию орбиталей.
Атомы углерода, азота и кислорода в
указанных молекулах находятся в состоянии
sp3
—
гибридизации.
Молекула
аммиака. В
невозбужденном состоянии центральный
атом азота в молекуле аммиака NH3
имеет
1s2
2s2
2p3
— электронную конфигурацию.
Графическая
схема распределения электронов по
энергетическим ячейкам представлена
схемой на рис.
16,
согласно которой могут образоваться
три взаимно перпендикулярные связи с
тремя атомами водорода. Однако в
действительности валентные углы в
аммиаке равны 107о
при тетраэдрическом их расположении.
Азот в молекуле аммиака находится в
sp3–гибридном
состоянии. При этом гибридизуются 2s
– орбиталь,
заполненная парой электронов и три 2p
– орбитали, имеющие по одному электрону.
В результате получается четыре
sp3
–
гибридных
орбитали, из которых одна содержит
неподеленную пару электронов. Остальные
три гидридные орбитали перекрываются
с орбиталями трех атомов водорода.
Неподеленная пара электронов находится
в одной из вершин тетраэдра, а атомы
водорода расположены в вершинах основания
тетраэдра, т.е. находятся в одной плоскости
(рис. 16).
Рис.
16. Пространственная конфигурация
молекулы NH3
Молекула
воды. В
молекуле воды
H2O
центральным атомом является атом
кислорода, который в невозбужденном
состоянии имеет следующую электронную
конфигурацию: 1s22s22p2.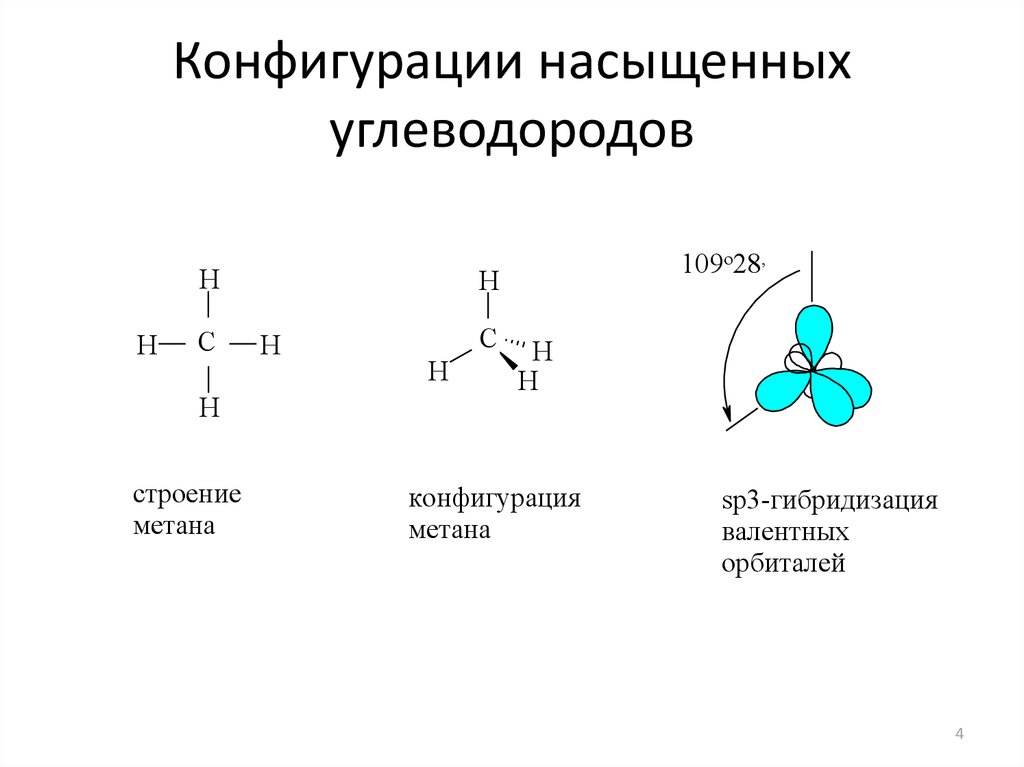
Кислород
в молекуле воды также находится в
состоянии sp3
–
гибридизации
(рис. 17).
Рис.
17. Пространственная конфигурация
молекулы Н2О
Рис.
18. Тетраэдрическое расположение связей
в молекуле воды
В
отличие от молекулы аммиака, в молекуле
воды имеются две гибридные орбитали с
неподеленными парами электронов и две
гибридные орбитали, имеющие по одному
электрону. Валентный угол между связями
равен 104,5о
при
тетраэдрическом их расположении (рис.
18).
У
рассмотренных молекул аммиака и воды
углы между связями отклоняются от
тетраэдрического 109о29′
и прямого 90о.
Это обусловлено различием сил взаимного
отталкивания орбиталей, заполненных
только парой электронов, и орбиталей,
перекрывающихся с атомами водорода.
Орбитали с парой электронов, т.е. не
имеющие области перекрывания, обладают
бόльшим отталкивающим эффектов по
сравнению с орбиталями, образующими
связь.
В
молекуле NH3
имеется одна sp3
– гибридная орбиталь, заполненная парой
электронов, и она отталкивает в направлении
от себя три остальные орбитали связи N
— H, уменьшая угол до 107о.
В молекуле H2O
— две орбитали с парами электронов. Их
влияние на орбитали связи еще сильнее,
и угол H-O-H уменьшается до 104,5о.
ГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §9 Пространственное строение молекул РЕШЕБНИК ОТВЕТЫ » Крутые решение для вас от GDZ.cool
ГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §9 Пространственное строение молекул РЕШЕБНИК ОТВЕТЫ
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Приведите примеры образования молекул органических и неорганических веществ на основе sp-, sp2— и sp3-гибридизации.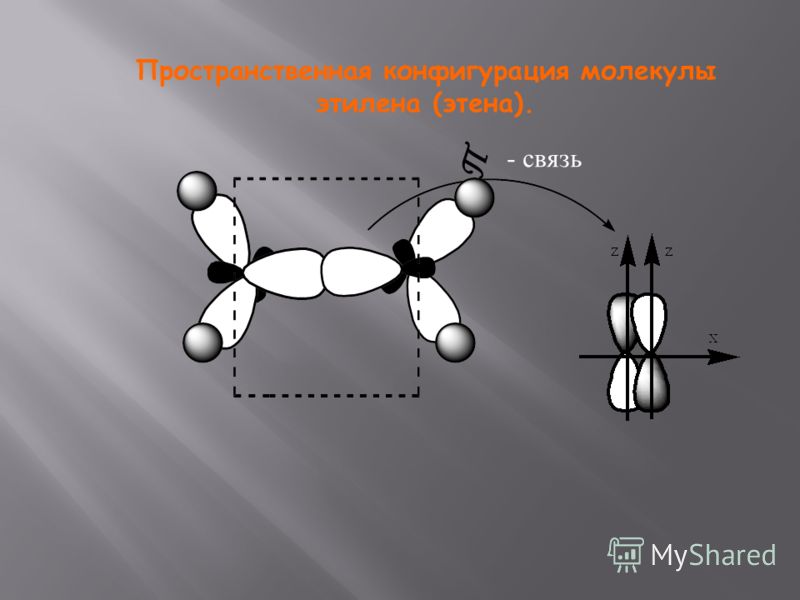
| Вещества | Тип гибридизации | ||
| sp-гибридизация | sp2-гибридизация | sp3-гибридизация | |
| Органические | этин HC≡CH | этен CH2=CH2 формальдегид H2C=O | метан CH4 этан CH3―CH3 |
| Неорганические | фторид бериллия BeF2 оксид углерода (IV) CO2 | хлорид бора BCl3 оксид серы (IV) SO2 | вода H2O аммиак NH3 |
Задание 2
Что общего у молекул метана, аммиака и воды и чем они различаются по строению?
Сходство состоит в том, что в молекулах метана CH4, аммиака NH3 и воды H2O центральные атомы находятся в состоянии sp3-гибридизации.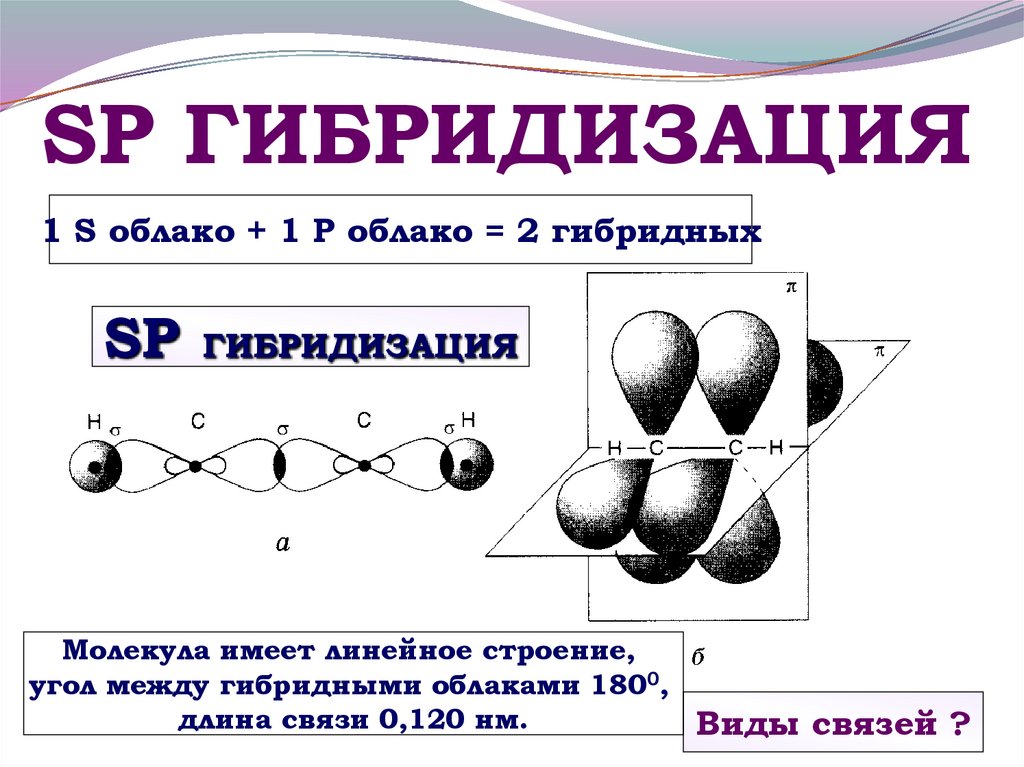
Различие состоит в том, что в молекуле метана в образовании связей участвуют все четыре гибридные орбитали атома углерода, в молекуле аммиака ― три гибридные орбитали атома азота (четвёртая заполнена неподелённой электронной парой), в молекуле воды ― две гибридные орбитали атома кислорода (две других заполнены неподелёнными электронными парами). В молекуле метана угол между связями приблизительно равен тетраэдрическому углу (109°28). Между орбиталями, участвующими в образовании связей, и орбиталями, занятыми свободными электронными парами, действуют силы отталкивания. Так как у атома азота одна такая пара, то угол отклонения от тетраэдрического небольшой и составляет 107,3°, а в атома кислорода их уже две, поэтому угол отклонения больше и составляет 104,5°.
Задание 3
Охарактеризуйте строение молекулы воды. Укажите вид связей, их количество, полярность. Как осуществляется перекрывание электронных орбиталей при образовании связей? Какую геометрическую форму имеет молекула?
Ковалентная связь образуется за счет двух неспаренных р-электронов атома кислорода и s-электрона каждого атома водорода, связи O―H являются полярными за счет более высокой электроотрицательности кислорода.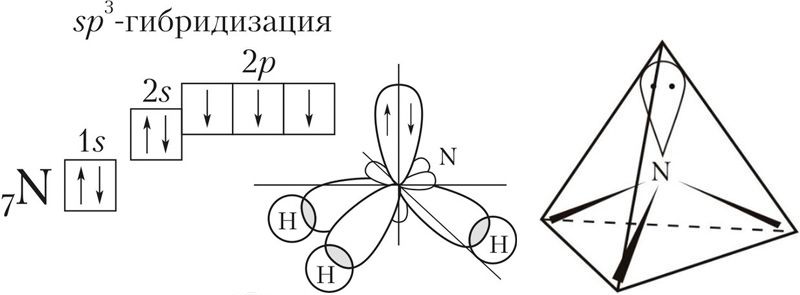
При образовании молекулы воды происходит гибридизация орбиталей атома кислорода по типу sp3, в результате перекрывания s-орбиталей атомов водорода с sр3-гибридными орбиталями атома кислорода, угол между связями H–O–H равен 104,5°. Отклонение от тетраэдрического угла (109°28′) обусловлено действием неподелённых электронных пар: у атома кислорода связывающими электронными парами заняты только две sp3-гибридные орбитали, а две другие заполнены неподелёнными электронными парами.
Так как молекула воды имеет угловое строение и образована элементами с разной степенью электроотрицательности, то она является полярной.
Задание 4
Составьте структурную формулу четырёххлористого углерода. Определите вид химической связи в этом соединении, тип гибридизации орбиталей атома углерода и форму молекулы.
| Cтруктурная формула четырёххлористого углерода | Вид химической связи в соединении | Тип гибридизации орбиталей | Форма молекулы |
| ковалентная полярная (электронные пары смещены в сторону хлора) | sp3-гибридизация (угол между связями 109028′) | тетраэдрическая |
Задание 5
К 200 г раствора, содержащего 24% нитрата калия, добавили 800 мл воды.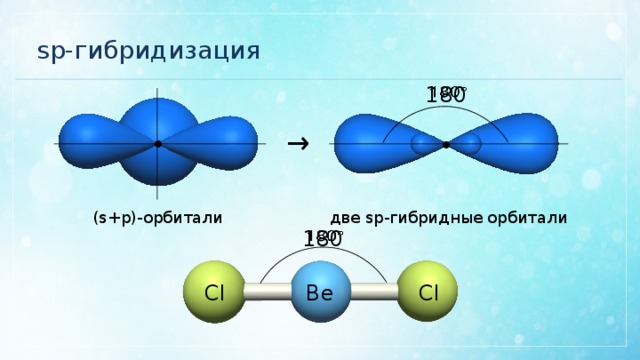 Определите массовую долю (в процентах) нитрата калия в полученном растворе.
Определите массовую долю (в процентах) нитрата калия в полученном растворе.
Дано: m(раствора)=200 г, V(H2O)=800 мл, ω(KNO3)=24%
Найти: ω1(KNO3)-?
Решение
1. Вычислим массу воды:
m(H2O)=ρ(H2O)•V(H2O)=1 г/мл•800 мл=800 г
2. Вычислим массу нитрата калия в начальном растворе:
m(KNO3)=(ω(KNO3)•m(раствора)):100%=(24%•200 г):100%=48 г
3. Рассчитаем массу полученного раствора:
m1(раствора)=m(раствора)+m(Н2О)=200 г + 800 г=1000 г
4. Вычислим массовую долю нитрата калия в полученном растворе:
ω1(KNO3)=(m(KNO3)/m2(раствора))•100%=(48 г : 1000 г)•100%=4,8%
Ответ: 4,8%
Тест 1
sp3-гибридизацией можно объяснить геометрическую форму молекулы
1) NH3
2) Br2 молекула линейная Br–Br
3) C2H6
4) HBr молекула линейная H–Br
Тест 2
sp2-гибридизацией можно объяснить геометрическую форму молекулы
1) C2H4
2) BBr2
3) CH4 sp3-гибридизация
4) H2O sp3-гибридизация
Тест 3
sp-гибридизацией можно объяснить геометрическую форму молекулы
1) BCl3 sp2-гибридизация
2) BeF2
3) C2H2
4) C2H6 sp3-гибридизация
Другие задания смотри здесь.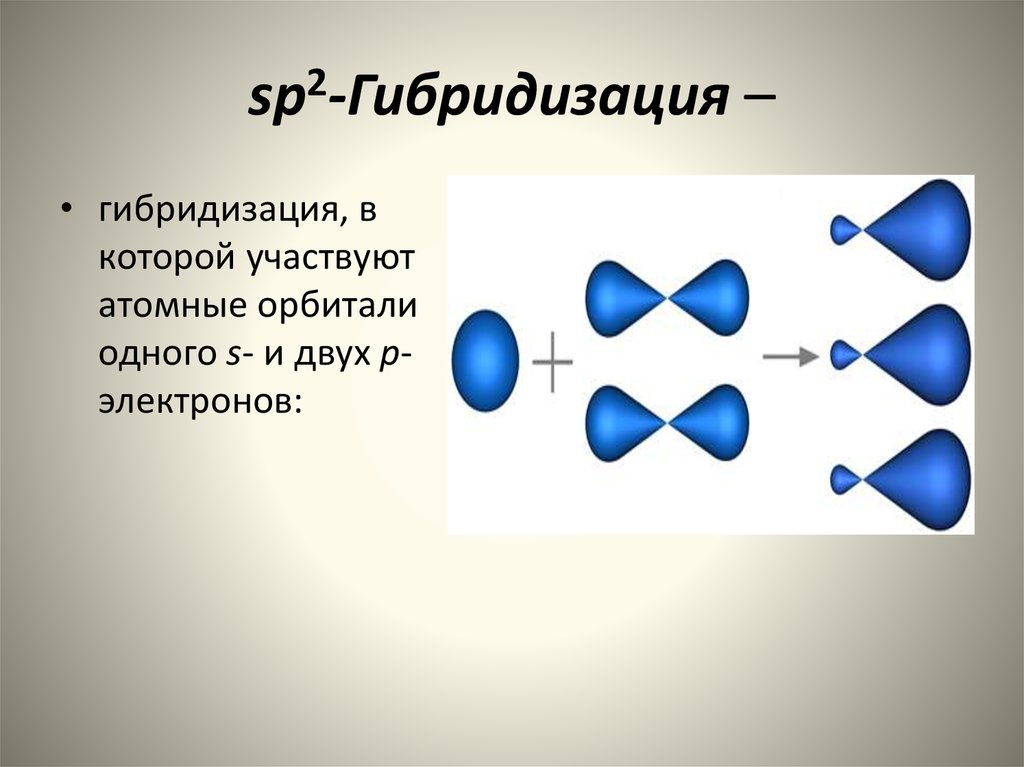 ..
..
Гибридизация воды — Infinity Learn
Введение
Только средняя молекула подвергается гибридизационному взаимодействию в соответствии с общими принципами гибридизации. Мы фокусируемся на йоте кислорода во время создания частицы воды. Йота кислорода sp 3 гибридизуется в ходе гибридизации H 2 O.
Зарегистрируйтесь и получите бесплатные пробные тесты и учебные материалы0003
Вы ученик Шри Чайтаньи?
НетДа
+91
Подтвердить OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
- Название молекулы: Вода
- Субатомная формула: H 2 O
- Тип гибридизации: sp 3
- Угол соединения: 104,5 или
- Math: угловой или V-образный
Фокусная йота, которая гибридизуется, представляет собой кислород. В развитии атома воды есть три 2p-орбитали и одна 2s-орбиталь. Они объединяются для создания sp 3 межпородные орбитали.
Кроме того, каждая частица водорода образует ковалентные ассоциации с двумя перекрестными орбиталями и двумя смесевыми орбиталями, вовлекаясь при взаимодействии одиночными наборами.
Расчет гибридизации
Частица sp 3 представляет собой кислород, гибридизованный с атомами H 2 O
каркаса. Одиночные пары подготавливают две половинные орбитали, а две другие заняты удержанием йоты водорода.
Поскольку одиночные наборы не добавляются к расчету частиц, H 2 O имеет лихую форму.
Отталкивание (одинокая пара-одиночная пара) более выражено, чем отталкивание (одиночная пара-пара связей) или (пара связей-пара связей). Соответственно, точка, образованная HOH, составляет 104,5°, что не является идеальной тетраэдрической точкой 109°28′.
Стерическое число фокальной частицы (O) равно 2+2, поскольку атомы H 2 O имеют два одиночных набора и два набора связей. Тем не менее, он имеет исключение нечетных электронных частиц и стереохимически латентных одиночных наборов , где
стерический номер = одиночные наборы + наборы связей.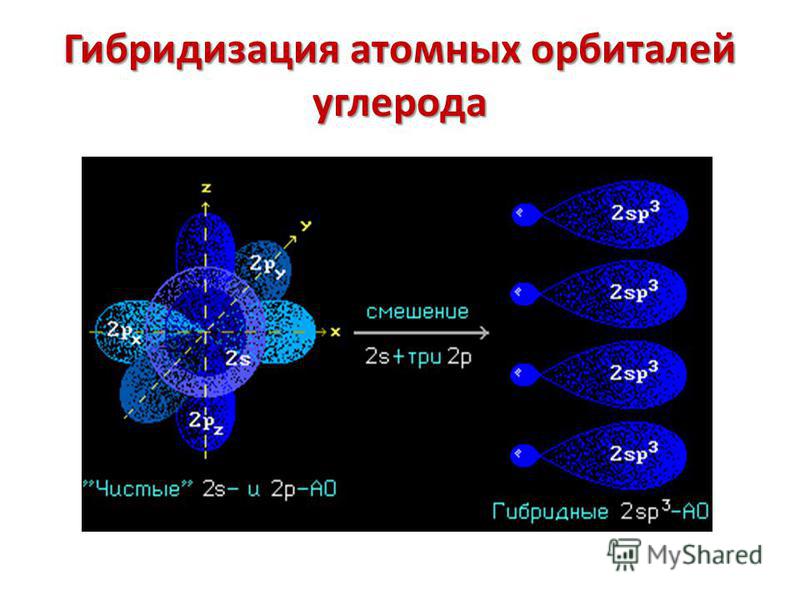
Часто задаваемые вопросы
В: Что означает sp 3 Гибридизация воды?
Ответ: Валентные орбитали частицы, включенные в тетраэдрический план одиночных комбинаций и удерживающих наборов, имеющих связку из четырех sp 3 смешанных орбиталей, называются гибридизацией H 2 O. Смеси в результате смешивания одной (s) орбитали и каждой из трех (p) орбиталей, что дает четыре сравнительных sp 3 смешанные орбитали. Обратитесь к картинке внизу, чтобы хорошо увидеть инструмент гибридизации sp 3 в воде. Если вы заметите, то обнаружите, что каждая из этих пересекающихся орбиталей указывает на альтернативный угол тетраэдра.
В: Существуют ли какие-либо критерии для соблюдения определенного типа гибридизации?
Ответ: Действительно. Соблюдение — это набор руководящих принципов, которые угадываются, чтобы получить вид гибридизации в соединении или частице.
- Определите абсолютное число одиночных наборов электронов
- Вычислите количество валентных электронов.
- Вычислить количество октетов или дуплексов
- Оценить абсолютное количество используемых орбиталей = Количество дуплексов или октетов + Количество одиночных наборов электронов
Если не будет ни одной уединенной пары электронов, то тогда гибридизация H 2 O и расчет орбиталей и частиц будут уникальными.
В: При каких обстоятельствах можно заметить особый вид Гибридизации?
Ответ: Далее следует ряд решений, которые были предложены для определения типа гибридизации в синтетическом материале или в частице.
- Вычислите полное количество одиночных наборов электронов.
- Определите количество валентных электронов.
- Подсчитать количество октетов или дуплексов в организации.
- Количество дуплексов или октетов + количество одиночных наборов электронов = полное количество используемых орбиталей
- Без следа одиночной пары электронов гибридизация H 2 O и орбитальная и субатомная математика будут изменены.

В: Что такое H 2 O?
Ответ: Вода ( H 2 O ) представляет собой неорганическое синтетическое соединение, которое является простым, тусклым, без запаха и в основном неприятным.
Это фундаментальная часть гидросферы Земли и жидкости всех известных живых существ (где он считается растворимым).
Несмотря на то, что он нуждается в калориях и натуральных добавках, он необходим для всех живых существ. Как указано в рецепте его соединения, H 2 O, каждая из его частиц имеет одну молекулу кислорода и две молекулы водорода, связанные ковалентными связями.
В: Каковы физические и материальные свойства H 2 O?
Ответ: Несомненно, вода в природе обычно содержит дезинтегрированные синтетические соединения, требующие дополнительных циклов для искусственного очищения воды. В типичных земных условиях вода является основным нормальным веществом, существующим в твердом, жидком и газообразном состояниях.
- Вода — единственная в своем роде жидкость, которая теряет толщину при замерзании.
- При напряжении в один воздух (атм) лед тает или вода замерзает при 0 градусов Цельсия (32 градуса по Фаренгейту),
- , пока пузырьки воды или дым собираются при температуре 100 градусов Цельсия (212 градусов по Фаренгейту).
- Несмотря на то, что у людей есть специальные датчики, которые могут определять наличие воды во рту, и принято считать, что лягушки имеют возможность чувствовать ее запах, чистая вода обычно считается пресной и без запаха.
- Чистая вода кажется синей из-за поглощения света в районе 600-800 нм.
- Частица воды в жидком или сильном состоянии может образовывать до четырех водородных связей с окружающими ее атомами из-за ее экстремальности.
- Электрическая проводимость чистой воды увеличивается, когда разрушается ограниченное количество ионного вещества, такого как обычная соль.
В: Какое влияние оказывает H 2 O на жизнь, включая анаболизм и катаболизм?
Ответ: Вода обладает набором органических характеристик, которые необходимы для распространения жизни. Это достигается за счет того, что природные синтетические соединения реагируют таким образом, который позволяет происходить репликации. Все известные виды жизни требуют наличия воды.
Это достигается за счет того, что природные синтетические соединения реагируют таким образом, который позволяет происходить репликации. Все известные виды жизни требуют наличия воды.
- Вода необходима для некоторых метаболических циклов в организме, а также является растворимым веществом, в котором расщепляется большое количество растворенных веществ организма. Анаболизм и катаболизм — две части пищеварения.
- Вода берется из атомов во время анаболизма для образования более крупных частиц. Вода используется в катаболизме для разрыва связей и структурирования более скромных частиц (например, глюкозы, ненасыщенных жиров и аминокислот, которые используются для получения энергии или других целей).
- Эти метаболические упражнения были бы невозможны без воды.
В: Что предлагает составное удержание воды?
Ответ: Вода (H 2 O) представляет собой прямую трехатомную изогнутую частицу с субатомным балансом C2V и точкой связи 104,5 ° между средними молекулами кислорода и водорода.
Несмотря на то, что это одно из наименее сложных трехатомных соединений, его синтетический план удерживания запутан, поскольку некоторые из его удерживающих границ, например, точка связи, энергия ионизации и энергия электронного состояния, не могут быть прояснены с помощью одиночная собранная холдинговая модель.
Существуют различные произведения искусства и усовершенствованные модели удерживания, которые используются для удовлетворительного уточнения синтетического удерживания. Они должны быть конкретными:
Основная структура Льюиса и VSEPR
- Гипотеза валентной связи
- Гипотеза субатомной орбиты
- Изовалентная гибридизация
- Стандарт Twisted
Похожие материалы
Молекула — определение, примеры, структура, гибридизация
Что такое молекула?
Молекула в химии или биологии представляет собой наименьшую идентифицируемую единицу, состоящую из двух или более атомов и сохраняющую химические свойства формообразующих веществ. Различные типы сил или химических связей ответственны за образование большинства типов молекул.
Различные типы сил или химических связей ответственны за образование большинства типов молекул.
Во многих кристаллических твердых молекулах атомы являются структурными единицами, и эти атомы удерживаются вместе ионными, ковалентными или водородными связями.
- Хлорид натрия (NaCl) и хлорид калия (KCl) являются хорошо известными примерами молекул, образованных ионной связью.
- Сульфид цинка, карбид кремния, йодид серебра и вода являются примерами молекул, образованных ковалентной связью.
- При изучении химии кристаллическая форма органических соединений, таких как спирт и карбоновая кислота, поддерживается водородными связями.
Примеры полярных и неполярных молекул
Ковалентные молекулы состоят из положительно заряженных ядер и отрицательно заряженных электронов, распределенных в пространстве. По структурному устройству и полярности молекулы бывают двух типов
- Полярные молекулы
- Неполярные молекулы
Полярная молекула
Полярная молекула – это молекула, в которой существует разделение центров тяжести положительных и отрицательных зарядов.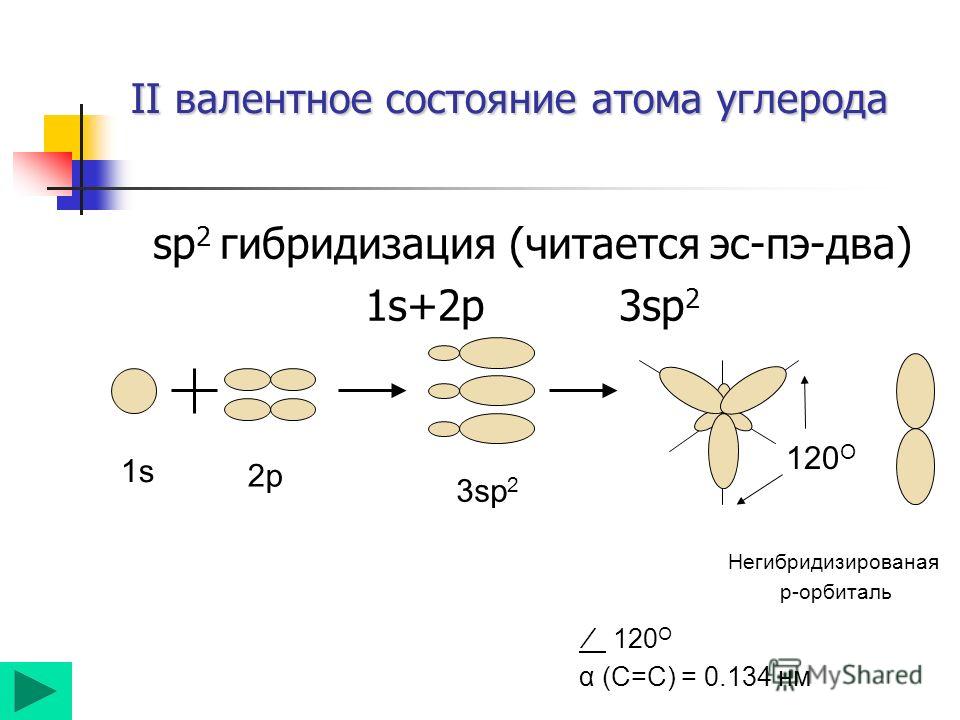 Молекула развила положительный и отрицательный полюс. В норме гетероядерные двухатомные молекулы полярны из-за разницы в электроотрицательности связывающих атомов.
Молекула развила положительный и отрицательный полюс. В норме гетероядерные двухатомные молекулы полярны из-за разницы в электроотрицательности связывающих атомов.
Полярный характер молекулы описывается термином дипольный момент. Примеры некоторых распространенных полярных молекул:
| Пример молекулы | Молекулярная формула | Дипольный момент (Дебай) |
| Фторид водорода | ВЧ | 1,91 |
| Вода | Н 2 О | 1,85 |
| Сероводород | Н 2 С | 1,10 |
| Хлористый водород | HCl | 1,03 |
| Бромоводород | HBr | 0,78 |
| Аммиак | НХ 3 | 1,46 |
| Диоксид серы | SO 2 | 1,63 |
| Монооксид углерода | СО | 0,12 |
| Закись азота | Н 2 О | 0,17 |
| Трифторид азота | НФ 3 | 0,20 |
Неполярная молекула
Неполярная молекула – это молекула, в которой центр тяжести положительного заряда ядер совпадает с центром тяжести отрицательного заряда электрона.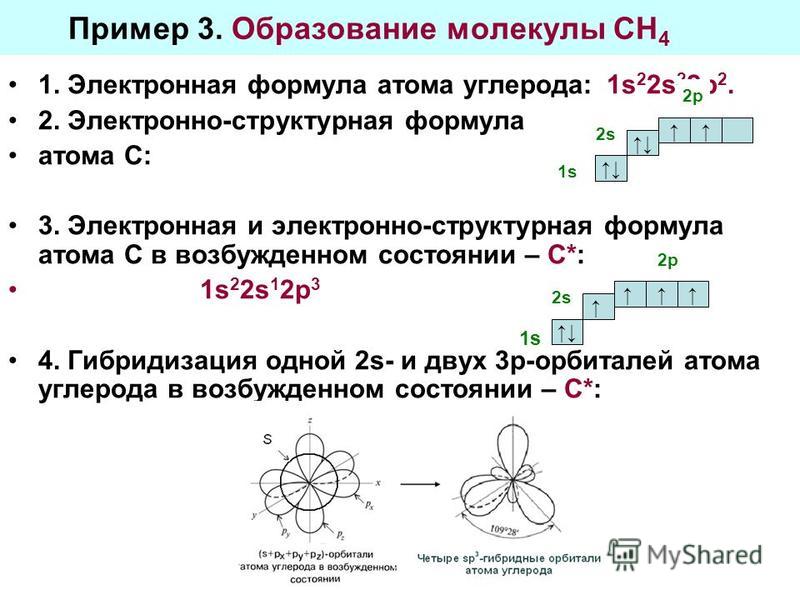
Бинарные гомоядерные молекулы неполярны, так как связывающие элементы обладают одинаковой электроотрицательностью. Примеры некоторых распространенных неполярных молекул:
| Примеры молекул | Молекулярная формула | Дипольный момент (Дебай) |
| Водород | Н 2 | 0 |
| Хлор | Класс 2 | 0 |
| Пентахлорид фосфора | PCl 5 | 0 |
| Углекислый газ | СО 2 | 0 |
| Сероуглерод | CS 2 | 0 |
| Четыреххлористый углерод | ККл 4 | 0 |
| Трехфтористый бор | БФ 3 | 0 |
| Бензол | С 6 Н 6 | 0 |
| Хлорид олова | SnCl 4 | 0 |
| Хлорид бериллия | BeCl 2 | 0 |
Структура молекул
Молекулы с ионными и ковалентными связями удерживаются вместе в трехмерной структуре.
- Ионные молекулы сформировали трехмерную кристаллическую структуру.
- Ковалентные молекулы образуются в результате обмена электронными парами между атомами.
- В металлическом кристалле одна молекула образована металлической связью.
После развития квантовой механики две альтернативные теории и гибридизация используются для объяснения структуры различных типов ковалентных молекул. Эти теории — теория валентной связи и теория молекулярных орбиталей.
Примеры резонанса
Когда химические свойства молекул не могут быть описаны одной структурной схемой, она образует различные типы молекулярных структур, истинная структура в химической науке означает резонансный гибрид чистой молекулы. Резонанс обеспечивает различные типы электронных структур молекул.
Резонансный гибрид молекул уксусной кислоты и газообразного озона приведен под рисунком,
Что такое гибридизация?
В химии гибридизация — это смешивание чистых атомных орбиталей с получением равного числа гибридизованных орбиталей. Например, атом углерода в молекуле метана находится в sp 3 гибридизации.
Например, атом углерода в молекуле метана находится в sp 3 гибридизации.
Правила гибридизации
- Только орбитали с одинаковой энергией, принадлежащие одному и тому же атому или иону, могут быть гибридизированы вместе.
- Количество произведенных гибридизованных орбиталей равно количеству орбиталей, подвергшихся гибридизации.
- Большинство орбиталей похожи, но они не обязательно имеют одинаковую форму.
- По типу гибридизации можно предсказать геометрию и валентный угол молекулы.
Типы гибридизации
sp, sp 2 и sp 3 являются наиболее распространенным типом гибридизации для молекул. Тип гибридизации предсказывает форму молекул. Некоторые общие примеры приведены ниже таблицы,
| Молекула | Типы гибридизации | Форма |
| BeCl 2 | сп | линейный |
| СО 2 | сп | линейный |
| БКл 3 | сп 2 | треугольная планарная |
| SnCl 2 | сп 2 | V-образный |
| CH 4 | сп 3 | четырехгранный |
| Н 2 О | сп 3 | V-образный |
| ПФ 5 | сп 3 д | тригонально-бипирамидальный |
| CLF 3 | сп 3 д | Т-образный |
| СФ 6 | сп 3 д 2 | восьмигранный |
sp-гибридизация
Линейная комбинация одной s- и одной p-орбитали x в подходящей пропорции дает две sp-гибридные орбитали.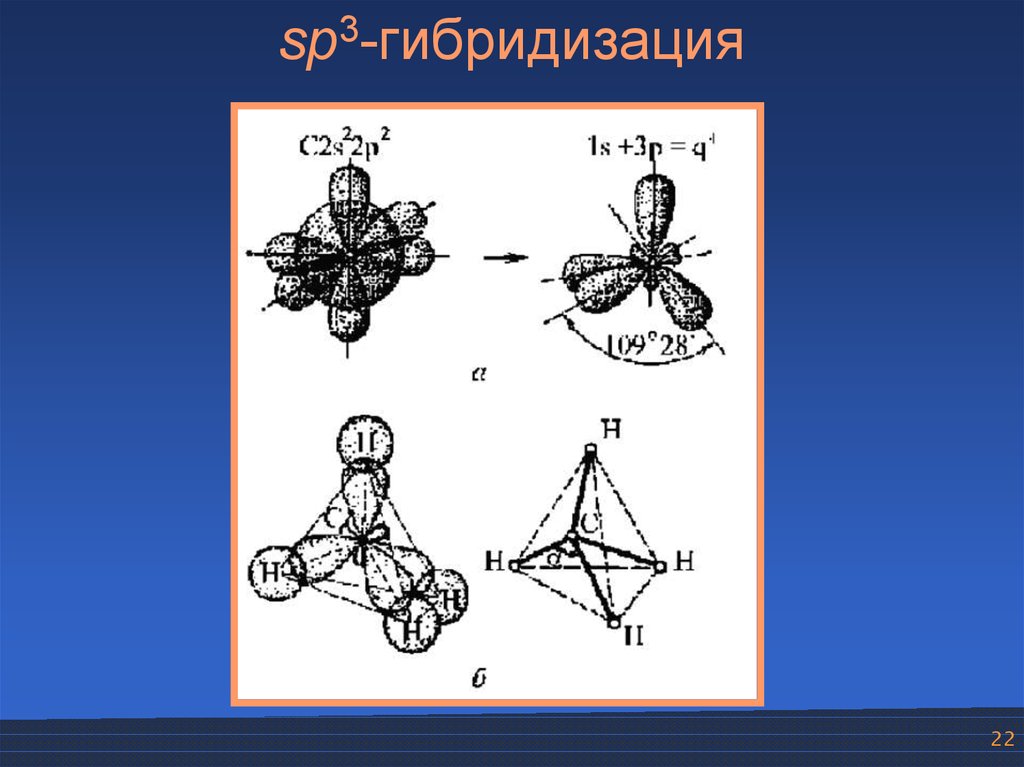 Этот тип гибридизации называется sp-гибридизацией. Смешение одного s и одного p x приведено ниже рисунка,
Этот тип гибридизации называется sp-гибридизацией. Смешение одного s и одного p x приведено ниже рисунка,
sp
2 гибридизация
Смешение одного s и двух p (p x и p y ) атомных орбиталей дает три sp 2 гибридных орбиталей. Формирование гибридизированных орбиталей sp 2 показано над рисунком. При гибридизации sp 2 гибридизованные орбитали образовали тригональную планирующую структуру.
sp
3 гибридизация
Одна s и три p атомные орбитали смешиваются вместе, образуя четыре эквивалентные sp 3 гибридные орбитали. Этот тип смешения атомных орбиталей называется гибридизацией sp 3 . Образование тетраэдра sp 3 гибридизированные орбитали приведены под рисунком,
Примеры молекул
Структура молекулы двуокиси углерода
Пример молекулы двуокиси углерода, образованной такими компонентами, как один атом углерода и два атома кислорода, имеющие линейные структурные формулы .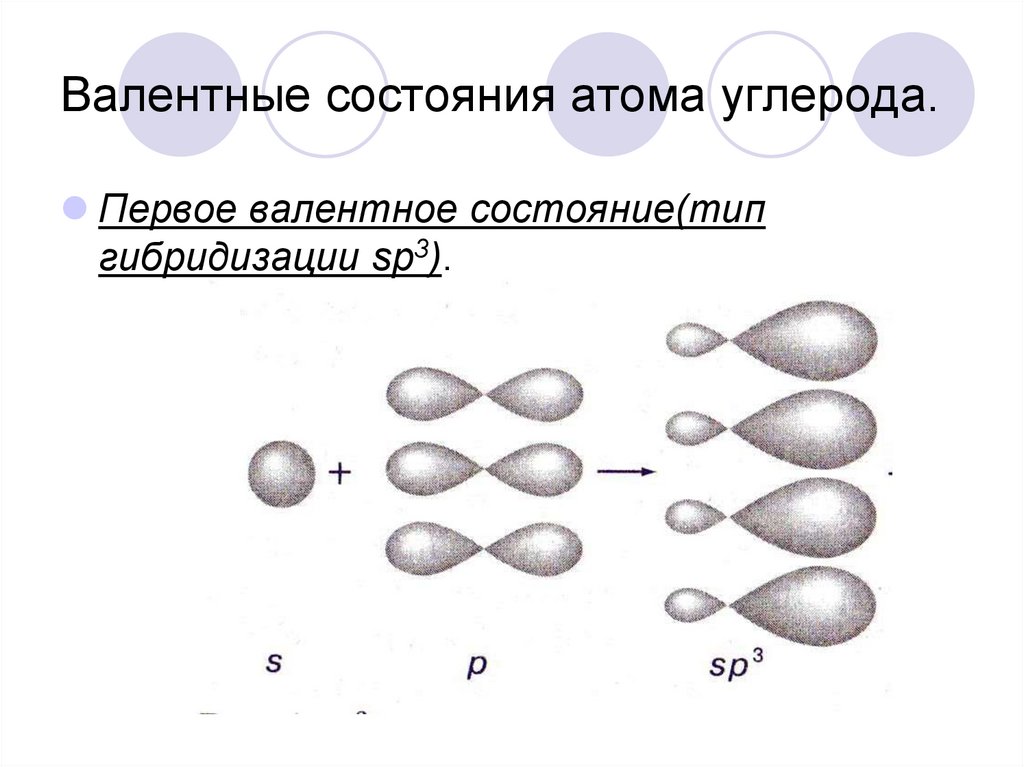
Электронная конфигурация валентной оболочки углерода химического элемента в возбужденном состоянии 2s 1 2p x 1 2p y 1 2p я 1 . Атомы кислорода (нормальное состояние) 2s 2 2p x 1 2p y 1 2p z 1 .
Форма подкладки O=C=O предполагает, что атом углерода является центральным атомом с sp-гидридизацией. Две sp-гибридные орбитали атомов углерода перекрываются с двумя атомами кислорода, образуя две сигма-связи. Еще две полузаполненные 2р-орбитали атомов углерода связываются пи-связями с двумя атомами кислорода.
Экспериментальная длина связи углерод-кислород в молекуле углекислого газа = 1,15 Å. Резонирующая структура молекулы углекислого газа эквивалентна резонансной энергии связи 33 ккал/моль.
BCl
3 гибридизация
Атом бора является центральным атомом в молекуле BCl 3 в химии.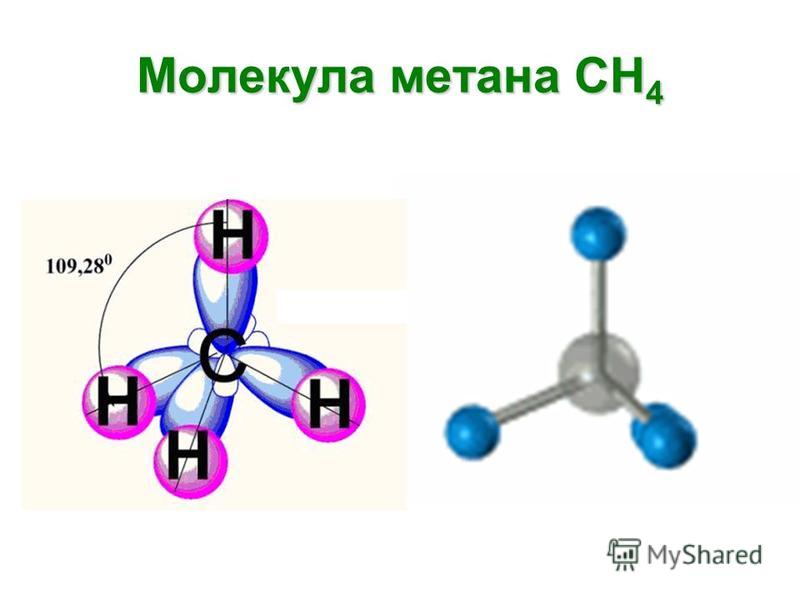 Электронная конфигурация валентной оболочки атома бора в возбужденном состоянии 2s 1 2p x 1 2p z 1 .
Электронная конфигурация валентной оболочки атома бора в возбужденном состоянии 2s 1 2p x 1 2p z 1 .
При гибридизации эти атомные орбитали образуют три sp 2 гибридных орбиталей. Эти гибридизованные орбитали перекрываются с тремя однократно заполненными орбиталями 3p z атома хлора с образованием трех сигма-связей B-Cl. Таким образом, BCl 3 молекула имеет форму треугольника.
В этой молекуле центральный атом бора с неполным октетом. Согласно определению оснований кислот Льюиса, сродство молекулы BCl 3 к принятию пары электронов действует как кислота Льюиса, образуя координационную ковалентную связь с другими молекулами или основаниями Льюиса.
Молекула метана
Молекула метана представляет собой простейший углеводород алкана или молекулу парафина, имеющую молекулярную формулу CH 4 . В молекуле метана возбужденный атом углерода выглядит как 2s 1 2p x 1 2p y 1 2p z 1 электронная конфигурация.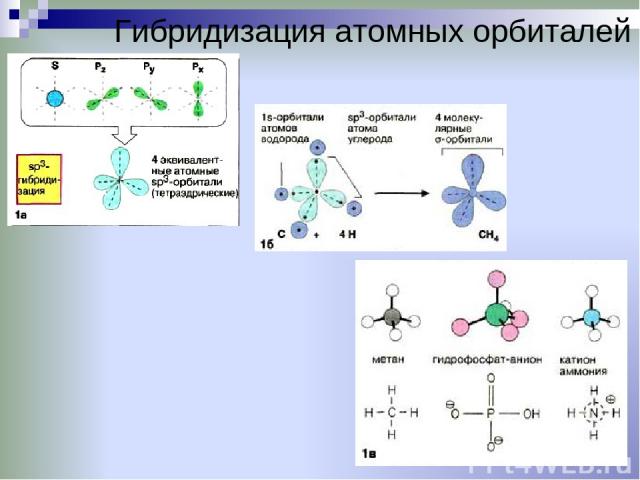
Смешивание этих четырех атомных орбиталей дает четыре эквивалентных sp 3 -гибридных орбиталей. Эти гибридные орбитали направлены к углам правильного тетраэдра. Следовательно, каждые sp 3 -гибридные орбитали перекрываются с 1s-атомными орбиталями четырех атомов водорода путем образования четырех сигма-связей в молекуле метана.
Структура молекулы аммиака
в молекуле аммиака атом азота является центральным атом, определяйте электронную структуру оболочки валентности, 2S 2 2P x 1 2P Y 1 2P Z 10009. Следовательно, четыре атомные орбитали азота гибридизуются с образованием четырех эквивалентных sp 3 -гибридных орбиталей.
Три из этих четырех орбиталей в молекуле аммиака перекрываются с 1s-орбиталями водорода, образуя три сигма-связи, а остальные гибридные орбитали содержат неподеленную пару электронов. Молекула аммиака имеет форму искаженного тетраэдра с валентным углом 107,5º.