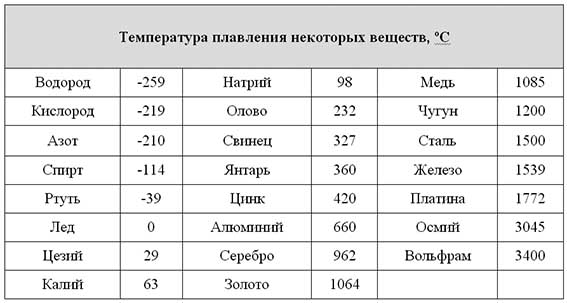
Содержание
Температура плавления и кипения различных веществ
Вещество | Температуры плавления и кипения, °С |
Ag | пл. 962, кип. 2170 |
Ag2O | разл. > 160 |
Al | пл. 660, кип. 2500 |
Al2O3 | пл. 2053, кип. > 3000 |
As | возг. 615, пл. 817 |
AsH3 | пл.- 117, кип.- 62 |
At | пл. 244, кип. 309 |
Au | пл. 1064, кип. 2947 |
B | пл. |
B2O3 | пл. 450, кип. ок. 2000 |
Ba | пл. 727, кип. ок. 1860 |
BaO | пл. ок. 2020 |
Be | пл. 1287, кип. 2507 |
BeO | пл. 2580, кип. 4260 |
Bi | пл. 271, кип. 1564 |
Bi2O3 | пл. 825, кип. 1890 |
C (графит) | пл. 4800 [см. примечание] |
C (алмаз) | 1800 ® C (графит) |
CH4 | пл. |
CO | пл.- 205, кип.- 192 |
CO2 | возг. — 78 |
Ca | пл. 842, кип. 1495 |
CaO | пл. ок. 2614, кип. 2850 |
Cd | пл. 321, кип. 767 |
CdO | возг. ок. 900, разл. |
Cl2 | пл.- 101, кип.- 34 |
ClO2 | пл.- 60, кип. +11 |
Cl2O | пл.- 116, кип. +2 |
Cl2O6 | пл. |
Cl2O7 | пл.- 90, кип. +83 |
Сo | пл. 1494, кип. 2960 |
Cr | пл. 1890, кип. 2680 |
Cr2O3 | пл. 2340, кип. 3000 |
Cs | пл. 29, кип. 668 |
Cu | пл. 1085, кип. 2540 |
CuO | разл. 1026 |
Cu2O | пл. 1240, кип. 1800 |
F2 | пл.- 220, кип.- 188 |
Fe | пл. |
FeO | пл. 1368 |
Fe2O3 | разл. 1390 |
Fr | пл. 21, кип. 660 |
Ga | пл. 30, кип. 2403 |
Ga2O3 | пл. ок. 1725 |
Ge | пл. 937, кип. ок. 2850 |
GeH4 | пл.- 166, кип.- 89 |
H2 | пл.- 259, кип.- 253 |
HBr | пл.- 87, кип.- 67 |
HCl | пл.- 114, кип.- 85 |
HF | пл. |
HI | пл.- 51, кип.- 35 |
HN3 | пл.- 80, кип. +36 |
HNO3 | пл.- 42, кип. +83, разл. |
H2O | пл. 0, кип. 100 |
H2O2 | пл.- 0,4, разл. +150 |
H(PH2O2) | пл. 27, разл. 140 |
H2(PHO3) | пл. 74, разл. 200 |
H3PO4 | пл. 42, разл. 150 |
H4P2O7 | пл. |
H2S | пл.- 86, кип.- 60 |
H2SO4 | пл. 10, кип. 296, разл. |
H2Se | пл.- 66, кип.- 42 |
H2SeO3 | пл. и разл. 70 |
H2SeO4 | пл. 62 |
H2Te | пл.- 51, кип.- 2, разл. |
H2TeO3 | 40 ® TeO2 |
H6TeO6 | пл. 136, 220 ® TeO3 |
Hg | пл. |
HgO | разл. > 400 |
I2 | пл. 114, кип. 184 |
I2O5 | разл. 275-350 |
In | пл. 157, кип. 2024 |
In2O3 | пл. 1910, кип. ок. 3300 |
K | пл. 64, кип. 760 |
Li | пл. 180, кип. 1337 |
Mg | пл. 648, кип. 1095 |
MgO | пл. 2825, кип. 3600 |
Mn | пл. 1245, кип. |
MnO | пл. 1780 |
MnO2 | разл. > 535 |
Mn2O3 | 940 ® (MnIIMn2III)O4 |
Mn2O7 | пл. 6, разл. > 55 |
Mo | пл. 2620, кип. 4630 |
N2 | пл.- 210, кип.- 196 |
NH3 | пл.- 78, кип.- 33 |
N2H4 | пл. 2, кип. 114 |
NH2OH | пл. 32, разл. > 100 |
NO | пл. |
NO2 | < 21 ® N2O4 |
N2O | пл.- 91, кип.- 89 |
N2O3 | кип.- 40, разл. > +5 |
N2O4 | пл.- 11, кип. 21, разл. |
N2O5 | пл. 41, разл. |
Na | пл. 98, кип. 886 |
Ni | пл. 1455, кип. ок. 2900 |
NiO | пл. 1955 |
O2 | пл. |
O3 | пл.- 193, кип.- 112 |
OF2 | пл.- 224, кип.- 145 |
P (красный) | возг. 416 |
P4 (белый) | пл. 44, кип. 287 |
PH3 | пл.- 134, кип.- 87 |
P4O6 | пл. 24, кип. 175 |
P4O10 | возг. 359, пл. 422 |
Pb | пл. 328, кип. 1745 |
PbO | пл. 886, кип. 1535 |
PbO2 | разл. |
(Pb2IIPbIV)O4 | 550 ® PbO |
Ra | пл. 969, кип. 1536 |
Rb | пл. 39, кип. 696 |
Re | пл. 3190, кип. ок. 5900 |
S8 (монокл.) | пл. 119, кип. 445 |
S8 (ромб.) | 96 ® S8 (монокл.) |
SO2 | пл.- 75, кип.- 10 |
SO3 | пл. 17, кип. 45 |
Sb | пл. 631, кип. |
SbH3 | пл. — 94, кип. — 18 |
Sb2O3 | пл. 655, кип. 1456 |
Se | пл. 217, кип. 685 |
SeO2 | возг. 315, пл. 340 |
SeO3 | пл. 118, разл. > 185 |
Si | пл. 1415, кип. ок. 3250 |
SiH4 | пл.- 185, кип.- 112 |
SiO2 (кварц) | пл. 1550, кип. 2950 |
Sn | пл. 232, кип. 2620 |
SnO | пл. |
SnO2 | пл. 1630, кип. 2500 |
Sr | пл. 768, кип. 1390 |
Tc | пл. 2250, кип.ок. 4600 |
Te | пл. 450, кип. 990 |
TeO2 | пл. 733, кип. 1257 |
TeO3 | разл. > 400 |
Ti | пл. 1668, кип. 3260 |
TiO2 | пл. 1870, кип. ок. 3000 |
Tl | пл. 304, кип. 1457 |
Tl2O | пл. |
V | пл. 1920, кип. 3450 |
W | пл. 3387, кип. ок. 5680 |
Zn | пл. 420, кип. 906 |
ZnO | возг. 1725, разл. |
Сокращения:
возг. — возгонка; кип. — кипение; ок. — около;
пл. — плавление; разл. — разложение; ® — переход одного вещества в другое
Примечание: определение температуры плавления графита является очень важной, но очень сложной научной проблемой, которой занимаются во всем мире. В данном справочнике мы приводим значение, которое, исходя из обзора Савватимского Александра Ивановича, зав. лаб. электровзрывных процессов ОИВТ РАН, является в настоящее время наиболее обоснованным и полученным с помощью самых современных методов. Обзор и описание методов см. в работах:
Обзор и описание методов см. в работах:
Савватимский А.И.»Плавление графита и жидкий углерод» УФН том 173 №12 стр.1371
A. I. Savvatimskiy. «Liquid carbon density and resistivity» J. Phys.: Condens. Matter 20 (2008) 114112
Korobenko V.N., Savvatimskiy A.I. «Graphite melting temperature» Electronic journal “INVESTIGATED IN RUSSIA” 2161
Примечание ко всем таблицам свойств: источниками справочных данных являются публикации в Интернете, поэтому они не могут считаться «официальными» и «абсолютно точными». Как правило, в Интернет справочниках не приводятся ссылки на научные работы, являющиеся основой опубликованных данных. Мы стараемся брать информацию из наиболее надежных научных сайтов. Однако если кого-то интересуют ссылки на эксперименты, советуем произвести самостоятельно углубленный поиск в Интернете. Будем признательны за любые комментарии к нашим справочным таблицам, а особенно за уточнения существующей информации или дополнение справочных данных.
ICSC 0876 — ДИИЗООКТИЛФТАЛАТ
ICSC 0876 — ДИИЗООКТИЛФТАЛАТ
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ДИИЗООКТИЛФТАЛАТ | ICSC: 0876 (Октябрь 2005) |
| CAS #: 27554-26-3 |
| EINECS #: 248-523-5 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее.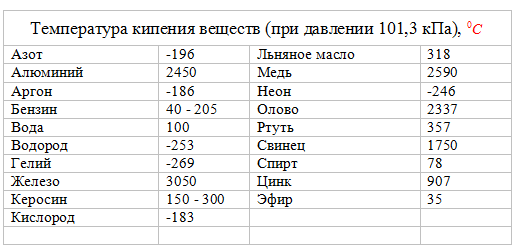 | НЕ использовать открытый огонь. | Использовать распыленную воду, пену, порошок, двуокись углерода. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Применять вентиляцию. | Свежий воздух, покой. | |
| Кожа | Защитные перчатки. | Ополоснуть и затем промыть кожу водой с мылом. | |
| Глаза | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. | |
| Проглатывание | Не принимать пищу, напитки и не курить во время работы.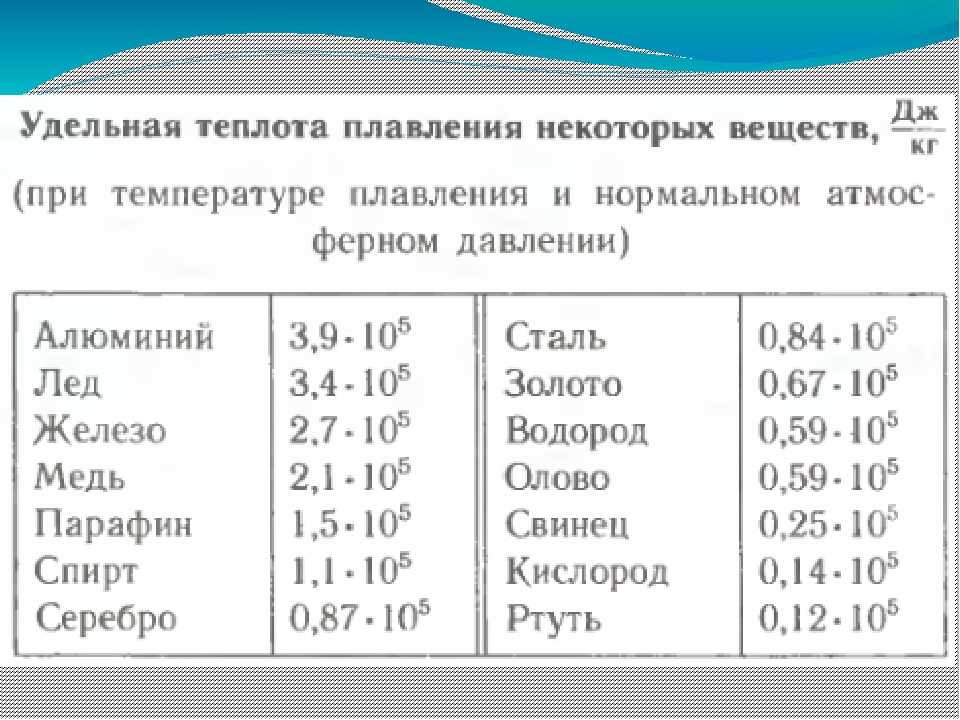 | Прополоскать рот. | |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| МеталлическиеСобрать подтекающую жидкость в герметичные контейнеры. Удалить оставшуюся жидкость при помощи песка или инертного абсорбента. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных окислителей. | |
| УПАКОВКА | |
| ДИИЗООКТИЛФТАЛАТ | ICSC: 0876 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C24H38O4 / (C8H17COO)2C6H4 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Точка плавления воды в градусах Цельсия, Фаренгейта и Кельвина
32 °F или 273 K.
Температура плавления воды — это температура, при которой твердый лед превращается в жидкую воду, которая составляет 0 °C, 32 °F или 273 K.
Разница между точкой замерзания и точкой плавления
В большинстве случаев точка замерзания и точка плавления воды имеют одну и ту же температуру. Но иногда температура замерзания намного ниже температуры плавления. Вода испытывает переохлаждение. Переохлаждение — это когда очень чистая вода, свободная от растворенных газов или примесей, не имеет центров зародышеобразования, которые позволяют образовываться льду. Переохлаждение потенциально снижает температуру замерзания воды до -48,3 °C или -55 °F!
Влияние давления на точку плавления воды
Давление влияет на температуру кипения, замерзания и плавления воды. Два способа оценить влияние давления на точку плавления — обратиться к фазовой диаграмме и использовать уравнение Клаузиуса-Клапейрона, которое связывает давление и температуру между двумя фазами вещества. Повышение давления снижает температуру плавления воды. Например, при давлении 800 бар (11603 фунтов на кв. дюйм) температура плавления воды составляет -6,9 °C. Когда вы уменьшаете давление, в конце концов вы достигаете точки, в которой твердый лед испаряется, а не превращается в жидкость.
Повышение давления снижает температуру плавления воды. Например, при давлении 800 бар (11603 фунтов на кв. дюйм) температура плавления воды составляет -6,9 °C. Когда вы уменьшаете давление, в конце концов вы достигаете точки, в которой твердый лед испаряется, а не превращается в жидкость.
Другие факторы, влияющие на температуру плавления воды
Помимо давления на температуру плавления влияют и другие факторы, в том числе примеси, структура льда и начальный размер твердого вещества.
Примеси нарушают связи между молекулами, облегчая преодоление межмолекулярных сил между ними. В воде и большинстве других соединений примеси повышают температуру плавления. Так, грязный лед тает при более высокой температуре, чем чистый лед.
Знакомая форма твердой воды — шестиугольный лед (лед Ih), но молекулы воды организуются в другие кристаллические формы, которые имеют разные температуры плавления.
В наноразмерном льду проявляется явление понижения температуры плавления. Депрессия точки плавления – это снижение температуры плавления при уменьшении размера образца. В повседневном мире лед состоит из множества молекул воды, поэтому понижение температуры плавления не является проблемой. Но если у вас есть только несколько молекул воды, температура плавления снижается, потому что лед имеет большее отношение поверхности к объему, чем обычно. Сцепление между несколькими молекулами увеличивается, что затрудняет их разделение и изменение фазы. По сути, молекулы воды сильнее связываются друг с другом, потому что у них не так много соседних молекул, влияющих на них межмолекулярными силами.
Депрессия точки плавления – это снижение температуры плавления при уменьшении размера образца. В повседневном мире лед состоит из множества молекул воды, поэтому понижение температуры плавления не является проблемой. Но если у вас есть только несколько молекул воды, температура плавления снижается, потому что лед имеет большее отношение поверхности к объему, чем обычно. Сцепление между несколькими молекулами увеличивается, что затрудняет их разделение и изменение фазы. По сути, молекулы воды сильнее связываются друг с другом, потому что у них не так много соседних молекул, влияющих на них межмолекулярными силами.
Понижение точки плавления — это процесс, сильно отличающийся от понижения точки замерзания, при котором примеси снижают температуру замерзания вещества. Как уже говорилось, примеси повышают, а не понижают температуру плавления льда.
Ссылки
- Clapeyron, MC (1834). «Mémoire sur la puissance motrice de la chaleur». Journal de l’École polytechnique .
 23: 153–190.
23: 153–190. - Фейстель, Р.; Вагнер, В. (2006). «Новое уравнение состояния для H 2 O Ice Ih». J. Phys. хим. Ссылка Данные . 35 (2): 1021–1047. doi: 10.1063/1.2183324
- Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). КПР Пресс. ISBN 978-1439855119.
Лед и вода. Температура плавления в зависимости от давления
Температура плавления: Температура, при которой твердое тело превращается в жидкость.
Точка плавления воды зависит от давления надо льдом (твердая вода), а точка плавления или температура замерзания снижается с увеличением давления. По определению 0 °C соответствует температуре плавления воды при давлении в 1 атмосферу.
Онлайн-калькулятор температуры плавления льда и воды
Приведенный ниже калькулятор можно использовать для расчета температуры плавления воды при заданном давлении.
Температура на выходе указывается в °C, °F, K и °R.
Внимание! Давление должно быть в пределах 0,01-2000 бар абс., 0,1-29 000 фунтов на кв. дюйм, 5-1500 000 мм рт. ст. или 0,2-59000 дюймов рт. ст.
Термодинамические свойства при стандартных условиях см. в разделе «Вода и тяжелая вода».
См. также другие свойства Вода при при различных температуре и давлении : Температуры кипения при высоком давлении, Температуры кипения при вакууме, Плотность и удельный вес, Динамическая и кинематическая вязкость, Энтальпия и энтропия, Теплота парообразования, Константа ионизации, pK w , от нормальной и тяжелая вода, число Прандтля, свойства в условиях газожидкостного равновесия, давление насыщения, удельный вес, удельная теплоемкость (теплоемкость), удельный объем, теплопроводность, температуропроводность и давление пара при газожидкостном равновесии.
| Pressure | Temperature | |||||
| [MPa] | [bara] | [psia] | [mm Hg] | [in Hg] | [°C] | [°F] |
0. 000612 000612 | 0.00612 | 0.089 | 4.59 | 0.18 | 0.01 | 32.02 |
| 0.1 | 1.01325 | 14.7 | 750 | 29.5 | 0.0026 | 32.00 |
| 1 | 10 | 145 | 7501 | 295 | -0.064 | 31.88 |
| 2 | 20 | 290 | 15001 | 591 | -0.14 | 31.75 |
| 5 | 50 | 725 | 37503 | 1476 | -0.37 | 31.33 |
| 10 | 100 | 1450 | 75006 | 2953 | -0.75 | 30.65 |
| 15 | 150 | 2176 | 112509 | 4429 | -1.14 | 29.95 |
| 20 | 200 | 2901 | 150012 | 5906 | -1. 54 54 | 29.23 |
| 30 | 300 | 4351 | 225019 | 8859 | -2.36 | 27.75 |
| 40 | 400 | 5802 | 300025 | 11812 | -3.21 | 26.22 |
| 50 | 500 | 7252 | 375031 | 14765 | -4.09 | 24.64 |
| 60 | 600 | 8702 | 450037 | 17718 | -5.00 | 23.00 |
| 70 | 700 | 10153 | 525043 | 20671 | -5.94 | 21.31 |
| 80 | 800 | 11603 | 600049 | 23624 | -6.91 | 19.56 |
| 90 | 900 | 13053 | 675056 | 26577 | -7.91 | 17.
|

 2075, кип. 3700
2075, кип. 3700 — 182, кип.- 162
— 182, кип.- 162 4, разл. > 20
4, разл. > 20 1539, кип. ок. 3200
1539, кип. ок. 3200 — 84, кип. +20
— 84, кип. +20 61, разл. 300
61, разл. 300 — 39, кип. +357
— 39, кип. +357 2080
2080 — 164, кип.- 152
— 164, кип.- 152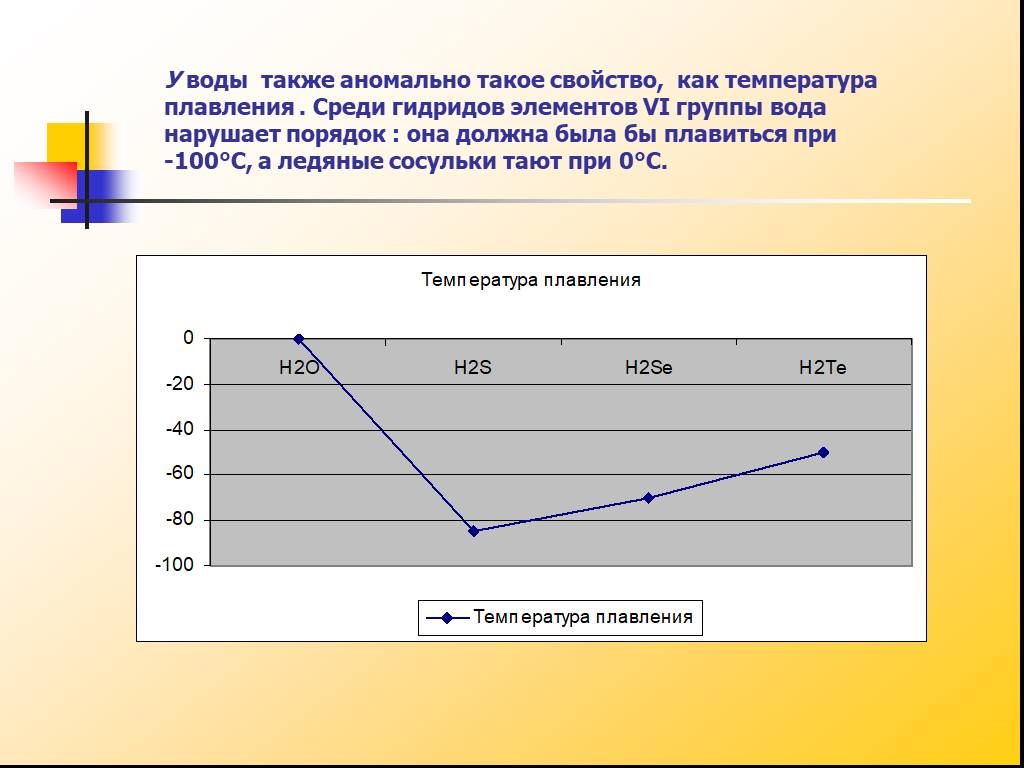 — 219, кип.- 183
— 219, кип.- 183 > 344
> 344 1634
1634 1040, кип. 1425
1040, кип. 1425 303, кип. ок. 1100
303, кип. ок. 1100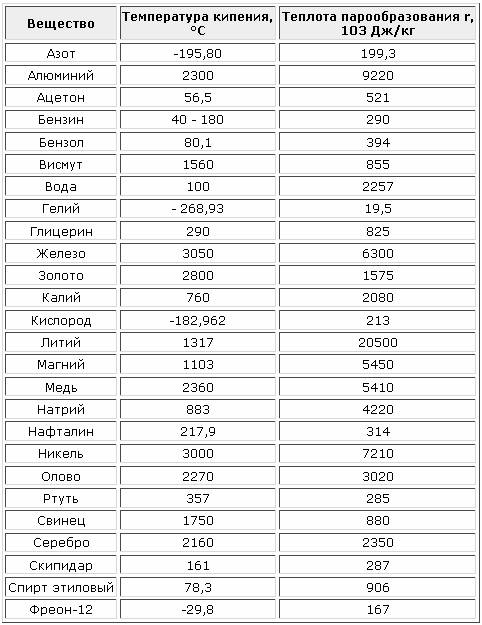

 23: 153–190.
23: 153–190.