Содержание
ВОДА, ЛЕД И ПАР | Энциклопедия Кругосвет
Содержание статьи
- Историческая справка.
- Распространенность.
- Морская вода.
- Минеральная вода.
- Мягкая и жесткая вода.
- Молекулярная структура.
- ВОДА
- Физические свойства.
- Давление паров.
- Химические свойства.
- Каталитическое действие.
- Гидраты.
- Гидролиз.
- Сольватация.
- Тяжелая вода.
- ЛЕД
- ПАР
ВОДА, ЛЕД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Историческая справка.
Идея древних философов о том, что все в природе образуют четыре элемента (стихии): земля, воздух, огонь и вода, просуществовала вплоть до Средних веков. В 1781 Г.Кавендиш сообщил о получении им воды при сжигании водорода, но не оценил в полной мере важности своего открытия. Позже (1783) А.Лавуазье доказал, что вода вовсе не элемент, а соединение водорода и кислорода. Й.Берцелиус и П.Дюлонг (1819), а также Ж.Дюма и Ж.Стас (1842) установили весовой состав воды, пропуская водород через оксид меди, взятый в строго определенном количестве, и взвешивая образовавшиеся медь и воду. Исходя из этих данных, они определили отношение Н:О для воды. Кроме того, в 1820-х годах Ж.Гей-Люссак измерил объемы газообразных водорода и кислорода, которые при взаимодействии давали воду: они соотносились между собой как 2:1, что, как мы теперь знаем, отвечает формуле Н2О.
Й.Берцелиус и П.Дюлонг (1819), а также Ж.Дюма и Ж.Стас (1842) установили весовой состав воды, пропуская водород через оксид меди, взятый в строго определенном количестве, и взвешивая образовавшиеся медь и воду. Исходя из этих данных, они определили отношение Н:О для воды. Кроме того, в 1820-х годах Ж.Гей-Люссак измерил объемы газообразных водорода и кислорода, которые при взаимодействии давали воду: они соотносились между собой как 2:1, что, как мы теперь знаем, отвечает формуле Н2О.
Распространенность.
Вода покрывает 3/4 поверхности Земли. Тело человека состоит из воды примерно на 70%, яйцо – на 74%, а некоторые овощи – это почти одна вода. Так, в арбузе ее 92%, в спелых томатах – 95%.
Вода в природных резервуарах никогда не бывает однородной по составу: она проходит через горные породы, соприкасается с почвой и воздухом, а потому содержит растворенные газы и минеральные вещества. Более чистой является дистиллированная вода.
Морская вода.
Состав морской воды различается в разных регионах и зависит от притока пресных вод, скорости испарения, количества осадков, таяния айсбергов и т. д. См. также ОКЕАН.
д. См. также ОКЕАН.
Минеральная вода.
Минеральная вода образуется при просачивании обычной воды сквозь породы, содержащие соединения железа, лития, серы и других элементов.
Мягкая и жесткая вода.
Жесткая вода содержит в больших количествах соли кальция и магния. Они растворяются в воде при протекании по породам, сложенным гипсом (СaSO4), известняком (СаСО3) или доломитом (карбонаты Mg и Са). В мягкой воде этих солей мало. Если вода содержит сульфат кальция, то говорят, что она обладает постоянной (некарбонатной) жесткостью. Ее можно умягчить добавлением карбоната натрия; это приведет к осаждению кальция в виде карбоната, а в растворе останется сульфат натрия. Соли натрия не вступают в реакцию с мылом, и расход его будет меньше, чем в присутствии солей кальция и магния.
Вода, обладающая временной (карбонатной) жесткостью, содержит бикарбонаты кальция и магния; ее можно умягчить несколькими способами: 1) нагреванием, приводящим к разложению бикарбонатов на нерастворимые карбонаты; 2) добавлением известковой воды (гидроксида кальция), в результате чего бикарбонаты превращаются в нерастворимые карбонаты; 3) с помощью обменных реакций.
Вода, содержащая в большом количестве растворенный диоксид углерода, просачиваясь через известняковые породы, растворяет их, что приводит к образованию пещер. При повышении температуры начинается обратный процесс: бикарбонат разлагается и вновь образуется известняк. Именно из него состоят сталактиты и сталагмиты.
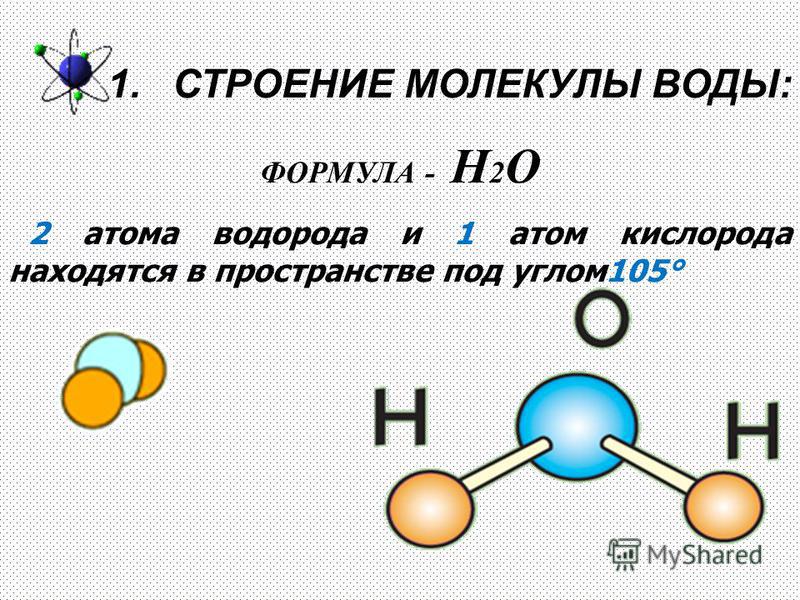
Молекулярная структура.
Анализ данных, полученных из спектров поглощения, показал, что три атома в молекуле воды образуют равнобедренный треугольник с двумя атомами водорода в основании и кислородом в вершине:
Валентный угол НОН равен 104,31°, длина связи О–Н составляет 0,99 Å (1 Å = 10–8 см), а расстояние Н–Н равно 1,515 Å. Атомы водорода так глубоко «внедрены» в атом кислорода, что молекула оказывается почти сферической; ее радиус – 1,38 Å.
ВОДА
Физические свойства.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0° С) и кипения (100° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей.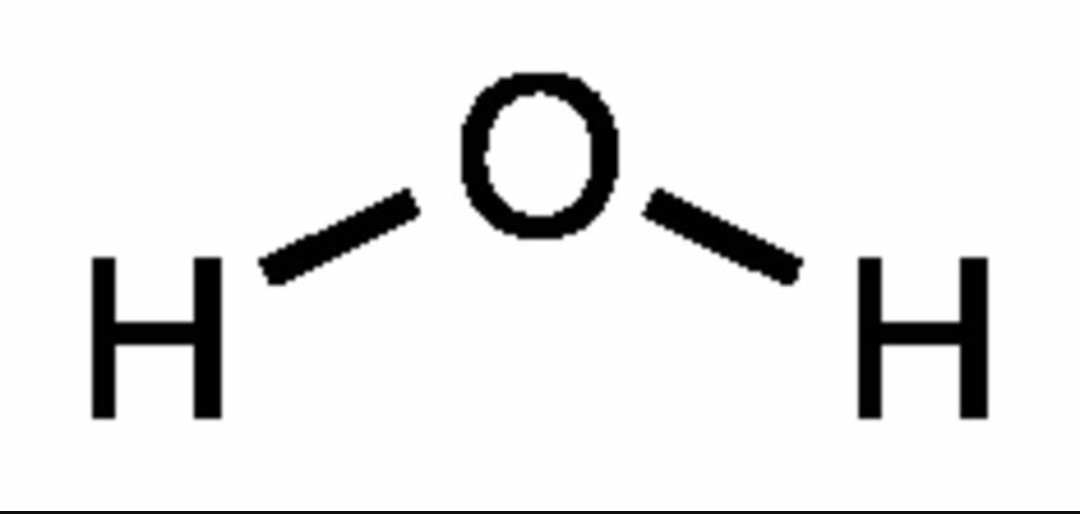 Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества, ее удельная электропроводность равна 1,5Ч10–8 Ом–1Чсм–1 при 0° С. Сжимаемость воды очень мала: 43Ч10–6 см3 на мегабар при 20° С. Плотность воды максимальна при 4° С; это объясняется свойствами водородных связей ее молекул.
Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества, ее удельная электропроводность равна 1,5Ч10–8 Ом–1Чсм–1 при 0° С. Сжимаемость воды очень мала: 43Ч10–6 см3 на мегабар при 20° С. Плотность воды максимальна при 4° С; это объясняется свойствами водородных связей ее молекул.
Давление паров.
Если оставить воду в открытой емкости, то она постепенно испарится – все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт. ст. и температура кипения оказывается равной 90° С.
ст. и температура кипения оказывается равной 90° С.
Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье.
Вязкость воды с ростом температуры быстро уменьшается и при 100° С оказывается в 8 раз меньше, чем при 0° С.
Химические свойства.
Каталитическое действие.
Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.
Гидраты.
Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4Ч5H2O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250° С. Еще один стабильный гидрат – серная кислота; она существует в двух гидратных формах, SO3ЧH2O и SO2(OH)2, между которыми устанавливается равновесие.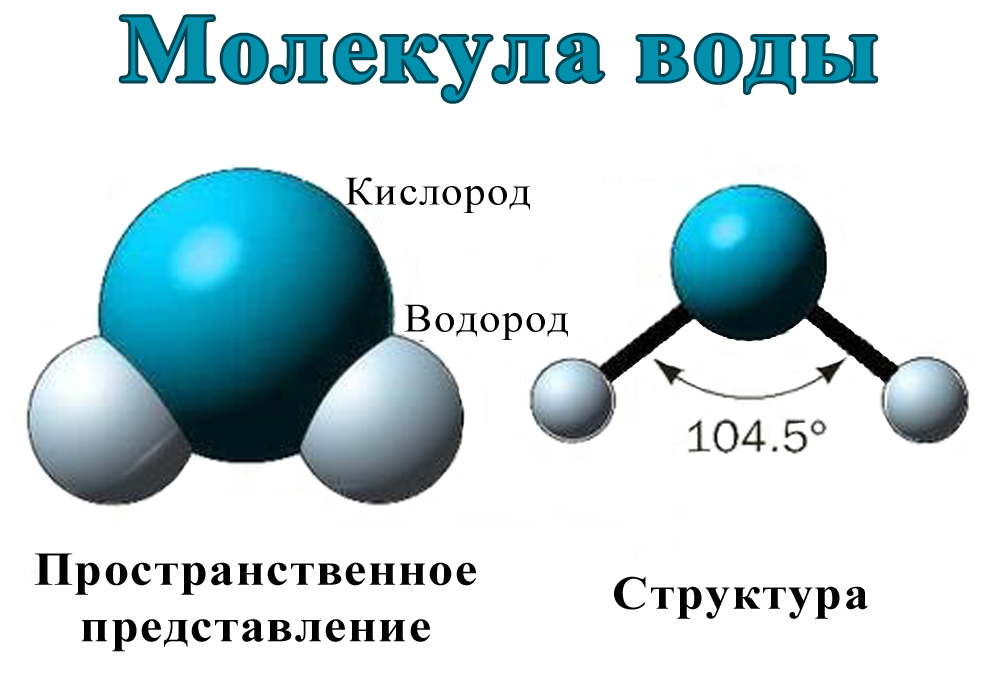 Ионы в водных растворах тоже часто бывают гидратированы. Так, Н+ всегда находится в виде иона гидроксония Н3О+ или Н5О2+; ион лития – в виде Li (H2O)6+ и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2Ч10 H2O и Cl2Ч6H2О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2Ч2H2O, английская соль (сульфат магния) MgSO4Ч7H2O, питьевая сода (карбонат натрия) Na2CO3Ч10 H2O, глауберова соль (сульфат натрия) Na2SO4Ч10 H2O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4Ч5H2O, CuSO4Ч3H2O и CuSO4ЧH2O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду.
Ионы в водных растворах тоже часто бывают гидратированы. Так, Н+ всегда находится в виде иона гидроксония Н3О+ или Н5О2+; ион лития – в виде Li (H2O)6+ и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2Ч10 H2O и Cl2Ч6H2О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2Ч2H2O, английская соль (сульфат магния) MgSO4Ч7H2O, питьевая сода (карбонат натрия) Na2CO3Ч10 H2O, глауберова соль (сульфат натрия) Na2SO4Ч10 H2O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4Ч5H2O, CuSO4Ч3H2O и CuSO4ЧH2O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Гидролиз.
Гидролиз – это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой:
PCl3 + 3H2O = P (OH)3 + 3HCl
Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.
Сольватация.
Вода – полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И.А.Каблуковым.
Тяжелая вода.
В 1931 Г.Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа.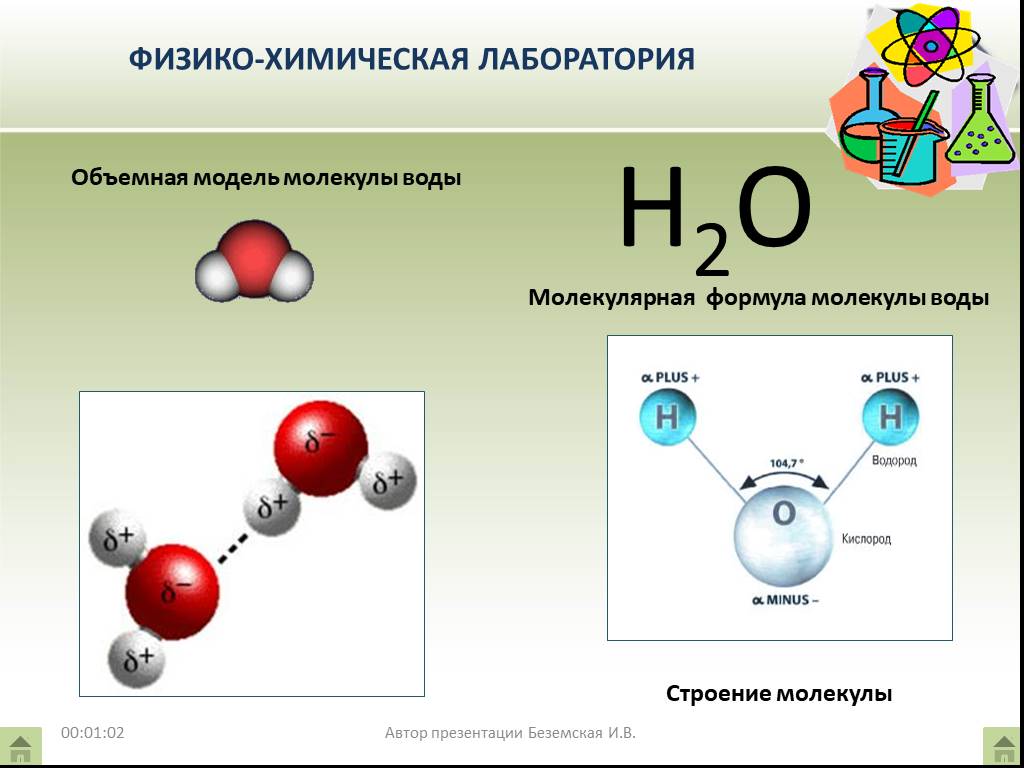 Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий – важный участник реакций ядерного синтеза.
Третий изотоп водорода – тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах – 1:1019, в глубинных водах он отсутствует. См. также ВОДОРОД.
В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах – 1:1019, в глубинных водах он отсутствует. См. также ВОДОРОД.
ЛЕД
Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка.
Лед при нормальном давлении существует только при температуре 0° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема. См. также АЙСБЕРГИ.
ПАР
Пар – газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот «пар», который вырывается из кипящего чайника, – это на самом деле множество мельчайших капелек воды.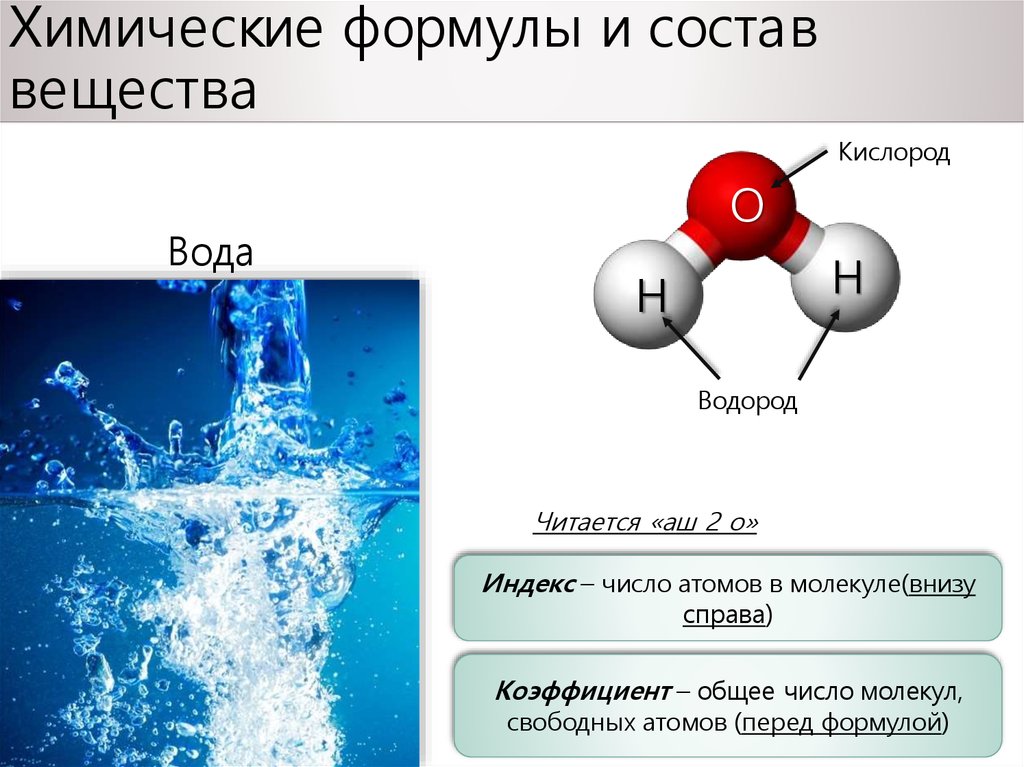 Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню.
Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню.
Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, – утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях. См. также КОТЕЛ ПАРОВОЙ; ДВИГАТЕЛЬ ТЕПЛОВОЙ; ТЕПЛОТА; ТЕРМОДИНАМИКА.
химическая формула, почему не отличается от воды, строение молекулы, какие формулы используются в химии для расчетов, связанных с водяным паром?
Содержание
- Химическая формула
- Почему не отличается от воды?
- Строение молекулы
- Какие используются формулы для расчетов, связанных с водяным паром?
- Заключение
Химическая формула
Химическая формула водяного пара не отличается от формулы воды h3O.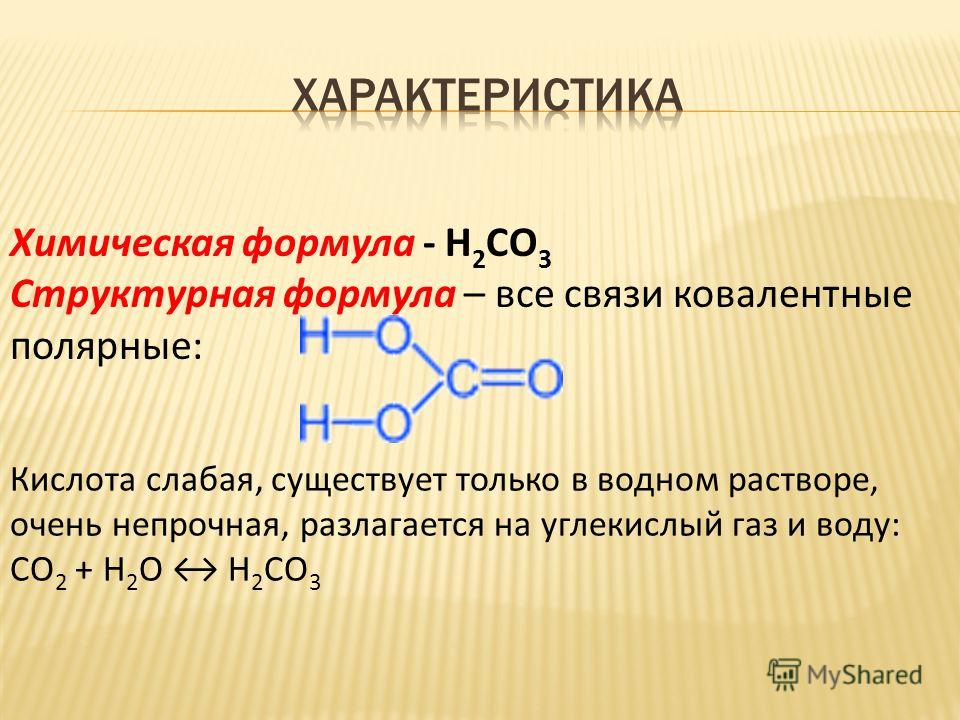
Она состоит из 2 атомов водорода и одного атома кислорода, которые между собой соединены при помощи ковалентных связей и образуют равносторонний треугольник.
При этом молекула пара представляет собой одиночную молекулу. В воде эти молекулы образуют целую структуру из связанных между собой частиц.
Почему не отличается от воды?
Отсутствие отличия заключается в исходной формуле. Молекула воды не теряет ковалентных связей при фазовом переходе.
Теряется только водородная связь между молекулами, что определяет скорость парообразования. Также остается неизменной и молярная масса воды, которая составляет 18 г/моль.
Строение молекулы
Молекула водяного пара состоит из одного атома кислорода и двух атомов водорода. В классическом написании формула выглядит как h3O, но наглядно ее можно представить в виде H-O-H.
Молекуле воды свойственно:
- Атомы водорода и кислорода образуют равнобедренный треугольник.

- Атомы связаны ковалентной связью.
- Угол связи составляет 104,31 градуса.
- Расстояние между О-Н 0,99°А, что примерно равно 10-8 см.
- Расстояние между Н-Н составляет 1,5°А.
- За счет плотного расположения всех атомов, относительно друг друга, молекула представляет собой сферу, радиусом 1,38 °А.
- Молекулы воды между собой соединены водородной связью. Именно она разрывается при переходе из жидкого состояния в газообразное с последующим вытеснением молекул воды с поверхности жидкости.
Именно тесное соединение между атомами водорода и кислорода определяет температуру кипения и парообразования, которые составляют 100 градусов при атмосферном давлении 101 кПа. При этих параметрах воздействия разрывается связь между молекулами, так как они получают достаточную кинетическую энергию для разрыва связи и выхода с поверхности.
Какие используются формулы для расчетов, связанных с водяным паром?
Для расчета различных параметров водяного пара используются следующие формулы:
Удельная теплота парообразования при обращении воды в пар: L=Q/m или Q=Lm, где:
- Q – количество теплоты;
- L – удельная теплота парообразования;
- M — масса.

Энтальпия пара: h=u+pv, где:
- H – энтальпия;
- U – внутренняя энергия;
- P — давление;
- V — объем.
Плотность: P=PM/Rt, где:
- p — плотность;
- P – плотность насыщенного пара;
- M – молярная масса;
- R – газовая постоянная;
- T — температура.
Влажность: φ= p/po*100%, где:
- φ — влажность;
- p-po — абсолютное и относительное давление;
- 100% — влажность.
Давление насыщенного пара: po=nkt, где:
- po – давление;
- n – концентрация молекул;
- K – постоянная Больцмана;
- T – температура.
Абсолютная влажность: P=m/v=Mp/Rt, где:
- P – абсолютная влажность;
- m – молярная масса;
- V – объем;
- M – масса;
- P – давление;
- R – газовая постоянная;
- T – температура.
Это основные формулы для расчета различных параметров водяного пара, которые используются в физике, промышленных и инженерных расчетах.
Заключение
Вода – это структура, состоящая из молекул, связанных между собой водородной связью. При нагревании, водородная связь разрывается, и молекулы воды покидают структуру. При этом собственная структура молекулы не разрушается.
При конденсации пара, отдельные молекулы воды снова выстраивают структуру. Иными словами, при парообразовании меняется только структура воды, а не ее отдельные молекулы.
А какова Ваша оценка данной статье?
Загрузка…
Тайна, искусство и наука о воде: химия воды: структура
Вода — это химическое вещество!?
Верно! Вода является одним из самых распространенных химических веществ. Его химическая формула h30, пожалуй, самая известная из всех химических формул.
О чем говорит нам химическая формула?
Формула h30 говорит нам, что одна молекула воды состоит из 2 атомов водорода и одного атома кислорода, связанных вместе. Связи, удерживающие водород и кислород вместе, называются ковалентными, они очень прочные.
Связи, удерживающие водород и кислород вместе, называются ковалентными, они очень прочные.
Давайте посмотрим на изображение молекулы воды: на этом рисунке два атома водорода представлены белыми сферами, а кислород — красной сферой.
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, Джон У. Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, издательство Macmillan Publishing Company, Нью-Йорк, 1993 г.
На этом втором изображении водороды показаны белыми сферами, а кислород — красной сферой. «Палочки», соединяющие атомы водорода с кислородом, представляют собой ковалентные связи.
Почему молекула воды выглядит изогнутой?
Молекула воды сохраняет изогнутую форму (фактически изогнута под углом 107,5 градусов) из-за двух соображений. Во-первых, тетраэдрическое расположение вокруг кислорода, а во-вторых, наличие неподеленной пары электронов на кислороде.
Что такое неподеленная пара электронов?
Это электроны, которые не участвуют в ковалентных связях. Пары электронов остаются в покое. На нашем рисунке они представлены двойными точками. Эти неподеленные пары очень негативны — содержат по два отрицательных электрона в каждой — и стараются держаться подальше друг от друга, насколько это возможно. Эти силы отталкивания сближают атомы водорода.
Пары электронов остаются в покое. На нашем рисунке они представлены двойными точками. Эти неподеленные пары очень негативны — содержат по два отрицательных электрона в каждой — и стараются держаться подальше друг от друга, насколько это возможно. Эти силы отталкивания сближают атомы водорода.
Ты сказал «Тетраэдр» — что это значит?
Тетраэдрический означает «четырехсторонний». В химии мы интерпретируем это в нашем воображении.
Нарисуйте центральный атом в воображаемом пространстве. Затем расположите атомы, присоединенные к центральному атому, вокруг него так, чтобы расстояние между ними было максимальным. Расположение, которое вы примете, будет формой правильного тетраэдра. Эта молекулярная форма показана ниже. Он имеет правильные валентные углы 109.5
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, Джон У. Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, издательство Macmillan Publishing Company, Нью-Йорк, 1993 г.
Если мы создадим аналогичное расположение воды, поместив кислород в центр и используя два атома водорода и две неподеленные пары по углам, мы также получим тетраэдрическое расположение. Однако есть одно важное отличие — валентные углы для воды не равны 109,5. Из-за присутствия очень отрицательной неподеленной пары электронов два атома водорода сжимаются, поскольку две неподеленные пары пытаются уйти друг от друга как можно дальше. Полученный угол дает воде валентный угол 104,5. Поскольку мы не «видим» электроны, получившийся тетраэдр «выглядит» согнутым!
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, Джон У. Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, издательство Macmillan Publishing Company, Нью-Йорк, 1993 г.
Какова ваша точка зрения?
Как и многие вещи в химическом мире, форма и структура молекулы являются важным фактором, определяющим ее функцию. Важность изогнутой структуры воды заключается в том, что она дает воде две различные «стороны»: одна сторона молекулы воды имеет две отрицательные неподеленные пары, а другая сторона представляет собой два атома водорода.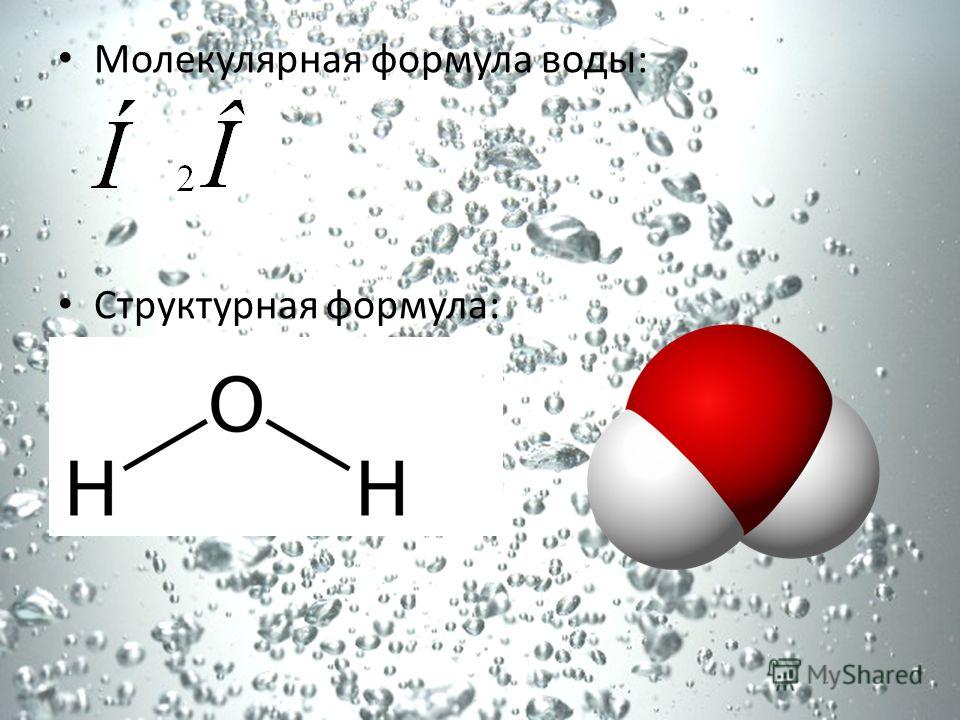 Давайте еще раз посмотрим:
Давайте еще раз посмотрим:
[рис карты электронной плотности воды]
Это делает воду необычной?
ДА! Но не только изогнутая молекула делает ее особенной. Вода также сильно полярна — две стороны воды имеют очень разный заряд.
Неподвижные пары отрицательны. Являются ли водороды положительными ?
Водороды являются слегка положительными. Они получаются такими из-за «электроотрицательности» кислорода. Электроотрицательность — это мера того, насколько один атом хочет иметь электроны, а кислород хочет иметь электроны больше, чем водород. Кислород имеет более высокую электроотрицательность. Из-за этой разницы в электроотрицательности электроны в ковалентных связях между кислородом и водородом слегка притягиваются к кислороду. Это оставляет водороды немного электронодефицитными и, следовательно, слегка положительными. Мы можем нарисовать эту поляризацию следующим образом:
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд.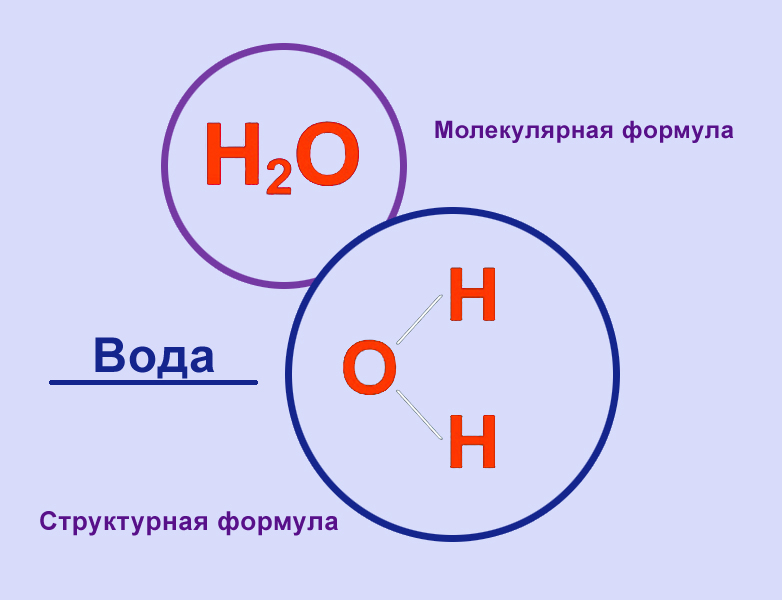 : А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
Или посмотрите на это с точки зрения «сетевой поляризации», например:
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, Джон У. Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, издательство Macmillan Publishing Company, Нью-Йорк, 1993 г.
Какое отношение поляризация имеет к свойствам воды?
Все! Поскольку вода имеет слегка отрицательный конец и слегка положительный конец, она может взаимодействовать сама с собой и образовывать высокоорганизованную «межмолекулярную» сеть. Положительный водородный конец одной молекулы может благоприятно взаимодействовать с отрицательной неподеленной парой другой молекулы воды. Это взаимодействие называется «водородной связью». Это тип слабого электростатического притяжения (от положительного к отрицательному). Поскольку каждая молекула воды может образовывать четыре водородные связи, образуется сложная сеть молекул.
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд. : А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
Но если водородные связи слабы, как они могут быть важны?
Подумай, сколько их! Сила в количестве!
Полярность также позволяет воде взаимодействовать с электрическим полем:
И взаимодействовать с другими полярными молекулами — так вещества растворяются в воде.
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд.: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
Ученые открывают новый способ получения воды
В знакомой школьной демонстрации химии инструктор сначала использует электричество, чтобы разделить жидкую воду на составляющие ее газы, водород и кислород. Затем, объединив два газа и воспламенив их искрой, инструктор превращает газы обратно в воду с громким хлопком.
Ученые из Университета Иллинойса открыли новый способ приготовления воды, причем без шипучки. Мало того, что они могут производить воду из необычных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
Мало того, что они могут производить воду из необычных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
«Мы обнаружили, что нетрадиционные гидриды металлов можно использовать для химического процесса, называемого восстановлением кислорода, который является неотъемлемой частью процесса производства воды», — сказал Захария Хейден, докторант и ведущий автор статьи, принятой к публикации в Журнал Американского химического общества .
Молекула воды (ранее известная как монооксид дигидрогена) состоит из двух атомов водорода и одного атома кислорода. Но вы не можете просто взять два атома водорода и приклеить их к атому кислорода. Реальная реакция образования воды немного сложнее: 2ч3 + О2 = 2ч3О + Энергия.
Уравнение на английском языке гласит: Чтобы получить две молекулы воды (h3O), две молекулы двухатомного водорода (h3) должны быть соединены с одной молекулой двухатомного кислорода (O2).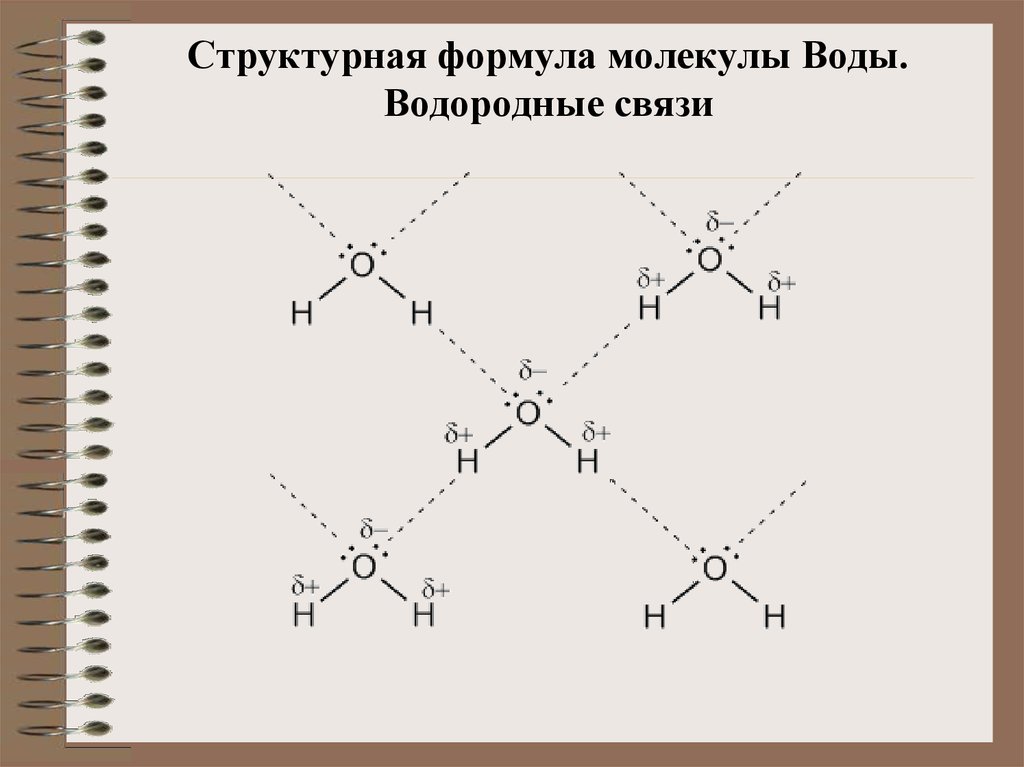 Энергия будет высвобождаться в процессе.
Энергия будет высвобождаться в процессе.
«Эта реакция (2h3 + O2 = 2h3O + Energy) известна уже два века, но до сих пор никто не заставил ее работать в гомогенном растворе», — сказал Томас Раухфус, профессор химии и соответствующий автор статьи.
Хорошо известная реакция также описывает то, что происходит внутри водородного топливного элемента.
В типичном топливном элементе двухатомный водород входит в одну сторону элемента, двухатомный кислород входит в другую сторону. Молекулы водорода теряют свои электроны и становятся положительно заряженными в результате процесса, называемого окислением, в то время как молекулы кислорода получают четыре электрона и становятся отрицательно заряженными в результате процесса, называемого восстановлением. Отрицательно заряженные ионы кислорода объединяются с положительно заряженными ионами водорода, образуя воду и высвобождая электрическую энергию.
«Трудной стороной» топливного элемента является реакция восстановления кислорода, а не реакция окисления водорода, сказал Раухфусс. «Однако мы обнаружили, что новые катализаторы для восстановления кислорода могут также привести к новым химическим средствам для окисления водорода».
«Однако мы обнаружили, что новые катализаторы для восстановления кислорода могут также привести к новым химическим средствам для окисления водорода».
Rauchfuss и Heiden недавно исследовали относительно новое поколение катализаторов гидрогенизации с переносом для использования в качестве нетрадиционных гидридов металлов для восстановления кислорода.
В своей статье JACS исследователи сосредоточились исключительно на окислительной реакционной способности катализаторов гидрирования переноса на основе иридия в гомогенном неводном растворе. Они обнаружили, что комплекс иридия влияет как на окисление спиртов, так и на восстановление кислорода.
«Большинство соединений реагируют либо с водородом, либо с кислородом, но этот катализатор реагирует и с тем, и с другим», — сказал Хайден. «Он реагирует с водородом, образуя гидрид, а затем реагирует с кислородом, образуя воду; и делает это в гомогенном неводном растворителе».
Новые катализаторы могут привести к разработке более эффективных водородных топливных элементов, что существенно снизит их стоимость, сказал Хейден.