Содержание
Дистанционный репетитор — онлайн-репетиторы России и зарубежья
КАК ПРОХОДЯТ
ОНЛАЙН-ЗАНЯТИЯ?
Ученик и учитель видят и слышат
друг друга, совместно пишут на
виртуальной доске, не выходя из
дома!
КАК ВЫБРАТЬ репетитора
Выбрать репетитора самостоятельно
ИЛИ
Позвонить и Вам поможет специалист
8 (800) 333 58 91
* Звонок является бесплатным на территории РФ
** Время приема звонков с 10 до 22 по МСК
ПОДАТЬ ЗАЯВКУ
Россия +7Украина +380Австралия +61Белоруссия +375Великобритания +44Израиль +972Канада, США +1Китай +86Швейцария +41
Выбранные репетиторы
Заполните форму, и мы быстро и бесплатно подберем Вам дистанционного репетитора по Вашим пожеланиям.
Менеджер свяжется с Вами в течение 15 минут и порекомендует специалиста.
Отправляя форму, Вы принимаете
Условия использования
и даёте
Согласие на обработку персональных данных
Вы также можете воспользоваться
расширенной формой подачи заявки
Как оплачивать и СКОЛЬКО ЭТО СТОИТ
от
800 до 5000 ₽
за 60 мин.
и зависит
ОТ ОПЫТА и
квалификации
репетитора
ОТ ПОСТАВЛЕННЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
(например, подготовка к олимпиадам, ДВИ стоит дороже, чем подготовка к ЕГЭ)
ОТ ПРЕДМЕТА (например, услуги репетиторовиностранных языков дороже)
Оплата непосредственно репетитору, удобным для Вас способом
Почему я выбираю DisTTutor
БЫСТРЫЙ ПОДБОР
РЕПЕТИТОРА И
ИНДИВИДУАЛЬНЫЙ ПОДХОД
ОПТИМАЛЬНОЕ
СООТНОШЕНИЕ ЦЕНЫ И
КАЧЕСТВА
ПРОВЕРЕНЫ ДОКУМЕНТЫ ОБ
ОБРАЗОВАНИИ У ВСЕХ
РЕПЕТИТОРОВ
НАДЕЖНОСТЬ И ОПЫТ.
DisTTutor на рынке с 2008 года.
ПРОВЕДЕНИЕ БЕСПЛАТНОГО, ПРОБНОГО УРОКА
ЗАМЕНА РЕПЕТИТОРА, ЕСЛИ
ЭТО НЕОБХОДИМО
375865 УЧЕНИКОВ ИЗ РАЗНЫХ СТРАН МИРА
уже сделали свой выбор
И вот, что УЧЕНИКИ ГОВОРЯТ
о наших репетиторах
Владимир Александрович Кузьмин
«
Тренинг у Кузьмина В. А. проходил в экстремальных условиях. Мой модем совершенно не держал соединение. За время часового тренинга связь прерывалась практически постоянно. Ясно, что в таких условиях чрезвычайно непросто чему-то учить.
Однако Владимир Александрович проявил удивительную выдержку и терпение. Неоднократно он перезванивал мне на сотовый телефон, чтобы дать пояснения или комментарии.
Ценой больших усилий нам удалось рассмотреть три программы: ConceptDraw MINDMAP Professional Ru, GeoGebra и Ultra Flash Video FLV Converter. Владимир Александрович открыл мне курс на платформе dist-tutor.info и научил подключать и настраивать Виртуальный кабинет, порекомендовав изучать возможности этого ресурса, чтобы постепенно уходить от использования Skype.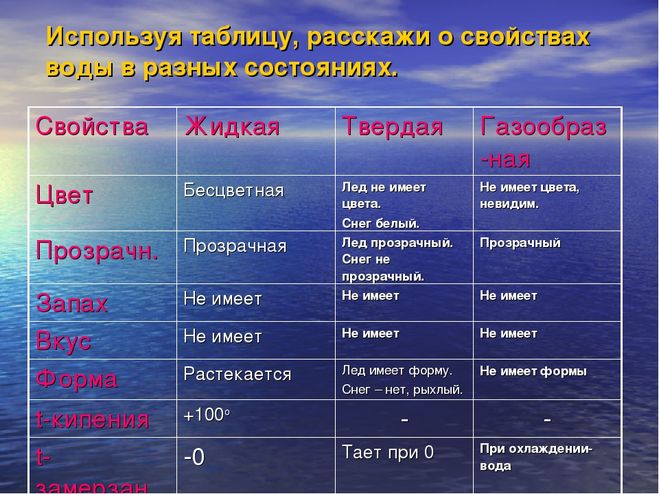
В итоге, занятие мне очень понравилось! Спокойное объяснение материала, дружелюбный настрой, подбадривание дистанционного ученика даже в самых непростых ситуациях — вот далеко не полный перечень качеств Владимира Александровича как дистанционного педагога. Мне следует учиться у такого замечательного репетитора!
«
Вячеслав Юрьевич Матыкин
Чулпан Равилевна Насырова
«
Я очень довольна репетитором по химии. Очень хороший подход к ученику,внятно объясняет. У меня появились сдвиги, стала получать хорошие оценки по химии. Очень хороший преподаватель. Всем , кто хочет изучать химию, советую только её !!!
«
Алина Крякина
Надежда Васильевна Токарева
«
Мы занимались с Надеждой Васильевной по математике 5 класса. Занятия проходили в удобное для обоих сторон время. Если необходимо было дополнительно позаниматься во внеурочное время, Надежда Васильевна всегда шла навстречу. Ей можно было позванить, чтобы просто задать вопрос по непонятной задачке из домашнего задания. Моя дочь существенно подняла свой уровень знаний по математике и начала демонстрировать хорошие оценки. Мы очень благодарны Надежде Васильевне за помощь в этом учебном году, надеемся на продолжение отношений осенью.
Моя дочь существенно подняла свой уровень знаний по математике и начала демонстрировать хорошие оценки. Мы очень благодарны Надежде Васильевне за помощь в этом учебном году, надеемся на продолжение отношений осенью.
«
Эльмира Есеноманова
Ольга Александровна Мухаметзянова
«
Подготовку к ЕГЭ по русскому языку мой сын начал с 10 класса. Ольга Александровна грамотный педагог, пунктуальный, ответственный человек. Она всегда старается построить занятие так, чтобы оно прошло максимально плодотворно и интересно. Нас абсолютно все устраивает в работе педагога. Сотрудничество приносит отличные результаты, и мы его продолжаем. Спасибо.
«
Оксана Александровна
Клиентам
- Репетиторы по математике
- Репетиторы по русскому языку
- Репетиторы по химии
- Репетиторы по биологии
- Репетиторы английского языка
- Репетиторы немецкого языка
Репетиторам
- Регистрация
- Публичная оферта
- Библиотека
- Бан-лист репетиторов
Партнеры
-
ChemSchool -
PREPY. RU
RU
-
Class
Строение, свойства и функции воды
Цель урока: сформировать представление о целостной картине мира на примере вещества воды, осуществив интеграцию знаний учащихся, полученных в курсах физики, химии и биологии.
Задачи урока:
- Образовательные: усвоение всеми учащимися стандартного минимума фактических сведений о строении и функциях воды на всех уровнях организации живого.
- Развивающие: совершенствование надпредметных умений сравнивать и анализировать, устанавливать причинно-следственные связи; переводить информацию в графический вид (таблицу), постановки и решения проблем; оперировать понятиями и связывать с ранее полученными знаниями в курсах ботаники, зоологии, анатомии; рассуждать по аналогии, развивать память, произвольное внимание.

- Воспитательные: развивать интерес к окружающим явлениям, умение работать в парах и в коллективе, вести диалог, слушать товарищей, оценивать себя и других, формировать культуру речи.
Планируемые результаты: умение характеризовать функции вещества на основе строения и свойств; обобщение полученных знаний о функциях воды на разных уровнях организации живого в форме таблицы.
Тип урока: изучение нового материала и первичное закрепление знаний.
Методы обучения: беседа, рассказ учителя, показ иллюстраций, презентации, индивидуальная работа с текстом, контроль знаний.
Формы организации учебной деятельности: работа в парах (составление обобщающей таблицы), индивидуальная, фронтальная, эксперимент.
Оборудование: фотографии, компьютер, мультимедийный проектор, на столах учащихся раздаточный материал для урока, демонстрационные опыты.
Ход урока
Организационный момент (2 мин.): поздороваться, представиться детям.
Введение (5 мин.):
Вода – самое распространенное и удивительное на Земле вещество (например, расширяется при охлаждении, замерзает уже при 0 0С, кипит при 100 0С, выполняет множество функций и даже может хранить информацию). Ею заполнены океаны, моря, озера и реки; пары воды входят и в состав воздуха. Вода содержится в клетках всех живых организмов (животных, растений, грибов, бактерий) в значительных количествах: организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%, в костях человека – 45 %, а в мозге до 90 %.
Цели урока: почему воды больше всего в составе живых организмов? Почему вода покрывает большую часть суши? Как вода сохраняет информацию? На эти вопросы нам с вами предстоит ответить в конце урока.
Как будем работать: беседуем, я рассказываю, показываю иллюстрации и схемы (Презентация), в процессе объяснения заполняем пропущенные слова в распечатках (Приложение 1). В конце урока я проконтролирую, как вы меня поняли. Мы заполним обобщающую таблицу, а я оценю ваши старания.
В конце урока я проконтролирую, как вы меня поняли. Мы заполним обобщающую таблицу, а я оценю ваши старания.
Демонстрационные опыты:
Опыт № 1:
Цель опыта: доказать растворимость веществ в воде.
Ход опыта: насыпать в колбу с водой соль или сахар. Размешать.
Результат: соль (сахар) полностью растворились.
Вывод: вода – хороший растворитель.
Опыт № 2
Цель опыта: доказать способность воды передвигаться по сосудам стебля за счет корневого давления и присасывающей силы испарения.
Ход опыта: поставить на сутки укоренившийся побег бальзамина в раствор чернил.
Результат: стебель и некоторые листья бальзамина окрасились в синий цвет.
Вывод: вода передвигается по сосудам стебля за счет сил сцепления между молекулами при помощи корневого давления и присасывающей силы испарения..
Опыт № 3:
Цель опыта: доказать способность воды двигаться в область меньшей концентрации растворителя.
Ход опыта: в две чашки Петри поместить одинаковые кусочки картофеля. В одну чашку налить воду, в другую – концентрированный раствор соли.
Результат: картофель в простой воде набух, а в концентрированном растворе соли сморщился.
Вывод: молекулы воды двигаются в область меньшей концентрации растворителя.
Объяснение нового материала (20 мин.):
Проводится в форме беседы. Изучаем вещества по определенному плану (пишу на доске): строение – свойства – функции на системных уровнях организации живого.
Строение молекулы и межмолекулярные связи
| Свойства
|
|---|---|
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный примерно 105 0. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород – отрицательно. | Вода – хороший растворитель. Растворы образуются путем взаимодействия растворенного вещества с частицами растворителя. Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. |
| Вода – реагент в реакциях гидролиза (разрушение сложных химических веществ под действием воды до более простых с новыми свойствами) и ряде других реакций |
Водородные связи между молекулами воды | Растворы ряда веществ образуются за счет водородных связей между веществом и молекулами растворителя (сахара, газы) |
Водородных связей много, поэтому необходимо много энергии для их разрыва.
| Вода обладает хорошей теплопроводностью и большой теплоемкостью. Вода медленно нагревается и медленно остывает. |
Водородные связи слабые | Молекулы воды подвижны относительно друг друга |
Силы межмолекулярного сцепления образуют пространства между молекулами | Вода практически не сжимается |
Образование водородных связей между молекулами воды и других веществ | Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, текучесть воды Опыт № 2 |
Вода замерзает при 0 0С, при замерзании образуется много водородных связей, возникают пространства между молекулами | Максимальная плотность воды при 4 С° равна 1 г/см3, лед имеет меньшую плотность, и всплывает на ее поверхность. |
| Функции на системных уровнях организации живого |
|---|
Вода обеспечивает диффузию — пассивный транспорт веществ в клетку и из нее в область меньшей концентрации (осмос) и пиноцитоз, а также транспорт веществ из клетки. |
|
Гидрофильные вещества проникают внутрь клетки. |
Вода – терморегулятор. |
«Смазочный материал» в суставах, плевральной полости и околосердечной сумке. |
|
Капиллярный кровоток, движение веществ в капиллярах почвы, восходящий и нисходящий ток растворов в растениях. |
Лед защищает водоемы от промерзания. |
Вода может хранить информацию (Приложение 2).
Закрепление (13 мин.):
Биологические задачи:
- Показать синюю или зеленую хризантему. Как создают такие растения? Являются ли они результатом селекционной работы?
- Почему кожа на пальцах при длительном купании сморщивается?
- Почему сморщивается яблоко, лежащее в тепле?
Разделить класс на три группы (по рядам). Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Функции воды
| В живой клетке | В живом организме | В экосистемах и биосфере |
|---|---|---|
1. Транспорт веществ в клетке. | 1. Охлаждение организмов. | 1. Дыхание и фотосинтез водных организмов. |
2. Основная среда всех биохимических процессов. | 2. «Смазочный материал» в суставе, плевральной полости, околосердечной сумке, глазном яблоке. | 2. Регуляция температуры на планете. |
3. | 3. Гидростатический скелет. | 3. Благоприятная среда обитания для живых организмов. |
4. Сохранение структуры клетки. | 4. Защита плода млекопитающих. | 4. Защита водоемов от промерзания. |
5. Тургорное давление. | 5. Капиллярный кровоток, нисходящий и восходящий ток в растениях. | 5. Часть среды обитания животных. |
|
| 6. Подъем почвенных растворов по капиллярам почвы. |
Подведение итогов урока, оценка работы (2 мин.)
Словарик (Приложение 2)
3.
 11: Биохимические свойства воды
11: Биохимические свойства воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17004
- Сюзанна Ваким и Мандип Грюал
- Колледж Бьютт
Голубой мрамор
Его часто называют «водной планетой», и ему дали прозвище «голубой мрамор». Вы, наверное, просто называете это «домом». Почти три четверти нашей родной планеты покрыты водой, и без нее жизнь на Земле, какой мы ее знаем, не могла бы существовать. Вода, как и углерод, играет особую роль в живых существах. Он необходим всем известным формам жизни. Хотя вода состоит из простых молекул, каждая из которых содержит всего три атома, ее структура придает ей уникальные свойства, которые помогают объяснить, почему она жизненно важна для всех живых организмов.
Рисунок \(\PageIndex{1}\): Планета Земля
Химическая структура и свойства воды
Вероятно, вы уже знакомы со многими свойствами воды. Например, вы наверняка знаете, что вода без вкуса, без запаха и прозрачна. В небольших количествах он также бесцветен. Однако, когда наблюдается большое количество воды, например, в озере или океане, она на самом деле светло-голубого цвета. Голубой оттенок воды является внутренним свойством и обусловлен избирательным поглощением и рассеянием белого света. Эти и другие свойства воды зависят от ее химического строения.
Прозрачность воды важна для организмов, живущих в воде. Поскольку вода прозрачна, через нее может проходить солнечный свет. Солнечный свет необходим водным растениям и другим водным организмам для фотосинтеза.
Химическая структура воды
Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода, поэтому она имеет химическую формулу H 2 O. Расположение атомов в молекуле воды показано на рисунке \( \PageIndex{2}\), объясняет многие химические свойства воды. В каждой молекуле воды ядро атома кислорода (с 8 положительно заряженными протонами) притягивает электроны гораздо сильнее, чем ядра водорода (только с одним положительно заряженным протоном). Это приводит к отрицательному электрическому заряду вблизи атома кислорода (из-за «притяжения» отрицательно заряженных электронов к ядру кислорода) и положительному электрическому заряду вблизи атомов водорода. Разница в электрическом заряде между различными частями молекулы называется 9.0046 полярность . Полярная молекула — это молекула, в которой часть молекулы заряжена положительно, а часть молекулы — отрицательно.
В каждой молекуле воды ядро атома кислорода (с 8 положительно заряженными протонами) притягивает электроны гораздо сильнее, чем ядра водорода (только с одним положительно заряженным протоном). Это приводит к отрицательному электрическому заряду вблизи атома кислорода (из-за «притяжения» отрицательно заряженных электронов к ядру кислорода) и положительному электрическому заряду вблизи атомов водорода. Разница в электрическом заряде между различными частями молекулы называется 9.0046 полярность . Полярная молекула — это молекула, в которой часть молекулы заряжена положительно, а часть молекулы — отрицательно.
Рисунок \(\PageIndex{2}\): эта модель представляет собой атомную диаграмму воды, показывающую два атома водорода и атом кислорода в центре.
Вода является хорошим растворителем
Вода считается очень хорошим растворителем в биохимических реакциях. На рисунке \(\PageIndex{3}\) показано, как вода растворяет соли. Поваренная соль (NaCl) состоит из положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Кислород воды притягивается к положительному иону Na. Водороды воды притягиваются к отрицательному иону Cl.
Кислород воды притягивается к положительному иону Na. Водороды воды притягиваются к отрицательному иону Cl.
Рисунок \(\PageIndex{3}\): На этой диаграмме показаны положительные и отрицательные части молекулы воды. На нем также показано, как заряд, например, иона (например, Na или Cl) может взаимодействовать с молекулой воды.
Водородная связь
Противоположные электрические заряды притягиваются друг к другу. Поэтому положительная часть одной молекулы воды притягивается к отрицательным частям других молекул воды. Из-за этого притяжения между атомами водорода и кислорода соседних молекул воды образуются связи, как показано на рисунке \(\PageIndex{4}\). В этом типе связи всегда участвует атом водорода, поэтому он называется 9.0046 водородная связь .
Водородные связи также могут образовываться внутри одной большой органической молекулы. Например, водородные связи, которые образуются между различными частями белковой молекулы, изгибают молекулу, придавая ей характерную форму, что важно для функций белка. Водородные связи также удерживают вместе две нуклеотидные цепи молекулы ДНК.
Водородные связи также удерживают вместе две нуклеотидные цепи молекулы ДНК.
Рисунок \(\PageIndex{4}\): Водородные связи образуются между положительно и отрицательно заряженными частями молекул воды. Связи удерживают молекулы воды вместе. Как вы думаете, как это может повлиять на свойства воды?
Липкая, влажная вода
Вода обладает некоторыми необычными свойствами благодаря своим водородным связям. Одним из свойств является когезия , склонность молекул воды слипаться. Силы сцепления между молекулами воды ответственны за явление, известное как поверхностное натяжение . Молекулы на поверхности не имеют других подобных молекул со всех сторон и, следовательно, они сильнее связываются с молекулами, непосредственно связанными с ними на поверхности. Например, если вы капнете небольшое количество воды на очень гладкую поверхность, молекулы воды будут слипаться и образовывать капли, а не растекаться по поверхности. То же самое происходит, когда вода медленно капает из прохудившегося крана. Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Рисунок \(\PageIndex{5}\): Капли росы прилипают к паутине, демонстрируя сцепление, тенденцию молекул воды слипаться из-за водородных связей.
Другим важным физическим свойством воды является адгезия . С точки зрения воды адгезия — это соединение молекулы воды с другим веществом, например, с боковыми сторонами жилок листа. Этот процесс происходит потому, что водородные связи уникальны тем, что они разрываются и восстанавливаются с большой частотой. Эта постоянная перегруппировка водородных связей позволяет определенному проценту всех молекул в данном образце связываться с другим веществом. Эта характеристика захвата, которую образуют молекулы воды, вызывает капиллярность способность жидкости течь против силы тяжести в узком пространстве. Примером капиллярного действия является ситуация, когда вы опускаете соломинку в стакан с водой. Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
Адгезия и капиллярное действие необходимы для выживания большинства организмов. Именно этот механизм отвечает за транспорт воды у растений через корни и стебли, а у животных — через мелкие кровеносные сосуды.
Водородные связи также объясняют, почему температура кипения воды (100°C) выше, чем у аналогичных веществ без водородных связей. Из-за относительно высокой температуры кипения воды большая часть воды существует на Земле в жидком состоянии. Жидкая вода необходима всем живым организмам. Следовательно, наличие жидкой воды позволяет жизни выжить на большей части планеты.
Кроме того, вода имеет высокую удельную теплоемкость, поскольку для повышения или понижения температуры воды требуется много энергии. В результате вода играет очень важную роль в регулировании температуры. Поскольку клетки состоят из воды, это свойство помогает поддерживать гомеостаз.
В результате вода играет очень важную роль в регулировании температуры. Поскольку клетки состоят из воды, это свойство помогает поддерживать гомеостаз.
Плотность льда и воды
Температура плавления воды равна 0°C. Ниже этой температуры вода находится в твердом состоянии (лед). В отличие от большинства химических веществ, вода в твердом состоянии имеет меньшую плотность, чем вода в жидком состоянии. Это происходит потому, что вода расширяется при замерзании. Опять же, причиной является водородная связь. Водородные связи заставляют молекулы воды менее эффективно выстраиваться во льду, чем в жидкой воде. В результате молекулы воды во льду разнесены дальше друг от друга, что придает льду меньшую плотность, чем жидкая вода. Вещество с меньшей плотностью плавает на веществе с большей плотностью. Это объясняет, почему лед плавает в жидкой воде, тогда как многие другие твердые тела опускаются на дно жидкой воды.
В большом водоеме, таком как озеро или океан, вода с наибольшей плотностью всегда опускается на дно. Вода наиболее плотная при температуре около 4°С. В результате вода на дне озера или океана обычно имеет температуру около 4°С. В климате с холодными зимами этот слой воды температурой 4°C изолирует дно озера от отрицательных температур. Озерные организмы, такие как рыбы, могут пережить зиму, оставаясь в этой холодной, но незамерзшей воде на дне озера.
Вода наиболее плотная при температуре около 4°С. В результате вода на дне озера или океана обычно имеет температуру около 4°С. В климате с холодными зимами этот слой воды температурой 4°C изолирует дно озера от отрицательных температур. Озерные организмы, такие как рыбы, могут пережить зиму, оставаясь в этой холодной, но незамерзшей воде на дне озера.
Обзор
- Опишите строение молекулы воды. Что такое полярность и почему вода полярна?
- Объясните, как внутренняя полярность молекулы воды делает ее хорошим растворителем?
- Объясните, как водородные связи заставляют молекулы жидкой воды слипаться.
- Что такое капиллярное действие? Приведите пример.
- Какое свойство воды помогает поддерживать гомеостаз и как?
Принадлежности
- Water Planet от НАСА/Роберта Симмона и Марит Джентофт-Нильсен, общественное достояние через Wikimedia Commons
- Water by Lumen Learning, лицензия CC BY 2.
 0
0 - Растворяющаяся соль Чарльза Молнара и Джейн Гейр, лицензия CC BY 4.0
- Водородное связывание от Lumen Learning с лицензией CC BY 2.0
- Капли воды Службы охраны рыбных ресурсов и дикой природы США, общественное достояние на Викискладе
- Текст адаптирован из книги «Биология человека» по лицензии CK-12, лицензия CC BY-NC 3.0
.
Эта страница под названием 3.11: Биохимические свойства воды распространяется под лицензией CK-12 и была создана, изменена и/или курирована Сюзанной Ваким и Мандипом Грюалом с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Сюзанна Ваким и Мандип Гревал
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- СК-12
- Версия лицензии
- 3,0
- Программа OER или Publisher
- Программа ASCCC OERI
- Показать оглавление
- да
- Теги
- адгезия
- капиллярное действие
- сплоченность
- водородная связь
- точка плавления
- полярная молекула
- полярность
- источник@https://www.
 ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/ - поверхностное натяжение
2.2 Вода – концепции биологии – 1-е канадское издание
Перейти к содержанию
Глава 2: Введение в химию жизни
К концу этого раздела вы сможете:
- Описывать свойства воды, которые имеют решающее значение для поддержания жизни
Посмотрите видео о том, зачем нам нужен кислород и как он создает проблемы для живых существ.
Вы когда-нибудь задумывались, почему ученые тратят время на поиски воды на других планетах? Это потому, что вода необходима для жизни; даже мельчайшие следы его на другой планете могут указывать на то, что жизнь могла существовать или существовала на этой планете. Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Без него жизни просто не было бы.
Атомы водорода и кислорода в молекулах воды образуют полярные ковалентные связи. Общие электроны проводят больше времени, связанного с атомом кислорода, чем с атомами водорода. У молекулы воды нет общего заряда, но есть небольшой положительный заряд на каждом атоме водорода и небольшой отрицательный заряд на атоме кислорода. Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы. Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и называется гидрофильный («водолюбивый»). Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры. Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Рис. 2.7 Как видно из этого макроскопического изображения нефти и воды, нефть является неполярным соединением и, следовательно, не растворяется в воде. Масло и вода не смешиваются.
Водородные связи в воде позволяют ей поглощать и выделять тепловую энергию медленнее, чем многие другие вещества. Температура является мерой движения (кинетической энергии) молекул. Чем больше движение, тем выше энергия и, следовательно, выше температура. Вода поглощает большое количество энергии, прежде чем ее температура повысится. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и разрушаться быстро, вода поглощает увеличение энергии и изменения температуры лишь в минимальной степени. Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхность жидкости (такой как водоем, листья растения или кожа организма) в процессе, называемом 9.0046 испарение . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Этот процесс приводит к высвобождению отдельных молекул воды на поверхность жидкости (такой как водоем, листья растения или кожа организма) в процессе, называемом 9.0046 испарение . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Наоборот, по мере уменьшения молекулярного движения и снижения температуры выделяется меньше энергии для разрыва водородных связей между молекулами воды. Эти связи остаются неповрежденными и начинают формировать жесткую решетчатую структуру (например, лед) (рис. 2.8 a ). В замороженном виде лед менее плотный, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 9).0046 б ). В озерах, прудах и океанах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения от замерзания в воде. Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
Рис. 2.8 (а) Решетчатая структура льда делает его менее плотным, чем свободно текущие молекулы жидкой воды. Меньшая плотность льда позволяет ему (б) плавать на воде. (кредит а: модификация работы Джейн Уитни; кредит б: модификация работы Карлоса Понте)
Поскольку вода полярна, имеет небольшие положительные и отрицательные заряды, ионные соединения и полярные молекулы могут легко растворяться в ней. Таким образом, вода — это то, что называют растворителем — веществом, способным растворять другое вещество. Заряженные частицы будут образовывать водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для разделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательно заряженными атомами кислорода в молекулах воды. Отрицательно заряженный ион хлора окружен частично положительными зарядами атомов водорода в молекулах воды. Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Рисунок 2.9. Когда поваренная соль (NaCl) смешивается с водой, вокруг ионов образуются сферы гидратации.
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода на самом деле образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии . При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Сплоченность дает начало поверхностное натяжение , способность вещества выдерживать разрыв при растяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода. Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
Рис. 2.10. Вес иглы, лежащей на поверхности воды, снижает поверхностное натяжение; в то же время поверхностное натяжение воды тянет ее вверх, удерживая иглу на поверхности воды и удерживая ее от погружения. Обратите внимание на углубление в воде вокруг иглы.
Эти когезионные силы также связаны со свойством воды адгезии или притяжением между молекулами воды и другими молекулами. Это наблюдается, когда вода «поднимается» по соломинке, помещенной в стакан с водой. Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это происходит потому, что молекулы воды притягиваются к соломинке и поэтому прилипают к ней.
Силы сцепления и сцепления важны для поддержания жизни. Например, из-за этих сил вода может течь от корней к верхушкам растений, чтобы питать растение.
Например, из-за этих сил вода может течь от корней к верхушкам растений, чтобы питать растение.
Концепция в действии
Чтобы узнать больше о воде, посетите Геологическую службу США «Наука о воде для школ: все о воде»! Веб-сайт.
pH раствора является мерой его кислотности или щелочности. Вы, вероятно, использовали лакмусовую бумагу , бумагу, обработанную натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH, чтобы проверить, сколько кислоты или основания (щелочность) существует в растворе. Возможно, вы даже использовали его, чтобы убедиться, что вода в открытом бассейне правильно очищена. В обоих случаях этот тест pH измеряет количество ионов водорода, присутствующих в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его рН и может быть измерена на 9Шкала рН 0046 (рис. 2.11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
2.11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
Шкала рН колеблется от 0 до 14. Изменение на одну единицу по шкале рН соответствует изменению концентрации ионов водорода в 10 раз, изменение на две единицы соответствует изменению концентрации ионов водорода в коэффициент 100. Таким образом, небольшие изменения pH представляют большие изменения концентрации ионов водорода. Чистая вода нейтральна. Он не является ни кислым, ни основным, и имеет рН 7,0. Все, что ниже 7,0 (в диапазоне от 0,0 до 6,9) является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Кровь в ваших венах слабощелочная (pH = 7,4). Среда в желудке очень кислая (pH = 1–2). Апельсиновый сок слабокислый (pH = примерно 3,5), тогда как пищевая сода имеет щелочную реакцию (pH = 9,0).
Рис. 2.11 Шкала pH измеряет количество ионов водорода (H+) в веществе.
Кислоты представляют собой вещества, которые обеспечивают ионы водорода (H + ) и более низкий pH, тогда как основания обеспечивают ионы гидроксида (OH – ) и повышают pH. Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко отдают H + при добавлении к воде. И наоборот, основания — это те вещества, которые легко отдают OH — . Ионы OH – объединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и выделяют OH 9.0290 – быстро при помещении в воду, тем самым повышая рН.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко отдают H + при добавлении к воде. И наоборот, основания — это те вещества, которые легко отдают OH — . Ионы OH – объединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и выделяют OH 9.0290 – быстро при помещении в воду, тем самым повышая рН.
Большинство клеток в нашем организме функционируют в очень узком интервале шкалы pH, обычно в диапазоне от 7,2 до 7,6. Если pH тела выходит за пределы этого диапазона, дыхательная система работает со сбоями, как и другие органы тела. Клетки больше не функционируют должным образом, а белки разрушаются. Отклонение за пределы диапазона pH может вызвать кому или даже смерть.
Так как же мы можем глотать или вдыхать кислотные или основные вещества и не умирать? Буферы — это ключ. Буферы легко поглощают излишки H + или OH – , тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Углекислый газ является частью важной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбоната (HCO 3 – ). Если в организм попадает слишком много H + , бикарбонат соединяется с H + 9.0291 для создания угольной кислоты и ограничения снижения pH. Аналогичным образом, если в систему ввести слишком много OH – , угольная кислота быстро диссоциирует на бикарбонат и ионы H + . Ионы H + могут соединяться с ионами OH – , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим.
Буферы легко поглощают излишки H + или OH – , тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Углекислый газ является частью важной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбоната (HCO 3 – ). Если в организм попадает слишком много H + , бикарбонат соединяется с H + 9.0291 для создания угольной кислоты и ограничения снижения pH. Аналогичным образом, если в систему ввести слишком много OH – , угольная кислота быстро диссоциирует на бикарбонат и ионы H + . Ионы H + могут соединяться с ионами OH – , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим.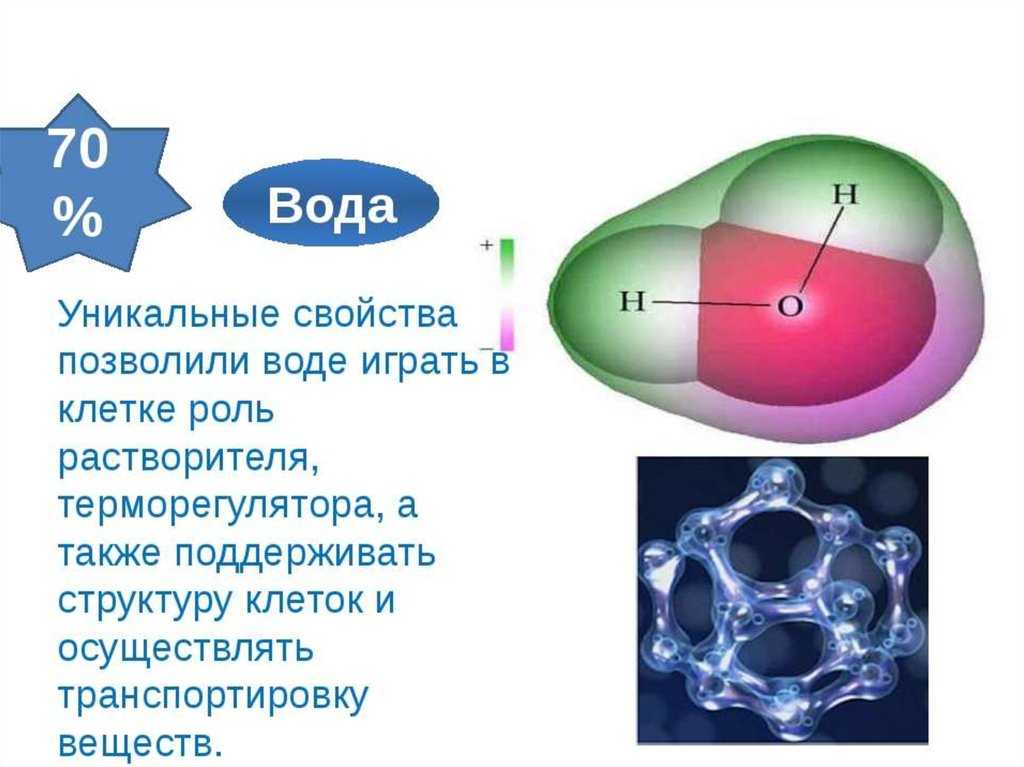 Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Вода обладает многими свойствами, которые имеют решающее значение для поддержания жизни. Он полярен, что позволяет образовывать водородные связи, которые позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды придают воде способность удерживать тепло лучше, чем многие другие вещества. По мере повышения температуры водородные связи между водой постоянно разрываются и восстанавливаются, что позволяет общей температуре оставаться стабильной, хотя в систему добавляется повышенная энергия. Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны в химии живых организмов.
pH раствора является мерой концентрации ионов водорода в растворе. Раствор с большим количеством ионов водорода является кислым и имеет низкое значение рН. Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение рН. Шкала рН колеблется от 0 до 14, при этом рН 7 является нейтральным. Буферы представляют собой растворы, которые смягчают изменения pH при добавлении в буферную систему кислоты или основания. Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень рН.
Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение рН. Шкала рН колеблется от 0 до 14, при этом рН 7 является нейтральным. Буферы представляют собой растворы, которые смягчают изменения pH при добавлении в буферную систему кислоты или основания. Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень рН.
кислота: вещество, которое отдает ионы водорода и поэтому снижает рН
адгезия: притяжение между молекулами воды и молекулами другого вещества
основание: вещество, которое поглощает ионы водорода и поэтому повышает рН
буфер: раствор, устойчивый к изменению pH за счет поглощения или выделения ионов водорода или гидроксида
сцепление: межмолекулярные силы между молекулами воды, вызванные полярной природой воды; создает поверхностное натяжение
испарение: высвобождение молекул воды из жидкой воды с образованием водяного пара
гидрофильное: описывает вещество, которое растворяется в воде; водолюбивый
гидрофобный: описывает вещество, которое не растворяется в воде; боится воды
лакмусовая бумага: фильтровальная бумага, обработанная натуральным водорастворимым красителем для использования в качестве индикатора pH
шкала pH: шкала от 0 до 14, которая измеряет приблизительно концентрация ионов водорода вещества
растворитель: вещество, способное растворять другое вещество
поверхностное натяжение: сила сцепления на поверхности тела жидкости, которая предотвращает разделение молекул
температура: мера молекулярного движения
Каталожные номера
Humphrey, W.

 RU
RU







 Участвует в ряде химических реакций.
Участвует в ряде химических реакций. 0
0 ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/