Содержание
Изоамиловый спирт, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
11 неожиданных способов использовать нашатырный спирт в быту
18 сентября 2021
Жизнь
Он вернёт блеск окнам, поможет при укусах насекомых, избавит от пятен — и это ещё не всё.
Нашатырный спирт — это водный раствор аммиака. Его продают в аптеках, обычно в концентрации 10%. Как и пищевая сода, он может стать незаменимым помощником в хозяйстве. Только перед использованием нужно запомнить несколько правил:
- Никогда не смешивайте нашатырный спирт (и любые средства, содержащие аммиак) с хлоркой. Они вступают в реакцию и образуют токсичные испарения. Если собираетесь совмещать нашатырный спирт с готовым чистящим средством, обязательно проверяйте, чтобы в составе не было хлора.
- Нашатырный спирт вызывает раздражение на слизистых и коже. Работая с ним, надевайте резиновые перчатки и хорошо проветривайте помещение.
- Если нашатырный спирт попал в глаза, промойте их большим количеством холодной воды.
 Если после этого вы заметили проблемы со зрением, немедленно обращайтесь к врачу.
Если после этого вы заметили проблемы со зрением, немедленно обращайтесь к врачу.
1. Отчистить жир
Решётку из духовки или с плиты довольно трудно отчистить, если на ней накопилось много жира и нагара. Нашатырный спирт размягчит такие пятна.
Налейте в большой таз или ванну тёплой воды, добавьте 100 мл спирта и замочите решётку на 20 минут. После этого потрите грязные места тряпкой и тщательно ополосните решётку чистой водой, чтобы на ней не осталось спирта.
2. Снять зуд от укусов насекомых
Смочите в нашатырном спирте ватную палочку и потрите ей место укуса. Не делайте этого, если вы уже расчесали укус, иначе будет сильно щипать. Если у вас чувствительная кожа, вам лучше воспользоваться другими средствами.
3. Придать блеск стеклянным поверхностям
От нашатырного спирта ваши окна, зеркала, хрусталь и стеклянная посуда засверкают как новые. Смешайте 1 столовую ложку спирта и 2 стакана воды и перелейте раствор в бутылку с пульверизатором. Распылите смесь на стеклянную поверхность и тут же вытрите мягкой тряпкой. Лучше всего подойдёт тряпка из микрофибры, после неё на стекле не останется ворсинок.
Распылите смесь на стеклянную поверхность и тут же вытрите мягкой тряпкой. Лучше всего подойдёт тряпка из микрофибры, после неё на стекле не останется ворсинок.
4. Избавиться от неприятных запахов
Если нужно избавиться от запаха в холодильнике, протрите его смесью нашатырного спирта с водой (1 столовая ложка на 1 литр). Затем сполосните чистой водой и оставьте открытым на несколько часов, чтобы точно выветрился запах самого спирта.
5. Удалить мыльные отложения
Разведите 1 столовую ложку нашатырного спирта в 4 л воды и нанесите смесь на ванну или раковину. Оставьте минут на десять, а потом протрите грязные места. После этого тщательно ополосните водой.
6. Вернуть белый цвет кроссовкам
Смешайте нашатырный спирт с водой в соотношении 1 : 1, намочите тряпку и протрите обувь. Если этот способ не дал желаемого результата, попробуйте другие.
7. Подкормить растения
Такое удобрение будет полезно растениям, которые любят щелочную почву. Среди них хризантемы, мальвы, клематисы, фиалки, сирень, огурцы, бобовые, капуста, тыква.
Разведите 1 столовую ложку нашатырного спирта в 4 л воды и полейте землю. Старайтесь не попадать на листья, это может вызвать ожоги.
8. Обработать пятна на одежде
Смешайте 150 мл нашатырного спирта, 150 мл средства для мытья посуды, 6 столовых ложек соды и 2 стакана тёплой воды. Нанесите смесь на пятно и оставьте на полчаса, а потом постирайте вещь как обычно. Для трудновыводимых пятен, например от крови или травы, можно использовать смесь спирта с водой в соотношении 1 : 1.
Такой метод поможет справиться с пятнами на хлопковой и полиэстровой ткани. А вот на шерсти и шёлке использовать нашатырный спирт нельзя, эти ткани слишком деликатные.
9. Избавиться от пятен на коврах и мебельной обивке
Смешайте нашатырный спирт с водой в соотношении 1 : 1, нанесите смесь на пятно и подержите 10 минут. Затем положите на это место старое полотенце и поставьте разогретый утюг с включённым паром. Подержите утюг 20 секунд и проверьте пятно: оно должно начать переходить на полотенце. Повторяйте процедуру и периодически добавляйте смесь спирта с водой, пока пятно не исчезнет.
Повторяйте процедуру и периодически добавляйте смесь спирта с водой, пока пятно не исчезнет.
10. Освежить кафельную плитку
Нашатырный спирт избавит её от мыльных потёков, разводов и прочих загрязнений. Смешайте 4 л воды и 60 мл спирта. Смачивайте тряпку или губку в этой смеси и протирайте плитку. Особенно загрязнённые места потрите щёткой с мягкой щетиной. В конце вымойте всё чистой водой.
11. Отогнать моль
Смешайте 1 л воды и 100 мл нашатырного спирта. Вымойте этой смесью шкафы, ящики и полки, где храните одежду. Дайте им высохнуть. Не забудьте открыть окна, чтобы комната проветривалась.
Читайте также 🧴☕🧽
- 8 способов использовать молотый кофе после заваривания
- 18 способов использовать перекись водорода в быту
- 5 способов использовать пищевую соду в уходе за одеждой
Алкоголь и вода не смешиваются
Контактное лицо: Линн Яррис, [email protected]
| Скотч и вода: несовершенная смесь | |
Любителям шотландского виски и воды следует помнить, что они могут никогда не достичь идеальной смеси. Ученые использовали усовершенствованный источник света (ALS) в Национальной лаборатории Лоуренса в Беркли для изучения электронных состояний метанола, самого простого из спиртов, как в растворе с водой, так и вне его; они показали, что на молекулярном уровне спирт и вода не смешиваются полностью.
Ученые использовали усовершенствованный источник света (ALS) в Национальной лаборатории Лоуренса в Беркли для изучения электронных состояний метанола, самого простого из спиртов, как в растворе с водой, так и вне его; они показали, что на молекулярном уровне спирт и вода не смешиваются полностью.
«Никто никогда не пробовал идеальной на микроскопическом уровне смеси спирта и воды», — говорит ученый с БАС Цзинхуа Го, один из руководителей этого исследования. «Мы обнаружили, что смешивание спирта и воды на микроскопическом уровне будет неполным, сколько бы вы ни ждали. Однако самый важный научный вывод из нашего исследования заключается в том, что мы создали инструмент для исследования молекулярных свойств жидкостей и растворов, что до сих пор было трудно получить».
Пьяницы уже давно комбинируют алкоголь и воду в бесчисленных смесях напитков. Смешивание вина с водой было обычаем древних греков, по крайней мере, со времен Гомера; на самом деле греки считали, что употребление несмешанного вина ведет к безумию. Ученые по совершенно другим причинам провели последние четыре десятилетия, изучая, как спирт и вода смешиваются на молекулярном уровне. Спирт в воде является одним из основных растворов жидкость-жидкость, эндемичным для бесчисленных химических и биологических процессов. Однако до сих пор экспериментальные данные о молекулярных свойствах таких растворов поступали в основном из анализа нейтронной дифракции и вызывали смешанные чувства.
Ученые по совершенно другим причинам провели последние четыре десятилетия, изучая, как спирт и вода смешиваются на молекулярном уровне. Спирт в воде является одним из основных растворов жидкость-жидкость, эндемичным для бесчисленных химических и биологических процессов. Однако до сих пор экспериментальные данные о молекулярных свойствах таких растворов поступали в основном из анализа нейтронной дифракции и вызывали смешанные чувства.
«Наши знания о геометрии и электронной структуре молекул в жидкой фазе очень ограничены, — говорит Го. «Не только расположение молекул меняется в очень быстром временном масштабе, но и свойства отдельных молекул постоянно меняются».
| Физик Цзинхуа Го руководил совместным исследованием США и Швеции в ALS Beamline 7.0.1, которое раскрыло тайну спирта и воды в растворе. |
Одна большая загадка заключается в том, что при смешивании спирта и воды беспорядок или энтропия полученной системы не увеличивается, как ожидается для идеальных растворов.
На микроскопическом уровне полное смешивание спирта и воды привело бы к случайному соединению двух молекул в единую жидкую фазу без взаимодействия друг с другом. Это означает, что энтропия водно-спиртового раствора должна существенно увеличиваться по сравнению с энтропией чистого спирта. Чтобы выяснить, почему этого не происходит, Гуо и его сотрудники обратились к ALS — ускорителю электронов и накопительному кольцу, оптимизированному для производства рентгеновского и ультрафиолетового света, пульсирующего в пикосекундном масштабе.
Работая на линии луча ALS и экспериментальной станции, известной как установка флуоресцентной спектроскопии мягкого рентгеновского излучения, группа изучала поглощение и испускание низкоэнергетического (мягкого) рентгеновского излучения жидким метанолом в растворе с водой и вне его. Хотя метанол не используется в напитках, ожидается, что его молекулярное поведение при смешивании с водой будет таким же, как у этанола, пригодной для питья формы алкоголя. Результаты этого исследования были опубликованы в номере журнала 9 от 10 октября 2003 г.0061 Письма о физическом обзоре .
Результаты этого исследования были опубликованы в номере журнала 9 от 10 октября 2003 г.0061 Письма о физическом обзоре .
«Мы обнаружили, что структура жидкого метанола при комнатной температуре представляет собой комбинацию колец и цепей, каждая из которых состоит из 6 или 8 молекул метанола», — говорит Го. «При добавлении воды цепи метанола взаимодействуют с кластерами молекул воды разного размера. Это изгибает цепи в стабильные структуры с открытыми кольцами. Формирование новых упорядоченных структур, в которых участвуют как молекулы воды, так и молекулы метанола, означает, что эти две жидкости очень мало смешиваются на микроскопическом уровне».
На молекулярном уровне в растворе происходит очень незначительное смешивание спирта и воды. Вместо этого цепочки молекул метанола реагируют с кластерами молекул воды, образуя стабильные структуры с открытыми кольцами, которые снижают энтропию раствора. |
Соавторами статьи Physical Review Letters с Го были Йи Луо, Степан Кастанов и Ханс Агрен из Королевского технологического института в Швеции, Андреас Аугустссон, Ян-Эрик Рубенсон и Джозеф Нордгрен из Упсальского университета в Швеции, и Дэвид Шу из отдела химических наук лаборатории Беркли.
Установка Soft-X-Ray Fluorescence Spectroscopy, Beamline 7.0.1, представляет собой набор экспериментальных станций, которые используют свет, извлекаемый из сохраненного электронного пучка ALS с помощью ондуляторного магнита. Этот очень яркий, высоко когерентный импульсный свет идеально подходит для исследования электронных, структурных и динамических свойств молекул, даже когда они находятся в жидком состоянии.
В более раннем исследовании Гуо и его сотрудники использовали тот же луч ALS для изучения геометрии и электронной структуры чистой жидкой воды при комнатной температуре. Они обнаружили, что молекулы воды образуют кластерные структуры, а водородные связи служат клеем, удерживающим эти кластеры вместе. Однако эти водородные связи быстро разрываются и восстанавливаются, так что в любой данный момент в жидкой воде присутствуют «свободно плавающие» молекулы воды. Поскольку эти кластеры с водородными связями взаимодействуют с цепями метанола в спиртовых и водных растворах, свободно плавающие молекулы воды никогда не присутствуют. Это помогает объяснить, почему энтропия уменьшается для таких решений.
Однако эти водородные связи быстро разрываются и восстанавливаются, так что в любой данный момент в жидкой воде присутствуют «свободно плавающие» молекулы воды. Поскольку эти кластеры с водородными связями взаимодействуют с цепями метанола в спиртовых и водных растворах, свободно плавающие молекулы воды никогда не присутствуют. Это помогает объяснить, почему энтропия уменьшается для таких решений.
«Кольца, образующиеся при смешивании спирта и воды, представляют собой стабильные структуры, поскольку водородные связи насыщены», — говорит Го. «Можно было бы ожидать еще большего снижения энтропии системы, если бы было больше молекул метанола и воды, образующих высокоупорядоченные структуры».
Значит ли это, что любители виски, разбавленного водой, никогда не смогут добиться идеальной смеси? По словам Го, трудно сказать.
«Если мы смешаем спирт и воду при повышенной температуре, мы можем ожидать увидеть в смеси разные молекулярные структуры», — говорит Го. «Много лет назад исследователи использовали лазеры, чтобы вызвать реакции в жидкостях, и смогли на короткое время изменить запах. Однако я не уверен, что люди когда-либо пробовали такой ликер».
Однако я не уверен, что люди когда-либо пробовали такой ликер».
Дополнительная информация
- Подробнее о Цзинхуа Го
- Подробнее об усовершенствованном источнике света
14.5: Реакции спиртов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16045
- Аноним
- LibreTexts
Цели обучения
- Назовите два основных типа реакций спиртов.
- Опишите результат окисления первичного спирта.
- Опишите результат окисления вторичного спирта.
Химические реакции в спиртах происходят главным образом в функциональной группе, но некоторые из них включают атомы водорода, присоединенные к атому углерода, содержащему ОН, или к соседнему атому углерода. Из трех основных видов алкогольных реакций, которые суммированы на рисунке \(\PageIndex{1}\), здесь рассматриваются два — дегидратация и окисление. Третий тип реакции — этерификация — описан в другом месте.
Из трех основных видов алкогольных реакций, которые суммированы на рисунке \(\PageIndex{1}\), здесь рассматриваются два — дегидратация и окисление. Третий тип реакции — этерификация — описан в другом месте.
Рисунок \(\PageIndex{1}\): Реакции спиртов. Здесь рассматриваются окисление и дегидратация спиртов. Блок-схема трех возможных реакций спирта. Конечные продукты реакций также показаны в конце блок-схемы.
Дегидратация
Как показано на рисунке \(\PageIndex{1}\), спирт подвергается дегидратации в присутствии катализатора с образованием алкена и воды. Реакция удаляет группу ОН от атома углерода спирта и атом водорода от соседнего атома углерода в той же молекуле:
Структурная формула обезвоживания этанола в избытке концентрированной серной кислоты при 180°С. Продуктами являются этилен и побочный продукт молекулы воды.
При надлежащих условиях дегидратация может происходить между и двумя молекулами спирта . Удаляется вся ОН-группа одной молекулы и только атом водорода ОН-группы второй молекулы. Две этильные группы, присоединенные к атому кислорода, образуют молекулу эфира.
Две этильные группы, присоединенные к атому кислорода, образуют молекулу эфира.
Две молекулы этанола обезвоживают в концентрированной серной кислоте при 140 градусах Цельсия и избытке этанола с получением диэтилового эфира и молекулы воды.
(Простые эфиры обсуждаются в другом месте). Таким образом, в зависимости от условий можно получить либо алкены, либо простые эфиры путем дегидратации спиртов.
Реакции как дегидратации, так и гидратации происходят непрерывно в клеточном метаболизме, при этом ферменты служат катализаторами и при температуре около 37°C. В пути «Эмбдена–Мейергофа» 9 происходит следующая реакция.0003
Структурная формула 2-фосфоглицерата, образующего фосфоенолпируват и молекулу воды с помощью ферментов.
Хотя участвующие соединения являются сложными, реакция та же: удаление воды из исходного материала. Идея состоит в том, что если вы знаете химию конкретной функциональной группы, вы знаете химию сотен различных соединений.
Окисление
Первичные и вторичные спирты легко окисляются. Ранее мы видели, как метанол и этанол окисляются ферментами печени с образованием альдегидов. Поскольку различные окислители могут вызывать окисление, мы можем указать окислитель, не указывая конкретный, написав уравнение с символом [O] над стрелкой. Например, мы запишем окисление этанола — первичного спирта — с образованием ацетальдегида — альдегида — следующим образом:
Ранее мы видели, как метанол и этанол окисляются ферментами печени с образованием альдегидов. Поскольку различные окислители могут вызывать окисление, мы можем указать окислитель, не указывая конкретный, написав уравнение с символом [O] над стрелкой. Например, мы запишем окисление этанола — первичного спирта — с образованием ацетальдегида — альдегида — следующим образом:
Формула этанола, вступающего в реакцию с образованием ацетальдегида с буквой О в скобках над правой стрелкой.
Мы увидим, что альдегиды окисляются еще легче, чем спирты, и дают карбоновые кислоты. Вторичные спирты окисляются до кетонов . Окисление изопропилового спирта дихроматом калия (\(\ce{K2Cr2O7}\)) дает ацетон, простейший кетон:
В отличие от альдегидов, кетоны относительно устойчивы к дальнейшему окислению, поэтому для их выделения не требуется особых мер предосторожности. по мере их формирования. Обратите внимание, что при окислении обоих первичных (RCH 9{3+} + 7h3O} \номер\]
Окисление спирта играет важную роль в живых организмах. Реакции окисления, контролируемые ферментами, обеспечивают клетки энергией, необходимой для выполнения полезной работы. Один из этапов метаболизма углеводов включает окисление вторичной спиртовой группы в изолимонной кислоте до кетоновой группы:
Реакции окисления, контролируемые ферментами, обеспечивают клетки энергией, необходимой для выполнения полезной работы. Один из этапов метаболизма углеводов включает окисление вторичной спиртовой группы в изолимонной кислоте до кетоновой группы:
Общий тип реакции такой же, как и при превращении изопропилового спирта в ацетон.
Третичные спирты (R 3 COH) устойчивы к окислению, поскольку атом углерода, несущий группу ОН, не имеет присоединенного атома водорода, а вместо этого связан с другими атомами углерода. Описанные нами реакции окисления включают образование двойной связи углерод-кислород. Таким образом, атом углерода, несущий ОН-группу, должен быть в состоянии освободить один из присоединенных к нему атомов для образования двойной связи. Связи углерод-водород легко разрушаются в окислительных условиях, но связи углерод-углерод не разрушаются. Поэтому третичные спирты плохо окисляются.
Пример \(\PageIndex{1}\)
Напишите уравнение окисления каждого спирта.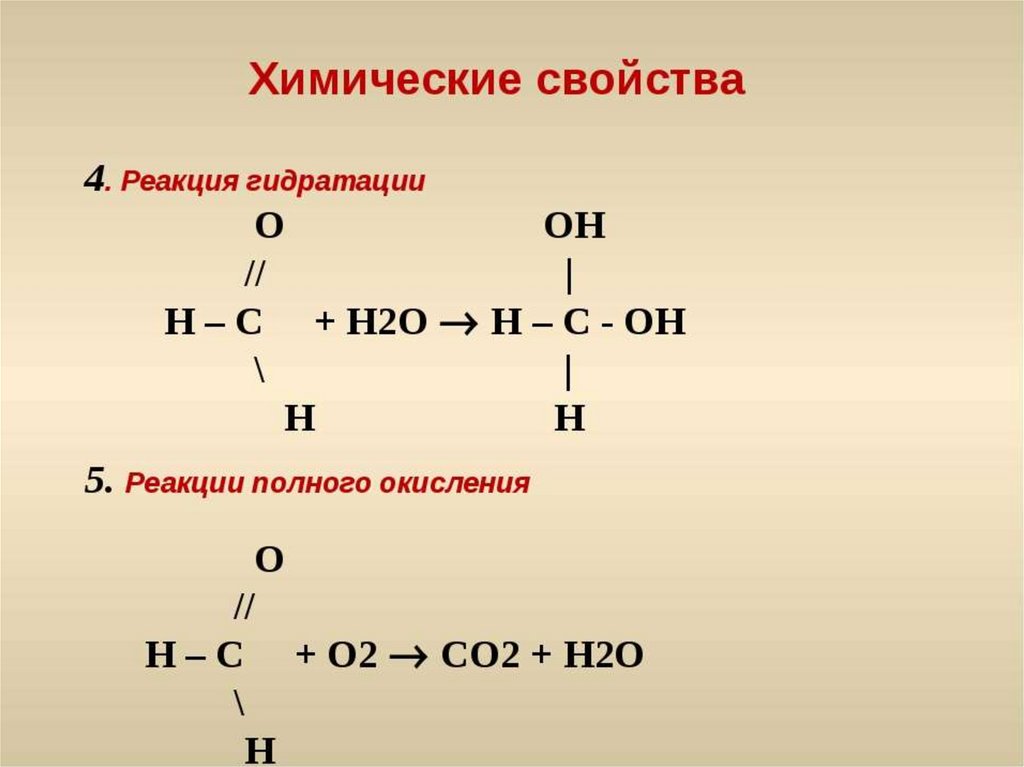 Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции нет, напишите после стрелки «нет реакции».
Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции нет, напишите после стрелки «нет реакции».
- CH 3 CH 2 CH 2 CH 2 CH 2 OH
- Слева направо четыре атома углерода в прямой цепи алкана с метильной и гидроксильной группой на углероде 2.
- Слева направо в прямой цепи алкана шесть атомов углерода с гидроксильной группой на углероде 2.
Раствор
Первый шаг — определить класс каждого спирта как первичный, вторичный или третичный.
- Этот спирт имеет группу ОН на атоме углерода, который присоединен только к одному другому атому углерода, поэтому это первичный спирт. При окислении сначала образуется альдегид, а при последующем окислении образуется карбоновая кислота.
- Этот спирт имеет группу ОН на атоме углерода, который присоединен к трем другим атомам углерода, поэтому это третичный спирт.
 Никакой реакции не происходит.
Никакой реакции не происходит. - Этот спирт имеет группу ОН на атоме углерода, который присоединен к двум другим атомам углерода, поэтому он является вторичным спиртом; окисление дает кетон.
Упражнение \(\PageIndex{1}\)
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции нет, напишите после стрелки «нет реакции».
- Слева направо в прямой цепи алкана шесть атомов углерода с гидроксильной группой и метильной группой на углероде 3.
- Слева направо в прямой цепи алкана четыре атома углерода с метильной группой на углероде 3, а также гидроксильной группой на углероде 4.
- Слева направо в прямой цепи алкана шесть атомов углерода с метильной группой на углероде 2 и гидроксильной группой на углероде 3.
Резюме
Спирты могут дегидратироваться с образованием либо алкенов (более высокая температура, избыток кислоты), либо простых эфиров (более низкая температура, избыток спирта).

 Если после этого вы заметили проблемы со зрением, немедленно обращайтесь к врачу.
Если после этого вы заметили проблемы со зрением, немедленно обращайтесь к врачу. Никакой реакции не происходит.
Никакой реакции не происходит.