Содержание
Химический состав природной воды
По
своему химическому составу природные
воды являются весьма разнообразными,
в них содержится большинство известных
химических соединений. Количество тех
или иных химических веществ в воде
зависит от многих условий, например,
геологических, физико-географических
и т.п.
По значению для
организма человека химические вещества,
встречающиеся в природной воде, можно
разделить «на четыре основные группы.
К
первой группе следует
отнести вещества, являющиеся показателями
возможного загрязнения воды патогенными
микроорганизмами. К таким веществам
относятся азотсодержащие соединения;
органические вещества, обусловливающие
так называемую окисляемость; хлориды,
фосфаты, растворенный кислород и
биохимическая потребность воды в
кислороде (БПК), сероводород, показатель
концентрации водородных ионов (рН).
Азот
в воде может присутствовать в виде как
органических, так и неорганических
соединений. Органические соединения
Органические соединения
представлены так называемым альбуминовым
азотом (низшие пептиды, аминокислоты,
мочевина и т.п.). Однако, определение его
в воде не нашло широкого распространения
из-за сложности методики и трудности
дифференцирования азота животного
происхождения и растительного. На
практике широко используется определение
неорганических соединений азота: ионов
аммония (NН4),
ионов азотистой (NО3)
и азотной (NО3)
кислот. Они появляются в воде, главным
образом, в результате конечного распада
веществ белкового происхождения. Причем
вначале образуется аммиак, затем под
действием ферментов нитрифицирующих
бактерий в присутствии достаточного
количества кислорода аммиак окисляется
до азотистой и азотной кислот.
Химический
состав органических веществ весьма
сложен и разнообразен. Они образуются
в воде за счет жизнедеятельности водных
организмов и растений, а также в результате
их распада после отмирания. Органические
вещества могут попадать в воду с
атмосферными, ливневыми, хозяйственно-бытовыми
и техническими сточными водами. Суммарное
Суммарное
содержание органических веществ
определяется по количеству миллиграммов
кислорода, пошедшего на окисление в 1 л
воды всех веществ, способных окисляться
(окисляемость воды). Чистые подземные
воды имеют окисляемость 1-2 мг/л О2;
грунтовые воды — 2-4 мг/л и воды поверхностных
водоисточников 6-8 мг/л О2.
Источником
кислорода в природных водах является
атмосфера и жизнедеятельность некоторых
водных организмов.
Содержание
кислорода в воде зависит от площади
соприкосновения поверхности ее со
свободной атмосферой, от температуры,
давления, интенсивности биологических
и биохимических процессов.
Подземные
воды практически не содержат кислород.
В поверхностных водах при слабом развитии
биологических и биохимических процессов
кислород находится в пределах 6-8 мг/л
летом и 8-10 мг/л — зимой.
При
интенсивно протекающих биологических
процессах, сопровождающихся фотосинтезом,
может иметь место перенасыщение воды
кислородом (до 120-130 % от максимально
возможного насыщения при данной
температуре). И, наоборот, при интенсивно
И, наоборот, при интенсивно
развитых биологических процессах
окислительного характера содержание
кислорода может снижаться до ничтожно
малых величин.
Очень
чистой считается вода, в которой
количество кислорода за 5 суток уменьшилось
на 1 мг в литре, чистая вода — 2 мг/л,
довольно чистая — 3-4 мг/л, загрязненная
— 4-5 мг/л и очень грязная — более 5 мг/л.
Соединения
фосфора могут попасть в воду из земной
коры, за счет распада органических
веществ белковой природы и за счет смыва
атмосферными водами фосфатных удобрений
с полей. Однако большое количество
фосфора может поступать с хозяйственно-бытовыми
и техническими сточными водами. К
примеру, в суточной моче человека
содержится от 2 до 2,5 г фосфора, а в каловых
массах — около 8 % от всего сухого
содержимого. В связи с этим обстоятельством
фосфорные соединения рассматриваются
как один из показателей загрязнения
воды экскрементами.
В
большинстве природных вод сероводород
отсутствует, значительное его количество
(до 40 мг/л) может встречаться в некоторых
водах глубокого грунтового происхождения.
Гигиеническое значение сероводорода
заключается в его влиянии на запах воды.
Концентрация порядка 0,28 мг/л является
крайним пределом переносимости.
Источником появления сероводорода в
воде могут служить органические вещества
белковой природы.
Хлориды
встречаются практически во всех природных
водах в виде анионов хлора, соединенных
с одним из катионов, чаще всего с натрием.
Они попадают в воду из почвы, а также с
хозяйственно-бытовыми и промышленными
стоками. С одной стороны, они влияют на
вкусовые свойства воды, с другой- могут
служить показателем возможного
загрязнения ее указанными выше стоками.
Допускается содержание хлоридов в воде
централизованного хозяйственно-питьевого
водоснабжения до 350 мг/л.
Основными
веществами, определяющими реакцию воды
(рН), является угольная кислота и ее
соли. Обычная величина рН природных вод
колеблется от 6,5 до 8,5.
Гигиеническое
значение рН заключается в том, что
значительные колебания рН от обычных
величин могут происходить вследствие
попадания в
воду
промышленных и бытовых стоков, а в
экстремальных ситуациях — различного
рода химических веществ, в том числе
сильнодействующих и отравляющих.
Ко
второй
группе относятся
вещества, в известных концентрациях
оказывающие вредное действие на организм
человека. К этой группе относятся такие
вещества, присутствие которых в воде
во всех случаях нежелательно или должно
быть строго ограничено. Одни из них
имеют природное происхождение, другие
представляют собой продукт производственной
и бытовой деятельности людей.
К числу
природных веществ отнесены бериллий,
молибден, мышьяк, нитраты, свинец, селен,
стронций и фтор. Сюда же можно отнести
и радиоактивные природные вещества,
обусловливающие фоновую радиоактивность
воды. Конечно же, все эти вещества могут
быть и хозяйственно-бытового происхождения.
Продукты производственной деятельности
людей включают большое количество
органических и неорганических соединений,
а также большую группу радиоактивных
неприродных веществ.
К
третьей группе относятся
вещества, имеющие положительное
биологическое значение. Сюда относятся
некоторые минеральные вещества,
присутствие которых в воде желательно
в определенных концентрациях. К ним
К ним
принадлежат фтор, железо, медь, йод,
цинк, марганец, кремний, кобальт, молибден,
селен, хром, никель, олово и ванадий.
Конечно же, основным источником
поступления их в организм является
пища. Роль же воды известна лишь в
отношении фтора, отчасти йода, в какой-то
мере железа, марганца, меди, цинка и
кремния.
Содержание фтора
в природных водах колеблется от сотых
долей до 5 и даже 12 мг/л. Кроме природного
происхождения, фтор может попадать в
водоисточники с промышленными стоками.
Физиолого-гигиеническое
значение фтора определяется его влиянием
на формирование костного аппарата и, в
первую очередь, на ткани зубов. Недостаток
поступления фтора в организм приводит
к кариесу зубов. Избыточное количество
фтора в воде свыше 2-5 мг/л также
нежелательно. Считается, что в этих
случаях могут возникать очаговые
разрушения эмали зубов, а в дальнейшем
всего зуба. Однако, в последние годы,
американские исследователи пришли к
выводу, что данная патология вызывается
другими факторами, в частности, недостатком
полноценных белков, кальция, магния и
витаминов в пище.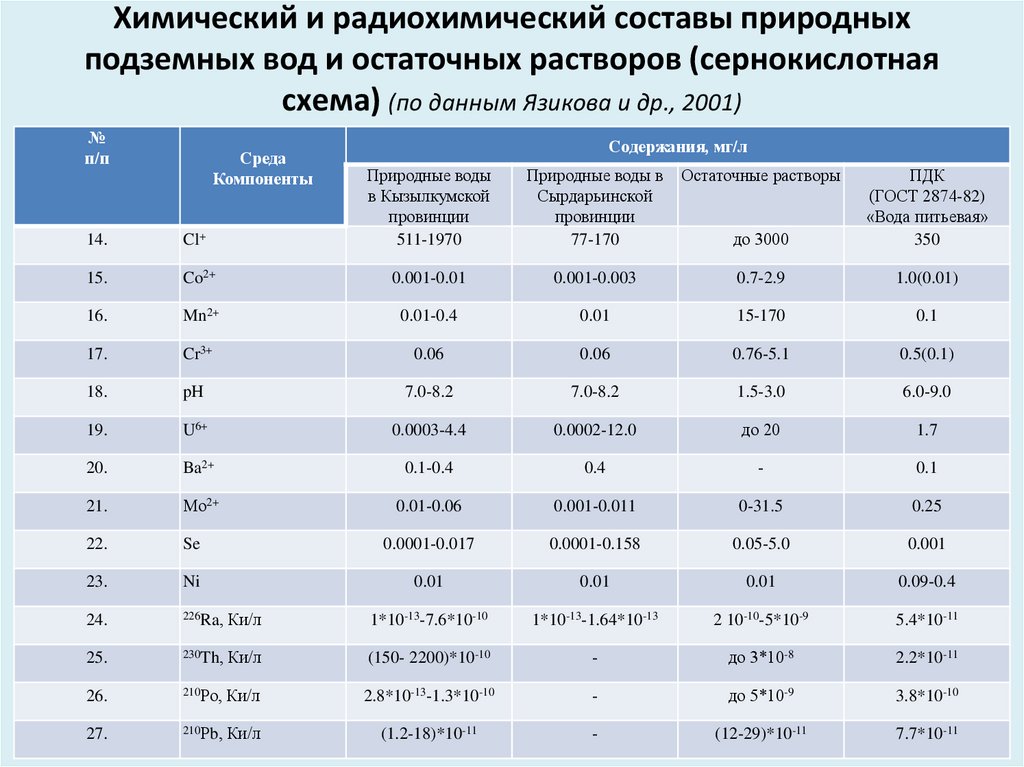 Ион фтора, наоборот,
Ион фтора, наоборот,
уменьшает вероятность проявления этого
заболевания.
При
недостаточном поступлении в организм
йода у человека появляется зоб, называемый
эндемическим, так как заболевание
связано с определенной местностью.
Основным поставщиком йода является
пища, с водой в организм человека он
поступает в количестве 4-5%. В то же время
вода играет роль показателя обеспеченности
йодом данной местности и вероятности
возникновения зоба среди населения.
Содержание железа
в поверхностных водах обычно небольшое,
несколько больше его содержится в
подземных водах (до десятков мг/л).
Биологическое
значение железа очень велико. Оно входит
в состав гемоглобина, ферментов,
участвующих в тканевом дыхании, в состав
клеточных ядер. Основным поставщиком
железа является пища, с питьевой водой
поступает 10-15 % от его общего количества.
Токсическим действием железо почти не
обладает. Длительное потребление его
в количестве 300 мг в день вызывало лишь
явления легкого гастроэнтерита.
Присутствие
больших количеств (более 1 мг/л) железа
в воде считается нежелательным, главным
образом, из-за ухудшения физических
свойств воды и вяжущего привкуса.
Значение
марганца для человека установлено
сравнительно недавно, в 1972 году. При его
недостатке наблюдается задержка развития
костного аппарата, умственная отсталость,
стерильность, гипохромазия волос и
другие расстройства. В больших количествах
(более 0,5 мг/л) марганец изменяет окраску
воды, придает ей вяжущий привкус и
вызывает появление коричневых пятен
на белье при его стирке. Токсичность
марганца при пероральном потреблении
очень незначительна.
В
природных водах медь содержится в
пределах от 20 до 400 мкг/л. Медь стимулирует
созревание эритроцитов, гормональную
активность передней доли гипофиза,
способствует переходу железа из
неорганических молекул в железо-парафины.
При дефиците меди возникает анемия,
остеопороз, атаксия, альбинизм, слабоумие,
потеря эластичности стенок крупных
сосудов.
К
истинному биоэлементу относится также
цинк, который входит в состав многих
ферментов, гормона поджелудочной железы,
обладает липотропным и антихолистеринемическим
действием, усиливает толерантность к
инфекциям и способствует усвоению
белков. При его недостатке возникает
потеря обоняния и вкуса, затрудняется
имплантация зародышей, замедляется
рост. Употребление воды, содержащей до
30 мг/л цинка никакого отрицательного
действия на людей не оказывает. Токсическое
действие наступает при концентрациях
порядка сотен и тысяч мг/л.
К
четвертой группе относятся
химические вещества индифферентные и
даже полезные для организма. К этой
группе веществ относятся такие, отсутствие
или наличие которых не сказывается на
качестве воды, и только по достижении
определенных концентраций они ухудшают
органолептические (вкус, запах) или
физические (прозрачность, цветность)
свойства воды. К таким веществам
принадлежат: сульфаты, карбонаты и
гидрокарбонаты, ионы кальция, магния,
натрия, калия, свободная углекислота,
гумусовые вещества, коллоидные взвеси
кремния и окиси алюминия, а также сухой
остаток и показатель общей минерализации.
Состав природных вод
После проведения поиска воды на участке и процесса бурения, следует процедура определения химического состава подземной воды.
При определении состава природных вод используются следующие компоненты:
- физические свойства воды;
- химический состав воды;
- бактериологический состав воды;
- газовый состав воды.
К физическим свойствам природных вод относятся температура, прозрачность, осадок, цвет, запах и удельный вес.
1) Определение температуры производят ртутными термометрами или электронными термометрами, как правило температура воды из подземных источников колеблется в диапазоне 5-10 С,
2) Определение прозрачности:
- прозрачная;
- слабоопалесцирующая;
- опалесцирующая;
- слегка мутная;
- мутная;
- сильно мутная;
Для качественного определения прозрачности в пробирку наливают 10 мл исследуемой воды и глядя сверху оценивают ее прозрачность.
Количественное определение прозрачности производится в приборе, представляющем собой цилиндр с отъемным плоским пришлифованным дном, градуированным по высоте на сантиметры. Воду взбалтывают, наливают в цилиндр, затем ставят неподвижно над шрифтом и добавляя или отливая воду, находят предельную высоту столба воды, при которой чтение шрифта еще возможно. Прозрачность выражается в сантиметрах высоты столба с точностью до 0,5 см.
Для определения взвешенных веществ хорошо взбалтывают 0,5-1,0 л воды и фильтруют её через взвешенный тигель с пористым дном. Сушат тигель с осадком до постоянного веса. Разница в весе даёт вес взвешенных веществ во взятом для определения объёме воды.
3) Определение осадка и изменения воды при стоянии. Осадок характеризуется по количеству (нет, незначительный, заметный, большой) и по качеству (кристаллический, хлопьевидный, илистый, песочный и т.д.) с указанием его цвета (бурый, жёлтый, чёрный и т.д.). Отмечают изменение воды при стоянии: выпадение осадка, образование кристаллов на внутренней поверхности бутылки, образование мути, осветление и т.п.
Отмечают изменение воды при стоянии: выпадение осадка, образование кристаллов на внутренней поверхности бутылки, образование мути, осветление и т.п.
4) Определение цвета. Качественное определение производят в прозрачной воде. Если вода не прозрачна её фильтруют. Пробирку наполняют исследуемой водой почти доверху, ставят на белую бумагу и определяют её цвет. Цвет воды характеризуют следующим образом: бесцветная, зеленоватая, желтоватая, бурая и т.п.. Количественное определение цвета производят сравнением исследуемой воды со стандартным платинокобальтовым раствором.
5) Запах определяют при температуре 50-60С. Для определения запаха наполняют исследуемой водой пробирку, нагревают до необходимой температуры и сразу нюхают. Характер запаха: без запаха, сероводородный, болотный, гнилостный, плесневелый и т.п. Интенсивность запаха оценивают по шкале от 1 до 5.
6) Определение вкуса и привкуса. Незагрязнённую воду подогревают примерно до 30 С, и пробуют на вкус. Дифференцируют вкусы и привкусы, например кисло, сладко, горько с металлическим привкусом.
Дифференцируют вкусы и привкусы, например кисло, сладко, горько с металлическим привкусом.
7) Определение удельного веса. Ориентировочное определение удельного веса производят с помощью ареометра , точное с помощью пикнометра.
Химический состав. Формирование состава природных вод происходит в результате выщелачивания, испарения, конденсирования, ионного обмена, поглощения и выделения газов, процесса жизнедеятельности организмов и в результате других физико-химических процессов взаимодействия вод с породами, почвами и газами. В природных водах найдено свыше 60 элементов, которые присутствуют в виде ионов, недиссоциированных молекул в том числе газов и коллоидов. Однако, обычно только некоторые из них присутствуют в значительных количествах.
К числу таких элементов относят натрий, кальций, магний и хлор, присутствующие в виде простых ионов, а также углерод, серу, азот, кислород, водород и кремний, которые бывают в виде сложных ионов, недиссоциированных молекул и коллоидов и растворимых газов.
Вещества, содержащиеся в природных водах, подразделяются на основные группы: макро- и микрокомпоненты.
К макрокомпонентам относятся компоненты, часто находящиеся в водах в повышенных относительно других компонентов содержаниях. Среди них кальций, натрий, магний, хлор, углерод, железо, являющиеся преобладающими катионами и анионами во многих типах подземных вод регионального распространения. К микрокомпонентам можно отнести все остальные ионы, а также коллоиды. Большую роль в определении свойств природных вод имеют показатели, характеризующие состояние воды и в значительной мере определяющие возможность присутствия в воде элементов в тех или иных соединениях. К числу таких показателей относятся концентрация водородных ионнов pH и окислительно-восстановительный потенциал Eh.
Формы выражения результатов химического анализа воды.Основной формой выражения результатов анализа воды является ионная форма. При этом содержание того или иного иона выражается в граммах или миллиграммах на 1 л воды, а для минерализованных вод и рассолов — в граммах на килограмм или в граммах на 100 г. Результаты определения в воде микрокомпонентов выражаются в микрограммах на 1 л воды. Однако, для полной характеристики свойств воды, ионная форма выражения недостаточна. Поэтому наряду с ионной формой пользуются миллиграмм-эквивалентной формой. Пересчёт данных анализа производится делением количества миллиграммов каждого иона в 1л воды на его эквивалентный вес. Полученные величины называют миллиграм-эквивалентами, или милливалями. При сравнении результатов анализа вод различной минерализации для получения пропорциональных величин количество миллиграмм-эквивалентов пересчитывают в процент-эквиваленты(%-экв).
При этом содержание того или иного иона выражается в граммах или миллиграммах на 1 л воды, а для минерализованных вод и рассолов — в граммах на килограмм или в граммах на 100 г. Результаты определения в воде микрокомпонентов выражаются в микрограммах на 1 л воды. Однако, для полной характеристики свойств воды, ионная форма выражения недостаточна. Поэтому наряду с ионной формой пользуются миллиграмм-эквивалентной формой. Пересчёт данных анализа производится делением количества миллиграммов каждого иона в 1л воды на его эквивалентный вес. Полученные величины называют миллиграм-эквивалентами, или милливалями. При сравнении результатов анализа вод различной минерализации для получения пропорциональных величин количество миллиграмм-эквивалентов пересчитывают в процент-эквиваленты(%-экв).
Бактериалогический состав воды. Бактериалогические исследования воды проводятся с целью санитарной оценки питьевой воды. Санитарное состояние воды определяется степенью фекальной загрязненности. Главным показателем этого загрязнения воды служит кишечная палочка. Для оценки санитарного состояния питьевой воды определяется содержание одной кишечной палочки в единице объема воды (Coli-титр). Чем вода качественнее, тем в больших объемах удается обнаружить кишечную палочку и наоборот. Классифицируют воду следующим образом: здоровая, достаточно здоровая, сомнительная, нездоровая, совершенно нездоровая.
Главным показателем этого загрязнения воды служит кишечная палочка. Для оценки санитарного состояния питьевой воды определяется содержание одной кишечной палочки в единице объема воды (Coli-титр). Чем вода качественнее, тем в больших объемах удается обнаружить кишечную палочку и наоборот. Классифицируют воду следующим образом: здоровая, достаточно здоровая, сомнительная, нездоровая, совершенно нездоровая.
Газовый состав воды. Состав газов, растворённых в подземных водах, и их концентрация очень разнообразны. Наиболее распространёнными являются кислород, азот, метан, углекислый газ, сероводород, инертные газы. Реже встречаются водород, ближайшие гомологи метана — этан, пропан и бутан, а также окись углерода, закись азота и другие.
Природная вода — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 37368
- Чанг (Питер) Чие
- Университет Ватерлоо
Вопросы для обсуждения
- Что такое жесткая вода?
- В чем разница между временной и постоянной жесткостью воды?
- Как превратить жесткую воду в мягкую?
- Как производить деионизированную воду?
Вода — самый важный ресурс. Без воды жизнь невозможна. С химической точки зрения вода, H 2 O, представляет собой чистое соединение, но на самом деле вы редко пьете, видите, прикасаетесь или используете чистую воду. Вода из различных источников содержит растворенные газы, минеральные вещества, органические и неорганические вещества.
Без воды жизнь невозможна. С химической точки зрения вода, H 2 O, представляет собой чистое соединение, но на самом деле вы редко пьете, видите, прикасаетесь или используете чистую воду. Вода из различных источников содержит растворенные газы, минеральные вещества, органические и неорганические вещества.
Гидросфера
Вся водная система, окружающая планету Земля, называется гидросферой . Он включает пресноводные системы, океаны, атмосферный пар и биологические воды. Северный Ледовитый, Атлантический, Индийский и Тихий океаны покрывают 71% поверхности Земли и содержат 97% всей воды. Менее 1 % приходится на пресную воду, а 2-3 % — на ледяные шапки и ледники. Антарктический ледяной щит размером почти с континент Северная Америка. Эти воды определяют нашу погоду и климат, прямо или косвенно влияя на нашу повседневную жизнь. Они охватывают 3,35×10 8 км 2 . Четыре океана имеют общий объем 1,35×10 9 км 3 .
- Солнечный свет тускнеет на 1/10 на каждые 75 м в океане, и люди едва видят свет ниже 500 м. Температура почти всех глубин океана составляет 4°С (277 К).
- Средняя глубина океана составляет 4 км, а самая глубокая точка Марианской впадины составляет 10 912 м (35 802 фута), что сопоставимо с высотой горы Эверест 8,8 км.
Гидросферные процессы — это шаги, по которым циркулирует вода на планете Земля. К этим процессам относятся сублимация льда, испарение жидкости, перенос влаги воздухом, дождем, снегом, речными, озерными и океанскими течениями. Все эти процессы связаны с физическими и химическими свойствами воды, и многие государственные учреждения созданы для изучения и регистрации связанных с ними явлений. Изучение этих процессов называется гидрология
Среди планет Земля единственная, на которой есть твердые, жидкие и газообразные воды. Эти условия как раз подходят для жизни, жизненно важной частью которой является вода. Вода является самым распространенным веществом в биосфере Земли. Подземные воды являются важной частью водной системы. Когда пар охлаждается, образуются облака и дождь. Часть дождя просачивается через почву в нижележащие породы. Вода в скалах подземные воды , которые движутся медленно.
Вода является самым распространенным веществом в биосфере Земли. Подземные воды являются важной частью водной системы. Когда пар охлаждается, образуются облака и дождь. Часть дождя просачивается через почву в нижележащие породы. Вода в скалах подземные воды , которые движутся медленно.
Горная порода, содержащая значительное количество воды, называется водоносным горизонтом . Ниже уровня грунтовых вод водоносный горизонт заполнен (или насыщен) водой. Над уровнем грунтовых вод находится ненасыщенная зона. В некоторых регионах имеется два или более зеркала грунтовых вод. Эти зоны обычно разделены водонепроницаемым материалом, таким как валун и глина. Подземные воды можно вывести на поверхность путем бурения ниже уровня грунтовых вод и откачать. Количество воды, которое можно откачать, зависит от структуры водоносного горизонта. Небольшое количество воды хранится в плотных слоях гранита, но большое количество воды хранится в слоях водоносных слоев известняка. В некоторых районах есть подземные реки. 9{-8.35}\)
В некоторых районах есть подземные реки. 9{-8.35}\)
Общие ионы, присутствующие в природной воде
Гидрология также изучает взаимодействие твердых и растворенных веществ в воде и с водой. В этой ссылке подробно приведены составы морской воды, состав атмосферы, составы дождя и снега, составы речных и озерных вод. В таблице \(\PageIndex{1}\) перечислены основные ионы, присутствующие в морской воде. Состав варьируется в зависимости от региона, глубины, широты и температуры воды. Воды в устьях рек содержат меньше солей. Если ионы используются живым организмом, их содержание варьируется в зависимости от популяций организмов.
Частицы пыли и ионы, присутствующие в воздухе, являются центрами зарождения капель воды. Так, дождевые и снеговые воды также содержат такие ионы: Ca 2+ , Mg 2+ , Na + , K + , NH 4 + . Эти катионы уравновешены анионами HCO 3 — , SO 4 — , NO 2 — , Cl — — — и NO 3 . pH дождя составляет от 5,5 до 5,6. Дождевые и снеговые воды со временем становятся речной или озерной водой. Когда выпадают дождевые или снеговые воды, они взаимодействуют с растительностью, верхним слоем почвы, коренными породами, руслом реки и дном озера, растворяя все, что растворяется. Также процветают бактерии, водоросли и водные насекомые. Растворимость неорганических солей определяется кинетикой и равновесием растворения. Наиболее распространенные ионы в озерной и речной воде такие же, как и в дождевой воде, но в более высоких концентрациях. pH этих вод зависит от русла реки и дна озера. Природные воды содержат растворенные минералы. Воды, содержащие Ca 9Ионы 0052 2+ и Mg 2+ принято называть жесткой водой .
pH дождя составляет от 5,5 до 5,6. Дождевые и снеговые воды со временем становятся речной или озерной водой. Когда выпадают дождевые или снеговые воды, они взаимодействуют с растительностью, верхним слоем почвы, коренными породами, руслом реки и дном озера, растворяя все, что растворяется. Также процветают бактерии, водоросли и водные насекомые. Растворимость неорганических солей определяется кинетикой и равновесием растворения. Наиболее распространенные ионы в озерной и речной воде такие же, как и в дождевой воде, но в более высоких концентрациях. pH этих вод зависит от русла реки и дна озера. Природные воды содержат растворенные минералы. Воды, содержащие Ca 9Ионы 0052 2+ и Mg 2+ принято называть жесткой водой .
Жесткая вода
Минералы обычно растворяются в естественных водоемах, таких как озера, реки, родники и подземные водные пути (грунтовые воды). Карбонат кальция, CaCO 3 , является одним из наиболее распространенных неорганических соединений в земной коре. Это ингредиент как для кальцита, так и для арагонита. Эти два минерала имеют разную кристаллическую структуру и внешний вид. На этой фотографии показаны кристаллы типичного кальцита. 9{-9}\]
Это ингредиент как для кальцита, так и для арагонита. Эти два минерала имеют разную кристаллическую структуру и внешний вид. На этой фотографии показаны кристаллы типичного кальцита. 9{-9}\]
Из произведения растворимости мы можем (см. пример 1) оценить молярную растворимость как 7,1×10 -5 M или 7,1 мг/л (7,1 ppm CaCO 3 в воде). Растворимость увеличивается по мере снижения pH (повышения кислотности). Это усугубляется, когда вода насыщена двуокисью углерода, CO 2 . Насыщенный раствор CO 2 содержит угольную кислоту, которая способствует растворению за счет реакции:
\[H_2O + CO_2 \rightleftharpoons H_2CO_3\] 9-\]
Из-за этих реакций некоторые природные воды содержат более 300 частей на миллион карбонатов кальция или их эквивалентов.
Углекислый газ в природной воде создает интересное явление. Дождевая вода насыщена CO 2 и растворяет известняки. При потере СО 2 из-за изменения температуры или вытекания капель воды происходит обратная реакция. Однако образовавшееся твердое вещество может быть менее стабильной фазой, называемой арагонитом, которая имеет ту же химическую формулу, но другую кристаллическую структуру, чем у кальцита.
Однако образовавшееся твердое вещество может быть менее стабильной фазой, называемой арагонитом, которая имеет ту же химическую формулу, но другую кристаллическую структуру, чем у кальцита.
Дождь растворяет карбонат кальция в результате двух реакций, показанных выше. Вода уносит с собой ионы, глотает сквозь трещины скал. Достигнув потолка пещеры, капля долго болтается там, прежде чем упасть. За это время улетучивается углекислый газ и повышается рН воды. Начинают появляться кристаллы карбоната кальция. Кальцит, арагонит, сталактит и сталагмит — это четыре распространенных твердых вещества, встречающихся при образовании пещер.
Природные воды содержат ионы металлов. Вода, содержащая кальций, магний и их противоанионы, называется 9.-\]
вода, содержащая ионы Ca 2+ , Mg 2+ и CO 3 2- , называется временной жесткой водой , потому что жесткость можно устранить кипячением. Кипячение вызывает обратную реакцию, вызывая отложения в трубах и накипь в котлах. Отложения снижают эффективность теплообмена в котлах и уменьшают расход воды в трубах. Таким образом, временная жесткая вода должна быть умягчена перед тем, как она попадет в котел, бак горячей воды или систему охлаждения. Количество ионов металлов, которое можно удалить при кипячении, называется 9.0050 временная жесткость
Отложения снижают эффективность теплообмена в котлах и уменьшают расход воды в трубах. Таким образом, временная жесткая вода должна быть умягчена перед тем, как она попадет в котел, бак горячей воды или систему охлаждения. Количество ионов металлов, которое можно удалить при кипячении, называется 9.0050 временная жесткость
После кипячения остаются ионы металлов за счет присутствия хлорид-ионов, сульфат-ионов, нитрат-ионов и достаточно высокой растворимости MgCO 3 . Количество ионов металлов, которое не может быть удалено кипячением, называется постоянной жесткостью . Общая твердость представляет собой сумму временной и постоянной твердости. Жесткость часто выражают эквивалентностью количества ионов кальция в растворе. Таким образом, водоподготовка является важной темой. Стоимость рынка очистки воды оценивается в 30 миллиардов долларов. 9{2-} + \rightarrow CaCO_{3(s)}\]
При этой обработке необходимое количество Ca(OH) 3 эквивалентно временной жесткости плюс жесткость по магнию. Требуемое количество карбоната натрия эквивалентно постоянной жесткости. Таким образом, известково-содовое умягчение эффективно, если определены как временная, так и общая жесткость. Ион натрия останется в воде после обработки. Уровень pH воды также довольно высок в зависимости от количества используемой извести и карбонатов натрия.
Требуемое количество карбоната натрия эквивалентно постоянной жесткости. Таким образом, известково-содовое умягчение эффективно, если определены как временная, так и общая жесткость. Ион натрия останется в воде после обработки. Уровень pH воды также довольно высок в зависимости от количества используемой извести и карбонатов натрия.
Комплексообразование
Добавление комплексообразователя для образования растворимых комплексов с Ca 2+ и Mg 2+ предотвращает образование твердого вещества. Одним из комплексообразователей является трифосфат натрия Na 3 PO 4 , который продается как Calgon и т. д. Фосфат является комплексообразователем. Другие комплексообразователи, такие как Na 2 H 2 ЭДТА, также могут быть использованы, но комплексообразователь ЭДТА 4- образует прочные комплексы с переходными металлами. Это вызывает проблему коррозии, если только трубы системы не изготовлены из нержавеющей стали.
Ионный обмен
Сегодня в большинстве умягчителей воды используются цеолиты и технология ионного обмена для смягчения жесткой воды. Цеолиты представляют собой группу гидратированных кристаллических алюмосиликатов, обнаруженных в некоторых вулканических породах. Тетраэдрически координированные атомы алюминия и кремния образуют тетраэдрические группы AlO 4 и SiO 4 . Они соединяются друг с другом, разделяя атомы кислорода, образуя структуры клеточного типа, как показано справа. Эта диаграмма и следующая структурная диаграмма взяты из введения в цеолиты. Существует много видов цеолитов, некоторые из которых были недавно синтезированы.
Кристаллическая структура цеолитов любого типа содержит большие клетки. Клетки соединены друг с другом, образуя каркас с множеством полостей и каналов. В этих полостях и каналах могут задерживаться как положительные, так и отрицательные ионы, как показано ниже.
Для каждого кислорода, который не является общим в тетраэдрических группах AlO 4 и SiO 4 , на группе остается отрицательный заряд. Эти отрицательные заряды уравновешиваются за счет захвата ионов щелочных и щелочноземельных металлов. Когда захватывается больше катионов, ионы гидроксида и хлорида остаются в полостях и каналах цеолитов.
Эти отрицательные заряды уравновешиваются за счет захвата ионов щелочных и щелочноземельных металлов. Когда захватывается больше катионов, ионы гидроксида и хлорида остаются в полостях и каналах цеолитов.
Для приготовления цеолита для обработки воды их замачивают в концентрированном растворе NaCl. Полости захватывают столько ионов натрия, сколько могут вместить. После обработки цеолит обозначается как Na-цеолит. Затем солевой раствор сливают, а цеолит промывают водой для удаления лишней соли. Когда через них протекает жесткая вода, ионы кальция и магния захватываются цеолитом Na. На каждый захваченный Ca 2+ или Mg 2+ высвобождается два иона Na + . Очищенная вода содержит довольно высокую концентрацию Na + , но низкие концентрации ионов Mg 2+ и Ca 2+ . Таким образом, цеолитный ионообмен превращает жесткую воду в мягкую.
Чистая вода с помощью ионного обмена
В большинстве случаев смолы представляют собой полистирол с функциональными -SO 3 H-группами, присоединенными к полимерной цепи для катионообменной смолы, и с функциональной группой -N(CH 3 ) 3 + прикреплен к цепи для анионообменной смолы. Подготовить смолу для изготовления 9{+} + OH- <=> h3O}\]
Подготовить смолу для изготовления 9{+} + OH- <=> h3O}\]
Таким образом, ионный обмен обеспечивает чистую воду для удовлетворения лабораторных требований.
Система фильтрации воды обратного осмоса
Этот метод также можно использовать для подготовки воды для бытовых и лабораторных нужд. Этот метод обсуждался в Очистка сточных вод
Магнитная очистка воды
Ниже приведен список компаний, продающих магнитные устройства для магнитной обработки воды . Все устройства основаны на результатах некоторых исследований, показывающих, что, когда вода проходит через магнитное поле, карбонат кальция выпадает в осадок в виде арагонита, а не обычного кальцита. Например, К.Дж. Кроненберг опубликовал статью в IEEE Transactions on Magnetics (том Mag-21, № 5, сентябрь 1985 г., страницы 2059-2061). и заявил следующее:
Было обнаружено, что способ кристаллизации минерального содержимого воды изменился от дендритного, связанного с субстратом, к форме отдельных дискообразных кристаллов после того, как вода прошла через ряд магнитных полей. Прежний дефицит зародышей кристаллизации в воде превратился в обилие зародышей в воде. Уменьшение количества кристаллов, связанных с подложкой, использовалось как количественная мера магнитного эффекта.
Прежний дефицит зародышей кристаллизации в воде превратился в обилие зародышей в воде. Уменьшение количества кристаллов, связанных с подложкой, использовалось как количественная мера магнитного эффекта.
Многие компании производят различные устройства для магнитной обработки воды и утверждают, что их устройства помогут очистить трубы и бойлеры за небольшие деньги или бесплатно. Мне еще предстоит протестировать одно из этих устройств на соответствие его заявлению, но мои предварительные тесты показывают, что постоянный магнит мало влияет на отложения карбоната кальция временной жесткой воды. Эффект очистки, о котором они заявляют, вероятно, сильно преувеличен.
Пример \(\PageIndex{1}\)
Из произведения растворимости, показанного для растворения карбоната кальция, 9{-5}\; M\]
Концентрация 7,1×10 -5 M эквивалентна 7,1 мг/л (7,1 ppm CaCO 3 в воде).
ОБСУЖДЕНИЕ
В системе могут присутствовать другие ионы и другие условия равновесия в дополнение к упомянутому здесь равновесию. В реальном мире проблемы более сложны.
В реальном мире проблемы более сложны.
Упражнение \(\PageIndex{1}\)
При кипячении 1,0 л воды образуется 10 мг твердого CaCO3. Какова временная жесткость воды?
- Ответить
10 частей на миллион
Авторы и авторство
Эта страница под названием «Природная вода» распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Чанг (Питер) Чие.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Чанг (Питер) Чие
- хайтоп
- да
- Показать страницу TOC
- № на стр.

- Теги
- Гидросфера
- Постоянно жесткая вода
- Временно жесткая вода
- Вода
Лаборатория экогидрологии – EPFL
В центре внимания лаборатории ECHO (сокращение от ЭКогидрология) находится понимание и моделирование функции речных сетей как экологических коридоров для миграции видов и болезней. Исследования ECHO сочетают лабораторные и полевые работы с теоретическим моделированием для разработки интегрированной экогидрологической основы для понимания, например, пространственной экологии видов, биоразнообразия в речных бассейнах, динамики популяций, биологических инвазий вдоль водных путей и распространения заболеваний, передающихся через воду и связанных с водой.
Модель сдерживания пандемии в Италии
26.08.20Исследования
Группа исследователей моделировала потенциальное распространение пандемии коронавируса в Италии. Используя свою модель, они могут рассчитать количество инфицированных и высокозаразных людей, а также ежедневные усилия по изоляции, необходимые для снижения кривой эпидемии.
Здоровье экосистем на основе жужелицы
03.06.20EPFL
Ученые EPFL только что опубликовали открытый инструмент для прогнозирования динамики популяций жужелиц — важных биоиндикаторов для устойчивого управления парками и мониторинга экосистем — в итальянском Gran Paradiso National Парк. Инструмент включает спутниковые и другие данные дистанционного зондирования.
Карантин в Швейцарии резко снизил число случаев заболевания COVID-19
30.05.20Исследования
Исследователи EPFL смоделировали последствия мер, принятых в стране для замедления распространения коронавируса. По их оценкам, уровень заражения снизился на 53-92%, в зависимости от кантона, а передвижение людей сократилось на 30-80%.
По их оценкам, уровень заражения снизился на 53-92%, в зависимости от кантона, а передвижение людей сократилось на 30-80%.
Все новости
Журнальные статьи
Оценка времени прохождения в водосборах: последние достижения и направления на будущее
П. Бенеттин; Н. Б. Родригес; М. Шпренгер; М. Ким; Дж. Клаус и соавт.
Исследование водных ресурсов . 01.11.2022. Том. 58, номер. 11, с. e2022WR033096. DOI: 10.1029/2022WR033096.
Подробная запись
Посмотреть в издательстве
Вторжение экологии в гидрологию и морфодинамику
Р. Басси; А. Ринальдо; G. Seminar
Rendiconti Lincei-Scienze Fisiche E Naturali . 2022-05-10. DOI: 10.1007/s12210-022-01072-х.
Подробная запись
Посмотреть в издательстве
Экогидрология 2.0
А. Ринальдо; I. Rodriguez-Iturbe
Rendiconti Lincei-Scienze Fisiche E Naturali . 2022-05-04. DOI: 10.1007/s12210-022-01071-y.
2022-05-04. DOI: 10.1007/s12210-022-01071-y.
Подробная запись
Полный текст — Посмотреть у издателя
Вода флоэмы, изотопно отличающаяся от воды ксилемы: потенциальные причины и последствия для экогидрологического отслеживания
М. Ф. Нехеми; П. Бенеттин; С. Т. Аллен; К. Степной; А. Ринальдо и соавт.
Экогидрология . 2022-03-25. п. е2417. DOI: 10.1002/eco.2417.
Подробная запись
Просмотр в издательстве
Эпидемия распространения холеры и судьба мер инфекционного контроля
К. Тревизин; Дж. К. Леметр; Л. Мари; Д. Пасетто; М. Гатто и соавт.
Журнал интерфейса Королевского общества . 09.03.2022. Том. 19, номер. 188. DOI: 10.1098/rsif.2021.0844.
Подробная запись
Полный текст – Посмотреть в издательстве
Сохранение заселенности метапопуляции земноводных в динамичных водно-болотных ландшафтах
L. E. Bertassello; Дж. В. Джавиц; Э. Бертуццо; Г. Боттер; А. Ринальдо и соавт.
Bertassello; Дж. В. Джавиц; Э. Бертуццо; Г. Боттер; А. Ринальдо и соавт.
Ландшафтная экология . 2022-01-19. Том. 37, с. 695–711. DOI: 10.1007/s10980-022-01400-4.
Подробная запись
Посмотреть у издателя
Улучшенная структура для оценки времени в пути и производных распределений в объемах гидрологического контроля
М. Асадоллахи / А. Ринальдо; П. Бенеттин (Реж.)
Lausanne, EPFL, 2022.
Подробная запись
Полный текст – см. в издательстве
Применение анализа главных компонентов для более глубокого понимания системы подземных вод: тематическое исследование бассейна Баккильоне (Венето, Италия)
M мегиорин; П. Булло; В. Аккото; Г. Пассадоре; А. Соттани и соавт.
Acque Sotterranee-Итальянский журнал подземных вод . 01.01.2022. Том. 11, номер. 2, с. 7-17. DOI: 10.7343/as-2022-5732022-AS41-573.
