Содержание
Соляная кислота: влияние на экологию и здоровье человека. Справка
Соляная кислота (хлористоводородная кислота) – водный раствор хлористого водорода HCl, представляет собой прозрачную бесцветную жидкость с острым запахом хлористого водорода. Техническая кислота имеет желтовато-зеленый цвет из-за примесей хлора и солей железа. Максимальная концентрация соляной кислоты около 36% HCl; такой раствор имеет плотность 1,18 г/см3. Концентрированная кислота на воздухе «дымит», так как выделяющийся газообразный HCl образует с водяным паром мельчайшие капельки соляной кислоты.
Соляная кислота не горюча, не взрывоопасна. Она является одной из самых сильных кислот, растворяет (с выделением водорода и образованием солей – хлоридов) все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями она ведет себя как восстановитель.
Соли соляной кислоты – хлориды, за исключением AgCl, Hg2Cl2, хорошо растворимы в воде. К ней устойчивы стекло, керамика, фарфор, графит, фторопласт.
К ней устойчивы стекло, керамика, фарфор, графит, фторопласт.
Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия.
Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют концентрированной, если она содержит 24% и больше HCl, если содержание HCl меньше, то кислота называется разбавленной.
Соляную кислоту применяют для получения хлоридов различных металлов, органических полупродуктов и синтетических красителей, уксусной кислоты, активированного угля, различных клеев, гидролизного спирта, в гальванопластике. Ее применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и др. осадков и загрязнений. В металлургии кислотой обрабатывают руды, в кожевенной промышленности – кожу перед дублением и крашением. Соляную кислоту применяют в текстильной, пищевой промышленности, в медицине и т. д.
д.
Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах, а также в полиэтиленовой посуде.
Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза.
При попадании соляной кислоты на кожные покрытия ее необходимо немедленно смыть обильной струей воды.
Очень опасны туман и пары хлороводорода, образующиеся при взаимодействии с воздухом концентрированной кислоты. Они раздражают слизистые оболочки и дыхательные пути. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, помутнение роговицы глаз, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства.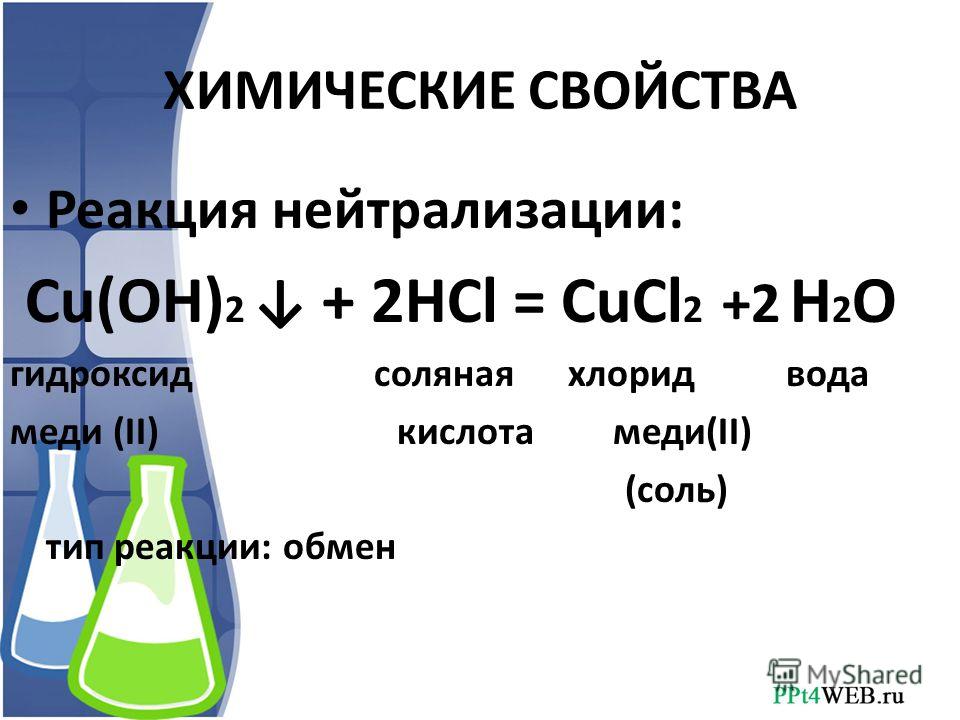
Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды.
Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод.
Там, где вода в реках и озерах стала довольно кислой (рН менее 5) исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий.
В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
В случае разлива соляную кислоту смывают с поверхностей большим количеством воды или щелочного раствора, который нейтрализует кислоту.
Материал подготовлен на основе информации открытых источников
Соляная кислота. Кислородсодержащие кислоты
Соляная кислота HCl
Цистерна с соляной кислотой
Соляная кислота — одна из сильных одноосновных кислот и образуется при растворении газа хлороводорода (HCl) в воде,
— прозрачная бесцветная жидкость с характерным запахом хлора. Разбавленная соляная кислота (также как и фосфорная) часто применяется для снятия оксидов при пайке металлов.
Иногда газообразное соединение HCl ошибочно называют соляной кислотой. HCl — это газ, который при растворении в воде образует соляную кислоту.
Хлороводород — бесцветный газ с резким удушливым запахом хлора. Он переходит в жидкое состояние при -840C, а при -1120C — переходит в твёрдое состояние.
Хлороводород очень хорошо растворяется в воде. Так при 00C в 1л воды растворяется 500л хлороводорода.
В сухом состоянии газ хлороводород достаточно инертный, но уже может взаимодействовать с некоторыми органическими веществами, например с ацетиленом (газ, который выделяется при опускании карбида в воду).
Химические свойства соляной кислоты
— химическая реакция с металлами:
2HCl + Zn =ZnCl2 + H2 — образуется соль (в данном случае прозрачный раствор хлорид цинка) и водород
— химическая реакция с оксидами металлов:
2HCl + CuO = CuCl2 + H2O — образуется соль (в данном случае раствор соли зёленого хлорида меди) и вода
— химическая реакция с основаниями и щелочами (или реакция нейтрализации)
HCl + NaOH = NaCl + H2O — реакция нейтрализации, -образуется соль (в данном случае прозрачный раствор хлорид натрия) и вода.
— химическая реакция с солями (например, c мелом СaCO3):
HCl + СaCO3 = CaCl2 + CO2 + H2O — образуется углекислый газ, вода и прозрачный раствор хлорида кальция CaCl2.
Получение соляной кислоты
Соляную кислоту получают с помощью химической реакции соединения:
H2 + Cl2 = HCl
— реакция происходит при повышенной температуре
А также при взаимодействии поваренной соли и концентрированной серной кислотой:
H2SO4 (конц.) + NaCl = NaHSO4 + HCl
В этой реакции, если вещество NaCl — в твёрдом виде, то HCl — это газ хлороводород, который при растворении в воде образует соляную кислоту
Кислородсодержащие кислоты
Соляная кислота
Существуют сложные химические вещества, по химическому строению сходные с соляной кислотой, но при этом содержащие в молекуле от одного до четырёх атомов кислорода. Эти вещества можно назвать кислородсодержащими кислотами. С повышением числа атомов кислорода увеличивается стойкость кислоты и её окислительная способность.
Эти вещества можно назвать кислородсодержащими кислотами. С повышением числа атомов кислорода увеличивается стойкость кислоты и её окислительная способность.
К кислородсодержащим кислотам слудующие:
- хлорноватистая (HClO),
- хлористая (HClO2),
- хлорноватая (HClO3),
- хлорная (HClO4).
Каждое из этих химических сложных веществ обладает всеми свойствами кислот и способна образовывать соли. Хлорноватистая кислота (HClO) образует
гипохлориты, например, соединение NaClO — гипохлорит натрия. Сама хлорноватистая кислота образуется при растворении хлора в холодной воде по химической реакции:
H2O + Cl2 = HCl + HClO,
Как видите, в этой реакции образуется сразу две кислоты — соляная HCl и хлорноватистая HClO. Но последняя — нестойкое химическое соединение и постепенно переходит в соляную кислоту;
Но последняя — нестойкое химическое соединение и постепенно переходит в соляную кислоту;
Хлористая HClO2 образует хлориты, соль NaClO2 — хлорит натрия;
хлорноватая (HClO3) — хлораты, соединение KClO3, — хлорат калия (или бертолетова соль)- кстати, это вещество широко применяется при изготовления спичек.
И наконец самая сильная из известных одноосновных кислот — хлорная (HClO4) — бесцветная, дымящаяся на воздухе, сильно гигроскопичная жидкость, — образует перхлораты, например, KClO4 — перхлорат калия.
Соли, образованные хлорноватистой HClO и хлористой HClO2 кислотами, в свободном состоянии не устойчивы и являются сильными окислителями в водных растворах. А вот соли, образованные хлорноватой HClO3 и хлорной HClO4 кислотами на основании щелочных металлов (например, таrже бертолетова соль KClO3), — достаточно устойчивы и не проявляют окислительных свойств.
Прямое производство анодной соляной кислоты и катодной щелочи при электролизе воды
Прямое производство анодной соляной кислоты и катодной щелочи при электролизе воды
Скачать PDF
Ваша статья скачана
Карусель с тремя слайдами одновременно. Используйте кнопки «Назад» и «Далее» для перехода по трем слайдам за раз или кнопки с точками в конце для перехода по трем слайдам за раз.
Скачать PDF
- Открытый доступ
- Опубликовано:
- Хуэй-Вэнь Линь 1 ,
- Росио Сехудо-Марин 2 ,
- Адриан В.
 Джеремиас 3 ,
Джеремиас 3 , - Корнил0 Раба0023 ,
- Чжиго Юань 1 и
- …
- Илье Пикаар 1,5
Научные отчеты
том 6 , Номер статьи: 20494 (2016)
Процитировать эту статью
8241 Доступ
42 Цитаты
Сведения о показателях
Предметы
- Инженерное дело
- Химия окружающей среды
Abstract
Соляная кислота (HCl) и щелочь (NaOH) являются одними из наиболее широко используемых химических веществ в водном хозяйстве. Прямое анодное электрохимическое производство HCl с помощью электролиза воды не увенчалось успехом, поскольку современные коммерчески доступные электроды склонны к образованию хлора. В этом исследовании представлена инновационная технология одновременного получения HCl и NaOH из NaCl с использованием Mn 0,84 Mo 0,16 O 2,23 электрод выделения кислорода при электролизе воды. Результаты показали, что протоны могут генерироваться анодно с высокой кулоновской эффективностью (т.е. ≥ 95%), при этом на образование хлора приходится 3 ~ 5% подаваемого заряда. HCl был получен анодно при умеренной прочности при CE 65 ± 4% вместе с CE 89 ± 1% для производства катодной щелочи. Снижение CE при генерации HCl было вызвано переходом протонов из анода в среднее отделение. В целом, это исследование показало потенциал одновременного образования HCl и NaOH из NaCl и представляет собой важный шаг для водного хозяйства к производству HCl и NaOH на месте. В данном исследовании в качестве источника ионов натрия и хлора использовали искусственный рассол.
Прямое анодное электрохимическое производство HCl с помощью электролиза воды не увенчалось успехом, поскольку современные коммерчески доступные электроды склонны к образованию хлора. В этом исследовании представлена инновационная технология одновременного получения HCl и NaOH из NaCl с использованием Mn 0,84 Mo 0,16 O 2,23 электрод выделения кислорода при электролизе воды. Результаты показали, что протоны могут генерироваться анодно с высокой кулоновской эффективностью (т.е. ≥ 95%), при этом на образование хлора приходится 3 ~ 5% подаваемого заряда. HCl был получен анодно при умеренной прочности при CE 65 ± 4% вместе с CE 89 ± 1% для производства катодной щелочи. Снижение CE при генерации HCl было вызвано переходом протонов из анода в среднее отделение. В целом, это исследование показало потенциал одновременного образования HCl и NaOH из NaCl и представляет собой важный шаг для водного хозяйства к производству HCl и NaOH на месте. В данном исследовании в качестве источника ионов натрия и хлора использовали искусственный рассол. Теоретически искусственный рассол можно заменить солевыми потоками отходов, такими как концентрат обратного осмоса (ROC), превратив ROC в ценный ресурс.
Теоретически искусственный рассол можно заменить солевыми потоками отходов, такими как концентрат обратного осмоса (ROC), превратив ROC в ценный ресурс.
Введение
Соляная кислота (HCl) и едкий натр (NaOH) широко используются для очистки воды и сточных вод 1,2 . Каустик в основном производится в хлорно-щелочном процессе электролизом хлорида натрия (NaCl) с сопутствующим производством хлора 2,3 . Хотя HCl нельзя синтезировать напрямую в этом процессе, его можно получить путем сжигания газообразного хлора и водорода, образующихся на катоде 3 . Тем не менее, транспортировка, хранение и обращение с концентрированными HCl и NaOH сопряжены с серьезными проблемами охраны труда и техники безопасности (OH&S) в водном хозяйстве. Поскольку в большинстве случаев оба соединения используются в водном хозяйстве в относительно низких концентрациях, существует общий интерес к получению на месте растворов HCl и NaOH средней концентрации, чтобы избежать вышеупомянутых проблем.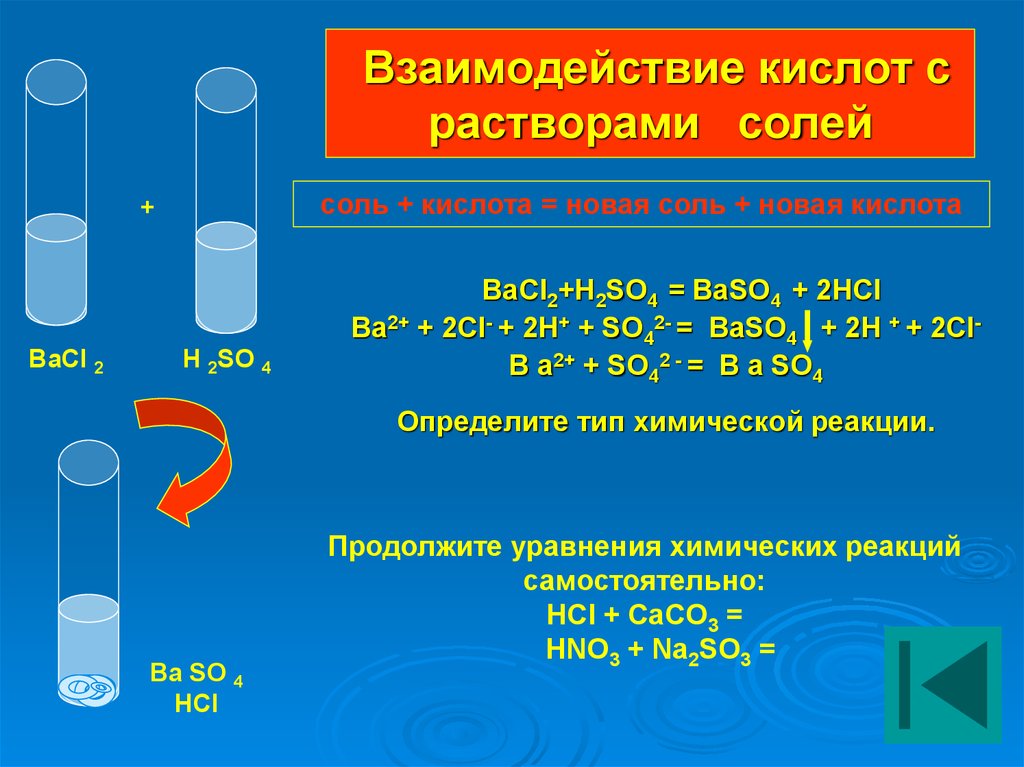 Генерация на месте также позволит избежать этапа концентрации и, таким образом, снизить общее потребление энергии.
Генерация на месте также позволит избежать этапа концентрации и, таким образом, снизить общее потребление энергии.
Протоны (H + ) и гидроксид-ионы (OH — ) могут быть получены путем электролиза воды с использованием двухкамерной электрохимической ячейки с анодом, питаемым NaCl, содержащим воду, и катодом, питаемым чистой водой. Однако коммерчески доступные в настоящее время анодные материалы, такие как титан с покрытием из смешанных оксидов металлов (MMO) и легированный бором алмаз (BDD), склонны к образованию хлора даже при низких концентрациях хлоридов 4,5,6 . Следовательно, эти материалы не позволяют производить HCl напрямую из растворов NaCl.
Во избежание образования хлора была предложена пятикамерная электрохимическая система (т.е. биполярный мембранный электродиализ) для одновременного получения кислоты и щелочи из концентратов обратного осмоса 7 . Хотя была продемонстрирована возможность одновременного производства кислоты и каустика, ожидается, что практическая и экономическая осуществимость будет ограничена из-за сложной конфигурации реактора и больших энергетических потребностей системы, вызванных использованием нескольких мембран.
Предыдущие исследования показали, что покрытие титановых электродов оксидами марганца-молибдена вместо Ir MMO заметно снижает электрокаталитическую активность по отношению к образованию гипохлорита 8,9,10,11 . Хотя эти исследования были направлены на получение водорода из морской воды в слабощелочных или кислых условиях с использованием неразделенных электрохимических элементов, результаты показывают, что этот материал потенциально может предотвратить образование хлора при производстве соляной кислоты умеренной концентрации. Действительно, было высказано предположение, что MnO 9Покрытия на основе 0079 2 могут выступать в качестве диффузионного барьера для ионов хлора. Это позволяет формировать высокую степень концентрационной поляризации, увеличивая тем самым концентрационное перенапряжение для реакции выделения хлора. Следовательно, выделение кислорода в результате окисления воды благоприятствует 12 . Поэтому в этой работе мы предполагаем, что без образования анодного хлора было бы целесообразно использовать анод Mn x Mo y O z для одновременного производства HCl и NaOH без необходимости использования двух дополнительных биполярных мембран. и деионизированная вода как среда в упомянутой выше электрохимической системе 7 . Следовательно, предлагаемая нами система может работать при гораздо более низком омическом сопротивлении и, таким образом, потреблять меньше энергии.
и деионизированная вода как среда в упомянутой выше электрохимической системе 7 . Следовательно, предлагаемая нами система может работать при гораздо более низком омическом сопротивлении и, таким образом, потреблять меньше энергии.
Здесь мы стремимся оценить возможность использования анодов Mn x Mo y O z для одновременного производства HCl и NaOH с использованием трехкамерной электрохимической ячейки. В этой конфигурации анодное и среднее отделения разделены анионообменной мембраной (АЕМ), а катодное и среднее отделения разделены катионообменной мембраной (СЕМ), в которой концентрированный раствор NaCl циркулирует по среднему отделению. Таким образом, HCl и NaOH могут производиться одновременно в анодном и катодном отделениях соответственно. Теоретически можно было бы использовать не только искусственный рассол, но и солевые (отходные) потоки (например, концентраты обратного осмоса), что потенциально могло бы произвести революцию в очистке солевых потоков сточных вод.
Результаты и обсуждение
Характеристики электрода
Первая серия экспериментов показала, что средний КЭ для образования HCl составил 65,0 ± 3,5% при конечной концентрации HCl 0,81 ± 0,04 % масс., в то время как средний КЭ для образования щелочи составил 88,6 ± 0,5% при конечной щелочной прочности 1,16 ± 0,01 % масс. Конечные уровни рН в анодном и катодном отсеках составили 0,95±0,04 и 13,63±0,03 соответственно. IC-анализ концентраций хлоридов в аноде также подтвердил образование HCl (0,78 ± 0,05% масс.).
Уменьшение CE для производства HCl было связано с переходом протонов через AEM в средний отсек, а снижение CE для производства NaOH было вызвано обратной диффузией гидроксида через CEM в средний отсек и, возможно, также протонным переходом -через КЭМ в катодное отделение. Протоны в среднем отсеке нейтрализуют ионы гидроксида, мигрировавшие через СЕМ, и могут также мигрировать через СЕМ в катодное отделение. Конечный рН среднего отсека со временем снизился до 2,0 ± 0,0, что указывает на то, что переход протонов с анода был более выраженным, чем обратная диффузия гидроксида с катода. Чистое увеличение концентрации протонов в среднем отсеке (pH при 2,0) составляло 10,8 ± 0,1% от общего нанесенного заряда. Потери ЭЭ при производстве гидроксида оцениваются в 11,4 ± 0,5%. Следовательно, общие потери CE для производства HCl оцениваются в 22,2 ± 0,5% от общего количества применяемой загрузки. Основано на ионообменной емкости АЕМ (общая ионная емкость: 1,3 мэкв/г; масса сухой мембраны, контактировавшей с раствором: 1,44 мкг) и СЕМ (общая ионная емкость: 1,6 мэкв/г; масса сухой мембраны, контактировавшей с раствором: 1,64). g) использованные в экспериментах расчетные потери ХЭ для H + рассчитано как 2,1% и 2,9% для AEM и CEM соответственно. Важно отметить, что наблюдаемое образование хлора составляет только 5,3 ± 2,0% подаваемой загрузки. С учетом вышеперечисленных факторов конечный электронный баланс для анодных реакций составил 97,6 ± 2,0%. Кроме того, анодный потенциал и напряжение на ячейке составляли 1,56 ± 0,02 В по сравнению с НВЭ и 5,4 ± 0,0 В соответственно, что ясно показывает воспроизводимость экспериментов.
Чистое увеличение концентрации протонов в среднем отсеке (pH при 2,0) составляло 10,8 ± 0,1% от общего нанесенного заряда. Потери ЭЭ при производстве гидроксида оцениваются в 11,4 ± 0,5%. Следовательно, общие потери CE для производства HCl оцениваются в 22,2 ± 0,5% от общего количества применяемой загрузки. Основано на ионообменной емкости АЕМ (общая ионная емкость: 1,3 мэкв/г; масса сухой мембраны, контактировавшей с раствором: 1,44 мкг) и СЕМ (общая ионная емкость: 1,6 мэкв/г; масса сухой мембраны, контактировавшей с раствором: 1,64). g) использованные в экспериментах расчетные потери ХЭ для H + рассчитано как 2,1% и 2,9% для AEM и CEM соответственно. Важно отметить, что наблюдаемое образование хлора составляет только 5,3 ± 2,0% подаваемой загрузки. С учетом вышеперечисленных факторов конечный электронный баланс для анодных реакций составил 97,6 ± 2,0%. Кроме того, анодный потенциал и напряжение на ячейке составляли 1,56 ± 0,02 В по сравнению с НВЭ и 5,4 ± 0,0 В соответственно, что ясно показывает воспроизводимость экспериментов. С учетом стандартного потенциала E 0 для выделения кислорода 1,17 В по сравнению с NHE (при pH 1), перенапряжение для выделения кислорода можно оценить в 0,39 В. Это значение аналогично перенапряжениям, обнаруженным для других известных каталитических покрытий для выделения кислорода, как подробно обсуждается в Фридендаль, и др. 13 . Снижение напряжения ячейки может быть дополнительно достигнуто за счет использования лучшей конфигурации реактора или мембран, имеющих меньшее поверхностное сопротивление.
С учетом стандартного потенциала E 0 для выделения кислорода 1,17 В по сравнению с NHE (при pH 1), перенапряжение для выделения кислорода можно оценить в 0,39 В. Это значение аналогично перенапряжениям, обнаруженным для других известных каталитических покрытий для выделения кислорода, как подробно обсуждается в Фридендаль, и др. 13 . Снижение напряжения ячейки может быть дополнительно достигнуто за счет использования лучшей конфигурации реактора или мембран, имеющих меньшее поверхностное сопротивление.
Во второй серии экспериментов (n = 3) в качестве анолита использовали бикарбонатный буферный раствор вместо 0,1 мас.% раствора HCl, чтобы подтвердить сродство к выделению кислорода, а не образованию хлора. Наблюдаемый КЭ для образования свободного доступного хлора (т. е. суммы хлора, хлорноватистой кислоты и гипохлорит-иона) составлял всего 2,9.± 0,6% при pH ~ 7,5, что указывает на высокое сродство к выделению кислорода с CE для окисления воды выше 97%. Это высокое сродство к выделению кислорода согласуется с нашим тестом на выделение хлора (см. Дополнительную информацию). Кроме того, средний КЭ для образования NaOH составил 86,2 ± 4,3%. pH среднего отсека со временем увеличился до 11,7 ± 0,6, что составляет 9,3 ± 7,4% от общего заряда. Результаты подтверждают, что потери CE при образовании NaOH были в основном связаны с обратной диффузией гидроксида от катода к среднему отсеку.
Это высокое сродство к выделению кислорода согласуется с нашим тестом на выделение хлора (см. Дополнительную информацию). Кроме того, средний КЭ для образования NaOH составил 86,2 ± 4,3%. pH среднего отсека со временем увеличился до 11,7 ± 0,6, что составляет 9,3 ± 7,4% от общего заряда. Результаты подтверждают, что потери CE при образовании NaOH были в основном связаны с обратной диффузией гидроксида от катода к среднему отсеку.
Значение для практики
Здесь мы показали возможность одновременного производства HCl и NaOH за счет использования Mn 0,84 Mo 0,16 O 2,23 покрытых титановых электродов. Это было достигнуто с помощью трехкамерной электрохимической ячейки с искусственным рассолом в качестве раствора в средней камере. Представленный здесь метод знаменует собой важный шаг вперед к производству HCl и NaOH на месте. Использование такой технологии устранило бы проблемы ОЗиОБТ, связанные с транспортировкой, хранением и обращением с концентрированными HCl и NaOH. В данном исследовании мы использовали раствор NaCl в качестве источника ионов натрия и хлора. В практических приложениях раствор NaCl может быть заменен солеными потоками отходов, такими как концентрат обратного осмоса (ROC) или морская вода, что потенциально может произвести революцию в обработке соленых потоков отходов, таких как ROC, превратив ROC в ценный ресурс вместо потока отходов.
В данном исследовании мы использовали раствор NaCl в качестве источника ионов натрия и хлора. В практических приложениях раствор NaCl может быть заменен солеными потоками отходов, такими как концентрат обратного осмоса (ROC) или морская вода, что потенциально может произвести революцию в обработке соленых потоков отходов, таких как ROC, превратив ROC в ценный ресурс вместо потока отходов.
В этом экспериментальном исследовании HCl и NaOH были получены с концентрацией 0,81 ± 0,04 % масс. и 1,16 ± 0,01 % масс. соответственно. Для практической ситуации рекомендуется дальнейшее увеличение концентрации раствора (например, 3 ~ 5 % масс.), чтобы минимизировать требуемый объем хранения.
Стабильность покрытия в применяемых условиях должна быть проверена в ходе долгосрочных экспериментов и ускоренных испытаний на срок службы, тогда как кислородная эффективность покрытия может быть дополнительно улучшена за счет добавления других металлов в покрытие (например, вольфрама) и улучшения процесс анодного нанесения путем многократного анодного осаждения 14 . Кроме того, следует изучить и другие факторы, потенциально препятствующие промышленному внедрению, такие как деградация электрода из-за роста оксида на подложке 10 . Действительно, необходимы будущие исследования для детального изучения влияния фонового электролита на окисление хлоридов на покрытиях Mn x Mo y O z .
Кроме того, следует изучить и другие факторы, потенциально препятствующие промышленному внедрению, такие как деградация электрода из-за роста оксида на подложке 10 . Действительно, необходимы будущие исследования для детального изучения влияния фонового электролита на окисление хлоридов на покрытиях Mn x Mo y O z .
Кроме того, АЭМ, использованный в этом исследовании, был склонен к значительному перекресту протонов, таким образом, эффективность процесса может быть дополнительно повышена за счет использования мембран, менее склонных к перекресту протонов, таких как мембраны, используемые в качестве блокаторов кислоты 15 . Из-за потенциального воздействия хлора на анионообменные мембраны можно предложить устойчивые к хлору мембранные или пористые пластинчатые сепараторы 16,17 .
Методы
Электрохимическая ячейка и работа
Методы, используемые для подготовки и определения характеристик электродов, подробно описаны в дополнительной информации 9,18,19 . На рис. 1 представлен схематический обзор экспериментальной установки. Трехкамерная электрохимическая ячейка состояла из трех рамок из плексигласа с внутренними размерами 20 × 5 × 1 см, создавая объемы по 100 мл для каждой камеры. АЭМ (Ultrex AMI-7001, Membranes International Inc., США) отделял анод от среднего отсека, а катод и средние отсеки были разделены с помощью СЭМ (Ultrex CMI-7000, Membranes International Inc., США). Изготовленная сетка фасонная Мн 0,84 Mo 0,16 O 2,23 Титановый электрод с покрытием и сетка из нержавеющей стали (размер ячеек 6 мм, проволока 0,8 мм) с выступающей поверхностью 24 см 2 были использованы в качестве материала анода и катода соответственно. Все растворы (т.е. анодный, катодный и промежуточный растворы) рециркулировали со скоростью потока 4 л/ч с использованием перистальтического насоса. В анодном отсеке использовали электрод сравнения Ag/AgCl (предположим, при + 0,197 В по сравнению с NHE). Эксперименты контролировали гальваностатически при плотности тока 250 А/м 2 с помощью потенциостата/гальваностата Wenking (KP07, Bank Elektronik, Германия).
На рис. 1 представлен схематический обзор экспериментальной установки. Трехкамерная электрохимическая ячейка состояла из трех рамок из плексигласа с внутренними размерами 20 × 5 × 1 см, создавая объемы по 100 мл для каждой камеры. АЭМ (Ultrex AMI-7001, Membranes International Inc., США) отделял анод от среднего отсека, а катод и средние отсеки были разделены с помощью СЭМ (Ultrex CMI-7000, Membranes International Inc., США). Изготовленная сетка фасонная Мн 0,84 Mo 0,16 O 2,23 Титановый электрод с покрытием и сетка из нержавеющей стали (размер ячеек 6 мм, проволока 0,8 мм) с выступающей поверхностью 24 см 2 были использованы в качестве материала анода и катода соответственно. Все растворы (т.е. анодный, катодный и промежуточный растворы) рециркулировали со скоростью потока 4 л/ч с использованием перистальтического насоса. В анодном отсеке использовали электрод сравнения Ag/AgCl (предположим, при + 0,197 В по сравнению с NHE). Эксперименты контролировали гальваностатически при плотности тока 250 А/м 2 с помощью потенциостата/гальваностата Wenking (KP07, Bank Elektronik, Германия). Потенциалы электродов регистрировали каждые 2 минуты с помощью блока сбора данных (Agilent Technologies, США). В анодном и катодном отсеках использовались водяные затворы для предотвращения накопления кислорода (анод) и газообразного водорода (катод). 200 мл раствора щелочи (2 % масс.) использовали в качестве гидрозатвора анода для улавливания образующегося газообразного хлора.
Потенциалы электродов регистрировали каждые 2 минуты с помощью блока сбора данных (Agilent Technologies, США). В анодном и катодном отсеках использовались водяные затворы для предотвращения накопления кислорода (анод) и газообразного водорода (катод). 200 мл раствора щелочи (2 % масс.) использовали в качестве гидрозатвора анода для улавливания образующегося газообразного хлора.
Рисунок 1
Схематический обзор экспериментальной установки.
Изображение полного размера
Процедуры экспериментальных прогонов
Предварительные результаты показали, что приготовленный титановый электрод с покрытием Mn 0,84 Mo 0,16 O 2,23 имел гораздо более низкое сродство к выделению хлора, чем имеющийся в продаже титановый электрод с покрытием x 900/хлор. Титановые электроды с покрытием (см. дополнительную информацию). Впоследствии были проведены две серии 4-часовых экспериментальных запусков. Первая серия экспериментов (n = 3) была проведена для определения эффективности производства HCl и NaOH. 300 мл раствора HCl (1 г/л) использовали в качестве анолита, а 300 мл NaOH (1 г/л) использовали в качестве католита для обеспечения достаточной начальной проводимости. В среднем отсеке использовали 1 л раствора NaCl (35 г/л). В конце каждого эксперимента отбирали жидкие пробы с анода и катода для измерения HCl и NaOH соответственно. Вторая серия экспериментов (n = 3) была проведена для подтверждения того, что образование хлора было незначительным. 1 л раствора 40 г/л NaHCO 3 и 1 г/л NaCl использовали в качестве анолита, а 500 мл раствора NaOH (1 г/л) использовали в качестве католита. В среднем отсеке использовали 1 л раствора NaCl (35 г/л). Раствор NaHCO 3 использовали для поддержания его анодного уровня рН > 7,5, таким образом, любой образовавшийся молекулярный хлор оставался бы в растворе в виде хлорноватистой кислоты и иона гипохлорита, а не газообразного хлора.
Первая серия экспериментов (n = 3) была проведена для определения эффективности производства HCl и NaOH. 300 мл раствора HCl (1 г/л) использовали в качестве анолита, а 300 мл NaOH (1 г/л) использовали в качестве католита для обеспечения достаточной начальной проводимости. В среднем отсеке использовали 1 л раствора NaCl (35 г/л). В конце каждого эксперимента отбирали жидкие пробы с анода и катода для измерения HCl и NaOH соответственно. Вторая серия экспериментов (n = 3) была проведена для подтверждения того, что образование хлора было незначительным. 1 л раствора 40 г/л NaHCO 3 и 1 г/л NaCl использовали в качестве анолита, а 500 мл раствора NaOH (1 г/л) использовали в качестве католита. В среднем отсеке использовали 1 л раствора NaCl (35 г/л). Раствор NaHCO 3 использовали для поддержания его анодного уровня рН > 7,5, таким образом, любой образовавшийся молекулярный хлор оставался бы в растворе в виде хлорноватистой кислоты и иона гипохлорита, а не газообразного хлора. Таким образом, можно точно определить КЭ для образования хлора. Пробы жидкости с катода отбирали для измерения образования NaOH после 4-часовой работы. В конце каждого эксперимента отбирали жидкие пробы с анода для измерения концентраций хлорида и хлора, а также измеряли конечные значения pH во всех отсеках.
Таким образом, можно точно определить КЭ для образования хлора. Пробы жидкости с катода отбирали для измерения образования NaOH после 4-часовой работы. В конце каждого эксперимента отбирали жидкие пробы с анода для измерения концентраций хлорида и хлора, а также измеряли конечные значения pH во всех отсеках.
Химический анализ
Концентрации HCl и NaOH определяли титрованием с использованием 1 М раствора NaOH или 1 М раствора HCl соответственно. Значения рН измеряли с помощью ручного рН-метра (Eutech Instruments, Австралия). Общий и свободный хлор измеряли с помощью наборов для определения содержания свободного хлора DPD (Hach Lange, Германия). Эти тестовые наборы основаны на фотометрическом методе DPD, который соответствует стандартным методам (Стандартный метод USEPA 4500-CI G). Концентрацию хлорида измеряли с помощью ионной хроматографии, оснащенной системой Dionex 2010i.
Дополнительная информация
Как цитировать эту статью : Lin, H.-W. и др.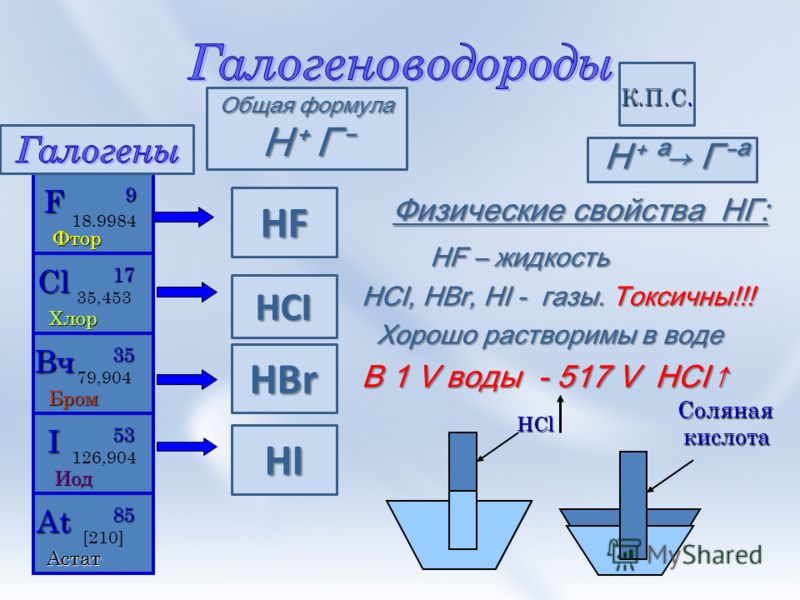 Прямое производство анодной соляной кислоты и катодной щелочи при электролизе воды. науч. Респ. 6 , 20494; doi: 10.1038/srep20494 (2016).
Прямое производство анодной соляной кислоты и катодной щелочи при электролизе воды. науч. Респ. 6 , 20494; doi: 10.1038/srep20494 (2016).
Ссылки
Остин С. и Гловацки А. в Энциклопедии промышленной химии Ульмана (Wiley-VCH Verlag GmbH & Co. KGaA, 2000).
Курт С. и Биттнер Дж. в Энциклопедии промышленной химии Ульмана (Wiley-VCH Verlag GmbH & Co. KGaA, 2000).
О’Брайен, Т., Боммараю, Т. В. и Хайн, Ф. Справочник по хлорно-щелочной технологии. (Спрингер, 2005).
Мензель, Н., Ортель, Э., Метте, К., Крэнерт, Р. и Штрассер, П. Стабильные по размеру Ru/Ir/TiO2-аноды с заданной мезопористостью для эффективного электрохимического выделения хлора. Катал. 3, 1324–1333 (2013).
Артикул
КАСGoogle ученый
Bagastyo, A.Y. et al. Электрохимическое окисление концентрата обратного осмоса на легированных бором алмазных анодах при околонейтральном и кислом рН.
 Вода Res. 46, 6104–6112 (2012).
Вода Res. 46, 6104–6112 (2012).Артикул
КАСGoogle ученый
Бергманн М.Э.Х. и Копарал А.С. Исследования производства электрохимических дезинфицирующих средств с использованием анодов, содержащих RuO2. Дж. Заявл. Электрохим. 35, 1321–1329 (2005).
Артикул
КАСGoogle ученый
Yang, Y., Gao, X., Fan, A., Fu, L. & Gao, C. Инновационное полезное повторное использование концентрата морской воды с использованием электродиализа с биполярной мембраной. Дж. Член. науч. 449, 119–126 (2014).
Артикул
КАСGoogle ученый
Fujimura, K. et al. Анодно-осажденные оксидно-марганцево-молибденовые аноды с высокой селективностью выделения кислорода при электролизе морской воды. Дж. Заявл. Электрохим. 29, 769–775 (1999).
Артикул
Google ученый
Fujimura, K.
 et al. Стойкость оксидно-марганцево-молибденовых анодов к выделению кислорода при электролизе морской воды. Электрохим. Акта 45, 2297–2303 (2000).
et al. Стойкость оксидно-марганцево-молибденовых анодов к выделению кислорода при электролизе морской воды. Электрохим. Акта 45, 2297–2303 (2000).Артикул
КАСGoogle ученый
Като З. и др. Электрохимическая характеристика деградации анода выделения кислорода для электролиза морской воды. Электрохим. Acta 116, 152–157 (2014).
Артикул
КАСGoogle ученый
Като, З., Бхаттараи, Дж., Кумагаи, Н., Изумия, К. и Хасимото, К. Повышение долговечности и разрушение анодов выделения кислорода при электролизе морской воды для производства водорода. заявл. Серф. науч. 257, 8230–8236 (2011).
Артикул
КАС
ОБЪЯВЛЕНИЯGoogle ученый
Bennett, J. E. Электроды для получения водорода и кислорода из морской воды. Междунар. J. Hydrogen Energy 5, 401–408 (1980).
Артикул
КАСGoogle ученый
Фридендал, Р.
 и др. Сравнительный анализ стабильности катализаторов реакции выделения кислорода: важность мониторинга потерь массы. ХимЭлектроХим 1, 2075–2081 (2014).
и др. Сравнительный анализ стабильности катализаторов реакции выделения кислорода: важность мониторинга потерь массы. ХимЭлектроХим 1, 2075–2081 (2014).Артикул
КАСGoogle ученый
Мацуи, Т. и др. Анодно-осажденные марганцево-молибденово-вольфрамовые оксидные аноды для выделения кислорода при электролизе морской воды. Дж. Заявл. Электрохим. 32, 993–1000 (2002).
Артикул
КАСGoogle ученый
Сюй Т. Ионообменные мембраны: состояние их развития и перспективы. Дж. Член. науч. 263, 1–29(2005).
Артикул
КАСGoogle ученый
Баштан С.Ю., Гончарук В.В., Чеботарева Р.Д., Беляков В.Н., Линьков В.М. Получение гипохлорита натрия в электролизере с керамической мембраной. Опреснение 126, 77–82 (1999).
Артикул
КАСGoogle ученый
Сондхи Р.
 , Бхаве Р. и Юнг Г. Применение и преимущества керамических мембран. Мембранные технологии 2003, 5–8 (2003).
, Бхаве Р. и Юнг Г. Применение и преимущества керамических мембран. Мембранные технологии 2003, 5–8 (2003).Артикул
Google ученый
Hayfield, P.C.S. Разработка титанового электрода с покрытием из благородного металла/оксида. Платина Мет. Ред. 42, 116–116 (1998).
КАС
Google ученый
Парк, Б.-О., Локханде, К.Д., Парк, Х.-С., Юнг, К.-Д. и Джу, О.-С. Характеристики суперконденсатора с электроосажденными электродами из пленки оксида рутения — влияние толщины пленки. Дж. Источники питания 134, 148–152 (2004).
Артикул
КАС
ОБЪЯВЛЕНИЯGoogle ученый
Скачать ссылки
Благодарности
Хуэй-вэнь Линь благодарит Университет Квинсленда за стипендиальную поддержку. Это исследование было проведено в рамках проекта ARC Linkage LP120200238. КР поддерживается Междисциплинарным исследовательским партнерством «Гентская биоэкономика» и проектом ЕС FP7 «Kill-Spill».
Информация об авторе
Авторы и организации
Центр передового управления водными ресурсами (AWMC), Университет Квинсленда, Квинсленд, 4072, Австралия
Хуэй-Вэнь Линь, Корнил Рабаи, Жигуо Юань и Илье Пикаар
Факультет физики, Группа фотоэлектрических устройств и оптоэлектроники Universitat Jaume I, Castelló, 12071, Испания
Rocío Cejudo-Marín
MAGNETO special anodes B.V.s, Calandstraat 109, Schiedam, 3125, BA, Нидерланды
Adriaan W. Jeremiasse
Лаборатория микробной экологии и технологии (LabMET), Гентский университет, Coupure Links 653, Гент, 9000, Бельгия
Korneel Rabaey
Университет Квинсленда, Школа гражданского строительства, Квинсленд, 4072, Австралия
Илье Пикаар
Авторы
- Hui-Wen Lin
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Академия - Rocío Cejudo-Marín
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Adriaan W.
 Jeremiasse
JeremiasseПросмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Korneel Rabaey
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Zhiguo Yuan
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Илье Пикаар
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
H.-W.L., K.R., Z.Y. и И.П. задумал и спроектировал исследование. А.Дж. и Р.К.-М. выполнили подготовку и характеристику электрода. Х.-В.Л. провел эксперимент, проанализировал, интерпретировал данные и написал статью. Все авторы рассмотрели рукопись.
Декларации этики
Конкурирующие интересы
Авторы не заявляют о конкурирующих финансовых интересах.
Электронные дополнительные материалы
Дополнительная информация
Права и разрешения
Эта работа находится под лицензией Creative Commons Attribution 4.0 International License. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке; если материал не включен в лицензию Creative Commons, пользователям необходимо будет получить разрешение от держателя лицензии на воспроизведение материала. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/
Перепечатка и разрешения
Об этой статье
Эту статью цитирует
Многостадийный биполярный мембранный электродиализ для производства оснований из сточных вод высокой минерализации
- Ариф Хусейн
- Хайян Ян
- Тонгвэнь Сюй
Границы химической науки и техники (2022)
Добавление нитритов в подкисленный ил значительно улучшает усвояемость, удаление токсичных металлов, обезвоживаемость и снижает количество патогенов.

- Фанчжоу Ду
- Юрг Келлер
- Илье Пикаар
Научные отчеты (2016)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Скачать PDF
Соляная кислота — Факты химической безопасности
Обновлено 14 октября 2022 г.
Соляная кислота — это водный раствор газообразного хлористого водорода и основной компонент желудочной кислоты, кислоты, которая естественным образом вырабатывается в желудке человека и помогает переваривать пищу. Соляная кислота производится синтетическим путем для различных промышленных и коммерческих целей.
Соляная кислота производится синтетическим путем для различных промышленных и коммерческих целей.
Ключевые моменты/Обзор
Соляная кислота может использоваться для обработки стали в строительстве. Он используется в химической промышленности при крупномасштабном производстве винилхлорида, используемого для производства ПВХ, и является одним из химических веществ, используемых для производства пенополиуретана и хлорида кальция.
Обычное конечное использование соляной кислоты включает бытовые чистящие средства, обслуживание бассейнов и производство продуктов питания.
OSHA рекомендует рабочим на промышленных предприятиях носить средства индивидуальной защиты, такие как респираторы, резиновые перчатки, защитные очки и лицевые щитки при работе с соляной кислотой.
Пластиковые контейнеры, например, из ПВХ, обычно можно использовать для хранения соляной кислоты. Металлические контейнеры, как правило, не подходят для хранения соляной кислоты из-за ее коррозионной природы.
Применение и преимущества
Соляная кислота — это сильная коррозионно-активная кислота, которую можно использовать в промышленности для обработки стали, используемой в строительстве. Он используется в химической промышленности в крупномасштабном производстве винилхлорида, используемого для изготовления поливинилхлоридного (ПВХ) пластика, и является одним из химических веществ, которые используются для производства пенополиуретана и хлорида кальция.
Соляная кислота также используется для производства многих других химикатов, а также в качестве дезинфицирующего средства и слимицида, химиката, предотвращающего рост слизи в бумажной массе.
Другие распространенные виды конечного использования соляной кислоты включают бытовые чистящие средства, обслуживание бассейнов и производство продуктов питания.
Производство стали
Соляная кислота используется в операциях травления для удаления ржавчины и других примесей с углеродистой, легированной и нержавеющей стали, для подготовки стали к окончательному применению в строительных проектах, а также в таких продуктах, как кузова автомобилей и бытовая техника. Он также используется для травления алюминия и очистки металлов.
Он также используется для травления алюминия и очистки металлов.
Бытовые чистящие средства
Соляная кислота может входить в состав бытовых чистящих средств, таких как чистящие средства для унитазов, чистящие средства для плитки в ванной и другие чистящие средства для фарфора, из-за ее коррозионных свойств, которые помогают удалять стойкие пятна.
Санитарная обработка бассейнов
Соляная кислота используется в качестве реагента для обработки плавательных бассейнов, помогая поддерживать оптимальный уровень pH в воде.
Производство и переработка пищевых продуктов
В пищевой промышленности соляная кислота используется для обработки различных пищевых продуктов, таких как кукурузные сиропы, используемые в безалкогольных напитках, печенье, крекеры, кетчуп и хлопья. Соляная кислота также используется в качестве подкислителя в соусах, овощных соках и консервах, чтобы улучшить вкус и уменьшить порчу.
Производство хлорида кальция
Когда соляная кислота смешивается или вступает в реакцию с известняком, образуется хлорид кальция, тип соли, используемой для удаления льда с дорог. Хлорид кальция также используется в производстве продуктов питания в качестве стабилизатора и укрепляющего агента, например, в хлебобулочных изделиях, а также в качестве противомикробного средства.
Хлорид кальция также используется в производстве продуктов питания в качестве стабилизатора и укрепляющего агента, например, в хлебобулочных изделиях, а также в качестве противомикробного средства.
Дополнительное использование
Информация по технике безопасности
Соляная кислота в концентрированной жидкой форме имеет сильный раздражающий запах и является очень коррозионной. По данным Национальной медицинской библиотеки США, при контакте он может вызвать повреждения, такие как химические ожоги. Центры США по контролю и профилактике заболеваний (CDC) отмечают, что соляная кислота может вызвать повреждение глаз, даже слепоту, если попасть в глаза.
Проглатывание концентрированной соляной кислоты может вызвать серьезное повреждение полости рта, горла, пищевода и желудка. При работе с соляной кислотой следует использовать средства индивидуальной защиты (СИЗ), такие как респираторы, резиновые перчатки, защитные очки и лицевые щитки. При использовании на рабочем месте рекомендуется иметь устройство для промывки глаз на случай случайного воздействия.
При использовании чистящих средств для бассейнов, содержащих соляную кислоту (также известную как соляная кислота), важно следовать указаниям на этикетке продукта для безопасного обращения. CDC разработал два плаката с рекомендациями по безопасному обращению с химикатами в бассейне, а также по хранению химикатов для бассейнов для владельцев и операторов бассейнов.
Хранение соляной кислоты
Металлические контейнеры не подходят для хранения соляной кислоты из-за ее коррозионной природы. Пластиковые контейнеры, например, из ПВХ, обычно можно использовать для хранения соляной кислоты.
Часто задаваемые вопросы
Вредна ли соляная кислота, используемая для производства продуктов питания и напитков?
В пищевой промышленности соляная кислота используется для обработки различных пищевых продуктов. По данным Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, продукты питания и напитки содержат небольшое количество соляной кислоты, которая «нейтрализуется и буферизуется во время приема внутрь и пищеварения или после всасывания». Соляная кислота обычно считается безопасной при использовании в качестве буфера и нейтрализующего агента.
Соляная кислота обычно считается безопасной при использовании в качестве буфера и нейтрализующего агента.
Почему соляная кислота используется в бассейнах?
Соляная кислота используется для регулирования pH воды в бассейне. Уровень хлора в воде бассейна зависит от pH воды, который можно оптимизировать с помощью химических веществ, таких как соляная кислота. Более подробную информацию о техническом обслуживании для здорового и безопасного плавания в бассейне можно найти на веб-сайте CDC.
Опасно ли длительное воздействие соляной кислоты?
Хроническое воздействие соляной кислоты может быть опасным. Профессиональное воздействие может происходить в промышленных условиях при вдыхании или контакте с кожей во время производства и использования соляной кислоты. Сообщается, что длительное воздействие вызывает у людей хронический бронхит, дерматит и фотосенсибилизацию. У крыс, которые постоянно подвергались ингаляционным испытаниям, наблюдались поражения носовой полости и другие побочные эффекты.

 Джеремиас 3 ,
Джеремиас 3 ,.png) Вода Res. 46, 6104–6112 (2012).
Вода Res. 46, 6104–6112 (2012). et al. Стойкость оксидно-марганцево-молибденовых анодов к выделению кислорода при электролизе морской воды. Электрохим. Акта 45, 2297–2303 (2000).
et al. Стойкость оксидно-марганцево-молибденовых анодов к выделению кислорода при электролизе морской воды. Электрохим. Акта 45, 2297–2303 (2000). и др. Сравнительный анализ стабильности катализаторов реакции выделения кислорода: важность мониторинга потерь массы. ХимЭлектроХим 1, 2075–2081 (2014).
и др. Сравнительный анализ стабильности катализаторов реакции выделения кислорода: важность мониторинга потерь массы. ХимЭлектроХим 1, 2075–2081 (2014). , Бхаве Р. и Юнг Г. Применение и преимущества керамических мембран. Мембранные технологии 2003, 5–8 (2003).
, Бхаве Р. и Юнг Г. Применение и преимущества керамических мембран. Мембранные технологии 2003, 5–8 (2003). Jeremiasse
Jeremiasse