Содержание
ICSC 1166 — СЕРА
ICSC 1166 — СЕРА
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| СЕРА | ICSC: 1166 (Ноябрь 2000) |
| CAS #: 7704-34-9 |
| UN #: 1350 |
| EINECS #: 231-722-6 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. | НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. Замкнутая система, взрывозащищенное (для пыльной среды) электрическое оборудование и освещение. Не допускать оседания пыли. Предотвращать образование электростатического заряда (например, используя заземление). | Использовать распыленную воду, пену, порошок, сухой песк. В случае пожара: охлаждать бочки и т.д. распыляя воду. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Ощущения жжения. Кашель. Боли в горле. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Обратиться за медицинской помощью. Обратиться за медицинской помощью. |
| Кожа | Покраснение. | Защитные перчатки. | Снять загрязненную одежду. Ополоснуть и затем промыть кожу водой с мылом. |
| Глаза | Покраснение. Боль. Помутнение зрения. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Ощущение жжения. Диарея. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. Отдельно от сильных окислителей. | |
| УПАКОВКА | |
| СЕРА | ICSC: 1166 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: S / S8 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Often transported in molten state (UN 2448; TEC(R)-115). Molten sulfur reacts with hydrocarbons to form toxic and flammable gases. В зависимости от степени воздействия, рекомендуется периодическое медицинское обследование. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Сера
|
Сера / Sulphur (S) | |
|---|---|
|
Атомный номер |
16 |
|
Внешний вид простого вещества |
светло-желтое хрупкое твердое вещество, в чистом виде без запаха |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
32,066 а. е. м. (г/моль) |
|
Радиус атома |
127 пм |
|
Энергия ионизации (первый электрон) |
999,0 (10,35) кДж/моль (эВ) |
|
Электронная конфигурация |
[Ne] 3s2 3p4 |
|
Химические свойства | |
|
Ковалентный радиус |
102 пм |
|
Радиус иона |
30 (+6e) 184 (-2e) пм |
|
Электроотрицательность (по Полингу) |
2,58 |
|
Электродный потенциал |
0 |
|
Степени окисления |
6, 4, 2, -2 |
|
Термодинамические свойства простого вещества | |
|
Плотность |
2,070 г/см³ |
|
Молярная теплоёмкость |
22,61 Дж/(K·моль) |
|
Теплопроводность |
0,27 Вт/(м·K) |
|
Температура плавления |
386 K |
|
Теплота плавления |
1,23 кДж/моль |
|
Температура кипения |
717,824 K |
|
Теплота испарения |
10,5 кДж/моль |
|
Молярный объём |
15,5 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
орторомбическая |
|
Параметры решётки |
a=10,437 b=12,845 c=24,369 Å |
|
Отношение c/a |
— |
|
Температура Дебая |
n/a K |
|
S |
16 |
|
32,066 | |
|
[Ne]3s23p4 | |
|
Сера | |
Се́ра (Sulphur — обозн. «S» в таблице Менделеева) — высокоэлектроотрицательный элемент, проявляет неметаллические свойства. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде
«S» в таблице Менделеева) — высокоэлектроотрицательный элемент, проявляет неметаллические свойства. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде
Природные минералы серы
Схема атома серы
Сера является шестнадцатым по химической распространенности элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде. Важнейшие природные соединения серы FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
История открытия и происхождение названия
Сера (Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте.
Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трех принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом точно происхождение серы не установлено, но как сказано выше этот элемент использовался до Рождества Христова, а значит знаком людям с давних времен.
Происхождение названия
Происхождение латинского sulfur неизвестно. Русское название элемента обычно производят от санскритского «сира» — светло-желтый. Возможно родство «серы» с древнееврейским «серафим» — множественным числом от «сераф» — букв. сгорающий, а сера хорошо горит. В древнерусском и старославянском «сера» — вообще горючее вещество, в том числе и жир.
Возможно родство «серы» с древнееврейским «серафим» — множественным числом от «сераф» — букв. сгорающий, а сера хорошо горит. В древнерусском и старославянском «сера» — вообще горючее вещество, в том числе и жир.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления — одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (то есть одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-h3O и ангидрита CaSО4 в серу и кальцит СаСО3.
Данная теория создана в 1935 году советскими учеными Л. М. Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной.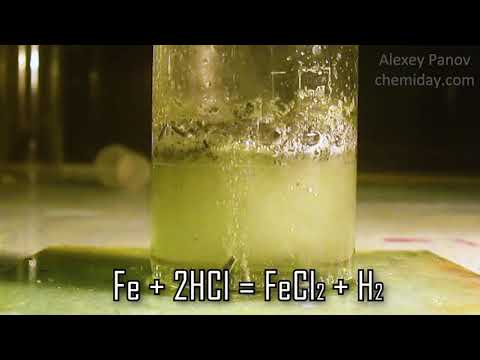 На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Разнообразие теорий и гипотез о происхождении самородной серы — результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Получение
Серу получают главным образом выплавкой самородной серы непосредственно в местах её залегания под землей. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш, предложил плавить серу под землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (113°C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Производители
Основными производителями серы в России являются предприятия ОАО Газпром: ООО Газпром добыча Астрахань и ООО Газпром добыча Оренбург, получающие ее как побочный продукт при очистке газа.
Физические свойства
Природный сросток кристаллов самородной серы
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов серы. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество желтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета. Формулу пластической серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде. Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде. Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Химические свойства
Горение серы
При комнатной температуре сера реагирует со фтором и хлором, проявляя восстановительные свойства:
S + 3F2 = SF6
S + Cl2 = SCl2
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании, окисляясь:
S + 6HNO3(конц.) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(конц.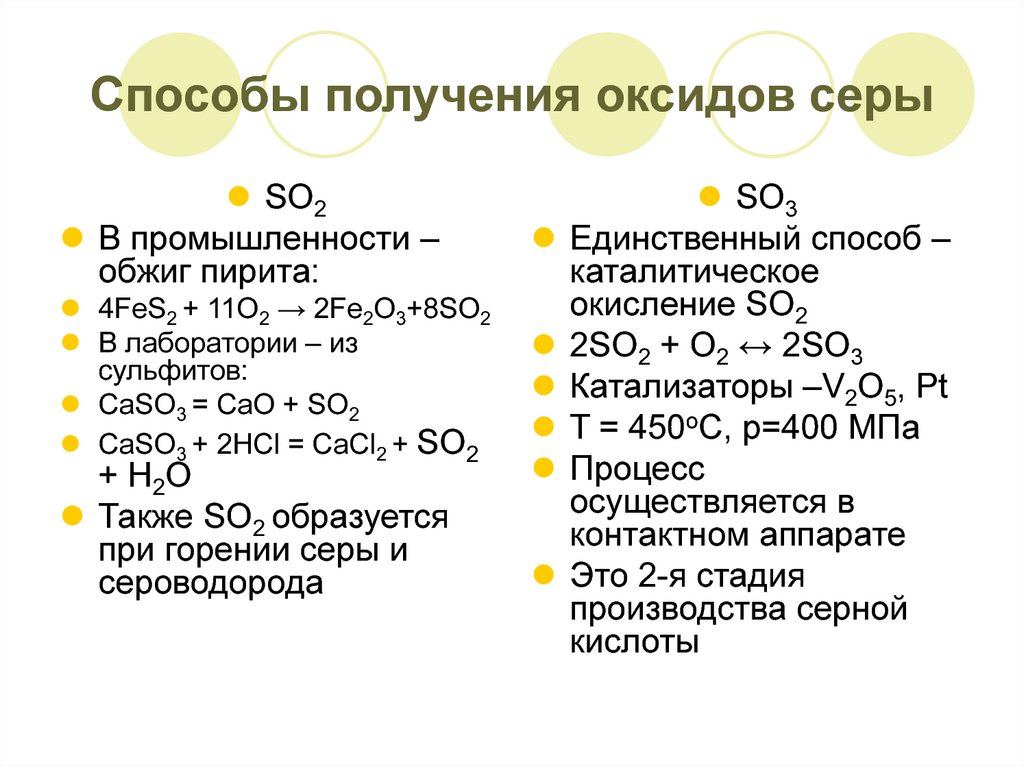 ) = 3SO2 ↑ + 2H2O
) = 3SO2 ↑ + 2H2O
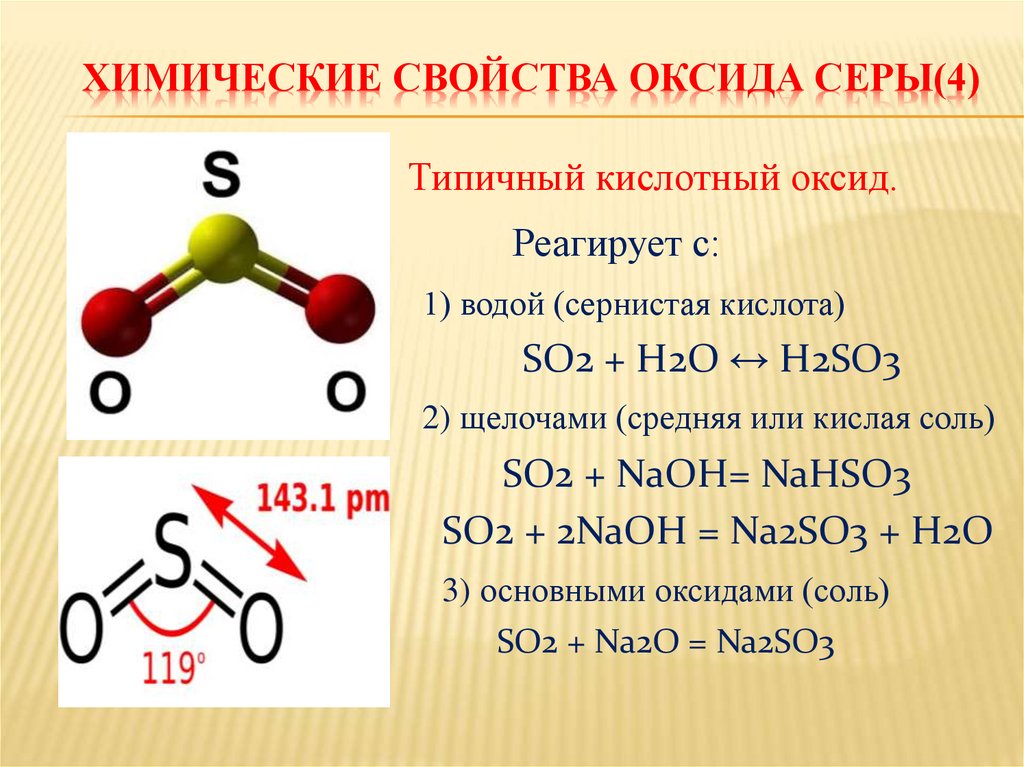
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
S + O2 = SO2
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.
При взаимодействии с металлами образует сульфиды. 2Na + S = Na2S
При добавлении к этим сульфидам серы образуются полисульфиды: Na2S + S = Na2S2
При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом:
C + 2S = CS2 (сероуглерод)
Сера при нагревании растворяется в щёлочах — реакция диспропорционирования
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Пожароопасные свойства серы
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углем, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распыленная вода, воздушно-механическая пена.
Обнаружение горения серы является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Горение происходит при низкой температуре. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространенными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Так как воздух по объему состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объема кислорода получается один объем SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха и объемное содержание SO2 в газовой смеси меньше теоретически возможного составляя обычно 14…15 %.
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см. Температура пламени при горении серы составляет 1820 °C
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет Вест Западной Капской провинции Южно-Африканской Республики произошел крупный пожар, погибли два человека.
16 января 2006 г. около пяти вечера на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250-ти квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет.
15 марта 2007 рано утром на ООО «Балаковский завод волоконных материалов» произошел пожар на закрытом складе серы. Площадь пожара составила 20 кв.м. На пожаре работало 4 пожарных расчета с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал.
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов.
В апреле 2008 недалеко от поселка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчетов и спасатели. В тот момент, когда пожарные оказались около склада, горела еще не вся сера, а только ее небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землей и залиты водой.
Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчетов и спасатели. В тот момент, когда пожарные оказались около склада, горела еще не вся сера, а только ее небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землей и залиты водой.
В июле 2009 в Днепродзержинске горела сера. Пожар произошел на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал.
Безопасна ли серная вода? | Обработка сернистой воды в вашем доме
Если вы заметили запах тухлых яиц в воде, вы, вероятно, задаетесь вопросом, в безопасности ли вы и ваша семья. Запах тухлых яиц является признаком того, что уровень серы в вашей воде может быть слишком высоким. Иногда странный запах указывает на наличие других загрязнений.
Понятно, если пить или купаться в дурно пахнущей воде не хочется, да и не нужно. Хорошая, чистая вода не имеет вкуса и запаха и не представляет опасности для вашего здоровья. Если ваша вода имеет неприятный запах или вкус тухлых яиц, мы здесь, чтобы помочь. В этом посте мы рассмотрим риски, связанные с сернистой водой, ответим на распространенные вопросы и покажем вам, как обрабатывать сернистую воду. У вас может быть чистая вода, которая не имеет неприятного запаха и не повреждает трубы в вашем доме, независимо от того, поступает ли ваша вода из колодца или из общественного источника.
Что такое сульфаты и сероводород?
Сульфаты естественным образом встречаются в горных породах и почве. С течением времени сульфаты со временем растворяются и попадают в подземные воды — источника колодезной воды. Сульфат не выделяет газа и поэтому не имеет запаха.
Газообразный сероводород также встречается в природе и может поступать из многих различных источников под землей, таких как гниющие растительные материалы или бактерии. Вы можете представить крошечные бактерии, питающиеся серой, а затем производящие сероводород в качестве отходов. Не очень приятно знать, что вонючая вода является продуктом жизнедеятельности бактерий.
Вы можете представить крошечные бактерии, питающиеся серой, а затем производящие сероводород в качестве отходов. Не очень приятно знать, что вонючая вода является продуктом жизнедеятельности бактерий.
Сероводород может также образовываться в результате бурения скважин в сланцах или водонагревателях, содержащих магниевые стержни. Независимо от причины, вы можете больше ощущать запах при использовании горячей воды, потому что нагретая вода высвобождает захваченный газ быстрее, чем холодная вода.
Опасна ли серная вода?
Многие спрашивают: «Может ли от серной воды заболеть?» Ответ на этот вопрос зависит от количества серы в воде. Хотя в большинстве бытовых источников воды нет опасного уровня серы, слишком высокий уровень может вызвать боль в желудке и тошноту. Точно так же высокий уровень сульфатов в питьевой воде может быть проблематичным, особенно для младенцев.
Во многих случаях самой большой проблемой с серной водой является ее вкус или запах. Большинство людей могут обнаружить сероводород в воде в небольшой концентрации 0,5 частей на миллион (млн-1). Вода с концентрацией серы от 0,5 до 1 ppm пахнет затхлостью, в то время как уровни выше 1 ppm вызывают запах тухлых яиц и вызывают коррозию металлических труб.
Большинство людей могут обнаружить сероводород в воде в небольшой концентрации 0,5 частей на миллион (млн-1). Вода с концентрацией серы от 0,5 до 1 ppm пахнет затхлостью, в то время как уровни выше 1 ppm вызывают запах тухлых яиц и вызывают коррозию металлических труб.
Диарея и обезвоживание: Питьевая вода с высоким содержанием сульфатов может оказывать слабительное действие и вызывать диарею, которая затем может вызвать обезвоживание.
Горький вкус: сульфаты могут вызывать горький вкус из-за отложений накипи в трубах.
Слизь, забивающая трубы: сульфаты могут привести к образованию слизи, которая забивает трубы или пачкает одежду.
Неэффективный отбеливатель: сульфаты могут снизить эффективность отбеливателя и затруднить надлежащую чистку одежды».
}
}]
}
Можно ли пить серную воду?
Если уровень серы в питьевой воде не слишком высок, это не должно привести к проблемам со здоровьем. Однако слишком большое количество сульфатов может привести к следующим проблемам:
- Диарея и обезвоживание: Питьевая вода с высоким содержанием сульфатов может иметь слабительный эффект и привести к диарее, которая затем может вызвать обезвоживание.

- Горький вкус: Сульфаты могут вызывать горький вкус из-за отложений накипи в трубах.
- Слизь, забивающая трубы: Сульфаты могут привести к образованию слизи, которая забивает трубы или пачкает одежду.
- Неэффективный отбеливатель: Сульфаты могут снизить эффективность отбеливателя и затруднить надлежащую чистку одежды.
Сероводород также не вызывает проблем со здоровьем в питьевой воде, если его уровень не слишком высок, но он может вызывать другие проблемы, такие как:
- Зловонный запах: воды и может сделать напитки и другие напитки неаппетитными.
- Плохой вкус: Сероводород может влиять на вкус напитков и пищи.
- Корродированный металл: Сероводород изнашивает такие металлы, как железо, сталь и медь. В результате сероводород может сократить срок службы труб и повлиять на водопроводную систему дома.

- Запятнанная сантехника: Сероводород может вызвать появление желтых или черных пятен на сантехнике в ванной или на кухне.
- Потускневшая посуда: Сероводород может вызвать появление черного потускнения на изделиях из серебра и окрасить медную или латунную посуду.
Полезна ли серная вода для волос и кожи?
Многие считают, что употребление серы или купание в серной воде полезно для кожи, волос и ногтей, но научных данных, подтверждающих пользу этого минерала для красоты, немного. Многие распространенные продукты, такие как яйца, рыба и птица, естественным образом содержат серу. Сбалансированная диета обеспечит всю необходимую серу, а потребление слишком большого количества серы может привести к желудочно-кишечным симптомам.
Как удалить серу из воды
Первым шагом к удалению сульфатов и сероводорода из воды является личное тестирование воды квалифицированным специалистом. Это позволит определить точную причину плохого вкуса и неприятного запаха воды. Убедитесь, что в вашей воде нет других загрязняющих веществ, о которых вы можете не знать, таких как бактерии. Иногда причиной запаха является загрязнение сточными водами, которые содержат вредные примеси, такие как колиформные бактерии и нитраты, поэтому очень важно проверить воду. Анализ воды также покажет вам, сколько серы содержится в вашей воде, чтобы вы могли предпринять правильные шаги для решения проблемы.
Убедитесь, что в вашей воде нет других загрязняющих веществ, о которых вы можете не знать, таких как бактерии. Иногда причиной запаха является загрязнение сточными водами, которые содержат вредные примеси, такие как колиформные бактерии и нитраты, поэтому очень важно проверить воду. Анализ воды также покажет вам, сколько серы содержится в вашей воде, чтобы вы могли предпринять правильные шаги для решения проблемы.
Даже если вас не беспокоит уровень содержания серы, все равно стоит проверить воду. Департамент по охране окружающей среды, Агентство по охране окружающей среды и Государственный университет Пенсильвании рекомендуют домовладельцам с частными колодцами ежегодно проверять воду на наличие бактерий.
Как только вы узнаете, что и сколько содержится в вашей воде, вы сможете предпринять необходимые шаги для удаления загрязняющих веществ. Наилучшая обработка зависит от уровня и формы сероводорода или сульфатов в вашей воде, а также от наличия других загрязнителей. Некоторые варианты очистки воды включают следующее:
- Аэрация : Метод удаления аэрации добавляет в воду воздух, что может снизить уровень сероводорода в воде.
 Этот метод требует установки системы аэрации для добавления воздуха в колодезную воду, прежде чем она попадет в дом.
Этот метод требует установки системы аэрации для добавления воздуха в колодезную воду, прежде чем она попадет в дом. - Neutra Sul: Neutra Sul (перекись водорода) нейтрализует запах тухлых яиц и загрязняющие вещества серы путем окисления. Neutra Sul имеет проверенную консистенцию и может использоваться для предотвращения образования цвета, привкуса, коррозии и образования накипи в результате разложения загрязнения. Стабилизатор в составе Neutral Sul обеспечивает в 5 раз больший срок годности по сравнению со стандартной перекисью водорода 7%. Pro Neutra Sul сертифицирован NSF на соответствие стандарту NSF/ANSI Standard 60 для добавок для питьевой воды.
- Фильтр для удаления железа : Вы можете использовать фильтр для удаления железа, который удалит умеренное количество сероводорода. Фильтр химически реагирует с сероводородом, превращая его в нерастворимую серу, которую затем можно удалить в процессе фильтрации.
- Хлорный отбеливатель: Хлорный отбеливатель может удалять сероводород путем взаимодействия с сероводородом и уничтожения запаха.
 Этот метод требует использования автоматического хлоратора для подачи хлора в систему водоснабжения. Затем система фильтрации удаляет серу и другой образовавшийся осадок.
Этот метод требует использования автоматического хлоратора для подачи хлора в систему водоснабжения. Затем система фильтрации удаляет серу и другой образовавшийся осадок.
Другие варианты включают установку системы очистки воды на раковине или установку нового колодца. Если запах тухлых яиц возникает из-за стержня в водонагревателе, вы можете решить проблему, заменив стержень из магния на стержень из алюминия или цинка.
Запишитесь на анализ воды на сероводород сегодня
Если вы чувствуете запах тухлых яиц в воде, мы рекомендуем обратиться к специалисту для проверки воды. Вы узнаете причину запаха и обнаружите любые другие потенциально вредные загрязнители в вашей воде. Специалист по водным ресурсам подскажет, какой метод обработки воды лучше всего подходит для вашей уникальной ситуации, чтобы вы могли спокойно пить воду дома.
Если вы живете в Аллентауне, штат Пенсильвания, и хотите, чтобы ваша вода была проверена профессионалами, которым вы можете доверять, обратитесь к нам в Long’s EcoWater Systems, Inc. Мы предоставим бесплатный анализ воды на дому и адаптировать решение для удовлетворения ваших потребностей. Чтобы начать свой путь к чистой и безопасной воде, запланируйте анализ воды сегодня!
Мы предоставим бесплатный анализ воды на дому и адаптировать решение для удовлетворения ваших потребностей. Чтобы начать свой путь к чистой и безопасной воде, запланируйте анализ воды сегодня!
Поделиться:
Все, что вам нужно знать о содержании серы в вашем водоснабжении —
Имея более чем 30-летний опыт работы в области очистки воды для жилых и коммерческих помещений, Марк Нельсон является оператором питьевой воды класса 1 и CBWA ( Канадская ассоциация бутилированной воды) Сертифицированный оператор завода. Как основатель и президент компании Nelson Water в Оттаве, Марк занимается проектированием сложных систем водоподготовки для проблемной воды. Он также возглавляет крупнейший завод по розливу воды в городе Оттава с сетью доставки по всей долине.
Сера является особенно неприятным загрязнителем в вашей воде, потому что она имеет ужасный вкус и запах, а когда вода неприятна на вкус, люди просто не пьют достаточно, чтобы избежать обезвоживания. Если у вас есть проблема с каким-либо типом загрязнения, первым делом необходимо установить масштаб проблемы, и тогда вы поймете, сколько вам нужно удалить. Это довольно легко, если у вас есть проблемы с железом или марганцем, потому что они представляют собой растворенные твердые вещества, которые легко измерить. Но сера — это растворенный газ, и его тестирование сложно и дорого. Давайте подробнее рассмотрим серу, чтобы лучше понять проблему и предложить решение, как удалить ее из воды.
Это довольно легко, если у вас есть проблемы с железом или марганцем, потому что они представляют собой растворенные твердые вещества, которые легко измерить. Но сера — это растворенный газ, и его тестирование сложно и дорого. Давайте подробнее рассмотрим серу, чтобы лучше понять проблему и предложить решение, как удалить ее из воды.
Почему в вашем водоснабжении содержится сера?
Присутствие серы в вашей воде вызвано газообразным водородом и серой, и она может попасть в вашу воду тремя основными путями.
Сульфаредуцирующие бактерии могут превращать соединения в вашей воде в сероводородный газ.
Вода прошла через камни и почву, содержащую определенный уровень разложения серы, и этот материал просочился в систему водоснабжения и растворился.
В водонагревателе образуется сероводород.
В чем проблема с серой?
Маловероятно, что в пище, которую вы едите, содержится большое количество серы. Но у вас может быть высокая концентрация серы в воде, которую вы пьете и используете для приготовления пищи. Основная претензия к сере — запах тухлых яиц, который сделает любую воду неприятной для большинства пользователей. Если вы каким-то образом можете игнорировать запах серы и пили серную воду или ели пищу, приготовленную в ней, вредного воздействия на здоровье, такого как спазмы желудка, диарея и обезвоживание, немного. Эти проблемы со здоровьем вряд ли причинят большой вред здоровому взрослому, но они могут представлять более серьезный риск для здоровья уязвимых групп, таких как младенцы, маленькие дети и пожилые люди. Со временем ваше тело, возможно, даже сможет приспособиться к повышенному уровню серы, но многие люди не готовы зайти так далеко и бороться с этими последствиями для здоровья в течение любого периода времени.
Но у вас может быть высокая концентрация серы в воде, которую вы пьете и используете для приготовления пищи. Основная претензия к сере — запах тухлых яиц, который сделает любую воду неприятной для большинства пользователей. Если вы каким-то образом можете игнорировать запах серы и пили серную воду или ели пищу, приготовленную в ней, вредного воздействия на здоровье, такого как спазмы желудка, диарея и обезвоживание, немного. Эти проблемы со здоровьем вряд ли причинят большой вред здоровому взрослому, но они могут представлять более серьезный риск для здоровья уязвимых групп, таких как младенцы, маленькие дети и пожилые люди. Со временем ваше тело, возможно, даже сможет приспособиться к повышенному уровню серы, но многие люди не готовы зайти так далеко и бороться с этими последствиями для здоровья в течение любого периода времени.
Есть ли польза от употребления серы?
Многие из продуктов, которые вы потребляете ежедневно, уже могут содержать небольшое количество серы. На самом деле, сера очень полезна как часть вашего повседневного питания, и она может помочь различными способами, такими как улучшение кожи, придание объема и блеска вашим волосам и помощь в создании соединительной ткани в вашем теле. Но когда вы потребляете серу в больших количествах, эти преимущества не увеличиваются, больше серы не означает улучшение состояния волос и кожи. На самом деле, как мы уже видели, большое количество серы может вызвать проблемы со здоровьем, и вам нужно лишь небольшое количество серы каждый день, чтобы удовлетворить ваши ежедневные потребности в питании.
На самом деле, сера очень полезна как часть вашего повседневного питания, и она может помочь различными способами, такими как улучшение кожи, придание объема и блеска вашим волосам и помощь в создании соединительной ткани в вашем теле. Но когда вы потребляете серу в больших количествах, эти преимущества не увеличиваются, больше серы не означает улучшение состояния волос и кожи. На самом деле, как мы уже видели, большое количество серы может вызвать проблемы со здоровьем, и вам нужно лишь небольшое количество серы каждый день, чтобы удовлетворить ваши ежедневные потребности в питании.
Как насчет использования сернистой воды другими способами?
Итак, пить серную воду или есть приготовленную в ней пищу не лучшая идея, но как насчет других домашних дел. Купание и душ в серной воде не опасны, но большинство людей не смогут долго выносить запах «тухлых яиц». После того, как вы закончили омовение, вы можете обнаружить, что чувствуете себя не очень чистым, а неприятный запах может даже остаться на вашей коже и волосах. Если вы будете стирать одежду в серной воде, то можете заметить, что на одежде появятся бледно-желтые пятна, и она будет выглядеть не очень чистой.
Если вы будете стирать одежду в серной воде, то можете заметить, что на одежде появятся бледно-желтые пятна, и она будет выглядеть не очень чистой.
3 простых теста на серу
Как мы упоминали выше, тестирование на серу может быть дорогостоящим, поэтому мы составили краткий список из трех простых тестов, которые вы можете провести дома, чтобы установить наличие проблемы. Это не замена анализу воды, но, по крайней мере, вы не будете тратить деньги на анализ воды на содержание серы, когда проблем не возникнет. Вместо этого вы будете устанавливать масштаб проблемы, потому что вы уже знаете, что у вас действительно есть более высокие концентрации серы в вашей воде.
Когда вы открываете входную дверь, вы сразу чувствуете характерный запах серы? Если ответ положительный, то у вас чрезвычайно высокая концентрация серы в вашей воде.
Если вы не чувствуете присутствия серы у входной двери, идите на кухню и откройте кран с холодной водой в раковине не менее чем на 3 минуты. Чувствуете запах серы в кухонной раковине? Если ответ «да», вероятно, у вас умеренный уровень загрязнения серы в вашей воде.
Чувствуете запах серы в кухонной раковине? Если ответ «да», вероятно, у вас умеренный уровень загрязнения серы в вашей воде.
Если вы не чувствуете запаха серы после выполнения шага 3, наклонитесь к раковине и снова попытайтесь обнаружить присутствие серы, можете ли вы ее почувствовать? Если ответ да, то у вас низкая концентрация серы в вашей воде.
Опять же, это грубый и готовый тест, но он даст вам представление о масштабах вашей проблемы с серой, а затем вы сможете провести дополнительные анализы воды, если это необходимо для подтверждения этих результатов.
Как избавиться от серы в воде?
Откуда бы вы ни брали воду, маловероятно, что вы сможете поменять воду в источнике. Единственный способ удалить серу — это установить в собственном доме дополнительную систему фильтрации воды. Наиболее популярным способом удаления серы в высоких концентрациях является использование системы фильтрации серы с окислением. Но очень важно получить фильтр для воды с содержанием серы, соответствующий масштабу проблемы, и чтобы устройство могло обеспечить необходимый вам объем воды.


 c.
c. Вещество может оказать воздействие на дыхательные пути. Может привести к хроническому бронхиту.
Вещество может оказать воздействие на дыхательные пути. Может привести к хроническому бронхиту.


 Этот метод требует установки системы аэрации для добавления воздуха в колодезную воду, прежде чем она попадет в дом.
Этот метод требует установки системы аэрации для добавления воздуха в колодезную воду, прежде чем она попадет в дом. Этот метод требует использования автоматического хлоратора для подачи хлора в систему водоснабжения. Затем система фильтрации удаляет серу и другой образовавшийся осадок.
Этот метод требует использования автоматического хлоратора для подачи хлора в систему водоснабжения. Затем система фильтрации удаляет серу и другой образовавшийся осадок.