Свойства воды как растворителя. Растворитель воды
Вода как растворитель | АКВАРИУМНЫЕ РЫБКИ
Если аквариумисты говорят о воде, то они совершенно не думают о h3O, а думают о предназначенной для рыб среде. Однако эта среда значительно отличается от чистой воды, которая производится в лаборатории с помощью дорогостоящей неоднократной дистилляции (перегонки). Дождевые воды уже не являются «Aqua dest». Каждый из нас знает о вызванных «кислотными дождями» проблемах. При движении по воздуху вода уже накапливает чужеродные вещества. Этот процесс усугубляется, когда дождевая капля касается земли. Теперь вода реагирует с твердой средой.
Химически связанная молекула воды, как свидетельствует изложенное выше, имеет положительные полюса. Если это так, то грунт аквариума обязательно является предметом взаимодействия с водой.
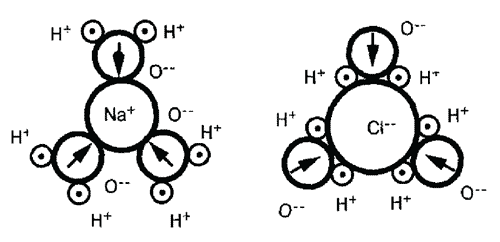
Поваренная соль (NaCl) растворяется в воде, вследствие чего диссоциирует на ион натрия и ион хлора. Заряженные ионы окружаются молекулами воды, которые ориентируются соответствующим образом.
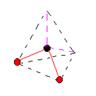
Представим себе, что дождевая капля падает через очень чистый воздух. Она практически не загрязнена воздухом и чиста почти как дистиллированная вода. Едва она попадает в землю, сразу же встречает молекулу поваренной соли. Полярность воды так сильна, что она в состоянии разделить оба атома в соединении поваренной соли. Это происходит вследствие того, что молекулы воды со стороны отрицательного кислорода группируются вокруг атома натрия, а со стороны положительного водорода – вокруг атома хлора. Атомы, растворенные в воде таким образом, называются ионами. Рисунок показывает, что происходит с положительно заряженными ионами, как например, Na+. Эти ионы называются катионами. Отрицательно заряженные ионы, такие, как Cl , называются анионами.
Попадая на землю, вода преимущественно растворяет вещества в виде солей. Вещества, содержащиеся в воде, уже не являются первоначальными солями. Поэтому будем приводить в анализах воды всегда только электролиты, т.е. катионы или анионы. В воде всегда существует баланс катионов и анионов. Для биологических процессов наряду с веществами, в основном содержащимися в воде, большое значение имеют так же сопутствующие вещества и микроэлементы. В таблице на стр. 23 представлен состав воды в естественном водоеме.
Содержание солей в проточной воде
| Истинный раствор | Коллоидный раствор | Суспензия | ||||
| Вид и количество | Электролиты | Неэлектролиты | ||||
| Катионы | Анионы | Газы | Твердые вещества | |||
| Основные вещества> 10 мг/л | Na+Ka+Mg++Ca2+ | Cl–NO3–HCO3–SO4– | O2N2CO2 | SiO2* x h3O | Глины, желтые пески, органические вещества | |
| Сопутствующие вещества<<10 мг/л>0,1 мг/л | Sr+Fe++Mn2+Nh5 | F–Br–I–HPO4–HBO2 | h3SNh4Ch5He | Органические соединения, продукты обмена веществ | Гидроокиси Fe, Mn, кремниевая кислота, силикаты и гуминовые вещества | Гидроокиси Fe, Mn, масла, жиры и иные органические вещества |
| Микроэлементы< 0,1 мг/л | Li+Rb+Ba2+As(lll)Cu2+Zn2+Pb2+ | HS– | Rn | |||
ИНТЕРЕСНЫЕ СТАТЬИ:
 Февраль 16, 2017 Ремонт аквариумов своими руками в домашних условиях
Февраль 16, 2017 Ремонт аквариумов своими руками в домашних условиях Февраль 8, 2017 Таймер для аквариума — описание фото видео обзор
Февраль 8, 2017 Таймер для аквариума — описание фото видео обзор Февраль 16, 2017 Аквариум Амано Такаши — удивительный подводный мир
Февраль 16, 2017 Аквариум Амано Такаши — удивительный подводный мир Февраль 16, 2017 Жесткость воды в аквариуме
Февраль 16, 2017 Жесткость воды в аквариуме Февраль 13, 2017 Температура воды в аквариуме для рыбок
Февраль 13, 2017 Температура воды в аквариуме для рыбок Февраль 16, 2017 Голландский аквариум — описание фото видео
Февраль 16, 2017 Голландский аквариум — описание фото видео Февраль 13, 2017 Карантин аквариумных рыбок — описание
Февраль 13, 2017 Карантин аквариумных рыбок — описание Февраль 9, 2017 Чешутся рыбы в аквариуме что делать — описание
Февраль 9, 2017 Чешутся рыбы в аквариуме что делать — описание Февраль 8, 2017 Кондиционер для воды в аквариуме как пользоваться — описание фото
Февраль 8, 2017 Кондиционер для воды в аквариуме как пользоваться — описание фото Февраль 18, 2017 Основные ошибки начинающих аквариумистов
Февраль 18, 2017 Основные ошибки начинающих аквариумистов
aquarium-fish-home.ru
Вода как растворитель
Химия  Вода как растворитель
Вода как растворитель
просмотров - 229
Энергия образования молекул воды высока, она составляет 242 кДж/моль. Этим объясняется устойчивость воды в природных условиях. Устойчивость в сочетании с электрическими характеристиками и молекулярным строением делают воду практически универсальным растворителем для многих веществ. Высокая диэлектрическая проницаемость обусловливает самую большую растворяющую способность воды по отношению к веществам, молекулы которых полярны. Из неорганических веществ в воде растворимы очень многие соли, кислоты и основания. Из органических веществ растворимы лишь те, в молекулах которых полярные группы составляют значительную часть – многие спирты, амины, органические кислоты, сахара и т.д.
Растворение веществ в воде сопровождается образованием слабых связей между их молекулами или ионами и молекулами воды. Это явление принято называть гидратацией. Для веществ с ионной структурой характерно формирование гидратных оболочек вокруг катионов за счет донорно-акцепторной связи с неподеленной парой электронов атома кислорода. Катионы гидратированы тем в большей степени, чем меньше их радиус и выше заряд. Анионы, обычно менее гидратированные, чем катионы, присоединяют молекулы воды водородными связями.
В процессе растворения веществ изменяется величина электрического момента диполя молекул воды, изменяется их пространственная ориентация, разрываются одни и образуются другие водородные связи. В совокупности эти явления приводят к перестройке внутренней структуры.
Растворимость твердых веществ в воде зависит от природы этих веществ и температуры и изменяется в широких пределах. Повышение температуры в большинстве случаев увеличивает растворимость солей. При этом растворимость таких соединений, как CaSО4·2h3О, Ca(OH)2, при повышении температуры снижается.
При взаимном растворении жидкостей, одной из которых является вода, возможны различные случаи. К примеру, спирт и вода смешиваются друг с другом в любых соотношениях, так как оба полярны. Бензин (неполярная жидкость) в воде практически нерастворим. Наиболее общим является случай ограниченной взаимной растворимости. Примером могут служить системы вода–эфир, вода–фенол. При нагревании взаимная растворимость для одних жидкостей возрастает, для других – уменьшается. К примеру, для системы вода–фенол повышение температуры выше 68 °С приводит к неограниченной взаимной растворимости.
Газы (к примеру, Nh4, СО2, SО2) хорошо растворимы в воде, как правило, в тех случаях, когда они вступают с водой в химическое взаимодействие; обычно же растворимость газов невелика. При повышении температуры растворимость газов в воде уменьшается.
Следует отметить, что растворимость кислорода в воде почти в 2 раза выше, чем растворимость азота. Вследствие этого состав растворенного в воде водоемов или очистных сооружений воздуха отличается от атмосферного. Растворенный воздух обогащен кислородом, что очень важно для организмов, обитающих в водной среде.
Для водных растворов, как и для любых других, характерны понижение температуры замерзания и повышение температуры кипения. Одно из общих свойств растворов проявляется в явлении осмоса. В случае если два раствора разной концентрации разделены полупроницаемой перегородкой, молекулы растворителя проникают через нее из разбавленного раствора в концентрированный. Механизм осмоса можно понять, если учесть, что, согласно общему естественному принципу, все молекулярные системы стремятся к состоянию наиболее равномерного распределения (в случае двух растворов — стремление к выравниванию концентраций по обе стороны перегородки).
Читайте также
Благодаря полярности молекул воды она растворяет многие вещества лучше других жидкостей. Растворение кристаллов неорганических солей осуществляется благодаря гидратации входящих в их состав ионов. Хорошо растворяются в воде органические вещества с карбоксильными,... [читать подробенее]
Энергия образования молекул воды высока, она составляет 242 кДж/моль. Этим объясняется устойчивость воды в природных условиях. Устойчивость в сочетании с электрическими характеристиками и молекулярным строением делают воду практически универсальным растворителем... [читать подробенее]
oplib.ru
Свойства воды как растворителя
вода – растворитель, самый распространенный в природе
свойства воды как растворителя:
- высокая диэлектрическая проницаемость - вода активно растворяет вещества с полярными молекулами
- образование водородных связей между частицами в-ва и молекулами воды
- низкая вязкость воды
свойства воды как растворителя определяются строением молекул воды
строение молекулы воды
 формула молекулы воды h3O
формула молекулы воды h3O
H -
\
О(II)-2 хим.связь одинарная полярная ковалентная, Ð105°
 / молекула имеет угловую форму _ -
/ молекула имеет угловую форму _ -
H+ -
молекула в виде диполя: 2 неподеленные е-пары атома кислорода образуют (-)полюс +
2 катиона водорода образуют (+)полюс +
диполи воды активно растворяют вещества с полярными молекулами:
полярные - молекулы неорганических веществ, имеющие или ионные связи, или полярные ковалентные связи
полярные - молекулы органических веществ, имеющие полярные функциональные группы
полярные молекулы имеют свойства диполей
электрический диполь - два точечных заряда, одинаковые по величине и противоположные по знаку,
находящиеся на расстоянии l друг от друга, которое называется плечом диполя
Р = q × l - электрический момент диполя
различают молекулы с постоянной полярностью – жесткие диполи, и
молекулы с непостоянной полярностью – индуцированные диполи
диполи воды вызывают электролитическую диссоциацию растворяемых в-в или распад в-в на ионы:
растворяемые в-ва должны иметь ионные или полярные ковалентные связи
вокруг частиц растворяемого в-ва диполи воды образуют гидратные оболочки
 гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва
гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва
ПР: HCl полярная ковалентная связь
в-во находится в растворенном виде,
в электрическом поле диполя H+Сl- диполи Н2О располагаются упорядоченно,
взаимодействие диполей Н+Cl- и упорядоченно расположенных диполей Н2О поляризует связь Н+-Cl- до ионной
взаимодействие диполей Н+-Сl- и упорядоченно расположенных диполей Н2О ослабляет связи Н+-Cl-,
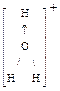 образуются ионы Cl-_и Н+ (свободно не существуют)
образуются ионы Cl-_и Н+ (свободно не существуют)
физическая фаза ®химическая фаза:
в электрическом поле ионов Н+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Сl- и ионы гидроксония Н3О+ (донорно-акцепторная связь)

NaCl ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и Cl- и диполей Н2О ослабляет связи Na+-Cl-,
образуются ионы Na+ и Cl- (одновременно идет растворение и диссоциация)
физическая фаза ®химическая фаза:
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и Сl-

NaОН ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и ОН- и диполей Н2О ослабляет связи Na+-ОН-,
образуются ионы Na+ и ОН- (одновременно идет растворение и диссоциация)
физическая фаза ®химическая фаза:
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и гидроксид-ионы ОН-
гидрофильное и гидрофобное взаимодействие веществ с водой
вещества по растворимости в воде делятся на гидрофильные и гидрофобные
- гидрофильные хорошо растворяются в воде
состоят из ионов и полярных молекул или молекул с полярными функциональными группами
варианты гидрофильного взаимодействия – ионно-дипольное ПР: растворение NaCl
диполь-дипольное ПР: растворение HCl
образование водородных связей ПР: растворение С2Н5ОН
- гидрофобные плохо растворяются в воде
состоят из неполярных молекул
гидрофобное взаимодействие – «отталкивание» молекул воды от молекулы в-ва
- дифильные, у которых молекулы имеют и гидрофильные, и гидрофобные группы
дифильные молекулы при растворении в воде деформируются так,
чтобы контакт с водой гидрофобных групп уменьшился, а контакт с водой гидрофильных групп увеличился
ПР: в воде белковые молекулы приобретают форму глобул
внутри глобул гидрофобные группы, снаружи глобул гидрофильные группы
влияние на растворимость природы компонентов, температуры и давления
факторы, влияющие на растворимость в-в:
- природа растворителя
одно в-во в разных растворителях растворяется по-разному
289) природа в-ва.полярные растворители и неполярные растворители.
различают полярные растворители и неполярные растворители
ПР: вода, спирт – полярные растворители
у полярных растворителей полярные молекулы
полярные растворители сильно поляризуются и имеют высокую диэлектрическую проницаемость e
в полярных растворителях хорошо растворяются в-ва ионной структуры с ионными связями и
молекулярной структуры с полярными ковалентными связями
в неполярных растворителях хорошо растворяются в-ва молекулярной структуры с неполярными ковалентными..
- природа в-ва
в одном растворителе разные в-ва растворяются по-разному
некоторые в-ва имеют низкую растворимость
ПР: твердые в-ва с прочной атомной кристаллической решеткой практически нерастворимы
в-ва с ионной и полярной ковалентной связью хорошо растворяются в полярных растворителях
в-ва с неполярной ковалентной связью плохо растворяются в полярных растворителях
ПР:
одна из причин высокой растворимости в-в – образование связей между частицами в-ва и растворителя
ПР: при растворении спирта в воде образуются водородные связи между молекулами воды и спирта
ПР: при растворении AgCl в водном растворе Nh4 образуются комплексы [Ag(Nh4)4]+
- температура и давление, присутствие в растворе других в-в..
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
внешние факторы – температура, давление, присутствие других в-в..
график зависимости растворимости от температуры – кривая растворимости..
растворимость твердых в-в в жидкостях
факторы, влияющие на растворимость твердых в-в в жидкостях:
- природа растворителя..
- природа твердого в-ва..
- температура и давление
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
если растворение эндотермический процесс –
при нагревании растворимость твердых в-в в жидкостях увеличивается
если растворение экзотермический процесс –
при нагревании растворимость твердых в-в в жидкостях уменьшается
объем системы при растворении твердых тел в жидкостях не меняется –
повышение давления не влияет на растворимость твердых в-в в жидкостях
- присутствие в растворе других в-в..
studopedya.ru