Содержание
Как происходит процесс разложения воды электрическим током
Чистая, дистиллированная вода почти совершенно не проводит электрического тока.
Она обладает огромным сопротивлением. Например, сопротивление кубического сантиметра дважды перегнанной воды равно сопротивлению медной проволоки сечением в квадратный миллиметр, длина которой равна примерно 200 тысячам километров. Таким количеством проволоки можно больше чем 20 раз соединить между собой Москву и Владивосток. Для электролиза дистиллированная вода не годится. Нужна такая вода, которая бы хорошо проводила электрический ток, то есть была бы электропроводной.
Чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Большинство химических соединений, растворяясь в воде, распадаются на части, которые приобретают при этом тот или иной заряд. Образующиеся заряженные частицы называются ионами, а разложение вещества на ионы — электролитической диссоциацией.
Обыкновенная поваренная соль (NaCl) при растворении в воде распадается на ион натрия (Na+), заряженный положительно, и ион хлора (Сl—), заряженный отрицательно. Ионы натрия и хлора, имеющие только по одному заряду, называются одновалентными ионами. Ионы, которые имеют два или три заряда, называются двух- или трехвалентными. В качестве примера двухвалентного иона можно привести ион кальция (Са). Хлористый кальций (СаСl2), диссоциируя на ионы, дает два одновалентных отрицательных иона хлора (2Сl) и один двухвалентный ион кальция (Са), заряженный положительно. Треххлористое железо (FeCl3) при диссоциации на ионы дает три одновалентных отрицательных иона хлора (3Сl—) и один трехвалентный положительный ион железа (Fe+++).
Итак, при электролитической диссоциации соли образуются отрицательно заряженные ионы, которые называются анионами, и положительно заряженные ионы — катионы.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток. Серная кислота (H2SO4) распадается на два положительно заряженных иона водорода (2Н+) и кислотный остаток — анион (SO4—), обладающий двумя отрицательными зарядами.
Серная кислота (H2SO4) распадается на два положительно заряженных иона водорода (2Н+) и кислотный остаток — анион (SO4—), обладающий двумя отрицательными зарядами.
Щелочи при диссоциации образуют положительный ион металла и отрицательный ион гидроксила. Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две металлические пластинки и подключить к ним постоянный ток от аккумулятора, то положительные ионы — катионы — сразу же начнут передвигаться к отрицательному электроду, который называется катодом, а отрицательные ионы — анионы — направятся к положительному полюсу — аноду. Находящиеся у электрода анионы отдадут ему свои отрицательные заряды — электроны (е) — и разрядятся. В то же самое время разрядятся и катионы, получив электроны от своего электрода. Их места тут же занимают новые ионы, и через раствор начинает проходить электрический ток.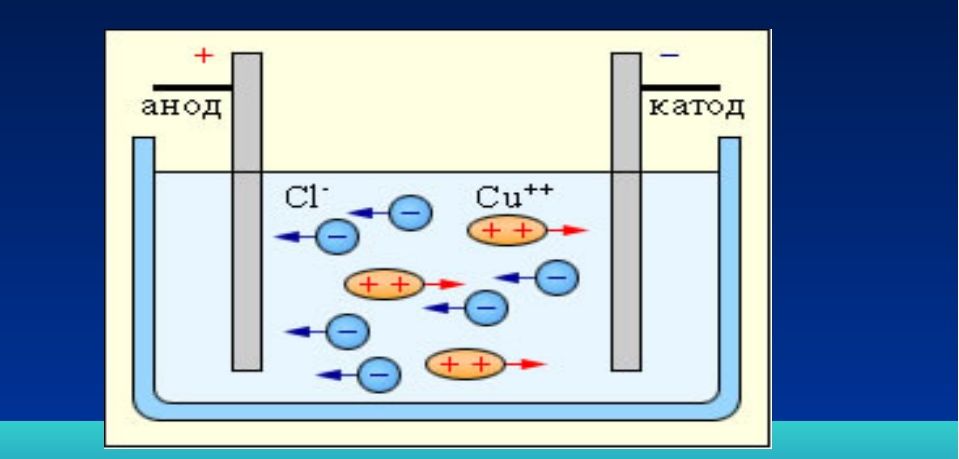 Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чтобы получить много ионов, недостаточно растворить много вещества. Необходимо, чтобы взятая соль, кислота или основание хорошо распадались на ионы, то есть хорошо диссоциировали. Имеются такие химические соединения, которые диссоциируют очень хорошо, и почти все молекулы растворенного вещества распадаются на ионы. Но есть и такие, которые диссоциируют плохо: только очень незначительная часть всех растворенных молекул распадается на ионы, а остальные остаются в виде недиссоциированных молекул.
Отношение числа распавшихся молекул к общему числу растворенных молекул называется степенью диссоциации. Чем меньше степень диссоциации, тем хуже электропроводность раствора.
К соединениям, обладающим плохой электропроводностью, относится дистиллированная вода. Подсчитано, что из 10 миллионов молекул воды на ионы распадается только одна молекула, образуя один положительно заряженный ион водорода (Н+) и один отрицательно заряженный ион гидроксила (ОН—). Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
Прохождение электрического тока через раствор: 1 — катод; 2 — анод; 3 — положительно заряженные ионы — катионы; 4 — отрицательно заряженные ионы — анионы.
Нам уже известно, что кислота в воде диссоциирует на ионы водорода и кислотный остаток, а щелочь — на ионы металла и ионы гидроксила. Естественно было бы ожидать, что в растворе, подкисленном серной кислотой, на катоде будут разряжаться ионы водорода, а на аноде — ионы SO4—. Ионы водорода, разрядившись, перейдут в атомы, которые, соединяясь попарно, дадут молекулу водорода, а ионы SO4—, отдав свой заряд электроду, перейдут в раствор в виде незаряженного кислотного остатка — радикала SO4. Соединяясь с водой, этот радикал образует серную кислоту и кислород.
Можно было бы ожидать, что в щелочных растворах ионы натрия (Na + (e) → Na) разрядятся на катоде, переходя в атомы натрия, которые, соединяясь с водой, дадут щелочь и водород (2Na + 2H2O → 2NaOH + H2). На аноде ионы гидроксила, потеряв свои электроны, соединятся попарно, образуя из радикалов воду, освобождая кислород (4OH— — 4(e) → 2H2O + O2).
Однако в действительности в кислых и щелочных растворах процесс образования кислорода и водорода происходит иначе.
Несмотря на то, что в щелочных растворах имеется очень много ионов натрия и мало ионов водорода, на катоде в первую очередь разряжаются ионы водорода.
В растворах, подкисленных серной кислотой, на аноде прежде всего разряжаются ионы гидроксила, полученные за счет диссоциации воды, а не ионы SO4—, которых неизмеримо больше. Это объясняется тем, что разряд ионов водорода или гидроксила происходит легче, чем ионов натрия или SO4—. Поэтому в щелочных растворах, которые обычно применяются для электролиза воды, на катоде разряжаются главным образом ионы водорода, а на аноде — ионы гидроксила. Как только эти ионы разрядятся, немедленно образуются новые ионы за счет диссоциации молекул воды.
Поэтому в щелочных растворах, которые обычно применяются для электролиза воды, на катоде разряжаются главным образом ионы водорода, а на аноде — ионы гидроксила. Как только эти ионы разрядятся, немедленно образуются новые ионы за счет диссоциации молекул воды.
Таким образом, при электролитическом получении кислорода и водорода расходуется только вода. Литр воды дает примерно 1360 литров водорода и 680 литров кислорода.
Электролиз воды: 1 — банка с электролитом; 2 — катод, на котором выделяется водород; 3 — анод, на котором выделяется кислород; 4 — трубка для отвода газов; 5 — чашечка с водой.
Под руководством учителя и соблюдая меры предосторожности, можно сделать опыт, показывающий, как разлагается вода.
Возьмите банку с широким горлом и наполните ее на две трети 20-процентным водным раствором щелочи. Плотно закройте банку пробкой, в которую вставлены две никелевые проволочки с небольшими пластинками на концах — электродами. В середину пробки вставьте коротким концом загнутую стеклянную трубку, через которую будут выходить газы.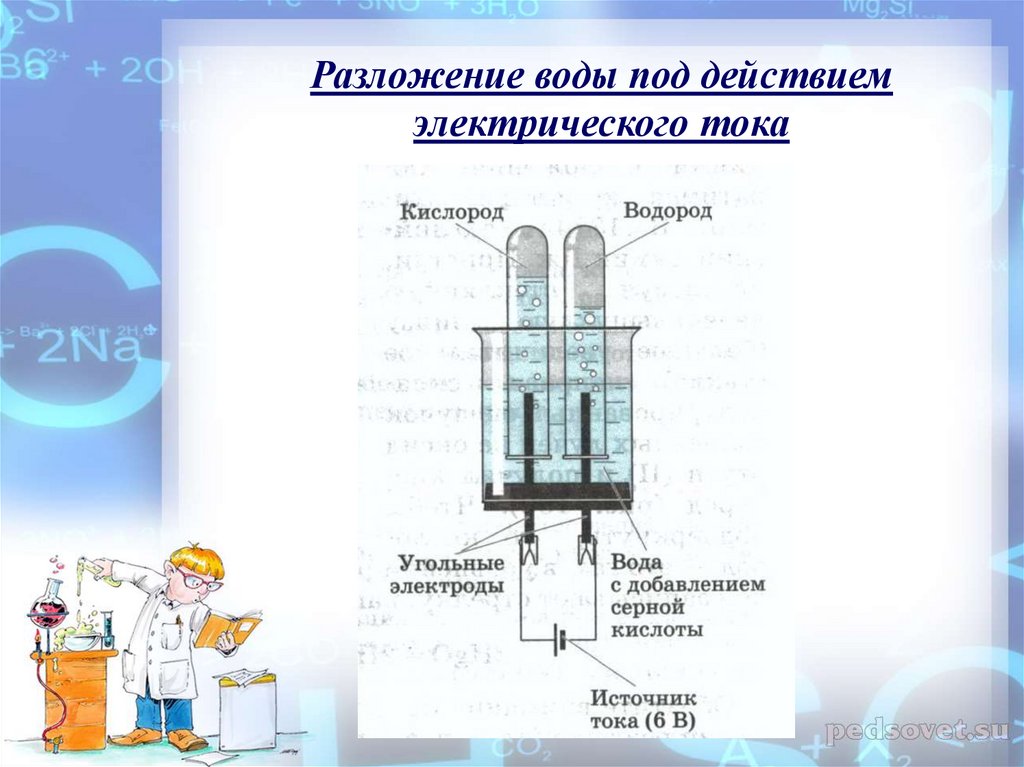 Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Вспомним свойство этой смеси газов. Если ее поджечь, она легко взрывается.
Поэтому подходить с огнем к банке опасно.
Чтобы убедиться, что в банке образовались кислород и водород, пропустите сначала немного газа через чашечку с чистой водой, а затем поставьте вместо нее чашечку с мыльной водой.
Образуются мыльные пузыри, наполненные гремучим газом. Раздастся легкий взрыв.
В пузыре была гремучая смесь — смесь одного объема кислорода с двумя объемами водорода.
Мы пока только разложили воду, но не разделили образовавшиеся газы и не получили кислорода.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Ленинград. Москва. 1953
Расщепление воды с эффективностью 100%: полдела сделано / Хабр
alizar
Научно-популярное Энергия и элементы питания Нанотехнологии Химия
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Теги:
- вода
- электролиз
- восстановление
- водородное топливо
- солнечная энергия
- фотолиз
Хабы:
- Научно-популярное
- Энергия и элементы питания
- Нанотехнологии
- Химия
Всего голосов 26: ↑23 и ↓3 +20
Просмотры
69K
Комментарии
75
Анатолий Ализар
@alizar
автор, фрилансер
Telegram
Комментарии
Комментарии 75
Разложение и осаждение – Управление растениями в водах Флориды
Проще говоря, разложение – это расщепление материи на ее основные компоненты. Когда речь идет об экологических процессах, это включает расщепление мертвого органического растительного материала (листьев, стеблей и т. д.) микроорганизмами. Когда растительный материал разлагается и опускается на дно водоема, он оставляет после себя слой осадка или грязи — процесс, называемый осаждением.
д.) микроорганизмами. Когда растительный материал разлагается и опускается на дно водоема, он оставляет после себя слой осадка или грязи — процесс, называемый осаждением.
Со временем из-за накопления отложений на дне озеро становится мелеющим. В конце концов, он может превратиться в болото, или даже луг, или лес.
Органические вещества производятся:
- растений
- водоросли
- частиц в дожде
- сток поверхностных вод
- эрозия береговой линии
- наполнитель для листьев
- экскременты птиц
- бытовые и промышленные сточные воды, навоз
В дополнение к органическим веществам в водоеме, эти материалы добавляют питательные вещества в виде азота и фосфора. Избыток питательных веществ способствует большему росту растений и водорослей. Когда эти дополнительные растения сбрасывают листья и стебли или умирают и разлагаются, на дно озера добавляется больше осадка.
По мере того, как озеро становится мелеющим, надводные растения, растущие вдоль береговой линии, могут расти ближе к центру озера, создавая болотоподобный водоем. Поскольку эти растения в конечном итоге умирают и разлагаются, они создают больше отложений и делают водоем более мелким, и деревья могут начать расти. Болото теперь может существовать там, где когда-то было озеро.
Поскольку эти растения в конечном итоге умирают и разлагаются, они создают больше отложений и делают водоем более мелким, и деревья могут начать расти. Болото теперь может существовать там, где когда-то было озеро.
Эти процессы способствуют естественному старению или обогащению озера питательными веществами: эвтрофикации. Без добавления питательных веществ в результате деятельности человека (например, ливневых и сельскохозяйственных стоков) или инвазивных инвазий водных растений эвтрофикация является медленным явлением, которое способствует превращению озера в болото или болото в течение сотен или тысяч лет. Типичные скорости осаждения колеблются от 1 до 10 миллиметров в год. Это соответствует скорости 3 фута за 1000 лет и более.
Управление водными растениями и озерные процессы
Рост и размножение инвазивных водных растений ускоряет процессы разложения и осаждения, поскольку все больше растений выделяют органический материал или умирают. Когда руководители заводов обрабатывают озеро, чтобы контролировать вредные растения, плотные скопления растений умирают, разлагаются и накапливаются на дне озера. Этот процесс не только добавляет осадок, но и разлагающиеся растения также используют кислород в воде — кислород, который необходим местным растениям и животным для выживания.
Этот процесс не только добавляет осадок, но и разлагающиеся растения также используют кислород в воде — кислород, который необходим местным растениям и животным для выживания.
Когда используются стратегии профилактического контроля, небольшие популяции растений-вредителей удаляются до того, как они станут крупными заражениями. Это уменьшает количество разлагающегося растительного материала в воде, тем самым уменьшая осаждение и истощение кислорода.
Несмотря на то, что осаждение обычно является медленным и естественным процессом, в некоторых озерах оно происходит быстрее. Озера Флориды, как правило, теплые и мелкие, что создает идеальные условия для быстрого роста растений и осаждения. Для озер, которые используются для отдыха, управления водными ресурсами или в эстетических целях, люди могут решить удалить накопление наносов, чтобы поддерживать озеро в соответствии с его предполагаемыми функциями. Прочтите о проекте по удалению навоза на озере Тохопекалига.
На жизненный цикл озера влияет множество факторов, включая температуру, климат, форму озера, концентрацию кислорода, химический состав воды, движение воды и деятельность человека. Управление водными растениями учитывает все эти факторы при управлении водоемами.
Управление водными растениями учитывает все эти факторы при управлении водоемами.
Дифференциальное разложение в наземной, пресноводной и морской среде: экспериментальное исследование
Abstract
Изучение разложения необходимо любому судебному антропологу для оценки посмертного интервала. Хотя поверхностные скорости разложения были изучены, особенно в некоторых областях (Mann et al. 1990), скорость разложения тел, погруженных в воду, редко изучалась с помощью контролируемых экспериментов (Haglund & Sorg 2002; Sorg et al. 1997). Большинство судебных антропологов просто полагаются на обобщения, например, тело, разлагающееся в течение одной недели на поверхности земли, эквивалентно телу, пролежавшему две недели в воде (по Mann et al., 1990). Кроме того, не было проведено большого расследования
влияет ли среда соленой воды на разложение иначе, чем среда пресной воды. Это дифференцированное разложение в различных средах, будь то земная поверхность под открытым небом, пресная или соленая вода, важно учитывать в Техасе, потому что там из-за
обилием пресноводных озер и рек и близостью Мексиканского залива. Это исследование было направлено на решение двух вопросов: 1) Влияет ли погружение в воду на разложение таким образом, который поддерживает давнее обобщение, согласно которому тело, разлагающееся в течение одной недели на поверхности земли, эквивалентно двум неделям в воде (после Mann et al. 1990), и 2) Влияет ли тип воды (соленая или пресная) на скорость разложения
Это исследование было направлено на решение двух вопросов: 1) Влияет ли погружение в воду на разложение таким образом, который поддерживает давнее обобщение, согласно которому тело, разлагающееся в течение одной недели на поверхности земли, эквивалентно двум неделям в воде (после Mann et al. 1990), и 2) Влияет ли тип воды (соленая или пресная) на скорость разложения
тело, погруженное в воду? После неофициальных данных была выдвинута гипотеза, что образцы с поверхности разлагаются быстрее всего, образцы в пресной воде разлагаются медленнее, а образцы в соленой воде разлагаются медленнее всех. Этот
Исследование проводилось на открытом воздухе в Исследовательском центре судебной антропологии Техасского государственного университета в Сан-Маркосе, штат Техас. Хотя человеческие останки и туши свиней плавают в воде по-разному (Haglund & Sorg 2002), в этом эксперименте вместо человеческих останков использовались туши свиней из-за их сходства с человеческими тканями, а также из-за практических ограничений. Шесть свиней (Sus scrofa) весом от 20 до 30 фунтов (9-13,6 кг) были гуманно усыплены
Шесть свиней (Sus scrofa) весом от 20 до 30 фунтов (9-13,6 кг) были гуманно усыплены
следуя руководящим принципам Институционального комитета по уходу и использованию животных. Туши помещали на поверхность земли (N=2), в резервуары с морской водой, полученной путем смешивания пресной воды с покупной морской смесью (N=2), и в резервуары с пресной водой с водой.
из местного водоносного горизонта Эдвардс (N=2). Соленость в резервуарах с морской водой была такой же, как в Мексиканском заливе (34-36 ppts; Boatman 2006). Ежедневно регистрировали температуру воздуха и воды. Поверхностные туши и резервуары были загорожены, чтобы животные не поедали падаль.
исследование было завершено, когда все образцы были полностью скелетированы. В то время как помещение в воду влияло на скорость разложения, помещение в пресную воду заставляло образцы разлагаться намного быстрее, чем те, что находились на поверхности земли или в соленой воде.
по крайней мере, в летних условиях центрального Техаса. Предполагается, что это результат того, что высокие температуры убивают массы личинок, присутствующих на поверхностных тушах, только через день после вылупления, в то время как массы личинок на тушах в пресной воде жили и процветали, возможно, из-за того, что температура воды была в среднем 4,45° по Цельсию (8).
