Содержание
Почему вода замерзает? Описание, фото и видео
Содержание:
Вода – это вещество, которое может наблюдаться в трех агрегатных состояниях. Она может замерзать и быть твердым льдом, она бывает в жидкой форме, и также она присутствует в виде пара – не только в бане, но и в небе, в виде облаков. Однако в рамках данной статьи остановимся на первом ее состоянии, твердом.
Вода замерзает, образуя кристаллики твердого льда. Лед может формировать многокилометровые поверхности, покрывая реки, озера и другие водоемы. При этом он оказывается легче жидкой воды и всегда находится сверху. Замерзает вода из-за понижения температур.
Температуры и агрегатное состояние веществ
Молекула воды в различных агрегатных состояниях
Чем выше температуры, тем дальше отстоят между собой молекулы любых веществ. Их отдаление друг от друга приводит к размягчению вещества, которое сначала становится жидким, а потом и вовсе газообразным. Этот процесс можно рассмотреть на примере железа, которое плавится в тигле и обретает жидкую форму. При сильном повышении температур оно может стать и газообразным, то есть, испариться, но для этого температура должна быть по-настоящему высокой.
При сильном повышении температур оно может стать и газообразным, то есть, испариться, но для этого температура должна быть по-настоящему высокой.
Вода же при обычной комнатной температуре является жидкостью. При повышении температур она станет паром, а при понижении – льдом. Ведь понижение температуры имеет обратное влияние на молекулы – они сближаются. А при их сближении вещество становится тверже, плотнее. Такого же эффекта можно добиться при механическом прессовании любого вещества- оно станет тверже, опять же из-за сближения молекул.
Что происходит при понижении температур?
Когда на воду оказывается влияние пониженных температур, молекулы сближаются, образуя шестигранные формы. Разумеется, это снежинки, которые являются кристаллами воды. Остывание воды и ее кристаллизация – это фактически синонимы, описывающие один и тот же процесс. Вода начинает кристаллизоваться при температуре в 0 градусов – именно этот момент и взят за нулевую отметку по шкале Цельсия. Если рассматривать американскую шкалу Фаренгейта, то здесь застывание воды будет происходить при 32 градусах.
Но для создания кристаллов воды нужна основа, какие-либо примеси или взвеси, благодаря которым стартует этот процесс. И если вода абсолютно чистая, здесь наблюдается несколько другое явление – порой она застывает только при -40 градусах, а при нуле и других не слишком низких отметках остается жидкой. Однако не замерзает она только в спокойном состоянии. Если ее взболтать при минусовых отметках, она немедленно превратится в лед.
Интересные факты
С водой связано множество парадоксов. И кроме уже описанного выше нюанса, необходимо отметить, что лед занимает больше объема, чем жидкая вода, то есть, при замерзании это вещество расширяется, в то время как другие наоборот занимают меньше объема при низких температурах. Именно с расширением воды при формировании льда и связано лопание бочек, труб и других объектов, оставленных на зиму заполненными водой.
На момент замерзания молекулы немного отдаляются друг от друга, что и дает такой эффект. И именно этот фактор, наряду с вмерзшими пузыриками воздуха, делает лед плавучим. Если бы он тонул или формировался со дна, ни одно живое существо в водоемах не смогло бы перезимовать. Но формируясь именно на поверхности, и оставаясь там, лед наоборот сохраняет тепло воды и выполняет защитную функцию в зимнее время, давая животным, растениям и рыбам возможность перезимовать и выжить.
Если бы он тонул или формировался со дна, ни одно живое существо в водоемах не смогло бы перезимовать. Но формируясь именно на поверхности, и оставаясь там, лед наоборот сохраняет тепло воды и выполняет защитную функцию в зимнее время, давая животным, растениям и рыбам возможность перезимовать и выжить.
Есть и другие интересные феномены. Так, практика показала, что горячая вода замерзает быстрее холодной, и это явление с удивлением наблюдали еще во времена античности. На данный момент существует несколько гипотез, объясняющих этот парадокс, но окончательного ответа так и не было найдено.
Вода – это загадочная стихия, и чем больше люди погружаются в ее изучение, тем больше необъяснимых загадок она приносит. На данный момент установлено, что она обладает памятью, может быть мертвой или живой. Она является универсальным растворителем, и имеет массу других уникальных качеств. Несмотря на ее изобилие и распространенность на нашей планете, она все еще сохраняет множество своих загадок, и с большинством из них ученым приходится только мириться. Ведь спорить с фактами затруднительно.
Ведь спорить с фактами затруднительно.
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
незамерзающая вода в мерзлоте — Наука и культура
Вода – основа жизни на нашей планете. Это все мы усвоили ещё в школе. Вода – самое распространённое на Земле химическое соединение. Около 95% её приходится на моря и океаны, менее 2% существует в виде льдов и снега Арктики, Антарктики и высокогорных ледников, примерно столько же составляют грунтовые воды, несколько меньше воды находится в реках и озёрах и лишь совсем небольшая часть – это водяные пары в атмосфере (облака, тучи и туманы). Но очень редко люди вспоминают о том, что ещё некоторая часть воды (в основном, в виде льда) присутствует в вечной мерзлоте. Да, количество её несущественно, по сравнению с водой в форме ледников, однако вполне сопоставимо с общим количеством воды в реках и озёрах нашей планеты.
Что ещё мы хорошо помним о воде из школьного курса, так это то, что пресная вода переходит в лёд при 0оС. А если в воде растворить какие-нибудь соли, то замерзать она будет уже в спектре отрицательных температур. И чем выше минерализация этого раствора, тем ниже будет его температура замерзания. Поэтому логично предположить, что в мерзлоте, характеризующейся отрицательной температурой, не вся вода будет находиться в виде ледяных кристаллов. И это действительно так. В ней всегда существует незамёрзшая вода. Только увидеть эту незамёрзшую воду невооружённым глазом можно далеко не всегда, потому что она существует не только на макро-, но и на микроуровне.
А если в воде растворить какие-нибудь соли, то замерзать она будет уже в спектре отрицательных температур. И чем выше минерализация этого раствора, тем ниже будет его температура замерзания. Поэтому логично предположить, что в мерзлоте, характеризующейся отрицательной температурой, не вся вода будет находиться в виде ледяных кристаллов. И это действительно так. В ней всегда существует незамёрзшая вода. Только увидеть эту незамёрзшую воду невооружённым глазом можно далеко не всегда, потому что она существует не только на макро-, но и на микроуровне.
Температура замерзания воды в природных условиях зависит от соотношения и количества растворённых в ней веществ. Замерзание морской воды с солёностью, равной средней солёности Мирового океана (35‰), происходит при температуре около −1,8°C. Морская вода солёностью 10‰ замерзает при температуре 0,5°C, а солёностью 40‰ уже при температуре –2,2°C.
Большие объёмы незамерзающей воды в мёрзлых толщах обычно приурочены к водонасыщенным грунтовым линзам и прослоям и имеют общее название – криопэги. И хотя существуют они столько же, сколько и вся мерзлота, специальное их исследование началось относительно недавно, в середине XX века; тогда же появился и термин «криопэги». В ту пору среди геокриологов (называвшихся в те времена мерзлотоведами) шла бурная дискуссия по вопросам терминологических определений всего, что связано с вечной мерзлотой. Именно в этот период в научный обиход вошли определения «многолетне- и сезонномёрзлых» горных пород, как содержащих лёд. Породы же, не содержащие воды и льда, но имеющие отрицательную температуру, стали называть «морозными». А горные породы с температурой ниже 0°С, насыщенные незамёрзшими солёными водами и рассолами, получили название «охлаждённых». Но вот такие названия, как «мокроморозные породы» или «жидкая мерзлота», не прижились и оказались за бортом научной терминологии. Хотя по мнению некоторых учёных, например, Владимира Романовича Алексеева, доктора географических наук, профессора, работающего в Институте мерзлотоведения им. П.И. Мельникова СО РАН, термин «жидкая мерзлота» отражает самое главное – тепловое состояние вещества и его «консистенцию» — и вполне мог бы стать российским аналогом термина «криопэги».
И хотя существуют они столько же, сколько и вся мерзлота, специальное их исследование началось относительно недавно, в середине XX века; тогда же появился и термин «криопэги». В ту пору среди геокриологов (называвшихся в те времена мерзлотоведами) шла бурная дискуссия по вопросам терминологических определений всего, что связано с вечной мерзлотой. Именно в этот период в научный обиход вошли определения «многолетне- и сезонномёрзлых» горных пород, как содержащих лёд. Породы же, не содержащие воды и льда, но имеющие отрицательную температуру, стали называть «морозными». А горные породы с температурой ниже 0°С, насыщенные незамёрзшими солёными водами и рассолами, получили название «охлаждённых». Но вот такие названия, как «мокроморозные породы» или «жидкая мерзлота», не прижились и оказались за бортом научной терминологии. Хотя по мнению некоторых учёных, например, Владимира Романовича Алексеева, доктора географических наук, профессора, работающего в Институте мерзлотоведения им. П.И. Мельникова СО РАН, термин «жидкая мерзлота» отражает самое главное – тепловое состояние вещества и его «консистенцию» — и вполне мог бы стать российским аналогом термина «криопэги».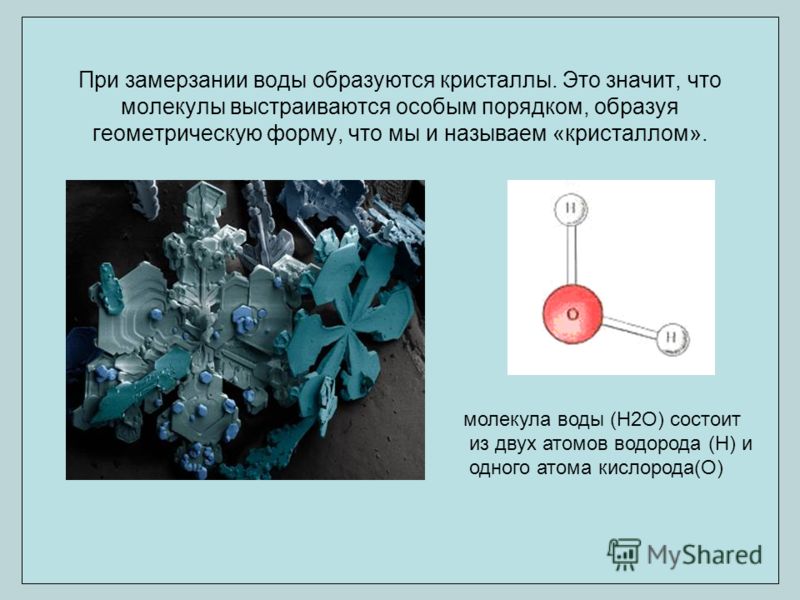
Криопэги – природные засолённые воды (рассолы), имеющие отрицательную температуру, но находящиеся в жидком состоянии. Чаще всего этот термин применяется к подземным природным водам, но может использовaться и в более широком смысле.
Первую развёрнутую классификацию отрицательно-температурных природных вод (криопэгов) ещё в 70-х годах прошлого века предложил выдающийся гидрогеолог и мерзлотовед Нестор Иванович Толстихин. Им были выделены три главные категории криопэгов – озёрные, морские и подземные. Каждая из этих категорий подразделялась на более дробные единицы, что в совокупности давало представление о масштабности распространения криопэгов и их разнообразии на земном шаре. В последующие годы учёные продолжили работы над классификацией криопэгов, учитывающей основные идеи Н.И. Толстихина, разделяя их по времени существования и температуре, а также по положению относительно вмещающей среды (горных пород, льдов и воды).
И здесь мы хотели бы, обращаясь к названию нашей статьи, начать говорить о парадоксах. Первым из них, и наиболее очевидным для человека, изучавшего основы физики в средней школе, является наличие солёных вод во льдах. Мы знаем, что природный лёд обычно значительно чище, чем вода, из которой он образуется, так как при кристаллизации воды в первую очередь в ажурную решётку выстраиваются молекулы воды, поэтому одиночные кристаллы льда должны быть ультрапресными, а из растаявшего льда получается самая чистая вода, лишённая примесей. Но что же происходит с механическими примесями и растворёнными в замерзающей воде солями? Они отжимаются вовне растущими кристаллами льда. Так в формирующихся массивах ледяных покровов появляются прослои воды с повышенной минерализацией вплоть до рассолов в сотни граммов на один литр – криопэги, которые иногда образуют настоящие «залежи» солёных вод среди многометровых ледяных толщ.
Первым из них, и наиболее очевидным для человека, изучавшего основы физики в средней школе, является наличие солёных вод во льдах. Мы знаем, что природный лёд обычно значительно чище, чем вода, из которой он образуется, так как при кристаллизации воды в первую очередь в ажурную решётку выстраиваются молекулы воды, поэтому одиночные кристаллы льда должны быть ультрапресными, а из растаявшего льда получается самая чистая вода, лишённая примесей. Но что же происходит с механическими примесями и растворёнными в замерзающей воде солями? Они отжимаются вовне растущими кристаллами льда. Так в формирующихся массивах ледяных покровов появляются прослои воды с повышенной минерализацией вплоть до рассолов в сотни граммов на один литр – криопэги, которые иногда образуют настоящие «залежи» солёных вод среди многометровых ледяных толщ.
Морские криопэги существуют далеко за пределами границы распространения плавучих льдов (фото из открытых источников).
Ещё один парадокс – существование криопэгов в водной среде: солёные воды с температурой ниже 0оС. Морские криопэги по общему объёму составляют значительную часть мирового океана и существуют далеко за пределами границ распространения плавучих льдов. К районам с морскими криопэгами относится практически весь Северный Ледовитый океан, северные части Тихого и Атлантического океанов и, конечно, океанические воды вокруг Антарктиды. Вероятно, более плотные солёные воды с температурой до –1,5° С стекают по материковому склону на дно Мирового океана на глубину более 3 км и распространяются далеко от места своего формирования в сторону экватора. Учёные не исключают, что именно с этими морскими криопэгами генетически связана перестройка течений в экваториальной части Тихого океана, влияющая на климат нашей планеты. Общая масса отрицательно-температурных морских вод не подсчитана, недостаточно изучены законы их существования во времени и пространстве. Тем не менее, с уверенностью можно утверждать, что океаническая «жидкая мерзлота» по объёму в несколько раз превышает свой континентальный аналог.
Морские криопэги по общему объёму составляют значительную часть мирового океана и существуют далеко за пределами границ распространения плавучих льдов. К районам с морскими криопэгами относится практически весь Северный Ледовитый океан, северные части Тихого и Атлантического океанов и, конечно, океанические воды вокруг Антарктиды. Вероятно, более плотные солёные воды с температурой до –1,5° С стекают по материковому склону на дно Мирового океана на глубину более 3 км и распространяются далеко от места своего формирования в сторону экватора. Учёные не исключают, что именно с этими морскими криопэгами генетически связана перестройка течений в экваториальной части Тихого океана, влияющая на климат нашей планеты. Общая масса отрицательно-температурных морских вод не подсчитана, недостаточно изучены законы их существования во времени и пространстве. Тем не менее, с уверенностью можно утверждать, что океаническая «жидкая мерзлота» по объёму в несколько раз превышает свой континентальный аналог.
Подземные криопэги в толщах мёрзлых горных пород не столь грандиозны по объёму, как морские отрицательно-температурные воды, но вполне могут конкурировать с криопэгами в поверхностных морских льдах. И именно о них нам хотелось бы поговорить более подробно в связи с их широким распространением в российской Арктике.
Распространение подземных криопэгов по площади совпадает с границами криолитозоны, а происхождение связано со следующими процессами:
— проникновением морских вод в толщу прибрежных горных пород;
— растворением солей, содержащихся в составе вмещающих подземную воду горных пород;
— криогенным концентрированием (вымораживанием) веществ, растворённых в подземных водах вследствие процессов их промерзания.
Морской тип засоления грунтов распространён по всему побережью Северного Ледовитого океана, как на арктических островах, так и на территории плейстоценовых морских трансгрессий на евразийском и северно-американском континентах. Здесь криопэги формировались при насыщении осадков морскими водами. При промерзании осадков часть солей из их поровых растворов отжималась вниз по разрезу по мере движения фронта промерзания горных пород и концентрировалась там, подвергаясь в последующем неоднократным криогенным преобразованиям (метаморфизации). Глубина залегания криопэгов в соответствии с мощностью криолитозоны сегодня может достигать нескольких сотен метров. Минерализация их непостоянна как по площади, так и по глубине, и может изменяется в широких пределах. Так, на полуострове Ямал она варьируется от 5 до 150 г/л. Местоположение криопэгов также непостоянно – они могут мигрировать в толщах мёрзлых пород. А температура начала их замерзания может опускаться на несколько десятков градусов ниже 0°C. Характерной особенностью криопэгов является их способность охлаждать вмещающие горные породы в процессе просачивании в нижние горизонты и тем самым понижать общую температуру массива, увеличивая мощность криолитозоны.
Здесь криопэги формировались при насыщении осадков морскими водами. При промерзании осадков часть солей из их поровых растворов отжималась вниз по разрезу по мере движения фронта промерзания горных пород и концентрировалась там, подвергаясь в последующем неоднократным криогенным преобразованиям (метаморфизации). Глубина залегания криопэгов в соответствии с мощностью криолитозоны сегодня может достигать нескольких сотен метров. Минерализация их непостоянна как по площади, так и по глубине, и может изменяется в широких пределах. Так, на полуострове Ямал она варьируется от 5 до 150 г/л. Местоположение криопэгов также непостоянно – они могут мигрировать в толщах мёрзлых пород. А температура начала их замерзания может опускаться на несколько десятков градусов ниже 0°C. Характерной особенностью криопэгов является их способность охлаждать вмещающие горные породы в процессе просачивании в нижние горизонты и тем самым понижать общую температуру массива, увеличивая мощность криолитозоны.
По температуре криопэги в природе могут разделяться на несколько категорий, от умеренно холодных (с температурой от 0 до -2оС) до сверх-холодных (с температурой ниже -36оС). Криопэги не замерзают даже при низких температурах в результате высокой минерализации (до 200 — 300 г/л).
Криопэги не замерзают даже при низких температурах в результате высокой минерализации (до 200 — 300 г/л).
Целенаправленное изучение подземных криопэгов началось сравнительно недавно, в последние 40-50 лет. Выяснилось, что они оказывают негативное влияние на фундаменты инженерных сооружений, построенных на мерзлоте, и создают различные осложнения при разработке полезных ископаемых в арктическом регионе. Оказалось, что арктическая мерзлота изобилует солёными водами, которые могут встречаются в различных частях разреза криолитозоны: в верхнем сезоннопротаивающем слое (надмерзлотные криопэги), в нижележащей многолетнемерзлой толще (внутри- или межмерзлотные криопэги), в подмерзлотных водоносных горизонтах (подмерзлотные криопэги).
Здесь нам хочется обратить внимание на ещё один момент, который также можно отнести к парадоксам существования незамерзающих подземных вод в вечной мерзлоте. В естественных условиях криопэги обычно не причиняют ущерба и вреда, поскольку все компоненты экосистемы северной природы находятся в определённом равновесии. Однако вмешательство человека, его непродуманная деятельность может вызвать настоящую агрессию со стороны мерзлоты вообще и криопэгов в частности. Например, криопэги в верхних горизонтах криолитозоны, если не учитываются их характерные свойства, могут ухудшать функционирование подземных коммуникаций, разрушать фундаменты зданий и сооружений, снижать устойчивость опор линий связи и электропередачи, вызывать коррозию заглублённых трубопроводов, а также ухудшать экологические условия существования почв, растительности, животного мира и человека.
Однако вмешательство человека, его непродуманная деятельность может вызвать настоящую агрессию со стороны мерзлоты вообще и криопэгов в частности. Например, криопэги в верхних горизонтах криолитозоны, если не учитываются их характерные свойства, могут ухудшать функционирование подземных коммуникаций, разрушать фундаменты зданий и сооружений, снижать устойчивость опор линий связи и электропередачи, вызывать коррозию заглублённых трубопроводов, а также ухудшать экологические условия существования почв, растительности, животного мира и человека.
Да и сам человек способен сформировать криопэги там, где их ранее не было, и где остальная природная среда не готова к равновесному взаимодействию с внезапно возникшим новым элементом. В отличие от природных криопэгов, формирующихся в течение сотен лет, техногенные криопеэги, возникающие в условиях интенсивной хозяйственной деятельности человека, а также химического загрязнения территории при сбросах бытовых и техногенных вод, могут образоваться в течении первых 10 – 15 лет.
В криолитозоне различают естественные и техногенные криопэги. Естественные криопэги часто залегают ниже подошвы многолетнемёрзлых пород, но встречаются также в виде прослоев и линз внутри мерзлоты. Техногенные криопэги обычно залегают на небольших на глубинах, исчисляемых первыми десятками метров от поверхности. Их минерализация может составлять от 1 до 10 г/л.
Глубоко залегающие межмерзлотные и подмерзлотные криопэги тоже могут начать «мстить» человеку за вмешательство в жизнь вечной мерзлоты. Например, проходку карьеров, вскрывающих криопэги, невозможно осуществить без откачки солёных вод. В первоначальный период горных разработок рассолы часто сбрасывали в речную сеть, некогда славящуюся своей чистотой и ценными породами промысловых рыб, тем самым нанося невосполнимый урон природе. Позже стали строить специальные бассейны-накопители, однако из хранилища рассолов продолжались утечки сквозь плотину, а нередко случались и аварийные сбросы. Потом появилась идея закачивать дренажные рассолы в толщу вечной мерзлоты или подмерзлотные горизонты, поскольку в процессе разведочного бурения там фиксировались зоны повышенной проницаемости, которые могли служить коллекторами. Однако дренажные рассолы, закачанные в толщу горных пород, могли возвращаться обратно в горную выработку, проникая через противофильтрационную завесу, откуда их снова приходилось откачивать, а потом находить новые резервуары для захоронения, как это было, например, в Западной Якутии при разработке алмазов.
Однако дренажные рассолы, закачанные в толщу горных пород, могли возвращаться обратно в горную выработку, проникая через противофильтрационную завесу, откуда их снова приходилось откачивать, а потом находить новые резервуары для захоронения, как это было, например, в Западной Якутии при разработке алмазов.
Выход захороненных рассолов сквозь противофильтрационную завесу карьера трубки «Мир». Фото отсюда.
А вот ещё один парадокс криопэгов: несмотря на высокую минерализацию и низкую отрицательную температуру, в криопэгах, оказывается, существует жизнь! Конечно, нам сразу вспоминаются морские криопэги. Да, условия жизни в холодных водах не очень благоприятны, однако морские экосистемы Арктики и Антарктики занимают одно из ведущих мест в структуре природных комплексов земного шара. Основу жизни в морских криопэгах составляет фито- и зоопланктон. Его активность зависит от продолжительности существования ледяного покрова: зимой продуктивность затухает, весной резко увеличивается. В Арктике относительно тёплое, хотя и короткое, лето приносит оживление и изобилие. Морская вода над континентальным арктическим шельфом в это время года буквально кишит живыми существами. Они почти неразличимы человеческим глазом, но это не мешает им быть хорошей кормовой базой для рыб и птиц, китов и тюленей.
В Арктике относительно тёплое, хотя и короткое, лето приносит оживление и изобилие. Морская вода над континентальным арктическим шельфом в это время года буквально кишит живыми существами. Они почти неразличимы человеческим глазом, но это не мешает им быть хорошей кормовой базой для рыб и птиц, китов и тюленей.
Но ещё более удивительным явлением представляется способность подземных криопэгов консервировать и длительное время сохранять жизнеспособные микроорганизмы в вечной мерзлоте! Учеными были обнаружены микробы в мёрзлых отложениях самого разного состава и происхождения, имеющих среднегодовую температуру до –18°С в Арктике и до –38°С в Антарктиде. Количество микроорганизмов в 1 г мёрзлой породы может изменяться от 100 тыс. до 100 млн., что на несколько порядков больше, чем во льду. Помимо бактерий, там могут встречаться водоросли, грибы и даже высшие растения. Примерно 20% микробных сообществ, выделенных из образцов мёрзлой породы, растут при температуре ниже –10°С, активны до –40°С, причём многие микроорганизмы выносят температуру –60°С и ниже. Видовой состав жизнеспособных существ в обособленных линзах криопэгов, а также в мёрзлых грунтах, где их сохранность при низких температурах обеспечивается во многом за счёт плёнок незамёрзшей воды, условия распределения и индикаторные свойства микроорганизмов в настоящее время активно изучают российские и зарубежные учёные. Это обусловлено тем, что сообщества микроорганизмов, адаптированных к условиям жизни в вечной мерзлоте, могут нести информацию не только о её эволюции в четвертичный период, но и пролить свет на более отдалённые эпохи, вплоть до начала возникновения жизни на Земле.
Видовой состав жизнеспособных существ в обособленных линзах криопэгов, а также в мёрзлых грунтах, где их сохранность при низких температурах обеспечивается во многом за счёт плёнок незамёрзшей воды, условия распределения и индикаторные свойства микроорганизмов в настоящее время активно изучают российские и зарубежные учёные. Это обусловлено тем, что сообщества микроорганизмов, адаптированных к условиям жизни в вечной мерзлоте, могут нести информацию не только о её эволюции в четвертичный период, но и пролить свет на более отдалённые эпохи, вплоть до начала возникновения жизни на Земле.
В отложениях Колымской низменности вскрыты линзы криопэгов с жизнеспособными редкими микроорганизмами, возраст которых составляет четверть миллиона лет. Справа стоит доктор геолого-минералогических наук Давид Гиличинский. Фото отсюда.
Сегодня изучением криопэгов занимаются учёные различных специальностей: геокриологи и инженеры-строители, геохимики и экологи, географы и гидрологи, биологи и почвоведы. И каждая научная дисциплина вносит свой вклад в познание этой парадоксальной «жидкой мерзлоты».
И каждая научная дисциплина вносит свой вклад в познание этой парадоксальной «жидкой мерзлоты».
А мы, продолжая свой рассказ о незамерзающей воде, спустимся от макроуровня криопэгов на микроуровень жидкой фазы в монолитной и внешне достаточно прочной мёрзлой породе.
И здесь мы сталкиваемся с очередным парадоксом, заключающимся в том, что мёрзлая порода, имеющая температуру ниже 0оС, кроме органо-минерального скелета и льда всегда содержит в своём составе и какое-то количество незамёрзшей воды. То есть, при достижении грунтом отрицательной температуры, не вся вода в поровом пространстве переходит в лёд – часть её остается в жидком состоянии. Это и есть так называемая незамёрзшая вода, количество которой зависит от величины отрицательной температуры и нелинейно убывает с понижением температуры. Здесь следует упомянуть известный «принцип Цытовича» о равновесном состоянии воды и льда в мёрзлых грунтах, сформулированный ещё в середине ХХ века профессором Николаем Александровичем Цытовичем, крупнейшим советским специалистом в области механики мёрзлых грунтов. Суть этого принципа состоит в том, что содержание незамёрзшей воды в конкретном мёрзлом грунте является, при фиксированной отрицательной температуре, постоянной величиной.
Суть этого принципа состоит в том, что содержание незамёрзшей воды в конкретном мёрзлом грунте является, при фиксированной отрицательной температуре, постоянной величиной.
Количество незамёрзшей воды в грунте зависит от многих факторов и прежде всего – от состава частиц и агрегатов, которые слагают скелет породы, а также от количества растворённых в поровом растворе солей. Известно, что грунтовая вода в поровом пространстве энергетически неоднородна. Различают свободную воду, которая практически не связана со скелетом, и связанную воду, которая, в свою очередь, подразделяется на капиллярную и плёночную.
Свободная вода, которая содержится в трещиноватых скальных, крупнообломочных породах и песках, обладает обычными свойствами жидкой фазы – передвигается под действием силы тяжести, заполняет почти все крупные пустоты. Пресная свободная вода замерзает практически вся при 0оС, однако с увеличением её минерализации температура замерзания постепенно понижается. Теоретически температура грунтовой воды может понизиться до эвтектической (например, для NaCl она будет соответствовать -21.2оС), когда начинается выпадение солей из раствора.
Теоретически температура грунтовой воды может понизиться до эвтектической (например, для NaCl она будет соответствовать -21.2оС), когда начинается выпадение солей из раствора.
Несколько сильнее связана с грунтом капиллярная вода, которая содержится в грунтах большей дисперсности (пылеватых и глинистых), передвигается и удерживается в них за счёт капиллярного натяжения и силы тяжести, начинает вымерзать в зависимости от уменьшения размеров капилляров при температурах от -1оС до -12оС и даже ниже. По своей природе капиллярная вода занимает промежуточное положение между свободной и связанной. Она может относиться как к той, так и к другой, в зависимости от размера (диаметра) капилляра и, соответственно, силы взаимодействия с поверхностью скелета грунта.
Расположение различных категорий поровой воды относительно поверхности грунтовой частицы: 1 – минеральная частица; 2 – прочносвязанная вода; 3 — рыхлосвязанная вода; 4 – свободная вода.
Следующая по силе взаимодействия с грунтом — связанная вода, которая удерживается на грунтовых частицах за счёт поверхностной энергии этих частиц. Чем ближе молекула воды к частице грунта, тем сильнее она к ней притягивается за счёт водородных связей. Прочносвязанной водой являются первые несколько слоёв молекул воды на поверхности частиц или даже отдельные островки молекул. Рыхлосвязанная вода образует плёнки, которые вымерзают в спектре отрицательных температур в зависимости от их толщины.Прочносвязанная вода имеет повышенную плотность и замерзает самой последней при очень низких отрицательных температурах – около -80°С. И если в реальности такие температуры для воздуха ещё возможны, например, в Антарктиде, то столь низких значений температуры мёрзлых пород в естественной природе не существует (их можно смоделировать только в лабораторных условиях). Поэтому мы можем вполне обоснованно утверждать, что в любых мёрзлых породах в Арктике на микроуровне всегда содержится какое-то количество незамёрзшей воды!
Основные компоненты мёрзлой породы: 1 – минеральные частицы; 2 – лёд; 3 – незамёрзшая вода.
Тут справедливости ради надо сказать, что всё же основная часть воды в мёрзлых породах замерзает и присутствует в виде твёрдой фазы – льда, который является важнейшим породообразующим минералом в мёрзлой породе. Весь этот лёд принято называть подземным, независимо от особенностей его образования и характера залегания. Лёд может присутствовать в мёрзлой породе в виде текстурообразующего не различимого невооружённым глазом льда-цемента, в виде отдельных визуально различимых включений (линз и прослоек), а также в виде крупных и даже гигантских скоплений и пластов. Но в любом льду, как в ультрапресном, так и в засолённом, обязательно присутствует незамёрзшая вода либо в виде плёнок вокруг отдельных кристаллов, либо в виде локализованных в порах, пустотах и карманах скоплений воды, обычно имеющих повышенную засолённость – это своего рода «криопэги в миниатюре».
Обнажение залежей подземного пластового льда (фото из открытых источников)
Итак, мы убедились в том, что в любой мёрзлой породе всегда присутствует какое-то количество незамёрзшей воды. И если бы не её наличие в мёрзлой породе, пусть даже в виде тонких плёнок, то свойства и поведение мёрзлых пород были бы несколько иными, поскольку именно количество незамёрзшей воды влияет почти на все физические и механические свойства мёрзлых пород. Очевидно, что чем меньше становится количество незамёрзшей воды в мёрзлой породе, тем порода делается прочнее, что обычно происходит при понижении отрицательной температуры. Однако внешнее воздействие на мёрзлую породу, например, давление, может приводить к таянию льда, то есть переходу части молекул воды в более подвижное состояние, в результате чего плёнки незамёрзшей воды на поверхности минеральных частиц и кристаллов льда утолщаются. И мёрзлая порода начинает вести себя как более высокотемпературная и вязкая среда, приближаясь по своим механическим характеристикам к талой (немёрзлой) породе. При этом, если воздействие на мёрзлую породу, пусть даже весьма существенное, производится короткое время, она сопротивляется нагрузкам, как прочная скальная порода, поскольку плавление льда и сдвиг грунта по плёнкам незамёрзшей воды не успевают произойти.
И если бы не её наличие в мёрзлой породе, пусть даже в виде тонких плёнок, то свойства и поведение мёрзлых пород были бы несколько иными, поскольку именно количество незамёрзшей воды влияет почти на все физические и механические свойства мёрзлых пород. Очевидно, что чем меньше становится количество незамёрзшей воды в мёрзлой породе, тем порода делается прочнее, что обычно происходит при понижении отрицательной температуры. Однако внешнее воздействие на мёрзлую породу, например, давление, может приводить к таянию льда, то есть переходу части молекул воды в более подвижное состояние, в результате чего плёнки незамёрзшей воды на поверхности минеральных частиц и кристаллов льда утолщаются. И мёрзлая порода начинает вести себя как более высокотемпературная и вязкая среда, приближаясь по своим механическим характеристикам к талой (немёрзлой) породе. При этом, если воздействие на мёрзлую породу, пусть даже весьма существенное, производится короткое время, она сопротивляется нагрузкам, как прочная скальная порода, поскольку плавление льда и сдвиг грунта по плёнкам незамёрзшей воды не успевают произойти. Но под действием длительной и возрастающей нагрузки в мёрзлых породах с течением времени начинают развиваться деформации и явление ползучести, когда порода проявляет пластические свойства и как бы течёт под нагрузкой, что может привести к потере прочности и полному её разрушению. Эти реологические свойства мёрзлых пород должны всегда учитываться при проектировании инженерных сооружений в Арктике и планировании хозяйственной деятельности на северных территориях. А основная причина всех этих проблем – уже знакомая нам незамёрзшая вода!
Но под действием длительной и возрастающей нагрузки в мёрзлых породах с течением времени начинают развиваться деформации и явление ползучести, когда порода проявляет пластические свойства и как бы течёт под нагрузкой, что может привести к потере прочности и полному её разрушению. Эти реологические свойства мёрзлых пород должны всегда учитываться при проектировании инженерных сооружений в Арктике и планировании хозяйственной деятельности на северных территориях. А основная причина всех этих проблем – уже знакомая нам незамёрзшая вода!
Мёрзлые грунты по своему агрегатному состоянию являются твёрдыми телами, однако наличие в них незамёрзшей воды и льда обусловливает проявление реологических свойств.
Реология — (от греческого «rheos» — течение) — наука об изменениях во времени напряжённо-деформированного состояния любой сплошной среды.
О незамерзающей воде в мёрзлых породах можно было бы рассказать ещё много интересного.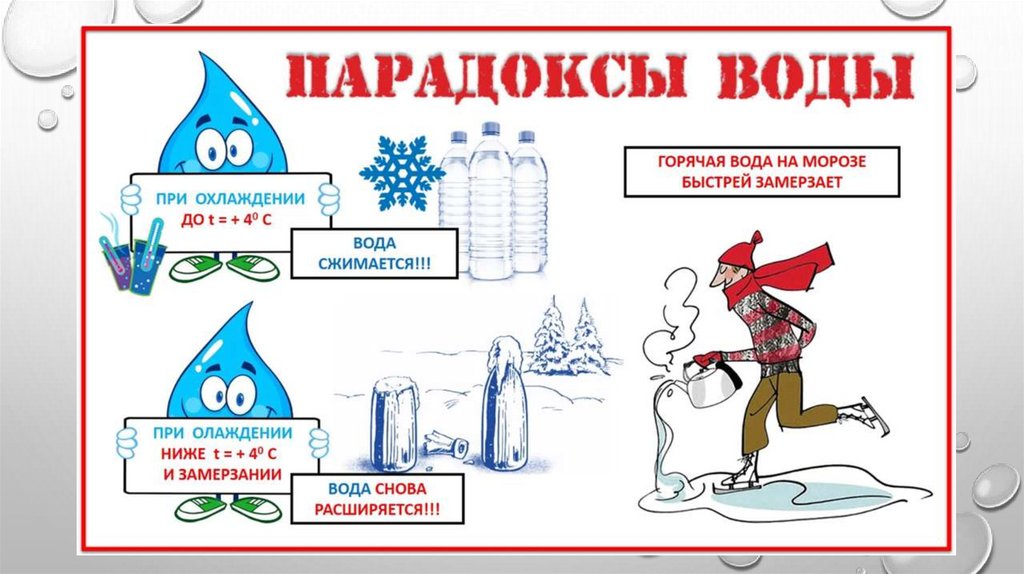 Например, о том, что при вымерзании насыщенных солями водных плёнок на их месте образуются новые криогенные минералы. Или о том, как по неизолированным (сообщающимися друг с другом) рыхлым плёнкам незамёрзшей воды мигрируют ионы солей или микроорганизмы, и иногда на значительные расстояния от места своего проникновения в плёночную воду. А ещё – о том, как высокое содержание незамёрзшей воды «стирает» разницу в показателях для талых и мёрзлых пород при интерпретации данных геофизических исследований (акустических, электрических), в результате чего часто невозможно провести границу между талыми и мёрзлыми породами.
Например, о том, что при вымерзании насыщенных солями водных плёнок на их месте образуются новые криогенные минералы. Или о том, как по неизолированным (сообщающимися друг с другом) рыхлым плёнкам незамёрзшей воды мигрируют ионы солей или микроорганизмы, и иногда на значительные расстояния от места своего проникновения в плёночную воду. А ещё – о том, как высокое содержание незамёрзшей воды «стирает» разницу в показателях для талых и мёрзлых пород при интерпретации данных геофизических исследований (акустических, электрических), в результате чего часто невозможно провести границу между талыми и мёрзлыми породами.
Но все это, и ещё много другое мы вынуждены оставить за рамками этой ознакомительной статьи. И мы будем рады, если то немногое, что нам удалось рассказать, сможет пробудить в читателях интерес к такому парадоксальному, на первый взгляд, явлению, присущему Арктике, как существование в мёрзлых породах незамерзающей воды.
Авторы: Чувилин Е. М., Соколова Н.С., Центр добычи углеводородов Сколтеха.
М., Соколова Н.С., Центр добычи углеводородов Сколтеха.
Почему вода замерзает
Поиск
- Дом
- Выход из системы… Выключение… Выходите наружу!
- Почему вода замерзает?
Почему вода замерзает?
Температура замерзания воды составляет 32°F. Молекулы воды всегда движутся. При повышении температуры эти молекулы движутся быстрее. При понижении температуры они двигаются медленнее. Замерзание происходит, когда молекулы жидкости становятся настолько холодными, что
достаточно замедлиться, чтобы зацепиться друг за друга. Этот процесс формирует твердый кристалл. Лед расширяется и на самом деле менее плотный, чем вода, что объясняет, почему кубики льда плавают.
Это очень важно для выживания многих наших пресноводных организмов. Лед на поверхности пруда зимой фактически изолирует воду под ним. Это предохраняет его от замерзания, поэтому рыбы и другие животные могут выжить, не беспокоясь о
твердая заморозка!
Температуру замерзания воды можно изменить, добавив в воду примеси. Добавление соли на наши дороги и тротуары снижает температуру замерзания воды. Этот процесс борьбы с обледенением замедляет образование льда на дороге.
Добавление соли на наши дороги и тротуары снижает температуру замерзания воды. Этот процесс борьбы с обледенением замедляет образование льда на дороге.
Видели ли вы во время прогулок по паркам каких-нибудь природных ловцов солнца, называемых сосульками?
Воспользуйтесь этими инструкциями по изготовлению Ледяного Ловца Солнца, чтобы создать по-настоящему крутую ледяную картину.
Оповещения Метропарка
Закрытие на День благодарения в 2022 году
Офисы MetroParks и приемные центры будут закрыты в четверг, 24 ноября, и в пятницу, 25 ноября 2022 г., в связи с праздником Благодарения. Офисы и приемные центры возобновят работу в обычном режиме в субботу, 26 ноября.
Приветственный центр VOA, осенне-зимние часы
Приветственный центр в Voice of America MetroPark начнет работу в осенне-зимний период 22 января. Приветственный центр будет открыт с 8:30 до 17:00 со среды по пятницу и иногда с 9:00 до 15:00 по выходным. Дополнительную информацию можно получить по телефону (513) 867-5835.
Дополнительную информацию можно получить по телефону (513) 867-5835.
Строительство пешеходного моста Dry Fork Осень 2022 г.
Начато строительство пешеходного моста Драй-Форк в Метропарке губернатора Бебба. Строительство может потребовать закрытия некоторых кемпингов в кемпинге Dry Fork Campground у губернатора Бебба. Если у вас есть какие-либо вопросы о закрытии кемпинга, свяжитесь с отделом обслуживания посетителей MetroParks по телефону (513) 867-5835 или по адресу электронной почты [email protected].
2022 Закрытие Метропарка Гилмор
В Gilmore MetroPark действует закрытие, чтобы облегчить проект строительства Miami 2 Miami Trail в Гилморе. Чтобы узнать о текущих закрытиях парка, посетите раздел «Новости» на веб-сайте MetroParks.
Create Family Fun
MetroParks предоставляет возможность насладиться открытыми зелеными насаждениями рядом с домом. Выберите время дня, которое соответствует вашему напряженному графику, чтобы провести время на природе. Прогуляйтесь по тропе, побродите по естественной среде обитания, понаблюдайте за дикой природой или просто поиграйте! Пожалуйста, рассмотрите возможность пожертвования на дальнейшую способность MetroParks предоставлять эти ресурсы.
Прогуляйтесь по тропе, побродите по естественной среде обитания, понаблюдайте за дикой природой или просто поиграйте! Пожалуйста, рассмотрите возможность пожертвования на дальнейшую способность MetroParks предоставлять эти ресурсы.
Пожертвовать сейчас
Замерзающая вода | Физика Фургон
Категория
Выберите категориюО фургоне физикиЭлектричество и магнитыВсе остальноеСвет и звукДвижение вещейНовая и захватывающая физикаСостояния материи и энергииКосмосПод водой и в воздухе
Подкатегория
Поиск
Задайте вопрос
Последний ответ: 22.10.2007
В:
Мне было интересно, как именно вода замерзает и как добавленные растворители/растворенные вещества влияют на процесс замерзания.
— Энджи (14 лет)
JHS, NYC, NY
A:
Привет, Энджи,
Замерзающая вода является примером фазового перехода — изменения физических свойств вещества при изменении температуры или давления. Фазовые переходы часто сопровождаются либо поглощением, либо выделением тепловой энергии.
Фазовые переходы часто сопровождаются либо поглощением, либо выделением тепловой энергии.
Молекулы воды обладают электрическим дипольным моментом — атомы кислорода заряжены более отрицательно, чем атомы водорода, и молекула имеет изогнутую форму, причем атомы водорода расположены не совсем по разные стороны от кислорода. Это означает, что молекулы воды сильно электростатически притягиваются друг к другу (разноименные заряды притягиваются друг к другу). Если нет слишком большого беспорядочного движения молекул (то есть вода не слишком горячая), то молекулы предпочитают выстраиваться упорядоченно, с положительно заряженной частью одной молекулы рядом с отрицательно заряженной. -заряженная часть другой молекулы и так далее, скрепленные в жесткий кристалл. Если молекулы обладают большей тепловой энергией, они трясутся и отрываются от своих соседей. Они по-прежнему любят держаться друг за друга, но из-за того, что они так много двигаются, они постоянно меняют своих соседей и отскакивают друг от друга. Это жидкая фаза.
Это жидкая фаза.
Лед на самом деле менее симметричен, чем жидкая вода. В жидком состоянии все направления кажутся одинаковыми, и все места в жидкости обладают такими же свойствами, как и все остальные. Со льдом дело обстоит иначе — кристаллы указывают в определенных направлениях на больших расстояниях (вам все еще может понадобиться микроскоп, чтобы хорошо их разглядеть, например, для снежинки, но кристаллы все равно очень велики по сравнению с хаотичностью на молекулярном уровне в жидкой воде). ). Замерзающие переходы веществ связаны с уменьшением их пространственной симметрии или, иначе говоря, с увеличением упорядоченности расположения молекул.
Когда вода замерзает, молекулы отдают часть своей энергии окружающей среде (посредством теплопроводности или излучения, а в макроскопических масштабах, конечно, благодаря конвекции) и замедляются. Они начинают прилипать друг к другу, и по мере образования постоянных связей высвобождается дополнительная энергия (требуется энергия, чтобы разъединить молекулы, и вы получаете энергию обратно, когда позволяете им прилипать друг к другу). Количество высвобождаемой энергии составляет 80 калорий на грамм воды при замерзании.
Количество высвобождаемой энергии составляет 80 калорий на грамм воды при замерзании.
Любопытная вещь о воде: жидкая вода с температурой, близкой к точке замерзания, на самом деле более плотная, чем лед, из-за того, что кристаллическое расположение молекул воды во льду не является максимально плотной упаковкой из-за формы молекулы. Вы можете . Я предполагаю, что это также идет в противоположном направлении — вода может снова замерзнуть, как только давление исчезнет. Но, конечно, как всегда, 80 калорий на грамм нужно добавлять, когда лед тает, и убирать, когда он снова замерзает.
Если что-то растворить в воде, то температура замерзания раствора будет ниже, чем у одной воды. . Причина этого в том, что соль, на самом деле ионы натрия и хлорида в растворе, «мешают» способности воды образовывать красивый, упорядоченный кристалл, поэтому, когда формируется кристалл льда, почти вся соль остается. в жидкости. Это означает, что замерзание воды не только выравнивает молекулы воды, но и ограничивает пространство, которое ионы соли могут перемещать. Это усложняет заморозку. Другие добавки к воде будут иметь аналогичный эффект. Например, вы можете попробовать поэкспериментировать с сахаром, чтобы увидеть, как его концентрация влияет на температуру замерзания воды. Некоторые вещества не растворяются в воде (например, масло) и не влияют на температуру замерзания, хотя нанесение масла на поверхность воды может влиять на скорость поступления и оттока тепла. емкость с водой.
Это усложняет заморозку. Другие добавки к воде будут иметь аналогичный эффект. Например, вы можете попробовать поэкспериментировать с сахаром, чтобы увидеть, как его концентрация влияет на температуру замерзания воды. Некоторые вещества не растворяются в воде (например, масло) и не влияют на температуру замерзания, хотя нанесение масла на поверхность воды может влиять на скорость поступления и оттока тепла. емкость с водой.
Том(+мв)
(опубликовано 22.10.2007)
Дополнение №1: Замораживание изменения энергии?
Q:
Является ли замерзание воды изменением энергии? если это изменение энергии?
— Аноним
Австралия
A:
Большое изменение энергии при замерзании воды происходит в потенциальной энергии взаимодействия между молекулами воды. Во льду молекулы соприкасаются так, что эта энергия снижается. В жидкости расположение менее правильное, и энергия не так сильно понижена.
Майк В.
Замораживание — это изменение порядка или структуры молекул. Кристалл льда имеет меньшую пространственную симметрию (определенные оси кристалла определены в пространстве), чем вода (каждое направление так же хорошо, как и любое другое направление). С этим переходом связана энергия — 80 калорий на грамм льда необходимо для растапливания льда при 0°C при обычном давлении, а 80 калорий на грамм воды выделяется в процессе замораживания.
Том
(опубликовано 22.10.2007)
Дополнение #2: замораживание духов
Вопрос:
что происходит, когда мы замораживаем духи после смешивания воды, спирта и ароматизатора. Как охлаждение до -4 градусов по Цельсию помогает различным веществам смешиваться друг с другом
— Али Ашхад (61 год)
Шарджа, ОАЭ
A:
Если вы частично заморозите водно-спиртовую смесь с некоторыми органическими растворенными веществами, образовавшийся лед будет почти чистой водой.
