Содержание
Какими свойствами (плотностью и другими) обладает тяжелая вода?
Содержание
- Особенности жидкости
- Физические характеристики
- Цвет, запах, вкус
- Температура кипения и замерзания
- Плотность
- Молярная масса
- Вязкость
- Растворимость
- Сравнение h3O (легкой) и D2O
- Видео по теме статьи
- Заключение
Особенности жидкости
В ее составе находится дейтерий, более тяжелый изотоп водорода. Благодаря такому изменению, вода принимает структуру D2O.
Наличие дейтерия определяет и основную характеристику: такая вода практически не поглощает нейтроны, что позволяет существенно замедлять их. Именно за это свойство, тяжелую воду стали применять в реакторах, но она не является радиоактивной.
Еще одним свойством является предотвращение размножения бактерий и микроорганизмов, что существенно сказывается на чистоте жидкости.
Данный факт позволяет употреблять жидкость в медицинских целях, но в малых дозах, для предотвращения раковых заболеваний.
Физические характеристики
Рассмотрим различные характеристики.
Цвет, запах, вкус
Тяжелая вода по своей прозрачности не отличается от обычной. На степень ее прозрачности также влияют различные примеси. В естественных условиях, такая вода не имеет цвета, но может отличаться по уровню прозрачности, в зависимости от количества растворенных в ней примесей, насыщения живыми организмами и бактериями.
Запаха такая вода также не имеет, если является чистой. По данному свойству она также не отличается от легкой структуры, имея зависимость от примесей, растворенных элементов, подвержена тухлости.
По вкусу этот тип воды отличается от обычной. У нее сладковатый привкус. Причина кроется не в составе, а в наличие ядерного квантового эффекта, который приводит к активации вкусовых рецепторов человека, отвечающих за ощущение сладости.
Температура кипения и замерзания
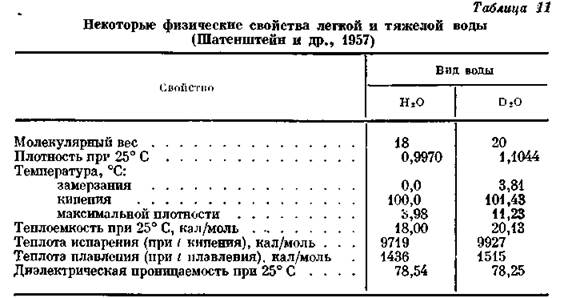
Температура кипения составляет 101,7 градусов, а замерзает тяжелая вода при 3,8 градусах.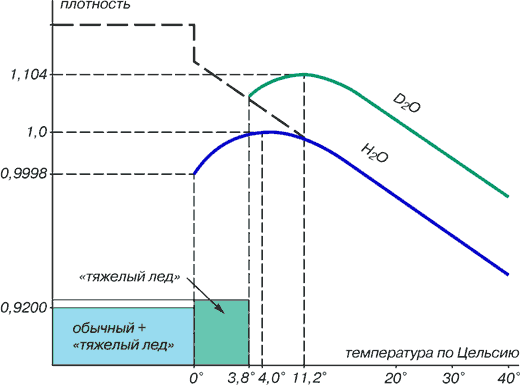 Отличие небольшое, но оно прямо указывает на то, что дейтерий тяжелее протия, который является более легким изотопом водорода, составляющим молекулярную структуру обычной (легкой) воды.
Отличие небольшое, но оно прямо указывает на то, что дейтерий тяжелее протия, который является более легким изотопом водорода, составляющим молекулярную структуру обычной (легкой) воды.
Плотность
Плотность, при 25 градусах Цельсия, составляет 1,1042 г/см3 против 0,9 г/см3 легкого состава.
Именно более высокая плотность способствует снижению свойства поглощать нейтроны, замедляет различного рода реакции.
Такая разница приемлема только для специально обогащенной жидкости. В естественных условиях концентрация атомов дейтерия составляет всего 1 к 7600 атомам протия.
Молярная масса
Молярная масса тяжелого состава 20,04 г/моль, что гораздо тяжелее легкой структуры 18,01 г/моль. Молекулярные массы этих жидкостей равны молярным. Тяжелая вода немногим тяжелее обычной, за счет веса молекулы дейтерия (атомная масса 2), относительно протия (атомная масса 1).
Вязкость
За счет увеличения веса, увеличивается и динамическая вязкость состава.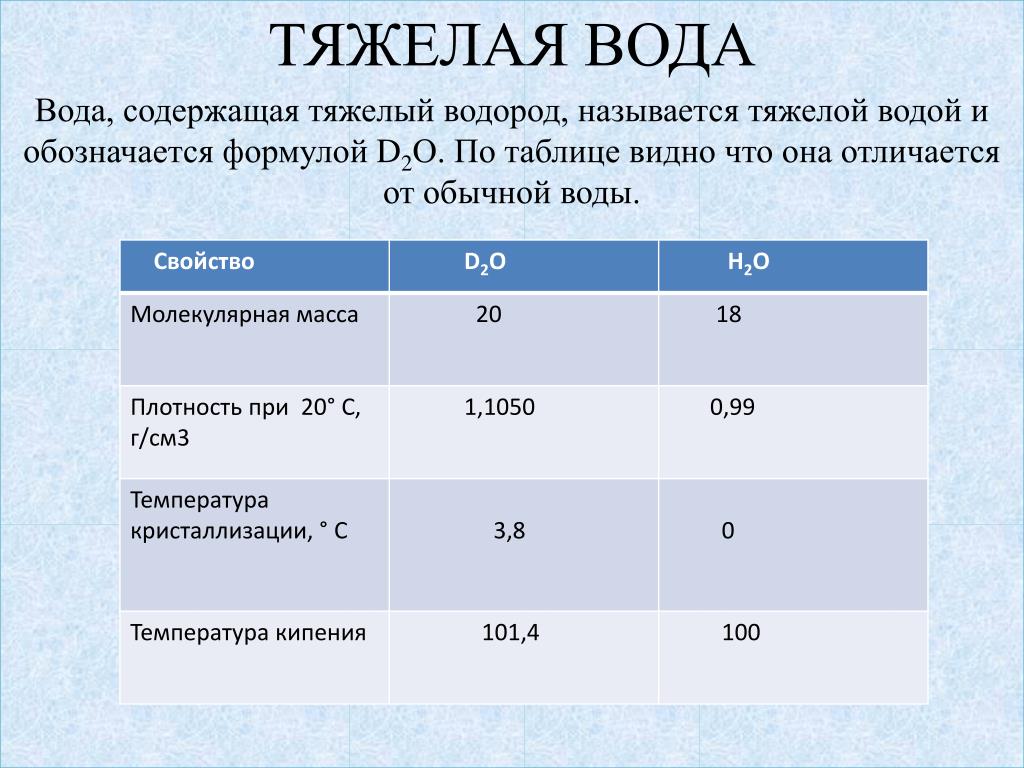 Единицей измерения этого параметра является сантипуаз (сП). У тяжелой воды он составляет 1,2 П, против 1 П легкого состава. Этот параметр также учитывается при условии направленного обогащения воды атомами дейтерия.
Единицей измерения этого параметра является сантипуаз (сП). У тяжелой воды он составляет 1,2 П, против 1 П легкого состава. Этот параметр также учитывается при условии направленного обогащения воды атомами дейтерия.
Растворимость
В обычной воде обладает неограниченной растворимостью, при контакте с эфиром наблюдается замедление растворимости. Также растворима в этаноле. На данную характеристику дополнительно влияет вес состава.
Так соль или иные кристаллические примеси не растворяются в такой воде из-за большой концентрации тяжелого изотопа водорода.
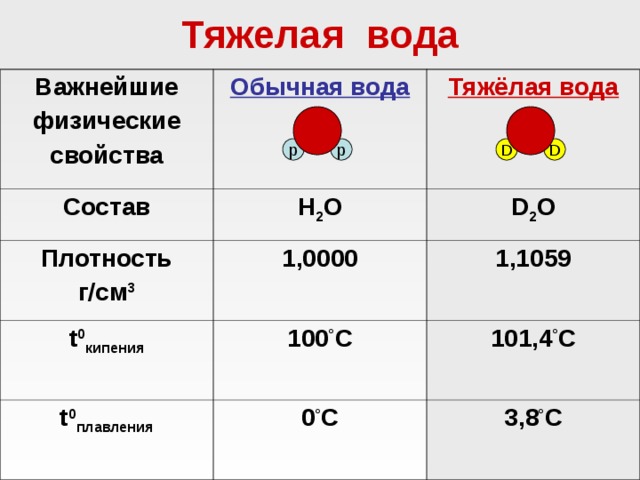
Сравнение h3O (легкой) и D2O
Ниже приведена более подробная таблица отличий двух составов воды по свойствам:
| Свойства | D2O тяжелая вода | h3O легкая вода |
| Молярная масса | 20,04 г/моль | 18,01 г/моль |
| Плотность | 1,1042 г/см³ | 0,9 г/см |
| Вязкость динамическая | 0,00125 Па | 0,0008 Па |
| Плавление °С | 3,8 | 0,0 |
| Кипение °С | 101,4 | 99,9 |
| Давление критическое | 21,4 МПа | 22,06 МПа |
| Теплоемкость | 4,105 Дж/кг | 4,18 Дж/кг |
| Натяжение поверхности | 71,87 дин/см | 71,98 дин/см |
| Энтальпия | -294,6 кДж/моль | 419 кДж/моль |
| Энтропия | 75,9 Дж/моль | 48 Дж/моль |
| Ph | 7,4 | 7 |
Как видно из таблицы, тяжелая вода по многим характеристикам превосходит более «легкий вариант». Причиной тому является превосходство в весе молекул дейтерия.
Причиной тому является превосходство в весе молекул дейтерия.
Видео по теме статьи
О свойствах тяжелой воды расскажет видео:
Заключение
Свойства тяжелой вода делают ее полезной в промышленности, особенно в ядерной физике. На основе этого вещества разрабатывается совершенно новый вид энергии – термоядерный синтез.
В быту мы также часто встречаем тяжелую воду, так как она нередко является частью обычной питьевой воды. Например, именно из тяжелой воды образуется самая верхняя ледяная корка при замерзании, так как температура плавления этой жидкости составляет 3,8 градуса.
А какова Ваша оценка данной статье?
Загрузка…
|
М.
Тяжелая вода очень дорога и дефицитна. Однако если удастся найти дешевый и практичный способ ее получения, то области применения этого редкого пока ресурса заметно расширятся. Могут открыться новые страницы в химии, биологии, а это новые материалы, неизвестные соединения, может быть, и неожиданные формы жизни.
Рис. 1.
Вода в природе бывает нескольких «сортов». Обычная, или протиевая (Н2О).
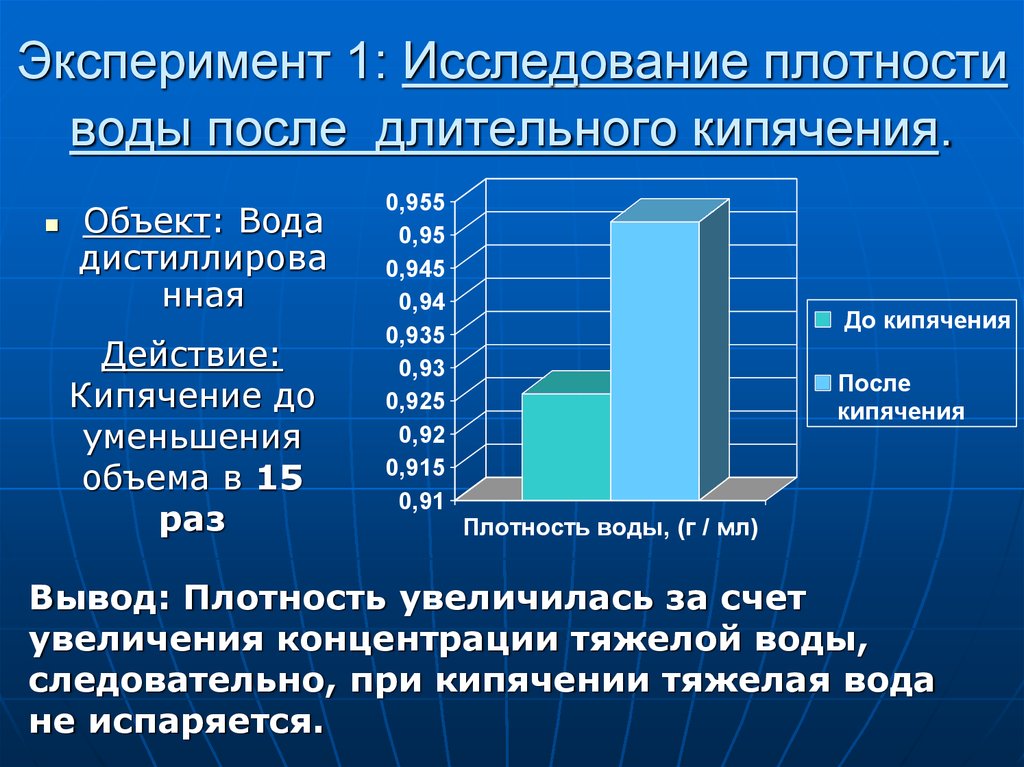
Если мы откроем водопроводный кран и наберем чайник, то там будет не однородная вода, а ее смесь. При этом дейтериевых «вкраплений» окажется очень немного — примерно 150 граммов на тонну. Получается, что тяжелая вода есть повсюду — в каждой капле! Проблема в том, как ее взять. Ныне во всем мире ее добыча связана с огромными затратами энергии и очень сложным оборудованием.
Однако есть предположение, что на планете Земля возможны такие природные ситуации, когда тяжелая и обычная вода на какое-то время отделяются одна от другой — D2O из рассеянного, «растворенного» состояния переходит в концентрированное. Так, может быть, существуют месторождения тяжелой воды? Пока однозначного ответа нет: никто из исследователей этим вопросом прежде не занимался.
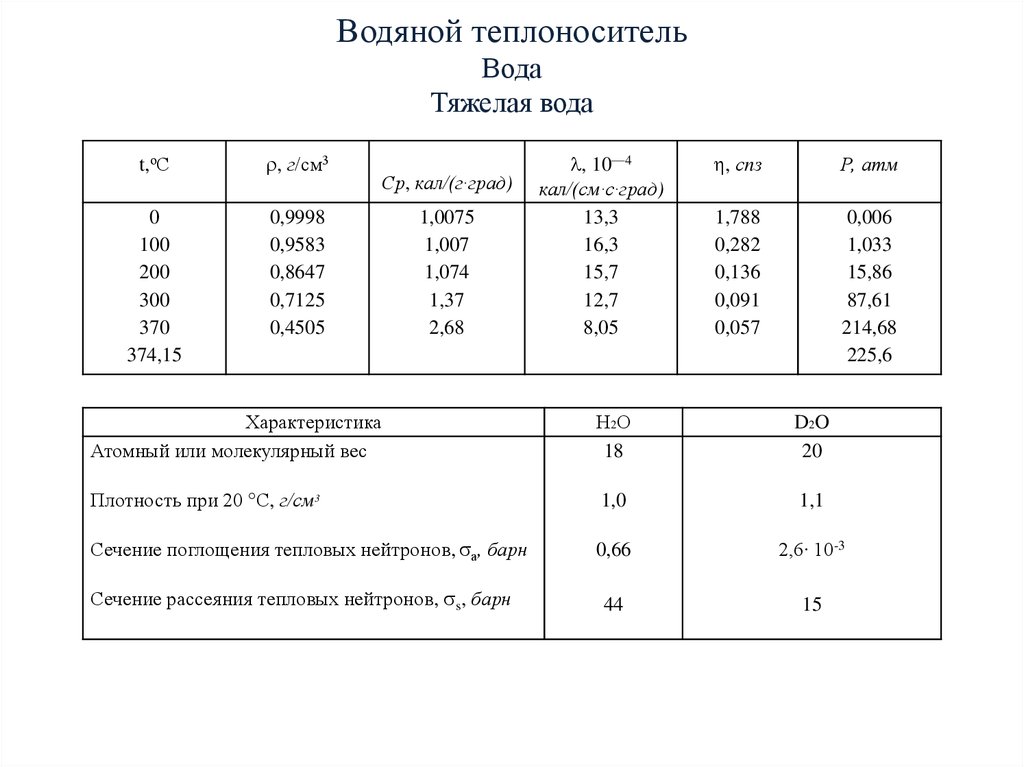
А вместе с тем известно, что физико-химические свойства D2O совсем иные, чем у Н20 — ее постоянного спутника. Так, температура кипения тяжелой воды +101,4°С, а замерзает она при +3,81°С. Ее плотность на 10 процентов больше, чем у обычной.
Надо также заметить, что происхождение тяжелой воды, по-видимому, сугубо земное — в космосе ее следов не обнаружено. Дейтерий образуется из протия вследствие захвата им нейтрона космического излучения. Мировой океан, ледники, атмосферная влага — вот природные «фабрики» тяжелой воды.
Рис. 2. Зависимость плотности обычной и тяжелой воды от температуры. Разница в плотности одной и другой разновидностей воды превышает 10%, и поэтому возможны условия, когда переход в твердое состояние при охлаждении происходит вначале у тяжелой воды, а затем у обычной. Во всяком случае, физика не запрещает появления участков твердой фазы с повышенным содержанием дейтерия. Такому «тяжелому» льду на диаграмме соответствует заштрихованный участок.
Итак, поскольку есть заметная разница в плотности между D2O и Н2О, то именно плотность, а также агрегатное состояние и могут служить наиболее чувствительными критериями в поисках возможных месторождений тяжелой воды — ведь эти критерии связаны с температурой окружающей среды. А как известно, окружающая среда наиболее «контрастна» в высоких широтах планеты.
Но к настоящему времени сложилось мнение, что воды высоких широт бедны дейтерием. Поводом к этому стали результаты исследований проб воды и льда из Большого Медвежьего озера в Канаде и из других северных водоемов. Обнаружились также колебания в содержании дейтерия по сезонам года — зимой, например, в реке Колумбия его меньше, чем летом. Эти отклонения от нормы связывались с особенностями распределения атмосферных осадков, которые, как принято предполагать, «разносят» дейтерий по планете.
Похоже, что никто из исследователей сразу не заметил скрытого противоречия в этом утверждении. Да, атмосферные осадки влияют на распределение дейтерия по водоемам планеты, однако они никак не влияют на глобальный процесс образования дейтерия!
Когда на Севере наступает осень, в реках начинается быстрое остывание водной массы, которое убыстряется под воздействием вечной мерзлоты, одновременно идет ассоциация молекул H2O. Наконец, наступает критический момент максимальной плотности — температура воды всюду чуть ниже +4°С. И тогда в придонной зоне на некоторых участках интенсивно намораживается рыхлый подводный лед.
В отличие от обычного льда он не имеет правильной кристаллической решетки, у него иная структура. Центры его кристаллизации различны: камни, коряги и разные неровности, причем не обязательно лежащие на дне и связанные с мерзлым грунтом. Появляется рыхлый лед на реках глубоких, со спокойным — ламинарным — течением.
Подводное ледообразование обычно заканчивается тем, что льдины всплывают на поверхность, хотя в это время никакого другого льда нет.
Можно допустить, что рыхлый лед представляет собой обогащенные концентрации тяжелой воды. Кстати, если это так, то нужно помнить, что тяжелая вода не отличима от обычной, однако потребление ее внутрь организма может вызвать тяжелые отравления. К слову сказать, местные жители высоких широт не употребляют речной лед для приготовления пищи — только озерный лед или снег.
«Механизм» фазового перехода D2O в реке очень напоминает тот, что используется химиками в так называемых кристаллизационных колоннах. Только в северной реке «колонна» растянута на сотни километров и не столь контрастна по температурному режиму.
Если же иметь в виду, что через центры кристаллизации в реке за короткое время проходят сотни и тысячи кубических метров воды, из которых превращается в лед — намораживается — пусть тысячная доля процента, то и этого достаточно, чтобы говорить о способности тяжелой воды концентрироваться, то есть образовывать месторождения.
Только присутствием таких концентраций можно объяснить тот доказанный факт, что зимой в северных водоемах процентное содержание дейтерия заметно уменьшается. Да и полярные воды, как показывают пробы, тоже бедны дейтерием, и в Арктике, вполне вероятно, есть районы, где плавают в основном только льдины, обогащенные дейтерием, — ведь рыхлый донный лед появляется первым и тает последним.
Больше того, как показали исследования, ледники и льды высоких широт в целом богаче тяжелыми изотопами, чем воды, омывающие льды. Например, в Южной Гренландии, в районе станции «Дай-3», выявлены изотопные аномалии на поверхности ледников, и происхождение таких аномалий пока не объяснено. Значит, могут встретиться и льдины, обогащенные дейтерием. Дело, как говорится, за малым — нужно найти эти пока еще гипотетические месторождения тяжелой воды. |
Тяжелая вода — термофизические свойства
Тяжелая вода ( Оксид дейтерия , 2 H 2 O , D 2 O ) — это форма воды, которая содержит больше нормального количества. изотоп водорода дейтерий (= тяжелый водород = 2 H = D), а не обычный изотоп водорода-1 ( 1 H = H = протий), который составляет большую часть водорода в обычной воде.
изотоп водорода дейтерий (= тяжелый водород = 2 H = D), а не обычный изотоп водорода-1 ( 1 H = H = протий), который составляет большую часть водорода в обычной воде.
Термодинамические свойства тяжелой воды — D 2 O:
- Температура кипения (при 101,325 кПа): 101,40 O C = 214,52 ° F
- Elastus Elastus Modulus (при 25 ° C): 2,10 x 100008 Pa или n/M 2 2 2
- Критическая плотность: 0,356 г/см 3 = 0,691 SLUG/FT 3 = 3,457 LB M /GAL (US)
- Критическое давление: 213,88 атм = 220,98 бар = 21,671 МПа (мн/М 9 9.0008 2 ) = 3143 фунтов на квадратный дюйм (= LB F /в 2 )
- Критическая температура: 370,697 O C = 699,255 ° F
- Константа иониза
- скрытая тепло испарения (при 101,4 ° C): 41,521 кДж/моль = 2073,20 кДж/кг = 891,32 BTU (IT)/LB
- Латентная тепло слияния: 6,132 кДж/моль = 30,2 кДж/кг = 131, ИТ)/фунт
- Максимальная плотность (при 11,23 O C): 1105,9 кг/м 3 = 2,1460 SLUG/FT 3 = 10,74048 фунт M /Гал (США)
- ТЕМПЕРАТИВНАЯ O C = 38,86 ° F
- Молярная масса: 20,02751 г/моль
- PD (~ pH) (при 25 ° C): 7,43
- Удельное тепло (C P ) Вода (при 20 ° C): 4,219 кДж/кгК = 1,008 БТЕ(ИТ)/(фунт м ° F) или ккал/(кг K)
- Удельный вес (при 11,23 O C): 10,8452 кН/м 3 = 69,0391 фунт F /FT 3
- Тенсинь 25 ° C): 71,87 DYN /CM
- ДАВЛЕНИЕ ТРЕМЕННОЙ ПУНКИ: 0,00652 АМТ = 0,00661 бар = 661 PA = 0,0959 фунтов на квадратный дюйм (= LB F /в 2 )
- ТЕМПЕРАТИЯ ТРЕМНА: 3,82 ° C = 38,88 °.
 Ф
Ф - Давление паров (при 25 ° C): 20,6 мм рт. Ст. = 0,027 атм = 0,028 бар = 2750 PA = 0,398 фунтов на кв. Дюйм
- Взысканность (при 20 ° C): 1,251 CP или MPA S
Ionizat нормальной и тяжелой воды различной температуры.
См. также подробнее об атмосферном давлении, а также СТП – Стандартная температура и давление и НТП – Нормальная температура и давление,
, а также Теплофизические свойства : ацетон, ацетилен, воздух, аммиак, аргон, бензол, бутан, двуокись углерода, окись углерода, этан, этанол, этилен, гелий, водород, сероводород, метан, метанол, азот, кислород, пентан, пропан, толуол и Вода.
Максимальная плотность тяжелой воды при 11,6 градуса Цельсия?
спросил
Изменено
5 лет, 7 месяцев назад
9оС}$.

 АДЖИЕВ
АДЖИЕВ Тяжелая, или дейтериевая (D2O). Сверхтяжелая, или тритиевая (Т2О), но ее в природе почти нет. Различается вода и по изотопному составу кислорода. Всего же насчитывается не менее 18 ее изотопных разновидностей.
Тяжелая, или дейтериевая (D2O). Сверхтяжелая, или тритиевая (Т2О), но ее в природе почти нет. Различается вода и по изотопному составу кислорода. Всего же насчитывается не менее 18 ее изотопных разновидностей.
 Если бы вода была «нормальной», а не аномальной жидкостью, то зависимость плотности от температуры имела бы вид, показанный пунктирной линией.
Если бы вода была «нормальной», а не аномальной жидкостью, то зависимость плотности от температуры имела бы вид, показанный пунктирной линией.
 Подводный лед иногда появляется и летом. Возникает вопрос: что это за «вода в воде», которая меняет свое агрегатное состояние, когда установившаяся температура в реке слишком высока для того, чтобы в лед превращалась обычная Н2О, чтобы, как говорят физики, произошел фазовый переход?
Подводный лед иногда появляется и летом. Возникает вопрос: что это за «вода в воде», которая меняет свое агрегатное состояние, когда установившаяся температура в реке слишком высока для того, чтобы в лед превращалась обычная Н2О, чтобы, как говорят физики, произошел фазовый переход?
 Ф
Ф