Содержание
Решение задачи
Задача 10
-
Реакция разложения карбоната двухвалентного металла: MCO3 → MO + CO2↑, т.е. потеря массы приходится на CO2. Следовательно, остальные 64,9% – это оксид металла, и M(MO)/M(CO2)=64,9/35,1 ⇒ M(MO)=44,0·64,9/35,1=81,4 а.е.м. Отсюда M (M) = 65.4 и М = Zn.
-
ZnO+ 2HCl → ZnCl2+ H2O; ZnO+ 2NaOH + H2O → Na2[Zn(OH)4].
-
nH2O: M(Zn(NO3)2·nH2O)/M(Zn(NO3)2) = 100% / 63,7% = (189,4 + 18n) / 189,4; n=6.
-
Процентная концентрация фактически дана в условии задачи: ω=63,7%; смас=63,7/(100/1,4)=0,892г/мл; смол = смас/M(Zn(NO3)2)=0,00471 моль/мл.
-
Zn(NO3)2→ ZnO + 2NO2↑+ ½O2↑.
 ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.
ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.
Задача 100
Масса смеси составит 3,5*106*0,584 = 2044000 г или 2044 кг. Пропана в смеси 0,58*2044 = 1185,5 кг или 1185,5/44 = 26,94 кмоль. Бутана в смеси 0,42*2044 = 858,5 кг или 858,5/58 = 14,80 кмоль. Мольное отношение пропан/бутан составляет 1,82, общее количество молекул в цистерне газовоза (26,94 + 14,80)*103*6,02*1023 = 2,51*1028, атомов (26,94*11 + 14,80*14)*103*6,02*1023 = 3,03*1029 шт. Объем газообразной смеси при н.у. равен (26,94 + 14,80)*103*22,4 = 935*103 л или 935 м3, что в 935/3,5 = 267 раз больше объема жидкости.
- С3Н8 + 5О2 = 3СО2 + 4Н2О(ж) (DrQ0= 3*393,5 + 4*241,8 – 103,9 = 2043,8 кДж/моль).

С4Н10 + 6,5О2 = 4СО2 + 5Н2О(ж) (DrQ0= 4*393,5 + 5*241,8 – 126,2 = 2656,8 кДж/моль). - При сгорании всей смеси, содержащейся в газовозе, выделится 26,94*103*2043,8 + 14,80*103*2656,8 = (55060 + 39321)*103 кДж = 94,4*106 кДж тепла.
- Масса бензина (октана) 3,5*106*0,703 = 2460500 г или 2460,5 кг. Его количество 2460,5/114 = 21,58 кмоль. Теплота сгорания: С8Н18 + 12,5О2 = 8СО2 + 9Н2О(ж) (DrQ0= 8*393,5 + 9*241,8 – 249,9 = 5074,3 кДж/моль). Количество тепла, которое выделится при сгорании всего бензина 21,58*103*5074,3 = 109,5*106 кДж. Получается, что приобретать пропан-бутановую смесь выгоднее в 94,4*106/3 : 109,5*106/5 = 1,44 раза.
- СН3-СH2-CH(СН3)-CH2-CH2-CH2-CH3(3-метилгептан) – 8 монохлорпроизводных; а) (СН3)3С-С(СН3)3 (2,2,3,3-тетраметилбутан) – 1; б) СН3-CH2-СH2-CH(СН3)-CH2-CH2-CH3(4-метилгептан) – 5.

Задача 101
1. Поскольку при сжигании Х были получены только углекислый газ и вода, Х могло содержать углерод, водород и кислород. Найдем количество образовавшихся при сгорании Х веществ: n(СО2) = 10,08 / 22,4 = 0,45 моль; n(Н2О) = 3,6 /18 = 0,2 моль. Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 — (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
2-3. Поскольку соединение содержит один атом кислорода, оно может быть спиртом, альдегидом, кетоном или простым эфиром. Х реагирует с аммиачным раствором оксида серебра(I), при нагревании его с гидроксидом меди(II) наблюдается выпадение красного осадка. Эти реакции указывают на наличие альдегидной группы в составе Х (Х можно отнести к классу альдегидов).
Т.к. вещество Х обесцвечивает бромную воду, оно может содержать в составе молекулы кратные связи (Х можно отнести к непредельным соединениям). Поскольку при окислении перманганатом калия образуется бензойная кислота (Х можно отнести к ароматическим соединениям), единственным соединением, которое удовлетворяет всем условиям, является 3‑фенилпропеналь (коричный альдегид).
3.Уравнения описанных в условии задачи реакций:
4. Коричный альдегид может существовать в виде цис- и транс-изомеров.
Задача 102
1. Рассмотрим схему превращений, основанную на применении этилена в качестве исходного соединения. Этилен при окислении, в присутствии металлического серебра в качестве катализатора окисляется кислородом до этиленоксида (соединение V). Более старым способом его получения является хлорирование этилена в водном растворе, с образованием 2-хлорэтанола (Б), который далее обрабатывают гидроксидом кальция при нагревании. Другим важным мономером, получаемым из этилена, является винилхлорид (III), который образуется при пиролизе 1,2-дихлорэтана (А). Промышленным методом получения 1,2-дихлорэтана является нагревание этилена со смесью хлороводорода и кислорода в присутствии катализатора. При нагревании этилена с уксусной кислотой в присутствии кислорода воздуха образуется винилацетат (IV). Этот процесс имеет сложный многостадийный характер и представляет собой одну из модификаций Вакер-процесса.
Рассмотрим вторую схему превращений. На первой стадии пропилен в условиях кислотного катализа присоединяет воду, образуя изопропиловый спирт (В), который далее превращается в ацетон (Г). Следующая стадия представляет собой реакцию нуклеофильного присоединения синильной кислоты к ацетону с образованием соответствующего циангидрина (Д). При неполном гидролизе нитрильной группы получается амид Е, который при нагревании с метанолом дает метилметакрилат (V).
Решение задачи 103
Решение задачи 104
Решение задачи 105
Решение задачи 11
8 класс. Химия. Вода и ее свойства — Вода и ее свойства
Комментарии преподавателя
Вода в природе
Вода – самое распространенное вещество на Земле. Поверхность земного шара на 3/4 покрыта водой, в довольно больших количествах вода находится в атмосфере, а также в земной коре. Основное количество воды содержится в океанах (около 97,6%), запасы же пресной воды достаточно ограничены. Около 85% всех запасов пресной воды сосредоточено в ледниках.
Основное количество воды содержится в океанах (около 97,6%), запасы же пресной воды достаточно ограничены. Около 85% всех запасов пресной воды сосредоточено в ледниках.
Вода – единственное вещество, которое встречается на Земле в трех агрегатных состояниях: твердом (лед), жидком и газообразном (водяной пар).
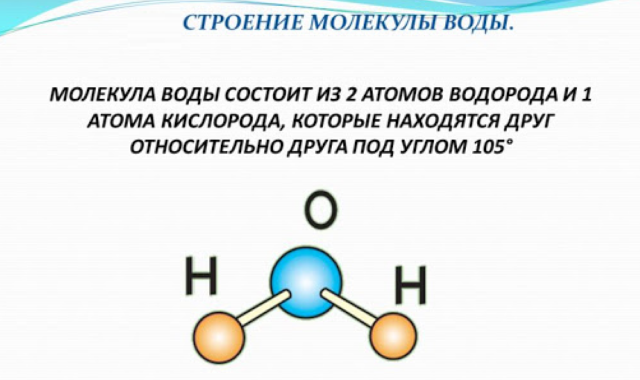
Состав молекулы воды вам хорошо знаком: на два атома водорода в молекуле воды приходится один атом кислорода, е химическая формула – Н2О. Такой состав был установлен еще А.Л. Лавуазье и подтверждается результатами эксперимента по разложению воды, когда на 1 объем выделяющегося кислорода приходится два объема выделяющегося водорода.
Вы уже знакомы с некоторыми химическими свойствами воды. При пропускании через воду электрического тока (или при нагревании до 2000˚С) вода разлагается на водород и кислород. Вода может вступать в реакцию соединения со многими оксидами.
Пример такой реакции вам хорошо знаком. Так называемое «гашение извести» — взаимодействие оксида кальция с водой.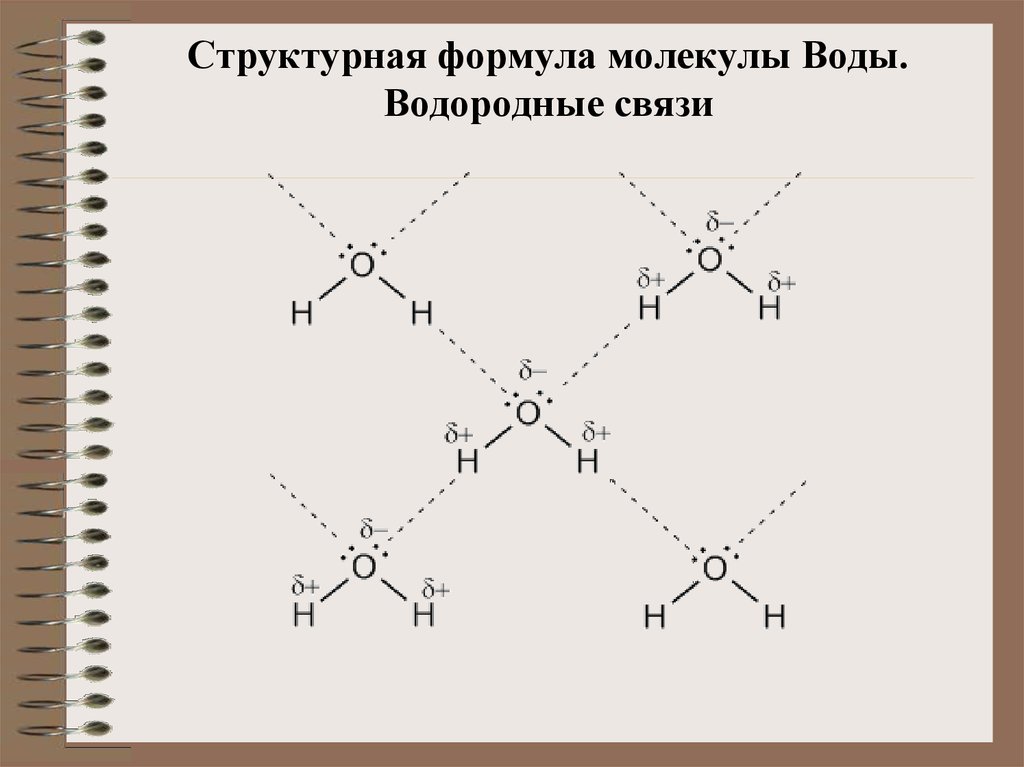 В результате этой реакции образуется гашеная известь – гидроксид кальция. Эта реакция является экзотермической, т.е. протекает с выделением тепла.
В результате этой реакции образуется гашеная известь – гидроксид кальция. Эта реакция является экзотермической, т.е. протекает с выделением тепла.
СаО + Н2О = Са(ОН)2 + Q
Вода способна вступать в реакции замещения с активными металлами. Например, кальций взаимодействует с водой с образованием гидроксида кальция и водорода.
Са + 2Н2О = Са(ОН)2 + Н2↑ + Q
В результате этой реакции выделяется большое количество теплоты.
Вода из природных источников не всегда пригодна для питья и даже промышленных процессов. Поэтому ее подвергают очистке. Питьевая вода не должна содержать нерастворенных примесей и болезнетворных микроорганизмов. Сначала воду из рек, озер и прудов отстаивают в специальных бассейнах и фильтруют через слой песка. Затем обрабатывают хлором, а иногда озоном или ультрафиолетом, для уничтожения микроорганизмов.
Рис. 3. Станция очистки воды
Роль воды в промышленности, быту и сельском хозяйстве сложно переоценить. Развитие всех отраслей хозяйства страны, рост городов нередко приводят к загрязнению водоемов.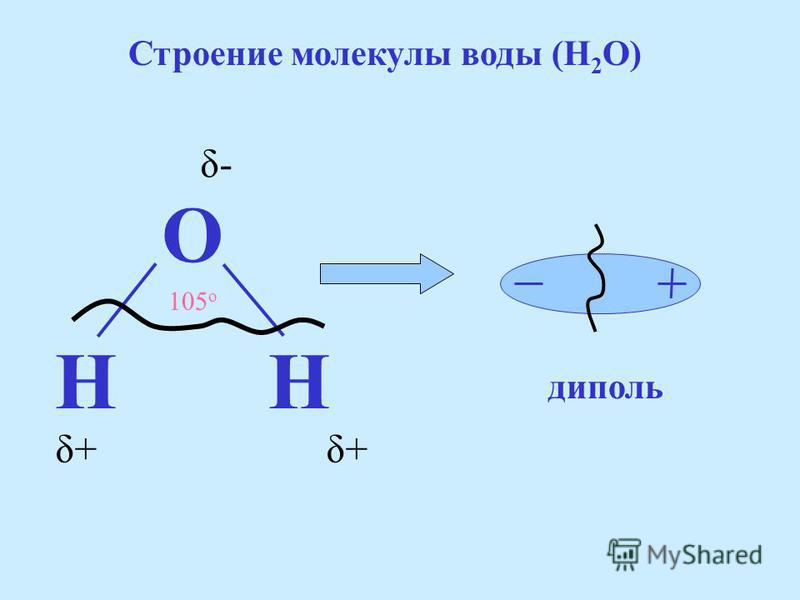 Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию водных природных ресурсов.
Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию водных природных ресурсов.
ИСТОЧНИКИ
источник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/voda
источник видео — http://www.youtube.com/watch?v=hl7NrtMZtss
источник видео — http://www.youtube.com/watch?v=ih6QhoRO_9U
источник презентации — http://ppt4web.ru/khimija/voda-fizicheskie-i-khimicheskie-svojjstva-vody.html
источник презентации — http://ppt4web.ru/ehkologija/sposoby-ochistki-pitevojj-vody.html
http://900igr.net/zip/khimija/Voda-i-ejo-svojstva.html
Какова молекулярная масса воды?A. 21Б. 18С. 20Д. 16
Ответ
Проверено
225.6k+ views
Подсказка: Чтобы вычислить молекулярную массу любого соединения, прежде всего, мы должны знать его молекулярную формулу, а затем атомную массу каждого типа атомов, которые объединяются вместе, чтобы образовать эта молекула.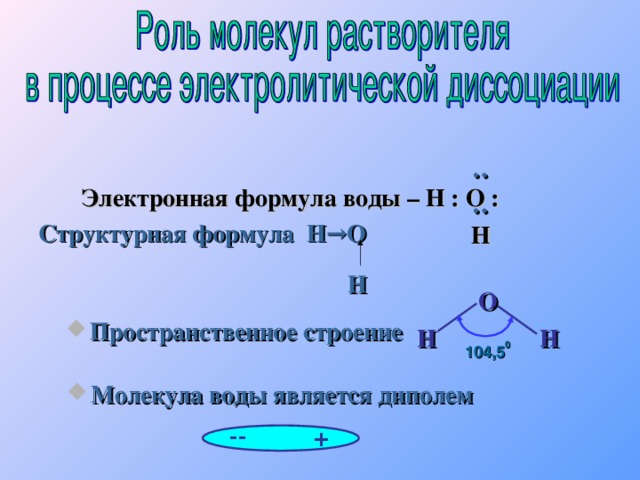 После этого мы можем добавить атомный вес каждого атома, присутствующего в молекуле, чтобы узнать его молекулярный вес.
После этого мы можем добавить атомный вес каждого атома, присутствующего в молекуле, чтобы узнать его молекулярный вес.
Полное пошаговое решение:
Когда группа атомов связывается вместе в определенной пропорции, они образуют соединение, и наименьшая фундаментальная единица этого соединения известна как молекула.
Молекулярная формула соединения — это химическая формула, которая дает информацию о количестве атомов каждого элемента, присутствующего в молекуле этого соединения.
Пример: $N{{H}_{3}}$ — это молекулярная формула молекулы соединения аммиака, которая ясно говорит нам, что для образования одной молекулы аммиака 1 атом азота и 3 атома водорода соединяются вместе. 9{-24}}\]г. Полная форма аму является атомной единицей массы.
Когда мы измеряем вес 1 грамм-моль молекул соединения, мы называем его грамм-молекулярной массой. Он представлен в граммах.
Обе молекулярные массы равны в цифрах, но различны в единицах.
Молекулярная формула воды: ${{H}_{2}}O$
Атомный вес водорода = 1 а.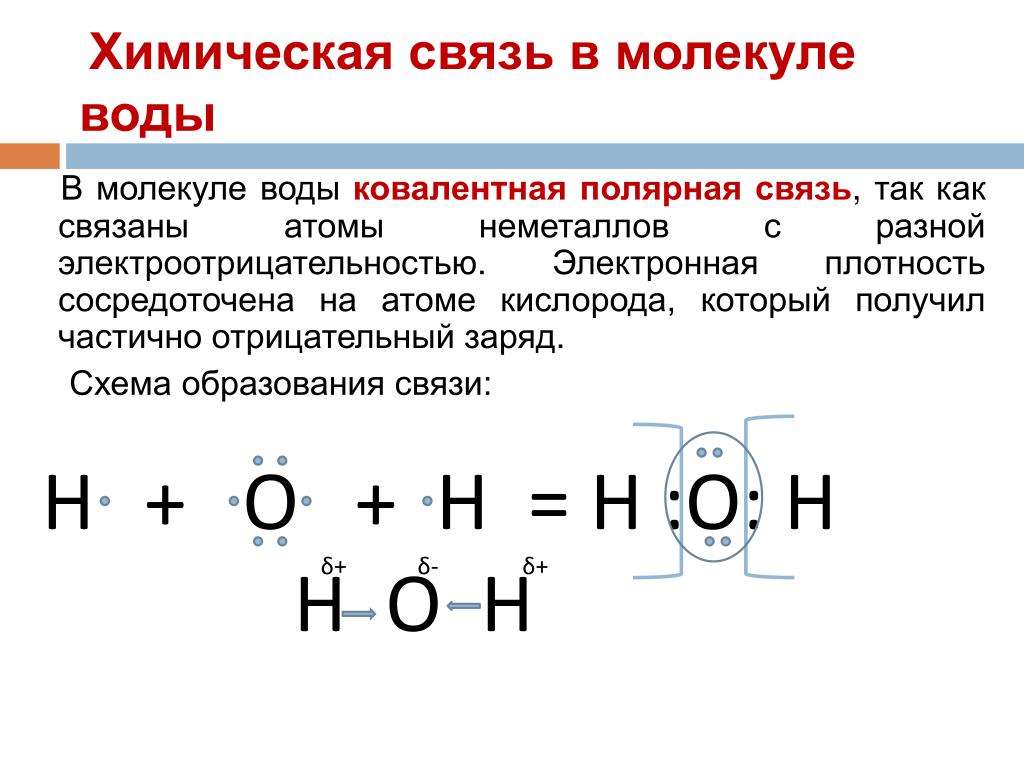 е.м.
е.м.
Атомный вес кислорода = 16 а.е.м.
Молекулярный вес воды = 2 (вес атома водорода) + вес атома кислорода
${{M}_{{{H}_{2}}O}} = 2{{M}_{H}}+{{M}_{O}}$ 9{-1}}$g
Вес одного грамма моля воды = $18$g
Примечание: Вода является очень хорошим растворителем, она очень легко растворяет в себе ионные соединения. Чтобы растворить в ней любое ионное соединение, вода высвобождает энергию, называемую энергией гидратации, чтобы разбить молекулу на ее ион, и после ионизации молекула воды окружает ионы и растворяет их. Поскольку диэлектрическая проницаемость очень высока, это причина, по которой он является очень хорошим полярным протонным растворителем для многих химических реакций.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий класс электродного потенциала 12 химия JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 химия JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 химия JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Кальций класса 12 химический JEE_Main
Тенденции сомнения
Химическая формула – определение, типы и примеры показать количество и тип атомов, присутствующих в молекуле, используя атомные символы и числовые индексы.
 Химическая формула — это простое письменное представление существующей трехмерной молекулы. Химическая формула описывает вещество с точностью до атомов, из которых оно состоит. Существует три основных типа химических формул: 9эмпирическая формула 0094 , молекулярная формула и структурная формула .
Химическая формула — это простое письменное представление существующей трехмерной молекулы. Химическая формула описывает вещество с точностью до атомов, из которых оно состоит. Существует три основных типа химических формул: 9эмпирическая формула 0094 , молекулярная формула и структурная формула .
Каждая из этих химических формул дает немного отличающуюся информацию о составе вещества, ключи к разгадке его трехмерной формы и тому, как оно будет взаимодействовать с другими молекулами, атомами и ионами. В химической формуле буквы представляют атомный символ каждого атома. Нижний индекс (нижний) представляет номер каждого атома, а верхний индекс (верхний) представляет заряд данного атома. А Коэффициент перед химической формулой представляет собой столько единиц молекулы. Каждый из различных типов химических формул читается немного по-разному.
Типы химической формулы
Эмпирическая формула
Эмпирическая химическая формула представляет собой относительное количество атомов каждого элемента в соединении.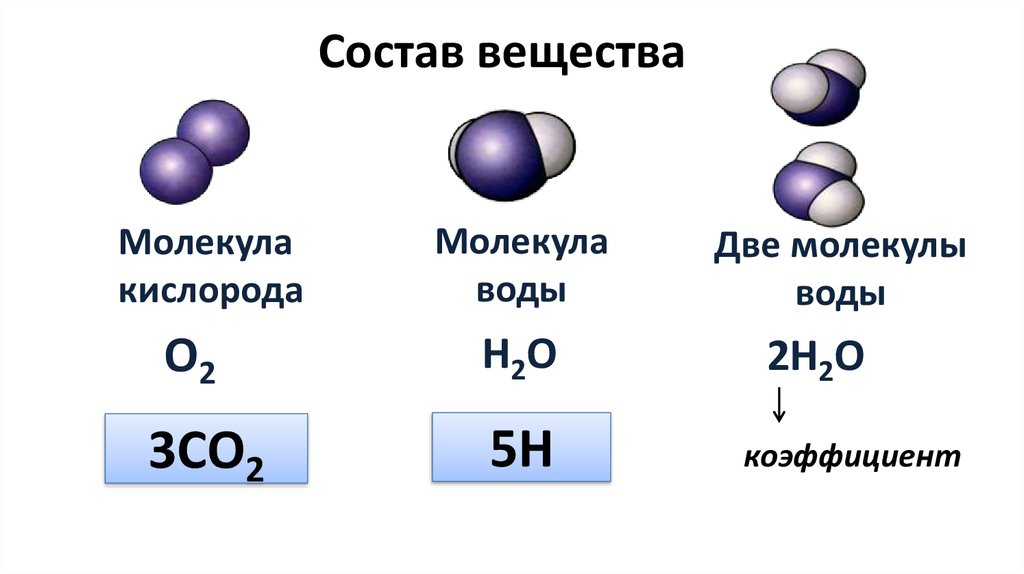 Некоторые соединения, такие как вода, имеют одинаковую эмпирическую и молекулярную формулу, потому что они малы и имеют одинаковое соотношение атомов в молекулах и число атомов в молекуле. Эмпирическая и молекулярная формула воды выглядит так:
Некоторые соединения, такие как вода, имеют одинаковую эмпирическую и молекулярную формулу, потому что они малы и имеют одинаковое соотношение атомов в молекулах и число атомов в молекуле. Эмпирическая и молекулярная формула воды выглядит так:
H 2 O
Эмпирическая формула определяется массой каждого атома в молекуле. Следовательно, для немного большей молекулы, такой как перекись водорода, эмпирическая формула показывает только соотношение атомов. В этом случае:
HO:
Однако эта эмпирическая химическая формула показывает только основную основу молекулы. На самом деле две молекулы HO: объединяются, образуя молекулу перекиси водорода.
Молекулярная формула
Молекулярная формула показывает фактическое количество атомов в каждой молекуле. Таким образом, молекулярная формула перекиси водорода выглядит следующим образом:
H 2 O 2
Как видите, это несколько запутывает реальную структуру перекиси водорода.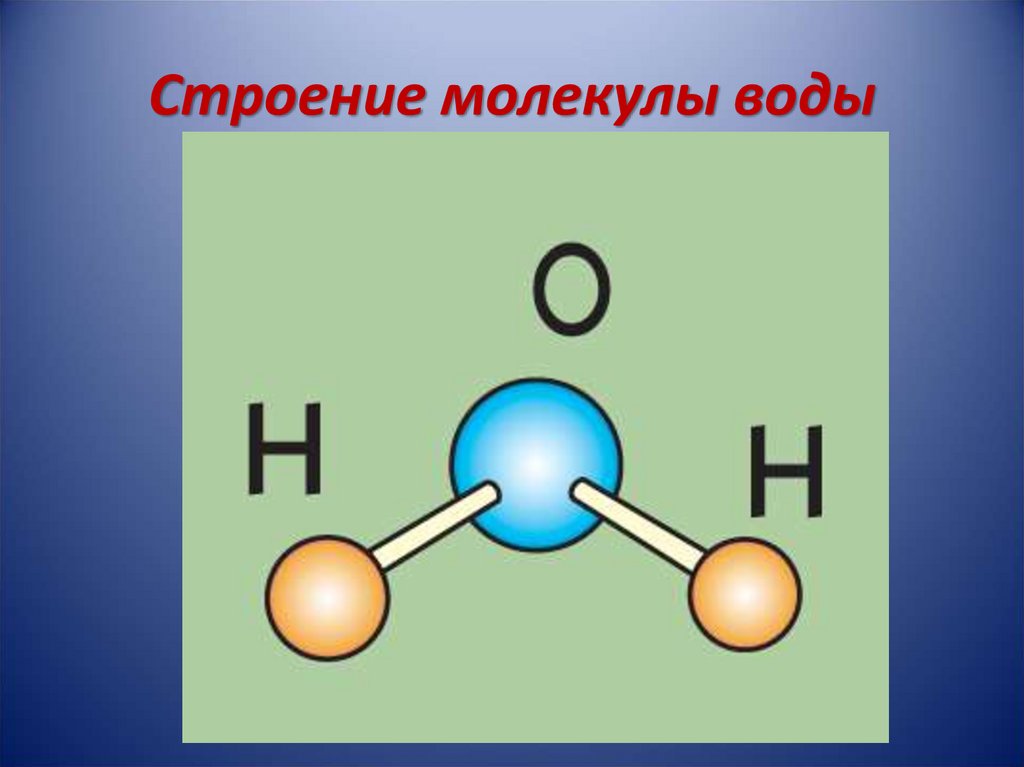 В то время как эмпирическая химическая формула дает представление о том, что молекула имеет два атома кислорода, связанных вместе в середине, молекулярная формула совсем не проясняет этого. Однако молекулярная формула часто используется для описания молекул просто потому, что это удобно, и большинство молекул можно найти после того, как будет определена их формула.
В то время как эмпирическая химическая формула дает представление о том, что молекула имеет два атома кислорода, связанных вместе в середине, молекулярная формула совсем не проясняет этого. Однако молекулярная формула часто используется для описания молекул просто потому, что это удобно, и большинство молекул можно найти после того, как будет определена их формула.
Структурная формула
Структурная формула молекулы представляет собой химическую формулу с более художественным уклоном. В этих химических формулах показаны фактические связи между молекулами. Это помогает читателю понять, как связаны различные атомы и, следовательно, как молекула функционирует в пространстве. Есть много различных структурных химических формул, которые следует учитывать.
В самом простом методе электронных точек для обозначения связей между атомами используются двоеточия и точки. Каждое двоеточие представляет собой пару электронов, разделенных между атомами по обе стороны от двоеточия.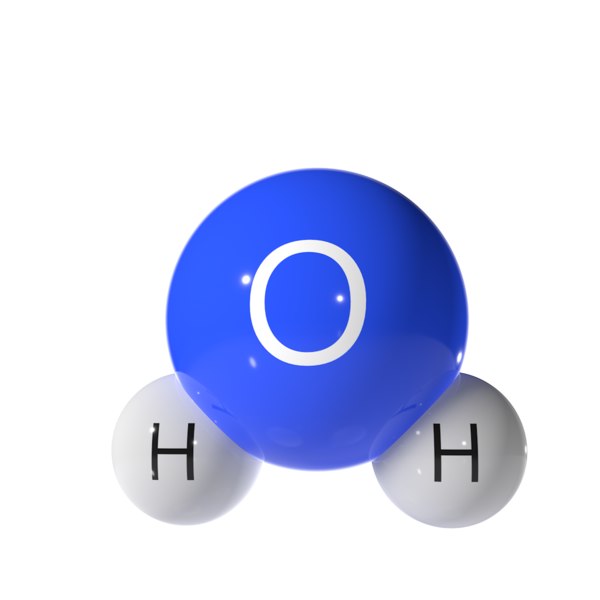 Эта формула более точно представляет фактическое расположение атомов в молекуле. В случае воды формула электронной точки будет выглядеть так:
Эта формула более точно представляет фактическое расположение атомов в молекуле. В случае воды формула электронной точки будет выглядеть так:
H:O:H
Другая химическая формула, формула линия связи , также показывает связи между атомами. Вместо того, чтобы показывать каждый общий электрон, линия используется для обозначения электронных пар, общих для атомов. Вода в формуле линии связи выглядит так:
H-O-H
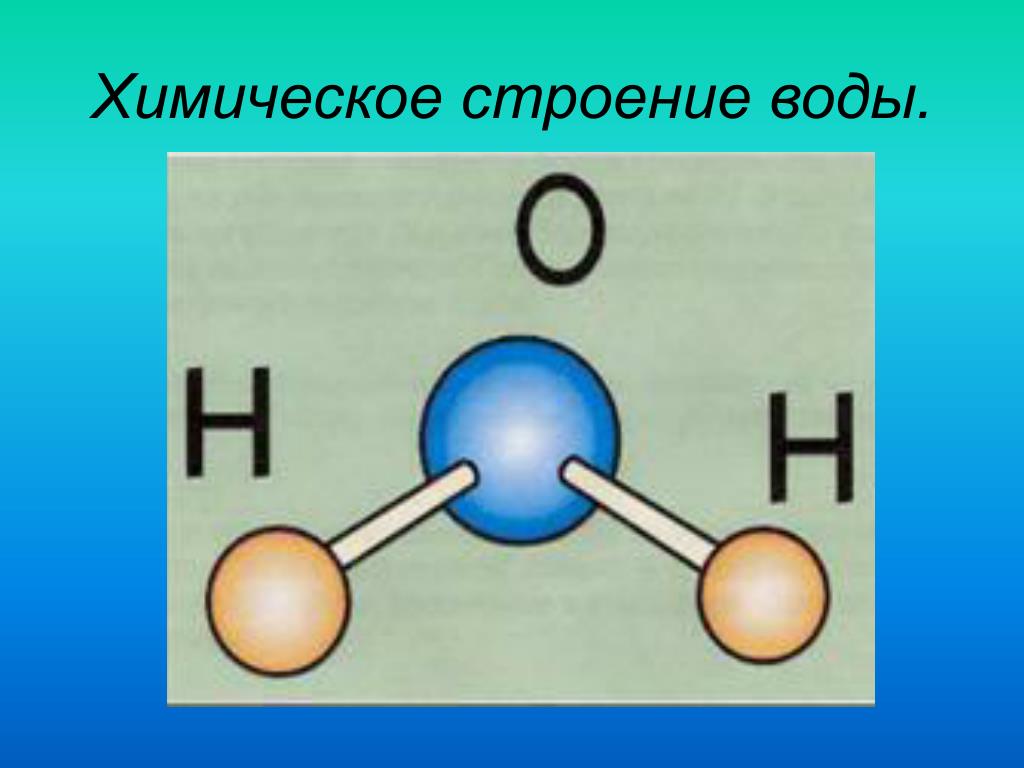
Ученые придумали гораздо более сложную формулу и представление молекул, включая трехмерные шарико-стержневые модели , заполняющие пространство модели и даже модели, в которых учитывается электронная плотность моделируемых атомов. Эти продвинутые модели учитывают не только присутствующие атомы и их количество, но и углы, размеры и расстояния между атомами внутри молекулы. Модель воды в виде шара и стержня, показанная ниже, даже показывает полярность молекулы, поскольку большой атом кислорода имеет тенденцию притягивать наибольшее количество электронов.
Молекулярная масса из химической формулы
Одним из важных навыков, полученных из химической формулы, является вычисление молекулярная масса . Молекулярная масса молекулы представляет собой сумму всех различных атомов внутри. Каждое вещество имеет определенную молекулярную массу, определяемую его особым составом.
Чтобы определить молекулярную массу вещества, рассмотрите химическую формулу. Формула легко отображает каждый присутствующий атом. Обязательно умножьте на количество атомов каждой молекулы. Нижние индексы на каждом атоме будут указывать, сколько их. Некоторые большие молекулы с несколькими похожими группами будут показывать группы примерно так, как в примере ниже:
C(OH) 4
В данном случае имеется четыре группы (OH), а не 4 атома водорода. Обязательно учитывайте это при расчете молекулярной массы. Молекулярную массу можно использовать для идентификации веществ, правильного взвешивания веществ для экспериментов и выполнения ряда расчетов, связанных с энергией, участвующей в химических реакциях.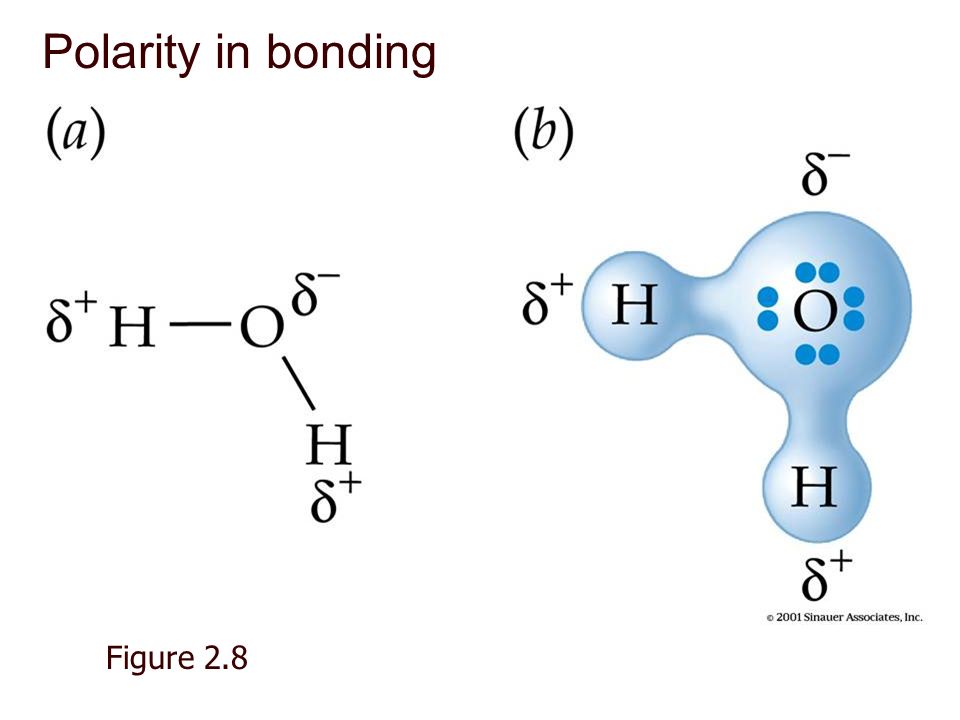

 ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.
ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.