Содержание
Окисляемость перманганатная
Оставить заявку
- Расчет стоимости оборудования
- Анализ воды
- Бесплатный выезд специалиста
- On-line калькулятор
- О компании
- Выполненные проекты
- Гарантии
- Оплата и доставка
- Полезная информация
Перманганатная окисляемость (ПМО) показывает общее значение загрязнения воды органическими и минеральными веществами. Такими могут быть гуминовые кислоты почв, следы гниения растений и различных химических соединений. Её величина представляет собой миллиграммы кислорода, ушедшего на окисление 1 дм3 воды с такими веществами.
Не стоит думать, что вредная органика загрязняет только открытые водоёмы и подземные воды. Стенки водопроводных труб постепенно обрастают различными водорослями и микроорганизмами в виде слизи. Продукты их жизнедеятельности могут вносить свой вклад в проблему общего загрязнения воды.
Стенки водопроводных труб постепенно обрастают различными водорослями и микроорганизмами в виде слизи. Продукты их жизнедеятельности могут вносить свой вклад в проблему общего загрязнения воды.
По требованиям СанПин норма ПМО – 5-7 мг/дм3. Такой индекс важен не только для питьевой воды, но и некоторых видов производства. Присутствие большого количества органики может вызывать вспенивание, окрашивание воды, а так же испортить трубы и аппаратуру.
Заказать анализ воды
Подобрать оборудование
Для выявления перманганатной окисляемости проводят химический анализ воды.
А чтобы снизить этот показатель, применяют фильтры комплексной очистки, сорбционно-осветлительные фильтры и УФ-обеззараживатели.
Видео очистки воды с показателем Перманганатной окисляемости 100 мг.л.
Для очистки воды использовался промывной фильтр с титановой мембраной
- Привезите воду для анализа в офис нашей компании
или отправьте результаты анализа воды нам на почту info@kr-company. ru с кратким пояснением, в каких объемах требуется очищенная вода
ru с кратким пояснением, в каких объемах требуется очищенная вода - Позвоните нам по многоканальному телефону
8(800) 222-80-97
и получите консультацию специалиста
Оставьте свой телефон и наш специалист перезвонит Вам
для консультации и уточнения необходимых деталей.
Ваше Имя:
Телефон: (обязательное поле)
E-mail:
Комментарий:
Вы можете также оформить заказ по телефону
8 (812) 643-20-97
Или заказать обратный звонок.
Информация:
Оплата товаров:
Оплата наличными
Производится в офисе компании
Безналичный расчет
После согласования комплекта водоочистного оборудования, мы выставляем счет,
который отправляем вам на электронную почту. Распечатав счет, вы можете его оплатить
в любом банке (Сбербанк, и т. д.)
д.)
Доставка водоочистного оборудования по России — Бесплатно
Доставка водоочистного оборудования по России осуществляется бесплатно до терминала транспортных компаний в Вашем городе.
Транспортные компании, осуществляющие доставку:
- «ПЭК»
- «КИТ»
- «ЖелДорЭкспедиция»
- «Деловые линии»
Доставка так же может быть осуществлена до указанного вами адреса. Стоимость рассчитывается индивидуально.
Срок доставки составляет от 1 до 7 рабочих дней. Точный срок доставки будет рассчитан вашим менеджером при подтверждении заказа.
Мы работаем с различными транспортными компаниями, поэтому сможем подобрать самый быстрый и экономичный вариант.
Пермаганатная окисляемость воды
Пермаганатная окисляемость характеризует соджержание в воде органических и минеральных веществ, удерживающих преобразование железа из двухвалентного в трехвалентное, которое может быть окислено кислородом. Т.е. пермаганатная окисляемость определяет именно то количество кислорода, которое спасет положение, причем из расчета на один литр исходной воды. Чем ниже окисляемость, тем меньше расходов и усилий на преобразование воды в пригодную. 1-2 единицы — вполне хороший показатель пермагантаной окисляемости, 4-6 — в пределах нормы, а выше — уже непреемлемый показатель.
Т.е. пермаганатная окисляемость определяет именно то количество кислорода, которое спасет положение, причем из расчета на один литр исходной воды. Чем ниже окисляемость, тем меньше расходов и усилий на преобразование воды в пригодную. 1-2 единицы — вполне хороший показатель пермагантаной окисляемости, 4-6 — в пределах нормы, а выше — уже непреемлемый показатель.
| Не знаете, как понизить окисляемость воды? — Вам нужен многофункциональный фильтр, подробнее здесь или у онлайн консультанта. | |||
От пермаганатной окисляемости зависит состав системы водоподготовки и водочистки всего дома. Даже если химический состав в двух скважинах по содержанию железа и органики одинаков, показатели пермаганатной окисляемости могут сильно разнится, что сделает возможным, или невозможным установку безреагентных фильтров в одном из домов.
Как правило высокий показатель пермаганатной окисляемости говорит о содержании в воде определенных биологическихз веществ именуемых железобактериями (гуминовые кислоты, растительная органика, органика антропогенная и т.д.). Они активно удерждивают двухвалентное железо в стабильной форме.
Источником повышенной загрязненности воды железобактериями является в большинстве случаев человеческая деятельность, а проще говоря, слив отходов. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными, она насыщенна органикой с почвы и опадающей в воду органикой. На окисляемость влияет водообмен между водоемами и грунтовыми водам. Она имеет выраженную сезонность. Вода равнинных рек как правило имеет окисляемость 5-12 мг О2 /дм3, рек с болотным питанием — десятки миллиграммов на 1 дм3. Подземные воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграма О2 /дм3. ПДК питьевой воды по перманганатной окисляемости согласно СанПиН 2.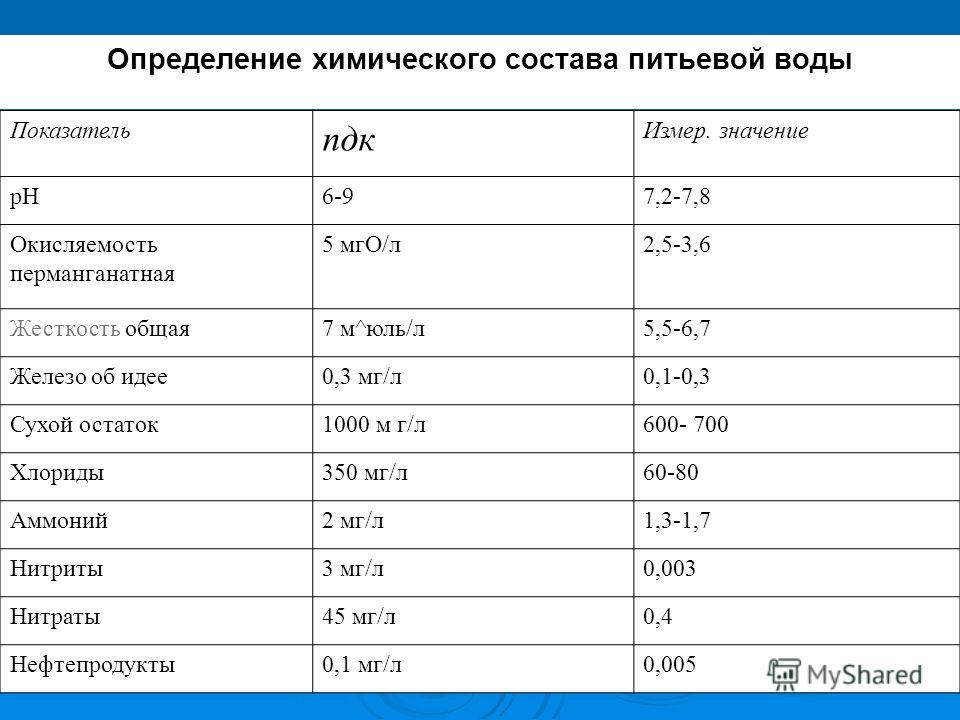 1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» составляет 5,0-7,0 мг/дм3.
1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» составляет 5,0-7,0 мг/дм3.
Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную. Наиболее высокая степень окисления достигается бихроматным методом. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах — как правило, бихроматную окисляемость (ХПК — «химическое потребление кислорода»).
В таких случаях используются реагентные фильтры, позволяющие порционно вводить мощные окислители (озон, перманганат калия, гидрохлорит натрия и т.п.). Установка таких фильтров и регулярная замена реагентов, безусловно, в разы дороже. Обычная аэрация в таких случая практически неэффективна.
Единственным рациолнальным решением, позволяющим избежать этой проблемы, является изменение места и глубины бурения. Переход на более глубокие грунтовые водные слои.
С точки зрения влияния на состояние челковека, то при высокой пермаганатной окисляемости наиболее опасны для человека крупные органические соединения, которые на 90% являются канцерогенами или мутагенами. Опасны хлорорганические соединения, образующиеся при кипячении хлорированной воды, т.к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах). Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев. И исходя из логики наличие железобактерий препятствует удалению железа из воды. О Влиянии железа на организм человека можно проичтать в этой статье.
физическая химия — Окисление воды перманганатом: Происходит ли эта реакция?
Вы действительно ошиблись. Ключевым моментом является то, что у вас есть более одного элемента, который будет восстановлен: водород также переходит из $\mathrm{+I}$ в $\pm0$ в вашем примерном уравнении. Кроме того, в нейтральных или слабоосновных растворах перманганат после окисления дает $\ce{MnO2}$, а не марганец(III).
Кроме того, в нейтральных или слабоосновных растворах перманганат после окисления дает $\ce{MnO2}$, а не марганец(III).
Что вы хотите сделать, так это восстановить перманганат до чего-то (что, как я уже установил, будет двуокисью марганца) при окислении что-то в воде что-то. Глядя на степени окисления водорода и кислорода в воде, единственный элемент, который может быть окислен, — это кислород, поскольку водород уже находится в максимально возможной степени окисления $\mathrm{+I}$. Окисление кислорода воды приводит к нескольким возможностям, из которых газообразный кислород действительно кажется наиболее вероятным. Следовательно, у нас есть окислительно-восстановительные пары:
$$\begin{align}\text{Red: }\ce{\overset{+VII}{Mn}O4-}/\ce{\overset{+IV}{Mn }O2}&&\text{Ox: }\ce{h3\overset{-II}{O}}/\ce{\overset{\pm0}{O2}}\end{align}$$
Затем мы можем определить соответствующие полуреакции по стандартной процедуре. Вместо того, чтобы рассказывать вам об этом, я представлю вам окончательный результат для сравнения.
$$\begin{align}\ce{MnO4- + 3e- + 4 H+ &-> MnO2 + 2 h3O}\tag{Red}\\
\ce{2h3O &-> O2 + 4e- + 4H+}\tag{Ox}\\[1em]\hline
\ce{4 MnO4- + 4 H+ &-> 4 MnO2 + 3O2 + 2 h3O}\tag{Redox}\end{align}$$
Получается, что окончательное уравнение реакции формально даже не нуждается в воде. Однако перманганат калия является твердым веществом, стабильным при хранении в нормальных лабораторных условиях (если исключить свет), поэтому разумно предположить, что реакция будет протекать только в водном растворе. 9{-0,405} &= [\ce{MnO4-}]\\
0,393 &= [\ce{MnO4-}]\end{align}$$
Таким образом, при любой концентрации выше $\pu{0,393M}$ перманганат должен начать формально окислять воду или разлагаться.
Произойдет ли это именно при этой концентрации, зависит от кинетических факторов, т. е. может ли в действительности производиться кислород в этих условиях, но термодинамически это было бы благоприятно.
Окисление марганца в системах питьевой воды с использованием перманганата калия | Водоснабжение
Пропустить пункт назначения навигации
Исследовательская статья|
01 декабря 2002 г.
Р. Равиндран;
Б. Шателье;
К. Уильямс
Водоснабжение (2002) 2 (5-6): 173–178.
https://doi.org/10.2166/ws.2002.0166
Расширенный поиск
Citation
Р. Равиндран, Б. Шателье, К. Уильямс; Окисление марганца в системах питьевого водоснабжения с использованием перманганата калия. Водоснабжение 1 декабря 2002 г.; 2 (5-6): 173–178. doi: https://doi.org/10.2166/ws.2002.0166
Равиндран, Б. Шателье, К. Уильямс; Окисление марганца в системах питьевого водоснабжения с использованием перманганата калия. Водоснабжение 1 декабря 2002 г.; 2 (5-6): 173–178. doi: https://doi.org/10.2166/ws.2002.0166
Скачать файл цитаты:
- Рис (Зотеро)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- Конечная примечание
- РефВоркс
- Бибтекс
Управление водного хозяйства Южного Гиппсленда испытывает проблемы с марганцем в большинстве своих поверхностных водоемов. Марганец присутствует в виде ионов марганца (II) и твердых частиц диоксида марганца. При низком уровне растворенного кислорода диоксид марганца восстанавливается до иона марганца (II). Если не окислиться, ион марганца(II) улетучивается через водоочистные сооружения и попадает в систему водоснабжения. Попадая в систему, ионы марганца постепенно окисляются до нерастворимого диоксида марганца, вызывая проблемы с грязной водой, которые могут испачкать одежду и купальные принадлежности. В рамках процесса очистки воды марганец (II) может быть окислен до нерастворимого оксида марганца, а затем удален путем осветления и фильтрации. Как правило, окисление может быть достигнуто путем аэрации или химического окисления путем добавления окислителя, такого как перманганат калия (KMnO 4 ) или хлор. Однако из-за колебаний уровня марганца в сырой воде методы очистки часто очень сложны. В этой статье рассказывается об опыте компании South Gippsland Water в использовании перманганата калия в процессе очистки воды для удаления марганца из поверхностных водоемов. Хотя рассматриваются преимущества и недостатки альтернативных методов окисления, в этой статье основное внимание уделяется использованию KMnO 4 для удаления марганца и вытекающим из этого аналитическим проблемам, связанным с контролем уровня марганца.
Попадая в систему, ионы марганца постепенно окисляются до нерастворимого диоксида марганца, вызывая проблемы с грязной водой, которые могут испачкать одежду и купальные принадлежности. В рамках процесса очистки воды марганец (II) может быть окислен до нерастворимого оксида марганца, а затем удален путем осветления и фильтрации. Как правило, окисление может быть достигнуто путем аэрации или химического окисления путем добавления окислителя, такого как перманганат калия (KMnO 4 ) или хлор. Однако из-за колебаний уровня марганца в сырой воде методы очистки часто очень сложны. В этой статье рассказывается об опыте компании South Gippsland Water в использовании перманганата калия в процессе очистки воды для удаления марганца из поверхностных водоемов. Хотя рассматриваются преимущества и недостатки альтернативных методов окисления, в этой статье основное внимание уделяется использованию KMnO 4 для удаления марганца и вытекающим из этого аналитическим проблемам, связанным с контролем уровня марганца.

 ru с кратким пояснением, в каких объемах требуется очищенная вода
ru с кратким пояснением, в каких объемах требуется очищенная вода