Содержание
Оксиды: классификация, получение и свойства
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
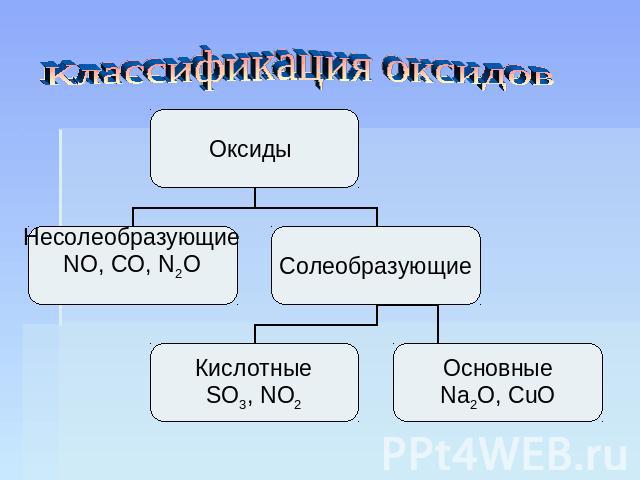
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → Na2O2
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т. к. азот реагирует с кислородом только в жестких условиях:
к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + h3O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др. :
:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.
Понравилось это:
Нравится Загрузка…
Оксиды 11 класс онлайн-подготовка на Ростелеком Лицей
Классификация оксидов
Оксиды – это соединения, состоящие из двух элементов, одним их которых является кислород в степени окисления -2. Например, оксид кальция: Са+2О-2. Не стоит путать оксиды и пероксиды. В состав пероксида входит кислород в степени окисления -1. Например, Н+12О-12, атомы кислорода связаны друг с другом.
Классификация оксидов
По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды – это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную (SiO2), либо ионную кристаллическую решетку (твердые СО2 или SO2).
Остальные оксиды – это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную (SiO2), либо ионную кристаллическую решетку (твердые СО2 или SO2).
По кислотно-основным свойствам оксиды делятся на:
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
- Основные оксиды
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления (Ag2O, HgO, NiO, Cu2O).
- Кислотные оксиды
Кислотные оксиды – это оксиды неметаллов (CO2, SO2, SiO2, SO3, P2O5) и некоторых переходных металлов в высоких степенях окисления (CrO3, Mn2O7, V2O5).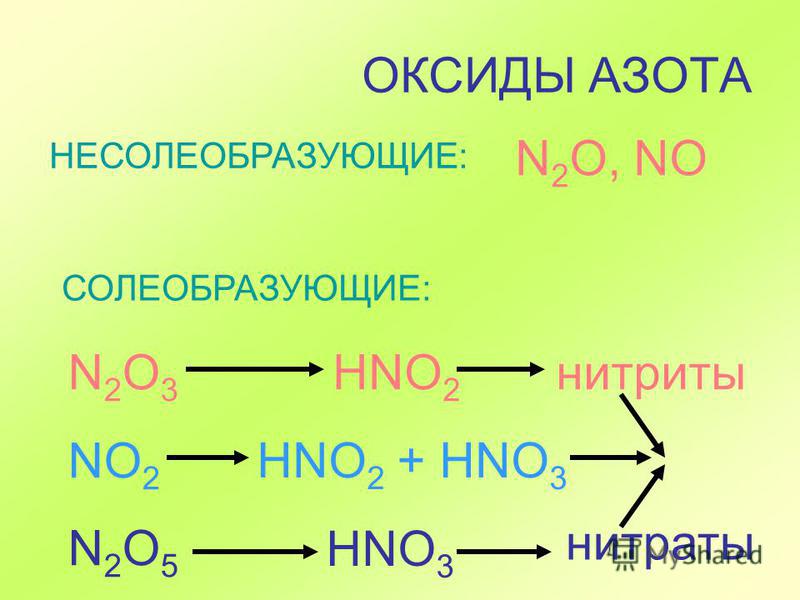
- Амфотерные оксиды
К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
Это: BeO, ZnO, Cr2O3, Al2O3, SnO, TiO2, MnO2 .
- Несолеобразующие оксиды
Несолеобразующие оксиды представлены в основном такими: CO, NO, N2O, H2O, F2O, SiO.
Оксиды в природе
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов, а также кварц и огромное количество его разновидностей (рис. 1-2). Массовая доля кварца и его разновидностей в земной коре составляет 60 %.
| Рис. 1 | Рис. 2 |
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Физические свойства оксидов
Оксиды обладают физическими свойствами. Многие оксиды неметаллов при стандартных условиях газообразны CO2, SO2, SO3, оксиды азота. Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7. Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O).
Рис. 3
Оксиды бывают бесцветными (CO2, SO2) или имеют окраску, например, NO2-, бурый газ (лисий хвост) (рис. 3).
Химические свойства оксидов
1. Отношение к воде:
С водой реагируют оксиды щелочных и щелочноземельных металлов (Li2O, Na2O, K2O, Pb2O, Cs2O, CaO, SrO, BaO, RaO).
Na2O + H2O → 2NaOH (1)
CaO + H2O → Ca(OH)2 (2)
Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение – SiO2.
N2O5 + H2O → 2HNO3 (3)
SO3 + H2O → H2SO4 (4)
Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2. Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
Основные оксиды взаимодействуют с кислотами с образованием соли и воды.
MnO + 2HCl → MnCl2 + H2O (5)
Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.
ZnO + 2HCl → ZnCl2 + H2O (6)
ZnO + 2KOH → K2ZnO2 + H2O (7)
Такая реакция (7) может протекать как в растворе, так и при сплавлении. При этом образуются различные продукты, в которых металл, образующий оксид, находится в ионной форме.
При этом образуются различные продукты, в которых металл, образующий оксид, находится в ионной форме.
Кислотные оксиды реагируют с основаниями, с образованием соли и воды.
SO2 + 2KOH → K2SO3 + H2O (8)
Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.
MnO + SO2 → MnSO3 (9)
3CaO + P2O5 → Ca3(PO4)2 (10)
Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.
Li + O2 → Li2O (11)
4P + 5O2 → 2P2O5 (12)
2. При горении сложных веществ.
CH4 + 2O2 → CO2 + 2H2O (13)
2H2S + 3O2 → 2SO2 + 2H2O (14)
3. Термическое разложение некоторых сложных веществ.
Термическое разложение некоторых сложных веществ.
Mg(OH) MgO + H2O
H2SiO3 SiO2 + H2O
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Диоксид циркония
Диоксид циркония – чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии. Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.
Подведение итога урока
В ходе урока были изучены такие неорганические соединения, как оксиды. Вы узнали о классификации оксидов, их химических свойствах и методах получения.
Список литературы
- Рудзитис Г.
 Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «internerurok.ru» (Источник)
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик.ру» (Источник)
Домашнее задание
- №№ 5 а, б (с. 192) Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
- Приведите примеры оксидов, которые имеют окраску.

- К какому классу соединений относится магнитный железняк?
Профессиональный научный эксперимент по окислению оксида азота (II)
Какие продукты окисления оксида азота?
[Викимедиа]
Оксид азота (II) — несолеобразующий оксид, ядовитый газ без цвета и запаха, плохо растворимый в воде. Оксид азота (II) способен частично димеризоваться (димером называют соединение, состоящее из двух более простых одинаковых молекул). Температура кипения -152 ᵒC или -242 ᵒF.
НЕТ структуры
[Викимедиа]
NO — единственный оксид азота, который можно получить из простых веществ:
N₂ + O₂ = 2NO (требуется электрический заряд или нагрев до 1200-1300°C или 2192-2372°F).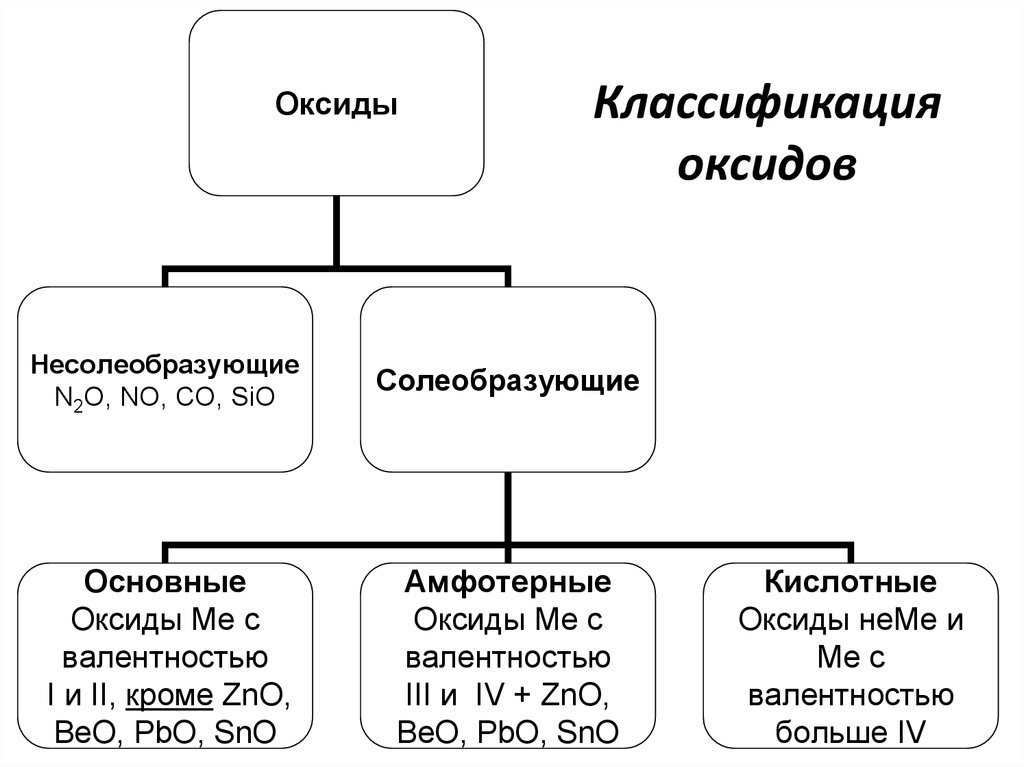
В лаборатории и в промышленности используются другие реакции. В лаборатории используется разбавленная азотная кислота:
3Cu + 8HNO₃ = 2NO + 3Cu(NO3)₂ + 4H₂O.
Раствор нитрата меди (II)
[Викимедиа]
В промышленности используется катализатор окисления аммония с платино-родиевым катализатором с подогревом:
4NH₃ + 5O₂ = 4NO + 6H₂O (необходимая температура около 700°C или 1292°F).
Химические свойства
Оксид азота (II) с водой не реагирует и практически не растворяется в ней. По своей природе он несолеобразующий – из этого оксида нельзя получить соли в результате реакций. В соединениях степень окисления азота +2, и этому оксиду не соответствуют никакие азотсодержащие кислоты (из этого оксида разбавлением нельзя получить кислоту). В зависимости от типа реакции оксид азота (II) может быть окислителем или восстановителем. Наиболее важные химические свойства вещества следующие.
Наиболее важные химические свойства вещества следующие.
На родиевом катализаторе оксид азота (II) может окислять монооксид углерода до диоксида углерода:
2NO + 2CO = 2CO₂ + N₂:
Может окислять диоксид серы до триоксида:
2200 2SO₃ + N₂.
Щелочное вызывает начало реакции диспропорционирования – «самоокисление-самовосстановление» – часть атомов азота окисляется, а часть восстанавливается:
6NO + 4KOH = N₂ + 4KNO₂ + 2H₂O (во флюсе).
Соединение может вступать в реакции сочетания с галогенами:
2NO + Cl₂ = 2NOCl (реакция протекает при низкой температуре).
via GIPHY
NO₂ – коричневый газ, и его довольно легко превратить NO в NO₂ Н₂О₃.
Окисление оксида азота (II)
В реакциях окисления оксид азота (II) является восстановителем – для начала его окисления кислородом не требуется особых условий.
NO₂ при разных температурах — от -196ᵒC до 50ᵒC
[Викимедиа]
2NO + O₂ = 2NO₂ (газ становится коричневым, так как оксид азота в степени окисления представляет собой коричневый газ).
Здесь вы можете найти эксперименты с диоксидом азота.
В кислой среде также возможно окисление перманганата калия:
5NO + 3KMnO₄ + 2H₂SO₄ = 2MnSO₄ + 3KNO₃ + Mn(NO₃)₂ + 2H₂O.
Перманганат калия KMnO₄
[Викимедиа]
Газ проявляет окислительные свойства только в реакциях с лучшими восстановителями, которые превосходят его восстановительную способность. Первая реакция окисления оксида азота (II) кислородом необходима для производства азотной кислоты, так как этот тип не может быть получен непосредственно из его оксида. Азотную кислоту можно получить из оксида азота IV по следующей реакции (должен быть избыток кислорода):
Азотную кислоту можно получить из оксида азота IV по следующей реакции (должен быть избыток кислорода):
4NO₂ + О₂ + 2H₂O = 4HNO₃.
Часто необходимый для этой реакции оксид азота получают из NO, так как этот газ довольно легко окислить до нужного NO₂ (для этого не требуются специальные условия).
Часто оксид азота (II) NO используется для производства азотной кислоты. Газ имеет большое биологическое и биохимическое значение, так как принимает участие в процессе жизнедеятельности. Вещество также является реагентом для проведения определенных химических реакций — например, получения азотной кислоты.
У нас есть для вас еще статьи по химии:
- Эксперимент «Глюконатная змея»
Как сделать фараонову змею из глюконата кальция и сухого топлива - Апельсин плавает или тонет?
Апельсин будет плавать или тонет в воде? Узнайте с помощью этого быстрого эксперимента!
Вы можете провести десятки химических опытов дома!
Трансмутация
Учить больше
Объяснение урока: Реакции оксидов
В этом объяснении мы научимся описывать и писать уравнения для
реакции оксидов.
Оксид представляет собой обычный тип химического соединения, состоящего как минимум из одного атома
кислорода в сочетании с другим элементом.
Определение: Оксид
Оксид – это химическое соединение, содержащее хотя бы один атом кислорода.
химически связан с атомом другого элемента.
Существует огромное количество оксидов различных элементов, включая оба металла
и неметаллы. Оксиды имеют много применений в нашем обществе. Оксид кальция
(СаО)
используется в производстве бетона и закиси азота
(NO2) используется в качестве
анестетик для стоматологических процедур.
Пример 1: Определение составных частей оксида
Какой элемент образует оксид — соединение, содержащее два
элементы – содержат хотя бы один атом?
Ответ
Оксид – это химическое соединение, содержащее элемент кислород. Кислород
в соединении будут связаны друг с другом элементом, создавая бинарную
сложный. Например, когда металлическая медь реагирует с газообразным кислородом, медь (II)
Например, когда металлическая медь реагирует с газообразным кислородом, медь (II)
образуется оксид (CuO). Таким образом, оксид содержит по крайней мере один атом
кислород.
Обычные оксиды металлов включают оксид магния, оксид натрия и оксид меди (II). Легкость образования оксидов металлов связана с реакционной способностью металла.
Щелочные металлы группы 1 хорошо известны своей высокой реакционной способностью и
следовательно, хранится под маслом, чтобы предотвратить реакции с кислородом и влагой в
воздух. Если кусок металла группы 1, такого как литий, отрезают только что,
блестящая поверхность вскоре становится тусклой, так как литий вступает в реакцию с кислородом воздуха,
образуя слой оксида лития (LiO2):
4Li()+O()2LiO()sgs22
Менее активные металлы, такие как медь, не будут так легко реагировать с кислородом. Металлическую медь оранжево-коричневого цвета необходимо сильно нагреть в пламени бунзеновской горелки, чтобы
протекала реакция с кислородом. Это приводит к образованию черного оксида меди(II) на
Это приводит к образованию черного оксида меди(II) на
поверхность медного металла:
2Cu()+O()2CuO()sgs2
Одним из наиболее распространенных оксидов неметаллов является двуокись углерода. Как один из продуктов
дыхания в организме человека, углекислый газ покидает наше тело каждый раз, когда мы
выдох. Он также производится при сжигании углерода:
C()+O()CO()sgg22
При сжигании серы в чистом кислороде в газовом баллоне сера сгорает с
ярко-синее пламя, образующее газообразный диоксид серы:
S()+O()SO()sgg22
Обратите внимание, что на фотографии показан кусочек лакмусовой бумажки позади газа.
цилиндр, который покраснел и начал белеть. Это обесцвечивание происходит из-за
образуется кислый сернистый газ.
Последним примером образования оксида неметалла является реакция фосфора с
кислород. В чистом виде фосфор является очень активным элементом.
самопроизвольно воспламеняется в присутствии кислорода:
P()+5O()PO()42410sgs
Оксиды можно классифицировать по их кислотной или основной природе. Есть четыре
Есть четыре
классификации: кислотные, основные, амфотерные и нейтральные.
По мере того, как мы перемещаемся по каждому периоду таблицы Менделеева, атомный номер увеличивается,
как и кислотная природа оксидов этих элементов. В результате получается металл
оксиды обычно считаются основными, а оксиды неметаллов рассматриваются
кислый.
Кислотность или основность оксида сильно влияет на его реакцию с кислотами и
щелочи. Оксиды основных металлов реагируют с минеральными кислотами с образованием соответствующих
соль и вода. Например, оксид меди будет реагировать с разбавленной соляной кислотой.
кислота:
CuO()+2HCl()CuCl()+HO()saqaql22
Этот тип реакции известен как реакция нейтрализации, которая имеет
следующее общее уравнение.
Уравнение: Нейтрализация
Кислотно-основная морская вода+⟶+
Можно использовать это общее уравнение, чтобы определить
неизвестные вещества. Например, если соль, полученная из
реакция нейтрализации содержала
ионы хлора, то используемая кислота должна
была соляная кислота. Это видно по реакции между
Это видно по реакции между
оксид натрия и соляная кислота:
NaO()+2HCl()2NaCl()+HO()22saqaql
Если в результате реакции нейтрализации образуется соль, содержащая сульфат-ионы, то
серная кислота должна быть использована:
CaO()+HSO()CaSO()+HO()saqaql2442
Наконец, если в результате реакции нейтрализации образуется соль, содержащая нитрат
ионов, азотная кислота должна была быть использована для нейтрализации основания:
MgO()+2HNO()Mg(NO)()+HO()saqaql3322
Пример 2. Определение оксида металла и кислоты, необходимых для образования хлорида цинка
Оксид металла и кислота реагировали вместе с образованием хлорида цинка
и вода. Что такое оксид металла и кислота?
- Оксид цинка и соляная кислота
- Оксид цинка и серная кислота
- Металлический цинк и азотная кислота
- Металлический цинк и соляная кислота
- Хлорид цинка и оксид цинка
Ответ
Реакция между оксидом металла и кислотой является примером
реакция нейтрализации. В реакции нейтрализации кислота взаимодействует с
В реакции нейтрализации кислота взаимодействует с
основания с образованием соли и воды. В этом случае образовавшаяся соль
хлорид цинка.
Кислота состоит из ионов водорода и одного из многих анионов. Эти анионы будут
быть теми же анионами, которые появляются в солевом продукте. Катион или положительный
ион металла в соли будет поступать из оксида металла. Наконец, кислород
атом оксида свяжется с водородом кислоты с образованием
вода.
В данном конкретном примере полученная соль представляет собой хлорид цинка. В качестве таких,
цинк должен быть получен из оксида цинка, а хлорид должен быть получен из
соляная кислота. Таким образом, правильный ответ: A.
В то время как основную природу оксидов металлов можно наблюдать по их реакции с разбавленными кислотами, некоторые оксиды металлов частично растворимы в
воды и образует щелочные растворы в соответствии со следующим общим уравнением.
Уравнение: растворение основных оксидов
Основной оксидводащелочной+⟶
Конкретные примеры этой реакции включают:
MgO()+HO()Mg(OH)()NaO()+HO()2NaOH()KO()+HO()2KOH()slaqslaqslaq222222
Когда мы перемещаемся по таблице Менделеева и исследуем оксиды неметаллов, изменение кислотной природы этих соединений становится очевидным.
Например, двуокись углерода мало растворима в воде и образует
кислый раствор угольной кислоты:
CO()+HO()HCO()2223glaq
Мы можем подтвердить кислотность раствора угольной кислоты с помощью универсального индикатора. Добавление в раствор нескольких капель универсального индикатора дает
красный цвет, что свидетельствует о кислотности раствора. Образуются кислые растворы.
при растворении оксидов неметаллов в воде.
Общее уравнение растворения неметаллического кислого оксида в воде:
Уравнение: растворение кислых оксидов
Кислотный оксидВодаКислота+⟶
Еще одним примером этой реакции является реакция воды с триоксидом серы с образованием серной кислоты:
SO()+HO()HSO()3224glaq
Другим кислотным оксидом неметалла является пятиокись фосфора, которая будет реагировать с
раствор гидроксида натрия для получения фосфата натрия и воды:
PO()+12NaOH()4NaPO()+6HO()410342saqaql
Пример 3: определение того, какой из выбранных оксидов является кислым
Какой из следующих оксидов, скорее всего, является кислым оксидом?
- CuO
- NaO2
- MgO
- CaO
- CO2
Ответ
который, вероятно, будет кислотным оксидом.
На первый взгляд кажется, что выбор оксидов в этом вопросе
все кажутся похожими. Однако при ближайшем рассмотрении мы можем увидеть такой ответ.
E имеет одно принципиальное отличие.
Углекислый газ является оксидом неметалла, в отличие от оксида меди, натрия
оксид, оксид магния и оксид кальция, которые все являются оксидами металлов. Оксиды металлов являются основными, тогда как оксиды неметаллов являются кислотными, поэтому оксид
который, скорее всего, будет кислым из этого выбора, это ответ E,
СО2.
Не все оксиды можно считать чисто кислотными или основными оксидами. Металлы, такие как
цинк и алюминий имеют оксиды, которые являются как кислотными, так и основными по своей природе.
называют амфотерными.
Амфотерный оксид может реагировать как с кислотами, так и с основаниями. Оксид алюминия будет
реагируют с разбавленной соляной кислотой с образованием хлорида алюминия и воды:
AlO()+6HCl()2AlCl()+3HO()2332saqaql
Общее уравнение реакции между амфотерным оксидом и разбавленной минеральной кислотой:
Уравнение: Нейтрализация амфотерных оксидов кислотой
Однако оксид алюминия также будет реагировать с раствором гидроксида натрия,
образуя соль, известную как алюминат натрия и воду:
AlO()+2NaOH()2NaAlO()+HO()2322saqaql
Общее уравнение реакции между амфотерным оксидом и раствором гидроксида:
Уравнение: нейтрализация амфотерных оксидов щелочью
в
во-вторых, он ведет себя как кислота.
Другой оксид, обладающий кислотными и основными свойствами, который можно считать
амфотерный – оксид цинка, реагирующий с разбавленными минеральными кислотами и щелочами.
следующими способами:
ZnO()+HSO()ZnSO()+HO()ZnO()+2NaOH()NaZnO()+HO()saqaqlsaqaql2442222
Остался последний тип оксида, который следует рассмотреть. Нейтральные оксиды не являются кислотными
не являются основными по своей природе и поэтому не реагируют с кислотами или основаниями. Примеры нейтрального
оксиды включают окись углерода
(CO) и закись азота
(NO2).
Пример 4. Прогнозирование цвета универсального индикатора в различных водных растворах оксидов
Для определения рН различных оксидов был поставлен эксперимент. Три
стаканы наполняли 0,5 л деионизированной воды и добавляли несколько капель
добавлен универсальный индикатор. Шпатель следующих оксидов был
затем добавляют в каждый стакан.
Какой цвет изменит каждый раствор после добавления оксида?
- A: зеленый, B: красный, C: синий
- A: красный, B: зеленый, C: синий
- A: синий, B: зеленый, C: красный
- A: красный, B: синий, C: зеленый
- A: синий, B: красный, C: зеленый
Ответ
В этом вопросе у нас есть три различных оксида фосфора, магния,
и алюминий. Магний — металл второй группы периодической таблицы Менделеева.
Магний — металл второй группы периодической таблицы Менделеева.
образует основные оксиды, которые растворяются в воде с образованием щелочных растворов. Фосфор находится в 15 группе периодической таблицы и, как неметалл,
растворяется в воде с образованием кислого раствора. Оксид алюминия образует
амфотерный оксид, который является как кислотным, так и основным по своей природе.
Универсальный индикатор — это общий индикатор, используемый для определения того,
является кислой или щелочной. В присутствии кислоты универсальный индикатор
превратить раствор от желтого до красного. В присутствии щелочного раствора
универсальный индикатор окрашивает раствор в фиолетовый цвет. Универсальный
индикатор будет зеленым в присутствии нейтрального раствора.
Если мы объединим эти знания, мы должны ожидать, что стакан А, содержащий
кислый оксид фосфора окрашивается в красный цвет. Стакан B содержит основной
оксид магния, поэтому мы ожидаем, что этот раствор будет синего цвета,
и химический стакан С, содержащий амфотерный оксид алюминия, должен быть зеленого цвета. Это соответствует ответу D, правильному ответу.
Это соответствует ответу D, правильному ответу.
Общие тенденции существуют в оксидах элементов некоторых групп в
периодическая таблица. В группах в левой части периодической таблицы
таких как группа 1 и группа 2, основные свойства оксидов повышаются
по мере спуска группы.
Если рассматривать рассмотренные нами реакции в целом, то можно увидеть
что по мере того, как мы перемещаемся по периодической таблице, атомный номер увеличивается
и оксиды элементов становятся все более кислыми по своей природе.
Чтобы объяснить некоторые из этих понятий, мы можем рассмотреть кислоты и
основания в виде гидроксисоединений с общей формулой
МЗ, где
М это
атом изучаемого нами элемента.
Гидроксисоединение может ионизироваться двумя различными способами:
MOHM+OHMOHMO+H()()Base+–Acid–+
Способ ионизации гидроксисоединений определяется
притяжение и отталкивание, которое существует между тремя составляющими ионами
в веществе. На следующем рисунке показан треугольник с
На следующем рисунке показан треугольник с
силы притяжения между противоположно заряженными ионами и отталкивания
между ионами с одинаковыми зарядами.
Мы можем использовать эту модель для объяснения тенденций внутри групп, которые мы
ранее обсуждалось. Если сила притяжения между
Н+ и О–
больше, чем между M+ и O–, вещество будет ионизироваться с образованием
база. Например, по мере продвижения вниз по группе 1 образуется больше основных оксидов. Увеличение атомных номеров и, как следствие, увеличение размера иона,
уменьшить плотность заряда, тем самым уменьшая притяжение между M+
и O–, более легко образующие гидроксид-ионы.
Если сила притяжения между M+
и O– больше, чем между
H+ и O– вещество ионизируется с образованием кислоты. Это то, что мы
увидеть, что происходит, когда мы перемещаемся по периодам таблицы Менделеева от
от группы 1 до группы 17.
Когда оксиды неметаллов ионизируются в виде кислот, прочность кислородсодержащих
Образующаяся кислота зависит от числа атомов кислорода в анионе, которые
не связаны с атомами водорода.
Мы можем проанализировать некоторые примеры этой изменяющейся силы, используя
общая формула MO(OH), которая основывается на той, которую мы ранее
использовал.
Чем выше число атомов кислорода, не связанных водородной связью
(О),
большей силы кислоты, как видно из примеров в
следующую таблицу.
Существуют и другие менее распространенные формы оксидов, такие как пероксиды и
супероксиды. Пероксид представляет собой особый тип соединения, в котором два атома кислорода
атомы соединены одинарной ковалентной связью, например, в соединении
перекиси водорода, как показано ниже.
Соединения супероксида содержат отрицательный ион супероксида,
O2–, такие как
КО2. Соединения супероксидов особенно важны для нашей биологии, поскольку
Соединения супероксидов особенно важны для нашей биологии, поскольку
наша иммунная система вырабатывает соединения супероксида, чтобы убить вторгшихся
микроорганизмы.
Пример 5: Описание оксида алюминия
AlO23 представляет собой оксид, который может реагировать как с кислотами, так и с основаниями,
как показано в следующих уравнениях:
AlO+3HSOAl(SO)+3HOAlO+2NaOh3NaAlO+HO232424322322
Что из следующего описывает этот оксид?
- Это нейтральный оксид металла.
- Это амфотерный оксид неметалла.
- Это пероксид.
- Это амфотерный оксид металла.
- Это нейтральный оксид неметалла.
Ответ
В этом вопросе нас просят описать оксид алюминия из двух
данные реакции. Первая реакция показывает, как оксид алюминия взаимодействует с
кислота, серная кислота. Второе уравнение показывает реакцию оксида алюминия с
основание, гидроксид натрия. Из этих уравнений мы видим, что алюминий
Из этих уравнений мы видим, что алюминий
оксид реагирует как с кислотами, так и с основаниями.
Ответ А описывает алюминий как нейтральный оксид металла. Тем не менее, нейтральный
оксиды не реагируют с разбавленными минеральными кислотами или щелочными растворами и поэтому
этот ответ должен быть неправильным.
Ответ B описывает оксид алюминия как амфотерный оксид неметалла, но его
расположение в 13 группе периодической таблицы означает, что алюминий является металлом
и поэтому этот ответ также неверен.
Пероксид представляет собой особый тип соединения, которое имеет два связанных атома кислорода
вместе одинарной ковалентной связью. Оксид алюминия имеет три атома кислорода
и не может считаться перекисью, поэтому ответ C неверен.
Ответ D описывает оксид алюминия как амфотерный оксид металла. Алюминий
действительно металл из-за его положения в группе 13 периодической таблицы
и может считаться амфотерным, так как реагирует как с кислотами, так и со щелочами,
как видно из двух приведенных выше химических уравнений.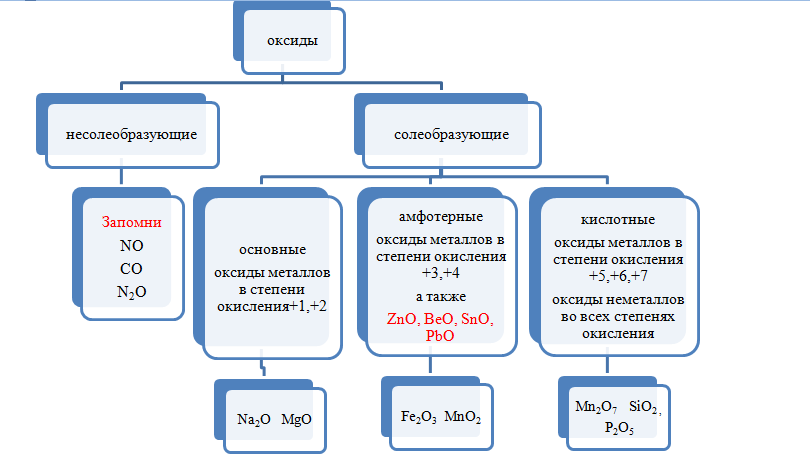
Поскольку ответ E состоит из вариантов, которые мы уже исключили, правильный
ответ D.
Давайте подытожим пункты, обсуждаемые в этом объяснителе.
Ключевые моменты
- Оксид – это соединение, которое содержит по крайней мере один атом кислорода и
атом другого элемента. - Легкость образования оксида из элемента относится к
реакционная способность этого конкретного металла или неметалла. - Металлы обычно образуют основные оксиды.
- Неметаллы обычно образуют кислотные оксиды.
- Некоторые элементы в центре таблицы Менделеева образуют амфотерные оксиды,
которые реагируют с кислотами и основаниями. - Основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные оксиды реагируют со щелочами с образованием солей и часто воды.
- Тесты pH можно использовать для определения того, является ли оксид кислотным или основным.
- Некоторые элементы образуют нейтральные оксиды, не реагирующие с кислотами и основаниями.


 Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.