Содержание
«Как узнали, что молекула воды состоит из двух атомов водорода и одного кислорода? Как вообще узнают атомный состав веществ?» — Яндекс Кью
Популярное
Сообщества
данил суханов
·
2,8 K
ОтветитьУточнить
Лучший
Игорь Савин
Топ-автор
8,2 K
Энергетик по профессии. Интересы: лингвистика, психология. · 15 июн 2020
Ну, сами химические элементы использовались с древнейших времён — люди занимались металлургией, керамикой, изготовлением красок и прочими подобными делами задолго до того, как хотя бы приблизились к пониманию строения вещества.
Сама идея молекул и атомов была предложена философами Древней Греции — Демокрит и кто-то ещё (сходу не вспомню) пришли к мысли, что любое вещество подобно речи — как речь состоит из слов, а слова состоят из букв, так и вещество состоит из молекул, а те состоят из атомов.
Потом прошло больше двух тысяч лет алхимии и самых разнообразных экспериментов. И в итоге только во времена, близкие к Ломоносову, эта идея снова обрела популярность.
Основой для развития химии стало изучение процесса горения — почему вещество горит, как меняется его структура? Существовали разные версии — что в каждом веществе содержатся атомы «флогистона», которые и обеспечивают горючесть, что «огонь» является одним из элементов, и подобные.
Как раз на этом этапе и узнали состав воды — химики смогли получить водород, а при его сжигании образовывалась вода. Именно с открытием таких газов как кислород и водород (и заодно — устранением «огня» как элемента), и появилась близкая к реальности теория строения вещества. Химики Дальтон и Авогадро предположили связь межу числом молекул газа и давлением. Благодаря этому стало возможным измерить массу атомов в газе, а благодаря этому — массу молекул в оксидах. Именно поэтому, кстати, у кислорода наиболее округлённая масса — 16. Просто потому что именно относительно него делались все практические измерения.
Просто потому что именно относительно него делались все практические измерения.
Как это делалось практически? Если взять два литра водорода, литр кислорода, то получим два литра водяного пара. В таком случае формула могла бы выглядеть как 2h3 + O2 = 2h3O (молекулы водорода и кислорода — двухатомные) или как 2Н + О2 = 2НО (молекула водорода одноатомная, кислорода — двухатомная). Из других реакций (например, H + Сl) выяснили, что молекула водорода двухатомная — значит, первое уравнение верно.
Ну а дальше осталось просто делом техники измерить массы известных соединений. Чуть позже Менделеев смог упорядочить все эти данные в таблицу, которой мы и пользуемся.
данил суханов
15 июня 2020
Не ожидал настолько развернутого ответа) спс от души😁
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Вода
Вода — это неорганическое соединение с химической формулой H20. Представляет собой прозрачную жидкость, без цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, а в газообразном— водяным паром.
Представляет собой прозрачную жидкость, без цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, а в газообразном— водяным паром.
Вода. Строение молекулы.
Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
Самая простая модель молекулы воды предсталяет собой тетраэдр. На самом деле одиночные молекулы воды при нормальных температуре и давлении не существуют, все они соединены друг с другом водородными связями. Можно сказать, все молекулы связаны в одну пространственную сетку – макромолекулу. Каждая молекула воды может участвовать максимум в четырёх водородных связях (каждый атом водорода в одной и атом кислорода — в двух). В таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, и молекулы воды располагаются плотнее. При нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение. А при испарении рвутся все оставшиеся связи.
А при испарении рвутся все оставшиеся связи.
Вода имеет несколько химических названий: оксид водорода, монооксид дигидрогена, гидроксид водорода (соединение гидроксильной группы OH- и катиона H+), гидроксильная кислота (воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH- оксидан дигидромонооксид.)
Кислород и водород в молекуле воды имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода выделяют следующие виды воды: лёгкая вода Н2О, тяжёлая вода (дейтериевая) D2O и сверхтяжёлая вода (тритиевая) T2O.
Вода. Важные свойства.
Вода – самое необычное вещество природы. Это связано с тем, что свойства воды во многом не соответствуют физическим законам, которым подчиняются другие вещества. Рассмотрим какими удивительными физическими свойствами обладает вода. Большинство веществ находясь в твердом состоянии обладают более высокой плотностью чем в жидком. А вода наоборот в твердом состоянии (лед) обладает более низкой плотностью чем в жидком. Наибольшая плотность воды достигается при температуре +4оС, что обеспечивает жизнь в воде зимой. В замерзающих водоёмах, когда температура падает ниже +4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура. Еще одно аномальное свойство воды – расширение объема на 10% при замерзании обеспечивает плавание льда, и как следствие сохранение жизни подо льдом.
Большинство веществ находясь в твердом состоянии обладают более высокой плотностью чем в жидком. А вода наоборот в твердом состоянии (лед) обладает более низкой плотностью чем в жидком. Наибольшая плотность воды достигается при температуре +4оС, что обеспечивает жизнь в воде зимой. В замерзающих водоёмах, когда температура падает ниже +4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура. Еще одно аномальное свойство воды – расширение объема на 10% при замерзании обеспечивает плавание льда, и как следствие сохранение жизни подо льдом.
Важное свойство воды – это большое поверхностное натяжение (72мН/м при 25 ОС). Так как у воды силы межмолекулярного взаимодействия очень велики, то каждая расположенная на поверхности воды молекула как бы втягивается внутрь слоя воды.
Вода это хороший растворитель полярных веществ. В связи со своими малыми размерами молекулы воды в большом количестве могут окружить каждую молекулу растворяемого вещества. Положительно заряженные части молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода.
В связи со своими малыми размерами молекулы воды в большом количестве могут окружить каждую молекулу растворяемого вещества. Положительно заряженные части молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода.
Чистая вода (без примесей) — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация ионов гидроксония h4O+ и гидроксид-ионов HO- составляет 0,1 мкмоль/л. А так как вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту. Чем ниже будет уровень электропроводности, тем чище вода.
Вода сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул воды, она также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.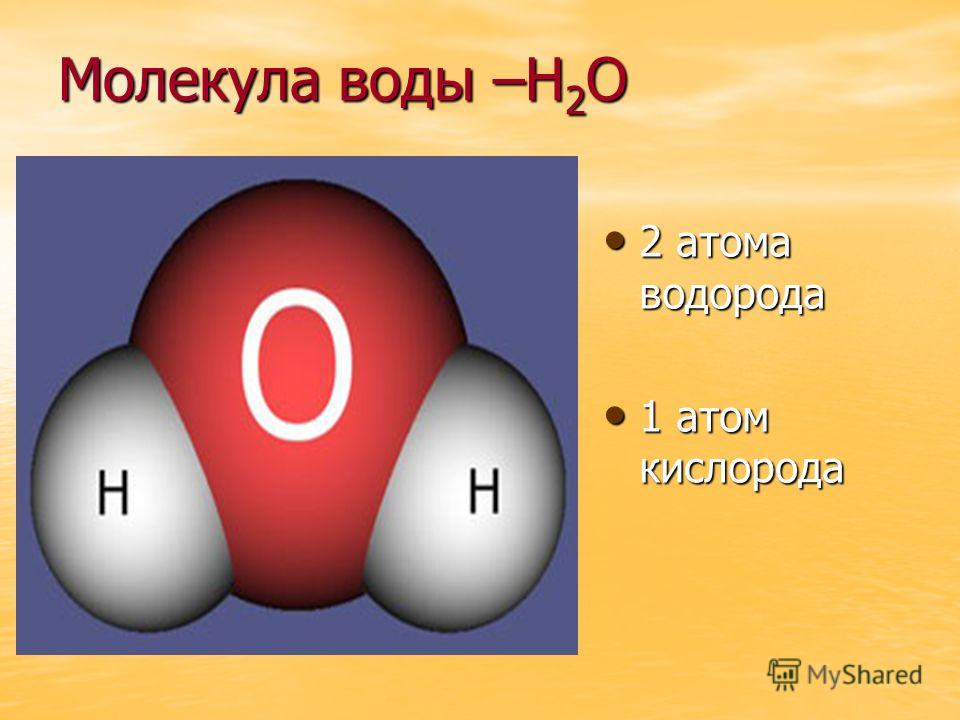
Вода медленно нагревается благодаря высокой теплоемкости, но процесс остывания происходит намного медленнее. Это дает возможность в летнее время года накапливать тепло на нашей планете посредством океанов и морей, а затем постепенно высвобождать тепло в зимний период. Таким образом, океаны и моря – это оригинальный и природный аккумулятор тепла на территории нашей планеты. Теплоемкость воды более чем в два раза превышает теплоемкость любого другого химического соединения, поэтому именно воду используют в качестве рабочего тела в энергетик.
Конфигурация молекулы воды
Модули и курсы InTeGrate > Наука о воде и общество > Материалы для учащихся > Модуль 2: Климатология воды > Уникальные свойства воды > Конфигурация молекулы воды
Узнать больше
Скрыть
Эти материалы являются частью коллекции проверенных в классе модулей и курсов, разработанных InTeGrate.
Материалы вовлекают учащихся в понимание земной системы, поскольку она переплетается с ключевыми социальными проблемами.
Коллекция находится в свободном доступе и готова к адаптации преподавателями бакалавриата для различных курсов, включая:
общеобразовательные или профильные курсы по дисциплинам, связанным с Землей, таким как геонауки или науки об окружающей среде,
обществознание, инженерия и другие науки, а также курсы по междисциплинарным программам.
Ознакомьтесь с коллекцией »
Для инструктора
Эти материалы для учащихся
дополнить
Наука о воде и общество
Инструкторские материалы.
Если вы хотите, чтобы ваши ученики имели доступ к учебным материалам, мы предлагаем вам либо
укажите их на студенческую версию
который опускает обрамляющие страницы с информацией, предназначенной для
факультет (и этот ящик). Или вы можете скачать эти страницы в нескольких форматах
которые вы можете включить на веб-сайт своего курса или в локальную систему управления обучением.
Узнайте больше об использовании,
изменение и обмен учебными материалами InTeGrate.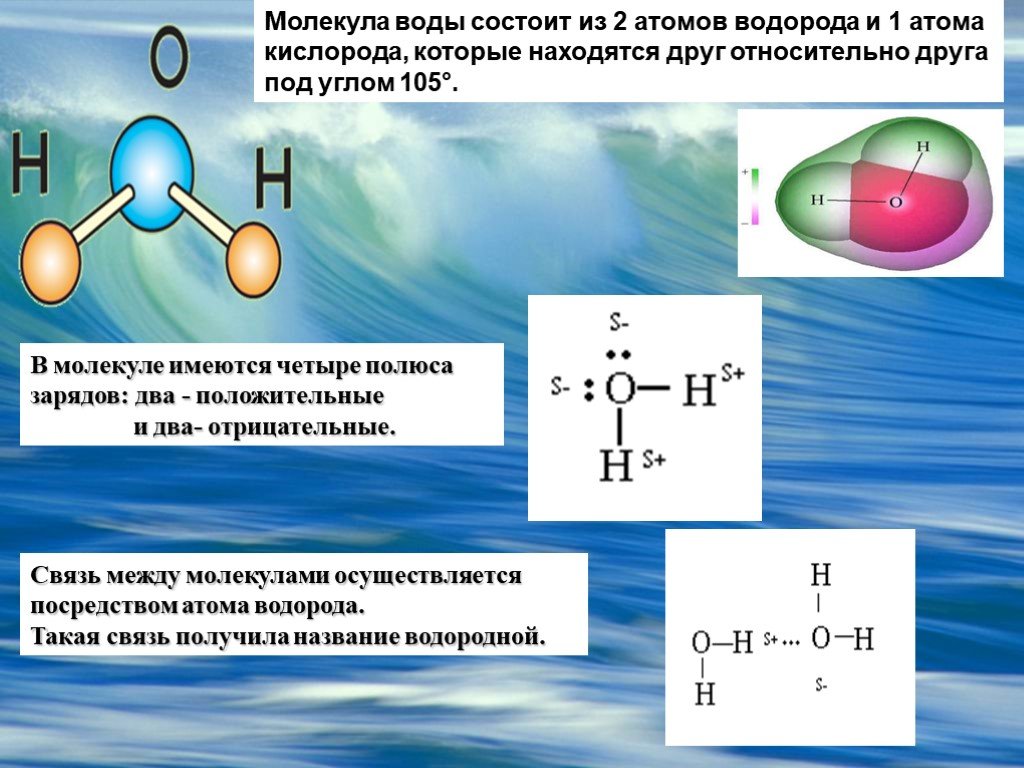
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Одно-единственное электронное кольцо вокруг ядра каждого атома водорода имеет только один электрон. Отрицательный заряд электрона уравновешивается положительным зарядом одного протона в ядре водорода. Электронное кольцо водорода на самом деле предпочло бы иметь два электрона для создания стабильной конфигурации. Кислород, с другой стороны, имеет два электронных кольца с внутренним кольцом, имеющим 2 электрона, что круто, потому что это стабильная конфигурация. С другой стороны, внешнее кольцо имеет 6 электронов, но хотелось бы иметь еще 2, потому что во втором электронном кольце 8 электронов являются стабильной конфигурацией. Чтобы уравновесить отрицательный заряд 8 (2+6) электронов, ядро кислорода имеет 8 протонов. Водород и кислород хотели бы иметь стабильные электронные конфигурации, но не как отдельные атомы. Они могут выбраться из этого затруднительного положения, если согласятся поделиться электронами (своего рода энергетический «договор»).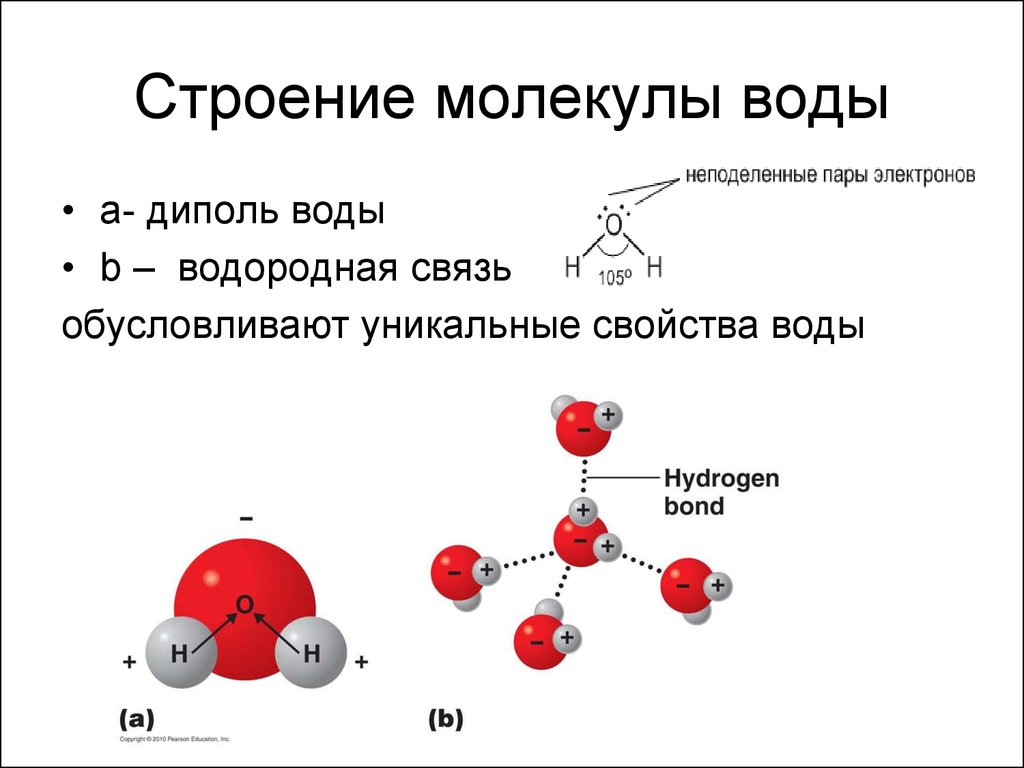 Итак, кислород делит один из своих внешних электронов с каждым из двух атомов водорода, и каждый из двух атомов водорода делит свой единственный электрон с кислородом. Это называется ковалентной связью. Каждый атом водорода думает, что у него есть два электрона, а атом кислорода думает, что у него 8 внешних электронов. Все довольны, нет?
Итак, кислород делит один из своих внешних электронов с каждым из двух атомов водорода, и каждый из двух атомов водорода делит свой единственный электрон с кислородом. Это называется ковалентной связью. Каждый атом водорода думает, что у него есть два электрона, а атом кислорода думает, что у него 8 внешних электронов. Все довольны, нет?
Рисунок 1. Молекула воды
Источник: Climate Science Investigations (CSI), НАСА
Однако два атома водорода находятся на одной стороне атома кислорода, так что положительно заряженные ядра атомов водорода остаются открытыми. , так сказать, оставив тот конец молекулы воды со слабым положительным зарядом. Между тем на другой стороне молекулы избыточные электроны атома кислорода дают этому концу молекулы слабое отрицательное изменение. По этой причине молекула воды называется «диполярной» молекулой. Вода является примером полярного растворителя (одного из лучших), способного растворять большинство других соединений из-за неравномерного распределения заряда молекулы воды. В растворе слабая положительно заряженная сторона одной молекулы воды будет притягиваться к слабой отрицательно заряженной стороне другой молекулы воды, и две молекулы будут удерживаться вместе за счет так называемой слабой водородной связи. В диапазоне температур морской воды слабые водородные связи постоянно разрываются и вновь образуются. Это придает воде некоторую структуру, но позволяет молекулам легко скользить друг по другу, превращая воду в жидкость.
В растворе слабая положительно заряженная сторона одной молекулы воды будет притягиваться к слабой отрицательно заряженной стороне другой молекулы воды, и две молекулы будут удерживаться вместе за счет так называемой слабой водородной связи. В диапазоне температур морской воды слабые водородные связи постоянно разрываются и вновь образуются. Это придает воде некоторую структуру, но позволяет молекулам легко скользить друг по другу, превращая воду в жидкость.
« Предыдущая страница Следующая страница »
Эти материалы являются частью набора проверенных в классе модулей и курсов, разработанных InTeGrate.
Материалы вовлекают учащихся в понимание земной системы, поскольку она переплетается с ключевыми социальными проблемами.
Коллекция находится в свободном доступе и готова к адаптации преподавателями бакалавриата для различных курсов, включая:
общеобразовательные или профильные курсы по дисциплинам, связанным с Землей, таким как геонауки или науки об окружающей среде,
обществознание, инженерия и другие науки, а также курсы по междисциплинарным программам.
Познакомьтесь с коллекцией »
Вода, молекула жизни
К Международному дню воды наш ученый, доктор Катя Николет, рассказала о воде, этой чудесной, волшебной молекуле, которая так важна для нашей жизни, что мы принимаем это само собой разумеющееся. Но мы определенно не должны. Узнайте больше о воде сегодня и никогда больше не смотрите на высокий стакан с водой так, как прежде.
Саргассум в Атлантическом океане
© Energy Observer Productions I Francine Kreiss
Молекула жизни
Молекула воды обладает некоторыми уникальными свойствами, которые делают возможной жизнь на Земле, или, скорее, жизнь развилась на основе этих особых качеств воды. В любом случае вода является синонимом жизни на нашей Голубой планете. Вода состоит из одного атома кислорода (O) и двух атомов водорода (H), вместе они образуют в целом стабильную и электрически нейтральную молекулу (она не заряжена). Однако, и здесь все становится интереснее, поскольку электроны предпочитают быть ближе к атому кислорода, чем атомы водорода, молекула в конечном итоге имеет Y-конфигурацию, при этом два атома водорода сближаются с одной стороны.
В результате одна сторона молекулы заряжена слегка положительно, а другая — слегка отрицательно. Эта полярность (небольшой положительный/отрицательный заряд) позволяет молекуле вести себя как магнит, который «притягивается» к другим молекулам воды или другим поляризованным молекулам. Слабые связи между водородом одной молекулы воды и кислородом другой молекулы воды называются водородной связью, и это делает воду почти волшебной.
© Wikimedia Commons
Из-за своей полярности вода является сильным растворителем! Например, молекула соли (NaCl) разрывается водой, потому что Na+ притягивается к отрицательной стороне, а CL- притягивается к положительной стороне. Таким образом, соль растворяется в воде, учитывая соленость нашего океана. Точно так же вода может растворять минералы в горных породах и отложениях и становиться важным источником минералов для людей, животных и растений. Например, 20% нашего ежедневного потребления кальция и магния поступает из питьевой воды (Olivares M.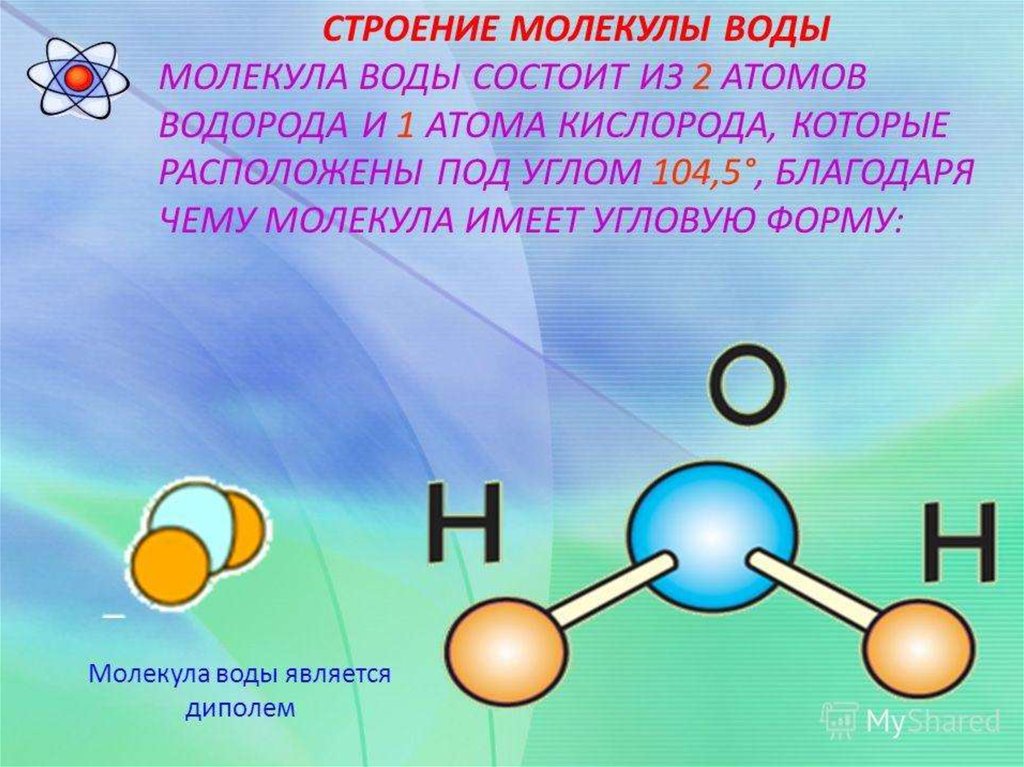 & Uauy R., 2005, 9).0019 Основные питательные вещества в питьевой воде , Всемирная организация здравоохранения).
& Uauy R., 2005, 9).0019 Основные питательные вещества в питьевой воде , Всемирная организация здравоохранения).
Лед плавает, ничего страшного, верно?
Водородные связи между молекулами воды приводят к еще одному свойству, называемому когезией. Когезия означает, что молекулы воды слипаются, что, в свою очередь, обеспечивает капиллярность. А капиллярность — это то, как вода будет счастливо течь по тканям растений и кровеносным сосудам даже вопреки силе гравитации. Волшебный. Или физика. Вам решать. Сцепление также отвечает за поверхностное натяжение, причина, например, в том, что вода образует купол на поверхности слегка переполненного стакана или что водомерки (насекомые) могут ходить по воде, не нарушая ее поверхности.
Но самое безумное: эта дополнительная липкость означает, что вода при комнатной температуре является жидкостью, а не газом из-за водородных связей! Хотя водородные связи постоянно формируются и разрушаются по мере движения молекул воды, липкости достаточно, чтобы удерживать молекулы воды близко друг к другу и не допускать превращения ее в газ при 20°C. Кроме того, связи в жидкой воде удерживают молекулы очень близко друг к другу, но когда вода замерзает, молекулы выстраиваются в кристалл, создавая больше промежутков между молекулами. Вот почему жидкая вода более плотная, чем твердая вода.
Кроме того, связи в жидкой воде удерживают молекулы очень близко друг к другу, но когда вода замерзает, молекулы выстраиваются в кристалл, создавая больше промежутков между молекулами. Вот почему жидкая вода более плотная, чем твердая вода.
Ледник на Шпицбергене
© Energy Observer Productions I Antoine Drancey
И это чрезвычайно важно. Мы всегда видели, как лед плавает в воде, поэтому мы никогда не задавались этим вопросом, но можете ли вы представить себе какой-либо другой элемент, который является более плотным, чем жидкость, а не твердое тело? Плавает ли твердый свинец на жидком свинце? Растворяется ли твердое масло (жир) на жидком масле? Нет!, потому что жидкое состояние обычно означает, что молекулы более возбуждены, больше перемещаются и, таким образом, между ними больше пространства. Но не вода. Самая плотная вода на самом деле имеет температуру 4°C, а наименее плотная – как вы уже догадались – 0°C. Волшебно, опять же.
Жизнь и смерть из-за льда
Итак, лед занимает больше места, чем вода. Вы, наверное, сталкивались с этим, когда взорвалась бутылка с водой, которую вы оставили в морозильной камере, или когда зимой прорвало водопроводную трубу. Это свойство льда имеет важные последствия для выветривания вещества и образования отложений в результате эрозии. По этой же причине большинство организмов умирает при замерзании, потому что лед, образующийся внутри клеток, пробивает клеточную мембрану. Лишь немногие животные и растения с белками-антифризами могут пережить понижение температуры тела ниже 0°C. И это также причина, почему, если бы вы были криогенизированы, вы бы превратились в лужу крови и тканей после оттаивания. Если только вы не крутая антарктическая рыба.
Вы, наверное, сталкивались с этим, когда взорвалась бутылка с водой, которую вы оставили в морозильной камере, или когда зимой прорвало водопроводную трубу. Это свойство льда имеет важные последствия для выветривания вещества и образования отложений в результате эрозии. По этой же причине большинство организмов умирает при замерзании, потому что лед, образующийся внутри клеток, пробивает клеточную мембрану. Лишь немногие животные и растения с белками-антифризами могут пережить понижение температуры тела ниже 0°C. И это также причина, почему, если бы вы были криогенизированы, вы бы превратились в лужу крови и тканей после оттаивания. Если только вы не крутая антарктическая рыба.
Однако менее плотный лед также означает жизнь. Если бы твердая вода была плотнее жидкой, озера, реки и океаны замерзали бы снизу вверх. Как только образовывались кристаллы льда, они опускались и скапливались на дне, пока все не замерзло. Все разнообразие бактерий, растений, беспозвоночных, рыб и амфибий, обитающих в озерах и полярных океанах, будет ежегодно вымирать, что сильно повлияет на водное биоразнообразие.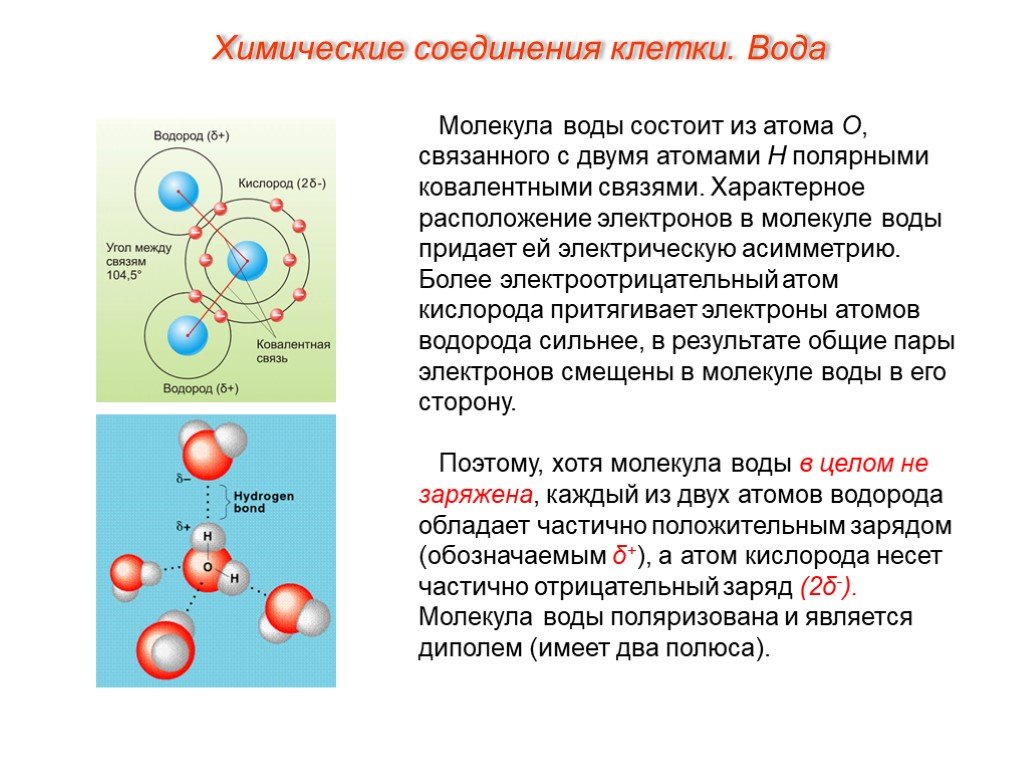 Вместо этого лед образуется на поверхности, создавая умеренно холодный слой (0°C) между водой и часто более холодными условиями окружающей среды. Таким образом, водные организмы защищены от низких температур и могут дожить до весны.
Вместо этого лед образуется на поверхности, создавая умеренно холодный слой (0°C) между водой и часто более холодными условиями окружающей среды. Таким образом, водные организмы защищены от низких температур и могут дожить до весны.
Голубая планета
Погружение под саргассум
© Energy Observer Productions I Francine Kreiss
Теперь вам, наверное, ясно, что вода — уникальная молекула и что жизнь на Земле зависит от нее. На самом деле 70% планеты покрыто океанами! Но для нас, неморских организмов, соленая вода не пригодна для питья. Если бы мы пили соленую воду, вода в наших клетках попыталась бы растворить соленую воду посредством процесса, называемого осмосом, и в итоге мы серьезно обезвоживались бы. То же самое для неморских растений и животных. В результате наземные и пресноводные организмы зависят от пресной воды. А пресной воды на земле на удивление мало!
Из всей воды на Земле 97,5% составляет соленая вода! На этой планете остается всего лишь 2,5% пресной воды (примерно 34 650 000 км3). Но ждать! Около 69% всей пресной воды хранится в ледниках, ледяных шапках и мерзлых грунтах (вечная мерзлота; цифры округлены). Таким образом, только 31 % пресной воды на Земле фактически доступен для жизни, подавляющее большинство из которых (30 %) составляют подземные воды, и только 1 % всей пресной воды в мире составляют поверхностные воды (435 100 км3).
Но ждать! Около 69% всей пресной воды хранится в ледниках, ледяных шапках и мерзлых грунтах (вечная мерзлота; цифры округлены). Таким образом, только 31 % пресной воды на Земле фактически доступен для жизни, подавляющее большинство из которых (30 %) составляют подземные воды, и только 1 % всей пресной воды в мире составляют поверхностные воды (435 100 км3).
Важность подземных вод
Подземные воды – это все воды, которые просачиваются и просачиваются сквозь землю, достигая подземных водоносных горизонтов. Эти водоносные горизонты состоят из различных материалов (песок, гравий, проницаемые осадочные породы, вулканические и кристаллические породы), которые улавливают воду из поверхностных осадков и таяния снега. Даже если поверхностные воды — это то, что мы можем видеть и испытывать каждый день, подземные воды на самом деле обеспечивают большую часть воды, используемой населением мира (сельское хозяйство, сельское хозяйство, промышленность) и напитков. В некоторых засушливых регионах это единственный доступный источник пресной воды, в результате чего 2,5 миллиарда человек зависят исключительно от грунтовых вод как от источника ежедневной воды.
Это хранилище подземных вод также чрезвычайно важно для среды обитания и растительности, обитающей на поверхности. Он играет ключевую роль в поддержании уровня воды и стока в реки, озера и водно-болотные угодья, особенно в засушливые месяцы. Этот поток воды через землю необходим для дикой природы и растительности, и только устойчивые к высыханию растения могут жить на участках, удаленных от грунтовых вод (некоторые возвышенности).
Потребление и загрязнение подземных вод
Наши потребности в воде трудно понять, но для поддержания рациона среднего американца путем выращивания сельскохозяйственных культур и разведения животных требуется 5 000 литров воды в день! Во всем мире на орошение приходится более 70% общего водозабора, как поверхностных, так и подземных. И около 45% от общего объема используемой оросительной воды приходится на подземные воды. И это только для нужд населения, животным и экосистемам требуется большое количество пресной воды для поддержания биоразнообразия и жизни. Пресноводные экосистемы являются домом для множества растений и животных, и в настоящее время скорость вымирания этих экосистем в 15 раз превышает скорость вымирания морских экосистем! По всем этим причинам пресная вода чрезвычайно важна.
Пресноводные экосистемы являются домом для множества растений и животных, и в настоящее время скорость вымирания этих экосистем в 15 раз превышает скорость вымирания морских экосистем! По всем этим причинам пресная вода чрезвычайно важна.
Шпицберген
© Energy Observer Productions I Antoine Drancey
К сожалению, системам пресной воды, и особенно подземным водам, угрожает чрезмерное потребление, деградация и загрязнение. Колодцы опустошили целые водоносные горизонты там, где потребности населения в воде превышали поступление воды с осадками. Снижение уровня некоторых водоносных горизонтов вблизи океана иногда приводит к просачиванию соленой воды в пористую почву, что делает грунтовые воды непригодными для питья и использования для сельскохозяйственных культур. Наконец, всевозможные антропогенные загрязнители могут проникать в землю вместе с осадками и загрязнять водоемы подземных вод. Неполный список включает пестициды и удобрения с полей, соли с дорог, химические вещества со свалок, органические загрязнения из протекающих септических и канализационных систем и т.
