Содержание
Физики упорядочили электродипольную решетку молекул воды
Физики экспериментально обнаружили переход группы молекул воды, размещенных в полостях кристаллической решетки кордиерита, в состояние, при котором электрические диполи этих молекул образуют упорядоченную структуру. Результат важен как с фундаментальной точки зрения — надежное экспериментальное наблюдение таких фазовых переходов в лаборатории ранее представляло трудности, так и с практической — упорядоченные электродипольные решетки молекул воды могут найти применение в области наноэлектроники (в том числе биосовместимой), а также помочь ученым в создании искусственных квантовых систем. Статья опубликована в журнале Nature Communications.
Когда возникает необходимость описывать электромагнитное поле сложных систем (как, например, молекулы) на расстояниях, которые значительно превышают размеры самой системы, физики пользуются дипольным приближением. В таком приближении роль реального объекта выполняет простая идеализированная система — диполь, причем поле (магнитное или электрическое) диполя с требуемой точностью соответствует настоящему и описывается векторной физической величиной — дипольным моментом.
Таким образом, для исследования электромагнитных свойств вещества бывает удобно рассматривать его как группу молекул, каждая из которых обладает неким дипольным моментом. При создании особых условий — например, приложении внешнего поля или охлаждении, диполи могут выстраиваться в упорядоченные структуры, а само вещество при этом — проявлять недоступные в стандартном состоянии свойства, которые удобно использовать на практике. На сегодняшний день упорядоченные состояния в большом количестве известны для систем магнитных диполей, в то время как экспериментальные исследования электрических — менее обширны и по-прежнему остаются сложной задачей.
Ученые из Германии, России, Чехии и Японии под руководством Михаила Белянчикова (M. A. Belyanchikov) из Московского физико-технического института экспериментально обнаружили и исследовали одно из упорядоченных состояний у электродипольной решетки воды — системы из регулярно расположенных в пространстве молекул H2O. Благодаря распространенности этой жидкости в окружающей среде, поиск таких конфигураций представляет интерес, в том числе, с позиции изучения природных систем и развития биосовместимых технологий. Тем не менее в условиях лаборатории группы молекул H2O в виде стандартной жидкости или льда не удается перевести в требуемое состояние — этому препятствуют водородные связи — электростатические взаимодействия между молекулами, которые не дают дипольным моментам выстраиваться в нужную конфигурацию.
Тем не менее в условиях лаборатории группы молекул H2O в виде стандартной жидкости или льда не удается перевести в требуемое состояние — этому препятствуют водородные связи — электростатические взаимодействия между молекулами, которые не дают дипольным моментам выстраиваться в нужную конфигурацию.
Чтобы преодолеть влияние водородных связей, физики разместили молекулы воды в наноразмерных (миллионные доли миллиметра) порах природного кристалла кордиерита — в результате расстояние между молекулами составило 5–10 ангстрем (один ангстрем составляет десятимиллионную часть миллиметра и приблизительно соответствует расстоянию между кислородом и водородом в молекуле воды), в то время как водородные связи проявляются на масштабе 1–2 ангстрем. При этом сохранилось дальнее взаимодействие между электрическими дипольными моментами, которое характерно для расстояний в 10–100 ангстрем — молекулы воды образовали трехмерную электродипольную решетку.
Готовый образец авторы охлаждали (вплоть до температуры в 0,3 кельвин), а также подвергали воздействию внешнего электрического поля с частотами в диапазоне от герц до мегагерц и в области
терагерц
, измеряя при этом
диэлектрическую проницаемость
, теплоемкость,
поляризацию
образца и возникающий
пироэлектрический
ток.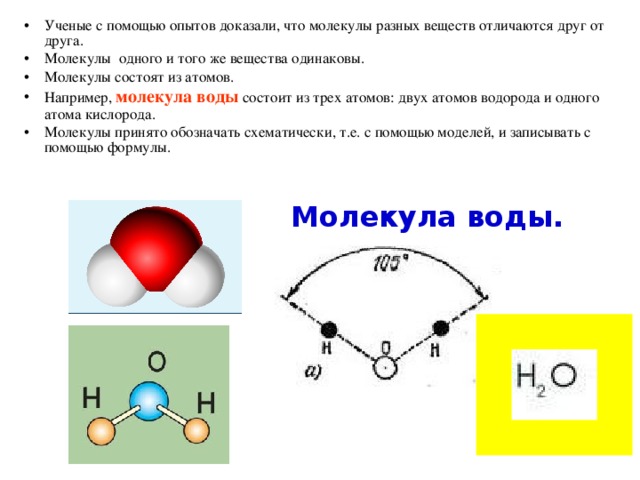 Те же измерения ученые проводили для кристалла без участия молекул воды — таким образом исследователям удалось извлечь из данных эксперимента информацию о том, как на изменения температуры и внешнего поля реагирует отдельно взятая электродипольная решетка.
Те же измерения ученые проводили для кристалла без участия молекул воды — таким образом исследователям удалось извлечь из данных эксперимента информацию о том, как на изменения температуры и внешнего поля реагирует отдельно взятая электродипольная решетка.
Для интерпретации результатов опыта физики использовали также компьютерные симуляции, моделируя взаимодействие системы диполей в диапазоне температур 0,001–300 кельвин и наблюдая за образующейся наноразмерной структурой.
В результате авторам удалось надежно обнаружить сегнетоэлектрический фазовый переход типа «порядок — беспорядок» в электродипольной решетке вблизи 3 кельвин — около этой температуры диэлектрические и термодинамические характеристики группы молекул воды, которые физики измеряли в эксперименте, претерпевали характерные для такого перехода изменения.
Компьютерные симуляции также продемонстрировали открытый в ходе опыта фазовый переход, а также позволили исследователям установить взаимную ориентацию дипольных моментов в решетке. Оказалось, что полученная структура сочетает в себе два различных вида упорядоченности (проявляющихся в разных плоскостях кристалла): сегнетоэлектрический, при котором дипольные моменты сонаправлены, и антисегнетоэлектрический, при котором направления дипольных моментов в соседних цепочках противоположны.
Оказалось, что полученная структура сочетает в себе два различных вида упорядоченности (проявляющихся в разных плоскостях кристалла): сегнетоэлектрический, при котором дипольные моменты сонаправлены, и антисегнетоэлектрический, при котором направления дипольных моментов в соседних цепочках противоположны.
По словам ученых, наряду с фундаментальной значимостью исследование имеет потенциал и для практического применения — воспроизведение упорядоченных состояний молекул воды в условиях лаборатории, вероятно, позволит достичь лучшего понимания явлений окружающей среды и поможет в создании устройств биосовместимой наноэлектроники.
От редактора
Изначально в заметке ошибочно сообщалось, что исследование опубликовано в Nature, но на самом деле статья вышла в Nature Communications.
Различные фазовые переходы часто становятся предметом исследования разных областей физики. Так, в прошлом году ученые предсказали преобразование формы звездных скоплений вокруг черной дыры, а в позапрошлом — впервые увидели переход азота в жидкое металлическое состояние.
Николай Мартыненко
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Диполь — вода — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
| Ассоциация диполей воды.
[1] |
Диполи воды имеют угловую форму, так как ядра атомов в них образуют равнобедренный треугольник. В основании его расположены два протона, а в вершине — ядро атома кислорода. При этом в молекуле воды две s / Я-гибридные орбитали атома кислорода образуют две ко-валентные связи О — Н ( длина которых около 0 1 нм) и остаются еще две неподеленные пары электронов.
[2]
Диполи воды соединены с гидрофильными группами белков водородными связями. Учитывая явления гидратации, можно объяснить рассмотренный нами процесс высаливания белков из растворов. При прибавлении к раствору белка высоких концентраций солей или таких органических растворителей, как спирт или ацетон, возникает конкуренция за молекулы воды между солью или спиртом, с одной стороны, и молекулами белка — с другой. При определенных концентрациях ионы солей, молекулы спирта или ацетона связывают такое большое количество молекул воды, что несвязанной воды недостаточно для растворения белка, и он выпадает в осадок.
При определенных концентрациях ионы солей, молекулы спирта или ацетона связывают такое большое количество молекул воды, что несвязанной воды недостаточно для растворения белка, и он выпадает в осадок.
[3]
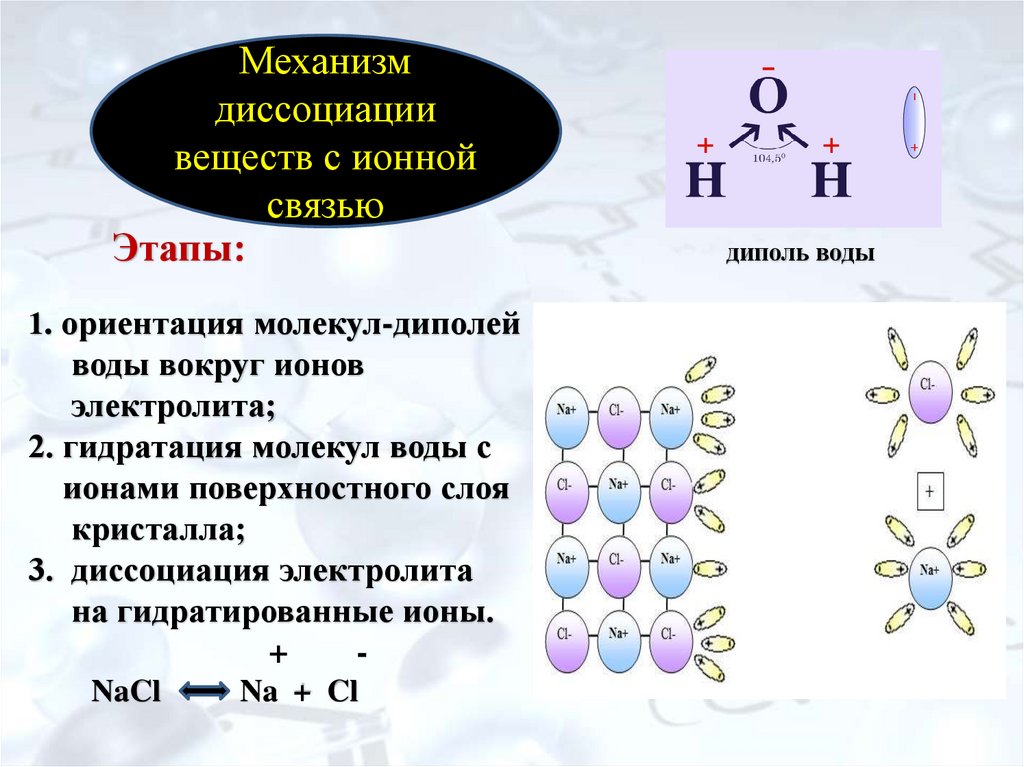
Диполи воды своими отрицательно заряженными концами притягиваются к положительным ионам металлов или водорода. Чем меньше заряд и больше размер ионов, тем быстрее и легче они отрываются диполями воды от поверхности элементарных кристаллов. Связь между листочками в пачках нарушается, и глина распускается в воде.
[4]
| Полярографические максимумы.
[5] |
Диполи воды, поляризуясь, образуют оболочку вокруг капли ртути, которая мешает адсорбироваться на поверхности капли новым ионам деполяризатора и предельный ток будет поддерживаться только диффузией деполяризатора через водную оболочку.
[6]
Если диполи воды ориентированы в поверхностном слое кристаллической решетки цементных минералов, то расстояния между поверхностными ионами практически не изменяются.
[7]
| Схема гидратации полярного электролита.
[8] |
Постепенно диполи воды проникают между ионами Na и С1 — в твердой фазе, отрывая их от кристалла.
[9]
При этом диполи воды Б поверхностном слое ориентированы таким образом, что кислород обращен в сторону газовой фазы, а водород — в сторону соли.
[10]
| Растворение кристалла поваренной соли в воде, сопровождающееся распадом на ионы.
[11] |
Окружающие кристаллик диполи воды сразу же ориентируются так, что их отрицательные полюса подходят к положительным ионам натрия, а положительные полюса — ближе к отрицательным ионам хлора. Таким образом, вокруг каждого иона поверхностного уровня кристалла образуется оболочка из молекул полярного растворителя — воды. Этот процесс называется сольватацией ( отлат. Если растворителем является вода, то такая сольватация называется гидратацией.
Если растворителем является вода, то такая сольватация называется гидратацией.
[12]
К полярным группам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер установил, что одна группа ОН притягивает три молекулы воды, СООН — четыре молекулы, СО — две молекулы, NH — две молекулы, Nh3 — три молекулы.
[13]
К полярным группам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер установил, что одна группа ОН притягивает три молекулы воды, СООН — четыре молекулы, С О — две молекулы, NH — две молекулы, МН2 — три молекулы.
[14]
Знак минус означает, что диполи воды обращены положительным концом наружу.
[15]
Страницы:
1
2
3
4
5
Молекула воды
Вода представляет собой химическое соединение и полярную молекулу, которая является жидкостью
при стандартной температуре и давлении.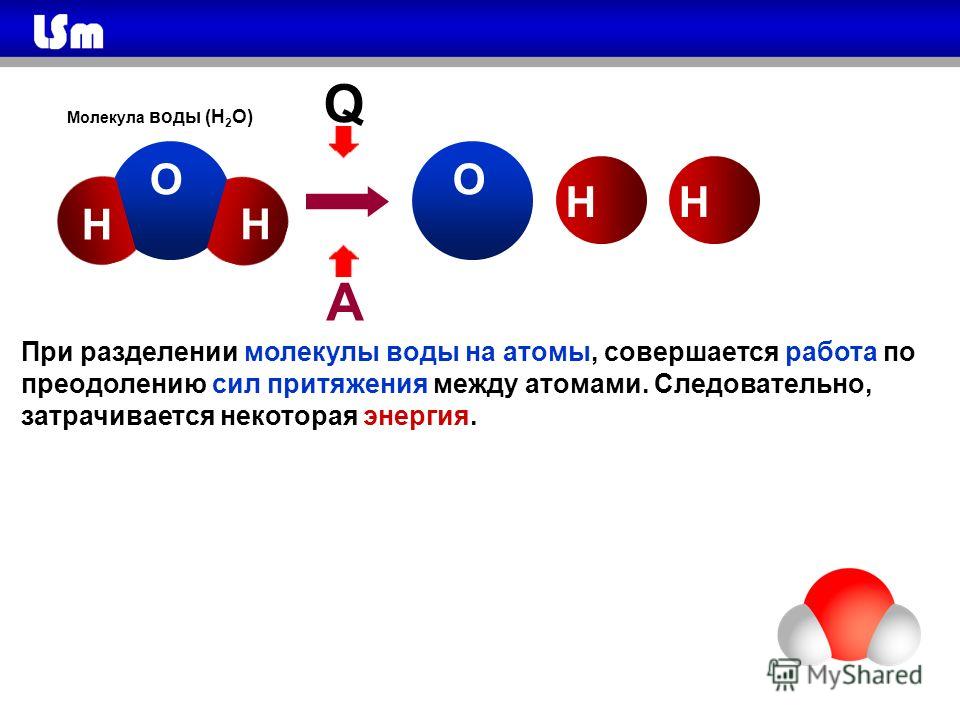 Он имеет химическое
Он имеет химическое
формула H 2 O, означающая, что одна молекула воды
состоит из двух атомов водорода и одного атома кислорода. Вода
встречается почти повсюду на земле и требуется всем
известная жизнь. Около 70% поверхности Земли покрыто
вода. Известно, что вода в виде льда существует на нескольких других
тел в Солнечной системе и за ее пределами, и доказательство того, что оно существует
(или существовали) в жидкой форме где-либо, кроме Земли.
быть убедительным доказательством внеземной жизни.
Общий
Твердое состояние воды известно как лед;
газообразное состояние известно как водяной пар (или пар).
единицы температуры (ранее градус Цельсия, а теперь
Кельвина) определяются через тройную точку
вода, 273,16 К (0,01 ° С) и 611,2 Па, температура
и давление, при котором твердая, жидкая и газообразная вода сосуществуют
в равновесии. Вода проявляет очень странное поведение,
Вода проявляет очень странное поведение,
включая образование таких состояний, как стекловидный лед,
некристаллическое (стекловидное) твердое состояние воды.
При температуре выше 647 К и давлении выше 22,064
МПа, совокупность молекул воды принимает сверхкритических условий, в которых жидкоподобные кластеры плавают внутри
парообразная фаза.
Путь жидкой воды является мерой количества жидкости
воды в столбе воздуха.
Биполярная природа молекулы воды
Важной особенностью молекулы воды является ее полярная природа.
молекула воды образует угол с атомами водорода
наконечники и кислород на вершине. Так как кислород имеет более высокую
электроотрицательность, чем водород, сторона молекулы
с атомом кислорода имеет частичный отрицательный заряд. Молекула
с такой разностью зарядов называется диполем.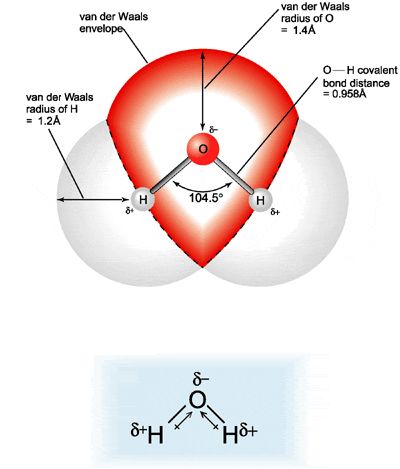 Заряд
Заряд
различия заставляют молекулы воды притягиваться к каждому
другое (относительно позитивные сферы привлекают
относительно отрицательные области) и к другим полярным молекулам.
Это притяжение известно как водород
склеивание.
водородная связь между двумя молекулами воды
Эта относительно слабая (по сравнению с ковалентными связями внутри
сама молекула воды) притяжение приводит к физическому
такие свойства, как относительно высокая температура кипения, поскольку
много тепловой энергии необходимо, чтобы расщепить водород
связи между молекулами. Например, сера является элементом
ниже кислорода в периодической таблице и его эквивалентное соединение,
сероводород (H 2 S) не содержит водорода
связей, и хотя его молекулярная масса в два раза превышает молекулярную массу воды,
это газ при комнатной температуре.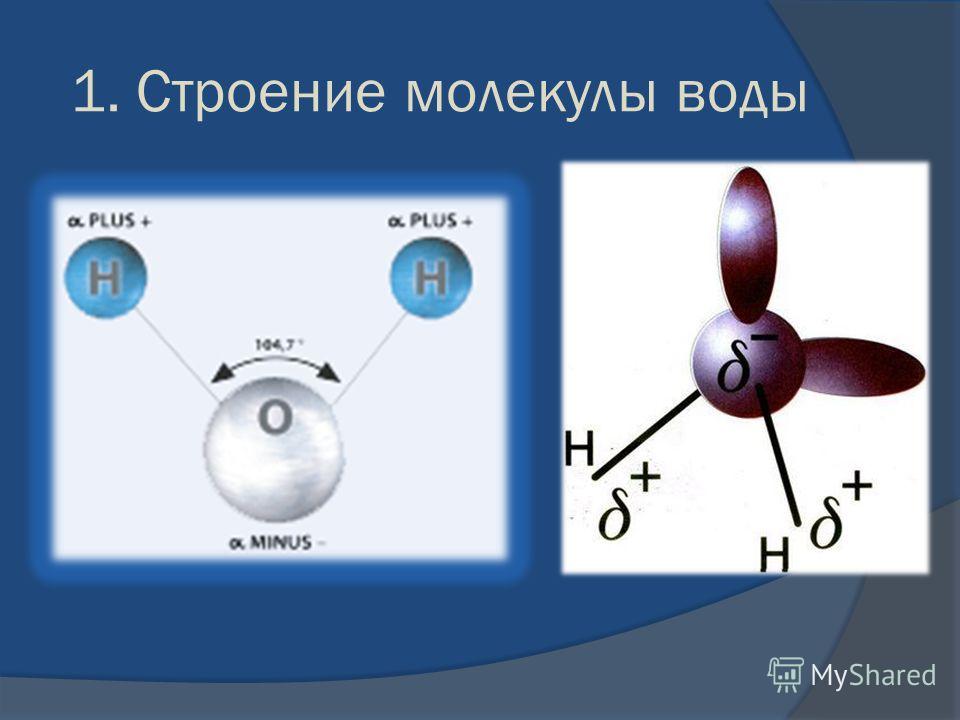 Дополнительная связь между
Дополнительная связь между
молекулы воды также придает жидкой воде большую удельную
теплоемкость.
Водородная связь также придает молекулам воды необычное поведение
при замерзании. Как и большинство других материалов, жидкость
становится более плотным с понижением температуры. Однако, в отличие от
большинство других материалов при охлаждении почти до точки замерзания
наличие водородных связей означает, что молекулы,
поскольку они перестраиваются, чтобы минимизировать свою энергию, образуют структуру
на самом деле он имеет меньшую плотность: следовательно, твердая форма, лед, будет плавать в воде. Другими словами, вода расширяется.
при замерзании (большинство других материалов дают усадку при затвердевании).
Жидкая вода достигает наибольшей плотности при температуре
4°С. Это имеет интересные последствия для водной жизни.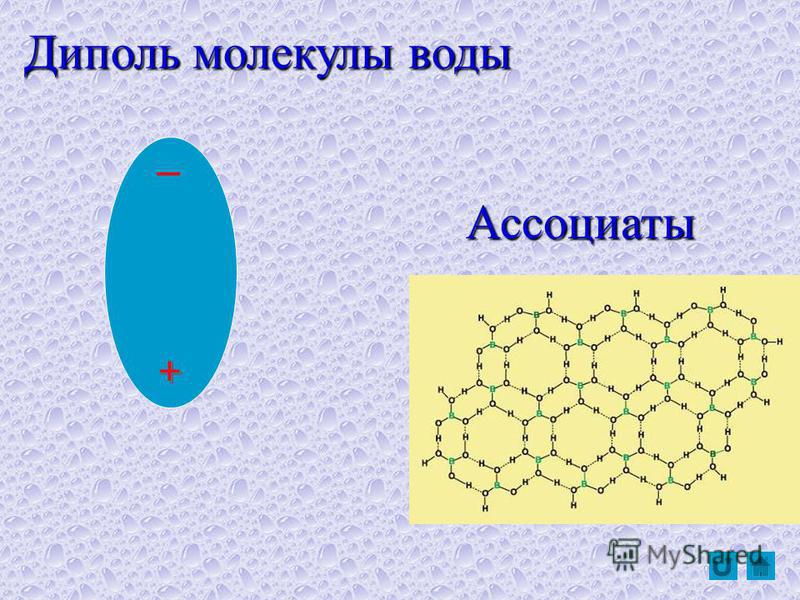
зимой. Вода, охлажденная на поверхности, становится более плотной и
тонет, образуя конвекционные потоки, охлаждающие всю воду
тела, но когда температура озерной воды достигает
4°C, вода на поверхности при дальнейшем охлаждении становится менее плотный и остается поверхностным слоем,
в конечном итоге образует лед. Поскольку нисходящая конвекция холоднее
вода блокируется изменением плотности, любое большое тело
вода, замерзшая зимой, будет иметь большую часть своей воды
жидкость при температуре 4 ° C под ледяной поверхностью, что позволяет рыбе
выживать. Это один из основных примеров тонкой настройки
физические свойства, поддерживающие жизнь на Земле, которые используются
как аргумент в пользу антропного принципа.
Другой
следствием этого является то, что лед растает, если будет приложено достаточное давление.
Структура воды и льда
Выше показано сравнение коробки диаметром 10 Ангстрем. Он ясно показывает, что лед занимает больше места из-за водородных связей, возникающих при переходе из жидкого состояния в твердое. Во льду Ih каждая вода образует четыре водородные связи с расстояниями O—O 2,76 Ангстрем до ближайшего соседа по кислороду. Из-за упорядоченной структуры во льду в данном пространстве объема меньше молекул h30.
Вода
в качестве растворителя
Вода также является хорошим растворителем из-за ее полярности. Растворитель
свойства воды жизненно важны в биологии, потому что многие биохимические
реакции протекают только в водных растворах (например,
реакции в цитоплазме и крови). Кроме того, вода
используется для транспортировки биологических молекул.
Когда ионное или полярное соединение входит в воду, оно окружено
молекулами воды.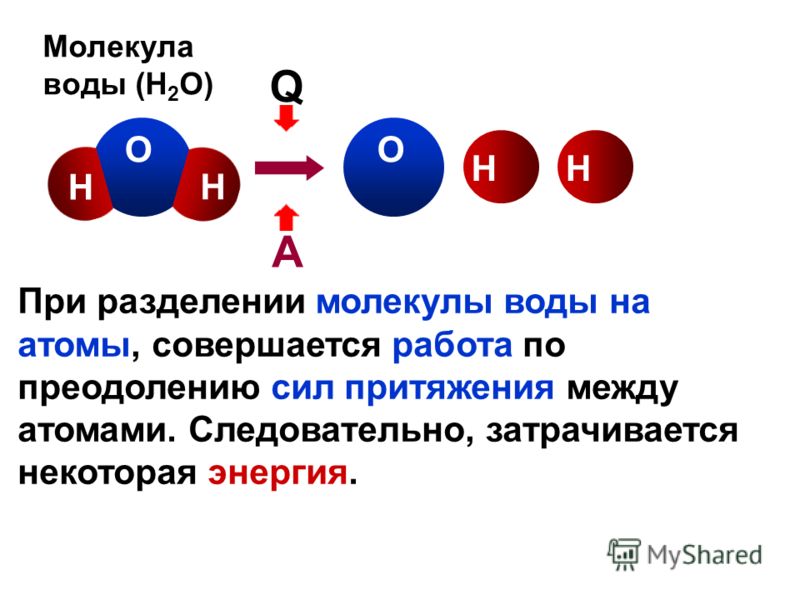 Относительно небольшой размер молекул воды обычно позволяет
Относительно небольшой размер молекул воды обычно позволяет
много молекул воды, чтобы окружить одну молекулу из раствор . частично
отрицательные диполи воды притягиваются к положительно заряженным компонентам
растворенное вещество, и наоборот для положительных диполей.
В общем, ионные и полярные вещества, такие как кислоты, спирты,
и соли легко растворимы в воде, а неполярные вещества
такие как жиры и масла не являются. Неполярные молекулы остаются вместе
в воде, поскольку она энергетически более выгодна для
молекулы воды образуют водородные связи друг с другом, чем
участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль; натрий
хлорид, NaCl, распадается на катионы Na + и
Cl — анионов, каждый из которых окружен молекулами воды.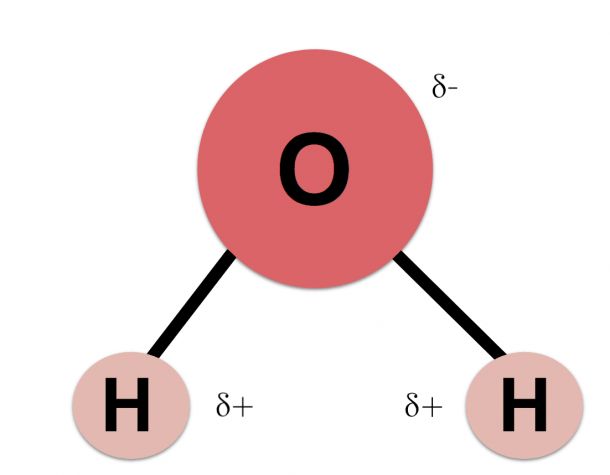
Затем ионы легко переносятся из своей кристаллической формы.
решетка в раствор. Примером неионного растворенного вещества является
столовый сахар. Водородная связь диполей воды с диполярным
участки молекулы сахара и позволяют ему переносить
уходит в раствор.
Сплоченность
и поверхностное натяжение
Прочные водородные связи придают воде высокую когезивность
и, следовательно, поверхностное натяжение. Это очевидно, когда
небольшое количество воды наносится на нерастворимую поверхность
и вода остается вместе, как капли. Эта функция важна
при переносе воды через ксилему вверх по стеблю у растений;
сильное межмолекулярное притяжение удерживает водяной столб
вместе и предотвратить напряжение, вызванное транспирацией.
Другие жидкости с более низким поверхностным натяжением будут иметь более высокое
склонность к «разрыву», образованию вакуумных или воздушных карманов и рендерингу
сосуды ксилемы не функционируют.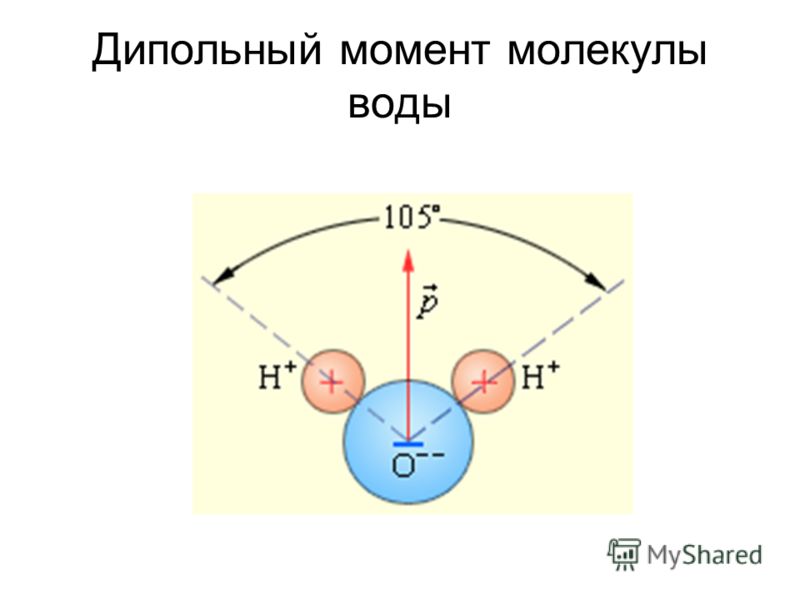
Проводимость
Чистая вода на самом деле хороший изолятор (плохой проводник),
Это означает, что он плохо проводит электричество. Потому что
вода является таким хорошим растворителем, однако она часто имеет некоторые
растворенные в нем растворенные вещества, чаще всего соли. Если вода имеет
таких примесей, то он может гораздо лучше проводить электричество,
потому что примеси, такие как соль, содержат свободные ионы в водной среде.
раствор, по которому может протекать электрический ток.
Электролиз
Вода может быть разделена на составные элементы, водород
и кислород, пропуская через него ток. Этот процесс
называется электролиз . Молекулы воды естественно
диссоциировать на ионы H + и OH — ,
которые притягиваются к катоду и аноду соответственно.
На катоде два иона H + подхватывают электроны
и форма H 2 газ.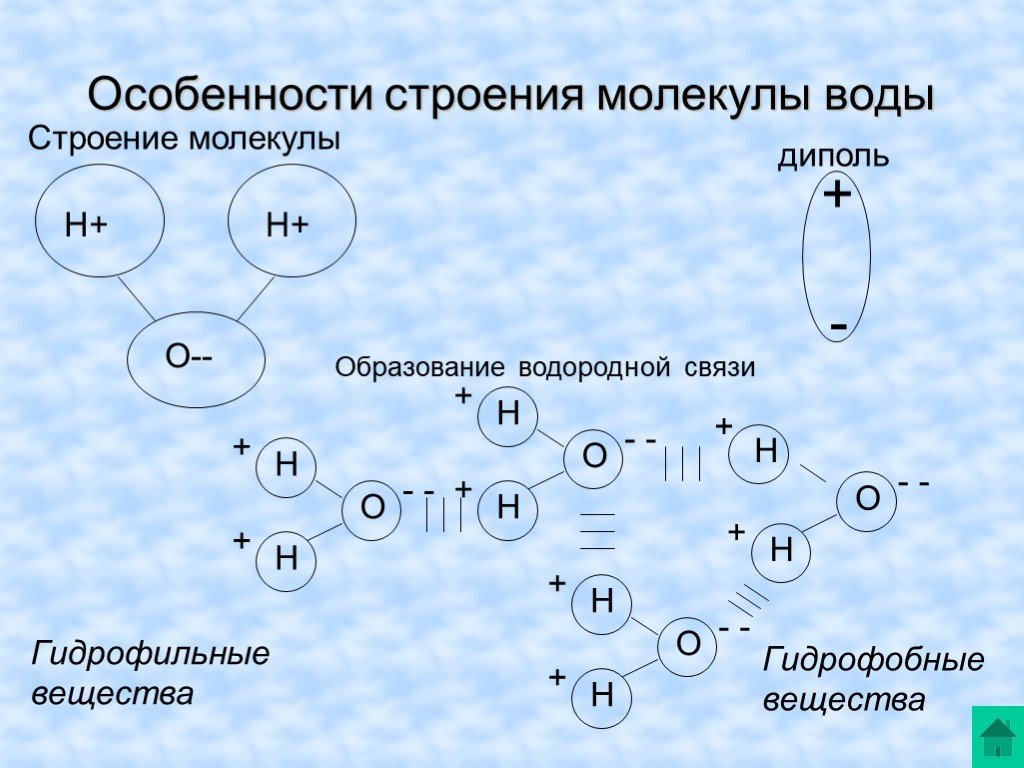 На аноде четыре иона OH — объединяются и выделяют газ O 2 , молекулярную воду,
На аноде четыре иона OH — объединяются и выделяют газ O 2 , молекулярную воду,
и четыре электрона. Газы образовали пузырьки на поверхности,
где их можно собрать.
Реакционная способность
Химически вода амфотерна: способна действовать как кислота
или база. Иногда термин гидроксидная кислота используется
используется, когда вода действует как кислота в химической реакции.
При рН 7 (нейтральный) концентрация ионов гидроксида
(ОН — ) равен гидроксонию (H 3 O + )
или ионы водорода (H + ) ионы. Если равновесие
нарушается, раствор становится кислым (более высокая концентрация
ионов гидроксония) или основной (более высокая концентрация гидроксида
ионы).
Вода может действовать как кислота
или основание в реакциях.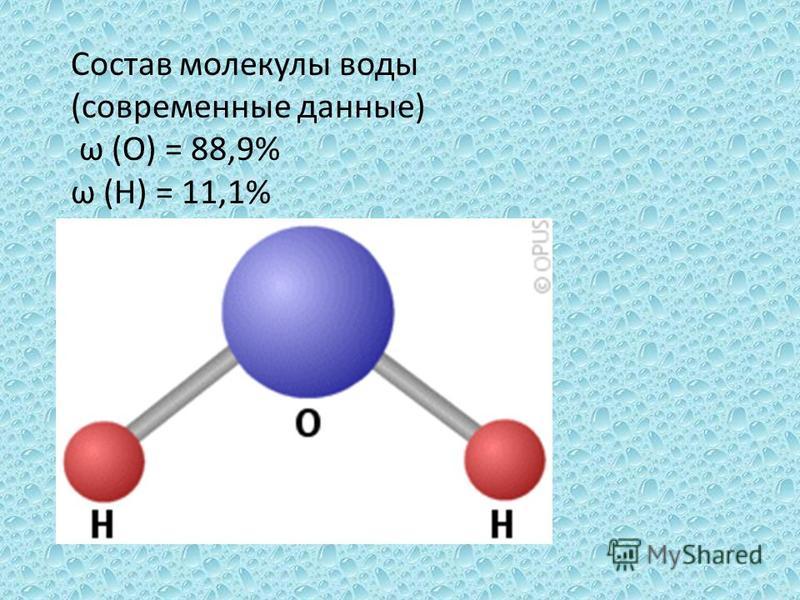 По системе Бренстеда-Лоури кислоту определяют
По системе Бренстеда-Лоури кислоту определяют
как частица, которая отдает протон (ион H +) в реакции, и основание как один
который получает протон. При взаимодействии с более сильной кислотой вода действует как основание;
при реакции с более слабой кислотой действует как кислота. Например, он получает
ион H+ из HCl в равновесии:
HCl + H 2 O —> H 3 O + + Cl —
Здесь вода действует как основание, получая ион H+.
Кислота отдает ион Н+, и вода тоже может это делать, например, в реакции
с аммиаком, Nh4:
NH 3 + H 2 O —> NH 4 + + OH —
pH на практике
25
Теоретически чистая вода имеет рН 7. На практике чистую воду очень трудно
производить. Вода, оставленная на воздухе в течение любого промежутка времени, быстро растворяется.
углекислый газ, образующий раствор угольной кислоты, с предельным рН ~5,7
(ссылка: Кендалл, Дж. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
Очистка
вода
Очищенная вода необходима для многих промышленных применений,
так и для потребления. Людям нужна вода, которая
не содержат слишком много соли или других примесей. Общие примеси
включают химические вещества или вредные бактерии. Некоторые растворенные вещества
приемлемым и даже желательным для воспринимаемого улучшения вкуса.
Воду, пригодную для питья, называют 9.0003 питьевая
вода .
Шесть популярных методов
очистки воды:
- Фильтрация : Вода проходит через
сито, которое улавливает мелкие частицы. Чем плотнее
меш сита, тем мельче должны быть частицы, чтобы
пройти через. Фильтрация недостаточна для полного
Фильтрация недостаточна для полного
очищать воду, но часто это необходимый первый шаг,
поскольку такие частицы могут мешать более тщательному
методы очистки. - Кипячение : Вода нагревается до кипения
точки достаточно долго, чтобы инактивировать или убить микроорганизмы
которые обычно живут в воде при комнатной температуре. В областях
где вода «жесткая» (содержащая растворенный кальций
соли), кипячение разлагает бикарбонат-ион, в результате чего
часть (но не весь) растворенного кальция осаждается
в виде карбоната кальция. Это так называемый
«налет», который накапливается на элементах чайника и т. д. в жесткой воде
области. За исключением кальция, кипячение не
удаляют растворенные вещества с более высокой температурой кипения, чем вода, и
на самом деле увеличивает их концентрацию (из-за некоторого количества воды
теряется как пар) - Угольная фильтрация : Древесный уголь, форма
углерода с большой площадью поверхности из-за его способа
препарата, адсорбирует многие соединения, в том числе некоторые токсичные
соединения. Вода пропускается через активированный уголь
Вода пропускается через активированный уголь
для удаления таких загрязнений. Этот метод чаще всего
используется в бытовых фильтрах для воды и аквариумах. Семья
фильтры для питьевой воды иногда также содержат серебро,
следовые количества ионов серебра, обладающих бактерицидным действием. - Дистилляция : Дистилляция включает кипячение
вода для образования водяного пара. Затем водяной пар
поднимается на охлажденную поверхность, где может снова сконденсироваться в
жидкость и собираться. Поскольку растворенные вещества не
обычно испаряясь, они остаются в кипящем растворе.
Даже дистилляция не очищает воду полностью, т.к.
загрязняющих веществ с одинаковыми температурами кипения и капельками
неиспарившейся жидкости, переносимой паром. Однако,
9Вода чистотой 9,9% может быть получена дистилляцией.
- Обратный осмос : механическое давление
применяется к нечистому раствору, чтобы протолкнуть чистую воду через
полупроницаемая мембрана. Термин обратный осмос ,
потому что нормальный осмос привел бы к движению чистой воды
в другом направлении, чтобы разбавить примеси. Задний ход
осмос теоретически является наиболее тщательным методом крупномасштабного
доступна очистка воды, хотя идеальная полупроницаемость
мембраны создать сложно. при обмене
хроматография : В этом случае пропускают воду
через заряженную колонку смолы, которая имеет боковые цепи, которые
задерживают ионы кальция, магния и других тяжелых металлов. В
во многих лабораториях этот метод очистки заменил
дистилляция, так как она обеспечивает большой объем очень чистого
вода быстрее и с меньшим потреблением энергии, чем другие
процессы. Вода, очищенная таким образом, называется деионизированный
Вода, очищенная таким образом, называется деионизированный
вода .
Сброс воды
Сброс воды – злоупотребление водой, т.е.
используя его без надобности. Примером может служить использование воды,
особенно вода, очищенная до стандартов безопасной питьевой воды для человека,
в ненужном поливе. Также в домах может быть вода.
впустую, если унитаз смыт без необходимости или бачок
утечки. Загрязнение воды может быть самым большим
однократное злоупотребление водой. В той мере, в какой загрязнитель ограничивает
другие виды использования воды, она становится пустой тратой ресурса,
независимо от выгоды для загрязнителя.
Мифология
Вода — один из четырех классических элементов наряду с
огонь, земля и воздух, и считался илем, или основным
вещи вселенной.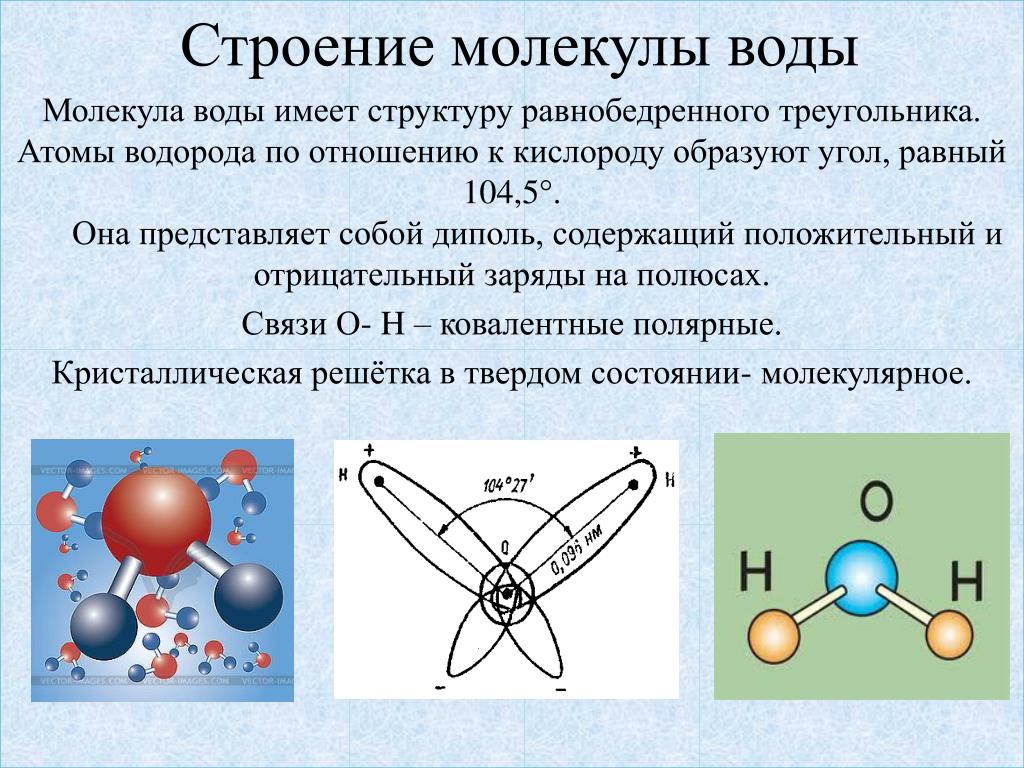 Вода считалась холодной и влажной.
Вода считалась холодной и влажной.
В теории четырех телесных жидкостей вода ассоциировалась
с мокротой. Вода также была одним из пяти элементов в
Китайский даосизм, наряду с землей, огнем, деревом и металлом.
Вода
права и развитие
Доклад ЮНЕСКО об освоении водных ресурсов мира (WWDR, 2003 г.) из
его Программа оценки водных ресурсов мира указывает, что в
ближайшие 20 лет мир столкнется с беспрецедентной нехваткой
питьевой воды. Количество воды, доступное каждому
прогнозируется снижение на 30%. Причины — загрязнение,
глобальное потепление и политические проблемы. Более 2,2 млн.
человек умерло в 2000 году от болезней, связанных с потреблением
загрязненной воды. В 2004 году британская благотворительная организация WaterAid
сообщили, что ребенок умирает каждые 15 секунд из-за легкого
предотвратимых заболеваний, связанных с водой. В отчете указывается
В отчете указывается
большие глобальные различия в необработанном объеме доступных
вода: от 10 м³ на человека в год в Кувейте до 812,121
м³ во Французской Гвиане. Однако более богатые страны, такие как Кувейт
может легче справиться с нехваткой воды. в
Водное право США разделено на две правовые доктрины:
права на прибрежные воды, используемые в восточной и южной
государства, где есть обилие воды и присвоение
доктрина (или доктрина Колорадо), используемая в засушливых западных
состояния.
диполей молекул воды | Примечания к пересмотру биологии уровня A
Присоединяйся сейчас
Если вы готовы сдать экзамены по биологии уровня A, станьте участником прямо сейчас, чтобы получить полный доступ ко всей нашей библиотеке материалов для повторения.
Присоединяйтесь к более чем 22 000 учащихся, сдавших экзамены благодаря нам!
Зарегистрируйтесь ниже, чтобы получить мгновенный доступ!
Присоединяйтесь →
Или попробуйте пример.
 ..
..
Еще не готовы приобрести комплект для доработки? Без проблем. Если вы хотите ознакомиться с тем, что мы предлагаем, перед покупкой, у нас есть бесплатная подписка с образцами материалов для пересмотра.
Зарегистрируйтесь в качестве бесплатного члена ниже, и вы вернетесь на эту страницу, чтобы попробовать образцы материалов перед покупкой.
Скачать образцы →
Быстрая навигация
[скрыть]
Сводка диполей молекул воды
- Вода является основным компонентом всех организмов
- Молекула воды называется диполярной, потому что она имеет положительный и отрицательный полюс в результате неравномерного распределения электронов внутри нее
- Дипольная природа молекулы воды создает силы притяжения известная как водородная связь, позволяющая им слипаться
- Одним из многих свойств воды является высокая удельная теплоемкость, что означает, что для нагрева данной массы воды требуется много энергии
- Большое количество водородных связей в молекулах воды также означает, что для испарения одного грамма воды требуется много энергии.
 Энергия называется скрытой теплотой парообразования
Энергия называется скрытой теплотой парообразования - Вода также используется для разрушения многих сложных молекул, например, путем гидролиза; дисахарид углеводы, расщепленные на моносахариды
Введение в воду
Вода является основным химическим компонентом всех клеток при построении новых клеток, а также используется для разрушения молекул. Он играет много важных ролей в организмах и является ключевым реагентом, используемым в фотосинтезе. По сути, вода известна как среда жизни, где около 70% поверхности Земли покрыто водой. Его полезные и уникальные свойства обусловлены его структурой. Это химическое соединение, известное как полярная молекула, где при стандартных температурах и давлении вода представляет собой жидкую водную форму, а твердое состояние воды известно как лед.
Подробнее о структуре и свойствах воды
Химическая структура воды
- Вода имеет гораздо меньшую структуру по сравнению с другими молекулами
- Является универсальным растворителем
- Вода состоит из 2 атомов водорода, связанных с одним атом кислорода, что дает молекулярную формулу H 2 O.
 Атомы водорода связаны с атомами кислорода через ковалентные связи, которые представляют собой тип химической связи, которая соединяет атомы водорода и кислорода вместе
Атомы водорода связаны с атомами кислорода через ковалентные связи, которые представляют собой тип химической связи, которая соединяет атомы водорода и кислорода вместе - Ковалентная связь – это связь, в которой два атома имеют одну и ту же пару электронов.
- Ковалентные связи образуются, когда электроны распределяются между двумя атомами для заполнения каждой внешней оболочки. Атому водорода требуется еще один электрон, а атому кислорода необходимо получить еще один электрон, чтобы внешняя оболочка была полной . Полярные молекулы, помещенные в воду, растворяются и диссоциируют на ионы воды. Ионные молекулы при попадании в воду диссоциируют на ионы. Именно вода обеспечивает протекание различных химических реакций:
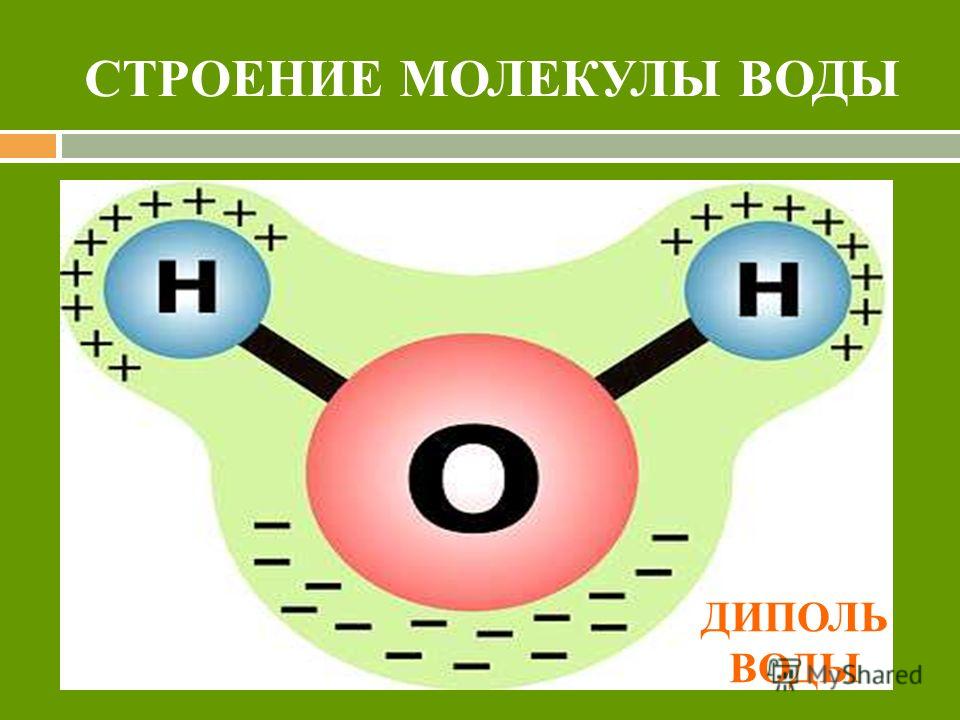
- Электроны в ковалентных связях воды распределены неравномерно и расположены ближе к ядру кислорода, чем к ядрам водорода. Это связано с тем, что отрицательно заряженные электроны в электронной паре больше притягиваются к ядру кислорода, поскольку положительно заряженных протонов больше.
 Ядро кислорода в природе намного больше, так как в нем 8 протонов, тогда как ядро водорода имеет 1 протон (рис. 1). Протоны по своей природе положительны, а электроны заряжены отрицательно. Электроны, связанные ковалентной связью, будут притягиваться к положительным вещам, и поскольку в ядре кислорода больше протонов, чем в водороде, они будут больше притягиваться к атому кислорода.
Ядро кислорода в природе намного больше, так как в нем 8 протонов, тогда как ядро водорода имеет 1 протон (рис. 1). Протоны по своей природе положительны, а электроны заряжены отрицательно. Электроны, связанные ковалентной связью, будут притягиваться к положительным вещам, и поскольку в ядре кислорода больше протонов, чем в водороде, они будут больше притягиваться к атому кислорода. - Неравное распределение электронов приводит к тому, что атом кислорода становится полярным и слегка отрицательным. Есть слегка отрицательный атом кислорода и слегка положительные атомы водорода.
Неравномерное распределение заряда по молекулам воды делает ее полярной молекулой .
Полярные молекулы — это молекулы с неравномерным распределением заряда. Полярность воды вызывает притяжение между молекулами воды. Эта сила притяжения известна как водородная связь .Водородная связь в воде
Связь между молекулами, при которой слегка положительные атомы водорода в одной молекуле воды притягиваются к слегка отрицательному атому кислорода в другой молекуле воды.
 Тип притяжения представляет собой слабое взаимодействие, которое происходит между слегка отрицательно заряженными атомами и слегка положительно заряженными атомами. Она слабее ковалентной связи, но представляет собой сильнейшую межмолекулярную силу. Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.
Тип притяжения представляет собой слабое взаимодействие, которое происходит между слегка отрицательно заряженными атомами и слегка положительно заряженными атомами. Она слабее ковалентной связи, но представляет собой сильнейшую межмолекулярную силу. Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.Водородная связь представляет собой слабое взаимодействие, возникающее между слегка отрицательно заряженными атомами и слегка положительно заряженными атомами.
Вода образует внутри себя водородные связи. Множество водородных связей в воде придает ей высокую стабильность, поэтому для повышения температуры воды требуется большое количество энергии.
Рисунок 1: Молекула воды
Физические свойства воды
Хотя вода является самой распространенной жидкостью на Земле, структура молекулы воды обуславливает ее несколько необычных свойств.
В частности, многие из указанных ниже свойств обусловлены его диполярной природой и последующими водородными связями , которые он образует и допускает.
Растворитель
Вода является хорошим растворителем, поскольку она представляет собой заряженную молекулу, позволяющую легко ее транспортировать, а дипольная природа ее молекулы воды позволяет другим полярным молекулам легко растворяться в воде. Такие примеры заряженных полярных молекул, как соли, аминокислоты и сахара, способны легко растворяться в воде. Их называют гидрофильный ; «водолюбивые» молекулы. Неполярные молекулы, такие как липиды, называются гидрофобными , «ненавидящими воду».
Высокая теплоемкость
Склонность молекул воды слипаться называется когезией. Следовательно, для разделения слипшихся молекул потребовалось бы больше тепловой энергии, чем если бы они не были связаны друг с другом. Что касается воды, вода не очень легко меняет температуру, поскольку ее удельная теплоемкость составляет 4,2 Дж г-1 °C-1, что, говоря простым языком, означает, что для нагрева 1 г воды на 1 °C требуется 4,2 Дж энергии.
 . Это очень высокий показатель, который поддерживает стабильность водной и клеточной среды.
. Это очень высокий показатель, который поддерживает стабильность водной и клеточной среды.Высокая скрытая теплота парообразования
Водородные связи между молекулами воды позволяют ей иметь высокую скрытую теплоту парообразования. Следовательно, для перехода воды из жидкого состояния в газообразное требуется большое количество энергии, при этом испарение оказывает охлаждающее действие на организмы, такое как потоотделение у животных и транспирация у растений
Плотность
Вода обладает уникальным свойством что в твердом состоянии (лед) он менее плотный, чем в жидком состоянии, и может плавать на воде. Это свойство отличается от обычной ситуации, поскольку большинство веществ находятся в газообразной форме, когда они менее плотные, а более плотные находятся в твердом состоянии. Это показывает, насколько вода отличается. Свойство воды делает жизненно важным для водных организмов способность выживать при минусовых температурах, например, в прудах, озерах и т.
 д.
д.Когезия и поверхностное натяжение в воде
Вода обладает свойствами когезии, когда они имеют тенденцию слипаться с другими молекулами. Это связано с водородными связями внутри молекул воды, которые вызывают большие силы сцепления, что позволяет воде проходить через трубку, например, в растениях; сосуды ксилемы, которые представляют собой длинные трубки, которые помогают в транспортировке воды, чтобы обеспечить план механической поддержкой. Другая сила называется 9Поверхностное натяжение 0003 также является уникальным свойством воды. Поверхностное натяжение — это сила притяжения, которая может действовать на поверхность других молекул жидкости, что придает поверхности жидкости тенденцию сжиматься до минимальной площади поверхности, а не вытекать из массы воды. Поверхностное натяжение воды позволяет фигуристам ходить по воде или позволяет насекомым, которые обычно плотнее воды, плавать по поверхности воды.
pH
Вода сама по себе частично ионизирована и содержит ионы H+, что делает некоторые биохимические реакции чувствительными к изменениям pH.
 Чистая вода не буферизуется при нейтральном рН, в отличие от цитоплазмы и тканевых жидкостей живых организмов, которые буферизуются при нейтральном рН 7,5.
Чистая вода не буферизуется при нейтральном рН, в отличие от цитоплазмы и тканевых жидкостей живых организмов, которые буферизуются при нейтральном рН 7,5.Ионизация
Ионизация – это процесс образования или расщепления молекул на их катионы и анионы. Например, когда хлорид натрия (NaCl) растворяется в воде, они ионизируются и разделяются на положительные и отрицательные ионы (Na ++ , Cl – ).
Часто задаваемые вопросы
Что такое диполи воды?
Молекула воды полярна по своей природе. Он имеет два полюса, частичный положительный полюс и частичный отрицательный полюс. Атом кислорода имеет частичный отрицательный заряд, тогда как атомы водорода имеют частичный положительный заряд.
Как образуются диполи в молекуле воды?
Диполи образуются в молекулах воды из-за различий в электроотрицательности или неравного распределения электронов между атомами кислорода и водорода.
Почему важна биполярность молекул воды?
Полярность воды делает ее отличным растворителем.

- Электроны в ковалентных связях воды распределены неравномерно и расположены ближе к ядру кислорода, чем к ядрам водорода. Это связано с тем, что отрицательно заряженные электроны в электронной паре больше притягиваются к ядру кислорода, поскольку положительно заряженных протонов больше.

 Фильтрация недостаточна для полного
Фильтрация недостаточна для полного Вода пропускается через активированный уголь
Вода пропускается через активированный уголь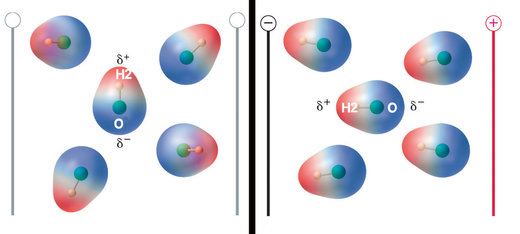
 Вода, очищенная таким образом, называется деионизированный
Вода, очищенная таким образом, называется деионизированный Энергия называется скрытой теплотой парообразования
Энергия называется скрытой теплотой парообразования Атомы водорода связаны с атомами кислорода через ковалентные связи, которые представляют собой тип химической связи, которая соединяет атомы водорода и кислорода вместе
Атомы водорода связаны с атомами кислорода через ковалентные связи, которые представляют собой тип химической связи, которая соединяет атомы водорода и кислорода вместе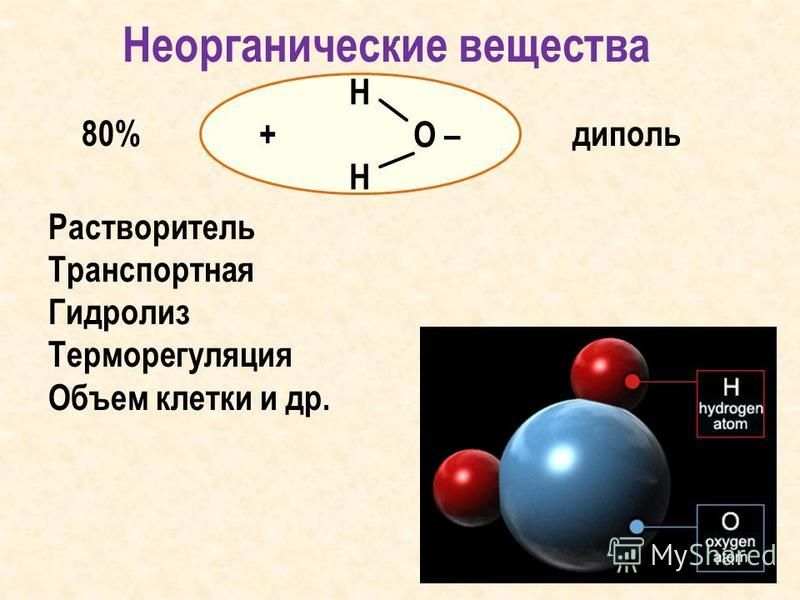 Ядро кислорода в природе намного больше, так как в нем 8 протонов, тогда как ядро водорода имеет 1 протон (рис. 1). Протоны по своей природе положительны, а электроны заряжены отрицательно. Электроны, связанные ковалентной связью, будут притягиваться к положительным вещам, и поскольку в ядре кислорода больше протонов, чем в водороде, они будут больше притягиваться к атому кислорода.
Ядро кислорода в природе намного больше, так как в нем 8 протонов, тогда как ядро водорода имеет 1 протон (рис. 1). Протоны по своей природе положительны, а электроны заряжены отрицательно. Электроны, связанные ковалентной связью, будут притягиваться к положительным вещам, и поскольку в ядре кислорода больше протонов, чем в водороде, они будут больше притягиваться к атому кислорода.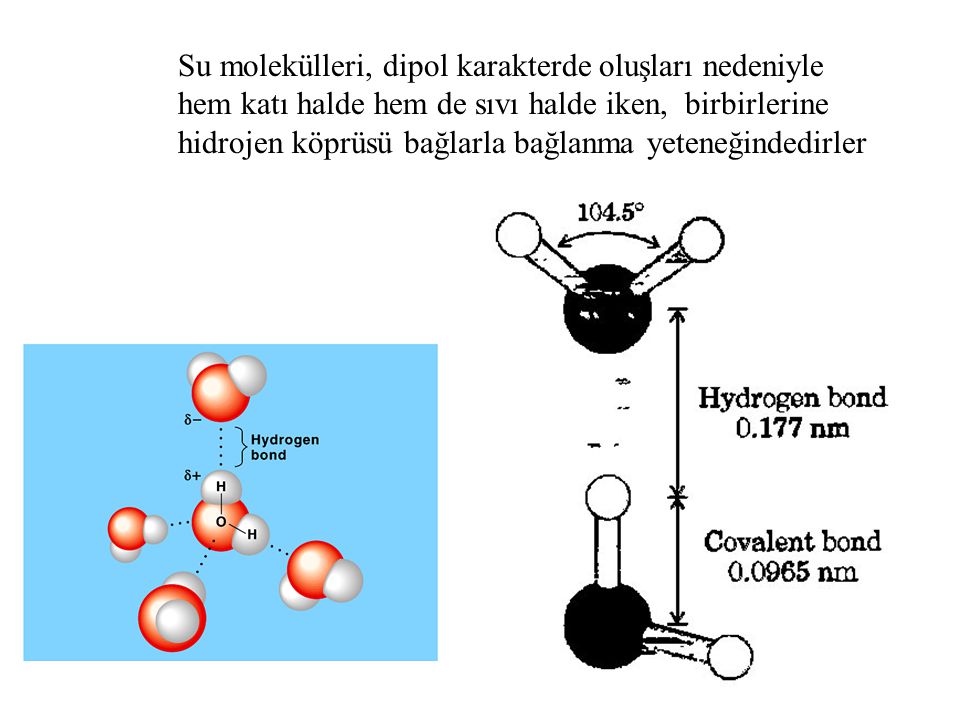 Тип притяжения представляет собой слабое взаимодействие, которое происходит между слегка отрицательно заряженными атомами и слегка положительно заряженными атомами. Она слабее ковалентной связи, но представляет собой сильнейшую межмолекулярную силу. Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.
Тип притяжения представляет собой слабое взаимодействие, которое происходит между слегка отрицательно заряженными атомами и слегка положительно заряженными атомами. Она слабее ковалентной связи, но представляет собой сильнейшую межмолекулярную силу. Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.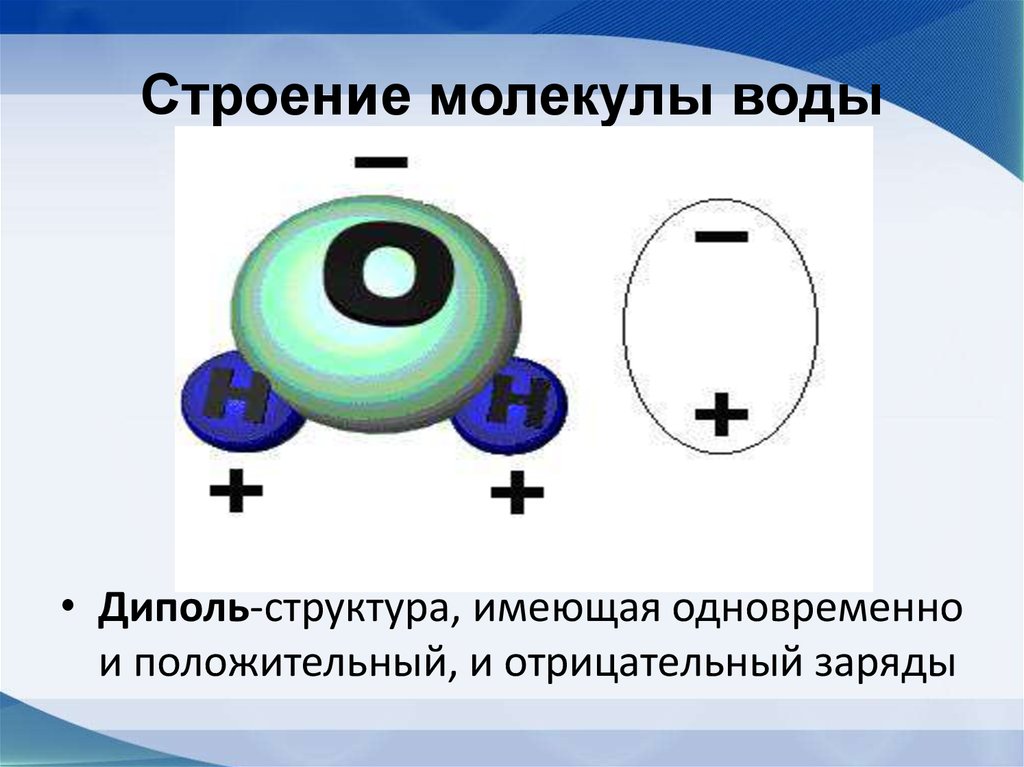
 . Это очень высокий показатель, который поддерживает стабильность водной и клеточной среды.
. Это очень высокий показатель, который поддерживает стабильность водной и клеточной среды. д.
д. Чистая вода не буферизуется при нейтральном рН, в отличие от цитоплазмы и тканевых жидкостей живых организмов, которые буферизуются при нейтральном рН 7,5.
Чистая вода не буферизуется при нейтральном рН, в отличие от цитоплазмы и тканевых жидкостей живых организмов, которые буферизуются при нейтральном рН 7,5.