Содержание
Магний, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Калорийность Вода стелмас Магний плюс. Химический состав и пищевая ценность.
Химический состав и анализ пищевой ценности
Пищевая ценность и химический состав
«Вода стелмас Магний плюс».
В таблице приведено содержание пищевых веществ (калорийности, белков, жиров, углеводов, витаминов и минералов) на 100 грамм съедобной части.
| Нутриент | Количество | Норма** | % от нормы в 100 г | % от нормы в 100 ккал | 100% нормы |
| Макроэлементы | |||||
| Калий, K | 500 мг | 2500 мг | 20% | 500 г | |
| Кальций, Ca | 500 мг | 1000 мг | 50% | 200 г | |
| Магний, Mg | 350 мг | 400 мг | 87. 5% 5% | 114 г | |
| Натрий, Na | 500 мг | 1300 мг | 38.5% | 260 г |
Энергетическая ценность Вода стелмас Магний плюс составляет 0 кКал.
Основной источник: Создан в приложении пользователем. Подробнее.
** В данной таблице указаны средние нормы витаминов и минералов для взрослого человека. Если вы хотите узнать нормы с учетом вашего пола, возраста и других факторов, тогда воспользуйтесь приложением
«Мой здоровый рацион».
Вода стелмас Магний плюс богат такими витаминами и минералами, как:
калием — 20 %, кальцием — 50 %, магнием — 87,5 %
- Калий является основным внутриклеточным ионом, принимающим участие в регуляции водного, кислотного и электролитного баланса, участвует в процессах проведения нервных импульсов, регуляции давления.

- Кальций является главной составляющей наших костей, выступает регулятором нервной системы, участвует в мышечном сокращении. Дефицит кальция приводит к деминерализации позвоночника, костей таза и нижних конечностей, повышает риск развития остеопороза.
- Магний участвует в энергетическом метаболизме, синтезе белков, нуклеиновых кислот, обладает стабилизирующим действием для мембран, необходим для поддержания гомеостаза кальция, калия и натрия. Недостаток магния приводит к гипомагниемии, повышению риска развития гипертонии, болезней сердца.
Полный справочник самых полезных продуктов вы можете посмотреть в приложении «Мой здоровый рацион».
Калорийность и химический состав других продуктов
- Зелёная чечевица вареная без соли
- Арахисовое печенье
- Суп-рассольник ПП
- Вермишель паутинка
- тесто пельменное
- Рыбий жир в капсулах
- Макароны из полбы цельнозерновые
- Шампиньоны запеченые
- Кексы шоколадные
- квасоля в томаті (щедра нива)
- фарш для пельменей с курицей
- салат рукколой
- Чечевичный хлеб
- Блины на кефире
- пельмени куриные
- Окрошка сухая
- Овощной микс
- Кекс в микроволновке
- Самса жареная 300
- Сок томатный Сочная долина
- Протеиновые мюсли умный завтрак
- спагетти с куриной грудкой
- kapustni salat s kukuruzoy
- Крем желейный
- Манник тыквенный
- Сендвич с курицей и яйцом
- Морская капуста без уксуса и консервантов
- Хлебцы клюквенные
- Уха
- Кекс в кружке для микроволновки
- суп грибной (yelli)
- Печенье с изюмом (eVitalia)
- окунь морской на пару
- Суп гороховый2
- Компливит
- баранина с овощами
- Творог 5% ,»зёрнышко»
- Брокколи + шпинат
- כבד דגпечень трески
- Йогурт ванильный (Эвиталия)
- Арахисовая паста с какао
- Кокосовая паста
- Линь жареный
- Суп гороховый
- Black Sesame
- Батончик BaseBar (Bubblegum)
- Гороховый суп
- гречка
- Соевые битки
- салат » моей матери «
- Майонез 40% Беларусь
- бульон куриный
- Тофу
- Овощной салат с моцареллой 09.
 05.19
05.19 - Оливки Senorita
- Суп-пюре бататовый
- филе куриное отварное
- Окрошка
- Филе индейки тушеное
- Филе куриное тушеное
- томатный соус Сицилиана с оливками «De Cecco»
- Семечки тыквенные очищенные
- Соевые битки в соевом соусе
- Халва на фруктозе со стевией
- Свинина в сметане
- Мамины котлеты
- Impact whey protein (banana)
- Бахчисарай каберне
- Тыквенный крем-суп
- Кофе сгущеное
- TidBit
- Кофе 1 сахара
- Двойной кофе 1,5 сахара
- Сельдь тихоокеанская пресервы в острой заливке огонек [Астронотус] 150г
- чиабата ржаная
- Мой тирамису 1322
- Савоярди мои
- Комплекс витаминно-минеральный для женщин
- Салат греческий
- Печенье пьюр
- Біфідойогурт АКТИВІА Персик-Чіа-Гранола
- Суп овощной
- блины из кабачков с сыром
- Морс клюква-шиповник
- Колбаса городская
- куриные маффины с брокколи
- Печенье овсяное
- Крабовые палочки с крилем
- Цезарь лайт
- Ягодное суфле с гранолой
- Ветчина куриная филейная «ПРАВИЛЬНОЕ РЕШЕНИЕ»
- Салат из овощей
- Мюсли без сахара
- Макрурус на пару
- Лимонный корж
- Креме йогурт
- Мороженое
- мусс клубника
- свежий салат
- торт ягода
Метки:
Вода стелмас Магний плюс
калорийность 0 кКал, химический состав, питательная ценность, витамины, минералы, чем полезен Вода стелмас Магний плюс, калории, нутриенты, полезные свойства Вода стелмас Магний плюс
Калькуляторы
Реакция магния с водяным паром | Выставочная химия
Посмотреть это
Посмотреть видео и загрузить технические заметки с веб-сайта Education in Chemistry: rsc.li/3oBNyqC
При обучении серии реактивности учащиеся обычно проводят практические занятия, чтобы изучить закономерности в химии. реакции кислот с менее активными металлами. Точно так же они могут увидеть демонстрацию более реакционноспособных металлов с водой или даже сами исследовать их на практике. Такой подход создает у некоторых учеников впечатление, что эти два типа реакций несопоставимы. Как металл средней реактивности, магний можно использовать, чтобы помочь учащимся провести ментальный мост между этими типами реакций. Лента магния удовлетворительно реагирует с сильными кислотами и практически не реагирует с водой комнатной температуры. Однако он будет быстро реагировать с паром.
Лента магния удовлетворительно реагирует с сильными кислотами и практически не реагирует с водой комнатной температуры. Однако он будет быстро реагировать с паром.
Комплект
- Защитные экраны
- Лента магниевая (легковоспламеняющаяся) – примерно 10 см
- Минеральная вата
- Боросиликатная кипящая трубка
- Зажим и подставка
- Резиновая пробка со стеклянной трубкой
- Защита глаз для публики
- Брызгозащитные очки для демонстратора
- Горелка Бунзена
- Шина
Подготовка
Установка защитных экранов для защиты зрителей и демонстрантов. Сверните магниевую ленту в спираль примерно 0,5 см в диаметре и 3 см в длину. Загрузите минеральную вату в кипящую трубку и смочите ее водой, прежде чем зажать трубку горизонтально и вставить магниевый змеевик. Наконец, добавьте пробку со стеклянной трубкой. Конец трубки должен выступать из резины не менее чем на 2 см, чтобы можно было зажечь выделившийся водород из демонстрации.
Рисунок 1: Установка, готовая к реакции магниевой ленты с паром
Перед классом
Зрители должны находиться на расстоянии не менее 2 метров, в защитных очках. Демонстратор должен носить защитные очки. Нагрейте трубку горелкой Бунзена прямо под магнием, пока лента не загорится. Затем переместите горелку Бунзена на пропитанную водой минеральную вату, чтобы начать испарение воды. Магний светится ярче, когда над ним проходит пар, и можно использовать лучину, чтобы зажечь выделившийся водород на конце стеклянной трубки.
Безопасность
- Носите брызгозащитные очки и используйте защитные экраны для защиты зрителей и демонстрантов. Учащиеся должны оставаться на расстоянии 2 м и носить защитные очки.
- Никогда не смотрите прямо на горящий магний.
- Не используйте порошок магния.
- Никогда не пытайтесь реагировать с паром на кальций или щелочные металлы.
- Примите меры для предотвращения кражи; никогда не оставляйте катушки с магнием в лаборатории.

- CLEAPSS следует обратиться к HC016.
Членам
Учебная цель
Учащиеся, вероятно, уже видели реакцию магния с кислотами с образованием газообразного водорода и соли (уравнение 1). Они также могли наблюдать реакцию лития с водой с образованием газообразного водорода и гидроксида, о чем свидетельствует использование универсального индикатора или фенолфталеина (уравнение 2).
Уравнение 1: Mg(тв) + 2HCl(водн.) → MgCl 2 (водн.) + H 2 (г)
Уравнение 2: 2HCl(тв) + 2H 2 O(ж) → 2LiOH(водн.) + H 2 (г)
Эта демонстрация показывает, как можно резко ускорить реакцию металлов с водой за счет повышения температуры. Учащиеся могут увидеть образование газообразного водорода и провести мысленную связь между реакциями, показанными в уравнении 1 и уравнении 2.
Здесь реакция первоначально дает оксид магния (уравнение 3), который может продолжать производить гидроксид при реакции с жидкая вода (уравнение 4).
Уравнение 3: Mg(s) + H 2 O(g) → MgO(aq) + H 2 (g)
Уравнение 4: MgO(s) + H
7 8 O(9067 2 9067) l) → Mg(OH) 2 (водн.)
Затем учащимся можно предложить сделать предположения о том, какие реагенты и продукты образуются в реакции магния и воды при комнатной температуре, и какие данные мы можем собрать для проведения реакции. место (уравнение 5), если у них было несколько дней, чтобы ждать результатов.
Уравнение 5: Mg(s) + 2H 2 O(g) → Mg(OH) 2 (водн.) + H 2 (g)
Увидев использование индикатора в реакциях металл-вода и производстве газообразного водорода в реакциях металл-кислота, учащиеся могут предположить, что это возможные признаки того, что реакции связаны.
Вы можете проверить это, оставив перевернутую воронку и сборную трубку над магниевой лентой, погруженной в воду с несколькими каплями фенолфталеина. Индикатор начнет менять цвет в течение нескольких минут (Рисунок 2), но может потребоваться несколько дней, чтобы собрать значительный объем газа, который можно будет протестировать на следующем уроке.
Рисунок 2: Испытания на производство водорода
Утилизация
Там, где горящий магний контактировал со стеклом, мог образовываться силицид магния. Пробирку для кипячения нельзя использовать повторно, но ее можно промыть в 500 см 3 воды для преобразования любых силицидов в силаны. Могут быть видны небольшие хлопки или вспышки от пирофорных силанов. Промытую стеклянную посуду можно выбросить в контейнер для битого стекла.
Деклан ФлемингДеклан Флеминг — учитель химии и автор рубрики «Химия на выставке».
Темы
- Covid-19
- Практические навыки и техника безопасности
- Реактивность
РЕАКЦИИ ЭЛЕМЕНТОВ ГРУППЫ 2 С ВОДОЙ На этой странице рассматриваются реакции элементов 2-й группы — бериллия, магния, кальция, стронция и бария — с водой (или паром). Факты Бериллий Бериллий реагирует с паром при высоких температурах (обычно около 700°C или выше) с образованием белого оксида бериллия и водорода. (Уравнение точно такое же, как для магния ниже.) | |
Примечание: До ноября 2016 года на этот момент у меня было утверждение: «Бериллий не вступает в реакцию с водой или паром даже при красном калении». Это часто цитировалось в учебниках, и моими источниками были книги по неорганическим наукам на уровне степени, а позже книги по неорганическим наукам на уровне А. Тем не менее, исследователь в области развития ядерного синтеза указал мне, что проводится много работы над реакцией между бериллием и паром, потому что это может быть проблемой безопасности в конструкции реактора, и прислал мне фотографию, показывающую результат подвергание бериллия воздействию пара при 800°С. Я думаю, проблема в том, что бериллий дорог и опасен для здоровья. Это означает, что немногие учителя когда-либо справились с этим — я, конечно, не справился. Это означает, что заявления об этом в учебниках (или в наши дни в Интернете) никогда не проверяются и просто передаются независимо от их точности. Я извиняюсь за свою роль в этом. | |
Магний Магний сгорает в паре с образованием белого оксида магния и газообразного водорода.
Очень чистая лента из магниевого сплава слабо реагирует с холодной водой. Через несколько минут на его поверхности образуются пузырьки водорода, а виток магниевой ленты обычно всплывает на поверхность. Однако реакция вскоре останавливается, так как образующийся гидроксид магния почти нерастворим в воде и образует барьер для магния, препятствующий дальнейшей реакции.
| |
Примечание: Как правило, если металл вступает в реакцию с холодной водой, образуется гидроксид металла. Если он реагирует с паром, образуется оксид металла. Это связано с тем, что гидроксиды металлов термически разлагаются (расщепляются при нагревании) с образованием оксида и воды. | |
Кальций, стронций и барий Все они реагируют с холодной водой с возрастающей энергией с образованием гидроксида металла и водорода. Стронций и барий имеют реакционную способность, подобную литию в группе 1 периодической таблицы. Кальций, например, довольно энергично реагирует с холодной водой в экзотермической реакции. Выделяются пузырьки газообразного водорода и образуется белый осадок (гидроксида кальция) вместе со щелочным раствором (также гидроксида кальция — гидроксид кальция мало растворим). Уравнение реакции любого из этих металлов будет таким: X(s) + 2H 2 O(l) X(OH) 2 (водный или s) + H 2 (g) Гидроксиды плохо растворимы, но они становятся более растворимыми по мере продвижения вниз по Группе. Образовавшийся гидроксид кальция проявляется в основном в виде белого осадка (хотя некоторые растворяются). Вы получаете меньше осадка по мере продвижения вниз по группе, потому что больше гидроксида растворяется в воде. Сводка тренда реактивности Металлы группы 2 становятся более реактивными по отношению к воде по мере продвижения вниз по группе. Объяснение тренда реактивности Бериллий в особом случае Существует дополнительная причина недостаточной реакционной способности бериллия по сравнению с остальной группой. Бериллий имеет прочный стойкий слой оксида на своей поверхности, который снижает его реакционную способность при обычных температурах. Изменение энтальпии реакций Изменение энтальпии реакции является мерой количества тепла, поглощаемого или выделяемого при протекании реакции. Изменение энтальпии отрицательно, если тепло выделяется, и положительно, если оно поглощается. Это действительно все, что вам нужно знать об этом разделе! | |
Примечание: Если вас не устраивают изменения энтальпии, вы можете изучить раздел энергетики Chemguide или мою книгу по химическим расчетам. | |
Если вы рассчитаете изменение энтальпии возможных реакций между бериллием или магнием и паром, вы получите следующие ответы: Be(s) + H 2 O(g) BeO(s) + H 2 (g) ∆H = -369 кДж моль -1 Mg(s) + H 2 O(g) MgO(s) + H 2 (g) ΔH = -360 кДж моль -1 Обратите внимание, что обе возможные реакции сильно экзотермичны и выделяют почти одинаковое количество тепла. Точно так же, если вы подсчитаете изменения энтальпии для реакций между кальцием, стронцием или барием и холодной водой, вы снова обнаружите, что количество выделяемого тепла в каждом случае почти одинаково — в этом случае около -430 кДж моль -1 . Причина повышения реактивности должна опять быть в другом. Энергии активации реакций Энергия активации реакции – это минимальное количество энергии, необходимое для протекания реакции. Неважно, насколько экзотермической будет реакция, когда она начнется, — если существует высокий энергетический барьер активации, реакция будет происходить очень медленно, если вообще будет происходить. Когда металлы группы 2 реагируют с образованием оксидов или гидроксидов, образуются ионы металлов. | |
Примечание: Это упрощение в случае бериллия. | |
Образование ионов из исходного металла включает несколько стадий, каждая из которых требует затрат энергии, что способствует увеличению энергии активации реакции. Эти этапы предполагают ввод:
После этого будет ряд стадий, которые снова выделяют тепло, что приводит к образованию продуктов и общим экзотермическим реакциям. На графике показано влияние этих важных стадий поглощения энергии по мере того, как вы спускаетесь в группу 2. Обратите внимание, что здесь доминируют энергии ионизации, особенно энергии второй ионизации. Энергии ионизации падают, когда вы спускаетесь по Группе. Поскольку становится легче образовывать ионы, реакции будут происходить быстрее. | |
Примечание: Если вас не устраивают изменения энергии ионизации при переходе в группу 2, перейдите по этой ссылке. Вы найдете дополнительную ссылку на более широкое обсуждение энергии ионизации, если вам это нужно. | |
Обобщая причину увеличения реактивности по мере спуска Группа Реакции становятся легче, поскольку энергия, необходимая для образования положительных ионов, падает. Это в основном связано с уменьшением энергии ионизации по мере продвижения вниз по Группе. Это приводит к более низким энергиям активации и, следовательно, более быстрым реакциям. | |

 05.19
05.19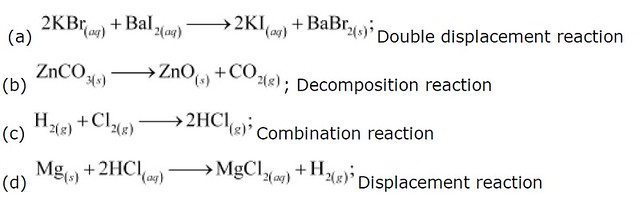
 Эти реакции используются для изучения тенденции реактивности в группе 2.
Эти реакции используются для изучения тенденции реактивности в группе 2. Однозначно реагирует.
Однозначно реагирует.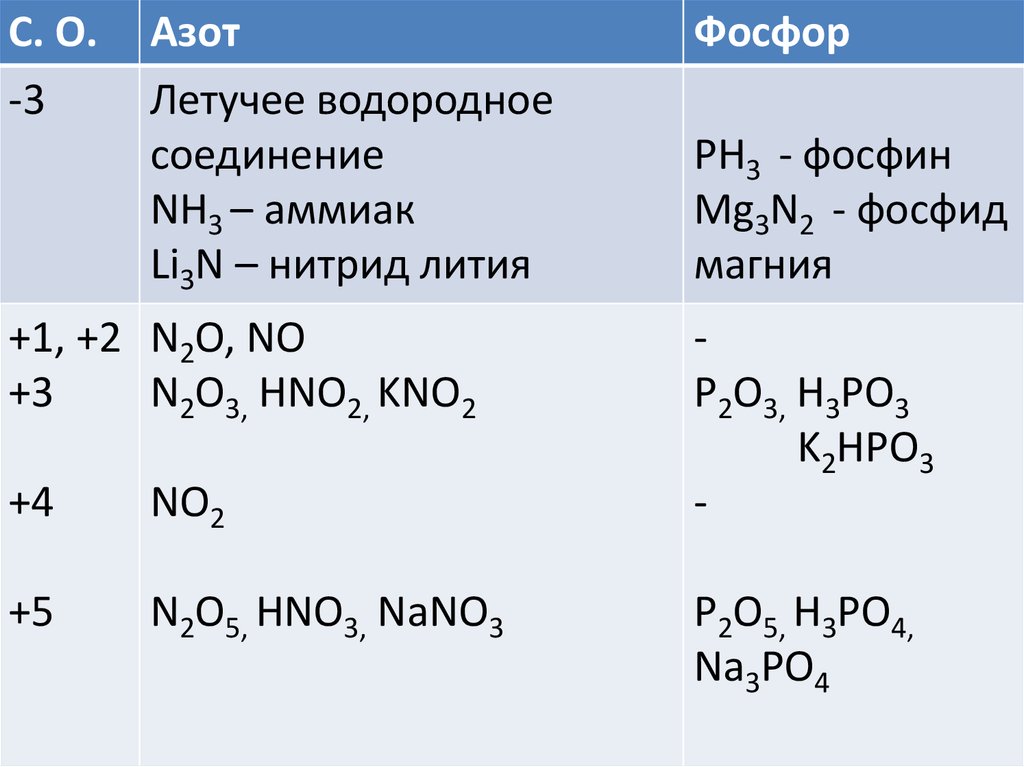

 Однако оксидный слой разрушается при температуре выше 750 °C и обнажает поверхность металлического бериллия под ним, и поэтому защита не работает.
Однако оксидный слой разрушается при температуре выше 750 °C и обнажает поверхность металлического бериллия под ним, и поэтому защита не работает. Однако реакция магния протекает гораздо быстрее. Объяснение различной реактивности должно лежать где-то еще.
Однако реакция магния протекает гораздо быстрее. Объяснение различной реактивности должно лежать где-то еще. Оксид бериллия не является полностью ионным. Между бериллием и кислородом недостаточно разницы в электроотрицательности, чтобы бериллий потерял контроль над связывающей парой электронов и образовал ионы. Подход, который мы используем здесь, соответствует типу ответа, который вы должны были бы дать на уровне A. Думать о бериллии как о совершенно другом случае сделало бы этот аргумент излишне сложным.
Оксид бериллия не является полностью ионным. Между бериллием и кислородом недостаточно разницы в электроотрицательности, чтобы бериллий потерял контроль над связывающей парой электронов и образовал ионы. Подход, который мы используем здесь, соответствует типу ответа, который вы должны были бы дать на уровне A. Думать о бериллии как о совершенно другом случае сделало бы этот аргумент излишне сложным.
