Содержание
Литиевые батареи
Внимательно прочтите эти правила перед использованием батарей! |
Литий — наиболее легкий металл, он вдвое легче воды и всплывает даже в керосине. Одновременно с этим, литий обладает огромным электрохимическим потенциалом, что делает его одним из самых активных металлов. Это свойство лития дает возможность создавать на его основе батареи и аккумуляторы с очень высокой плотностью энергии при минимальных размерах и массе.
Преимущества, которыми обладают литиевые аккумуляторы
Еще одно преимущество литиевых аккумуляторов — очень низкий ток саморазряда. Это означает, что батарея может пролежать «на полке» или в выключенном приборе на годы дольше щелочных батареек. Для литиевых аккумуляторов это означает, что в малопотребляющих приборах не придется периодически подзаряжать аккумулятор (что придется сделать с никель-металлгидридными (NiMh), никель-кадмиевыми (NiCd) или свинцовокислотными (Lead Acid) аккумуляторами), или придется это делать намного реже.
Литиевые аккумуляторы также обладают еще одним важным преимуществом — они практически не теряют емкость при отрицательных температурах: большинство выпускаемых батарей спокойно работают от -40° а некоторые типы — от -60°. В условиях русской зимы и особенно Крайнего севера — литиевые батареи незаменимы.
Все эти параметры становятся особенно важными при использовании в устройствах выживания — к примеру, в фонарях, аварийных маячках или рациях.
Можно один раз «заправить» фонарь комплектом литиевых батарей, и более десяти лет не беспокоиться о том, что батареи (или аккумуляторы) разрядились, и требуют замены.
При этом, они легче других батарей, работают дольше, и не теряют емкость при отрицательных температурах.
Литиевые батареи и аккумуляторы производятся с разнообразными химическими формулами, что дает
разное рабочее напряжение и энергоемкость.
Наиболее распространены:
- Li-MnO2 (батареи с префиксом «CR»).
Номинальное напряжение: 3В.
Наиболее распространенный вид литиевых батарей. К батареям такого типа относятся, например,
батареи CR123 или CR2. Батарея такой системы обладает большой емкостью, может отдавать
большой ток, обладает широким температурным диапазоном (от -40 до +60).
К батареям этого типа относится также совместимая батарея типа «Корунд» (тип ISO «1604») напряжением 9В, которая физически состоит из трех элементов (обычные щелочные — из 6) - Li-FeS2 (литий-железодисульфидные батареи)
Номинальное напряжение: 1.5В.Современные литиевые батареи, призванные заменить традиционные щелочные и солевые батарейки.
Напряжение 1.5В позволяет напрямую вставлять их в приборы, предназначенные для работы с обычными батарейками.При этом за счет литиевой химии, они обладают преимуществами по сравнению с щелочными батареями и Ni-Mh аккумуляторами:
- Работают до 3-4 раз дольше. Литиевые батареи АА обладают эффективной емкостью 2900 мАч.

- Имеют массу на 35% меньше.
- Могут отдавать большой ток, что делает их применение возможным в «прожорливых» устройствах.
- Рабочий температурный диапазон — от -40° до +60°
- Низкий саморазряд: срок хранения — более десяти лет.
К недостаткам можно отнести сравнительно высокую цену, но наращивание объемов производства
таких батарей с каждым годом сокращает разрыв цены с щелочными батареями, и для работы в устройствах с большим энергопотреблением покупать такие батареи выгоднее, чем щелочные. - Работают до 3-4 раз дольше. Литиевые батареи АА обладают эффективной емкостью 2900 мАч.
- Li-Ion (литий-ионные батареи (аккумуляторы))
Номинальное напряжение: 3.6-3.7В.
В этих элементах металлический литий заменен на ионы лития, что сделало батарею более
безопасной. Эти батареи являются перезаряжаемыми (аккумуляторами).В отличие от аккумуляторов других систем, они не подвержены «эффекту памяти», и обладают превосходными энергетическими характеристиками.

Саморазряд этих батарей — около 5% в месяц, по сравнению с 30% Ni-Mh аккумуляторов (новейшие типы Ni-Mh аккумуляторов имеют более низкие, чем 30%, токи саморазряда), и 10% Ni-Cd.
Однако, литий-ионные аккумуляторы теряют емкость по мере старения, вне зависимости от заряда и количества циклов заряда-разряда. В среднем, это старение составляет около 20-30% в год, и усиливается при высоких температурах.
Сильная электрохимическая активность лития, наряду с огромным энергетическим потенциалом, создает дополнительные инженерные проблемы производителям батарей. Например, литий вступает в сильную реакцию с водой, с образованием щелочи и водорода.
Как известно, водород в смеси с кислородом воздуха, при определенной пропорции смеси, становится взрывоопасным.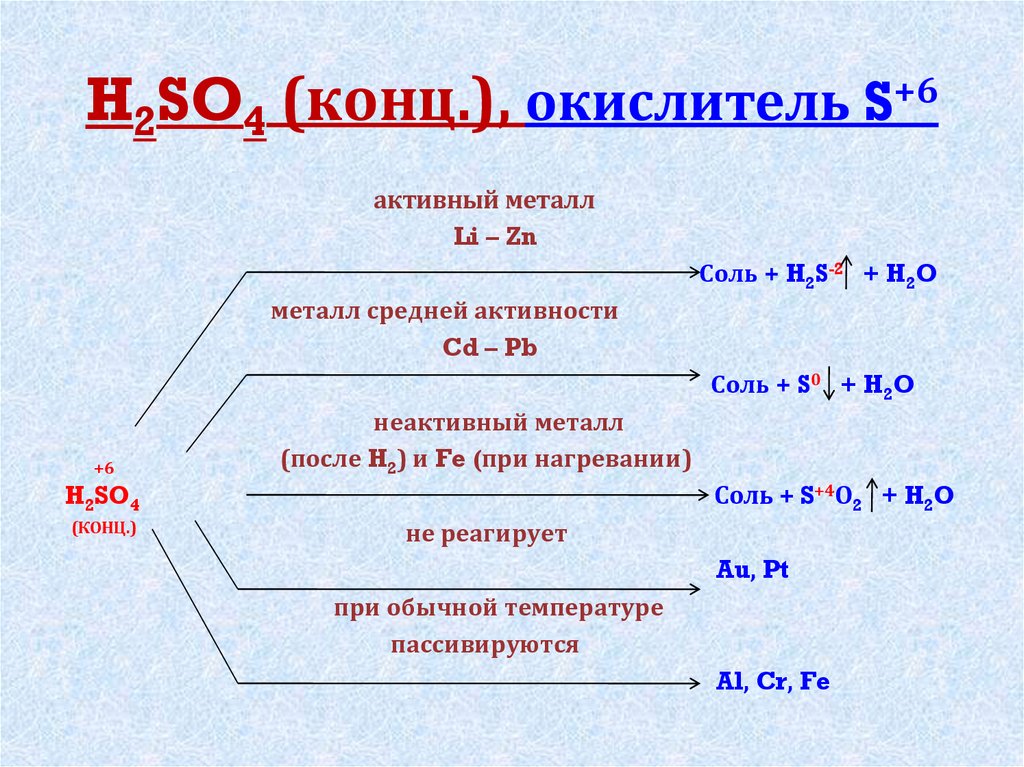 А тепло, выделяющееся при реакции, может воспламенить эту смесь.
А тепло, выделяющееся при реакции, может воспламенить эту смесь.
Впрочем, эта проблема присуща также и свинцовокислотным аккумуляторам.
По этой причине все литиевые элементы упаковываются в герметичную оболочку.
В высокоэнергетических литиевых батареях и литий-ионных аккумуляторах при коротком замыкании или неправильной эксплуатации повышается температура и давление. Поэтому в конструкцию элементов добавляют предохранительные клапаны и контакты («PTC» — Positive Temperature Coefficient), размыкающиеся при повышении температуры. Эти меры позволяют предотвратить взрыв батарей, при неправильном с ними обращении.
Литий-ионные и литий-полимерные аккумуляторы очень чувствительны к процессу заряда и разряда,
поэтому в 99% случаев вместе с собственно элементом питания в батарее присутствует также и плата электроники, которая следит за «здоровьем» батареи, контролирует процесс заряда, разряда, а также предотвращает взрыв при коротком замыкании или превышении тока заряда.
Именно поэтому большинство литий-ионных аккумуляторов имеет не два, а три или четыре контакта — через дополнительные контакты микроконтроллер платы защиты общается с основным устройством.
Использование незащищенных литий-ионных аккумуляторов не рекомендуется по следующим причинам:
- Короткое замыкание, неправильная полярность, превышение напряжения или тока заряда могут вызвать взрыв.
- Слишком сильный разряд аккумулятора «убьет» его, сделав невозможным его дальнейшее использование. Не все устройства содержат защиту от глубокого разряда вставленных в них аккумуляторов. Обычно критическое напряжение глубокого разряда составляет 2.4-2.7В, в зависимости от химической формулы.
Меры предосторожности при работе с литиевыми аккумуляторами.
Проведенные исследования режимов эксплуатации на пожаро- и взрывобезопасность, а также миллиарды использованных литиевых батарей (в том числе батареи Вашего мобильного телефона, плеера, компьютера и т. п.), установили, что современные конструкции литиевых элементов практически безопасны при их правильной эксплуатации, и более того — вполне рассчитаны на «дурака».
п.), установили, что современные конструкции литиевых элементов практически безопасны при их правильной эксплуатации, и более того — вполне рассчитаны на «дурака».
Но, следуя принципу «предупрежден — значит вооружен», мы публикуем основные моменты работы
с литиевыми батареями. В общем-то все, написанное ниже, применимо и обязательно для выполнения при использовании и обычных щелочных батареек. (и всегда пишется на упаковке)
Используя в бытовой технике батареи и аккумуляторы литиевой системы, вы должны
осознавать, что их повышенные по сравнению с щелочными батареями и Ni-Mh аккумуляторами
потребительские свойства — энергоемкость, масса — взяты не «с потолка», а являются следствием
использования более активного материала.
Как показывает практика, потребители редко читают инструкцию по эксплуатации батарей и аккумуляторов, и еще реже её соблюдают, надеясь на русский «авось».
И хотя правила эксплуатации литиевых батарей ничем не отличаются от правил эксплуатации
щелочных батарей и других аккумуляторов, их соблюдение особенно важно, т. к. несоблюдение может привести к более серьезным последствиям.
к. несоблюдение может привести к более серьезным последствиям.
Итак:
Не перезаряжать, не нагревать.
В литиевой батарее есть т.н. пассивирующий слой на литиевом аноде. Эта защитная пленка соединений лития, в обычных условиях, препятствует прямым химическим реакциям металлического лития с электролитом и основными продуктами реакции. Зарядка литиевых батарей (не аккумуляторов, а именно неперезаряжаемых батарей, к примеру CR123) разрушает эту пленку и категорически запрещена. Это приводит к высвобождению и накоплению в батарее металлического лития, его реакции с электролитом, росту температуры и давления, и, как следствие, утечке токсичного газа (через предохранительный клапан), электролита, и может привести к воспламенению или взрыву батареи.
К этому также может привести закорачивание батареи или её нагревание. К батарее нельзя припаивать провода бытовыми паяльниками и паяльными станциями — это нарушит или сплавит защиту от перегрева батареи, и она станет небезопасна. Нельзя оставлять батарею под прямыми солнечными лучами.
Нельзя оставлять батарею под прямыми солнечными лучами.
То же самое относится к превышению тока заряда и напряжения заряда литиевых аккумуляторов. Используйте только качественные зарядные устройства, не стоит подключать «вот эту батарейку» к «вон тому заряднику» от «вон того прибора». Это опасно.
Некоторые компании даже выпускают спец. оболочки-пакеты для зарядки литиевых элементов на предельных режимах:
Не смешивать бывшие в употреблении и новые батареи; батареи разных типов или производителей.
Установка элементов с разным напряжением (например, новый и бывший в употреблении) приведет к тому, что один элемент (новый) будет стремиться отдавать больший ток, и станет заряжать другой (старый). Батареи разных производителей, во-первых, могут иметь разное внутреннее сопротивление, а во-вторых, незначительно отличающийся химический состав. По описанной в п.1 схеме, и то, и другое может привести к взрыву.
Батареи разных производителей, во-первых, могут иметь разное внутреннее сопротивление, а во-вторых, незначительно отличающийся химический состав. По описанной в п.1 схеме, и то, и другое может привести к взрыву.
Согласно исследованиям, смешивание Б/У и новых батарей или батарей разных производителей,
явилось причиной №1 случаев возгорания и взрыва литиевых батарей в фонарях и других приборах.
Наихудшее с точки зрения безопасности соотношение — это использование новой батареи и
на 20% использованной. И хотя таких случаев зарегистрировано менее десяти на сотни тысяч случаев беспроблемного использования, делать этого не стоит.Не разбирать, не сжигать, не использовать батареи со следами повреждений или протечек.
Прокол элементов или смятие может привести к внутреннему короткому замыканию, с последующим возгоранием и взрывом; Расплавление лития от высокой температуры также приводит к взрыву.
При разгерметизации внутрь элемента может попасть вода или сконденсироваться атмосферная влага, что может привести к реакции с выделением водорода и возгоранию.
Не закорачивать. Соблюдать полярность.
При разряде большими токами или коротком замыкании из-за некоторой неоднородности структуры батареи и наличия примесей могут возникать локальные «горячие точки», которые лавинообразно вызывают разогрев всей батареи.
Результат — взрыв.Не утилизировать с бытовыми отходами.
Хотя это общепринятая практика в нашей стране, но, вопреки ей, элементы питания нельзя
выкидывать вместе с бытовым мусором.К примеру, остатки соленой воды в кухонных отходах могут закоротить элемент.
И хотя у нас не создано никаких условий для правильной утилизации таких отходов —
позаботьтесь хотя бы о том, чтобы литиевый элемент не контактировал с другими отходами.
Например, поместив его в индивидуальный полиэтиленовый пакет, и завязав его.Хранить в сухом, прохладном месте.
Влага, кроме прямого закорачивания контактов, может вызвать коррозию внешней оболочки
батареи, заткнуть вентиляционные клапаны или нарушить герметичность. Батарею с признаками коррозии использовать нельзя.
Высокая температура, близость к батареям отопления, духовым шкафам, печным трубам
или прямые солнечные лучи могут вызвать повышение давления внутри батареи.
Современные литиевые батареи содержат множество элементов конструкции, которые призваны повысить степень защиты — сбросить нарастающее давление, разъединить электрическую цепь при превышении тока или температуры, а также разнообразную защитную электронику, но их лучше рассматривать как средства «последнего эшелона», и надеяться не на них, а на разумное соблюдение правил безопасности.
Соблюдение этих правил почти наверняка избавит вас от неприятных моментов использования литиевых батарей. И хотя случаи возгорания или взрыва батарей в фонарях очень редки (в Интернет-сообществе описано менее 10 случаев за все время на весь мир), мы считаем важным упомянуть основные сценарии развития событий.
- В большинстве редких случаев возгорания литиевых батарей в фонарях, фонарь «тухнет» или теряет яркость на сравнительно свежем комплекте батарей. В любом случае, это должно вас насторожить.
Часто после этого, иногда через значительное время (20-30 мин.) слышится шипение клапана сброса
давления батареи. Если вы слышите шипение этого клапана или фонарь неожиданно потускнел или нагрелся — ни в коем случае не направляйте фонарь стеклом или торцом к себе.
Настороженность также должно вызвать ненормальное для данного режима работы фонаря нагревание батарейного отсека, особенно в выключенном состоянии (выше 60-70 градусов).
При возникновении описанных симптомов — если фонарь у вас в руках — немедленно выключите его и положите подальше от людей, домашних животных и легковоспламеняемых предметов.
Если фонарь не в руках — не подходите к нему как минимум 3-4 часа.Шипение клапана сброса давления часто сопровождается выделением едкого белого дыма с
характерным «электрическим» запахом. Этот дым токсичен — старайтесь не вдыхать его и проветрить
помещение.
Если из батареи вылился электролит — не допускайте его контактов с кожей.
Пролитый электролит следует засыпать пищевой содой или опилками, и вытереть насухо.
Взрыв батареи иногда происходит через 1-2 секунды, а иногда через 20-30 минут после шипения клапана.
При возгорании и взрыве литиевых батарей запрещается тушить их углекислотными огнетушителями:
литий бурно реагирует с углекислотой.
Эффективно применение порошковых огнетушителей (напр. ОП-10).Тушение горящих элементов и их обломков можно производить, накрывая очаги горения
плотной термостойкой тканью (асбестовым полотном).
Можно тушить сухим песком, покрывалом, сухой поваренной солью.
Вода неэффективна при тушении горящего лития, и предотвращает главным образом распространение
пожара. Наоборот, реакция лития с водой может вызвать выделение водорода, который усилит горение.Не берите в руки фонарь, обломки или батареи ранее, чем через несколько часов после прекращения
любых проявлений реакции. Не приближайтесь к взорвавшимся или вытекшим батареям, пока они
не остынут.Защищайте кожу от контактов с электролитом резиновыми перчатками.
Засыпьте батареи, а также обломки, пищевой содой, для нейтрализации электролита.
Поместите в полиэтиленовый пакет и утилизируйте.Помните телефон пожарной охраны: В России это 101, или 112, или 911 (с мобильного телефона).
- Чаще взрываются фонари на двух CR123-элементах (в большинстве случаев ксеноновые, а не светодиодные), чем на одном. Поэтому при использовании фонаря, работающего на двух элементах, старайтесь или использовать защищенный аккумулятор 18650 или 17670, если он допустим конструкцией фонаря, или особенно тщательно подходите к вопросу выбора пары батарей.
 Старайтесь ставить вместе батареи из одной партии.
Старайтесь ставить вместе батареи из одной партии.
Если у вас есть возможность измерить внутреннее сопротивление батарей — старайтесь совмещать
батареи по внутреннему сопротивлению.Естественно, ни в коем случае не ставьте разные батареи или использованные совместно с новыми.
- Чаще взрываются фонари на галогеновых (ксеноновых галогенных) лампах без электроники, чем светодиодные с электроникой.
Причина — описанные выше в п.4 «горячие точки», которые возникают при неконтролируемом
разряде большим током. - Старайтесь использовать качественный фонарь, нежели безымянный.
Плохая конструкция и используемые материалы могут служить причиной закорачивания
батарей. Особенно это относится к дешевым галогеновым фонарям на элементах CR123.
Старайтесь использовать водонепроницаемый фонарь — это также предотвратит
нештатные ситуации при использовании литиевых батарей. - Старайтесь использовать алюминиевый фонарь, нежели пластиковый.

Пластиковый фонарь может разлететься в непредсказуемых направлениях.
У алюминиевых фонарей «вышибает» стекло и торцевую кнопку (если такая есть). Так что, при взрыве в руке в большинстве описанных случаев (3 случая) обошлось без травм.
Одновременно, пластиковый корпус менее стоек к разогреву батарей и может обеспечить
меньше защиты батареям от внешнего тепла.
А остальные миллиарды случаев успешного использования литиевых батарей без каких-либо эксцессов подтверждают: за этими элементами ближайшее будущее. И если век топливных или био-элементов еще не наступил, то для лития — самое время.
В реальности же с безопасностью дело обычно обстоит так:
Ссылки по теме:
Статья про элементы питания на HPC.RU
Лабораторные опыты по Химии, видео: реакция лития с водой (опыт 12)
Реакция лития с водой, видео (другой опыт)
Статья на сайте FlashLightReviews про батарейки вообще(англ. )
)
Статья на сайте FlashLightReviews про батарейки подробнее(англ.)
Статья на сайте FlashLightReviews про взрывы батарей (англ.)
Сравнение разных типов и марок батарей (с графиками)
Взаимодействие щелочных металлов с водой (передача «Мозголомы»), видео
Литиевые смазки. Классификация и применение
Литиевые смазки
Минеральные литиевые смазки
Синтетические литиевые смазки
Силиконовые смазки
Эфирные смазки
Полиальфаолефиновые смазки
Комплексные смазки
Литиевые смазки EFELE
Заключение
Основными компонентами пластичных смазок являются базовые масла и загустители. Для улучшения и придания новых эксплуатационных свойств этих материалов (например, антикоррозионных, антиокислительных, противозадирных) в состав могут вводить различные присадки и твердые наполнители.
В большинстве пластичных смазок используются мыльные загустители – соли жирных кислот различных металлов. Чаще всего применяются литиевые, кальциевые, алюминиевые мыла или их комплексы. По загустителю дается название группе пластичных смазок.
Чаще всего применяются литиевые, кальциевые, алюминиевые мыла или их комплексы. По загустителю дается название группе пластичных смазок.
Литиевые смазки
Пластичные смазки, изготовленные на основе литиевого мыла или их комплексов, относятся к литиевым смазкам.
Зная тип загустителя, можно определить область применения, многие свойства и характеристики материала. От применения того или иного загустителя зависят рабочий диапазон температур механическая стабильность, температура каплепадения, водостойкость.
Впервые пластичная смазка на базе простого литиевого мыла была зафиксирована патентом США № 2274675 3 марта 1942 года. Американский инженер-химик Кларенс Э. Эрл открыл новую эру в индустрии смазочных материалов.
На сегодняшний день более 70 % выпускающихся смазок являются литиевыми. Литиевый загуститель является одним из самых дешевых, но, в то же время, обеспечивает достаточно высокие эксплуатационные свойства пластичным смазкам.
Литиевые смазки пользуются высоким спросом во всем мире.
По сравнению с другими щелочными мылами литиевые имеют ряд достоинств. Они имеют лучшую водостойкость, чем у натриевых материалов, большую термостойкость, чем у кальциевых и натриевых смазок, характеризуются отличной механической стабильностью.
Главными преимуществами литиевых смазок являются универсальность применения и многофункциональность.
В настоящее время производители смазочных материалов выпускают широкий ассортимент литиевых пластичных смазок. Такие материалы изготовлены на основе высококачественных минеральных, полусинтетических и синтетических масел, содержат различные присадки и твердосмазочные наполнители. Такой состав позволяет решать подавляющее большинство задач, стоящих перед промышленными предприятиями и сервисными компаниями.
Смазочные материалы с загустителями на основе простых или комплексных литиевых загустителей, обладают свойствами, удовлетворяющими самым взыскательным потребностям, и имеют широкую сферу применения.
Минеральные литиевые смазки
Подавляющее большинство пластичных литиевых смазок на базе минеральных масел в зависимости от предъявляемых требований используются в температурном диапазоне от -40 °С до +150 °С.
Обладая достаточно высокими эксплуатационными свойствами, минеральные смазки дешевле синтетических и полусинтетических материалов. При этом спектр их применения весьма широк – с их помощью обслуживают большинство узлов и механизмов со среднестатистическими условиями эксплуатации.
Минеральные масла в качестве базового компонента таких материалов накладывают некоторые ограничения на их применения. Так, минеральные масла могут вызывать набухание или разрушение некоторых видов пластмасс или эластомеров. Поэтому, перед использованием в узлах с парами трения «металл-пластмасса» или «металл-резина» рекомендуется провести тест на совместимость.
Синтетические литиевые смазки
Синтетические пластичные смазки – это материалы, в которых в качестве базовых используются искусственно синтезированные масла.
Большинство синтетических масел, использующихся в настоящее время в качестве базовых, были разработаны в период с 1920 по 1940 гг. Их стоимость даже сейчас остается достаточно высокой, поэтому доля синтетических пластичных смазок на рынке смазочных материалов составляет лишь небольшую часть.
Благодаря более высокой термостойкости, механической и химической стабильности эти материалы эффективно применяются в различных узлах трения, в том числе в парах трения «металл-пластмассы и «металл-эластомеры».
Силиконовые смазки
Силиконовые – еще один вид синтетических смазок. Эти материалы в качестве базового компонента используют силиконовые масла.
Силиконовые литиевые смазки характеризуются следующими особенностями:
- Широким диапазоном рабочих температур
- Высокой адгезией
- Безопасностью – не оказывают физиологического воздействия на организм человека
- Высокими диэлектрическими свойствами
- Химической инертностью и стойкостью
- Продолжительным сроком эксплуатации
- Отличными водоотталкивающими свойствами
- Низким коэффициентом трения
Из недостатков можно упомянуть тот факт, что силиконовые литиевые смазки обладают невысокой несущей способностью.
Эфирные смазки
Основное достоинство литиевых смазок, изготовленных на базе синтетических эфирных масел, является их способность работать при высоких скоростях. Фактор скорости Dnтаких материалов достигает значений 1300000 мм⋅об/мин и выше.
Эфирные литиевые смазки характеризуются следующими преимуществами:
- Устойчивостью к смыванию и водостойкостью
- Хорошими антикоррозионными свойствами
- Долгим сроком эксплуатации
- Обладают шумоподавляющим эффектом
Полиальфаолефиновые смазки
Среди синтетических материалов этой группы наиболее популярными стали полиальфаолефиновые (ПАО) литиевые смазки.
Использование ПАО-масел в качестве базовых обеспечивает литиевым смазкам дополнительные достоинства:
- Высокие антикоррозионные свойства
- Более низкие температуры застывания
- Высокую стойкость к окислению и термостабильность
- Невысокая коксуемость и больший индекс вязкости по сравнению с минеральными маслами.

Принимая во внимание, что полиальфаолефиновые смазки имеют невысокую (среди синтетических материалов) стоимость, эта группа смазок стала одной из самых востребованных в современной промышленности.
Комплексные смазки
Комплексные литиевые смазки в качестве загустителей используют дополнительные компоненты – мыла литиевых солей азелаиновой, адипиновой, уксусной и других кислот.
Смазки на комплексном литиевом загустителе характеризуются теми же положительными свойствами, что и простые литиевые, но имеют более высокую границу рабочих температур. Они лучше работают при воздействии воды, характеризуются более высокой механической стабильностью, уменьшенным маслоотделением.
В зависимости от дисперсионной среды диапазон рабочих температур может составлять от -50 до +230 °С.
Эти материалы применяются в оборудовании текстильной, станкостроительной, автомобильной и других отраслей промышленности.
Литиевые смазки EFELE
Компания «Эффективный Элемент» производит широкий ассортимент литиевых смазок различных видов. Они не уступают по качеству импортным аналогам, а по некоторым параметрам превосходят их.
Минеральные пластичные смазки EFELE на основе лития или литиевого комплекса представлены следующими материалами: EFELE MG-211, EFELE MG-212, EFELE MG-213, EFELE MG-214, Литол Спрей EFELE.
Эти смазки изготовлены на высококачественных минеральных маслах, поэтому их стоимость ниже, чем у аналогичных полусинтетических или синтетических материалов. Несмотря на это, минеральные смазки EFELE обладают высокими рабочими характеристиками.
EFELE MG-214 – это многоцелевая пластичная смазка, изготовленная на основе литиевого мыла. Диапазон рабочих температур -40…+120 °С. Предназначена для применения в подшипниках качения и скольжения, шарнирах, зубчатых передачах и других узлах трения колесных и гусеничных транспортных средств, дорожно-строительных, сельскохозяйственных и других механизмов промышленного оборудования и судовых механизмов различного назначения.
Диапазон рабочих температур -40…+120 °С. Предназначена для применения в подшипниках качения и скольжения, шарнирах, зубчатых передачах и других узлах трения колесных и гусеничных транспортных средств, дорожно-строительных, сельскохозяйственных и других механизмов промышленного оборудования и судовых механизмов различного назначения.
EFELE MG-211 – за счет введения в состав материала противозадирных присадок, она получила повышенную несущую способность и может работать даже в аварийных ситуациях, спасая оборудование от заклинивая и остановки. Диапазон ее рабочих температур составляет -30…+120 °С. Она хорошо себя зарекомендовала в узлах трения ходовой части автомобилей и подъемно-транспортных машин, подшипниках электродвигателей и вентиляторов, в направляющих и шариков-винтовых передачах металлообрабатывающего оборудования, в узлах конвейеров, горно-добывающего, цементного, сталелитейного и общепромышленного оборудования.
EFELE MG-212 – в состав этой литиевой многофункциональной смазки помимо противозадирных EP-присадок в качестве твердосмазочного наполнителя введен дисульфид молибдена. Такой состав позволяет смазке работать в условиях повышенных нагрузок даже в запыленных условиях. Диапазон рабочих температур от -30 до +120 °С. Применяется в узлах трения ходовой части автомобилей, тракторов, экскаваторов, бульдозеров, погрузчиков и других транспортных средств, работающих в тяжелых условиях эксплуатации, в высоконагруженных подшипниках общепромышленного обоурдования, подшипниках электродвигателей и вентиляторов.
Такой состав позволяет смазке работать в условиях повышенных нагрузок даже в запыленных условиях. Диапазон рабочих температур от -30 до +120 °С. Применяется в узлах трения ходовой части автомобилей, тракторов, экскаваторов, бульдозеров, погрузчиков и других транспортных средств, работающих в тяжелых условиях эксплуатации, в высоконагруженных подшипниках общепромышленного обоурдования, подшипниках электродвигателей и вентиляторов.
Универсальная литиевая смазка EFELE Литол Спрей в аэрозольной упаковке подходит для промышленных и бытовых целей, широко используется при обслуживании автотехники. Она продлевает срок службы подшипников, направляющих, различных видов передач, шарниров, цепей, тросов, замков, петель, роликов.
За счет содержания современного пакета присадок противозадирные характеристики EFELE Литол Спрей примерно на 30 % выше, чем у традиционного Литола-24.
Литиевая смазка отличается:
- Морозостойкостью (до -40 °С)
- Работоспособностью во влажной среде
- Устойчивостью к смыванию водой
- Высокая механическая и коллоидной стабильностью
- Хорошей адгезией
- Удобством нанесения в труднодоступные места
Смазка имеет густую консистенцию (NLGI 3), не растекается и не капает при нанесении. Особая конструкция распылительной насадки гарантирует точечное и экономное нанесение материала.
Особая конструкция распылительной насадки гарантирует точечное и экономное нанесение материала.
Среди комплексных литиевых смазок можно отметить EFELE MG-213 с противозадирными EP-присадками. Такой состав позволяет ее использовать в условиях повышенных нагрузок и температур до +160 °С. Она обладает хорошей водостойкостью и практически не смывается. Применяется в узлах трения легковых и грузовых автомобилей, тракторов, экскаваторов, бульдозеров, погрузчиков и других транспортных средств, а также в высоконагруженных подшипниках общепромышленного, металлургического, деревообрабатывающего оборудования, оборудования по переработке и производству полимеров, подшипниках электродвигателей и вентиляторов и т.д.
Синтетическая полиальфаолефиновая смазка EFELE SG-311 также изготовлена на литиевом загустителе.
Благодаря использованию полиальфаолефина литиевая смазка EFELE SG‑311 получила следующие преимущества:
- Очень низкую минимальную рабочую температуру (-60 °С)
- Способность работать при низких температурах и высоких скоростях
- Высокие антикоррозионные свойства
- Высокие термостабильность и стойкость к окислению
- Малую летучесть и коксуемость по сравнению с минеральными маслами
- Больший индекс вязкости по сравнению с минеральными маслами
- Невысокую стоимость по сравнению с другими синтетическими маслами
- Совместимость с пластмассами и эластомерами.
Она успешно выполняет свои функции в любой климатической зоне и используется для смазывания зубчатых передач в редукторах автомобильных стартеров, подшипников автомобильных генераторов, направляющих, деталей электропривода сидений, люка автомобиля; кнопок и ручек управления автомобиля; реечной передачи рулевого управления; подушек безопасности, защелок, рукояток, шарниров и рычагов дверных ручек, антенн, пластмассовых подвижных соединений автомобилей; шлицевых валов; небольших зубчатых передач, работающих на высоких и умеренных скоростях. Малое изменение вязкости с понижением или повышением температуры позволяют применять EFELE SG-311 для обслуживания узлов трения точных механизмов и приборов; офисной техники, в которых имеются пластиковые детали; пар трения пластик-пластик и пластик-металл в электромеханических устройствах.
Малое изменение вязкости с понижением или повышением температуры позволяют применять EFELE SG-311 для обслуживания узлов трения точных механизмов и приборов; офисной техники, в которых имеются пластиковые детали; пар трения пластик-пластик и пластик-металл в электромеханических устройствах.
Использование простых и комплексных литиевых смазок не ограничивается приведенными примерами. В зависимости от предъявляемых требований они позволяют эффективно решать большинство задач при ремонте и обслуживании транспорта и оборудования в любой климатической зоне и в любой отрасли промышленности.
Гидроксид лития – химическая формула, свойства, применение, примеры решения
Когда литий реагирует с водой в пробирке, образуется газообразный водород и гидроксид лития. LiOH — это химическая формула гидроксида лития. LiOH — сильное основание, но в то же время очень слабый щелочной металл. Ионы лития захватывают ионы водорода, которые, в свою очередь, превращаются в атомы водорода. Известно, что два атома водорода объединяются, образуя молекулу газообразного водорода. Отрицательный гидроксид-ион реагирует с литием с образованием гидроксида лития. Гидроксид лития в основном используется для общих целей. Обладает высокой водостойкостью и может использоваться в различных температурных диапазонах.
Известно, что два атома водорода объединяются, образуя молекулу газообразного водорода. Отрицательный гидроксид-ион реагирует с литием с образованием гидроксида лития. Гидроксид лития в основном используется для общих целей. Обладает высокой водостойкостью и может использоваться в различных температурных диапазонах.
Является ли гидроксид лития основанием?
Основная вещь, с которой нам нужно иметь дело, чтобы определить, является ли соединение основанием или кислотой, — это сила соединения. Сила снова определяется степенью ионизации. Ионизация — это процент растворенных молекул, которые выделяют ионы водорода или гидроксида. Гидроксид лития является очень сильным основанием. Он на 100% ионизирован в водном растворе. Из-за своей реакционной способности LiOH считается самой слабой кислотой при измерении в газообразном состоянии.
Каковы химические свойства гидроксида лития?
Химическая формула гидроксида лития: LiOH
Молярная масса: 23,95 г/моль (безводный)
41,96 г/моль (моногидрат)
Каковы физические свойства гидроксида лития?
Внешний вид: гигроскопичное белое твердое вещество
Запах: отсутствует
Плотность: 1,46 г/см3 (безводный)
1,51 г/см3 (моногидрат)
Температура плавления: 462 °C (864 °F) 3
KF; Температура кипения LiOH: 924 °C (1695 °F)
Растворимость в воде:
12,7 г/100 мл (0 °C)
12,8 г/100 мл (20 °C)
17,5 г/100 мл (100 °C)
Каковы виды использования гидроксида лития?
Наиболее распространенными свойствами гидроксида лития является то, что он используется в качестве электролита в батареях.
 Никель-водородные батареи, никель-кадмиевые батареи и т. д. производятся с использованием гидроксида лития. Эти батареи используются в кардиостимуляторах, часах, цифровых камерах, смартфонах и многом другом.
Никель-водородные батареи, никель-кадмиевые батареи и т. д. производятся с использованием гидроксида лития. Эти батареи используются в кардиостимуляторах, часах, цифровых камерах, смартфонах и многом другом.
Примеры решенных задач:
Гидроксид лития реагирует с водой
2LiOH + CO2 → Li2CO3 + h3O
Гидроксид лития реагирует с карбонатом и диоксидом углерода в виде продуктов. Реакция протекает при комнатной температуре, и раствор является высококонцентрированным.
Гидроксид лития реагирует с соляной кислотой
Гидроксид лития реагирует с соляной кислотой в процессе нейтрализации. В результате реакции образуется хлорид лития и вода. Полученный хлорид лития имеет кристаллическую природу и белый цвет.
LiOH + HCl —> LiCl + h3O
Литий реагирует с серной кислотой
Литий реагирует с серной кислотой с образованием султанов лития вместе с водой. Этот процесс представляет собой реакцию двойного замещения и обычно применяется для получения серной кислоты в различных экспериментах.
Этот процесс представляет собой реакцию двойного замещения и обычно применяется для получения серной кислоты в различных экспериментах.
LiOH + h3SO4 —> LiSO4 + h3O
Интересные факты о литии и гидроксиде лития:
Термин литий происходит от греческого слова «lithos».
Открыт в 1817 году Иоганном Августом.
Литий является единственным металлом, имеющим высокостабильные изотопы.
Литий — очень мягкий металл. Его можно даже резать с помощью ножа.
Металлический литий настолько легкий, что может легко плавать на воде.
Все мы знаем, что огонь можно потушить водой. Но огонь лития не так просто потушить. Применение воды к возгоранию лития только усугубит ситуацию.
 Поэтому для тушения возгорания лития требуется порошковый огнетушитель.
Поэтому для тушения возгорания лития требуется порошковый огнетушитель.Литий горит ярко-красным пламенем.
Гидроксид лития или LiOH обычно используется для очистки воздуха на космических кораблях, подводных лодках и т. д.
Благодаря небольшому весу гидроксида лития его можно комбинировать с различными металлами, такими как алюминий или медь, для получения легких сплавов.
Очень важным применением лития является то, что он используется в качестве основного материала для образования подобных соединений лития или химических веществ, таких как хлорид лития, фторид лития, бромид лития и т. д. Гидроксид лития также реагирует со всеми вышеупомянутыми химическими веществами лития.
Формула гидроксида лития – структура, свойства, применение, примеры вопросов
Литий получил свое название от «lithos». Это греческое слово, используемое для обозначения камня. Литий (Li), щелочной металл периодической таблицы (Группа 1) химического элемента. Литий — это тип металла, который в основном используется в зерне и овощах для диетических целей. Его различные формы используются в добавках. Литий — самый легкий металл твердого элемента. Температура кипения и степень окисления лития 1342°C и +1. Это элемент s-блока. Литий используется в аккумуляторных батареях для мобильных телефонов, ноутбуков, цифровых камер и электромобилей.
Это греческое слово, используемое для обозначения камня. Литий (Li), щелочной металл периодической таблицы (Группа 1) химического элемента. Литий — это тип металла, который в основном используется в зерне и овощах для диетических целей. Его различные формы используются в добавках. Литий — самый легкий металл твердого элемента. Температура кипения и степень окисления лития 1342°C и +1. Это элемент s-блока. Литий используется в аккумуляторных батареях для мобильных телефонов, ноутбуков, цифровых камер и электромобилей.
Гидроксид — это химическое соединение, содержащее одну или несколько групп. Он состоит из водорода и атома кислорода, которые связаны ковалентной связью. Водород несет отрицательный электрический заряд. Используется в пищевых консервантах.
Гидроксид лития
Это неорганическое соединение, имеющее формулу LiOH. Это гидроксид щелочного металла. Гидроксид лития, раствор выглядит как прозрачная белая жидкость. Это очень вредно, если не использовать с мерами предосторожности. Это может вызвать раздражение глаз и кожи нашего тела. Он используется для производства других химических веществ. Это сильное основание и самый слабый из известных гидроксидов щелочных металлов.
Это может вызвать раздражение глаз и кожи нашего тела. Он используется для производства других химических веществ. Это сильное основание и самый слабый из известных гидроксидов щелочных металлов.
Формула гидроксида лития
Химическая и молекулярная формула гидроксида лития – LiOH, молярная масса гидроксида лития – 23,91 г/моль. LiOH существует в двух формах: безводной и моногидратной. Только один гидроксид щелочного металла не проявляет полиморфизма.
Структура гидроксида лития
Структура гидроксида лития содержит ион лития, атом кислорода и атом водорода. Он очень реакционноспособен по своей природе, он может реагировать с другими соединениями с образованием других соединений.
Получение гидроксида лития
Когда мы реагируем литий с водой, получается гидроксид лития, и следующая реакция здесь
H 2 O + Li 2+ → LiOH
Максимальное количество гидроксида лития образуется, когда произошла реакция между гидроксидом кальция и карбонатом лития, в результате которой образуются гидроксид лития и карбонат кальция:
Ca(OH) + Li 2 CO 3 → CaCo 3 + 2LiOH
Физические свойства LiOH
- Гидроксид лития не имеет запаха.

- Повышает качество красителя.
- По внешнему виду представляет собой гигроскопичное белое твердое вещество.
- Плотность гидроксида лития составляет 1,46 г/см³.
- Температуры плавления и кипения LiOH составляют 462 °C и 924 °C.
- Хорошо растворим в воде, но плохо растворим в спирте.
Химические свойства LiOH
- При взаимодействии гидроксида лития (LiOH) с серной кислотой (H 2 SO 4 ) образуется сульфат лития и вода.
2LiOH + H 2 SO 4 → LiSO 4 + 2H 2
- При взаимодействии гидроксида лития (LiOH) с диоксидом углерода (CO2) образуется карбонат лития и вода. И эту реакцию еще называют экзотермической реакцией.
2LiOH + CO 2 → Li 2 CO 3 + H 2 O
- При взаимодействии гидроксида лития с хлором образуется гипохлорит лития и соляная кислота.

LiOH + Cl 2 → LiOCl + HCl
- При взаимодействии гидроксида лития с соляной кислотой образуется хлорид лития и вода. Эту реакцию также называют нейтральной реакцией.
LiOH + HCl → LiCl + H 2 O
Использование LiOH
- Гидроксид лития чаще всего используется в качестве электролита в батареях. Как никель-водородные батареи и т. д.
- Гидроксид лития и карбонат лития используются в качестве красителя. Они усиливают реакцию и улучшают качество красителя.
- Гидроксид лития используется для борьбы с коррозией.
- LiOH используется в качестве скруббера углекислого газа на подводных лодках.
- Используется в керамической и лакокрасочной промышленности.
Примеры вопросов
Вопрос 1 : Является ли LiOH основанием в воде?
Ответ:
Он является основанием, потому что при растворении в водном растворе дает два иона Li + и ОН – , и любая молекула, дающая ОН – после растворения в воде, определяется как основание по своей природе.
Вопрос 2: Используется ли гидроксид лития в батареях?
Ответ:
Гидроксид лития моногидрат используется в производстве катодного материала для литий-ионных аккумуляторов электромобилей, он более подходит, поскольку обеспечивает наилучший энергетический баланс. LiOH используется в качестве электролита в таких батареях, как никель-водородные и никель-кадмиевые батареи. Они производятся из гидроксида лития. Эти батареи используются в часах, цифровых камерах, смартфонах и т. д.
Вопрос 3: Какой тип элемента LiOH?
Ответ:
Гидроксид лития представляет собой неорганическое соединение, имеющее формулу LiOH. Он имеет две формы: безводную или гидратированную, и обе формы представляют собой белые гигроскопичные твердые вещества. По своей природе не имеет запаха. Это сильное основание со значением pH около 10, используемое для различных целей, таких как производство соли, защита от коррозии, окрашивание и т.


 Нельзя оставлять батарею под прямыми солнечными лучами.
Нельзя оставлять батарею под прямыми солнечными лучами. Батареи разных производителей, во-первых, могут иметь разное внутреннее сопротивление, а во-вторых, незначительно отличающийся химический состав. По описанной в п.1 схеме, и то, и другое может привести к взрыву.
Батареи разных производителей, во-первых, могут иметь разное внутреннее сопротивление, а во-вторых, незначительно отличающийся химический состав. По описанной в п.1 схеме, и то, и другое может привести к взрыву.


 Старайтесь ставить вместе батареи из одной партии.
Старайтесь ставить вместе батареи из одной партии.
 Литиевые смазки пользуются высоким спросом во всем мире.
Литиевые смазки пользуются высоким спросом во всем мире.