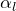ХИМБИО-INFORM: Сайт учителя химии и биологии Ващенко Н.Ю. . Кристаллическая решетка воды
Типы кристаллических решёток — урок. Химия, 8–9 класс.
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц. Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную, металлическую, атомную и молекулярную.
Ионными называют решётки, в узлах которых находятся ионы.
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов. Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na+ и хлора Cl−, а в узлах решётки сульфата калия чередуются простые ионы калия K+ и сложные сульфат-ионы SO42−.
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие. Такие вещества хорошо растворяются в воде.

Кристаллическая решётка хлорида натрия

Кристалл хлорида натрия
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов.
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск, ковкость, пластичность, хорошо проводят электрический ток и тепло.

Металлическая кристаллическая решётка

Металлические изделия
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
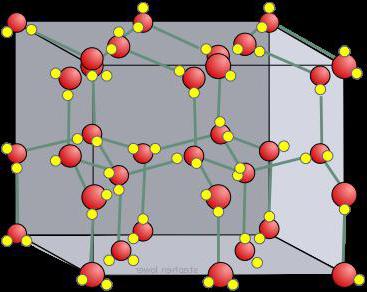
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, карборунд SiC и кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния(\(IV\)) SiO2.
Таким веществам характерны высокая прочность и твёрдость. Так, алмаз является самым твёрдым природным веществом. У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С. Атомные кристаллы практически нерастворимы.

Кристаллическая решётка алмаза

Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения. Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы. Такие вещества летучи. Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние. Некоторые молекулярные вещества имеют запах.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He,Ne,Ar,Kr,Xe,Rn), а также неметаллы с двух- и многоатомными молекулами (h3,O2,N2,Cl2,I2,O3,P4,S8).
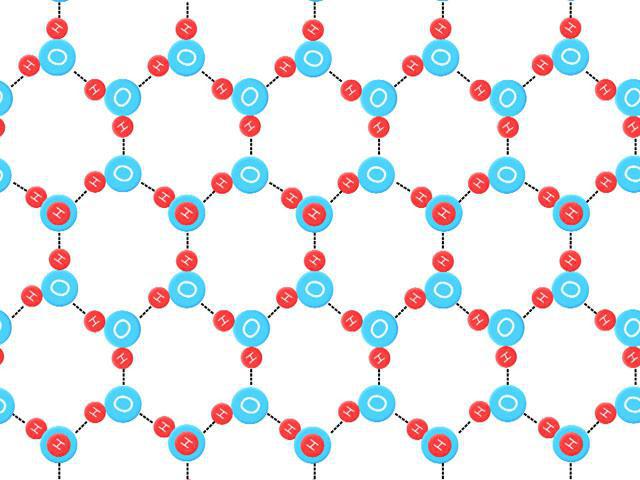
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд, твёрдые аммиак, кислоты, оксиды неметаллов. Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).

Кристаллическая решётка углекислого газа

«Сухой лёд»

Кристаллики иода
Если известно строение вещества, то можно предсказать его свойства.
Попробуем определить, каковы примерно температуры плавления у фторида натрия, фтороводорода и фтора.
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF, HF и F2 составляют соответственно \(995\) °С, \(–83\) °С, \(–220\) °С.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 133 с.
www.yaklass.ru
Кристаллическая решетка льда и воды
Образование 14 декабря 2017Трехмерное состояние жидкой воды трудно исследовать, но многое было изучено путем анализа структуры кристаллов льда. Четыре соседних атома кислорода с водородным взаимодействием занимают вершины тетраэдра (тетра = четыре, гедрон = плоскость). Средняя энергия, необходимая для разрушения подобной связи во льду, оценивается в 23 кДж / моль-1.

Способность молекул воды образовывать данное количество водородных цепей, а также указанная прочность создает необычно высокую температуру плавления. Когда он тает, то удерживается жидкой водой, структура которой нерегулярна. Большая часть водородных связей искажается. Для разрушения кристаллической решетки льда с водородной связью требуется большая масса энергии в виде тепла.
Особенности появления льда (Ih)
Многие из обывателей задаются вопросом о том, какая кристаллическая решетка у льда. Необходимо отметить, что плотность большинства веществ возрастает при замораживании, когда молекулярные движения замедляются и образуются плотно упакованные кристаллы. Плотность воды также увеличивается, когда она остывает до достижения максимума при 4°C (277K). Затем, когда температура опускается ниже этого значения, она расширяется.
Это увеличение обусловлено образованием открытого водородно-связанного кристалла льда с его решеткой и меньшей плотностью, в котором каждая молекула воды жестко связана указанным выше элементом и четырьмя другими значениями, и при этом двигается достаточно быстро, чтобы обладать большей массой. Поскольку происходит подобное действие, жидкость замерзает сверху вниз. Это имеет важные биологические результаты, вследствие которых слой льда на пруду изолирует живых существ подальше от сильного холода. Кроме того, два дополнительных свойства воды связаны с его водородными характеристиками: удельной теплоемкостьюи испарением.
Детальное описание структур
Первый критерий представляет собой количество, необходимое для повышения температуры 1 грамма вещества на 1°С. Для повышения градусов воды требуется относительно большая часть тепла, потому что каждая молекула участвует в многочисленных водородных связях, которые должны быть разрушены, чтобы кинетическая энергия увеличивалась. Кстати, обилие h3O в клетках и тканях всех крупных многоклеточных организмов означает, что флуктуация температуры внутри клеток сведена к минимуму. Эта особенность имеет решающее значение, поскольку скорость большинства биохимических реакций чувствительна.
Теплота испарения воды также значительно выше, чем у многих других жидкостей. Для преобразования этого тела в газ требуется большое количество тепла, потому что водородные связи должны быть разрушены, чтобы молекулы воды могли дислоцироваться друг от друга и войти в указанную фазу. Изменяемые тела представляют собой постоянные диполи и могут взаимодействовать с другими подобными соединениями и теми, что ионизируются и растворяются.
Иные вещества, указанные выше, могут вступать в контакт только при наличии полярности. Именно такое соединение участвует в строении этих элементов. Кроме того, оно может выравниваться вокруг этих частиц, образованных из электролитов, так что отрицательные атомы кислорода молекул воды ориентированы на катионы, а положительные ионы и атомы водорода, ориентированы на анионы.
В твердых веществах образуются, как правило, молекулярные кристаллические решетки и атомные. То есть если йод построен таким образом, что в нем присутствует I2, то в твердом диоксиде углерода, то есть в сухом льде, в узлах кристаллической решетки находятся молекулы CO2. При взаимодействии с подобными веществами, ионную кристаллическую решетку имеет лед. Графит, например, обладающий атомной структурой, в основе которой углерод, не способен ее менять, также как и алмаз.
Что происходит, когда кристалл столовой соли растворяется в воде: полярные молекулы притягиваются к заряженным элементам в кристалле, что приводит к образованию подобных частиц натрия и хлорида на его поверхности, в результате эти тела дислоцируются друг от друга, и он начинает растворяться. Отсюда можно наблюдать, что лед имеет кристаллическую решетку с ионной связью. Каждый растворенный Na + притягивает отрицательные концы нескольких молекул воды, тогда как каждый растворенный Cl - притягивает положительные концы. Оболочка, окружающая каждый ион, называется сферой спасения и, обычно, содержит несколько слоев частиц растворителя.
Видео по теме
Кристаллическая решетка сухого льда
Говорят, что переменные или ион, окруженные элементами, являются сульфатированными. Когда растворителем выступает вода, такие частицы гидратируются. Таким образом, любая полярная молекула имеет тенденцию к сольватации элементами жидкого тела. У сухого льда тип кристаллической решетки образует в агрегатном состоянии атомные связи, которые неизменны. Другое дело кристаллический лед (замороженная вода). Ионные органические соединения, такие как карбоксилазы и протонированные амины, должны обладать растворимостью в гидроксильной и карбонильной группах. Частицы, содержащиеся в таких структурах, двигаются между молекулами, причем их полярные системы образуют водородные связи с этим телом.
Конечно, количество последних указанных групп в молекуле влияет на ее растворимость, которая также зависит от реакции различных структур в элементе: например, одно-, двух- и трех углеродные спирты смешиваются с водой, но более крупные углеводороды с одиночными гидроксильными соединениями гораздо менее разбавляемы в жидкости.
Шестиугольный Ih схож по форме с атомной кристаллической решеткой. У льда и всего естественного снега на Земле она выглядит именно так. Об этом свидетельствует симметрия кристаллической решетки льда, выращенная из водяного пара (то есть снежинок). Находится в космической группе P 63/мм с 194; D 6h, класса Лауэ 6/мм; аналогичный β-, имеющей кратную 6-ти винтовую ось (вращение вокруг в дополнение к сдвигу вдоль нее). Он обладает довольно открытой структурой с низкой плотностью, где эффективность низкая (~ 1/3) по сравнению с простыми кубическими (~ 1/2) или гранецентрированными кубическими (~ 3/4) структурами.
По сравнению с обычным льдом, кристаллическая решетка сухого льда, связанная молекулами CO2, статична и меняется лишь при распаде атомов.
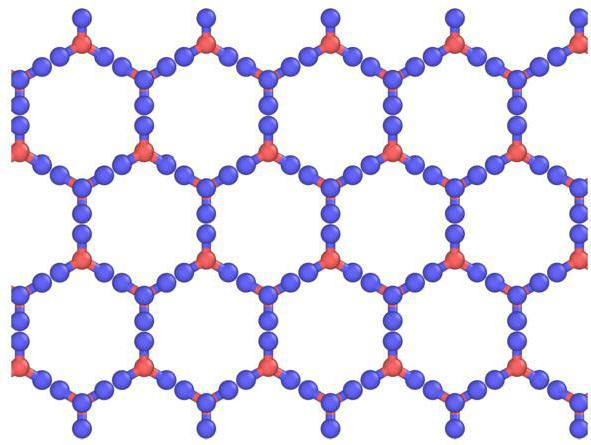
Описание решеток и входящих в них элементов
Кристаллы можно рассматривать, как кристаллические модели, состоящие из листов, расположенных друг над другом. Водородная связь упорядочена, тогда как в действительности она случайна, поскольку протоны могут перемещаться между молекулами воды (льда) при температурах выше примерно 5 К. Действительно, вполне вероятно, что протоны ведут себя, как квантовая жидкость в постоянном туннелированном потоке. Это усиливается рассеянием нейтронов, показывающих плотность их рассеяния на полпути между атомами кислорода, что указывает на локализацию и согласованное движение. Здесь наблюдается схожесть льда с атомной, молекулярной кристаллической решеткой.
Молекулы имеют ступенчатое расположение водородной цепи по отношению к трем своим соседям в плоскости. Четвертый элемент имеет затмеваемое расположение водородной связи. Существует небольшое отклонение от идеальной шестиугольной симметрии, как элементарной ячейки на 0,3% короче в направлении этой цепи. Все молекулы испытывают одинаковые молекулярные среды. Внутри каждой "коробки" достаточно места для удержания частиц интерстициальной воды. Хотя это, как правило, не считается, недавно они были эффективно обнаружены нейтронной дифракцией порошкообразной кристаллической решеткой льда.
Изменение веществ
Шестиугольное тело имеет тройные точки с жидкой и газообразной водой 0,01 ° C, 612 Па, твердыми элементами – три -21,985 ° C, 209,9 МПа, одиннадцать и два -199,8 ° C, 70 МПа, а также -34,7 ° C, 212,9 МПа. Диэлектрическая проницаемость гексагонального льда составляет 97,5.
Кривая плавления этого элемента дается МПа. Уравнения состояния доступны, кроме них некоторые простые неравенства, связывающие изменение физических свойств с температурой гексагонального льда и его водных суспензий. Твердость колеблется в зависимости от градусов, возрастающих примерно от или ниже гипса (≤2) при 0°С, до уровня полевого шпата (6 по шкале Мооса) при -80 ° С, аномально большое изменение абсолютной твердости (> 24 раза).
Шестиугольная кристаллическая решетка льда образует гексагональные пластины и столбцы, где верхняя и нижняя грани являются базальными плоскостями {0 0 0 1} с энтальпией 5,57 мкДж · см -2, а другие эквивалентные боковые называются частями призмы {1 0 -1 0} с 5,94 мкДж · см -2. Вторичные поверхности {1 1 -2 0} с 6.90 μJ ˣ см -2 могут быть сформированы по плоскостям, образованными сторонами структур.
Подобное строение показывает аномальное уменьшение теплопроводности с увеличением давления (как и кубический, и аморфный лед низкой плотности), но отличается от большинства кристаллов. Это связано с изменением водородной связи, уменьшающей поперечную скорость звука в кристаллической решетке льда и воды.
Существуют методы, описывающие, как подготовить большие образцы кристалла и любую желаемую поверхность льда. Предполагается, что водородная связь на поверхности гексагонального исследуемого тела будет более упорядоченной, чем внутри объемной системы. Вариационная спектроскопия с генерацией по частоте колебаний с фазовой решеткой показала, что существует структурная асимметрия между двумя верхними слоями (L1 и L2) в подповерхностной HO цепи базальной поверхности гексагонального льда. Принятые водородные связи в верхних слоях шестиугольниках (L1 O ··· HO L2) сильнее, чем принятые во втором слое к верхнему накоплению (L1 OH ··· O L2). Доступны интерактивные структуры гексагонального льда.
Особенности развития
Минимальное количество молекул воды, необходимых для зарождения льда, примерно 275 ± 25, как и для полного икосаэдрического кластера 280. Образование происходит с коэффициентом 10 10 на поверхности раздела воздух-вода, а не в объемной воде. Рост кристаллов льда зависит от разных темпов роста различных энергий. Вода должна быть защищена от замерзания при крио консервировании биологических образцов, пищи и органов.
Обычно это достигается быстрыми скоростями охлаждения, использованием небольших образцов и крио консерватора, а также увеличением давления для образования зародышей льда и предотвращения повреждения клеток. Свободная энергия льда / жидкости увеличивается от ~ 30 мДж/м2 при атмосферном давлении до 40 мДж/м-2 при 200 МПа, что указывает на причину, по которой происходит подобный эффект.
Какой тип кристаллической решетки характерен для льда
В качестве альтернативы они могут расти быстрее с поверхностей призмы (S2), на случайно нарушенной поверхности быстрозамороженных или взволнованных озер. Рост от граней {1 1 -2 0}, по крайней мере, такой же, но превращает их в основания призмы. Данные о развитии кристалла льда были полностью исследованы. Относительные скорости роста элементов разных граней зависят от способности образовывать большую степень совместной гидратации. Температура (низкая) окружающей воды определяет степень разветвления в кристалле льда. Рост частиц ограничивается скоростью диффузии при низкой степени переохлаждения, то есть <2 ° C, что приводит к большему их количеству.

Но ограничено кинетикой развития при более высоких уровнях понижения градусов >4°C, что приводит к игольчатому росту. Эта форма схожа со строением сухого льда (имеет кристаллическую решетку с шестиугольной структурой), различными характеристиками развития поверхности и температурой окружающей (переохлажденной) воды, которая находится за плоскими формами снежинок.
Зарождение льда в атмосфере глубоко влияет на образование и свойства облаков. Полевые шпаты, обнаруженные в пустынной пыли, которая попадает в атмосферу миллионами тонн в год, являются важными образователями. Компьютерное моделирование показало, что это связано с зарождением плоскостей призматических кристаллов льда на плоскостях поверхности высоких энергий.
Некоторые другие элементы и решетки
Растворенные вещества (за исключением очень небольшого гелия и водорода, которые могут входить в междоузлия) не могут быть включены в структуру Ih при атмосферном давлении, но вытесняются на поверхность или аморфный слой между частицами микрокристаллического тела. В узлах кристаллической решетки сухого льда находятся некоторые иные элементы: хаотропные ионы, такие как Nh5 + и Cl -, которые включены в более легкое замораживание жидкости, чем другие космотропные, такие как Na + и SO42-, поэтому удаление их невозможно, ввиду того, что они образуют тонкую пленку из оставшейся жидкости между кристаллами. Это может привести к электрической зарядке поверхности из-за диссоциации поверхностной воды, уравновешивающей оставшиеся заряды (что также может привести к магнитному излучению) и изменению рН остаточных жидких пленок, например, NH 42SO4 становится более кислым и NaCl становится более щелочным.
Они перпендикулярны граням кристаллической решетке льда, показывающей присоединенный следующий слой (с атомами О-черный). Им характерна медленно растущая базальная поверхность {0 0 0 1}, где прикрепляются только изолированные молекулы воды. Быстро растущая {1 0 -1 0} поверхность призмы, где пары вновь присоединенных частиц могут связываться друг с другом водородом (одна его связь/две молекулы элемента). Наиболее быстро растущая грань {1 1 -2 0} (вторичная призматика), где цепочки вновь присоединенных частиц могут взаимодействовать друг с другом водородной связью. Одна ее цепочка/ молекула элемента – это форма, образующая хребты, которые делят и поощряют превращение в две стороны призмы.
Энтропия нулевой точки
Может быть определена, как S 0 = k B ˣ Ln (N E0), где k B – это постоянная Больцмана, NE– эточисло конфигураций при энергии E, а E0 - наименьшая энергия. Это значение для энтропии гексагонального льда при нулевом кельвине не нарушает третьего закона термодинамики «Энтропия идеального кристалла при абсолютном нуле ровно равна нулю», поскольку эти элементы и частицы не идеальны, имеют неупорядоченное водородное связывание.
В этом теле водородная связь является случайной и быстро меняющейся. Эти структуры не точно равны по энергии, а распространяются на очень большое количество энергетически близких состояний, подчиняются «правилам льда». Энтропия нулевой точки – это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1. Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Ученые и их труды в этой сфере
Может быть определена, как S 0 = k B ˣ Ln (N E0), где k B – это постоянная Больцмана, NE– эточисло конфигураций при энергии E, а E0 - наименьшая энергия. Это значение для энтропии гексагонального льда при нулевом кельвине не нарушает третьего закона термодинамики «Энтропия идеального кристалла при абсолютном нуле ровно равна нулю», поскольку эти элементы и частицы не идеальны, имеют неупорядоченное водородное связывание.
В этом теле водородная связь является случайной и быстро меняющейся. Эти структуры не точно равны по энергии, а распространяются на очень большое количество энергетически близких состояний, подчиняются «правилам льда». Энтропия нулевой точки – это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1. Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.

Хотя порядок протонов в объемном льду не упорядочен, поверхность, вероятно, предпочитает порядок указанных частиц в виде полос свисающих Н-атомов и О-одиночных пар (нулевая энтропия с упорядоченными водородными связями). Найден беспорядок нулевой точки ZPE, J ˣ mol -1 ˣ K -1 и других. Из всего вышеизложенного видно и понятно, какие типы кристаллических решеток характерны для льда.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
 Образование Аномальная плотность льда и воды
Образование Аномальная плотность льда и воды Вода – загадочная жидкость. Это связано с тем, что большинство ее свойств являются аномальными, т.е. отличными от других жидкостей. Причина кроется в ее особой структуре, которая обусловлена водородными связями ...
 Образование Кристаллическая решетка и ее основные типы
Образование Кристаллическая решетка и ее основные типыАбсолютно любое химическое вещество, существующее в природе, образовано большим числом одинаковых частиц, которые связаны между собою. Все вещества существуют в трёх агрегатных состояниях: газообразном, ж...
 Автомобили Можно ли доливать воду в антифриз? Температура замерзания антифриза и воды
Автомобили Можно ли доливать воду в антифриз? Температура замерзания антифриза и водыЛюбой двигатель внутреннего сгорания при работе выделяет много тепла. Чтобы он не закипел, существует охлаждающая система. Антифриз, который в ней содержится, нужен для охлаждения блока и головки двигателя. Кроме этог...
 Бизнес Щелевая решетка: виды и назначение
Бизнес Щелевая решетка: виды и назначениеДля эффективной вентиляции помещения необходимо решить массу задач, среди которых грамотное воздухораспределение является одной из основных. Щелевая решетка используется в системах распределения воздуха в общественных...
 Дом и семья Сколько кошка может прожить без еды и воды?
Дом и семья Сколько кошка может прожить без еды и воды?Хорошая кормежка выступает источником активности и хорошего настроения для любого питомца. Недостаток питательных веществ и жидкости в организме может привести к болезни и даже смерти животного. Давайте разберемся, ск...
 Домашний уют Силиконовая форма для льда и ее особенности
Домашний уют Силиконовая форма для льда и ее особенностиСиликоновая форма для льда - вещь полезная и нужная на кухне. Она очень удобна в использовании, да и ухаживать за ней легко. К тому же, современные производители кухонных принадлежностей предлагают покупателю столько ...
 Домашний уют Вода до очистки и вода после очистки. Сравнение питьевой воды до и после очистки
Домашний уют Вода до очистки и вода после очистки. Сравнение питьевой воды до и после очисткиДревняя пословица гласит: мы - то, что мы едим и пьем. Это жизнь. Тут не поспоришь, так как наш организм почти на семьдесят пять процентов - это вода. Без воды человек может прожить не более недели, а в пустыне погибн...
 Домашний уют Мошки на кухне – это беда! Кормят их мусор, грязь и вода
Домашний уют Мошки на кухне – это беда! Кормят их мусор, грязь и водаВообразите себе огорчение хозяйки, когда она обнаруживает, что на кухне завелись мошки! На е...
 Еда и напитки Соотношение крупы и воды при приготовлении каш: пропорции. Каши: рецепты с пропорциями
Еда и напитки Соотношение крупы и воды при приготовлении каш: пропорции. Каши: рецепты с пропорциямиИздревле считалось, что «кашу любой дурень сварит». И вот тут современные стряпухи и профессиональные повара точно могут поспорить. Приготовление любой каши – особый процесс, требующий не только теор...
 Еда и напитки Соотношение гречки и воды при варке
Еда и напитки Соотношение гречки и воды при варкеИзвестно ли вам о том, какое соотношение гречки и воды должно быть при варке вкусной и питательной каши? Если такой информацией вы не обладаете, то вы найдете ее в представленной статье. Также мы раскроем вам секреты ...
monateka.com
Урок №53. Кристаллические решётки - ХиМуЛя.com
Строение веществаВ химические взаимодействия вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со строением вещества.

При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.
У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллы
Жидкие кристаллы открыты в конце XIX века, но изучены в последние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд плавится при температуре выше 2000 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т.е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Типы кристаллических решётокЛюбое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
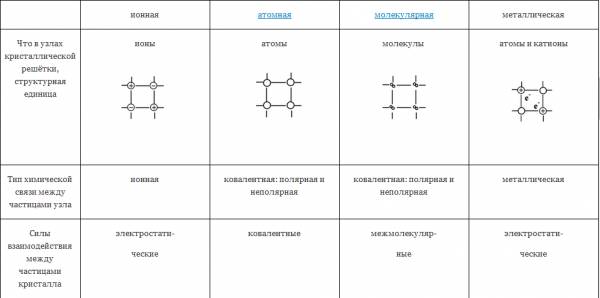
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
|
| ионная | атомная | молекулярная | металлическая |
| Что в узлах кристаллической решётки, структурная единица | ионы | атомы | молекулы | атомы и катионы |
| Тип химической связи между частицами узла | ионная | ковалентная: полярная и неполярная | ковалентная: полярная и неполярная | металлическая |
| Силы взаимодействия между частицами кристалла | электростати- ческие | ковалентные | межмолекуляр- ные | электростати- ческие |
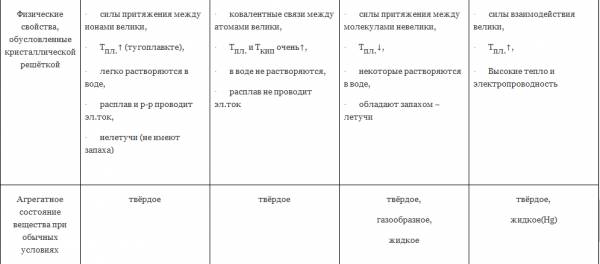
| Физические свойства, обусловленные кристаллической решёткой | · силы притяжения между ионами велики, · Тпл.↑ (тугоплавкте), · легко растворяются в воде, · расплав и р-р проводит эл.ток, · нелетучи (не имеют запаха)
| · ковалентные связи между атомами велики, · Тпл. и Tкип очень↑, · в воде не растворяются, · расплав не проводит эл.ток
| · силы притяжения между молекулами невелики, · Тпл.↓, · некоторые растворяются в воде, · обладают запахом – летучи
| · силы взаимодействия велики, · Тпл.↑, · Высокие тепло и электропроводность
|
| Агрегатное состояние вещества при обычных условиях | твёрдое | твёрдое | твёрдое, газообразное, жидкое | твёрдое, жидкое(Нg) |
| Примеры | большинство солей, щелочей, оксиды типичных металлов | С (алмаз, графит), Si, Ge, B, SiO2, CaC2, SiC (карборунд), BN, Fe3C, TaC(tпл.=38000С) Красный и чёрный фосфор. Оксиды некоторых металлов. | все газы, жидкости, большинство неметаллов: инертные газы, галогены, h3, N2, O2, O3, P4 (белый), S8. Водородные соединения неметаллов, оксиды неметаллов: h3O, CO2 «сухой лёд». Большинство органических соединений. | Металлы, сплавы |
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
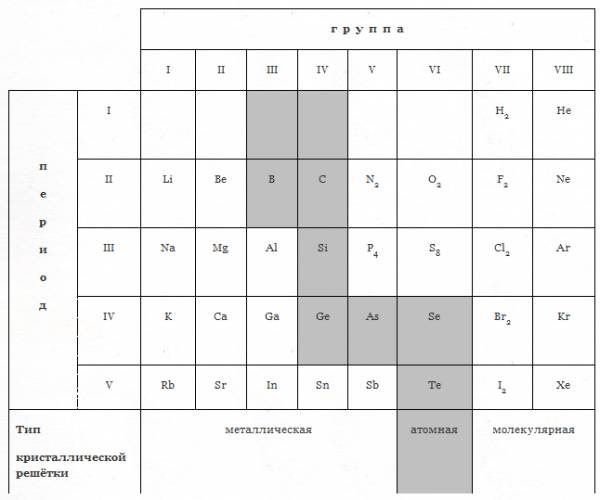
- Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
|
| г р у п п а | ||||||||
|
| I | II | III | IV | V | VI | VII | VIII | |
|
п е р и о д | I
|
|
|
|
|
|
| h3 | He |
| II
| Li | Be | B | C | N2 | O2 | F2 | Ne | |
| III
| Na | Mg | Al | Si | P4 | S8 | Cl2 | Ar | |
| IV
| K | Ca | Ga | Ge | As | Se | Br2 | Kr | |
| V | Rb | Sr | In | Sn | Sb | Te | I2 | Xe | |
| Тип кристаллической решётки | металлическая | атомная | молекулярная | ||||||
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие вопросы письменно в тетради:
- Что такое кристаллическая решётка?
- Какие виды кристаллических решёток существуют?
- Охарактеризуйте каждый вид кристаллической решётки по плану: Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
- Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (Ch4COOH), сахар (C12h32O11), калийное удобрение (KCl), речной песок (SiO2) – температура плавления 1710 0C, аммиак (Nh4), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
- По формулам приведённых веществ: SiC, CS2, NaBr, C2h3 - определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
- Тренажёр №1. "Кристаллические решётки"
- Тренажёр №2. "Тестовые задания"
- Тест (самоконтроль):
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a). тугоплавки и хорошо растворимы в воде б). легкоплавки и летучив). Тверды и электропроводны г). Теплопроводны и пластичны2) Понятия «молекула» не применимо по отношению к структурной единице вещества:
a). вода
б). кислород
в). алмаз
г). озон
3) Атомная кристаллическая решётка характерна для:
a). алюминия и графита
б). серы и йода
в). оксида кремния и хлорида натрия
г). алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
а). молекулярная
б). атомная
в). ионная
г). металлическая
sites.google.com
Кристаллические решетки: виды, свойства

Содержание:
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.

Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
www.poznavayka.org
Типы кристаллических решеток различных веществ
В природе есть два вида твердых тел, которые заметно различаются своими свойствами. Это аморфные и кристаллические тела. И аморфные тела не имеют точной температуры плавления, они во время нагревания постепенно размягчаются, а затем переходят в текучее состояния. Примером таких веществ может служить смола или обычный пластилин. Но совсем по-другому дело обстоит с кристаллическими веществами. Они остаются в твердом состоянии до какой-то определенной температуры, и только достигнув ее, эти вещества расплавляются.
Здесь все дело в строении таких веществ. В кристаллических телах частицы, из которых они состоят, расположены в определенных точках. И если их соединить прямыми линиями, то получится некий воображаемый каркас, который так и называется - кристаллическая решетка. А типы кристаллических решеток могут быть самые разные. И по виду частиц, из которых они «построены», решетки делятся на четыре типа. Это ионная, атомная, молекулярная и металлическая решетки.
И в узлах ионных кристаллических решеток, соответственно, расположены ионы, и между ними существует ионная связь. Ионы эти могут быть как простыми (Cl-, Na+), так и сложными (OH-, SO2-). И такие типы кристаллических решеток могут содержать некоторые гидроксиды и оксиды металлов, соли и другие подобные вещества. Возьмем, к примеру, обычный хлорид натрия. В нем чередуются отрицательные ионы хлора и положительные ионы натрия, которые образуют кубическую кристаллическую решетку. Ионные связи в такой решетке весьма устойчивы и вещества, «построенные» по такому принципу, имеют достаточно высокую прочность и твердость.
Есть также типы кристаллических решеток, называемых атомными. Здесь в узлах расположены атомы, между которыми существует сильная ковалентная связь. Атомную решетку имеют не очень много веществ. К ним относится алмаз, а также кристаллический германий, кремний и бор. Есть еще некоторые сложные вещества, которые содержат оксид кремния и имеют, соответственно, атомную кристаллическую решетку. Это песок, кварц, горный хрусталь и кремнезем. И в большинстве случаев такие вещества очень прочные, твердые и тугоплавкие. Также они практически нерастворимы.
А молекулярные типы кристаллических решеток имеют самые разные вещества. К ним относится замерзшая вода, то есть обычный лед, «сухой лед» - затвердевший оксид углерода, а также твердый сероводород и хлороводород. Еще молекулярные решетки имеют много твердых органических соединений. К ним относится сахар, глюкоза, нафталин и прочие подобные вещества. А молекулы, находящиеся в узлах такой решетки, связаны между собой полярными и неполярными химическими связями. И несмотря на то, что внутри молекул между атомами существуют прочные ковалентные связи, сами эти молекулы держатся в решетке за счет очень слабых межмолекулярных связей. Поэтому такие вещества достаточно летучи, легко плавятся и не обладают большой твердостью.
Ну а металлы имеют самые разные виды кристаллических решеток. И в их узлах могут находиться как атомы, так и ионы. При этом атомы могут легко превращаться в ионы, отдавая свои электроны в «общее пользование». Таким же образом ионы, «захватив» свободный электрон, могут становиться атомами. И такое строение металлической кристаллической решетки определяет такие свойства металлов, как пластичность, ковкость, тепло- и электропроводимость.
Также типы кристаллических решеток металлов, да и других веществ, делятся на семь основных систем по форме элементарных ячеек решетки. Самой простой является кубическая ячейка. Есть также ромбические, тетрагональные, гексагональные, ромбоэдрические, моноклинные и триклинные элементарные ячейки, которые определяют форму всей кристаллической решетки. Но в большинстве случаев кристаллические решетки являются более сложными, чем те, что перечислены выше. Это связано с тем, что элементарные частицы могут находиться не только в самих узлах решетки, а и в ее центре или на ее гранях. И среди металлов наиболее распространены такие три сложные кристаллические решетки: гранецентрированная кубическая, объемно-центрированная кубическая и гексагональная плотноупакованная. Еще физические характеристики металлов зависят не только от формы их кристаллической решетки, а и от межатомного расстояния и от других параметров.
fb.ru
Cайт учителя химии Ващенко Н.Ю.
Строение вещества.
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Наша задача познакомиться со строением вещества.

При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллы.
Жидкие кристаллы открыты в конце XIX века, но изучены в последние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд плавится при температуре выше 2000 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т.е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Типы кристаллических решёток.
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК

Свойства веществ с различной кристаллической решёткой (таблица)
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие вопросы письменно в тетради:- Что такое кристаллическая решётка?- Какие виды кристаллических решёток существуют?- Охарактеризуйте каждый вид кристаллической решётки по плану:
Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
- Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (Ch4COOH), сахар (C12h32O11), калийное удобрение (KCl), речной песок (SiO2) – температура плавления 1710 0C, аммиак (Nh4), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?По формулам приведённых веществ: SiC, CS2, NaBr, C2h3 - определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ. Тренажёр №1. "Кристаллические решётки"Тренажёр №2. "Тестовые задания"Тест (самоконтроль):
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:a). тугоплавки и хорошо растворимы в воде б). легкоплавки и летучив). Тверды и электропроводны г). Теплопроводны и пластичны
2) Понятия «молекула» не применимо по отношению к структурной единице вещества:
a). вода
б). кислород
в). алмаз
г). озон
3) Атомная кристаллическая решётка характерна для:
a). алюминия и графита
б). серы и йода
в). оксида кремния и хлорида натрия
г). алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
а). молекулярная
б). атомная
в). ионная
г). металлическая
himiknoginsk.ucoz.ru
Тайные послания воды. Код любви и здоровья (Анастасия Савина, 2007)
Кристаллическая решетка воды и ее структура – основа мироустройства
Вода – источник всего во Вселенной.
ГераклитУ всех на слуху целебные свойства воды. Однако никто не говорит напрямую, почему вода способна оздоравливать и оживлять. Только японец Масару Эмото приблизился к пониманию первозданных процессов. Но и он понял далеко не все, кроме того, его выводы не всегда безупречны. И тем не менее, несомненно, что он ухватил главное: биоэнергетическая матрица воды способна воздействовать на окружающий мир и на человека как один из объектов окружающего мира.
Говорят, что в бывшем СССР работал целый секретный Институт над этой проблематикой. Почему он относился к пресловутому «почтовому ящику»? Потому что речь шла об изучении свойств кристаллической решетки воды и влиянии ее изменчивости на состояние здоровья человека и статус социума. Институт работал над созданием сверхоружия, а не лекарства. Если «хорошая» вода может исцелять, то плохая – деморализовывать и убивать. А во времена «холодной войны» тема наращивания боевого потенциала была весьма актуальна. Вспомните многочисленные заводы оборонной промышленности; сотни лабораторий, занимавшихся «особо важными» исследованиями. Только один маленький нюанс: хоть предприятия и назывались «оборонными», они работали над созданием оружия массового уничтожения, а не обороны.
В рамках своих стратегических разработок наши ученые ответили на множество вопросов, связанных с матрицей воды. Была создана теория сверхпроводимости жидких сред и их взаимодействия с торсионными полями. Параллельно удалось ответить на вопросы, за счет чего вода может обладать врачующими качествами и каков механизм воздействия воды на человека. Будь в те времена СССР не закрытой сверхдержавой, а демократической страной, вероятно, эти разработки стали бы достоянием человечества, ученые были бы представлены к Нобелевской премии. Но этого по понятным причинам не произошло. Более того, архив того Института до сих пор находится в ведомстве спецхрана.
Однако некоторые разработки все-таки частично были приданы гласности. Как это произошло – не наш вопрос. Главное, что это случилось. И мы в этой книге расскажем все, что к настоящему времени известно об удивительных свойствах воды.
Взаимодействуя с водой (а это происходит практически постоянно, поскольку наш мир состоит как минимум на 2/3 из воды), надо помнить, что вода – это универсальный сверхпроводник. В нашем мире все зависит от правильности ее кристаллической структуры: структура первозданная– гармоничная, и мир гармоничен, и здоровье человеческое в порядке. А нарушается структура кристаллов воды – и наступают негативные перемены.
Доктор биологических наук Б. Ф. Сергеев начал свою книгу «Занимательная физиология» с главы о воде. Эта глава называется «Вещество, которое создало нашу планету». Действительно, нет на Земле вещества более важного для человечества, чем обыкновенная вода!
Почти 70 % поверхности нашей планеты занято океанами и морями. Твердой водой – снегом и льдом – покрыто 20 % суши. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Почти 70 % пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30 % – в водоносных слоях под землей, а в руслах всех рек содержатся одновременно всего лишь 0,006 % пресных вод.
Молекулы воды обнаружены в межзвездном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Но не только поэтому мы считаем воду жизненно важным веществом. Дело в том, что тело человека почти на 63–68 % состоит из воды. В организме человека с массой тела 65 кг содержится около 40 л воды: из них почти 25 л находится внутри клеток, а 15 л – в составе внеклеточных жидкостей организма. Из 25 л внутриклеточных жидкостей около 95 % находится в свободном состоянии, а 5 % – иммобилизовано за счет связи с биологическими макромолекулами. Почти 89 % воды содержит человеческий мозг, до 80 % воды входит в состав нашей крови, более чем на 70 % наши мышцы состоят из все той же воды, и даже в костях скелета около 20 % влаги. Особенно богаты водой ткани молодого организма. С годами человек «усыхает», теряет воду. В теле 3-месячного человеческого эмбриона содержится 95 % воды, 5-месячного – 86 %, новорожденного ребенка– 70 %, взрослого человека – от 55 до 65 %.
Представители животного и растительного мира содержат так же много воды в своих организмах. Например, организмы млекопитающих состоят из воды на 60–68 %; рыбы– на 70 %; водоросли – на 90–98 %. Меньше всего воды, лишь
5-7% веса, содержат мхи и лишайники.
Структура воды
Трудно поверить, но только в начале XIX века ученые Александр Гумбольдт и Жозеф-Луи Гей-Люссак установили, что вода – это соединение водорода и кислорода. До тех пор среди химиков вода считалась простым химическим элементом.
В XX веке ученые пошли дальше в своих исследованиях и обнаружили, что вода обладает определенной кристаллической структурой. С помощью простого микроскопа мы можем увидеть, как молекулы воды объединяются в группы. Эти группы принято называть кластерами. Именно советские ученые предположили, что кластеры – это своеобразные ячейки, в которых вода хранит память обо всем, что видит, слышит и ощущает. Как вы понимаете, это был один из первых выводов в ходе изучение принципиальной возможности создания нового вида оружия. Выяснилось, что феномен структурной памяти позволяет воде впитывать разнообразные сведения, хранить их и обмениваться с окружающей средой полученной информацией, любыми данными, содержащимися в мысли, свете, музыке, молитве или просто в слове. Подобно тому, как любая живая клетка содержит в себе сведения обо всем организме, каждая молекула воды способна хранить информацию обо всей нашей планетарной системе!
Школьникам до сих пор на уроках природоведения толкуют о круговороте воды в природе. С одной стороны, этот круговорот имеет место быть. Но, с другой-то, все обстоит значительно сложнее! Не потому загрязняются природные воды, что вбирают в себя грязь из окружающей среды. Не потому отравляется наша внутренняя вода, что мы имеем глупость и неосторожность пить «грязную» воду, не прошедшую фильтрации, прямо из-под крана. Дело в другом: в процессе цепной реакции сбивается биоэнергетическая матрица воды, а вода с измененной структурой кристаллической решетки начинает, стремясь восстановить свою решетку, впитывать разнообразные примеси, загрязняется. «Травмированная» вода с измененными кластерами не распознает объектов, с которыми взаимодействует. Она пытается во что бы то ни стало найти какие-то «протезы», которые хотя бы отчасти скомпенсируют повреждения в структуре. Такими «протезами» становятся подчас грязь, микробы, бактерии.
Когда мы болеем, наша внутренняя вода замещает в своей структуре утраченные элементы болезнетворными. В данном случае она ведет себя как «сумасшедшая» и «слепая». Наша задача предоставить ей возможность восстановить структуру правильным путем. Как только структура внутренней воды человека гармонизируется, болезни проходят.
Информационная память воды
С XVI века сохранилась легенда про графа де Мюреля, имевшего поместье на границе Испании и Франции. В источник, из которого брали воду для нужд замка, залезла нищая грязная старуха. Де Мюрель увидел это во время конной прогулки и возмутился. Он приказал нищенке немедленно убираться восвояси, но та в ответ только усмехнулась и что-то нашептала на воду. Старуху силой вытащили из воды. Затем – в наказание за осквернение графского источника и по подозрению в колдовстве – сожгли. Источником же продолжили пользоваться. Но это была плохая идея. Граф начал чахнуть на глазах и в скором времени умер. Пошла молва, что старуха наслала на графа проклятье через воду, заколдовала ключ. Это повергло людей со всей округи в мистический ужас. Как известно, в средние века колдунов особенно опасались. Правда, в их всесилие многие верят и сегодня.
Но нынче случай с графом был бы интерпретирован совершенно иначе, чем тогда. Современные ученые в один голос скажут: нет в подобных «инцидентах» никакого колдовства! Все объясняется очень просто: вода обладает памятью на уровне структуры своих кристаллов. Любые внешние факторы меняют структуру и биохимический состав воды. А ведь вода, как мы уже знаем, – основа любого организма! Это значит, что от воздействия на воду происходят и изменения в системе «человек»: перепрограммируются молекулы ДНК, заключающие в себе генную память, вплоть до полного разрушения.
Воздействовать через водную среду на человека своими мыслями, словами, завистью и недоброжелательностью может не только экстрасенс, но и каждый из нас, неосознанно. Наше плохое настроение, беспричинная агрессия или тревога, болезни могут оказаться последствиями негативного биоинформационного воздействия.
Общее загрязнение энергоинформационной среды способно менять структуру воды и таким образом влиять на нашу жизнь. Более того: через энергоинформационное поле вода поддерживает связь с человеком, воздействовавшим на нее, на каком бы расстоянии он ни находился. И если с ним что-нибудь случается, то и в структуре воды тоже могут произойти изменения.
Сегодня как никогда раньше энергоинформационную среду загрязняют насилие, криминал, военные конфликты, и вода все это запоминает. Но она не просто запоминает наши негативные поступки и мыслеобразы, она отвечает на них! Ученые полагают, что многие штормы, ураганы, наводнения – это реакция воды на общее загрязнение энергоинформационной среды. Таким способом вода возвращает нам вложенную в нее информацию.
Время сейчас на Земле нелегкое, да и, чего уж греха таить, не слишком доброе. Мы все активнее создаем запасы информационно грязной воды на планете. Как образуется эта «информационно грязная» вода? Под воздействием отрицательных внешних факторов молекулярное состояние воды изменяется: в ней появляются так называемые глобулы – «сгустки» молекул, или информационные зародыши. Эти «сгустки» обладают свойством информационно «заражать» любой объем воды. Даже минимальный объем информационно «грязной» воды способен заразить негативной информацией огромное количество воды чистой, нейтральной. Вот и получается: войны гремят где-то далеко от нас, страшные аварии случаются в отдаленных регионах, катастрофы происходят буквально «на краю света», а мы с вами получаем энерго-информационно грязную воду здесь, где все вроде бы тихо да гладко. И эта вода тормозит биохимические процессы в клетках нашего организма, отрицательно влияет на генный аппарат молекул ДНК.
В 1970-х наш секретный Институт пришел к сенсационному выводу. Любая информация передается по воде – благодаря ее структурированности. Происходит все так: структура кристаллов чувствительна к энергетически-информационным воздействиям, она претерпевает изменения, начинается цепная реакция изменений. Колебания передаются от кристалла к кристаллу, при этом меняются их решетки. Считывание этих изменений и есть считывание информации. В Институте был разработан специальный прибор для улавливания изменений в кристаллической решетке кристаллов воды и преобразования этих сигналов в легко интерпретируемую информацию.
Доктор биологических наук Николай Вепрев (Канада) отмечает: «Сегодняшние “железные” компьютеры – по сути своей прошлогодний снег. Будущее – за жидкокристаллической техникой, которая будет записывать всю информацию на воду. Первые модели таких водяных компьютеров уже сегодня созданы в Японии. Пока они недостаточно мощны, есть сложности при их эксплуатации. Но наука не стоит на месте. Как известно, НАУКА ИМЕЕТ МНОГО ГИТИК. Я уверен – через четверть века мы все забудем о громоздких конструкциях, которые нынче украшают наши офисы. В водном компьютере работает пипетка воды, в которой хранятся терабайты информации».
Вода добрая и злая
Примерно год назад в журнале «На грани невозможного» была опубликована удивительная статья. В ней рассказывалось о том, что японский ученый доктор Эмото Масару выявил взаимосвязь между человеческими мыслями, эмоциями и вообще информационным воздействием, с одной стороны, и формой кристаллов воды, на которую действует информация, с другой.
Он замораживал капельки воды и затем изучал их под сильным микроскопом, имеющим встроенную фотокамеру. Полученные фотографии наглядно демонстрируют различия в молекулярной структуре воды при ее взаимодействии с окружающей средой. Этот метод дал возможность показать всему миру, каким образом энергетические вибрации человека, его мысли, слова, идеи и музыка воздействуют на молекулярную структуру воды. Если вода перед замораживанием «прослушивала» Моцарта, Шуберта или Бетховена, то она превращалась в красивые снежинки идеальных форм. Если в ее присутствии ругались или просто негативно мыслили, после заморозки получались безобразные композиции. На сосуды с водой Эмото Масару наклеивал бумажные этикетки с различными словами и фразами, типа «Я люблю тебя» или «Я тебя убью», а также с именами «Гитлер», «Наполеон», «Христос», «мать Тереза» и затем, заморозив эту воду, наблюдал результат, который был просто ошеломляющим. Однажды японский исследователь провел такой эксперимент. Он взял пробу воды у плотины Фудзивара. Она оказалась грязной и токсичной. И эта же вода стала кристально чистой после того, как монахи-буддисты совершили над ней молитвенный обряд. Все это лишний раз доказывает, что вода – это субстанция, которая реагирует на каждую нашу эмоцию, на каждое слово и каждую мысль и обменивается этой информацией со всей Вселенной. Не зря, видимо, сказано в Библии, что каждый человек обязательно будет держать ответ за каждое свое слово!
kartaslov.ru