Содержание
12) Диссоциация воды. Константа диссоциации. Ионное произведение воды. Водородный и гидроксильный показатели.
Одним
из важнейших растворителей является
вода. Являясь слабым электролитом, вода
в незначительной степени диссоциирует
на ионы:
H2O
H+
+ OH—.
В
чистой воде концентрации ионов водорода
и гидроксид-ионов равны:
[H+]=[OH—].
Измерения
электропроводности чистой воды показали,
что при 22 °С
степень ее ионизации a = 1,8.10-9. Так как в
1 литре воды содержится
1000/M(H2O)
= 1000/18 = 55,55 моль,
то
концентрация ионов будет равна
[H+]
= [OH-] = 1,8.10-9.55,54 = 10-7 моль/л,
а
произведение равновесных концентраций:
[H+][OH-]
= 10-14 = Kw.
При
данной температуре величина Kw является
постоянной и называется ионным
произведением воды. Постоянство величины
Kw позволяет утверждать, что при увеличении
в растворе концентрации ионов водорода
H+ (растворение кислоты) происходит
уменьшение концентрации гидроксид-ионов,
и наоборот.
Если
[H+]=[OH-]=10-7 моль/л, то среда раствор
нейтральная;
если
[H+]>10-7 моль/л, то раствор кислый;
если
[OH-]>10-7 моль/л, то раствор щелочной.
Ионное
произведение воды — произведение
концентраций ионов водорода Н+ и ионов
гидроксила OH− в воде или в водных
растворах, показатель уровня кислотности
раствора.
Водородный
показатель pH – величина, характеризующая
концентрацию ионов водорода и кислотность
среды. pH – это отрицательный логарифм
концентрации ионов водорода: pH=-lg[H+].
Гидроксидный
показатель pOH – величина, характеризующая
концентрацию гидроксид-ионов и щелочность
среды. pOH – это отрицательный логарифм
концентрации гидроксид-ионов
pOH=-lg[OH-].
pOH + pH = 14.
Ионное произведение
воды. Вода
является слабым электролитом и
диссоциирует по схеме:
2Н2О
↔ Н3О+
+ ОН—
Ионы Н+ в воде
и водных растворах практически
отсутствуют, т.к. равновесие реакции
Н2О
+ Н+ ↔ Н3О+
полностью смещено
влево, обычно реакцию диссоциации воды
записывают упрощенно
Н2О
↔ Н+
+ ОН—
Константу
диссоциации воды можно записать:
В чистой воде
концентрации ионов водорода и гидроксида
очень малы и вместо активностей можно
использовать аналитические концентрации.
Диссоциация практически не влияет на
концентрацию воды, поэтому
Эта величина носит
название ионное произведение воды. При
295 К (22оС) ионное произведение равно
точно 10-14.
Диссоциация
воды протекает с поглощением тепла,
поэтому при повышении температуры КW
возрастает Из ур-ния (7.31) следует, что
в чистой воде концентрации ионов водорода
и гидроксила равны и составляют при 295
К
Такой раствор
называют нейтральным. Если
то раствор будет кислым, а если
то раствор щелочной.
Для характеристики
кислотности среды обычно используют
вместо концентрации водородный показатель
(рН) – отрицательный десятичный логарифм
активности (концентрации) ионов водород:
При 295 К в нейтральной
среде рН=7, в кислой – рН<7, в щелочной
— pH>7.
Несколько
реже используют гидроксидный покадатель
(рОН) отрицательный десятичный логарифм
активности (концентрации) ионов
гидроксила:
При 295 К в нейтральной
среде рОН=7, в кислой – pОH>7, в щелочной
— рОН<7.
рН+рОН=14.
Величина рН может
контролироваться с помощью приборов
(рН-метров) или посредством специальных
реактивов, называемых индикаторами.
Окраска индикаторов изменяется в
зависимости от концентрации ионов
водорода. Кислотно-основные индикаторы
представляют собой слабые органические
кислоты (HInd) или основания (IndOH),
диссоциирующие по схемам:
HInd↔H+
+ Ind—
IndOH↔Ind+
+ OH—
Молекулярная и
ионная формы индикаторов имеют разные
окраски. При избытке ионов водорода
HInd находится преимущественно в
молекулярной форме, а IndOH – в ионной, а
при избытке ионов гидроксила, наоборот
— HInd находится преимущественно в ионной
форме, а IndOH –в молекулярной.
Изменение окраски
индикатора происходит в некотором
интервале рН, называемом интервал
перехода индикатора, определяемом
величиной рКHind.
Константа диссоциации воды
Константа гидролиза соли сильного основания и слабой кислоты равна ионному произведению воды, деленному на константу диссоциации слабой кислоты.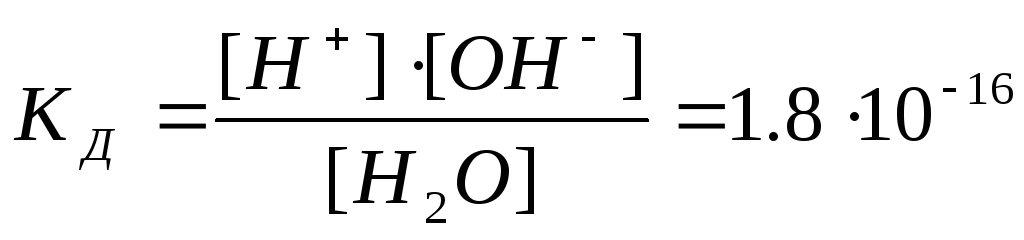 Или, другими словами, константа гидролиза определяется по константе диссоциации слабой кислоты или слабого основания.[ …]
Или, другими словами, константа гидролиза определяется по константе диссоциации слабой кислоты или слабого основания.[ …]
Константа гидролиза связана с ионным произведением воды, константой диссоциации кислоты (основания) и степенью гидролиза зависимостями, приведенными в табл. 2.3.[ …]
Константа гидролиза Кт характеризуется отношением ионного произведения воды к константе диссоциации кислоты КНА или основания /СМеОН.[ …]
Диссоциация кремневой кислоты до ионов БЮз- в природной воде практически не происходит ввиду очень малого значения второй константы диссоциации (Кг = 1,6 ■ 10-12). При pH воды ниже 8 в ней присутствует лишь На5Ю3, обычно в коллоидном состоянии с частицами состава 5Ю2 • Н20 дали в виде поликремневой кислоты — х 8Ю2 ■ у Н20.[ …]
В воде ионообменные смолы под влиянием осмотических явлений набухают. На этот процесс существенно влияет величина гидратации фиксированных ионов и про-тивоионов. Препятствуют набуханию смол частота и длина радикалов дивинилбензола, сшивающих длинные углеводородные цепи полимеров стирола с образованием трехмерной сетчатой структуры. Ясно, что чем больше степень сшивания полимерных цепей, тем более жесткую структуру имеет смола и тем меньше она набухает в водных растворах. Следует отметить, что область pH, в которой осуществляется обмен ионов, зависит от константы диссоциации ионообменных групп смолы. Так, сульфокислотные катиониты, например смола КУ 2 (р/(Лис способны к обмену ионов водорода на другие катионы в широком интервале pH и при pH > 2,5—3 кислотность на обмен практически не влияет. Карбоксильные катиониты (р/Сдис = 5—6) обменивают свои ионы при pH > 7 и могут использоваться только в солевой форме. Катиониты, содержащие фенольные гидроксильные группы, способны к обмену лишь при pH > 8, т. е. в области значений pH, отвечающей диссоциации фенольных групп. Все это необходимо учитывать при выборе смол для очистки промышленных сточных вод.[ …]
Ясно, что чем больше степень сшивания полимерных цепей, тем более жесткую структуру имеет смола и тем меньше она набухает в водных растворах. Следует отметить, что область pH, в которой осуществляется обмен ионов, зависит от константы диссоциации ионообменных групп смолы. Так, сульфокислотные катиониты, например смола КУ 2 (р/(Лис способны к обмену ионов водорода на другие катионы в широком интервале pH и при pH > 2,5—3 кислотность на обмен практически не влияет. Карбоксильные катиониты (р/Сдис = 5—6) обменивают свои ионы при pH > 7 и могут использоваться только в солевой форме. Катиониты, содержащие фенольные гидроксильные группы, способны к обмену лишь при pH > 8, т. е. в области значений pH, отвечающей диссоциации фенольных групп. Все это необходимо учитывать при выборе смол для очистки промышленных сточных вод.[ …]
Значения констант диссоциации К и /Сг обратно пропорциональны ионной силе раствора, которая определяет активность рассматриваемых ионов. В то же время значения констант прямо пропорциональны температуре. [ …]
[ …]
Кислоты с константой диссоциации 10 7—10 9 умеренно гидролизованы при 20—40 °С и значительно гидролизуются при 100—■ 120°С и выше, что и делает возможным поглощение аммиака с получением растворов названных солей при обратимом процессе. Соли кислот с константами диссоциации ниже 10 9 более чем на 40% гидролизуются уже при 40°С. Процесс абсорбция аммиака растворами этих кислот мало отличается по условиям равновесия от абсорбции водой.[ …]
Таким образом, в воде наряду с молекулами Н20 всегда присутствуют водные ионы. В табл. 50 представлены экспериментальные значения, характеризующие воду и лед как диссоциирующие среды. Из табл. 50 видно, что при плавлении на шесть порядков возрастает константа диссоциации молекулы Н20, на четыре порядка — постоянная скорости диссоциации и на два порядка уменьшается постоянная скорости рекомбинации.[ …]
Первые измерения константы диссоциации молекулы НгО были выполнены Аррениусом (1890—1893). Он использовал свою теорию гидролиза и экспериментальные данные относительно гидролиза в растворах. Скорость гидролиза зависит от концентрации Н+ и ОН- ионов. Кольрауш оценил значение К н2о из данных по электропроводности чистой воды. Наиболее красивый метод определения постоянной диссоциации молекулы НгО был рассмотрен выше (Эйген и Майер, 1958).[ …]
Скорость гидролиза зависит от концентрации Н+ и ОН- ионов. Кольрауш оценил значение К н2о из данных по электропроводности чистой воды. Наиболее красивый метод определения постоянной диссоциации молекулы НгО был рассмотрен выше (Эйген и Майер, 1958).[ …]
Все эти кислоты в воде — сильные электролиты и, следовательно, константа диссоциации каждой из них в водном растворе стремится к бесконечности. Вода — в данном случае нивелирующий силу кислот растворитель, уравнивающий их по силе. Иная картина в дифференцирующем силу кислот растворителе НАс. Серная кислота в этом растворителе в 40 раз слабее хлорной, а азотная кислота уступает хлорной в 250 раз.[ …]
Величина pH сточной воды, при которой происходит обмен ионами, зависит от константы диссоциации ионообменных групп смолы. Сильнокислотные катиониты позволяют проводить процесс в любых средах, а слабокислотные — в щелочных и нейтральных. Так, катиониты с карбоксильными группами обмениваются ионами при рН>7, а с фенольными группами при рН>8. [ …]
[ …]
Для оценки изменения константы диссоциации воды в малых объемах определялись установившиеся значения концентрации стабильных ион-ра-дикалов в капле дистиллированной воды. С этой целью снималась кинетическая зависимость изменения концентрации радикалов в капле, выдерживаемой на тефлоновой подложке дозаторного устройства прибора ЛИК-2.[ …]
В оборотной и сточной воде каждой концентрации ионов НС03- и Са2+ соответствует определенная концентрация растворенной С02, которая зависит от констант равновесия первой К2, и второй К2 ступеней диссоциации угольной кислоты, а также от константы произведения активностей (СаС03). Эта величина растворенной С02 называется «равновесной» углекислотой.[ …]
Цианиды встречаются в водах в виде слабодиссоциированной, очень токсичной синильной кислоты и в виде также очень токсичных цианид-ионов. Отношение между концентрациями обеих этих форм определяется значением pH среды. Комплексные цианид-ионы в незначительной мере также диссоциируют с отделением ионов СЫ , Степень этой диссоциации выражается константами устойчивости, наибольшие значения ¡которых имеют комплексные цианиды железа ), железа(Ш) и кобальта, наименьшее — комплексный цианид цинка. Чем ниже константа устойчивости, тем больше выделяется ионов СЫ при диссоциации и, следовательно, тем токсичнее соединение.[ …]
Чем ниже константа устойчивости, тем больше выделяется ионов СЫ при диссоциации и, следовательно, тем токсичнее соединение.[ …]
Например, вторая кажущаяся константа диссоциации (К2) карбоновой кислоты меняется от 4,2 -КН1 в пресной воде до 4,0 Ю-10 в воде, содержащей 9% хлора, и до 7,1. 10 10 в морской воде, содержащей 20% хлора, т. е. константа возрастает примерно в 20 раз [45].[ …]
Относительное содержание в воде сероводорода (НгБ), гидросульфид- (НБ-) и сульфид-ионов (¿2-) зависит от величины pH воды и определяется расчетом при помощи констант диссоциации сероводородной кислоты. Ниже приведено содержание Нг5 в воде в зависимости от pH воды и общего количества соединений сероводорода при температуре 20°С.[ …]
Далее по аналогии с разложением воды используется термин «разложение карбонатов». Уподобляя разложение карбонатов разложению воды, можно в то же время предполагать, что оно происходит легче, чем разложение воды (константа диссоциации НгО —Н+ + ОН порядка 1014, а константа диссоциации НСОз— Н+ + СО -порядка 108). Отсюда резкое повышение проникания карбонатов можно объяснить определенными условиями, которые предшествуют разложению воды. Если проникание через мембрану связано с метакарбонатами, нетрудно представить себе, как могут образоваться отложения карбоната кальция на поверхности мембраны. Подобный механизм позволяет объяснить образование отложений карбоната кальция и в отсутствии разложения воды.[ …]
Отсюда резкое повышение проникания карбонатов можно объяснить определенными условиями, которые предшествуют разложению воды. Если проникание через мембрану связано с метакарбонатами, нетрудно представить себе, как могут образоваться отложения карбоната кальция на поверхности мембраны. Подобный механизм позволяет объяснить образование отложений карбоната кальция и в отсутствии разложения воды.[ …]
При данной температуре величина константы диссоциации остается постоянной, причем не только в воде, но и в любом водном растворе кислот, щелочей и солей. Поэтому при увеличении концентрации водородных ионов путем добавки кислоты соответственно уменьшается концентрация ионов гидроксила.[ …]
Эллис и Андерсон показали [62], что константы диссоциации у кислот, например фосфорной и уксусной, которые при переходе из водной фазы в газовую не меняют своей структуры, слабо зависят от давления, а у кислот, переходящих в газовую фазу в форме ангидридов, например угольной, — сильно. Зависимость константы диссоциации сернистой кислоты от давления занимает промежуточное положение между указанными выше крайними случаями. По мнению авторов, этим подтверждаются данные о существовании сернистой кислоты в виде БОг • Н2О и о слабом взаимодействии оксида серы (IV) и воды.[ …]
По мнению авторов, этим подтверждаются данные о существовании сернистой кислоты в виде БОг • Н2О и о слабом взаимодействии оксида серы (IV) и воды.[ …]
Проведенная в [24] оценка истинных констант диссоциации (Кс) с корректировкой концентрации Н250з на значения [Б02 своб.] и [ИБО ] показала, что их значения приблизительно в 2 раза больше Ка, а доля сернистой кислоты в форме Н2БОз составляет примерно 55-65 % всей массы растворенной в воде 502 и уменьшается с ростом температуры и содержания оксида серы (IV).[ …]
Растворяющая способность тяжелой воды меньше, чем легкой. Для экзотермических реакций количество тепла, выделяемое в процессе реакции в 020, больше, чем в Н20, а при эндотермических реакциях тепла в результате реакции поглощается больше в 020, чем в Н20. Все процессы нейтрализации в тяжелой воде идут быстрее, а все процессы диссоциации в тяжелой воде происходят более медленно. Это связано с тем, что константа скорости рекомбинации больше в тяжелой воде, а постоянная скорости диссоциации больше в легкой воде (гл. 5).[ …]
5).[ …]
В приведенных формулах Ккмсл и Косн — константы диссоциации слабой кислоты и слабого основания; н2о — ионное произведение воды; Скисл, Сосн, Ссол — общая концентрация кислоты, основания и соли.[ …]
Уравнения (3.94) — (3.96) совместно с уравнениями констант химического равновесия, записанными для ионов, участвующих в химических реакциях в объеме электролита (уравнения произведения растворимостей, констант нестойкости комплексных ионов, ионного произведения воды, констант диссоциаций), описывают изменение pH среды с разделением продуктов электродных реакций. Модель учитывает начальную концентрацию веществ в обрабатываемом растворе, объемы анодного и катодного пространства, миграцию веществ через неактивную диафрагму при изменяющихся числах переноса, химические превращения веществ на электродах и в объеме электролита.[ …]
КМЦ — слабая кислота; при степени замещения 0,8 константа диссоциации КМЦ равна 5-10-5. Соли КМЦ тяжелых и поливалентных металлов, включай А1, нерастворимы в воде. Вязкость растворов Иа-КМи зависит от pH (максимум г соответствует pH = 6-4-9), с повышением температуры, особенно выше 50 °С, происходит необратимое уменьшение вязкости — диспергирование надмолекулярных структур Ыа-КМЦ.[ …]
Вязкость растворов Иа-КМи зависит от pH (максимум г соответствует pH = 6-4-9), с повышением температуры, особенно выше 50 °С, происходит необратимое уменьшение вязкости — диспергирование надмолекулярных структур Ыа-КМЦ.[ …]
Химические свойства. Диоксид серы, растворяясь в воде, образует сернистую кислоту Н3503 с константами диссоциации: Кх = 1,7-10-2, /(2 = 6,2-10-8. Окислители переводят БОа в Э03 или Н28 04, под действием восстановителей, в зависимости от их эффективности, Б02 превращается либо в элементарную серу (например, Н28 в печи Клауса), либо в Н28 [например, хлорид олова (II) или фосфорноватая кислота].[ …]
Содержание различных форм сернистых соединений в воде, диссоциированных согласно приведенным ниже уравнениям, определяется по константам диссоциации сероводородной кислоты первой и второй ступени [23].[ …]
| Модель основных химических равновесий компонентов воды и состояния насыщения ее карбонатом кальция |
Равновесие нейтрализации пиридиновых оснований кислотами с константой диссоциации менее 10 5 настолько сдвинуто в сторону обратной реакции, что условия улавливания не будут отличаться от условий поглощения водой. [ …]
[ …]
Дифференцирующее действие растворителей — увеличение разности между константами электролитической диссоциации электролитов в данном растворителе по сравнению со стандартным (в качестве последнего чаще всего выбирается вода) (стр. 49 сл.).[ …]
Основные физические свойства. Температура кипения —78,5 °С. Растворимость в воде: в 100 мл воды при 20 °С и 760 мм рт. ст. растворяется 88 мл С02. Константы диссоциации: Кг = 4,3-10 7, Кг = 5,6-10″11.[ …]
В случае сильных электролитов (к ним могут быть отнесены все растворенные в природной воде соли), в связи с отклонениями свойств их растворов от идеальных, для которых создана классическая теория электролитической диссоциации, при вычислении констант диссоциации необходимо использовать активности или умножать аналитически определяемые концентрации ионов на соответствующие коэффициенты активности.[ …]
Оказалось, что при связывании аналога ЭПР-сигнал заметно уширяется, а скорость продольной релаксации воды возрастает. В алкогольдегидрогеназе печени лошади титровались с помощью аналога 2-го участка на поверхности фермента с константной диссоциации комплекса Кд= 17+8 мкМ и 5—6 участков с Кд = 9 мкМ. Константа диссоциации НАДН из комплекса с ферментом, определенная при титровании, составила 5-10 5М, что значительно превышает величину, найденную ранее методом флюориметрического титрования—-2,0 • 10“7М [165].[ …]
В алкогольдегидрогеназе печени лошади титровались с помощью аналога 2-го участка на поверхности фермента с константной диссоциации комплекса Кд= 17+8 мкМ и 5—6 участков с Кд = 9 мкМ. Константа диссоциации НАДН из комплекса с ферментом, определенная при титровании, составила 5-10 5М, что значительно превышает величину, найденную ранее методом флюориметрического титрования—-2,0 • 10“7М [165].[ …]
Константа диссоциации 2М-4Х составляет 5,4 -10“4. Чистая 2М-4Х практически не имеет запаха [15], технические препараты в большинстве случаев имеют неприятный запах хлоркрезолов. С целью очистки и получения 2М-4Х, пригодной для аналитических целей, ее несколько раз перекристаллизовывают из бензола или хлорбензола [5].[ …]
Важно подчеркнуть, что в реакциях нейтрализации ОН-, образующихся при растворении карбонатов и силикатов, участвуют не только угольная кислота, но и органические кислоты (особенно фульво- и гуминовые), являющиеся агентом интенсивного разложения пород. Сильная диссоциация многих органических кислот приводит к увеличению в воде концентраций Н . Константы диссоциации таких распространенных в природе соединений, как фульво- и гуминовые кислоты, приближаются к и-10-3-«• 10″5. Это означает, что они могут снижать pH реальных подземных вод до 3 и менее. В связи с зтим такие органические кислоты интенсивно разлагают силикаты с разрушением их кристаллической решетки. Степень такого разложения тем больше, чем ниже минерализация подземных вод и чем более кислыми они являются.[ …]
Константы диссоциации таких распространенных в природе соединений, как фульво- и гуминовые кислоты, приближаются к и-10-3-«• 10″5. Это означает, что они могут снижать pH реальных подземных вод до 3 и менее. В связи с зтим такие органические кислоты интенсивно разлагают силикаты с разрушением их кристаллической решетки. Степень такого разложения тем больше, чем ниже минерализация подземных вод и чем более кислыми они являются.[ …]
Эти равновесия осложняются медленным превращением гипохлорита в хлорид и хлорат, с происходящим в результате этого уменьшением активного хлора для отбелки. Знание того [344], что константа гидролиза хлора в воде равна 4.5ХЮ-4, а константа диссоциации хлорноватистой кислоты [345, 346, 347] около 4ХЮ 8, создает возможность-путем вычисления определить, что составы разбавленных растворов, употребляемых на практике (содержащих больше или меньше 0,8 % активного хлора) меняются в зависимости от pH, как указано ранее. Свыше 95% активного хлора существует в виде недиссоциированной хлорноватистой кислоты в пределах рНотЗ до 6; при pH 9 около 97% присутствует в качестве иона гипохлорита, а в кислом растворе при pH 2 гидролиз дает около 32% активного хлора [82]. То, что скорость, при которой целлюлоза восстанавливает 0,04 н. гипохлорит натрия больше примерно в 10 раз при pH 7, чем при pH 4,6 или pH 9, говорит о том, что иедиссоциированная хлорноватистая кислота легче окисляет целлюлозу, чем ион гипохлорита или активный хлор [66, 84, 348]. Более медленная реакция в кислом растворе сильно катализируется ярким дневным светом [79], реакция при pH 7—ультрафиолетовыми линиями в ртутном спектре [341], а окисление в каустической соде мерсеризующей концентрации, также является быстрым [66]. В результате этих окислений из отбеливаемых примесей образуются слабые органические кислоты, а из слабой хлорноватистой кислоты — сильная соляная кислота. Следовательно, щелочная белильная жидкость во время использования имеет тенденцию приблизиться к опасным пределам pH от 6 до 8, где переокисление, ведущее к деградации целлюлозы, происходит быстро [345]. Вследствие этого было тщательно изучено [345] как с теоретической [82], так и с практической [83] точек зрения, буферное действие присутствующего натриевого или кальциевого основания вместе с эффективностью добавления карбоната натрия или кальция, бората натрия, фосфатов, ацетата, цинкового и алюминиевого буферов.
То, что скорость, при которой целлюлоза восстанавливает 0,04 н. гипохлорит натрия больше примерно в 10 раз при pH 7, чем при pH 4,6 или pH 9, говорит о том, что иедиссоциированная хлорноватистая кислота легче окисляет целлюлозу, чем ион гипохлорита или активный хлор [66, 84, 348]. Более медленная реакция в кислом растворе сильно катализируется ярким дневным светом [79], реакция при pH 7—ультрафиолетовыми линиями в ртутном спектре [341], а окисление в каустической соде мерсеризующей концентрации, также является быстрым [66]. В результате этих окислений из отбеливаемых примесей образуются слабые органические кислоты, а из слабой хлорноватистой кислоты — сильная соляная кислота. Следовательно, щелочная белильная жидкость во время использования имеет тенденцию приблизиться к опасным пределам pH от 6 до 8, где переокисление, ведущее к деградации целлюлозы, происходит быстро [345]. Вследствие этого было тщательно изучено [345] как с теоретической [82], так и с практической [83] точек зрения, буферное действие присутствующего натриевого или кальциевого основания вместе с эффективностью добавления карбоната натрия или кальция, бората натрия, фосфатов, ацетата, цинкового и алюминиевого буферов. Однако отбелка может быть безопасно и быстро выполнена вблизи нейтральной точки при соблюдении некоторых определенных условий [83].[ …]
Однако отбелка может быть безопасно и быстро выполнена вблизи нейтральной точки при соблюдении некоторых определенных условий [83].[ …]
В химическом отношении селен является аналогом серы, находясь с ней в главной подгруппе VI группы элементов. Для селена характерны степени окисления — 2, + 4, + 6; он образует диоксид Se02 и триоксид Se03, соответственно селенистую h3Se03 и селеновую кислоты h3Se04 (соли — селениты и селенаты). Селенистая кислота слабая, ее константы диссоциации: Кх = 2 ■ 10 3 и К2 = 5 ■ 10 9. Селеновая кислота сильная, степень ее диссоциации близка к степени диссоциации серной кислоты. Селениты щелочных металлов хорошо растворимы, другие селениты имеют низкую растворимость. Селенаты, как правило, хорошо растворимы в воде. Для содержания селенатов в воде установлен ПДК 0,2 мг/м3 в расчете на селен. Соли слабой селеноводородной кислоты h3Se — селениды — сходны по свойствам с сульфидами.[ …]
Для осуществления реакции конденсации необходим достаточно сильный катализатор. Целлюлоза обратимо адсорбирует формальдегид из нейтральных водных растворов [14], причем скорость адсорбции увеличивается в 2 раза при добавлении к реакционному раствору 5% нейтральной соли, такой, как, например, хлорид калия [15]. Однако реакция конденсации протекает только в кислой среде. Показано [16], что продукты конденсации, устойчивые к обработке в кипящей воде (pH 7), образуются только при использовании в качестве катализаторов кислот с константой диссоциации 10 2 и выше. Позже эти реакции были осуществлены в присутствии достаточно эффективного катализатора — кислот, константа диссоциации которых ниже 10 3 и 10 4 (например, молочной и винной кислот) [17].[ …]
Целлюлоза обратимо адсорбирует формальдегид из нейтральных водных растворов [14], причем скорость адсорбции увеличивается в 2 раза при добавлении к реакционному раствору 5% нейтральной соли, такой, как, например, хлорид калия [15]. Однако реакция конденсации протекает только в кислой среде. Показано [16], что продукты конденсации, устойчивые к обработке в кипящей воде (pH 7), образуются только при использовании в качестве катализаторов кислот с константой диссоциации 10 2 и выше. Позже эти реакции были осуществлены в присутствии достаточно эффективного катализатора — кислот, константа диссоциации которых ниже 10 3 и 10 4 (например, молочной и винной кислот) [17].[ …]
Вода, кислоты и основания
Вода,
Кислоты и основания
| Кислотно-основная химия воды | сильный Кислоты и Н 3 О + и ОН — Концентрация ионов |
Кислотно-основная химия
воды
В химии водных растворов преобладают
равновесие между нейтральными молекулами воды и ионами, которые они
форма.
2 Н 2 О( л )
H 3 O + ( aq ) + OH — ( aq )
Строгое применение правил записи равновесия
постоянные выражения этой реакции дают следующее
результат.
Это правильное выражение константы равновесия, но оно
не учитывает огромную разницу между
концентрации нейтральных молекул H 2 O и H 3 О +
ионы ОН — в равновесии.
Измерения способности воды проводить электрический ток
тока предполагают, что чистая вода при 25 o C содержит 1,0 x
10 -7 молей на литр каждого из этих ионов.
[Н 3 О + ] =
[OH — ] = 1,0 x 10 -7 M
При той же температуре концентрация нейтрального H 2 O
молекул составляет 55,35 молярных.
Отношение концентрации Н + (или ОН — )
ион к концентрации нейтральных молекул H 2 O
следовательно, 1,8 x 10 -9 .
Другими словами, только около 2 частей на миллиард (ppb)
молекулы воды диссоциируют на ионы при комнатной температуре.
Равновесная концентрация молекул H 2 O равна
настолько больше, чем концентрации H 3 О +
ионов ОН — , что она эффективно постоянна. Мы
поэтому встройте член [H 2 O] в равновесие
постоянной для реакции и тем самым значительно упростить
равновесные расчеты. Начнем с изменения равновесия
постоянное выражение для диссоциации воды дает
следующее уравнение.
[H 3 O + ][OH — ] = K c
х [ч 2 O] 2
Затем мы заменим член в правой части этого уравнения
с константой, известной как диссоциация воды
константа равновесия , К w .
[H 3 O + ] [OH — ] = K W
в чистой воде, при 25C, [H 3 O + ]
Концентрации ионов [OH — ] составляют 1,0 x 10 -7 М .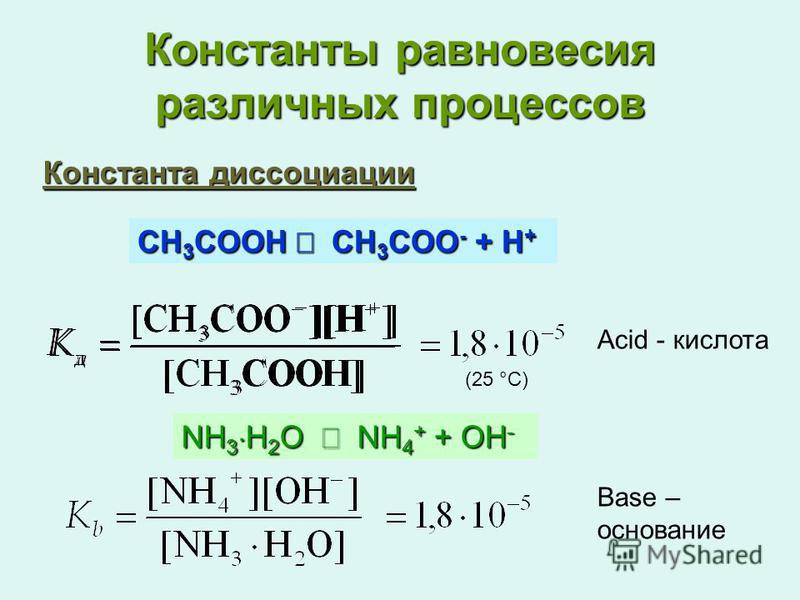
Таким образом, значение K w при 25°C равно
1,0 х 10 -14 .
| [1,0 x 10 -7 ][1,0 x 10 -7 ] | = | 1,0 x 10 -14 | (при 25С) |
Хотя K w определяется с точки зрения
диссоциация воды, это выражение константы равновесия
в равной степени справедливо для растворов кислот и оснований, растворенных в
вода. Независимо от источника H 3 О +
и OH — в воде, продукт
концентрации этих ионов в равновесии при 25°С всегда
1,0 х 10 -14 .
Сильные кислоты и
H 3 O +
и ОХ —
Концентрация ионов
Предположим, мы добавляем в стакан с водой достаточно сильной кислоты, чтобы
повысить концентрацию ионов H 3 O + до 0,010 M .
Согласно принципу Ле-Шателье, это должно управлять
равновесие между водой и ее ионами смещается влево, уменьшая
количество ионов H 3 O + и OH — в
решение.
2 Н 2 О( л )
Н 3 О + ( aq ) + OH — ( aq )
Потому что в
этого раствора изменение концентрации этого иона слишком
маленький, чтобы заметить. Когда система возвращается в равновесие, H 3 O +
концентрация ионов по-прежнему составляет около 0,010 M . Более того,
когда реакция возвращается к равновесию, продукт H 3 O +
и ОН — 9Концентрация ионов 0014 снова равна K w .
[H 3 O + ][OH — ] =
1 x 10 -14
Таким образом, раствор возвращается к равновесию, когда
диссоциация воды настолько мала, что ион ОН —
концентрация составляет всего 1,0 x 10 -12 M .
Таким образом, добавление кислоты в воду влияет на
концентрации как H 3 О + и ОН —
ионы. Поскольку это источник этого иона, добавление кислоты в воду
увеличивает концентрацию H 3 O +
ион. Однако добавление кислоты к воде снижает степень
которые вода диссоциирует. Таким образом, это приводит к значительному
снижение концентрации иона ОН — .
Как и следовало ожидать, обратный эффект наблюдается при
основание добавляется в воду. Поскольку мы добавляем базу, OH —
концентрация ионов увеличивается. Как только система вернется в
равновесие, произведение H 3 O + и OH —
концентрация ионов снова равна K w .
Единственный способ, которым это может быть достигнуто, это, конечно, уменьшение
концентрация иона H 3 O + .
6.5: Диссоциация воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 371806
- Мухаммад Ариф Малик
- Университет Хэмптона, Хэмптон, Вирджиния
Как диссоциируют молекулы воды?
Вода является амфотерным веществом, что означает, что вода может принимать протон, действующий как основание, а также может отдавать протон, действующий как кислота.
Примерно одна молекула воды из полумиллиарда диссоциирует на ион OH — , отдавая протон другой молекуле воды. Молекула, получившая протон, становится H 3 O + .
Диссоциация воды – это равновесная реакция, в которой одна молекула воды отдает свой протон другой молекуле воды.
Молекула воды, принимающая протон, действует как основание и превращается в сопряженную кислоту H 3 O + . Другая молекула воды, отдающая протон, действует как кислота и превращается в сопряженное основание ОН —. Стрелки в реакции показывают, что основание использует одну из своих неподеленных пар электронов для образования связи с протоном, а предыдущая пара электронов связи превращается в третью неподеленную пару электронов на атоме кислорода основания. Реакция обратима, т. е. сопряженная кислота (H 3 O + ) и сопряженное основание (OH — ) реагируют с образованием двух молекул воды.
Константа диссоциации воды
Диссоциация воды является равновесной реакцией. Это означает, что скорость прямой реакции равна скорости обратной реакции, а концентрации реагентов и продуктов не меняются при равновесии. Молярная концентрация H 3 O + , представленная как [H 3 O + ], равна 10 -7 M в пробе чистой воды при 25 o C, где M в молях. /Литр. Молярная концентрация ОН — , представленное как [OH — ], равно молярной концентрации H 3 O + в чистой воде, т.е. [H 3 O + ] = [OH — ] 10 -7 M.
Произведение молярной концентрации H 3 O + и OH — в воде есть константа, называемая константой диссоциации воды K w 6 равной 6 14 при 25 o С, т.е.:
\[\mathrm{K}_{\mathrm{w}}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{OH}^ {-}\right]=\left(10^{-7}\right)\left(10^{-7}\right)=10^{-14}\nonumber\nonnum\]
Нейтральные, кислые или щелочные водные растворы
Раствор, который имеет равную концентрацию H 3 O + и OH — , каждая из которых равна 10 -7 М, является нейтральным раствором .
Кислотный раствор содержит кислоту, растворенную в воде. Когда кислота растворяется в воде, она диссоциирует, добавляя больше H 3 O +. Значение [OH — ] должно уменьшаться, чтобы K w оставалось постоянным.
Раствор, содержащий [H 3 O + ] более 10 -7 и [OH — ] менее 10 -7 представляет собой кислый раствор .
Основной раствор имеет основание, растворенное в воде. Когда основание растворяется в воде, оно диссоциирует, добавляя больше OH —. [H 3 O + ] должно уменьшаться, чтобы K w оставалось постоянным.
Раствор, имеющий [H 3 O + ] менее 10 -7 и [OH — ] более 10 9{+}\right]}\nonumber\]
Когда сильная кислота, такая как HCl, растворяется в воде, она примерно на 100 % диссоциирует на ионы. Следовательно, [H 3 O + ] равно молярной концентрации кислоты. Количество H 3 O + , добавляемое при диссоциации молекул воды, очень мало по сравнению с тем, что получается при диссоциации сильной кислоты, и им можно пренебречь. Точно так же, когда сильное основание, такое как NaOH, растворяется в воде, оно примерно на 100% диссоциирует на ионы. Следовательно, [OH — ] равна молярной концентрации основания.
Количество H 3 O + , добавляемое при диссоциации молекул воды, очень мало по сравнению с тем, что получается при диссоциации сильной кислоты, и им можно пренебречь. Точно так же, когда сильное основание, такое как NaOH, растворяется в воде, оно примерно на 100% диссоциирует на ионы. Следовательно, [OH — ] равна молярной концентрации основания.
Примечание
При растворении в воде слабой кислоты или слабого основания они частично диссоциируют на ионы. Следовательно, [H 3 O + ] или [OH — ] в случаях слабых кислот и слабых оснований должны быть определены экспериментально для расчетов.
Пример \(\PageIndex{1}\)
Рассчитать концентрацию ионов OH — в 0,10 М растворе HNO 3 ? 9{-12} \mathrm{M}\)
б) Раствор кислый, потому что [H 3 O + ] > [OH — ].
Пример \(\PageIndex{3}\)
Рассчитайте значение [H 3 O + ] и [OH — ] в 0,010 М растворе NaOH?
Раствор
NaOH является сильным основанием.
