Содержание
Как проверить уровень кислотности воды?
Каждая сельскохозяйственная культура зависит от воды. Является ли вода подходящей для полива растений, или нет — это зависит от показателя pH. Показатель pH указывает на уровень кислотности. Но как определить уровень pH воды? В данной статье наши специалисты дадут вам подробные советы.
Характеристики подходящей воды
Общее правило заключается в том, что хорошая поливная вода обладает низким содержанием натриевых солей. Если вы выращиваете растения в открытой почве, то для полива обычно используется вода с содержанием натриевых солей 0,5 ммоль/литр. С другой стороны, содержание натриевых солей может быть выше, если вы культивируете растения, не являющиеся чувствительными к солям. Подходящей для полива, обычно, считается вода, уровень кислотности которой находится в пределах 4,5-6,0 pH. Если показатель pH ниже указанных значений, то существует вероятность повреждения почвы и корней растения. Слишком высокий уровень кислотности также ведет к снижению способности корневой системы впитывать полезные вещества. Присутствие бикарбоната в воде повышает уровень pH. А это, в свою очередь, усложняет контроль уровня кислотности в корневой среде. Поэтому, очень важно нейтрализовать основное содержание бикарбоната при помощи при помощи кислотных удобрений.
Присутствие бикарбоната в воде повышает уровень pH. А это, в свою очередь, усложняет контроль уровня кислотности в корневой среде. Поэтому, очень важно нейтрализовать основное содержание бикарбоната при помощи при помощи кислотных удобрений.
Подсказка: содержание бикарбоната в ммоль/литр должно быть равно азотной кислоты.
Проверка показателя pH воды для полива
Значение pH у воды для полива может быть проверено при помощи pH-метра. Для измерения уровня рН воды для полива, придерживайтесь следующего порядка действий:
- Налейте воду, которую собираетесь исследовать, в чистую чашку или измерительный стакан и измерьте ее температуру.
- Промойте датчик рН-метра дистиллированной водой и протрите его салфеткой. Затем, поместите датчик в воду, уровень кислотности которой хотите измерить, и слегка помешайте им.
- Установите температуру измеряемой жидкости на приборе при помощи левостороннего регулятора.

- Подержите датчик в воде на протяжении 1 минуты в неподвижном состоянии.
- Теперь вы можете прочитать уровень рН воды для полива.
- После измерения, опять промойте датчик дистиллированной водой и положите обратно в футляр.
Помните: в футляре постоянно должен быть определенный объем Probecare . Это обеспечит сохранность датчика измерительного прибора. Если датчик подключен, то прибор должен показывать приблизительное значение рН на уровне 4. Если показатель рН выше 5, замените Probecare в футляре. Очень важно калибровать pH-метр регулярно.
Сопутствующие товары
Связанные статьи
Значение рН для растений
Значение рН может отличатся для растений, выращиваемых в субстратах и различных типах почвы. Ниже вы найдете показатели и рекомендации для каждого типа культивации растений.
| Тип почвы | Рекомендации | Значение рН |
| Субстраты |
| <4,5 слишком низкий 4,6 — 5,3 низкий 5,4 — 6,1 нормальный 6,2 — 6,9 высокий >7,0 очень высокий
|
| Торфяные субстраты и горшечные смеси | Сделайте смесь из 1 части субстрата/горшечной смеси и 2 частей дистиллированной воды. После встряхивания смеси, можно измерить непосредственное значение рН. | <3,9 слишком низкий 4,0 — 4,7 низкий 4,8 — 5,5 достаточно низкий 5,6 — 6,3 нормальный 6,4 — 7,1 достаточно высокий >7,2 высокий |
| Тепличные почвы | Измерить значение рН в тепличной почве очень сложно, потому что точность измерений зависит от содержания каменноугольной извести, содержания органических веществ и способа их образования.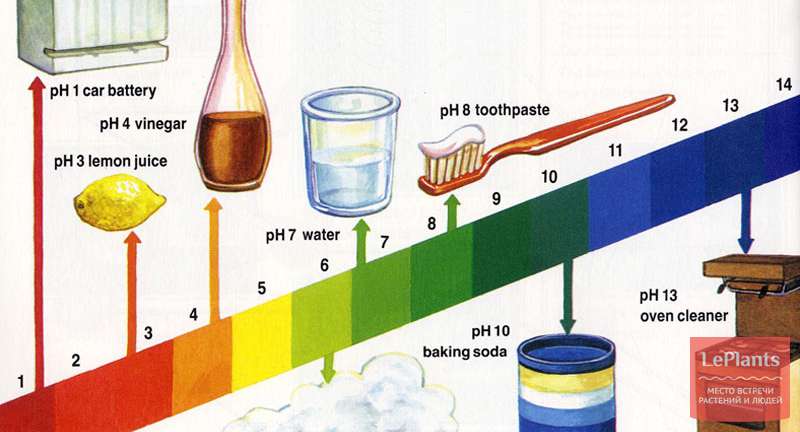 Именно поэтому мы предоставляем рекомендации для некоторых видов почв. Именно поэтому мы предоставляем рекомендации для некоторых видов почв. | A. Песчаный грунт pH 5,0 — 5,4 низкий 5,5 — 5,9 достаточно низкий 6,0 — 6,4 нормальный 6,5 — 6,9 высокий B. Глинистый грунт pH C. Торфяник |
Об авторе: Яапе Люберсене
Яп Люберсен является ведущим специалистом в отделе ухода за растениями компании «Роял Бринкман» и обладает 13-летним опытом работы в сфере тепличного растениеводства. «Как специалист, я ежедневно сталкиваюсь с различными видами проблем. Каждый раз я ищу ответв на на возникшие вопросы, независимо от того, в какой области они возникли: здоровье и рост растений, законодательные вопросы использования удобрений или безопасность их применения.»
Есть вопросы по этой статье?
Пожалуйста, свяжитесь с нашим специалистом по продукции, заполнив форму ниже, и мы ответим в течение 24 часов в рабочие дни.
Статьи, которые могут вас заинтересовать
Что такое pH ? Термин pH обозначает концентрацию кислотных частиц (ионов H +) в растворе или среде. pH является тем фактором, который в значительной степени определяет возможность…Подробнее
Микроэлементы Микроэлементы важны для полноценного развития выращиваемых культур. Существует восемь микроэлементов: молибден, медь, цинк, марганец, бор и железо. Помимо прочего, эти…Подробнее
Отбор проб питательной воды Для того, чтобы график подкормки бы эффективным инструментом, необходимо на регулярной основе отбирать пробы питательной воды/подложки (субстрата) для…Подробнее
Посмотреть другие статьи в этих категориях:
- Общий уход за растениями
Что такое рH воды: все, что нужно знать о кислотно-щелочном равновесии
Из этой статьи вы узнаете:
- Что такое рH воды
- Как рH воды влияет на ее качество
- От чего зависит уровень рH воды
- В каких пределах колеблется норма рH воды
- Какой уровень рH должен быть у питьевой воды
- О чем говорит показатель рH воды в бассейне
- Чем полезна щелочная вода и как приготовить ее самостоятельно
Качество воды в значительной степени зависит от показателя активности ионов водорода.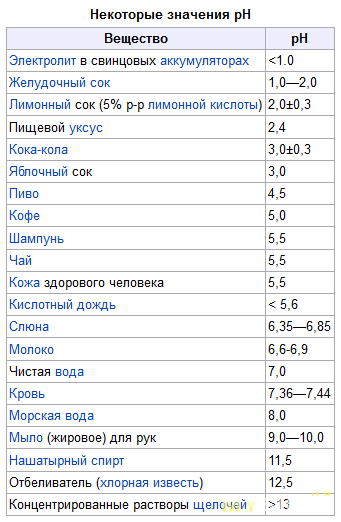 Именно этот критерий влияет на кислотно-щелочное равновесие и обуславливает биохимические реакции, которые вызывает в организме употребленная жидкость. Из этой статьи вы узнаете, что такое pН воды, каково его влияние на качество жидкости, а также о способах его определения и коррекции.
Именно этот критерий влияет на кислотно-щелочное равновесие и обуславливает биохимические реакции, которые вызывает в организме употребленная жидкость. Из этой статьи вы узнаете, что такое pН воды, каково его влияние на качество жидкости, а также о способах его определения и коррекции.
Что такое уровень pН воды
Прежде всего, стоит разобраться, что такое pH воды. Это единица активности ионов водорода, выражающая уровень кислотности жидкости. Показатель pH равен обратному логарифму активности водородных ионов. К примеру, если рН воды равен 6, жидкость содержит 10⁻⁶ моль ионов водорода на один литр. Соответственно, если pH равен 7,5, то в одном литре воды находится 10⁻⁷’⁵ моль ионов водорода.
Уровень кислотности воды измеряют по шкале, диапазон которой варьируется от 0 до 14. При уровне pH меньше 7, жидкость считается кислотной, если выше 7 – щелочной. Поверхностные воды могут иметь pH в районе 6,5–8,5, нормой для подземных вод является 6–8,5.
При температуре +25 °С рН воды равняется 7.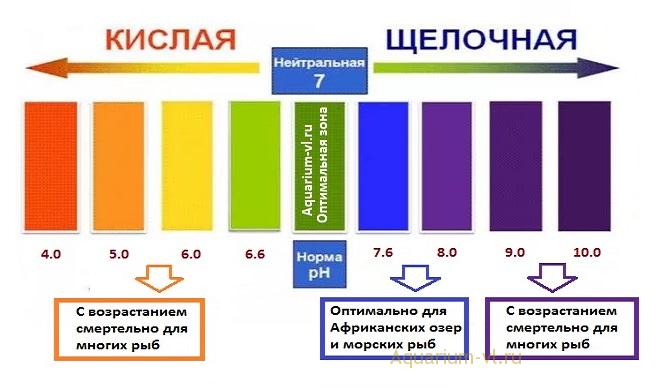 Однако взаимодействие жидкости с содержащимся в атмосфере диоксидом углерода снизит это значение до 5,2. На уровень pH существенное влияние оказывают атмосферный газ и температура, в связи с этим анализ воды должен осуществляться в кратчайшие сроки. Полную оценку ее качества на основании уровня pH дать нельзя, также повышенная или пониженная кислотность не будет служить поводом для ограничения использования и подачи жидкости.
Однако взаимодействие жидкости с содержащимся в атмосфере диоксидом углерода снизит это значение до 5,2. На уровень pH существенное влияние оказывают атмосферный газ и температура, в связи с этим анализ воды должен осуществляться в кратчайшие сроки. Полную оценку ее качества на основании уровня pH дать нельзя, также повышенная или пониженная кислотность не будет служить поводом для ограничения использования и подачи жидкости.
Растворяясь в воде, различные химические элементы изменяют ее состав, за счет чего меняется и показатель уровня кислотности. При добавлении в жидкость кислоты повышается количество содержащихся в ней ионов водорода с одновременным снижением концентрации гидроксид-ионов. Добавление щелочи запускает обратный процесс: происходит увеличение содержания гидроксид-ионов и уменьшение концентрации ионов водорода.
Рекомендуемые статьи по данной теме:
- Как проверить качество воды: самостоятельно и в лаборатории
- Питьевая вода на дом: здоровье прежде всего
- Можно ли пить воду из-под крана, и чего стоит опасаться
Итак, что же такое pН воды? Этот показатель отражает уровень кислотности или щелочности среды, которые свидетельствуют о количественном содержании в жидкости элементов, нейтрализующих щелочь и кислоту соответственно.
Если для сравнения взять температуру жидкости в качестве показателя, мы узнаем лишь уровень нагрева воды, но не количественный показатель тепла. То есть, потрогав воду, мы можем понять, что она является теплой или холодной, однако количество содержащегося в ней тепла нам известно не будет. Мы не сможем определить, сколько времени необходимо для нагрева или остывания жидкости.
Уровень pH относится к одному из основных показателей качества воды. Он свидетельствует о кислотно-щелочном балансе жидкости, определяя протекание в ней тех или иных биологических и химических процессов. Величина кислотно-щелочного баланса воды влияет на уровень коррозийной агрессивности жидкости, уровень токсичности загрязняющих веществ и другие факторы. Кроме того, именно от кислотно-щелочного баланса нашего организма зависит состояние здоровья, настроение и общий тонус тела.
Существует деление воды на группы в соответствии с присущим жидкости уровнем pH:
|
Тип воды
|
Величина pH
|
|
Сильнокислый
|
<3
|
|
Кислый
|
3–5
|
|
Слабокислый
|
5–6,5
|
|
Нейтральный
|
6,5–7,5
|
|
Слабощелочной
|
7,5–8,5
|
|
Щелочной
|
8,5–9,5
|
|
Сильнощелочной
|
>9,5
|
Осуществление контроля за уровнем pН важно на каждом из этапов очистки воды, поскольку смещение кислотно-щелочного равновесия отрицательно сказывается на вкусовых качествах, запахе и оттенке питьевой жидкости, снижая тем самым эффективность ее очистки.
Норма pH воды
Применяемые в России санитарные нормы допускают степень кислотности питьевой воды в пределах 6–9 единиц. Практически аналогичные требования содержатся в ЕС-директиве – 6,5–9,5 и в требованиях Агентства США по охране среды (USEPA) – 6,5–8,5.
В то же время существуют различия в уровне pH питьевой воды, а также жидкостей, предназначенных для удовлетворения потребностей в различных сферах жизни и производства. К примеру:
- Гидропоника предполагает применение растворов, уровень pH которых колеблется от 5,5 до 7,5. При этом указанный диапазон кислотно-щелочного равновесия жидкости делится на более узкие, предназначенные для конкретных видов растений.
- Общественные бассейны допускают использование воды с уровнем pH от 7,2 до 7,4; частные – от 7,2 до 7,6 (DIN 19643-1 – от 6,5 до 7,6).
- Для производства пива требуется вода, уровень pH которой варьируется от 6 до 6,5, безалкогольные напитки изготавливаются на основе жидкости с показателями от 3 до 6.

- При производстве экспортной водки на pH воды влияет степень жесткости используемой технологической жидкости. Уровень рН равняется 7, если жесткость составляет от 0 до 0,6 мг-экв/л и 6,5 – если жесткость колеблется от 0,61–1,2 мг-экв/л.
- На производстве водки, предназначенной для реализации на внутреннем рынке, – кислотно-щелочной баланс воды не превышает 7,8.
- Химическо-волоконное производство допускает уровень pH в границах 7-8.
- Красильно-отделочная отрасль промышленности использует воду с показателем 6,5–8,5.
- Для открытых систем теплоснабжения значение параметра кислотности воды варьируется от 7 до 8,5, для закрытых – от 7 до 11. В обоих случаях рН определяется при температуре 25 °С.
- Энерготехнические и паровые котлы работают с жидкостью, уровень кислотности которой составляет не менее 8,5, оборотные и добавочные воды систем охлаждения имеют pH от 6,5 до 8,5.
- Циркуляционные холодного контура используют воду с кислотностью от 6,5 до 8,2, горячего контура – от 6,80 до 8,00 и т.
 п.
п.
Уровень pH питьевой воды
Подробнее стоит рассказать об уровне рН для питьевой жидкости. По мнению специалистов, необходимо соответствие этого показателя нормальному уровню кислотно-щелочного баланса крови человека, равному 7,5. В связи с этим, нормой pH питьевой воды считается диапазон от 7 до 7,5.
Чистая питьевая вода, обладающая нормальным уровнем кислотности, способствует улучшению обменных процессов в организме человека, увеличивает общую продолжительность жизни и оптимизирует кислородообменные процессы. В свою очередь, сладкие, газированные и содержащие красители напитки снижают уровень pН крови, что приводит к закислению организма.
Многие специалисты рекомендуют приобретать бутилированную воду с хорошим рН, ведь ни одна фильтрационная система не придаст ей свойств, которыми обладает настоящая природная жидкость с оптимальным уровнем кислотности. Со всей информацией об уровне рН и других показателях воды можно ознакомиться на этикетке.
Также можно добиться снижения кислотности и придать воде полезные качества путем добавления в нее лимонного или огуречного сока. Однако это не всегда помогает привести уровень рН к необходимому значению. Самым эффективным способом коррекции pН считается электролиз, в результате которого образуются щелочная и кислая жидкости. Первую (с высоким уровнем pН) считают полезной, она подходит для использования в лечебных целях. Кислая вода называется «мертвой» и более пригодна для умывания.
Однако ежедневно проводить опыты с водой несколько затруднительно. Поэтому лучшим вариантом станет покупка слабо минерализованной природной воды, уровень кислотности которой является оптимальным для здоровья.
Уровень pH дистиллированной воды
Разберемся, что такое дистиллированная вода и какой рН у нее. Эта жидкость получается при дистилляции – процессе, разделяющем жидкие компоненты и смеси друг от друга. В состав дистиллированной воды входят только молекулы кислорода и водорода без каких-либо посторонних примесей. Физико-химические свойства дистиллированной и обычной питьевой воды существенно отличаются за счет высокой степени очистки первой.
Физико-химические свойства дистиллированной и обычной питьевой воды существенно отличаются за счет высокой степени очистки первой.
При значении pH воды, превышающем 7, речь идет о щелочной среде. Если показатель рН не достигает 7 – жидкость считается кислой. Для обычной воды характерна слегка кислая среда, уровень кислотности же дистиллированной равен 5,8.
Повышенная кислотность в этом случае является результатом большого количества растворенного в воде углекислого газа. В процессе растворения в дистиллированной воде СО2 превращается в карбоновую кислоту (2H₂O + CO₂ -> H₂O + H₂CO₃). Для раствора характерно наличие катиона аммония H₃O+ и аниона гидрокарбоната HCO₃-. Процесс насыщения дистиллированной воды углекислым газом, увеличивающим рН жидкости до 7, занимает около 60–120 минут.
Существуют определенные сложности с измерением уровня кислотности такой сверхчистой воды, поскольку ее электропроводность является практически нулевой. А это оказывает существенное влияние на результаты измерений, проводимых при помощи специальных приборов – pH-метров.
Дистиллированную жидкость применяют в следующих целях:
- Непосредственно в качестве питьевой воды – дистиллированная очищена от всех возможных загрязнений, а значит, безопасна для употребления. Из-за отсутствия примесей, жидкость замерзает точно при 0 ° Присущие ей физико-химические свойства сохраняются при заморозке и последующей разморозке.
- Химические опыты. Именно дистиллированная вода используется при работе с реактивами в условиях лабораторий.
- В промышленности и в производстве. Без чистой воды невозможно изготовление прохладительных напитков, а также работа котлов, в которых за счет использования дистиллированной воды не образуется накипь.
- Без дистиллированной воды не обходятся практически никакие медицинские процессы.
Уровень pH воды в бассейне
Если вы посещаете бассейн, важно знать, какой уровень рН у воды, в которой вы купаетесь. Не секрет, что для очистки жидкости используют хлор – сильнейший дезинфицирующий агент, который борется с распространением различных инфекционных заболеваний в общественных бассейнах и аквапарках. Однако вступление хлора в реакцию с содержащейся в воде органикой приводит к образованию побочных продуктов дезинфекции (ППД). Ряд из них представляет опасность для человека, поскольку провоцирует развитие астмы, а также относится к канцерогенам и в целом оказывает раздражающее воздействие на глаза и кожу.
Однако вступление хлора в реакцию с содержащейся в воде органикой приводит к образованию побочных продуктов дезинфекции (ППД). Ряд из них представляет опасность для человека, поскольку провоцирует развитие астмы, а также относится к канцерогенам и в целом оказывает раздражающее воздействие на глаза и кожу.
При низком уровне кислотности для очистки воды требуется меньшее количество хлора, при этом степень дезинфекции будет аналогичной. То есть в этом случае в воде будет содержаться и меньшее количество представляющих опасность для человека ППД.
Таким образом, правильный уровень pH воды в бассейне имеет существенное значение, наравне с наличием хлора. Идеальным уровнем кислотности для бассейна считается 7,2, что соответствует pH слезы человека.
Впрочем, различные исследования говорят, что оптимальный уровень pH воды в бассейне варьируется от 7,5 до 8. При снижении pH на 1–0,5 единицы (до 7–6,5) происходит существенное повышение уровня токсичных ППД, опасных для здоровья.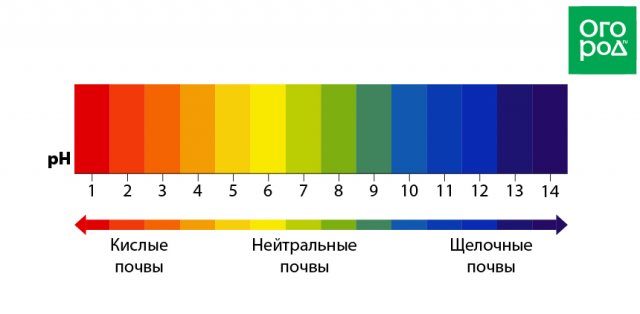
Наибольшую эффективность хлор оказывает при дезинфекции воды с уровнем pH 7,2 (примерно в десять раз выше, чем для воды с кислотностью 8,2).
Как определить pH воды
Уровень pH воды возможно измерить самостоятельно с помощью следующих способов:
Использование лакмусовой бумаги
Для определения уровня кислотности используют лакмусовую (в качестве индикатора) бумажку, меняющую цвет при краткосрочном соприкосновении с изучаемой средой. Вода с повышенной кислотностью окрашивает ее в красный оттенок, с повышенной щелочностью – в синий. Затем необходимо сопоставить полученный тон со специальной цветовой шкалой, которая показывает определенный уровень pH для каждого цвета. Это наиболее простой и дешевый способ определения уровня кислотности воды.
Применение pH-метра
Более точные результаты можно получить при использовании pH-метра для воды. Несмотря на высокую стоимость по сравнению с лакмусовой бумагой, прибор обладает большей эффективностью, поскольку позволяет очень точно определить уровень pН исследуемой жидкости.
Существуют бытовые (портативные) и лабораторные pH-метры для воды. Расскажем несколько подробнее о первых, как наиболее часто используемых. Их можно классифицировать в зависимости от:
- степени защиты от воды;
- наличия (отсутствия) автоматической калибровки;
- точности получаемых результатов.
На последний параметр влияет количество калибруемых точек (1 или 2), под которыми подразумеваются буферные растворы, производящие измерение pH-метра. Лучше всего пользоваться приборами с автоматической калибровкой.
Самодельные тест-полоски
Уровень рН можно установить с помощью специальных тест-полосок, которые отличаются удобством в использовании. Концентрация ионов водорода в воде определяется за счет соответствия цвета полоски и численного значения на специальной шкале. К недостаткам использования данного способа можно отнести высокую стоимость полосок, а также их редкое появление в продаже.
Если вы не готовы к финансовым затратам на приобретение тест-полосок, однако хотите узнать, каков уровень pH употребляемой вами воды, то можно использовать их самодельные аналоги.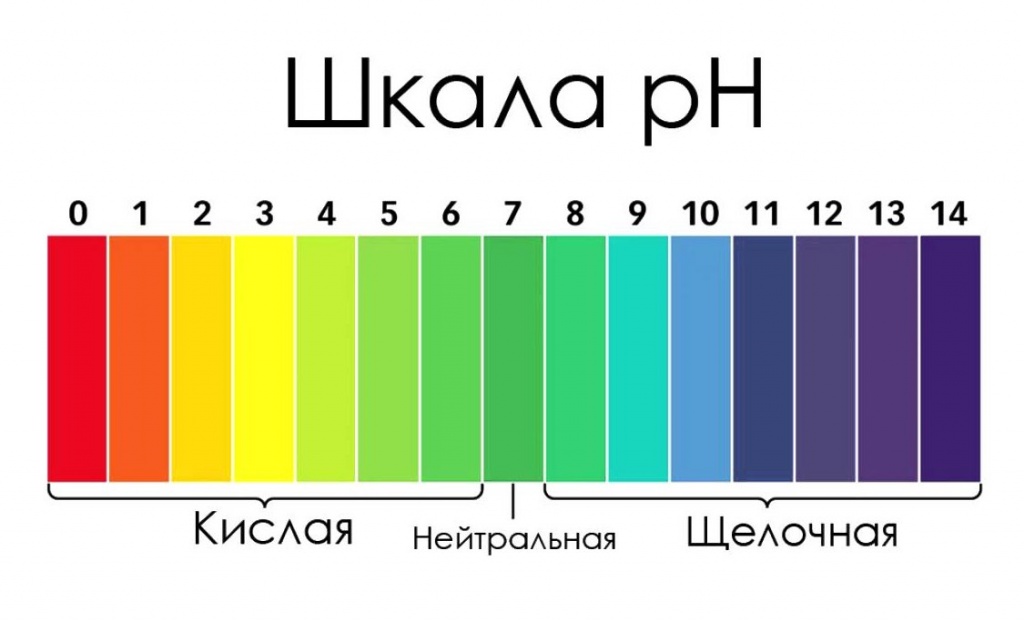
Количество содержащихся в воде ионов водорода оказывает влияние на изменение цвета различных веществ. К примеру, при добавлении в чай ломтика лимона, жидкость вместо коричневой станет желтой.
Аналогичным образом изменяется цвет вишневого, смородинового и других соков в зависимости от концентрации ионов водорода. Природа предлагает большое количество подобных органических индикаторов. Именно они ложатся в основу самодельных тест-полосок, позволяющих ответить на вопрос, что такое pH воды и каков его уровень.
Предлагаем для определения кислотности жидкости воспользоваться веществом, содержащимся в красной цветной капусте. В этом овоще присутствует пигмент антоциан, который относится к флавоноидам. Именно он отвечает за цвет капустного сока и изменяет оттенки в зависимости от уровня кислотности. Кислая среда придает антоциану красный оттенок, щелочная – синий, нейтральная – фиолетовый. Такие же свойства характерны для пигмента, присутствующего в свекле.
Проверить, что такое pH воды и уровень кислотности, можно, мелко нарезав половину кочана красной цветной капусты среднего размера. Нарезанный овощ помещается в емкость и заливается литром воды. Жидкость необходимо вскипятить и варить вместе с капустой около 20–30 минут.
Нарезанный овощ помещается в емкость и заливается литром воды. Жидкость необходимо вскипятить и варить вместе с капустой около 20–30 минут.
Этого времени достаточно для испарения части жидкости. Полученный отвар будет иметь насыщенный фиолетовый оттенок. После того как он остынет, можно готовить основу для тест-полоски.
Лучше всего воспользоваться белой бумагой для принтера, поскольку она не внесет погрешность в цвет исследуемой жидкости. Кроме того, она прекрасно впитает раствор индикатора. Бумагу необходимо нарезать полосками шириной 1 см и длиной 5 см.
Прежде чем воспользоваться тест-полосками для определения уровня pH воды, они должны быть пропитаны отваром индикатора. Охлажденный раствор процеживается через марлю, после чего в него опускаются полоски бумаги. Процедура занимает около 10 минут, при этом важно, чтобы бумага пропиталась отваром равномерно и приобрела бледно-сиреневый оттенок.
Затем полоски необходимо высушить, после чего можно определять уровень pН воды. Неиспользуемые полоски лучше поместить в коробку или в пакетик, чтобы предохранить от воздействия влаги.
Неиспользуемые полоски лучше поместить в коробку или в пакетик, чтобы предохранить от воздействия влаги.
Пользоваться такими самодельными тест-полосками очень просто. Достаточно капнуть одну-две капли исследуемой жидкости на полоску (для этого стоит воспользоваться пипеткой). Наблюдать результат взаимодействия индикатора и бумаги можно через пару минут. Тест-полоски приобретут определенный цвет, зависящий от уровня кислотности воды. Оценить итог можно, сравнив полученный оттенок со шкалой, которая выглядит следующим образом:
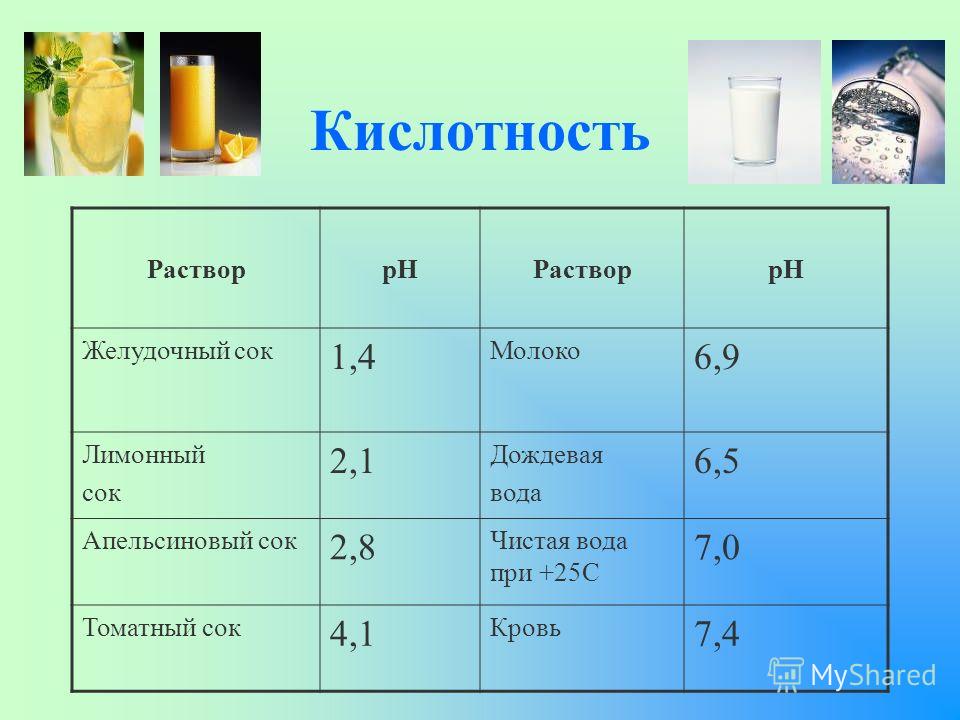
Калибровка шкалы выполняется с помощью веществ, имеющих в первоначальном виде постоянный pH среды. Эти элементы приведены в таблице:
|
Некоторые значения pН
| |
|
Вещество
|
pH
|
|
Лимонный сок (5%-ный р-р лимонной кислоты)
|
2,0±0,3
|
|
Пищевой уксус
|
2,4
|
|
Кока-кола
|
3,0±0,3
|
|
Яблочный сок
|
3,0
|
|
Пиво
|
4,5
|
|
Кофе
|
5,0
|
|
Шампунь
|
5,5
|
|
Чай
|
5,5
|
|
Слюна
|
6,35–6,85
|
|
Молоко
|
6,6–6,9
|
|
Чистая вода
|
7,0
|
|
Морская вода
|
8,0
|
|
Мыло (жировое) для рук
|
9,0–10,0
|
|
Нашатыpный спирт
|
11,5
|
|
Отбеливатель (хлоpная известь)
|
12,5
|
|
Концентрированные растворы щелочей
|
>13
|
Как повысить pH воды
Получить щелочную воду можно, прокипятив жидкость в течение пяти минут. Уровень кислотности питьевой воды варьируется от 7 до 7,2. Охлажденная кипяченая вода имеет более высокий pH – 8,3. За счет кипячения жидкости можно регулировать кислотно-щелочной баланс организма.
Уровень кислотности питьевой воды варьируется от 7 до 7,2. Охлажденная кипяченая вода имеет более высокий pH – 8,3. За счет кипячения жидкости можно регулировать кислотно-щелочной баланс организма.
Разобравшись с тем, что такое pH воды, расскажем и о способах искусственной коррекции кислотно-щелочного равновесия. Для этого подойдут подручные средства, имеющиеся обычно в каждом доме.
Первый способ заключается в добавлении в жидкость нашатырного спирта (одна-две капли на 10 л воды). После этого следует определить получившийся уровень pH, если его значение будет близко к 14, то воду необходимо прокипятить.
Второй способ предполагает растворение в одном литре воды по половине чайной ложки соды и соли (для улучшения вкусовых качеств можно также добавить сахар). Получившийся раствор переливают в бутылку и тщательно взбалтывают.
Третий способ использовался с давних времен, когда щелочность воды повышали при помощи золы. Порошок насыпали в холщовый мешочек, после чего промывали в проточной воде, а затем помещали в емкость с водой, в которой готовили раствор.
Кроме того, щелочную воду получали за счет использования толченой яичной скорлупы, которая тщательно промывалась и измельчалась до состояния пыли. На скорлупе вода настаивалась в течение суток.
Также можно приготовить талую воду. Для этого питьевая жидкость фильтруется, отстаивается в открытой емкости, чтобы испарился хлор, после чего разливается по емкостям, в которых будет заморожена. Затем она помещается в морозилку. После того как 3/4 воды превратится в лед, емкости вынимают из морозилки, сливают незамерзшую жидкость, а полученный лед размораживают. Образовавшаяся в результате талая вода будет щелочной.
Получить щелочную воду можно еще одним способом. Необходимо налить в стеклянную банку пол-литра воды, растворить в ней пол чайной ложки гималайской соли и добавить нарезанную на четыре части половину лимона. Банка закрывается крышкой и настаивается при комнатной температуре в течение 12 часов.
Где купить качественную питьевую воду, уровень pH которой соответствует норме
Проблему грязной воды в доме можно частично решить установкой качественного фильтра, но в таких системах периодически возникает необходимость замены комплектующих, ведь от этого напрямую зависит, насколько хорошо будет очищена жидкость для питья.
В то же время остается нерешенным вопрос: как добиться того, чтобы на нашем рабочем месте или у ребенка в школе была вода наилучшего качества? Лучшее решение – купить ее с доставкой.
Компания «Айсберг» предлагает выгодные условия для обслуживания своих клиентов:
- бесплатная доставка воды на дом или в офис: покупатели оплачивают только стоимость товара;
- скважины, из которых набирается наша вода, имеют документы регистрации в Государственном водном кадастре РФ;
- для добычи и бутилирования воды используются передовые технологии, что помогает сохранять и преумножать ее качество и природную чистоту;
- мы также реализуем современные кулеры для воды и другое оборудование, изготовленное известными европейскими брендами с учетом существующих стандартов качества. Размеры помп и стеллажей для бутылей варьируются, позволяя установить приборы даже в небольших помещениях;
- доставка питьевой воды на дом или в офис осуществляется по минимальной цене, благодаря постоянным акциям от нашей компании;
- вместе с водой вы можете приобрести одноразовую посуду, чай, кофе и прочую вспомогательную продукцию.

Наша компания производит быструю и выгодную доставку питьевой воды по Самаре и Тольятти. Оформить заявку можно как в телефонном режиме, так и через онлайн-форму на сайте фирмы.
Чистая вода – это ценность, но она не должна быть на вес золота. Наша миссия – обеспечить каждый дом и рабочее место качественной питьевой водой, поэтому мы приготовили для наших клиентов самые выгодные условия.
Как рассчитать Ka Из Ph
Обновлено 23 марта 2018 г.
Автор Chris Deziel
Каждая кислота имеет характерную константу диссоциации (K a ), которая является мерой ее способности отдавать ионы водорода в растворе. Другими словами, K a позволяет измерить силу кислоты. Большие значения означают более сильные кислоты. pH (сила водорода) раствора является мерой концентрации ионов водорода, а также мерой кислотности, но это не то же самое, что K и . Однако между ними существует взаимосвязь, и вы можете рассчитать K a для кислоты, если знаете концентрацию кислоты и pH раствора.
Константа диссоциации Ka
Соединение является кислым, если оно может отдавать ионы водорода водному раствору, что эквивалентно тому, что соединение способно образовывать ионы гидроксония (H 3 0 + ). Общее уравнение, описывающее, что происходит с кислотой (ГК) в растворе:
HA + H 2 0 <--> H 3 0 + + A — , где A — — сопряженное основание.
Некоторые кислоты являются сильными и диссоциируют полностью, тогда как другие являются слабыми и диссоциируют лишь частично. Силу кислоты можно измерить ее константой диссоциации K a , которая представляет собой отношение, образованное делением концентрации продуктов на концентрацию реагентов:
K a = [h40+] [A-]/[ ГА]
Все реакции происходят в воде, поэтому ее обычно вычеркивают из уравнения.
Получение Ka из pH
pH водного раствора кислоты является мерой концентрации содержащихся в нем свободных ионов водорода (или гидроксония): pH = -log [H + ] или pH = -log [ H 3 0 + ]. Последнее уравнение можно переписать:
Последнее уравнение можно переписать:
[ H 3 0 + ] = 10 -pH
Если вы знаете молярную концентрацию раствора кислоты и можете измерить его pH, приведенная выше эквивалентность позволяет вам рассчитать отношение концентрации кислоты к сопряженному основанию и получить константу диссоциации K и . Для этого полезно составить таблицу, в которой указаны начальные концентрации реагентов и продуктов I , изменения концентраций C и концентрации в равновесном состоянии E . Это таблица ICE. Вместо того, чтобы устанавливать его в общем виде, более поучительно проиллюстрировать процедуру на конкретном примере.
Константа диссоциации уксусной кислоты
Уксусная кислота, кислота, придающая уксусу его кислый вкус, является слабой кислотой, которая в растворе диссоциирует на ионы ацетата и гидроксония.
CH 3 CO 2 H + H 2 O <-> CH 3 CO 2 — + H 3 O +
Типичный домохозяйство-0,9 М
Типичный домохозяйство. раствор с рН 2,4. Используя данные, можно рассчитать константу диссоциации:
раствор с рН 2,4. Используя данные, можно рассчитать константу диссоциации:
Уксусная кислота (CH 3 CO 2) H) Ионы гидроксония (h4O + ) Ионы ацетата ( CH 3 CO
8 2
)
Исходный 0,9M 0 0
Изменение -x M +x M +x M
Равновесие (0,9 — x) M x M x M
Константа диссоциации K a равна [h4O+] [CH 3 CO 2 — ] / [CH 3 CO 2) H].
K a = x 2 /(0,9 — x)
Как было отмечено выше, [h4O+] = 10 -pH . Поскольку x = [h4O + ] и вы знаете pH раствора, вы можете записать x = 10 -2,4 . Теперь можно найти числовое значение для Ка.
Ка = (10 -2,4 ) 2 / (0,9 — 10 -2,4 ) = 1,8 х 10 -5 .
Общая характеристика кислот и оснований
Обновлено 27 апреля 2018 г.
Автор Chris Deziel
Кислоты и основания представляют собой соединения, имеющие одну важную общую черту: когда вы погружаете их в раствор, они высвобождают свободные ионы. В водном растворе, который является наиболее распространенным, традиционный способ их различения состоит в том, что кислота выделяет положительный водород (H + ), в то время как основание выделяет отрицательные гидроксидные (OH — ) ионы. Химики измеряют силу кислоты или основания по ее рН, что является термином, который относится к «силе водорода». Средняя точка шкалы рН нейтральна. Соединения с рН ниже среднего значения являются кислыми, а соединения с более высоким значением являются основными или щелочными.
В водном растворе, который является наиболее распространенным, традиционный способ их различения состоит в том, что кислота выделяет положительный водород (H + ), в то время как основание выделяет отрицательные гидроксидные (OH — ) ионы. Химики измеряют силу кислоты или основания по ее рН, что является термином, который относится к «силе водорода». Средняя точка шкалы рН нейтральна. Соединения с рН ниже среднего значения являются кислыми, а соединения с более высоким значением являются основными или щелочными.
TL;DR (слишком длинный; не читал)
Кислотный вкус кислый, а щелочной горький. Кислота реагирует с металлами с образованием пузырьков газообразного водорода, в то время как основание кажется слизистым на ощупь. Кислоты окрашивают синюю лакмусовую бумажку в красный цвет, а основания окрашивают красную лакмусовую бумагу в синий цвет.
Развивающиеся определения
Теория кислотного или основного соединения как вещества, высвобождающего ионы водорода или гидроксида соответственно, была введена шведским химиком Сванте Аррениусом в 1884 году.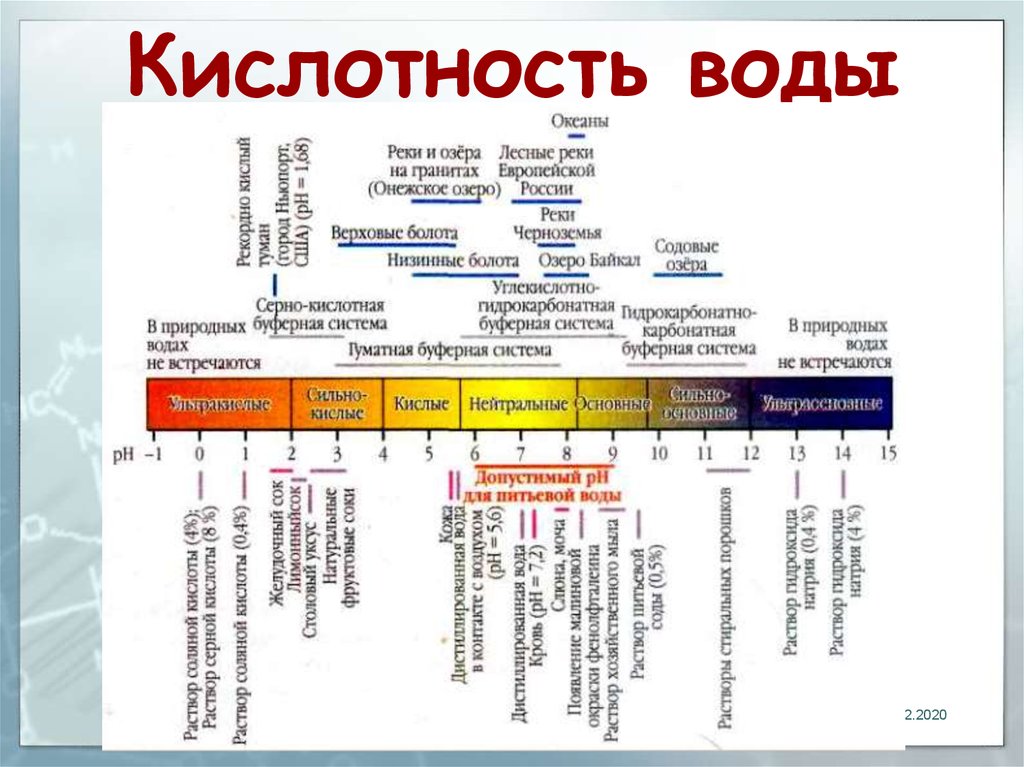 Теория Аррениуса в целом объясняет, как кислоты и основания ведут себя в растворе и почему они соединяются с образованием солей, но это не объясняет, почему некоторые соединения, не содержащие ионов гидроксида, такие как аммиак, могут образовывать основания в растворе.
Теория Аррениуса в целом объясняет, как кислоты и основания ведут себя в растворе и почему они соединяются с образованием солей, но это не объясняет, почему некоторые соединения, не содержащие ионов гидроксида, такие как аммиак, могут образовывать основания в растворе.
Теория Бренстеда-Лоури, введенная в 1923 химиков Йоханнеса Николауса Бронстеда и Томаса Мартина Лоури исправляет это положение, определяя кислоты как доноры протонов, а основания как акцепторы протонов. Это определение, на которое химики чаще всего полагаются при анализе водных растворов.
Третья теория, представленная химиком из Беркли Г.Н. Льюис, также в 1923 году, рассматривает кислоты как акцепторы электронных пар, а основания — как доноры электронных пар. Теория Льюиса имеет то преимущество, что включает соединения, вообще не содержащие водорода, поэтому она удлиняет список кислотно-основных реакций.
Шкала pH
Шкала pH относится к концентрации ионов водорода в растворе на водной основе.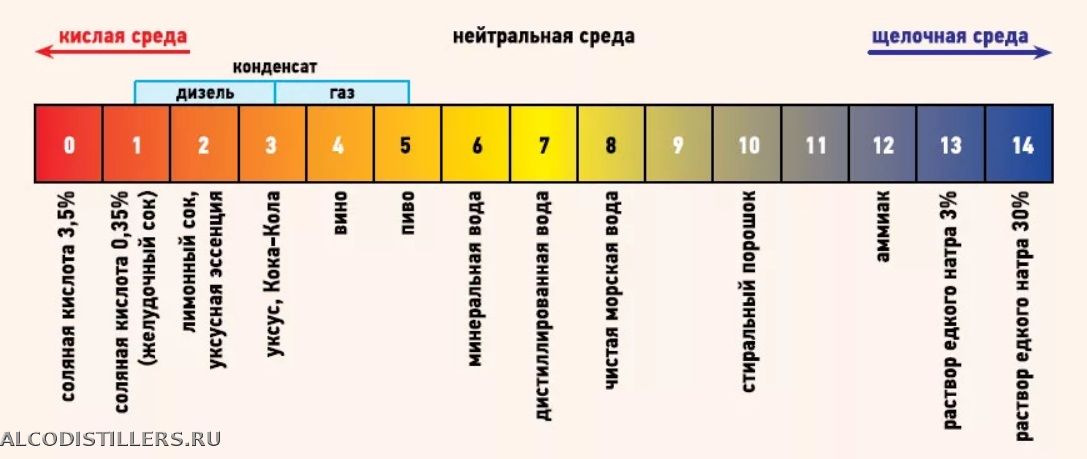 Это отрицательный логарифм концентрации ионов водорода: pH = -log [H+]. Шкала проходит от 0 до 14, а значение 7 является нейтральным. По мере увеличения концентрации ионов водорода pH уменьшается, поэтому значения от 0 до 7 указывают на кислоты, а значения от 7 до 14 — на основные. Очень высокие и очень низкие значения pH указывают на опасно коррозионные растворы.
Это отрицательный логарифм концентрации ионов водорода: pH = -log [H+]. Шкала проходит от 0 до 14, а значение 7 является нейтральным. По мере увеличения концентрации ионов водорода pH уменьшается, поэтому значения от 0 до 7 указывают на кислоты, а значения от 7 до 14 — на основные. Очень высокие и очень низкие значения pH указывают на опасно коррозионные растворы.
Вкус кислот и оснований
Если бы вы сравнили вкус кислого раствора со щелочным, что нецелесообразно, если pH очень высокий или очень низкий, вы бы обнаружили, что кислый раствор на вкус кислый, а щелочной на вкус горький. Кислый вкус цитрусовых обусловлен содержащейся в них лимонной кислотой, уксус кислый, потому что он содержит уксусную кислоту, а кислое молоко содержит много молочной кислоты. Подщелачивающая минеральная вода, напротив, имеет мягкий, но заметно горький вкус.
Основания становятся слизистыми, кислоты выделяют газ
Когда щелочной раствор, такой как аммиак и вода, соединяется с жирными кислотами, получается мыло.


 п.
п.