Содержание
Порядок добавления веществ определил активность кислоты в космических условиях
Последовательность введения
реагентов при смешивании воды и соляной кислоты в имитирующих межзвездные
условиях оказалась ключевым фактором, влияющим на реактивность соединений. При
добавлении воды к соляной кислоте (HCl) ученым удалось зафиксировать образование
ионов гидроксония H3O+, что указывает на диссоциацию кислоты на протон и
отрицательно заряженный ион хлора, в то время как ничего подобного не
происходило при добавлении соляной кислоты к воде. Авторы открытия считают,
что обнаруженный феномен может быть свойственен и другим кислотам, поэтому его
необходимо учитывать при проведении экспериментов и симуляций реакций в условиях космического
пространства, пишут исследователи в журнале Science Advances.
Диссоциация кислот, то
есть распад на ионы при растворении, получающиеся в результате растворенные
протоны и сопутствующие процессы играют ключевую роль во множестве процессов
как живой, так и неживой природы. Эти феномены могут значительно зависеть от
Эти феномены могут значительно зависеть от
температуры среды. Например, реакции на ледяных кристаллах в стратосферных
облаках с участием соляной кислоты при низких температурах протекают иначе, чем
при комнатных условиях.
Большинство исследований
о взаимодействии соляной кислоты и ледяных кристаллов в атмосфере проводилось
при температуре 190 кельвинов, типичной для полярных стратосферных облаков. В
рамках этих работ удалось выяснить, что кислота распадается на ионы. Однако при
более низких температурах данные разнятся: в некоторых исследованиях говорится лишь о 15-процентной ионизации при 60 кельвинах, а в других — о 80 процентах при
20 кельвинах.
Водяной лед распространен
не только на Земле, но и на других телах Солнечной системы, а также и на более
удаленных объектах и между ними. В частности, он есть в плотных межзвездных
облаках пыли, где характерные температуры составляют около 10 кельвин. В
таком контексте встает вопрос о влиянии подобных условий среды на фундаментальные
химические процессы, например, активность кислот и щелочей. Если отсутствие
Если отсутствие
возбуждения из-за связанных с температурой колебаний и наличием интенсивного
потока излучения приводит к возникновению новых феноменов, то это может быть
важно для понимания ранней химической эволюции, протекавшей задолго до
возникновения сложных органических соединений.
В работе под руководством
Мартины Хавенит (Martina Havenith) из Рурского университета в Германии описываются
результаты экспериментов по лабораторному изучению смеси воды и соляной кислоты
в условиях, имитирующих межзвездные пылинки. В рамках экспериментов ученые
исследовали поведение нескольких молекул веществ, заключенных в наноразмерную
каплю сверхтекучего гелия. Процесс реакции в динамике отслеживали при помощи
импульсов инфракрасного лазера.
В рамках первого
эксперимента ученые последовательно добавляли к молекуле соляной кислоты четыре
молекулы воды. В таком случае кислота диссоциировала, и протон соединялся с
водой, образуя гидроксоний. В результате ион хлора, гидроксоний и три молекулы
воды формировали стабильную систему. В других опытах авторы добавляли молекулу
В других опытах авторы добавляли молекулу
соляной кислоты к заранее сформированному кластеру из четырех молекул воды. Это
не приводило к распаду кислоты и возникновению отдельного протона, который
оставался связан с хлором.
«Эти открытия показывают,
что на фундаментальный вопрос о диссоциации кислот и соответствующей возможности
любой химии кислот и оснований в условиях сверхнизких температур нельзя ответить
«да» или «нет», — пишут авторы в выводах работы. — Таким
образом «диссоциация» и «отсутствие диссоциации» являются
сторонами одной медали».
Ученые отдельно отмечают,
что нет оснований полагать, что подобное поведение не будет свойственно другим
кислотам. Наоборот, оно скорее является отличительной чертой химии низких
температур. «Космическая химия отнюдь не проста, она может оказаться даже
сложнее химии в условиях поверхностей планет», — подытоживает соавтор работы
Доминик Маркс.
Недавно ученым удалось найти в космосе молекулу, которая считается первым связанным состоянием атомов во Вселенной. О поисках новых соединений в космосе в составе далеких звезд и экзопланет мы писали в материале «Космическая химия».
О поисках новых соединений в космосе в составе далеких звезд и экзопланет мы писали в материале «Космическая химия».
Тимур Кешелава
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Гиалуроновая кислота
Ни для кого уже не секрет, что основным компонентом человеческого организма является вода, в которой растворены различные водорастворимые вещества. По сути, наш с Вами организм состоит из водных коллоидных растворов.
Исследования ученых около 50 лет назад заставили косметологов и дерматологов по-новому взглянуть на роль жидкости в организме, и на ее влияние на внешний вид кожи человека. И, прежде всего, на состояние кожи лица: на молодость, упругость, прочность и устойчивость кожи лица к жизненным нагрузкам и стрессам.
Именно поэтому, когда разговор заходит о состоянии кожи лица, в последние годы так много и часто говорят огиалуроновой кислоте для лица.
Уникальность гиалуроновой кислоты:
- Гиалуроновая кислота – это один из важнейших представителей гликозаминогликанов.
 Гиалуроновая кислота представляет собой важный структурный элемент кожи. Считается, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды.
Гиалуроновая кислота представляет собой важный структурный элемент кожи. Считается, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды. - Гиалуроновая кислота, являясь составной частью гликозаминогликанов, располагается в соединительной ткани дермы между волокнами коллагена и эластина, а также в клетках рогового слоя и корнеоцитах.
- Гиалуроновая кислота обладает уникальной способностью связывать воду. При образовании гелей гиалуроновая кислота связывает 10000-кратный объем воды. Ее молекулы образуют в воде нечто подобие сетки (матрицы), что определяет уникальные свойства гиалуроновой кислоты.
- Гиалуроновая кислота – это, прежде всего, геле- и пленкообразователь с противовоспалительным действием.
- Гиалуроновая кислота – это молекулярная природная «губка» с суперувлажняющим действием.
- Гиалуроновая кислота способна удерживать большой объем воды.

- Гиалуроновая кислота является трансдермальной системой доставки многих других активных компонентов, необходимых для здоровья кожи лица.
- Гиалуроновая кислота предотвращает разрушение коллагена, этого уникального защитного барьера.
- Гиалуроновая кислота для лица ускоряет регенерацию кожи и играет важную роль в гидродинамике тканей.
Действие:
- Гиалуроновая кислота способствует регенерации тканей без образования шрамов, делает кожу более мягкой и гладкой.
- Обладая великолепной водосвязывающей способностью, снижает потери воды и обеспечивает не только поверхностное, но и глубокое увлажнение кожи. Защищает и придает гладкость коже. Создает условия для лучшего восприятия кожей других активных компонентов. Гиалуроновая кислота – один из главных антивозрастных компонентов в косметике.
Бывает 2-х типов: высокомолекулярная гиалуроновая кислота увлажняет верхние слои кожи, разглаживая мелкие морщинки, а низкомолекулярная, проникая вглубь, притягивает к себе молекулы воды, удерживает влагу и «выталкивает» морщины изнутри.
Сфера применения:
Гиалуроновая кислота применяется для введения в кожу и подкожные слои с помощью различных способов:
- Инъекционных.
- Безинъекционных.
Инъекционные процедуры с гиалуроновой кислотой применяются в таких методиках, как:
- Биоревитализация и мезотерапия лица — введение препарата в средние слои кожи; применяется при возрастных изменениях, сухости кожного покрова и для повышения его эластичности, тонуса и цвета, устранения угревой сыпи, растяжек и т. д.; длительность сохранения гиалуроновой кислоты в дерме — до 14 суток;
- контурная пластика — заполнение веществом подкожных структур с целью разглаживания морщин и коррекции контуров лица; препарат сохраняется под кожей в течение 1—2 недель;
- биорепарация и редермализация — введение модифицированной гиалуроновой кислоты, которая сохраняется в коже до 3 недель.

Безинъекционные методы заключаются в нанесении геля с кислотой на кожу и введения ее в более глубокие слои при помощи приборов с гальваническим током, пульсирующим кислородным потоком, также излучающих лазерный луч, микротоки, ультразвуковые волны. Эффект от этих методов наступает почти сразу и сохраняется в течение 5-20 дней.
Нельзя обойти стороной востребованную на сегодняшний день методику микронидлинга (мезотерапия мезороллером). В качестве препаратов для проведения микронидинга используются как чистая гиалуроновая кислота различной концентрации, так и мезококтейли.
Кислоты, основания и наука о воде Урок
При растворении в воде кислоты выделяют иона водорода (H+) . Ионы водорода — это атомы водорода, которые потеряли электрон и теперь имеют только протон, что придает им положительный электрический заряд. С другой стороны, основания, смешанные с водой, дают ионов гидроксида (ОН-) . Если раствор имеет высокую концентрацию ионов Н+, то он кислый. Если раствор имеет высокую концентрацию ионов ОН-, то он является основным.
Если раствор имеет высокую концентрацию ионов ОН-, то он является основным.
Во многих кислотно-основных реакции , в результате получается вода и соль. Если соединить соляную кислоту (HCL) и щелочной гидроксид натрия (NaOH), продуктом будет H 2 O (вода) и NaCl (хлорид натрия, поваренная соль). Ионы H+ в кислоте соединяются с ионами OH- основания и нейтрализуются ими с образованием H 2 O.
Одно из простейших действий, позволяющее показать, как кислоты и основания реагируют друг с другом (и продемонстрировать их различные свойства) состоит в том, чтобы сделать пищевую соду и уксус «вулкан» . Чтобы вызвать сильное извержение, используйте маленькую пластиковую бутылку (размером 20 унций безалкогольных напитков будет хорошо работать). Наполните бутылку наполовину (от 1 до 1,5 стакана) уксусом. Чтобы вызвать извержение, бросьте в бутылку «бомбу» из пищевой соды — заверните одну столовую ложку пищевой соды в небольшой кусочек папиросной бумаги, завязав концы ниткой. Вы должны увидеть мгновенное извержение! Пищевая сода, основа, нейтрализует кислоту в уксусе. Это высвобождает углекислый газ, который вызывает шипение в вашем вулкане. (Кислый раствор нейтрализуется добавлением к нему основания, а щелочной раствор нейтрализуется добавлением кислоты.)
Вы должны увидеть мгновенное извержение! Пищевая сода, основа, нейтрализует кислоту в уксусе. Это высвобождает углекислый газ, который вызывает шипение в вашем вулкане. (Кислый раствор нейтрализуется добавлением к нему основания, а щелочной раствор нейтрализуется добавлением кислоты.)
Для другого реакционного эксперимента поместите таблетку Alka-Seltzer на дно канистры из прозрачной пластиковой пленки (такой, в которой крышка входит внутрь, а не закрывается снаружи). Заполните канистру теплой водой, а затем быстро наденьте крышку и наблюдайте за кислотно-щелочной реакцией!
Шкала pH используется для измерения количества ионов H+ в растворе. Кислоты имеют рН ниже 7; основания имеют рН выше . Сильные кислоты имеют самый низкий уровень pH (0-4), а сильные основания имеют самый высокий уровень pH (10-14). Нейтральные растворы имеют pH 7 и не являются ни кислотными, ни щелочными. Дистиллированная вода нейтральна, так как ионы Н+ и ОН- уравновешены.
Лакмус – это природный кислотно-щелочной индикатор, извлекаемый из лишайника. Если у вас есть красная и синяя лакмусовая бумажка, вы можете проверить разные растворы на кислотность или щелочность. Синяя лакмусовая бумажка становится красной , когда раствор кислый; красная лакмусовая бумажка превращает в синюю в основных растворах. Попробуйте протестировать средство для мытья окон, средство для чистки унитаза, апельсиновый и яблочный сок — налейте немного каждого в отдельные пробирки, маленькие стаканы или баночки. С помощью лакмусовой бумажки определите, какие вещества являются кислотами, а какие основаниями. Вот уровни pH некоторых других веществ, которые вы можете проверить: лимонный сок (2), уксус (3), молоко (6), яичные белки (8), пищевая сода (9).) и аммиак (10). Человеческая кровь имеет идеальный рН 7,4; даже небольшие колебания могут серьезно повлиять на наш организм.
Вы также можете сделать свой собственный индикатор pH — с помощью блендера смешайте одну часть нарезанной краснокочанной капусты с двумя частями кипятка и используйте сок для тестирования различных растворов. Кислоты окрашивают пигменты индикатора в красноватый цвет; основы сделают пигменты голубоватыми или желто-зелеными.
Кислоты окрашивают пигменты индикатора в красноватый цвет; основы сделают пигменты голубоватыми или желто-зелеными.
Урок естествознания: хорошая вода
Иногда вода может показаться простой и скучной, но у нее есть интересные физические свойства! Вода весит около 62 фунтов на кубический фут при температуре замерзания; замерзает при 0°С и кипит при 100°; и он составляет около 60% состава нашего тела и 83% нашей крови! Что касается того, что она может сделать, вода называется «9».0003 универсальный растворитель ‘, потому что он может растворить больше веществ, чем любая другая жидкость, даже самая сильная кислота.
Химический состав воды H 2 O — два атома водорода и один кислород. То, как эти атомы соединяются вместе, образуя молекулу воды, определяет особые свойства воды. Два атома H образуют слабые водородные связи с кислородом; они прикрепляются к вершине молекулы, как уши Микки Мауса.
Эта молекулярная структура дает молекуле воды полярность или несимметричный электрический заряд, притягивающий другие атомы. Конец молекулы с двумя атомами Н заряжен положительно. Другой конец, с кислородом, заряжен отрицательно. Как и в магните, где северные полюса притягиваются к южным (противоположности притягиваются), положительный конец молекулы воды соединится с отрицательным концом других молекул.
Конец молекулы с двумя атомами Н заряжен положительно. Другой конец, с кислородом, заряжен отрицательно. Как и в магните, где северные полюса притягиваются к южным (противоположности притягиваются), положительный конец молекулы воды соединится с отрицательным концом других молекул.
Вода — единственное природное вещество, которое может существовать во всех трех агрегатных состояниях — твердом, жидком и газообразном — при обычных для Земли температурах. Многие другие вещества должны быть перегреты или охлаждены, чтобы изменить состояние. Твердое состояние воды (то есть лед) менее плотно, чем жидкое состояние, поэтому лед плавает.
Вещества Polar легко растворяются в воде, «универсальном растворителе». Это связано с тем, что один конец полярной молекулы заряжен более положительно, а другой — более отрицательно. Положительно заряженный конец полярной молекулы будет притягиваться к отрицательно заряженному концу молекулы воды, и наоборот. Точно так же положительные ионы притягиваются к отрицательному концу молекулы воды и наоборот. Это молекулярное притяжение позволяет столь многим веществам легко растворяться в воде — молекулы окружены молекулами воды. Масло и прочее 9Неполярные растворы 0003 не имеют положительно или отрицательно заряженных концов, поэтому молекулы воды будут притягиваться друг к другу, а не к маслу. Вот почему масло не смешивается с водой.
Точно так же положительные ионы притягиваются к отрицательному концу молекулы воды и наоборот. Это молекулярное притяжение позволяет столь многим веществам легко растворяться в воде — молекулы окружены молекулами воды. Масло и прочее 9Неполярные растворы 0003 не имеют положительно или отрицательно заряженных концов, поэтому молекулы воды будут притягиваться друг к другу, а не к маслу. Вот почему масло не смешивается с водой.
Известный ученый: сэр Хамфри Дэви (1778-1829)
Дэви родился в графстве Корнуолл, Англия, 17 декабря 1778 года. Там он получил образование, став учеником хирурга-аптекаря, когда умер его отец. . Через несколько лет он переехал в Бристоль и стал заведующим лечебным учреждением. В 22 года он написал Researches, Chemical and Philosophical о своей работе по изучению воздействия закиси азота (позже известной как веселящий газ). Он экспериментировал с газом, даже сам его вдыхал — одна из предполагаемых причин болезни, от которой он страдал в конце жизни.
Следующей его работой была электрохимия. Его использование электролиза (пропускание электрического тока через вещество для его разделения на части) привело его к правильному предположению, что элементы в соединении удерживаются вместе электрическими силами.
Дэви выделил элементы натрий, магний, калий, кальций, бор (вместе с Гей-Люссаком) и барий. Он также определил, что хлор является элементом, а не соединением кислорода, и дал ему название (от греческого слова «желто-зеленый»). Он экспериментировал с йодом, доказал, что алмазы образуются из углерода, и справедливо предположил, что кислоты содержат водород. В целом Дэви выделил больше элементов, чем любой другой химик до 20 -го века.
Хотя Дэви был известен своими работами в области химии, он был более известен своим изобретением безопасной шахтерской лампы. Газообразный метан в угольных шахтах взрывался при контакте с пламенем свечей, которые шахтеры использовали для освещения, что приводило к гибели и повреждениям. Дэви попросили найти решение. Он придумал конструкцию лампы, в которой пламя окружалось тонкой проволочной сеткой. Некоторый свет все еще мог излучаться, но пламя, вызванное только взрывами в камере, где газ попадал в лампу; марля не позволяла теплу пламени распространяться на внешние газы. Метод Дэви был использован в более поздних усовершенствованиях шахтного освещения.
Дэви попросили найти решение. Он придумал конструкцию лампы, в которой пламя окружалось тонкой проволочной сеткой. Некоторый свет все еще мог излучаться, но пламя, вызванное только взрывами в камере, где газ попадал в лампу; марля не позволяла теплу пламени распространяться на внешние газы. Метод Дэви был использован в более поздних усовершенствованиях шахтного освещения.
За свою жизнь Дэви был удостоен множества наград. Он был избран членом Королевского общества в 1803 году; два года спустя он получил свою престижную медаль Копли; а в 1820 году он был избран его президентом. Кроме того, он получил награду от Наполеона Бонапарта, на которого произвели впечатление его работы в области электрохимии. Он был посвящен в рыцари в 1812 году при принце-регенте (когда Георг III страдал от приступов безумия) и получил титул баронета.
СИЛЬНЫЕ И СЛАБЫЕ КИСЛОТЫ На этой странице объясняются термины «сильный» и «слабый» применительно к кислотам. Важно не путать слова сильный и слабый с терминами концентрированный и разбавленный . Как вы увидите ниже, сила кислоты зависит от ее доли, прореагировавшей с водой с образованием ионов. Концентрация говорит вам о том, сколько исходной кислоты растворено в растворе. Вполне возможно иметь концентрированный раствор слабой кислоты или разбавленный раствор сильной кислоты. Читать дальше . . . Сильные кислоты Объяснение термина «сильная кислота» Мы собираемся использовать определение кислоты Бренстеда-Лоури. | ||||||||||||||||||||||||||
Примечание: Если вы не знаете, что такое теория кислот Бренстеда-Лоури, вам следует прочитать о теориях кислот и оснований на другой странице этого раздела. Вам не нужно тратить время на чтение о кислотах и основаниях Льюиса для целей данной страницы. Используйте кнопку НАЗАД в браузере, когда будете готовы вернуться на эту страницу. | ||||||||||||||||||||||||||
Когда кислота растворяется в воде, протон (ион водорода) переносится на молекулу воды с образованием иона гидроксония и отрицательного иона в зависимости от исходной кислоты. В общем случае . . . Все эти реакции обратимы, но в некоторых случаях кислота настолько хорошо отдает ионы водорода, что мы можем считать эту реакцию односторонней. Кислота практически на 100% ионизирована. Например, когда хлороводород растворяется в воде с образованием соляной кислоты, происходит так мало обратной реакции, что мы можем написать: В любой момент времени практически 100% хлористого водорода прореагирует с образованием ионов гидроксония и ионов хлора. Хлористый водород описывается как сильная кислота. Сильная кислота – это кислота, которая практически на 100% ионизирована в растворе. Другие распространенные сильные кислоты включают серную кислоту и азотную кислоту. Уравнение ионизации можно найти в упрощенной форме: Это показывает, что хлористый водород, растворенный в воде, расщепляется с образованием ионов водорода в растворе и ионов хлора в растворе. Эта версия часто используется в этой работе только для того, чтобы все выглядело проще. Если вы используете его, помните, что на самом деле речь идет о воде, и что когда вы пишете H + (водн.) , на самом деле вы имеете в виду ион гидроксония, H 3 О + . | ||||||||||||||||||||||||||
Примечание: Вы должны выяснить, что предпочитают ваши экзаменаторы. Вы вряд ли найдете это в своей программе, но вам следует просмотреть последние экзаменационные работы и схемы оценок. Если вы сдаете экзамен в Великобритании и у вас нет копий учебного плана и прошлых работ, вы должны их иметь! Перейдите по этой ссылке, чтобы узнать, как их получить. | ||||||||||||||||||||||||||
Сильные кислоты и pH рН является мерой концентрации ионов водорода в растворе. Сильные кислоты, такие как соляная кислота, в концентрациях, которые вы обычно используете в лаборатории, имеют pH от 0 до 1. Чем ниже pH, тем выше концентрация ионов водорода в растворе. Определение pH | ||||||||||||||||||||||||||
Примечание: Если вас попросят определить pH на экзамене, просто запишите выражение черным цветом. Никогда не пытайтесь определить его словами — это пустая трата времени, и вы можете что-то упустить (например, упомянуть, что концентрация должна быть в моль дм -3 ). В приведенном выше выражении квадратные скобки подразумевают это, поэтому вам не нужно упоминать об этом. | ||||||||||||||||||||||||||
Определение рН сильной кислоты Допустим, вам нужно было определить рН 0,1 моль дм -3 соляной кислоты. С сильными кислотами это сделать легко. Соляная кислота — сильная кислота, практически на 100 % ионизированная. Каждый моль HCl реагирует с водой, давая 1 моль ионов водорода и 1 моль ионов хлора Значит, если концентрация кислоты 0,1 моль дм -3 , то концентрация ионов водорода также 0,1 моль дм -3 . Используйте свой калькулятор, чтобы преобразовать это в pH. Мой калькулятор хочет, чтобы я ввел 0,1, а затем нажал кнопку «журнал». Ваш может захотеть, чтобы вы сделали это в другом порядке. Вы должны узнать! log 10 [0,1] = -1 Но рН = — log 10 [0,1] — (-1) = 1 pH этой кислоты равен 1. | ||||||||||||||||||||||||||
Примечание: Если вам нужно больше примеров, чтобы посмотреть и попробовать себя (с полными готовыми решениями), вас может заинтересовать моя книга расчетов по химии. | ||||||||||||||||||||||||||
Слабые кислоты Объяснение термина «слабая кислота» Слабая кислота — это кислота, которая не полностью ионизируется при растворении в воде. Этановая кислота является типичной слабой кислотой. Он реагирует с водой с образованием ионов гидроксония и ионов этаноата, но обратная реакция протекает более успешно, чем прямая. Ионы очень легко реагируют на преобразование кислоты и воды. В любой момент только около 1% молекул этановой кислоты превратились в ионы. Остальные остаются в виде простых молекул этановой кислоты. Большинство органических кислот являются слабыми. Фторид водорода (растворяющийся в воде с образованием плавиковой кислоты) — это слабая неорганическая кислота, которую вы можете встретить где угодно. | ||||||||||||||||||||||||||
Примечание: Если вы заинтересованы в дальнейшем изучении органических кислот, вы найдете их объяснение в другом месте на сайте. Если вы хотите узнать, почему фтористый водород является слабой кислотой, вы можете узнать, перейдя по этой ссылке. Эти страницы находятся в совершенно разных частях этого сайта. Если вы перейдете по любой из ссылок, используйте кнопку НАЗАД, чтобы вернуться на текущую страницу. | ||||||||||||||||||||||||||
Сравнение сил слабых кислот Положение равновесия реакции между кислотой и водой варьируется от одной слабой кислоты к другой. Чем левее она лежит, тем слабее кислота. | ||||||||||||||||||||||||||
Примечание: Если вы не понимаете положение равновесия, перейдите по этой ссылке, прежде чем двигаться дальше. Вам также необходимо знать о константах равновесия, K c для гомогенных равновесий. Нет смысла читать дальше эту страницу, если вы этого не сделаете! Если вы перейдете по любой из ссылок, используйте кнопку НАЗАД, чтобы вернуться на текущую страницу. | ||||||||||||||||||||||||||
Константа диссоциации кислоты, К a Вы можете получить меру положения равновесия, записав константу равновесия для реакции. Чем ниже значение константы, тем больше положение равновесия смещено влево. Примером гомогенной реакции является диссоциация (ионизация) кислоты. Все присутствует в одной фазе — в данном случае в растворе в воде. Таким образом, вы можете написать простое выражение для константы равновесия K с . Вот снова равновесие: Вы могли бы ожидать, что константа равновесия будет записана как: Однако, если хорошенько подумать, в этом есть что-то странное. В конце выражения у вас есть термин для концентрации воды в растворе. Это не проблема, за исключением того, что число будет очень большим по сравнению со всеми остальными числами. В 1 дм 3 раствора будет около 55 молей воды. | ||||||||||||||||||||||||||
Примечание: 1 моль воды весит 18 г. 1 дм 3 раствора содержит примерно 1000 г воды. Разделите 1000 на 18, чтобы получить примерно 55. | ||||||||||||||||||||||||||
Если бы у вас была слабая кислота с концентрацией около 1 моль дм -3 , и только около 1% ее прореагировало с водой, то число молей воды уменьшится только примерно на 0,01. Другими словами, если кислота слабая, концентрация воды практически постоянна. В этом случае нет особого смысла включать его в выражение, как если бы это была переменная. Вместо этого определяется новая константа равновесия, которая не учитывается. Эта новая константа равновесия называется K a . Вы можете найти выражение K a , записанное по-другому, если вы будете работать с упрощенной версией равновесной реакции: Это может быть написано с символами состояния или без них. На самом деле это то же самое, что и предыдущее выражение для K a ! Помните, что хотя мы часто пишем H + для ионов водорода в растворе, на самом деле мы говорим о ионах гидроксония. Эта вторая версия выражения K a не так точна, как первая, но ваши экзаменаторы вполне могут с ней согласиться. Выяснить! Чтобы взять конкретный общий пример, равновесие для диссоциации этановой кислоты правильно записывается как: Выражение K a : Если вы используете более простую версию равновесия. . . . . . выражение K a : | ||||||||||||||||||||||||||
Примечание: Поскольку вы, вероятно, столкнетесь с обеими этими версиями в зависимости от того, где вы прочитали о K a , было бы разумно привыкнуть к любой из них. Однако для целей экзамена используйте то, что, по-видимому, предпочитают ваши экзаменаторы. | ||||||||||||||||||||||||||
В таблице приведены некоторые значения K a для некоторых простых кислот:
Это все слабые кислоты, потому что значения K a очень малы. Они перечислены в порядке убывания силы кислоты — значения K и становятся меньше по мере продвижения вниз по таблице. Однако, если вы не очень довольны числами, это не сразу очевидно. Поскольку числа состоят из двух частей, слишком многое нужно быстро обдумать! Чтобы избежать этого, числа часто переводятся в новую, более простую форму, называемую pK 9. Знакомство с ПК a pK a имеет такое же отношение к K a , как pH относится к концентрации ионов водорода: Если вы используете свой калькулятор для всех значений K a в таблице выше и конвертируете их в значения pK a , вы получите:
| ||||||||||||||||||||||||||
Примечание: Обратите внимание, что в отличие от K a , pK a не имеет единиц измерения. | ||||||||||||||||||||||||||
Обратите внимание, что чем слабее кислота, тем больше значение pK a . Теперь легко увидеть тенденцию к более слабым кислотам по мере продвижения вниз по таблице. Запомни это:
| ||||||||||||||||||||||||||
Примечание: Если вам нужно знать о K a и pK a , вам, скорее всего, потребуется уметь выполнять с ними вычисления. Возможно, вам понадобится вычислить рН слабой кислоты по ее концентрации и K по или pK по . Возможно, вам придется обратить это и рассчитать значение pK a на основе pH и концентрации. | ||||||||||||||||||||||||||

 Гиалуроновая кислота представляет собой важный структурный элемент кожи. Считается, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды.
Гиалуроновая кислота представляет собой важный структурный элемент кожи. Считается, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды.
 Как часть этого, он определяет и объясняет, что подразумевается под pH, K a и pK a .
Как часть этого, он определяет и объясняет, что подразумевается под pH, K a и pK a .

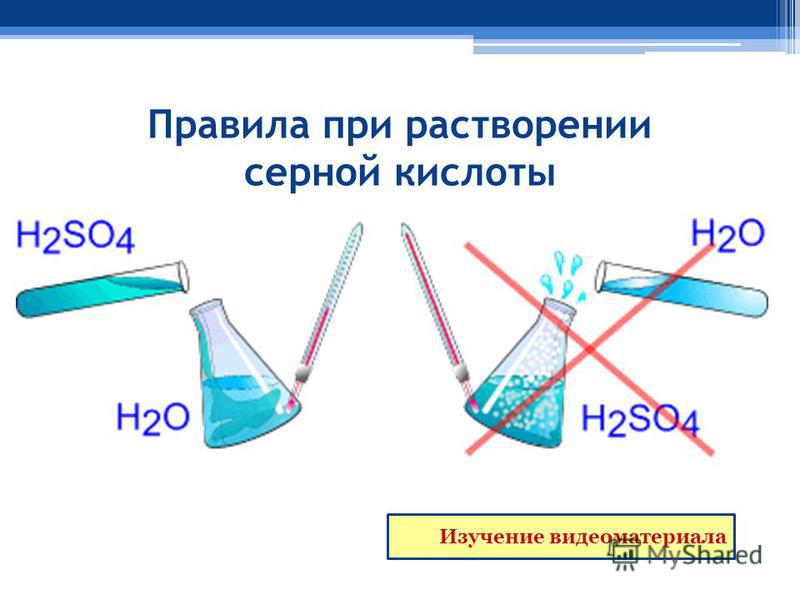
 Все, что вам нужно сделать, это определить концентрацию ионов водорода в растворе, а затем использовать калькулятор, чтобы преобразовать ее в pH.
Все, что вам нужно сделать, это определить концентрацию ионов водорода в растворе, а затем использовать калькулятор, чтобы преобразовать ее в pH. Это также включает в себя немного более запутанную проблему преобразования pH обратно в концентрацию ионов водорода.
Это также включает в себя немного более запутанную проблему преобразования pH обратно в концентрацию ионов водорода. Тем не менее, было бы неплохо сначала прочитать остальную часть этой страницы.
Тем не менее, было бы неплохо сначала прочитать остальную часть этой страницы.



 0011 и .
0011 и . 9 x 10 -8
9 x 10 -8 