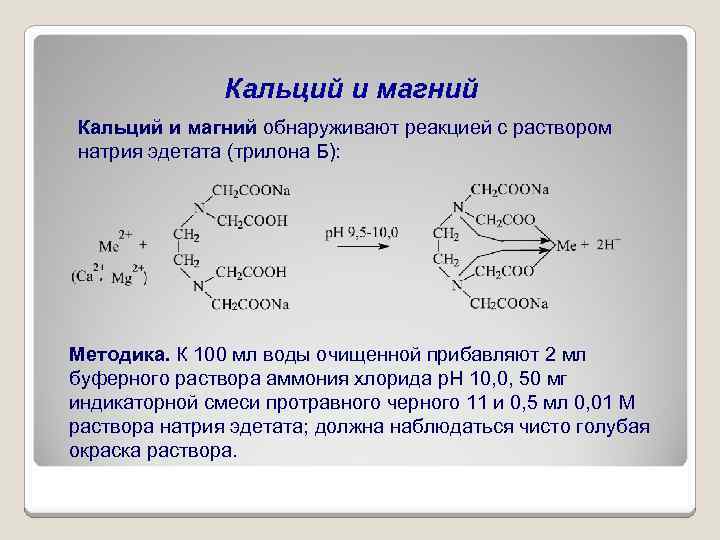
Содержание
Свойства кальция | Задачи 337
Задание 337
Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция: а) с V2O5; б) СаSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
Благодаря большому отрицательному значению G0298(СаО) = -604,2 кДж/моль возможно, что кальций способен вытеснять некоторые металлы из их оксидов. Этот метод позволяет применять кальций для получения металлов из их оксидов при действии высокой температуры.
Уравнения реакций кальция:
а) Са + V2O5 = СаО + V
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
5Ca0 + 2V+5 = 5Ca2+ + 2V0
Молекулярное уравнение:
5Са + V2O5 = 5СаО + 2V
б) Ca + СаSO4 = CaO + CaS
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
4Ca0 + S+6 = 4Ca2+ + S2-
Молекулярное уравнение:
4Са + CaSO4 = 4СаО + CaS
Задание 338
Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Решение:
СаО – оксид кальция называют «негашеная известь». Са(ОН)2 – гидроксид кальция называют «гашённая известь».
а) Оксид кальция получают при термическом разложении известняка СаСО3:
СаСО3(К) СаО(К) + СО2(г)
Этот процесс протекает при температуре 1000 0С (промышленный метод получения СаО).
б) При спекании известняка и графита получают оксид кальция:
С(графит) + СаСО3(К) = СаО(к) + СО(г)
Гашённую известь получают при действии воды на оксид кальция:
СаО + Н2О = Са(ОН)2
При прокаливании негашеной извести с углём образуется карбид кальция:
СаО + 3С СаС2 + СО
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
2Ca0 + С0 = 2Ca2+ + С4-
Таким образом, углерод является и окислителем, и восстановителем в данной реакции. Эта реакция является реакцией самоокисления-самовосстановления (реакцией диспропорционирования, дисмутации), потому что протекает с одновременным уменьшением и увеличением степени окисления одного и того же элемента (С – уголь).
Эта реакция является реакцией самоокисления-самовосстановления (реакцией диспропорционирования, дисмутации), потому что протекает с одновременным уменьшением и увеличением степени окисления одного и того же элемента (С – уголь).
Задание 339
Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Решение:
а) Са + Н2О = Са(ОН)2 +Н2↑
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
Ca0 + 2Н2О = Ca2+ + 2ОН– + Н20↑
б) 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
4Mg0 + N+5 = 4Mg2+ + N-3
Гидроксид кальция – формула, количество вещества и молярная масса
4. 23 атомов или молекул этого вещества.
23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.
Рис. 2. Гидроксид кальция.
Химические свойства гидроксида кальция
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Ca(OH)2 (гидроксид кальция)+H2SO4 (серная кислота)=CaSo4 (соль – сульфат кальция)+2H2 O (вода).
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
Ca(OH)2+CO2 (гидроксид кальция)=CaCO3 (карбонат кальция)+H2 O (вода)
При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Ca(OH)2 (гидроксид кальция)+CO (оксид углерода)=CaCO3 (карбонат кальция)+H2 (водород).
Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
Сa(OH)2 (гидроксид кальция)+Na2 SO3 (сульфит натрия)=CaSO3 (сульфит кальция)+2NaOH (гидроксид натрия).
При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:
Рис. 3. Гашеная известь.
Ca(OH)2 (гидроксид кальция)=CaO (оксид кальция)+H2 O (вода).
Получение гидроксида кальция происходит при химической реакции оксида кальция (негашеной извести) с водой. Этот процесс получил название «гашение извести». Уравнение реакции гашения извести выглядит следующим образом:
CaO (оксид кальция)+H2 O (вода)=Ca(OH)2 (гидроксид кальция).
Что мы узнали?
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
Гидроксид кальция используют в строительстве и промышленности.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 95.
А какая ваша оценка?
Q12 Напишите сбалансированные молекулярные уравнения для словесных уравнений 1 Кальций Кислород Оксид кальция 2 Кал…
Перейти к
- Упражнение
- Вопросы объективного типа
- Иметь значение
- Физические и химические изменения
- Элементы, соединения и смеси
- Атомная структура
- Язык химии
- Химические реакции
- Водород
- Вода
- Углерод и его соединения
Главная >
Союзные решения
Класс 8
Химия
>
Глава 5 — Язык химии
>
Упражнение
>
Вопрос 12
Вопрос 12 Упражнение
Q12) Напишите сбалансированные молекулярные уравнения для словесных уравнений:
Кальций + кислород → оксид кальция
Кальций + вода → гидроксид кальция + водород
Цинк + серная кислота → сульфат цинка + водород
Сульфат свинца + Гидроксид аммония → Сульфат аммония + Гидроксид свинца
Гидроксид меди + Азотная кислота → Нитрат меди + Вода
Нитрат свинца + хлорид натрия → Нитрат натрия + хлорид свинца
Ответ:
Решение:
(а) 2Ca+\ O_2\ →\ 2CaO
(б) Ca+2H_2O\ →\ Ca\левый(ОН\правый)_2+H_2
(в) Zn+H_2SO_4 \ →\ ZnSO_4+H_2
(г) PbSO_4+2NH_4OH\ →\ Pb\левый(ОН\правый)_2+\левый(NH_4\правый)_2SO_4
(д) Cu\левый(ОН\правый)_2+2HNO_3 →\ Cu\левый[NO_3\правый]_2+2H_2O
(е) Pb\левый[NO_3\правый]_2+2NaCl\ →\ 2NaNO_3+PbCl_2
youtube.com/embed/jfhaDIkSAhU?rel=0″ frameborder=»0″ allow=»autoplay; fullscreen» loading=»lazy» allowfullscreen=»»>
Стенограмма видео
«Здравствуйте, добро пожаловать на обучение. Мы собираемся решить, как сбалансировать уравнение монстра. Давайте посмотрим, либо сбалансируем молекулярное уравнение для словесных уравнений, использующих кальций плюс кислород. Вы, оксид кальция, в больнице собирались посмотри сейчас. Кальций. CA плюс кислород O2 вы нарезаете инструмент кальций справа. CA о создании побочных квестов перенаправляются на буквы. И rhs Пастор, когда мы закончим с этим, проверьте, жара Осень здесь. Мы получили, можно оценить на записи один атом кальция в его жидком кислороде, атомы кислорода здесь попали в кислород, был одним из десяти, когда я умножаю на два года, вы можете проверить, отправляйтесь в тюрьму и поместите кальций, а также вы можете оставаться здесь, чтобы мы могли сигнализировать об условиях для Галатам 2 кислород для окисления
И это равно правому балансу, тогда работайте над вторым. Calcium CA также позволяет поливать его. Используют нах, чтобы гидроксид кальция СА o h взял дважды плюс водород h3. Проверьте часы здесь. Я получил один кальций один кальций сбалансированный. Два водорода и для поддержки водорода здесь, чтобы прийти сюда и отсюда, чтобы сказать нам, когда я умножил на 2 здесь, и вы можете видеть, что увеличение кислорода на 0,042 для более безопасного для кислорода кальция сбалансировало водородный баланс и кислородный баланс. Ну, это равно rhs, когда я держу два года. Это был сбалансированный компьютер, один цинк плюс альфа-кепка, это, думаю, определенный процент от commbuys h3so4.
Calcium CA также позволяет поливать его. Используют нах, чтобы гидроксид кальция СА o h взял дважды плюс водород h3. Проверьте часы здесь. Я получил один кальций один кальций сбалансированный. Два водорода и для поддержки водорода здесь, чтобы прийти сюда и отсюда, чтобы сказать нам, когда я умножил на 2 здесь, и вы можете видеть, что увеличение кислорода на 0,042 для более безопасного для кислорода кальция сбалансировало водородный баланс и кислородный баланс. Ну, это равно rhs, когда я держу два года. Это был сбалансированный компьютер, один цинк плюс альфа-кепка, это, думаю, определенный процент от commbuys h3so4.
Тот же размер, что и сульфат цинка с сульфатом хондроитина, — это день, так что 4 сульфат — это так 4. Поместите водород H, чтобы сообщить им, что у нас есть хлопок с цинковым кольцом, и мы всего лишь квартал One Wing для авторов 2002 года, а не один раз и платите 100. NS равен ро по умолчанию сам. Итак, первая вторая, и мы закончили, мы собираемся изучить четвертую. Сегодня сам 84 мы делаем, мы должны знать, что исполнитель тепла один.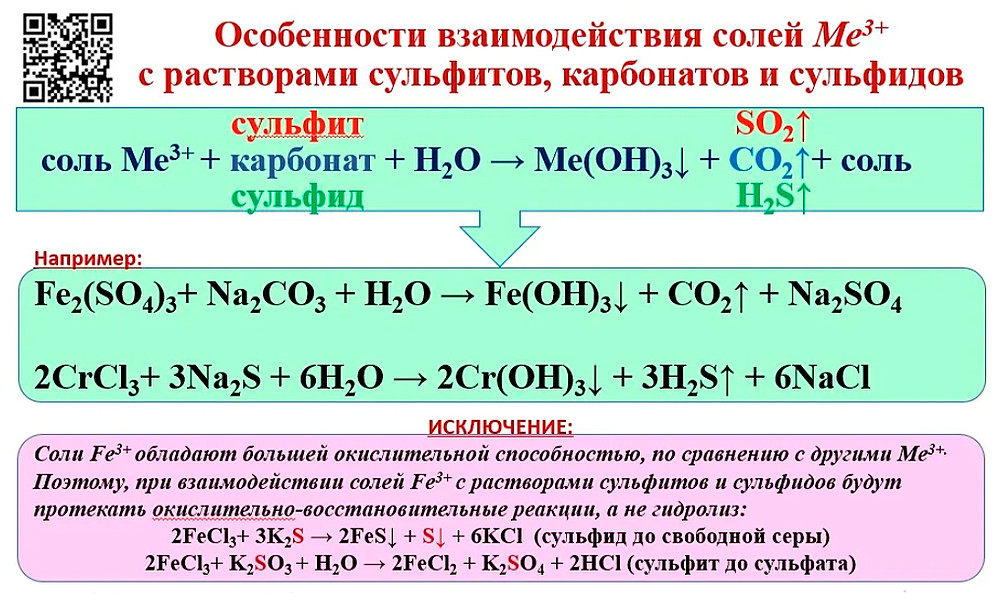 Это сама молекула. Это значит, что когда ТВ так за место. Гидроксид аммония компания аминов и чистой для водорода урологии просто ждать использования гидроксида аудио сульфат аммония аммиака то же самое, что аммиак означает и как для ОК. Что касается so4 Players, пусть гидроксид из 70 будет взят дважды, чтобы он обогатился на рекордной ноге. Можем ли мы поставить баланс одной ногой тогда? Мы пойдем сразу и встретимся здесь. Вы должны сконцентрировать баланс преступника здесь. У нас есть один общий здесь. Нас учат молекулам аммиака. Итак, чтобы увеличить еще один здесь. Итак, когда я увеличил молекулы аммиака до молекул аммиака, мы получили гидроксиды гидропса, и он также попал в топ-сайты.
Это сама молекула. Это значит, что когда ТВ так за место. Гидроксид аммония компания аминов и чистой для водорода урологии просто ждать использования гидроксида аудио сульфат аммония аммиака то же самое, что аммиак означает и как для ОК. Что касается so4 Players, пусть гидроксид из 70 будет взят дважды, чтобы он обогатился на рекордной ноге. Можем ли мы поставить баланс одной ногой тогда? Мы пойдем сразу и встретимся здесь. Вы должны сконцентрировать баланс преступника здесь. У нас есть один общий здесь. Нас учат молекулам аммиака. Итак, чтобы увеличить еще один здесь. Итак, когда я увеличил молекулы аммиака до молекул аммиака, мы получили гидроксиды гидропса, и он также попал в топ-сайты.
Итак, помощник по управлению дачами. С Фотоном покончено? Итак, я думаю, это то, что мы движемся, чтобы удержать человека, которому вы должны следовать, чтобы сбалансировать химическое уравнение в первую очередь. Мы должны мы должны я беспокоиться о калориях Чанг. Что это за форма молекулы условий или это молекула из гидроксида аммония Лос-Анджелеса, это вы все должны знать, тогда вы можете сделать это легко. Просто примите заезд или поворот, и тогда вы сможете легко следовать за ним. Я надеюсь, что вы понимаете это видео. Спасибо за просмотр этого видео.
Просто примите заезд или поворот, и тогда вы сможете легко следовать за ним. Я надеюсь, что вы понимаете это видео. Спасибо за просмотр этого видео.
Связанные вопросы
Q1) Объясните термин «символ». Объясните, почему символ кальция — «Ca», а меди — «Cu».
Q2) Дайте определение термину «валентность». Что касается воды и аммиака как соединений соответственно, укажите…
Q3) Объясните термин «переменная валентность». Медь, имеющая электронную конфигурацию [[2,8,18,1]], проявляет…
Q4) Укажите валентность следующих металлических элементов: (a) калий (b) натрий (c) кальций (d) M…
Q4) Некоторые металлы обладают переменной валентностью, включая валентность: 1+, 2+, 3+ и 4+. Укажите В…
Укажите В…
Q6) Укажите, какие из приведенных ниже ионов или радикалов неметаллических элементов проявляют ценность…
Фейсбук
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнения
Вопросы объективного типа
Главы
Материя
Физические и химические изменения
Элементы, соединения и смеси
Атомная структура
Язык химии
Химические реакции
Водород
Вода
Углерод и его соединения
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
РЕАКЦИИ ЭЛЕМЕНТОВ 2 ГРУППЫ С ВОДОЙ На этой странице рассматриваются реакции элементов 2-й группы — бериллия, магния, кальция, стронция и бария — с водой (или паром). Факты Бериллий Бериллий вступает в реакцию с паром при высоких температурах (обычно около 700°C или выше) с образованием белого оксида бериллия и водорода. (Уравнение точно такое же, как для магния ниже.) | |
Примечание: До ноября 2016 года на этот момент у меня было утверждение: «Бериллий не вступает в реакцию с водой или паром даже при красном калении». Это часто цитировалось в учебниках, и моими источниками были книги по неорганическим наукам на уровне степени, а позже книги по неорганическим наукам на уровне А. Тем не менее, исследователь в области развития ядерного синтеза указал мне, что проводится много работы над реакцией между бериллием и паром, потому что это может быть проблемой безопасности в конструкции реактора, и прислал мне фотографию, показывающую результат подвергание бериллия воздействию пара при 800°C. Я думаю, проблема в том, что бериллий дорог и опасен для здоровья. Это означает, что немногие учителя когда-либо справились с этим — я, конечно, не справился. Это означает, что заявления об этом в учебниках (или в наши дни в Интернете) никогда не проверяются и просто передаются независимо от их точности. Я извиняюсь за свою роль в этом. | |
Магний Магний сгорает в паре с образованием белого оксида магния и газообразного водорода.
Очень чистая лента из магниевого сплава слабо реагирует с холодной водой. Через несколько минут на его поверхности образуются пузырьки водорода, а виток магниевой ленты обычно всплывает на поверхность. Однако реакция вскоре останавливается, так как образующийся гидроксид магния почти нерастворим в воде и образует барьер для магния, препятствующий дальнейшей реакции.
| |
Примечание: Как правило, если металл реагирует с холодной водой, образуется гидроксид металла. Если он реагирует с паром, образуется оксид металла. Это связано с тем, что гидроксиды металлов термически разлагаются (расщепляются при нагревании) с образованием оксида и воды. | |
Кальций, стронций и барий Все они реагируют с холодной водой с возрастающей энергией с образованием гидроксида металла и водорода. Стронций и барий имеют реакционную способность, подобную литию в группе 1 периодической таблицы. Кальций, например, довольно энергично реагирует с холодной водой в экзотермической реакции. Выделяются пузырьки газообразного водорода и образуется белый осадок (гидроксида кальция) вместе со щелочным раствором (также гидроксида кальция — гидроксид кальция мало растворим). Уравнение реакции любого из этих металлов будет таким: X(s) + 2H 2 O(l) X(OH) 2 (водный или s) + H 2 (g) Гидроксиды плохо растворимы, но они становятся более растворимыми по мере продвижения вниз по Группе. Образовавшийся гидроксид кальция проявляется в основном в виде белого осадка (хотя некоторые растворяются). Вы получаете меньше осадка по мере продвижения вниз по группе, потому что больше гидроксида растворяется в воде. Сводка тренда реактивности Металлы группы 2 становятся более реактивными по отношению к воде по мере продвижения вниз по группе. Объяснение тренда реактивности Бериллий в особом случае Существует дополнительная причина недостаточной реакционной способности бериллия по сравнению с остальной группой. Бериллий имеет прочный стойкий слой оксида на своей поверхности, который снижает его реакционную способность при обычных температурах. Изменение энтальпии реакций Изменение энтальпии реакции является мерой количества тепла, поглощаемого или выделяемого при протекании реакции. Изменение энтальпии отрицательно, если тепло выделяется, и положительно, если оно поглощается. Это действительно все, что вам нужно знать об этом разделе! | |
Примечание: Если вас не устраивают изменения энтальпии, вы можете изучить раздел энергетики Chemguide или мою книгу по химическим расчетам. | |
Если вы рассчитаете изменение энтальпии возможных реакций между бериллием или магнием и паром, вы получите следующие ответы: Be(т) + H 2 O(г) BeO(т) + H 2 (г) ΔH = -369 кДж моль -1 Mg(s) + H 2 O(g) MgO(s) + H 2 (g) ΔH = -360 кДж моль -1 Обратите внимание, что обе возможные реакции сильно экзотермичны и выделяют почти одинаковое количество тепла. Точно так же, если вы рассчитаете изменения энтальпии для реакций между кальцием, стронцием или барием и холодной водой, вы снова обнаружите, что количество выделяемого тепла в каждом случае почти одинаково — в этом случае около -430 кДж моль -1 . Причина повышения реактивности должна опять быть в другом. Энергии активации реакций Энергия активации реакции – это минимальное количество энергии, необходимое для протекания реакции. Неважно, насколько экзотермической будет реакция, когда она начнется, — если существует высокий энергетический барьер активации, реакция будет происходить очень медленно, если вообще будет происходить. Когда металлы группы 2 реагируют с образованием оксидов или гидроксидов, образуются ионы металлов. | |
Примечание: Это упрощение в случае бериллия. | |
Образование ионов из исходного металла включает несколько стадий, каждая из которых требует затрат энергии, что способствует увеличению энергии активации реакции. Эти этапы предполагают ввод:
После этого будет ряд стадий, которые снова выделяют тепло, что приводит к образованию продуктов и общим экзотермическим реакциям. На графике показано влияние этих важных стадий поглощения энергии по мере того, как вы спускаетесь в группу 2. Обратите внимание, что здесь доминируют энергии ионизации, особенно энергии второй ионизации. Энергии ионизации падают, когда вы спускаетесь по Группе. Поскольку становится легче образовывать ионы, реакции будут происходить быстрее. | |
Примечание: Если вас не устраивают изменения энергии ионизации при переходе в группу 2, перейдите по этой ссылке. Вы найдете дополнительную ссылку на более широкое обсуждение энергии ионизации, если вам это нужно. | |
Обобщая причину увеличения реактивности по мере снижения Группа Реакции становятся легче, поскольку энергия, необходимая для образования положительных ионов, падает. Это в основном связано с уменьшением энергии ионизации по мере продвижения вниз по Группе. Это приводит к более низким энергиям активации и, следовательно, более быстрым реакциям. | |

 Он использует эти реакции для изучения тенденции реактивности в группе 2.
Он использует эти реакции для изучения тенденции реактивности в группе 2. Однозначно реагирует.
Однозначно реагирует.

.jpg) Однако оксидный слой разрушается при температуре выше 750 °C и обнажает поверхность металлического бериллия под ним, и поэтому защита не работает.
Однако оксидный слой разрушается при температуре выше 750 °C и обнажает поверхность металлического бериллия под ним, и поэтому защита не работает. Однако реакция магния протекает гораздо быстрее. Объяснение различной реактивности должно лежать где-то еще.
Однако реакция магния протекает гораздо быстрее. Объяснение различной реактивности должно лежать где-то еще. Оксид бериллия не является полностью ионным. Между бериллием и кислородом недостаточно разницы в электроотрицательности, чтобы бериллий потерял контроль над связывающей парой электронов и образовал ионы. Подход, который мы используем здесь, соответствует типу ответа, который вы должны были бы дать на уровне A. Думать о бериллии как о совершенно другом случае сделало бы этот аргумент излишне сложным.
Оксид бериллия не является полностью ионным. Между бериллием и кислородом недостаточно разницы в электроотрицательности, чтобы бериллий потерял контроль над связывающей парой электронов и образовал ионы. Подход, который мы используем здесь, соответствует типу ответа, который вы должны были бы дать на уровне A. Думать о бериллии как о совершенно другом случае сделало бы этот аргумент излишне сложным.