Содержание
Вода содержит кальций — норма и как определить
Кальций — щелочноземельный металл. Это один из самых распространенных химических элементов (3-е место среди металлов, 5-е место среди всех элементов), на долю минерала приходиться 3,38 % веса земной коры. Из-за высокой химической активности кальций в чистом виде не встречается, его соединения присутствуют в 385 природных минералах.
Итак, в воде есть кальций — что же делать?!
Источники кальция в воде
Кальций в воде встречается в виде солей сильных и слабых кислот: карбонатов и гидрокарбонатов (CaCO3), сульфатов и сульфитов (CaSO4, CaSO3) фторидов (CaF2), фосфатов (Ca5(PO4)3), а также других солей. Основные источники кальция в воде:
- Горные породы, через которые проходит поток воды.

- Выбросы от промышленных предприятий.
- Удобрения отраслей сельского хозяйства, попадающие в воду напрямую или через слой почвы.
Соединения кальция присутствуют в большинстве горных пород и биогенных отложений. Металл также содержится во всех растительных и животных тканях. Его соединения — основа костного скелета, раковин и панцирей беспозвоночных. Давайте разберемся, как определить кальций в воде, и каким должно быть его содержание?
Содержание ионов кальция в воде
В растворенном виде соединения кальция содержатся в морской воде и воде из подземных источников и открытых водоемов. Наибольшее количество кальция присутствует воде из горных рек и источников, артезианских скважин. На высокое содержание кальция в водопроводной воде или воде из скважины указывает:
- Белый нерастворимый осадок, появляющийся после кипячения воды, содержащей кальций.
- Накипь на стенках чайника, резервуара посудомоечной машины, другой кухонной техники.

- Белый налет на кранах и насадках для душа.
- Ухудшение вкуса напитков и приготовленных блюд.
- Потеря цвета ткани после стирки.
- Увеличение расхода мыла и моющих средств.
Как определить количество кальция в воде
Наиболее точный метод определения количества кальция в воде — лабораторный анализ. Такие услуги предоставляют специализированные организации, компании, поставляющие фильтры для воды. Для приблизительной оценки концентрации ионов кальция в воде применяют специальные тестовые полоски, меняющие цвет в зависимости от доли кальция в воде. Также эффективным методом определения кальция в воде является метод титрования. Узнать сколько кальция в воде можно и путем наблюдений, которые мы указали выше.
Нормы по содержанию кальция в воде
Жесткость воды определяется содержанием в ней ионов кальция и магния. Это одна из самых важных характеристик. Различают временную и постоянную жесткость. Первая определяется долей гидрокарбонатов кальция. При нагреве и кипячении эти соединения разлагаются с выделением углекислого газа и нерастворимого осадка. Временная жесткость имеет второе название — гидрокарбонатная жесткость.
При нагреве и кипячении эти соединения разлагаются с выделением углекислого газа и нерастворимого осадка. Временная жесткость имеет второе название — гидрокарбонатная жесткость.
Постоянная жесткость зависит от содержания сульфатов, хлоридов магния и кальция. Эти соли не разлагаются при кипячении. Такая жесткость называется некарбонатной.
По катионному составу различают кальциевую и магниевую жесткость. Вода из источников, залегающих в известняковых породах, имеет высокое содержание ионов кальция. Вода из районов с залежами доломита имеет преимущественно магниевую жесткость.
Международная единица измерения жесткости — моль/м3. В технических и лабораторных измерениях используется миллиграмм-эквивалент на литр (мг-экв/л). Например, вода жесткостью 1 мг-экв/л содержит 20,04 кальция или 12,16 магния. Согласно ГОСТ на кальций в воде 31865-2012, действующему в РФ, жесткость измеряется в градусах. 1 Ж = 1 мг-экв/л.
Нормы для кальция в питьевой воде можно рассчитать с помощью специальных методик определения ионов кальция в воде.
Санитарные нормы для централизованного водоснабжения СанПиН 2.1.4.1074-01 определяют нормативы и предельно допустимую концентрацию солей жесткости. Согласно требованиям норма кальция в воде — 7 мг-экв./л, предельное содержание — до 10 мг-экв./л. Однако, по нормам ВОЗ оптимальная концентрация кальция в воде примерно 1,5-2,5Ж.
Но для чего определяют кальций в воде, и как он влияет на наш организм?
Влияние кальция на организм
Кальций — один из самых необходимых для жизни элементов. Его соединения оставляют основу опорно-двигательной системы, зубной ткани. Ионы кальция участвуют в передаче нервных импульсов, синтезе гормонов и ферментов, поддержании щелочно-кислотного баланса в организме.
От 10 до 20% кальция мы получаем из питьевой воды. Недостаток также как и переизбыток этого элемента приводит к ухудшению здоровья, а именно:
- К ухудшению состояния костной системы. Кости становятся хрупкими, появляется специфическое заболевание остеопороз.
- К медленному росту ногтей и волос, ухудшению их состояния.
 Недостаток кальция приводит к расслоению ногтей, ломкости и истончению волосяного покрова головы.
Недостаток кальция приводит к расслоению ногтей, ломкости и истончению волосяного покрова головы. - К ухудшению общего состояния. Хроническая усталость, повышенная раздражительность также могут быть симптомами дефицита кальция.
В отдельных случаях возникают судороги, проблемы с сердечно-сосудистой системой, желудочно-кишечным трактом. При значительном избытке возникают нарушения сердечного ритма и работы центральной нервной системы. Избыток соединений кальция также является причиной ряда расстройств и заболеваний. Если в воде много кальция возникает:
- Почечно-каменная болезнь.
- Ускоренное развитие атеросклероза.
- Отложение солей в суставах.
- Превышение концентрации ионов кальция негативно влияет на бытовую технику и сантехнику:
- Трубы зарастают слоем отложений.
- На нагревательных элементах и стенках водонагревателей, котлов, откладываются нерастворимые соли.
Превышения кальция в водопроводной воде или воде из скважины приводит к увеличению расхода электроэнергии, снижению срока службы систем и техники. При избыточном содержании кальция и натрия в воде рекомендуются устанавливать ионообменные фильтры. Это поможет избежать проблем со здоровьем и продлит срок службы домашней техники и бытовых систем.
При избыточном содержании кальция и натрия в воде рекомендуются устанавливать ионообменные фильтры. Это поможет избежать проблем со здоровьем и продлит срок службы домашней техники и бытовых систем.
Необходимость дополнительной очистки воды от солей жесткости возникает при содержании солей Мg или Ca от 10 мг-экв./л. Для этого применяют ионообменные фильтры умягчения и установки обратного осмоса.
Определить необходимость установки фильтра для удаления кальция можно после анализа вода и определения химического состава примесей.
Кальций в воде — методы исследования и воздействие на человека
В разделе: Вода
15.01.2019
Бузин Игорь
Кандидат биологических наук
Химическое обозначение: Ca
Синонимы: известь, мягкий камень.
Описание: элемент 2 группы 4 периода с атомным номером 20. Мягкий металл серебристого цвета с высокой химической активностью.
Мягкий металл серебристого цвета с высокой химической активностью.
Методы определения: потенциометрия, титрование, масс-спектрометрия, атомная абсорбция и эмиссия.
Методики, используемые в Испытательном центре МГУ для определения концентрации кальция в природных средах
|
Нормативный документ на методику |
Метод определения |
Оборудование |
|---|---|---|
|
Вода | ||
|
ЦВ 3.18.05-2005 (ФР.1.31.2005.01714) |
масс-спектрометрия |
AGILENT 7500A ICP-MS |
|
Почва | ||
|
ФР.1.31.2009.06787 |
масс-спектрометрия |
AGILENT 7500A ICP-MS |
|
ЦВ 5.  18.19.01-2005 18.19.01-2005
|
масс-спектрометрия |
AGILENT 7500A ICP-MS |
Контроль измерений проводят на оборудовании: AGILENT 5110 ICP-OES, ANALYTIK JENA CONTRAA 300 и BRUKER S2 PICOFOX.
Распространённость: кальций в свободном виде не встречается в природе, однако распространён в составе соединений: 3,4% массы земной коры приходится на этот элемент. Кальций занимает четвёртое место по количеству образуемых минералов. Существенную часть последних составляют силикаты, алюмосиликаты, граниты, гнейсы, полевые шпаты, кальциты, ангидриты, гипсы, флюориты, апатиты и доломиты. Содержание кальция в воде обуславливает жёсткость воды.
Нормирование
В воде систем централизованного водоснабжения содержание кальция не нормируется напрямую: в водопроводной воде нормируется параметр жёсткости. Кальций, наряду с магнием и стронцием, вносит вклад в показатель жёсткости: если предположить, что вся жёсткость водопроводной воды будет обусловлена только кальцием, максимально допустимая его концентрация будет составлять 140,28 мг/л.
Предельно допустимая концентрация (ПДК) кальция в различных водных объектах
|
Нормирование |
ПДК, мг/л |
|---|---|
|
Бутилированная вода первой категории СанПиН 2.1.4.1116-02 |
0–130 |
|
Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 |
25–80 |
|
Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 |
— |
|
Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 |
0–180 |
|
Объекты рекреационного водопользования СанПиН 2.1.5.980-00 |
— |
|
Вода плавательных бассейнов СанПиН 2.  1.2.1188-03 1.2.1188-03
|
— |
|
Сточные воды в бытовых системах водоотведения Постановление Правительства РФ № 644 |
— |
|
Сточные воды в ливневых системах водоотведения Постановление Правительства РФ № 644 |
— |
Польза и вред
В потреблении воды с повышенным содержанием кальция нуждаются грудные дети (норма потребления 1,0–1,2 г в сутки) и беременные женщины (0,4–0,7 г в сутки).
Кальций участвует в:
- сокращении мышечных тканей;
- регулировании способности мембран клеток пропускать вещества и элементы;
- изменении концентрации липидов в кровяной сыворотке;
- передаче нервных импульсов;
- выделении гормонов гипофизом и надпочечниками;
- клеточном иммунитете;
- усвоении микроэлементов;
- ферментативной активности печени.

При недостатке элемента наблюдаются:
- неконтролируемые сокращения тканей мышц;
- судорожные фибрилляции сердечной мышцы;
- нарушение свёртываемости крови;
- нарушение нормального образования и формирования костей.
При избытке кальция наблюдается:
Методы очистки воды
Ионный обмен. В результате использования ион-обменных смол в воде происходит замена ионов кальция на ионы натрия.
Обратный осмос. Вместе с другими веществами обратный осмос убирает из воды кальций. Нецелесообразно использовать обратный осмос только для умягчения и при жёсткости воды более 7 мг-экв/л без предварительного умягчения.
Кипячение. Во время кипячения воды соли жёсткости, в состав которых входит кальций, осаждаются на стенках сосуда, поэтому вода становится немного мягче (т. е. содержит меньше кальция, чем исходная вода).
е. содержит меньше кальция, чем исходная вода).
Кальций относится к элементам, которые характеризуются как отрицательным, так и положительным влиянием на организм человека. Поэтому необходимо контролировать содержание кальция в питьевой воде и регулировать его содержание таким образом, чтобы концентрация находились в оптимальном диапазоне.
Кальций и жесткость воды — нониус
Введение
Кальций, Са
2+
Кальций в форме иона Са 2+ является одним из основных неорганических катионов или положительных ионов , в соленой и пресной воды. Он может возникать в результате диссоциации солей, таких как хлорид кальция или сульфат кальция, в воде.
Большая часть кальция в поверхностных водах поступает из ручьев, текущих по известняку, CaCO 3 , гипс, CaSO 4 •2H 2 O и другие кальцийсодержащие породы и минералы. Подземные воды и подземные водоносные горизонты вымывают еще более высокие концентрации ионов кальция из горных пород и почвы. Карбонат кальция относительно нерастворим в воде, но легче растворяется в воде, содержащей значительное количество растворенного диоксида углерода.
Карбонат кальция относительно нерастворим в воде, но легче растворяется в воде, содержащей значительное количество растворенного диоксида углерода.
Концентрация ионов кальция (Ca 2+ ) в пресной воде находится в диапазоне от 0 до 100 мг/л и обычно имеет самую высокую концентрацию любого катиона в пресной воде. В качестве верхнего предела для питьевой воды рекомендуется уровень 50 мг/л. Высокий уровень не считается проблемой для здоровья; однако уровни выше 50 мг / л могут быть проблематичными из-за образования избыточных отложений карбоната кальция в сантехнике или из-за снижения очищающего действия мыла. Если концентрация ионов кальция в пресной воде падает ниже 5 мг/л, она может поддерживать только скудную растительную и животную жизнь, состояние, известное как олиготрофный . Типичная морская вода содержит Ca 2+ на уровне около 400 мг/л.
Кальциевая жесткость в пересчете на CaCO
3
Когда вода проходит через минеральные отложения, такие как известняк, уровни ионов Ca 2+ , Mg 2+ и HCO 3 – 900 присутствуют в воды значительно увеличиваются и приводят к тому, что вода классифицируется как жесткая. Этот термин возникает из-за того, что ионы кальция или магния в воде соединяются с молекулами мыла, образуя липкую пену, которая мешает действию мыла и затрудняет получение пены. Одним из наиболее явных признаков жесткости воды является слой белой пленки, остающийся на поверхности душевых кабин. Поскольку большинство ионов жесткой воды происходит из карбоната кальция, уровни жесткости воды часто обозначают в единицах 9.0011 твердость как CaCO 3 . Например, если концентрация Ca 2+ в пробе воды составляет 30 мг/л, то ее кальциевую жесткость как CaCO 3 можно рассчитать по формуле
Этот термин возникает из-за того, что ионы кальция или магния в воде соединяются с молекулами мыла, образуя липкую пену, которая мешает действию мыла и затрудняет получение пены. Одним из наиболее явных признаков жесткости воды является слой белой пленки, остающийся на поверхности душевых кабин. Поскольку большинство ионов жесткой воды происходит из карбоната кальция, уровни жесткости воды часто обозначают в единицах 9.0011 твердость как CaCO 3 . Например, если концентрация Ca 2+ в пробе воды составляет 30 мг/л, то ее кальциевую жесткость как CaCO 3 можно рассчитать по формуле
(30 мг/л Ca 2+ ) × (100 г CaCO 3 / 40 г Ca 2+ ) = 75 мг/л кальциевой жесткости в пересчете на CaCO 3
Обратите внимание, что 30 мг/л Ca 2+ и 75 мг/л кальциевой жесткости поскольку CaCO 3 эквивалентны — это просто два разных способа выражения уровня кальция. Значение кальциевой жесткости как CaCO 3 всегда можно получить, умножив концентрацию Ca 2+ на коэффициент 100/40, или 2,5.
Другое распространенное измерение жесткости воды известно как общая жесткость как CaCO 3 . Это измерение учитывает как ионы Ca 2+ , так и ионы Mg 2+ . В среднем жесткость по магнию составляет около 1/3 от общей жесткости, а жесткость по кальцию — около 2/3. Если вы сравниваете свои собственные результаты испытаний кальциевой жесткости как CaCO 3 с результатами в публикациях, в которых единицы общей жесткости используются как CaCO 3 , можно оценить общую жесткость, умножив кальциевую жесткость на 1,5. См. Тест 14, Общая жесткость воды , для получения дополнительной информации по этой теме.
Объективы
- Измерение концентрации ионов кальция в ручье или озере в мг/л как Ca 2+ с использованием электрода, селективного по отношению к ионам кальция (ISE).
- Определить кальциевую жесткость как CaCO 3 в мг/л.
Датчики и оборудование
В этом эксперименте используются следующие датчики и оборудование.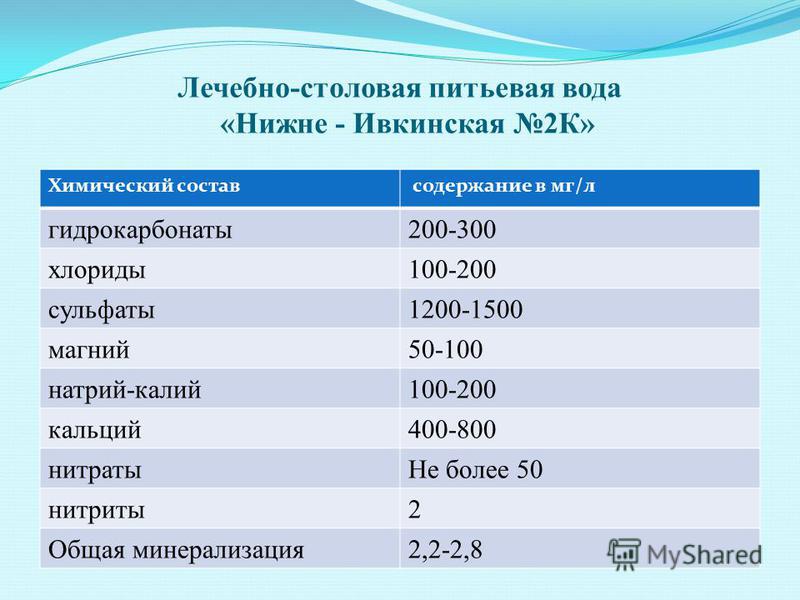 Может потребоваться дополнительное оборудование.
Может потребоваться дополнительное оборудование.
Зачем удалять кальций из воды, если это полезно для здоровья?
Как удалить кальций из воды:
Легко забыть, насколько важна вода в нашей жизни. Конечно, он нужен нам в нашем рационе, но в наших домах это инструмент и текучая среда, которая переносит материал из одного места в другое. И одна из причин, по которой он хорошо справляется с этой задачей, заключается в том, что он очень хорошо удерживает вещи, либо подвешивая их, либо растворяя.
Однако, в отличие от большинства инструментов, к воде не прилагается инструкция по эксплуатации. Если бы это было так, вы бы знали, почему посуда, которую вы считали вымытой, после высыхания покрывается пятнами, почему вода в вашем душе оставляет пленку на всем, к чему она прикасается, и почему то, что вы считали чистой водой, засорило вашу водопроводную систему. .
Это вызвано содержанием кальция в воде. Решение — это проблема… Пока вода находится в земле, она собирает растворимые частицы всего, через что проходит. Хотя это может означать загрязнение, которое делает воду непригодной для питья, во многих случаях это просто означает, что вода содержит минералы, найденные в земле. Из них кальций в воде имеет особое значение, поскольку он влияет на способность воды функционировать в наших домах. Кальций в воде делает нашу воду жесткой.
Хотя это может означать загрязнение, которое делает воду непригодной для питья, во многих случаях это просто означает, что вода содержит минералы, найденные в земле. Из них кальций в воде имеет особое значение, поскольку он влияет на способность воды функционировать в наших домах. Кальций в воде делает нашу воду жесткой.
Одним из эффектов жесткой воды является то, что мыло и моющие средства теряют некоторую эффективность. Вместо полного растворения мыло соединяется с минералами, образуя коагулированный мыльный творог. Поскольку растворяется меньше мыла, требуется больше. И липкий нерастворимый творог висит вокруг — он цепляется за кожу и может фактически препятствовать очищению. Вымытые волосы кажутся тусклыми и безжизненными.
В прачечной дела обстоят не намного лучше. Мыльный творог может попасть на вашу одежду, когда ее стирают в автоматической стиральной машине. Это может удерживать грязь в волокнах, а также может сделать ткань жесткой и шероховатой. Помимо того, что нерастворимые мыльные отложения влияют на сам процесс стирки, они оставляют пятна на всем, что вы моете — от посуды до семейного автомобиля — и мыльная пленка будет образовываться в вашей ванне и душе. Еще одна причина для беспокойства по поводу содержания кальция в воде – это его влияние на вашу водопроводную систему. Содержащийся в воде кальций может накапливаться в трубах, уменьшая подачу воды к кранам и приборам. В водонагревателях эти минералы образуют накипь, которая снижает эффективность и срок службы нагревателя.
Еще одна причина для беспокойства по поводу содержания кальция в воде – это его влияние на вашу водопроводную систему. Содержащийся в воде кальций может накапливаться в трубах, уменьшая подачу воды к кранам и приборам. В водонагревателях эти минералы образуют накипь, которая снижает эффективность и срок службы нагревателя.
Исправление:
Решение проблемы заключается в решении кальция в воде. Несмотря на то, что существуют химические методы обработки, которые делают это, включая традиционный смягчитель воды на основе соли, для которого потребуются гранулы соли или калия, и если предположить, что потребление кальция не вредно для вашего здоровья, наиболее практичным решением может быть Каталитический кондиционер для воды, такой как Hard Water. Пуля.
Сердцем этой системы является металлическое ядро, способное кондиционировать кальций, делая его безвредным, но оставляя кальций в воде в виде безвредного арагонита, и таким образом вода сохраняет свои питательные свойства. Он расщепляет кальций и магний, делая их безвредными и позволяя вашей воде сохранять питательные свойства.
Он расщепляет кальций и магний, делая их безвредными и позволяя вашей воде сохранять питательные свойства.
Эта система не требует регенерации, как обычная система умягчения воды, и не требует использования химикатов или соли для выполнения процесса кондиционирования.
Жесткость воды (кальций в воде) измеряется в гранах на галлон (GPG) или миллиграммах на литр (мг/л, что эквивалентно частям на миллион или ppm).
Вода до 1 GPG (или 17,1 мг/л) считается мягкой
Вода от 1 до 3,5 GPG считается умеренно жесткой.
Вода от 3,5 до 7 GPG является жесткой водой.
Вода от 7 до 10,5 GPG очень жесткая.
Проблемы со здоровьем:
Обычно жесткая вода не представляет опасности для здоровья. С другой стороны, хлорид натрия, который остается в умягченной воде (от обычного умягчителя воды), может быть проблемой для тех, кто придерживается диеты с ограничением натрия. Это еще одна веская причина заменить обычный смягчитель на бессолевой кондиционер.



 Недостаток кальция приводит к расслоению ногтей, ломкости и истончению волосяного покрова головы.
Недостаток кальция приводит к расслоению ногтей, ломкости и истончению волосяного покрова головы.