Содержание
Что представляет собой кальций, реакция кальция с кислородом
[Deposit Photos]
В древности люди использовали соединения кальция для строительства. В основном это был карбонат кальция, находившийся в горных породах, или продукт его обжига — известь. Также использовался мрамор и гипс. Раньше ученые считали, что известь, представляющая собой оксид кальция, — это простое вещество. Это заблуждение существовало вплоть до конца XVIII века, пока свои предположения по поводу этого вещества не высказал Антуан Лавуазье.
Добыча извести
[Flickr]
В начале XIX века английский ученый Хэмпфри Дэви с помощью электролиза открыл кальций в чистом виде. Причем получил он амальгаму кальция из гашеной извести и оксида ртути. Затем отогнав ртуть, он получил металлический кальций.
Кальций играет важную роль в биологической сфере и является распространенным микроэлементом, который в небольших количествах содержится в организме человека, животных, а также в растениях. Дефицит этого элемента приводит к различным заболеваниям.
Так как этот металл проявляет высокую активность, в природе кальций не встречается в чистом виде: большая часть соединений находится в горных породах, например, в силикатах и алюмосиликатах. Также он находится в осадочных горных породах, например, в известняке и меле, который представляет собой карбонат кальция. Кроме того, он встречается в морской воде и в земной коре.
Применение кальция
Этот элемент часто применяют в металлургической промышленности. Именно кальций выступает в роли восстановителя при получении некоторых металлов, например, нержавеющей стали.
Другие соединения кальция, использующиеся в промышленности:
оксид кальция CaO (негашеная известь) используется для строительных и ремонтных работ;
гидросульфит кальция Ca(HSO₃)₂ представляет собой бесцветные кристаллы, является консервантом, а также применяется в бумажной промышленности;
дигидрат сульфата кальция (гипс) CaSO₄·2H₂O применяется как вяжущий материал в целлюлозно-бумажной промышленности, а также в медицине — для фиксации переломов.

Физические свойства кальция
[Wikimedia]
Ca является мягким металлом, его без труда можно разрезать ножом.
Кальций — блестящий серебристо-белый металл, который при неправильном хранении тускнеет из-за образования оксидной пленки.
Вещество плавится при высокой температуре — 842 °С.
Обладает высокой электро- и теплопроводностью.
Кипит при температуре 1484 °С.
Химические свойства кальция
Ca находится во второй группе четвертого периода периодической системы Менделеева и относится к активным щелочноземельным металлам.
Кальций следует хранить под керосином: если оставить этот металл на открытом воздухе, он быстро потеряет свой металлический блеск и станет тусклым и серым под воздействием паров воды, кислорода и углекислого газа.
Реакция кальция с водой проходит бурно, но не сопровождается возгоранием.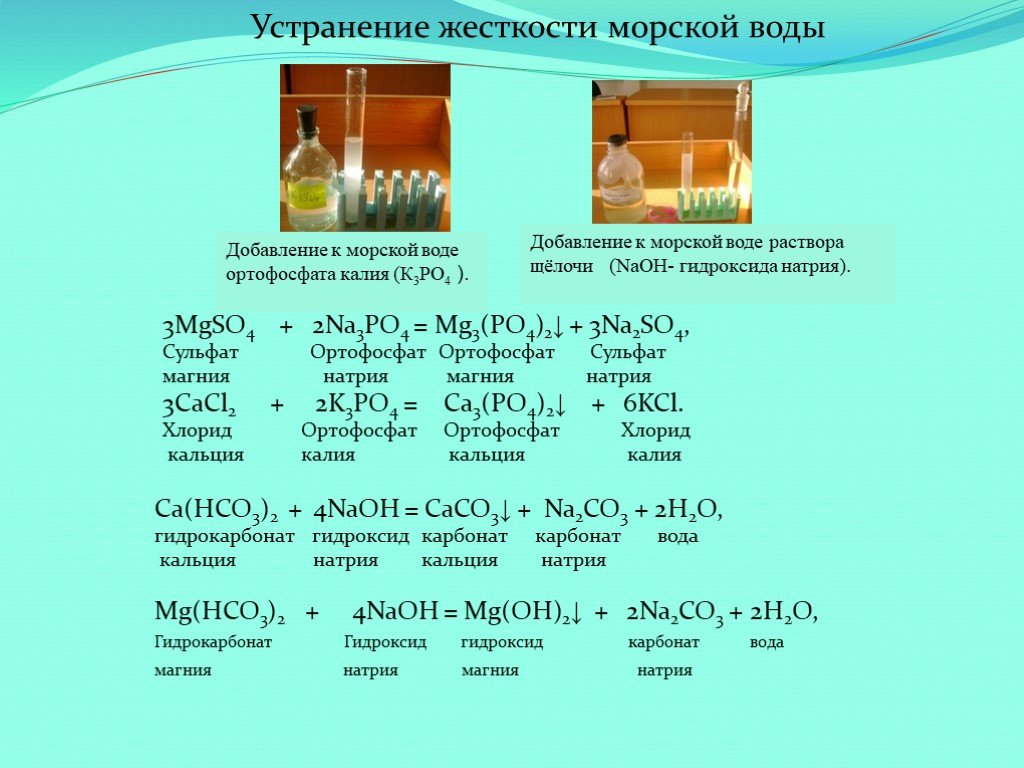 За счет обильного выделения водорода пластинка с кальцием будет перемещаться по воде. Также образуется вещество — гидроксид кальция. Если в жидкость добавить фенолфталеин, она окрасится в ярко-малиновый цвет — следовательно, Ca(OH)₂ является основанием.
За счет обильного выделения водорода пластинка с кальцием будет перемещаться по воде. Также образуется вещество — гидроксид кальция. Если в жидкость добавить фенолфталеин, она окрасится в ярко-малиновый цвет — следовательно, Ca(OH)₂ является основанием.
Ca + 2H₂O → Ca(OH)₂↓ + H₂↑
Реакция кальция с кислородом
Очень интересна реакция Ca и O₂, однако опыт нельзя выполнять в домашних условиях, так как он весьма опасен.
Рассмотрим реакцию кальция с кислородом, а именно горение этого вещества на воздухе.
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
Здесь вы найдете безопасные опыты по химии, которые можно проводить дома.
В качестве источника кислорода возьмем нитрат калия KNO₃. Если кальций хранился в керосиновой жидкости, то перед опытом его нужно очистить при помощи горелки, подержав над пламенем. Далее кальций опускают в порошок KNO₃. Затем кальций с нитратом калия нужно поместить в пламя горелки. Происходит реакция разложения нитрата калия на нитрит калия и кислород. Выделяющийся кислород поджигает кальций, и пламя окрашивается в красный цвет.
Выделяющийся кислород поджигает кальций, и пламя окрашивается в красный цвет.
KNO₃ → KNO₂ + O₂
2Ca + O₂ → 2CaO
Стоит отметить, что кальций реагирует с некоторыми элементами только при нагревании, к ним относятся: фосфор, сера, бор, азот и другие.
Химические и физические свойства кальция, его взаимодействие с водой
It looks like you are visiting our site from
Germany.
Please switch to our regional site for more relevant pricing, product details, and special offers.
Choose another country
Почему металл хранят в герметичной банке
Твитнуть
Отправить
[Deposit Photos]
Кальций располагается в четвертом большом периоде, второй группе, главной подгруппе, порядковый номер элемента — 20. Согласно периодической таблице Менделеева, атомный вес кальция — 40,08. Формула высшего оксида — СаО. Кальций имеет латинское название calcium, поэтому символ атома элемента — Са.
Формула высшего оксида — СаО. Кальций имеет латинское название calcium, поэтому символ атома элемента — Са.
Характеристика кальция как простого вещества
При обычных условиях кальций — это металл серебристо-белого цвета. Имея высокую химическую активность, элемент способен образовывать множество соединений разных классов. Элемент представляет ценность для технических и промышленных химических синтезов. Металл широко распространен в земной коре: его доля составляет около 1,5 %. Кальций относится к группе щелочноземельных металлов: при растворении в воде он дает щелочи, но в природе встречается в виде множественных минералов и солей. Морская вода содержит кальций в больших концентрациях (400 мг/л).
Чистый натрий
[Wikimedia]
Характеристики кальция зависят от строения его кристаллической решетки. У этого элемента она бывает двух типов: кубическая гранецентрическая и объемноцентрическая. Тип связи в молекуле кальция — металлический.
Тип связи в молекуле кальция — металлический.
Природные источники кальция:
- апатиты;
- алебастр;
- гипс;
- кальцит;
- флюорит;
- доломит.
Физические свойства кальция и способы получения металла
В обычных условиях кальций находится в твердом агрегатном состоянии. Металл плавится при 842 °С. Кальций является хорошим электро- и теплопроводником. При нагревании он переходит сначала в жидкое, а затем в парообразное состояние и теряет металлические свойства. Металл является очень мягким и режется ножом. Кипит при 1484 °С.
Под давлением кальций теряет металлические свойства и способность к электропроводимости. Но затем металлические свойства восстанавливаются и проявляются свойства сверхпроводника, в несколько раз превышающего по своим показателям остальные элементы.
Кальций долго не удавалось получить без примесей: из-за высокой химической активности этот элемент не встречается в природе в чистом виде. Элемент был открыт в начале XIX века. Кальций как металл впервые синтезировал британский химик Гемфри Дэви. Ученый обнаружил особенности взаимодействия расплавов твердых минералов и солей с электрическим током. В наши дни электролиз солей кальция (смеси хлоридов кальция и калия, смеси фторида и хлорида кальция) остается самым актуальным способом получения металла. Кальций также извлекают из его оксида с помощью алюминотермии — распространенного в металлургии метода.
Элемент был открыт в начале XIX века. Кальций как металл впервые синтезировал британский химик Гемфри Дэви. Ученый обнаружил особенности взаимодействия расплавов твердых минералов и солей с электрическим током. В наши дни электролиз солей кальция (смеси хлоридов кальция и калия, смеси фторида и хлорида кальция) остается самым актуальным способом получения металла. Кальций также извлекают из его оксида с помощью алюминотермии — распространенного в металлургии метода.
Химические свойства кальция
Кальций — активный металл, вступающий во многие взаимодействия. При нормальных условиях он легко реагирует, образуя соответствующие бинарные соединения: с кислородом, галогенами. Нажмите здесь, чтобы узнать больше о соединениях кальция. При нагревании кальций реагирует с азотом, водородом, углеродом, кремнием, бором, фосфором, серой и другими веществами. На открытом воздухе мгновенно взаимодействует с кислородом и углекислым газом, поэтому покрывается серым налетом.
Бурно реагирует с кислотами, при этом иногда воспламеняется. В солях кальций проявляет интересные свойства. Например, пещерные сталактиты и сталагмиты — это карбонат кальция, постепенно образовавшийся из воды, углекислого газа и гидрокарбоната в итоге процессов внутри подземных вод.
В солях кальций проявляет интересные свойства. Например, пещерные сталактиты и сталагмиты — это карбонат кальция, постепенно образовавшийся из воды, углекислого газа и гидрокарбоната в итоге процессов внутри подземных вод.
Из-за высокой активности в обычном состоянии кальций хранится в лабораториях в темной герметичной стеклянной посуде под слоем парафина или керосина. Качественная реакция на ион кальция — окрашивание пламени в насыщенный кирпично-красный цвет.
Кальций окрашивает пламя в красный цвет
[Wikimedia]
Идентифицировать металл в составе соединений можно по нерастворимым осадкам некоторых солей элемента (фторид, карбонат, сульфат, силикат, фосфат, сульфит).
Реакция воды с кальцием
Кальций хранят в банках под слоем защитной жидкости. Чтобы провести опыт, демонстрирующий, как происходит реакция воды и кальция, нельзя просто достать металл и отрезать от него нужный кусочек. Металлический кальций в лабораторных условиях проще использовать в виде стружки.
Металлический кальций в лабораторных условиях проще использовать в виде стружки.
Если металлической стружки нет, а в банке есть только большие куски кальция, потребуются пассатижи или молоток. Готовый кусочек кальция нужного размера помещают в колбу или стакан с водой. Кальциевую стружку кладут в посуду в марлевом мешочке.
Кальций опускается на дно, и начинается выделение водорода (сначала в месте, где находится свежий излом металла). Постепенно с поверхности кальция выделяется газ. Процесс напоминает бурное кипение, одновременно образовывается осадок гидроксида кальция (гашёная известь).
Гашение извести
[Flickr]
Кусок кальция всплывает, подхваченный пузырьками водорода. Примерно через 30 секунд кальций растворяется, а вода из-за образования взвеси гидроксида становится мутно-белой. Если реакцию проводить не в стакане, а в пробирке, можно наблюдать выделение тепла: пробирка быстро становится горячей. Реакция кальция с водой не заканчивается эффектным взрывом, но взаимодействие двух веществ протекает бурно и выглядит зрелищно. Опыт безопасен.
Реакция кальция с водой не заканчивается эффектным взрывом, но взаимодействие двух веществ протекает бурно и выглядит зрелищно. Опыт безопасен.
Если мешочек с оставшимся кальцием вынуть из воды и подержать на воздухе, то через некоторое время в результате продолжающейся реакции наступит сильное разогревание и оставшаяся в марле вода закипит. Если часть помутневшего раствора отфильтровать через воронку в стакан, то при пропускании через раствор оксида углерода CO₂ получится осадок. Для этого не нужен углекислый газ — можно продувать выдыхаемый воздух в раствор через стеклянную трубочку.
Твитнуть
Отправить
Больше статей о химии:
- Опыт «Египетская ночь»
Химическая реакция «Йодные часы» - Опыт «Золотой дождь»
Как получить блестящие золотистые кристаллы
Делайте эксперименты дома!
Трансмутация
Узнать больше
Попробовать
Кальций (Ca) и вода
Кальций встречается в воде естественным образом. Морская вода содержит приблизительно 400 частей на миллион кальция. Одной из основных причин обилия кальция в воде является его естественное залегание в земной коре. Кальций также входит в состав кораллов. Реки обычно содержат 1-2 части на миллион кальция, но в известняковых районах концентрация кальция в реках может достигать 100 частей на миллион.
Морская вода содержит приблизительно 400 частей на миллион кальция. Одной из основных причин обилия кальция в воде является его естественное залегание в земной коре. Кальций также входит в состав кораллов. Реки обычно содержат 1-2 части на миллион кальция, но в известняковых районах концентрация кальция в реках может достигать 100 частей на миллион.
Примеры концентраций кальция в водных организмах: морские водоросли luctuca 800-6500 ppm (влажная масса), устрицы примерно 1500 ppm (сухая масса).
В водном растворе кальций в основном присутствует в виде Ca 2+ (водн.), но также может встречаться в виде CaOH + (водн.) или Ca(OH) 2 (водн.) или в виде CaSO 4 в морской воде.
Кальций является важным фактором, определяющим использование воды, а также действует как стабилизатор pH благодаря своим буферным свойствам. Кальций также придает воде лучший вкус.
Каким образом и в какой форме кальций реагирует с водой?
В отличие от магния, расположенного непосредственно над кальцием в периодической таблице, элементарный кальций реагирует с водой при комнатной температуре по следующему механизму реакции:
Ca (т) + 2H 2 O (г) -> Ca(OH) 2 (водн.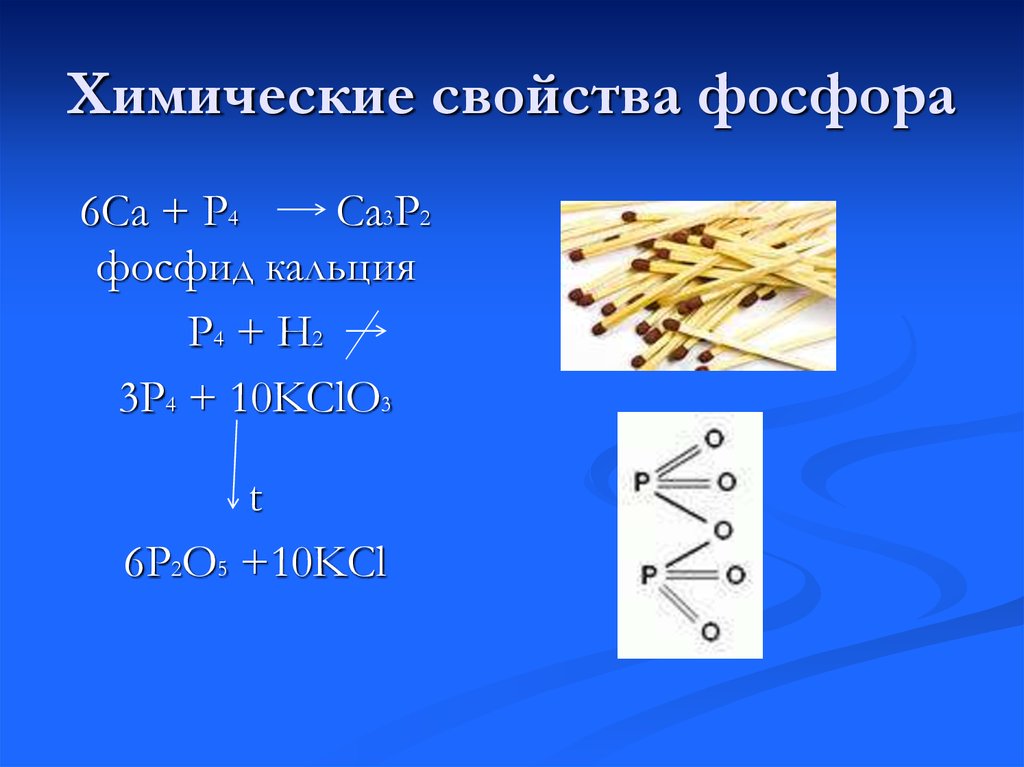 ) + H 2 (г)
) + H 2 (г)
В результате этой реакции образуется гидроксид кальция, который растворяется в воде в виде соды, и газообразный водород.
Другими важными механизмами реакции кальция являются реакции эрозии. Обычно это происходит при наличии углекислого газа. В нормальных условиях карбонат кальция нерастворим в воде. В присутствии углекислого газа образуется угольная кислота, влияющая на соединения кальция.
Механизм реакции выветривания углерода:
H 2 O + CO 2 -> H 2 CO 3 и Caco 3 + H 2 CO 3 -> CA (HCO 3 ) 2
-> А суммарный механизм реакции:
CaCO 3 (т) + CO 2 (г) + 2H 2 O (л) -> Ca 2+ (водн.) + 2 HCO 3 — (водный)
Продукт представляет собой гидрокарбонат кальция.
Растворимость кальция и соединений кальция
Элементарный кальций реагирует с водой. Соединения кальция более или менее растворимы в воде. Карбонат кальция имеет растворимость 14 мг/л, что умножается на пять в присутствии двуокиси углерода. Растворимость фосфата кальция 20 мг/л, фторида кальция 16 мг/л. Растворимость хромата кальция 170 г/л, а при 0 o С растворимость гипохлората кальция 218 г/л. Растворимость других соединений кальция находится между уровнями этих примеров, например арсената кальция 140 мг/л, гидроксида кальция 1,3 г/л и сульфата кальция 2,7-8,8 г/л.
Соединения кальция более или менее растворимы в воде. Карбонат кальция имеет растворимость 14 мг/л, что умножается на пять в присутствии двуокиси углерода. Растворимость фосфата кальция 20 мг/л, фторида кальция 16 мг/л. Растворимость хромата кальция 170 г/л, а при 0 o С растворимость гипохлората кальция 218 г/л. Растворимость других соединений кальция находится между уровнями этих примеров, например арсената кальция 140 мг/л, гидроксида кальция 1,3 г/л и сульфата кальция 2,7-8,8 г/л.
Почему кальций присутствует в воде?
Кальций естественно присутствует в воде. Он может растворяться в горных породах, таких как известняк, мрамор, кальцит, доломит, гипс, флюорит и апатит. Кальций является определяющим фактором жесткости воды, поскольку он присутствует в воде в виде ионов Ca 2+ . Магний является другим определяющим фактором твердости.
Кальций присутствует в различных строительных материалах, таких как цемент, кирпичная известь и бетон. Он присутствует в батареях и применяется в гипсе в виде сульфата кальция. Металл применяется для производства циркония и тория. В сталелитейной промышленности кальций применяется в качестве промокателя и добавляется в алюминиевые, медные и свинцовые сплавы. Кальций может извлекать диоксид серы из промышленных выхлопов и нейтрализовать серные кислоты перед сбросом. Другими примерами применения кальция являются гипохлорид кальция в качестве отбеливателя и для дезинфекции, фосфат кальция в стекольной и фарфоровой промышленности, полисульфид и гидроксид кальция в качестве флокулянтов при очистке сточных вод и фторид кальция в качестве агента помутнения в производстве эмалей, в УФ-спектроскопии и в качестве сырье для производства жидкой кислоты. Кальций также может применяться для удаления углерода и серы из железа и его сплавов, а также для обезвоживания нефти. Известняк применяется в качестве наполнителя для бумаги, благодаря чему бумага становится белее, а в пластмассах — для повышения стабильности.
Он присутствует в батареях и применяется в гипсе в виде сульфата кальция. Металл применяется для производства циркония и тория. В сталелитейной промышленности кальций применяется в качестве промокателя и добавляется в алюминиевые, медные и свинцовые сплавы. Кальций может извлекать диоксид серы из промышленных выхлопов и нейтрализовать серные кислоты перед сбросом. Другими примерами применения кальция являются гипохлорид кальция в качестве отбеливателя и для дезинфекции, фосфат кальция в стекольной и фарфоровой промышленности, полисульфид и гидроксид кальция в качестве флокулянтов при очистке сточных вод и фторид кальция в качестве агента помутнения в производстве эмалей, в УФ-спектроскопии и в качестве сырье для производства жидкой кислоты. Кальций также может применяться для удаления углерода и серы из железа и его сплавов, а также для обезвоживания нефти. Известняк применяется в качестве наполнителя для бумаги, благодаря чему бумага становится белее, а в пластмассах — для повышения стабильности.
Кальций часто положительно влияет на качество почвы, и в качестве удобрения вносятся различные соединения. Например, в садоводстве применяют растворы CaCl 2 — или Ca(NO) 3 . Оксид кальция является обезвоживающим моллюскоцидом.
Каково воздействие кальция в воде на окружающую среду?
Кальций необходим всем организмам, за исключением некоторых насекомых и бактерий. Карбонат кальция является строительным камнем скелетов большинства морских организмов и глазных линз. Фосфат кальция необходим для структуры костей и зубов наземных организмов. Растения в основном содержат оксалат кальция. Запас кальция в растениях составляет около 1% от сухой массы.
Кальций в значительной степени отвечает за жесткость воды и может негативно влиять на токсичность других соединений. Такие элементы, как медь, свинец и цинк, гораздо более токсичны в мягкой воде.
В известкованных почвах кальций может иммобилизовать железо. Это может вызвать нехватку железа, даже если в почве его много.
Это может вызвать нехватку железа, даже если в почве его много.
Жесткость воды влияет на токсичность металлов для водных организмов. В более мягкой воде проницаемость мембран жабр увеличивается. Кальций также конкурирует с другими ионами за места связывания в жабрах. Следовательно, жесткая вода лучше защищает рыб от прямого поглощения металлов. Значения pH 4,5-4,9может нанести вред икре лосося и взрослым лососям при низком содержании кальция, натрия и хлора.
Различные соединения кальция могут быть токсичными. LD 50 крыс для арсенита кальция составляет 20 мг/кг массы тела. Карбид кальция образует легковоспламеняющийся этин при контакте с водой и поэтому считается опасным.
Некоторые воздействия жесткости воды на окружающую среду включают повышение жесткости бытового оборудования, поскольку высокие температуры вызывают карбонатную жесткость. Это может резко сократить срок службы оборудования и привести к увеличению бытовых отходов. Карбонат кальция взаимодействует с моющими и чистящими средствами. Комплексообразование вызывает снижение эффективности моющих средств, что приводит к потребности в более частом применении моющих средств и покупке смягчителей (см. также магний и вода).
Комплексообразование вызывает снижение эффективности моющих средств, что приводит к потребности в более частом применении моющих средств и покупке смягчителей (см. также магний и вода).
Умягчение часто проводят с помощью ионообменников. Это должны быть регенераты с поваренной солью и, следовательно, отягощающие сточные воды.
Существует шесть стабильных изотопов кальция. На сегодняшний день известно о восьми нестабильных изотопах кальция. 45 Ca высокорадиоактивен и токсичен.
Как влияет на здоровье содержание кальция в воде?
Кальций является диетическим минералом, присутствующим в организме человека в количестве около 1,2 кг. Никакого другого элемента в организме нет в избытке. Фосфат кальция является вспомогательным веществом и вызывает рост костей и зубов вместе с витамином D. Кальций также присутствует в мышечной ткани и в крови. Он необходим для развития клеточных мембран и деления клеток, а также частично отвечает за сокращение мышц и свертывание крови. Кальций регулирует активность мембран, способствует передаче нервных импульсов и высвобождению гормонов, стабилизирует pH тела и является неотъемлемой частью зачатия. Для стимуляции этих функций организма взрослым рекомендуется ежедневный прием около 1000 мг кальция. Этого можно достичь, употребляя молочные продукты, зерновые и зеленые овощи.
Кальций регулирует активность мембран, способствует передаче нервных импульсов и высвобождению гормонов, стабилизирует pH тела и является неотъемлемой частью зачатия. Для стимуляции этих функций организма взрослым рекомендуется ежедневный прием около 1000 мг кальция. Этого можно достичь, употребляя молочные продукты, зерновые и зеленые овощи.
Карбонат кальция действует как средство от желудочной кислоты и может применяться для устранения расстройства пищеварения. Лактат кальция может помочь организму в периоды дефицита кальция, а хлорид кальция является мочегонным средством.
Жесткая вода может способствовать укреплению костей и зубов из-за высокого содержания в ней кальция. Это также может снизить риск сердечных заболеваний. Жесткость питьевой воды должна быть выше 8,4 o dH. Карбонат кальция положительно влияет на свинцовые водопроводные трубы, так как образует защитное покрытие из карбоната свинца(II). Это предотвращает растворение свинца в питьевой воде и тем самым предотвращает его попадание в организм человека.
Прием большого количества кальция может отрицательно сказаться на здоровье человека. Смертельная доза при пероральном приеме составляет около 5-50 мг/кг массы тела. Металлический кальций разъедает кожу при контакте с кожей, глазами и слизистыми оболочками.
Какие технологии очистки воды можно применить для удаления кальция из воды?
Удаление из воды ионов кальция и магния осуществляется умягчителями воды. Это ионообменники, которые обычно содержат Na + , которые высвобождаются и замещаются ионами Ca 2+ и Mg 2+ .
Соединения кальция могут применяться для очистки сточных вод. рН и жесткость питьевой воды можно изменить с помощью карбоната кальция и гидроксида кальция.
Литература и другие элементы и их взаимодействие с водой
Hydropool.com | Poolife Calcium Plus Water Balancer 8 фунтов
$21,99
Список
: $29.69 — Вы экономите: $7,70 (26%)
Пожалуйста, выберите: Количество
1 сумка
2 сумки
3 сумки
Количество
Наличие 84 шт. В наличии
В наличии
Доставка Доставка бесплатно В течение 1 рабочего дня
Когда я получу этот товар?
Краткое описание продукта
Балансировщик воды Poolife Calcium Plus 8 фунтов от Poolife
Poolife Calcium Plus используется для повышения уровня жесткости известкового налета во всех бассейнах.
Цена продажи: $21,99
Полная информация
Часто покупаемые вместе
Общая стоимость за
4 предмета
281,85 долл. США
Текущий элемент:
Poolife Calcium Plus Water Balancer 8 фунтов
21,99 $
Тест-полоски AquaChek 4-в-1 на хлор Кол-во: 50
$15,99
Учить больше
Poolife TurboShock 78% амортизатор для бассейна 12 фунтов
$83,88
Учить больше
Таблетки хлора с пролонгированным высвобождением Poolife NST 20,6 фунта
$159,99
Учить больше
Недавно просмотренные
Poolife Calcium Plus Water Balancer 8 фунтов
Быстрый просмотр
$ 29,69
21,99 $
Расчетная дата доставки основана на времени доставки наземной службой FedEx до указанного вами почтового индекса.

