Содержание
Погода в Этене (Мёз) сегодня, прогноз погоды Этен (Мёз) на сегодня, Лотарингия, Франция
GISMETEO: Погода в Этене (Мёз) сегодня, прогноз погоды Этен (Мёз) на сегодня, Лотарингия, Франция
Перейти на мобильную версию
Сейчас
6:37
−6 20
По ощущению −12 11
Вс, 18 дек
Сегодня
−621
−130
Пн, 19 дек
Завтра
+134
+745
3,4 мм
100
400
700
1000
1300
1600
1900
2200
−523
−621
−621
−523
−228
−228
−228
−130
Скорость ветра, м/cкм/ч
4-10 14-36
3-10 11-36
4-10 14-36
4-7 14-25
4-6 14-22
3-7 11-25
3-6 11-22
3-5 11-18
Осадки, мм
Распечатать. ..
..
Ветер, м/скм/ч
Вс, 18 дек, сегодня
Пн, 19
100
400
700
1000
1300
1600
1900
2200
Порывы
Партнерские Новости · Авто
Давление, мм рт. ст.гПа
Вс, 18 дек, сегодня
Пн, 19
100
400
700
1000
1300
1600
1900
2200
7511001
7511001
7511001
7511001
7511001
7501000
749998
749998
Влажность, %
Вс, 18 дек, сегодня
Пн, 19
100
400
700
1000
1300
1600
1900
2200
79
86
87
78
60
68
73
80
Солнце и Луна
Вс, 18 дек, сегодня
Пн, 19
Долгота дня: 8 ч 12 мин
Восход — 8:27
Заход — 16:40
Сегодня день такой же, как вчера
Луна стареющая, 30%
Заход — 13:25 (17 декабря)
Восход — 2:10
Полнолуние — 7 января, через 20 дней
Геомагнитная активность, Кп-индекс
Вс, 18 дек, сегодня
Пн, 19
100
400
700
1000
1300
1600
1900
2200
Осадки
Температура
Ветер
Облачность
Булиньи
Жудревиль
Пьенн
Конфлан-ан-Жарнизи
Одэнвиль
Лабри
Верден
Мон-Бонвиллер
Бельвиль-сюр-Маас
Жарни
Мансьель
Мерси-ле-Ба
Жиромон
Тьервиль-сюр-Маас
Дюньи-сюр-Маас
Валлеруа
Тюккенье
Брие
Дьё-сюр-Маас
Муанвиль
Донкур-ле-Конфлан
Мутье
Обуэ
Трье
Этен и этин — ненасыщенные углеводороды
Химия.
 9 класс. Григорович
9 класс. Григорович
Вспомните: как образуются кратные ковалентные связи (§ 2).
Молекулярная и структурная формулы этена и этина
• Ненасыщенные углеводороды — это углеводороды, в молекулах которых между атомами Карбона есть кратные связи — двойные или тройные.
Этен (этилен) — ненасыщенный углеводород, первый представитель гомологического ряда алкенов, главный признак которых — наличие в молекулах одной двойной связи между атомами Карбона.
Этин (ацетилен) — ненасыщенный углеводород, первый представитель гомологического ряда алкинов, в молекулах которых обязательно есть одна тройная связь между атомами Карбона.
В молекулах этих углеводородов есть по два атома Карбона, о чем можно узнать из их названия: названия «этен» и «этин» происходят от названия алкана этана, в молекуле которого есть два атома Карбона.
Составим структурные формулы этена и этина. Как и в случае с алканами, сначала запишем карбоновую цепь:
У этена каждый атом Карбона уже образует по две связи, следовательно, для соединения с Гидрогеном также остается по две связи. В этине каждый атом Карбона образует по три связи и может присоединить только по одному атому Гидрогена. Итак, для этена и этина:
В этине каждый атом Карбона образует по три связи и может присоединить только по одному атому Гидрогена. Итак, для этена и этина:
Теперь мы можем посчитать атомы в молекулах и получаем молекулярные формулы: этен — C2H4, этин — C2H2.
Сравните структурные и молекулярные формулы этена и этина с соответствующими формулами этана: в молекуле этена на два атома Гидрогена меньше, чем в молекуле этана, а в молекуле этина — на четыре атома меньше. По этой причине атомы Карбона в молекулах этена и этина не полностью насыщены атомами Гидрогена, поэтому этен и этин — это ненасыщенные углеводороды.
Физические свойства этена и этина
Физические свойства ненасыщенных углеводородов подобны свойствам насыщенных углеводородов. Этен и этин при обычных условиях газообразны, бесцветны, плохо растворяются в воде (растворимость этена составляет 22,6 мл, а этина — 137 мл в 100 мл воды при 0 °С), хорошо растворяются в органических растворителях, не имеют запаха, температура плавления этена -169,2 °С, этина 80,8 °С; температура кипения этена 103,7 °С, этина — 83,8 °С. Технический этин, добываемый карбидным методом, обладает специфическим резким запахом.
Технический этин, добываемый карбидным методом, обладает специфическим резким запахом.
Химические свойства этена и этина
Как и алканы, этен и этин активно вступают в реакцию горения с кислородом. Этен и этин — очень взрывоопасные вещества. Причем этин в воздухе вспыхивает от малейшей искры (даже от статического электричества пальцев руки), поэтому его обычно получают непосредственно перед использованием. Продуктами горения этих углеводородов, как и в случае алканов, являются углекислый газ и вода:
C2H4 + 3O2 → 2CO2 + 2H2O
2C2H2 + 5O2 →4CO2 + 2H2O
Горение этина широко используют в технике для сварки и резки металлов, поскольку ацетилен — рекордсмен по температуре пламени. Сконструированы специальные ацетиленовые горелки, в которых при правильно подобранном режиме подачи этина и кислорода температура пламени достигает 3000 °С (рис. 27.1).
27.1).
Рис. 27.1. Пламя ацетиленокислородной горелки (а) и баллон для получения ацетилена из кальций карбида CaC2 перед подачей его в горелку — генератор ацетилена (б)
В отличие от алканов ненасыщенные углеводороды химически очень активны. Причем благодаря ненасыщенности наиболее характерными для них являются реакции присоединения, в результате которых к каждому атому Карбона при двойной или тройной связи присоединяется атом или группа атомов.
Гидрирование (гидрогенизация) — реакция присоединения водорода. Этин реагирует с водородом при нагревании в присутствии никелевого катализатора с образованием этена:
Этен также является ненасыщенным углеводородом и может соединяться с водородом при таких же условиях:
При достаточном количестве водорода этин может сразу присоединять максимальное количество водорода и превращаться в этан:
Если алканы с галогенами вступают в реакцию замещения, то ненасыщенные углеводороды с галогенами реагируют, как с водородом: вступают в реакцию присоединения. Например:
Например:
Для этой реакции катализатор не нужен. Она происходит даже в водном растворе брома. При пропускании этена или этина через бромную воду (раствор брома в воде) ее желто-коричневая окраска исчезает. Эту реакцию используют как качественную для выявления ненасыщенных соединений.
Применение ненасыщенных углеводородов
Этен в чистом виде почти не применяют, из него получают другие ценные химические продукты (рис. 27.2). Одно из самых ценных свойств этена — способность полимеризоваться, о чем будет идти речь в следующем параграфе. Благодаря этому свойству из него получают различные пластмассы.
Рис. 27.2. Применение этена
Этен обладает интересным свойством: он является фитогормоном, ускоряющим созревание плодов. Обычно овощи и фрукты, нуждающиеся в длительной транспортировке, например, из стран Африки или Южной Америки, срывают еще зелеными: если их сорвать спелыми, они быстро испортятся. А уже на месте фрукты и овощи помещают в специальную камеру с небольшим содержанием этилена (около 2 мл этилена на 1 л воздуха), где в течение 1-2 суток они дозревают.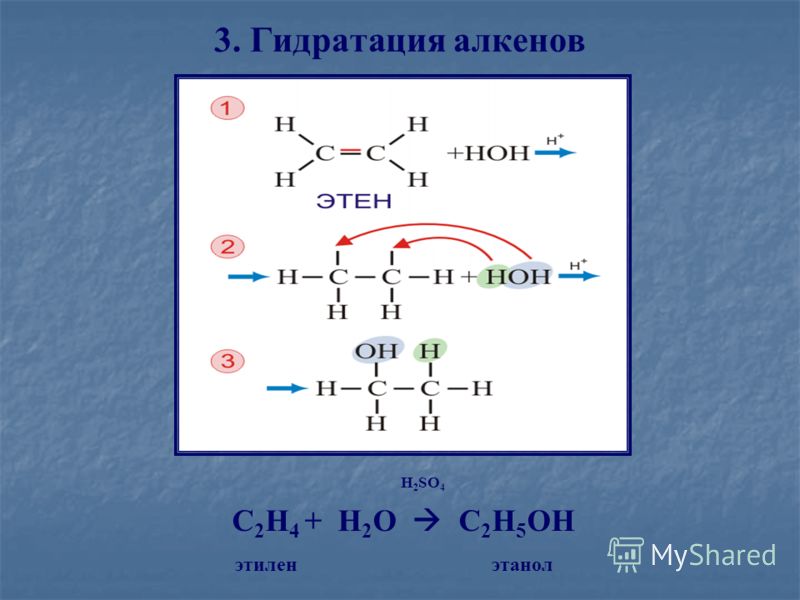
Этин используют в ацетиленовых горелках для сварки и резки металлов. Он также является сырьем для синтеза ценных веществ и материалов (рис. 27.3).
Рис. 27.3. Применение этина
Этилен для стимуляции созревания плодов использовали еще в Древнем Египте. Египтяне специально слегка мяли финики, инжир и другие плоды: повреждение тканей стимулирует образование этилена растениями и ускоряет созревание. В Древнем Китае в закрытых помещениях специально сжигали деревянные ароматические палочки или свечи с целью стимулировать созревание фруктов: при сгорании свечей или древесины выделяется не только углекислый газ, но и другие промежуточные продукты неполного сгорания, в частности этилен.
Ключевая идея
Этен и этин, подобно алканам, являются неполярными веществами, но, в отличие от алканов, они более химически активны благодаря ненасыщенности.
Контрольные вопросы
- 307. Какие углеводороды называют ненасыщенными? В чем их главное отличие от насыщенных углеводородов?
- 308.
 Охарактеризуйте физические свойства этена и этина.
Охарактеризуйте физические свойства этена и этина. - 309. Изобразите молекулярную и структурную формулы этена и этина.
- 310. Составьте уравнения реакций горения этена и этина.
- 311. Опишите применение этена и этина.
- 312. В чем заключается существенное отличие химических свойств ненасыщенных углеводородов от насыщенных? Составьте уравнения реакций взаимодействия этена и этина: а) с водородом; б) с хлором.
Задания для усвоения материала
313. Определите, у какого углеводорода — этена или этина — плотность больше. Сравните их плотность с плотностью воздуха.
314. Сравните объемы углекислого газа, образующегося при полном сгорании равных объемов этана, этена и этина.
315. На сгорание равных объемов какого углеводорода — этана, этена или этина — расходуется меньше кислорода?
316. Используя информацию параграфа, вычислите массовую долю этена и этина в их насыщенных при температуре 0 °С растворах в воде.
317. Как изменяется растворимость этена и этина в воде при повышении температуры? Наблюдаются ли видимые признаки при нагревании насыщенного при определенной температуре раствора этена? этина?
Как изменяется растворимость этена и этина в воде при повышении температуры? Наблюдаются ли видимые признаки при нагревании насыщенного при определенной температуре раствора этена? этина?
318. Вычислите объем водорода (н. у.), с которым взаимодействует: а) этен массой 7 г; б) этин объемом 5,6 л (н. у.).
319. Вычислите объем этена (н. у.), необходимый для обесцвечивания бромной воды массой 400 г, в которой массовая доля брома составляет 2 %.
320. Как изменится объем смеси этилена с кислородом, в которой соотношение объемов газов составляет 1 : 3, при условии полного взаимодействия веществ и образования воды: а) жидкой; б) газообразной?
ГДЗ к учебнику можно найти тут.
Попередня
Сторінка
Наступна
Сторінка
Зміст
Цей контент створено завдяки Міністерству освіти і науки України
МЕХАНИЗМ КИСЛОТНО-КАТАЛИЗАЦИОННОЙ ГИДРАТАЦИИ ЭТЕНА На этой странице описан механизм гидратации этилена с получением этанола с использованием фосфорной (V) кислоты в качестве катализатора. Гидратация этилена с получением этанола Напоминание о фактах Этен смешивают с паром и пропускают через катализатор, состоящий из твердого диоксида кремния, покрытого фосфорной (V) кислотой. Используемая температура составляет 300°С, а давление составляет приблизительно от 60 до 70 атмосфер. | ||
Примечание: Если вас интересуют причины условий, использованных в этой реакции, вы найдете их в разделе равновесия этого сайта, перейдя по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Механизм гидратации этилена Предполагается, что вы знаете о реакциях электрофильного присоединения этена и об использовании фигурных стрелок в механизмах органических реакций. Если вы не довольны ни одним из них, перейдите по ссылке ниже, прежде чем идти дальше. | ||
Примечание: Перейдите по этой ссылке, чтобы узнать о реакциях электрофильного присоединения этилена. Эти страницы находятся в совершенно другой части сайта. Самый быстрый способ вернуться сюда — использовать кнопку НАЗАД в браузере, файл истории или меню Go , если вас серьезно задержали! | ||
Все шаги в приведенном ниже механизме показаны как односторонние реакции, потому что это делает механизм менее запутанным. На аргумент это не влияет, но на самом деле все шаги обратимы. Этап 1 Все атомы водорода в фосфорной (V) кислоте заряжены довольно положительно, потому что они присоединены к очень электроотрицательному атому кислорода. | ||
Примечание: Если вы не уверены в электроотрицательности, вы можете перейти по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | ||
Один из этих атомов водорода сильно притягивается к двойной связи углерод-углерод. | ||
Примечание: Легко понять, почему кислород несет отрицательный заряд. Он получил полный контроль над парой электронов в исходной связи — таким образом, он приобрел дополнительный электрон, который изначально принадлежал водороду. Атом углерода имеет положительный заряд, потому что один из электронов в пи-связи изначально принадлежал ему. Он теряет этот электрон при разрыве пи-связи. | ||
Шаг 2 Образовавшийся карбокатион (ион карбония) реагирует с одной из неподеленных пар молекулы воды. Карбкатион — это тот, который несет положительный заряд на атоме углерода. | ||
Примечание: Самый простой способ помнить о том, что кислород должен нести положительный заряд, состоит в том, что вы реагируете на положительный ион с нейтральной молекулой. Единственный способ, которым атом кислорода может быть присоединен к трем объектам одновременно, — это если он несет положительный заряд. Положительный заряд придает кислороду ту же электронную структуру, что и атом азота, который, конечно, может образовывать три связи. | ||
Этап 3 Наконец, один из атомов водорода кислорода удаляется в результате реакции с ионом дигидрофосфата(V), H 2 PO 4 — , сформированный на первом этапе. Катализатор фосфорной(V) кислоты регенерирован. | ||
Примечание. Это небольшое упрощение. Концентрированная фосфорная(V) кислота, вероятно, содержит некоторое количество воды помимо воды в паре. Вполне вероятно, что некоторые из ионов водорода на этом последнем этапе будут удалены молекулами воды и, возможно, перенесены на ион дигидрофосфата (V) с образованием фосфорной (V) кислоты на более позднем этапе. | ||
В меню катализа. . . В меню «Физическая химия» . . . В меню органических механизмов. . . В главное меню . . .
© Джим Кларк, 2002 г. | ||
Гидратация алкенов Химия. Учебное пособие
Руководство по химии гидратации алкенов
Ключевые понятия
- Алкены представляют собой ненасыщенные углеводороды.
- Двойная связь (C=C) является активным центром молекулы.
- Гидратация алкенов является реакцией присоединения.
- Вода присоединяется к двойной связи алкена в реакции гидратации.
- Это дополнение следует правилу Марковникова.
(H + из H 2 O переходит к атому C, имеющему наибольшее количество атомов H)
- Реакции гидратации алкенов используются для получения технического этанола из этилена.
- Общее уравнение гидратации алкена:
уравнение слова: алкен + вода Н +
→алканол химическое уравнение: R- C = C -R’ |
Н|
Н+ Н -О-Н Н +
→Н
|О
|-H
R- C — C -R’ 1 |
Н|
НH + представляет собой разбавленную сильную кислоту, такую как разбавленная серная кислота.

R и R’ представляют собой водород (Н) или алкильные группы (алкановые цепи).
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Пример гидратации алкена: гидратация этена (этилена) до этанола
Этен (этилен) представляет собой алкен с сокращенной структурной формулой H 2 C=CH 2 .
Активным центром молекулы этена является двойная связь (С=С).
В присутствии разбавленной сильной кислоты вода будет присоединяться к двойной связи в этилене (этилене) с образованием этанола (этилового спирта).
Атом водорода молекулы воды присоединится к одному из атомов углерода этилена, а ОН из молекулы воды присоединится к другому атому углерода этилена.
Этот синтез этанола из этена показан в химических уравнениях ниже:
| эт ен (этилен) | + | вода | Н + → | этил ан ол (этиловый спирт) | ||||||||||||||||||||||||||||||
| С 2 Н 4 | + | Н 2 О | Н + → | С 2 Н 5 ОХ | ||||||||||||||||||||||||||||||
| CH 2 = CH 2 | + | Н 2 О | Н + → | CH 3 — CH 2 OH | ||||||||||||||||||||||||||||||
| + | Н -О-Н | Н + → |
| ||||||||||||||||||||||||||||||
Пример гидратации алкенов: гидратация пропена (пропилена) до пропанола
Пропен (пропилен) представляет собой алкен с сокращенной структурной формулой CH 3 -H 2 C=CH 2 .
Активным центром молекулы пропилена является двойная связь (C=C).
В присутствии разбавленной сильной кислоты вода будет присоединяться к двойной связи в пропилене (пропилене) с образованием смеси спиртов: пропан-1-ол (1-пропанол) и пропан-2-ол (2-пропанол) .
Пропан-1-ол и пропан-2-ол являются структурными изомерами, они имеют одинаковую молекулярную формулу (C 3 H 8 O), но разные структурные формулы (CH 3 -CH 2 -CHOH и CH 3 -CHOH-CH 3 ).
Пропан-1-ол и пропан-2-ол являются изомерами положения, они получены из одного и того же исходного алкана (пропана), но функциональная группа ОН (гидроксил) расположена в другом положении в углеродной цепи (первая атом C для пропан-1-ола и второй атом C для пропан-2-ола).
Эти два изомера пропанола не производятся в равных количествах.
Мы используем правило Марковникова, чтобы решить, какой продукт является «основным», а какой — «второстепенным».
Правило Марковникова гласит, что атом водорода молекулы воды присоединится к углероду с наибольшим числом атомов водорода.
Пропен: CH 3 — C (2) H= C (1) H 2
C (1) имеет 2 атома водорода, связанных с ним.
C (2) имеет только 1 связанный с ним атом водорода.
Правило Марковникова предсказывает, что атом водорода из воды в основном будет присоединен к C (1) , а OH воды будет присоединен к C (2) с образованием основного продукта пропан-2-ол.
Другой изомер, пропан-1-ол, менее предпочтителен, поэтому он будет присутствовать в меньшем количестве и известен как второстепенный продукт.
Этот синтез пропан-1-ола и пропан-2-ола из пропилена показан в химических уравнениях ниже:
| проп ен (пропилен) | + | вода | Н + → | реквизит и -2- ол (основной продукт) | + | реквизит и -1- ол (второстепенный продукт) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| СН 2 = СН-СН 3 | + | Н 2 О | Н + → | CH 3 — CH( OH )-CH 3 (основной продукт) | + | CH 3 — CH 2 -CH 2 OH (второстепенный продукт) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| + | Н -О-Н | Н + → |
| + |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Охарактеризуйте физические свойства этена и этина.
Охарактеризуйте физические свойства этена и этина.
 Вы найдете ссылку, объясняющую использование фигурных стрелок в механизмах на этой странице, если вам это нужно.
Вы найдете ссылку, объясняющую использование фигурных стрелок в механизмах на этой странице, если вам это нужно. Пи-часть связи разрывается, и электроны в ней движутся вниз, образуя новую связь с атомом водорода. Это вынуждает электроны в водородно-кислородной связи полностью опускаться на кислород.
Пи-часть связи разрывается, и электроны в ней движутся вниз, образуя новую связь с атомом водорода. Это вынуждает электроны в водородно-кислородной связи полностью опускаться на кислород. Это означает, что где-то на изделии должен быть положительный заряд.
Это означает, что где-то на изделии должен быть положительный заряд. Другие ионы водорода будут удалены непосредственно ионами дигидрофосфата (V), как показано выше. Не беспокойтесь об этом. Ваши экзаменаторы почти наверняка не будут искать такие мелкие детали.
Другие ионы водорода будут удалены непосредственно ионами дигидрофосфата (V), как показано выше. Не беспокойтесь об этом. Ваши экзаменаторы почти наверняка не будут искать такие мелкие детали. (последнее изменение: ноябрь 2007 г.)
(последнее изменение: ноябрь 2007 г.)