Совет 1: Как определить эквивалент вещества. Эквивалент воды
Эквиваленты и эквивалентные массы
Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как «эквивалент», и установлению закона эквивалентов:массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы. Математическое выражение закона эквивалентов:
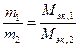 ,
,
где Мэк,1 и Мэк,2- эквивалентные массы.
Эквивалент - это частица или часть частицы, которая соединяется (взаимодействует) с одним атомом или ионом водорода.
Из этого определения видно, что понятие «эквивалент» относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
В одном атоме, одной молекуле или формульной единице вещества (В) может содержаться Z эквивалентов этого вещества. Число Z называют эквивалентным числом (или показателем эквивалентности). Обратная величина этого числа называется фактором эквивалентности. Фактор эквивалентности (f) - доля частицы, составляющая эквивалент.
Относительная масса эквивалента называется эквивалентной массой, а масса одного моля эквивалентов, выраженная в граммах, называется молярной эквивалентной массой; она обозначается Мэк, единица измерения – моль эк/г, она численно равна относительной молекулярной массе эквивалента.
Пример 5. Определить эквивалент, эквивалентную массу и молярную массу эквивалента кислорода в молекуле воды.
Решение. Такая формулировка вопроса предполагает реакцию образования воды из кислорода и водорода h3 + ½O2 = Н2О, в которой с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Атомная масса кислорода равна 16. Эквивалентом кислорода является ½ его атома, эквивалентная масса равна 8, а молярная масса эквивалента равна 8 г/ моль.
Эквиваленты одних и тех же элементов в различных химических соединениях могут различаться, т.к. величина эквивалента зависит от характера превращения, претерпеваемого им. Так, в соединении SO2 эквивалентная масса серы равна 8 г/моль, что составляет 1/4 от атомной массы, а в соединении SO3 - 5,3 г/моль, что составляет 1/6 от атомной массы серы. Эквивалентное число серы в этих оксидах равно 4 и 6, т.е. оно равно степени окисления (стехиометрической валентности) серы в этих соединениях. Таким образом, относительная эквивалентная масса и численно равная ей молярная масса элемента в соединении вычисляется по формуле:
Мэк (элемента)= 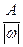 , (1.7)
, (1.7)
где А - атомная масса, w - степень окисления элемента в данном соединении.
Например, Z(Mn) в соединении KMnO4 составляет 7(w = +7), а Мэк (Mn)= 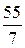 = 7,85 г/моль; в соединении Mn2O3 Z = 3 и поэтому Мэк (Mn)=
= 7,85 г/моль; в соединении Mn2O3 Z = 3 и поэтому Мэк (Mn)= 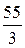 = 18,3 г/моль.
= 18,3 г/моль.
Эквивалентная масса вещества имеет различные значения в зависимости от того, в какой химической реакции участвует это вещество. При расчете эквивалентных масс можно пользоваться следующими правилами и формулами.
1. Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
Мэк кислоты = 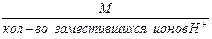
2. Эквивалентная масса основания в реакции замещения гидроксид-ионов равна:
Мэк основания = 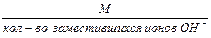
Пример 6. Определить эквивалентную массу h3SO4 в реакциях:
1) h3SO4 + KOH = KHSO4 + h3O
2) h3SO4 + 2KOH = K2SO4 + 2h3O
Решение.В реакции 1 замещён один ион водорода, следовательно, эквивалентное число серной кислоты Z(h3SO4) = 1, Мэк(h3SO4) = 98 г/моль эк. В реакции 2 заместились оба иона водорода, следовательно, эквивалентное число Z(h3SO4) = 2, а Mэк(h3SO4) = 49 г/моль эк.
Пример 7. Определить эквивалентную массу гидроксида висмута в реакциях:
1) Bi(OH)3 + HCl = Bi(OH)2Cl + h3O
2) Bi(OH)3 + 3HCl = BiCl3 + h3O
Решение.1)Z(Bi(OH)3) = 1, а Mэк(Bi(OH)3) = 260 г/моль эк, т.к. из трех гидроксид-ионов заместился один; 2) Z(Bi(OH)3) = 3, a Mэк(Bi(OH)3) = 260:3 = 86,3 г/моль эк, т.к. заместились все три иона ОН-).
3. Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Мэк. соли = 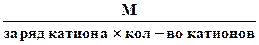
или Мэк соли = 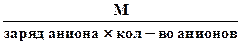
Например. в сульфате алюминия Al2(SO4)3 произведение заряда катиона на их число равно 3×2 = 6. Но эквивалентное число соединения в реакции может быть меньше (неполное замещение катионов) или больше (комплексообразование). Если, например, это соединение участвует во взаимодействии
Al2(SO4)3 + 12KOH = 2K3[Al(OH)6] + 3K2SO4,
то при этом три сульфат-аниона с суммарным зарядом 6 замещаются двенадцатью гидроксид-ионами ОН-, следовательно, в этой реакции Z(Al2(SO4)3) = 12.
4. Эквивалентная масса оксида в реакциях полного замещения равна
Мэк оксида = 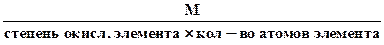
Например, Z(Fe2O3) = 3×2 = 6, Мэк = М(Fe2O3) = 160:6 = 26,6 г/моль эк. Но в реакции
Fe2O3 + 4HCl = 2FeOHCl2 + h3O
Z(Fe2O3) = 4, Мэк(Fe2O3) = 160:4 = 40 г/моль эк, т.к. одна формульная единица Fe2O3 взаимодействует с четырьмя эквивалентами HCl.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 л/моль эк (так как Мэк(Н) = 1 г/моль эк), а для кислорода – 5,6 л/моль эк (так как Мэк(О) = 8 г/моль эк).
Пример 8. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов, массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
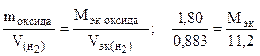
Отсюда
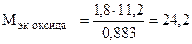 (г/моль),
(г/моль), 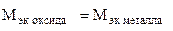 +
+ 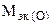 ,
,
следовательно
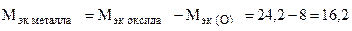 г/моль эк.
г/моль эк.
Пример 9. Вычислить эквивалентную массу цинка, если 1,168 г этого металла вытеснили из кислоты 438 мл Н2 (Т = 17 °С и Р = 750 мм рт. ст.).
Решение. 1) По уравнению Клапейрона–Менделеева вычисляем массу водорода:
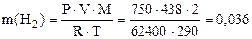 г
г
Согласно закону эквивалентов
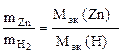 ,
,
следовательно
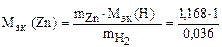 = 32,6 г/моль эк.
= 32,6 г/моль эк.
Похожие статьи:
poznayka.org
Химический эквивалент. Расчетные задачи
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТ
(ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
В.К.Камышова, И.Л.Волчкова
Методическое пособие для студентов 1-го курса всех направлений
Москва Издательство МЭИ 2010
ВВЕДЕНИЕ
К началу XIX века произошел резкий прорыв в изучении количественных методов исследования веществ, что привело к новому фундаментальному изменению в естествознании вообще и в химии в частности.
Резкий прорыв в изучении количественных методов исследования веществ в началу XIX века привел к новому фундаментальному изменению в естествознании вообще и в химии в частности.
После открытия Лавуазье закона сохранения массы последовал целый ряд новых количественных закономерностей – стехиометрических законов.
 Первым стехиометрическим законом стал закон эквивалентов, который сформулировал немецкий химик Иеремия Вениамин Рихтер в результате проведенных им в 1791-1798 г.г. опытов по изучению количеств веществ в реакциях нейтрализации и обмена, обобщенных в работе «Начальные основания стехиометрии или искусства измерения химических элементов». Первоначальная формулировка закона эквивалентов (термин «эквивалент» ввел в 1767 г. Г.Кевендиш) была следующей: «Если одно и то же количество какой либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты».
Первым стехиометрическим законом стал закон эквивалентов, который сформулировал немецкий химик Иеремия Вениамин Рихтер в результате проведенных им в 1791-1798 г.г. опытов по изучению количеств веществ в реакциях нейтрализации и обмена, обобщенных в работе «Начальные основания стехиометрии или искусства измерения химических элементов». Первоначальная формулировка закона эквивалентов (термин «эквивалент» ввел в 1767 г. Г.Кевендиш) была следующей: «Если одно и то же количество какой либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты».
Открытый В.Рихтером закон подтвердил убеждения многих химиков в том, что химические соединения взаимодействуют не в произвольных, а в строго определенных количественных соотношениях.
Теоретическая часть
Понятие «химический эквивалент»
Химическим эквивалентом (Э(В)) (по рекомендациям ИЮПАК) называется условная или реальная частица, равная или в целое число раз меньшая соответствующей ей формульной единице*:
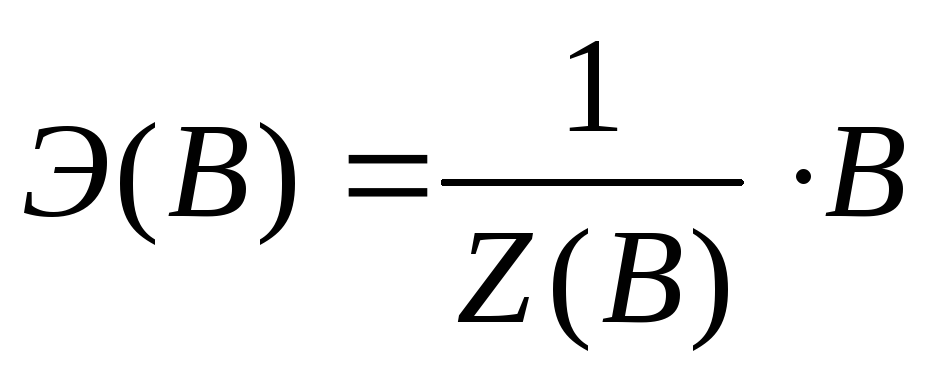
где В – формульная единица вещества: реально существующая частица, такая как атом (Cu, Na, C), молекула (N2, HCl, KOH, Al2(SO4)3, CO2), анионы (OH-, SO42-), катионы (Cu 2+, K+), радикалы (-NО2, С2Н5-), условные молекулы кристаллических веществ и полимеров, любые другие частицы вещества;
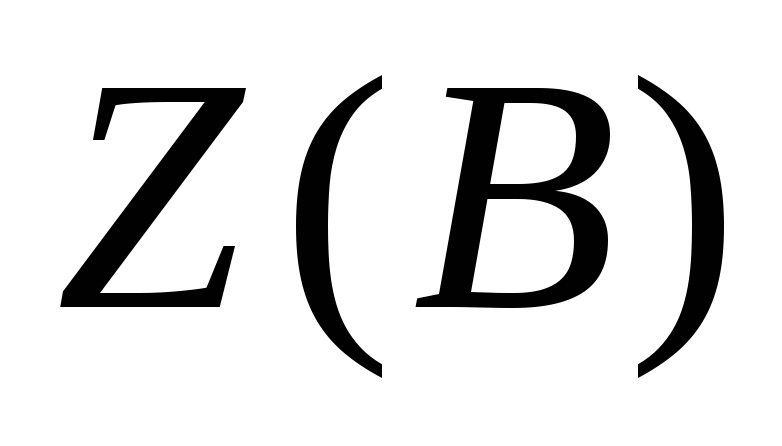 - эквивалентное число, показывающее какое число эквивалентов вещества В условно содержится в данной формульной единице этого вещества;
- эквивалентное число, показывающее какое число эквивалентов вещества В условно содержится в данной формульной единице этого вещества;
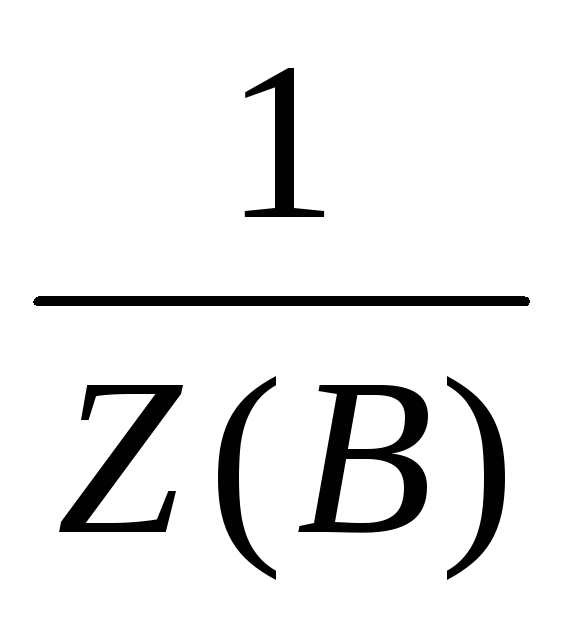 = fэкв. - фактор эквивалентности.
= fэкв. - фактор эквивалентности.
Использование фактора эквивалентности как дробной величины менее удобно.
Эквивалентное число Z всегда больше или равно 1 и является безразмерной величиной; при Z=1 эквивалент соответствует формульной единице вещества.
Расчет эквивалентного числа различных формульных единиц представлен в таблице 1.1.
Величины эквивалентного числа, а, следовательно, и эквивалента зависят от химической реакции, в которой участвует данное вещество.
* ранее под химическим эквивалентом понимали количество вещества, которое присоединяет или замещает 1 моль атомов водорода в ходе реакции. Однако это понятие относится не к самому эквиваленту, а к количеству вещества эквивалента.
В обменных реакциях, например, в реакции нейтрализации фосфорной кислоты, эквивалентное число (эквивалент) кислоты меняется в зависимости от полноты протекания реакции:
для реакции h4PO4 + 3KOH → K3PO4 + 3h3O эквивалентное число Z(h4PO4)= =n(Н+)=3, т.к. в реакции участвуют три иона Н+ фосфорной кислоты, и эквивалентом h4PO4 будет являться условная частица 1/3h4PO4 (Э (h4PO4)= 1/3h4PO4).
Таблица 1.1. Расчет эквивалентного числа Z вещества.
| частица | эквивалентное число Z | Пример |
| Элемент | Z(Э) = В(Э), где В(Э) – валентность элемента | Z(S)h3SO4 = 6 Z(C)CO2 = 4 |
| Простое вещество | Z(в-ва) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z(O2) = 2∙2=4 Z(Cl2) = 2∙1=2 |
| Оксид | Z(Э2Ох) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z(Н2О) = 2∙1=2 Z(SО2) = 1∙4=4 Z(Al2О3) = 2∙3=6 |
| Кислота | Z(к-ты) = n(Н+), где n(Н+) – число отданных в ходе реакции ионов Н+ (основность кислоты) | Z(Н2SО4) = 1 – основность равна 1 Z(Н2SО4) = 2 – основность равна 2 |
| Основание | Z(осн-я) = n(ОН-), где n(ОН-) – число отданных в ходе реакции гидроксид ионов ОН- (кислотность основания) | Z(Са(ОН)2 = 1 – кислотность равна 1 Z(Са(ОН)2) =2 – кислотность равна 2 |
| Соль | Z(соли) = n(Ме)∙В(Ме) = n(А)∙В(А), где n(Ме), В(Ме) – число атомов металла и его валентность n(А), В(А) – число кислотных остатков и их валентность | Z(Na2SО4) = 2∙1=1∙2=2 Z(Al2(CO3)3) = 2∙3=3∙2=6 |
| Частица в ОВР | Z(частицы) = nе, где n е – число электронов, участвующих в процессе, на одну формульную единицу | SO42-+2H++ +2e→SO32-+h3O Z(SО42-)=2, Z(H+)=1 2Cl- - 2e→Cl2 Z(Cl-)=1, Z(Cl2)=2 |
| ион | Z(иона) = n, где n– заряд иона | Z(SО42-) = 2 |
В реакции h4PO4 + KOH → KН2PO4 + h3O замещается только один ион водорода Н+ и поэтому Z(h4PO4)=1, а эквивалентом кислоты является частица h4PO4 (Э(h4PO4)= 1h4PO4).
Эквивалентное число (эквивалент) элемента также может меняться в зависимости от вида соединения, в состав которого он входит. Например, в оксиде Cr2O3 эквивалентное число хрома Z(Cr)=3 и, следовательно, эквивалентом хрома является условная частица 1/3Cr, а в хромовой кислоте Н2CrО3 эквивалентное число хрома Z(Cr)=6, а эквивалент Э(Cr)=1/6Cr.
В обменных реакциях эквивалентное число (эквивалент) определяется стехиометрией реакции. Например,
Cr2(SO4)3 + 12KOH → 2K3[Cr(OH)6] + 3K2SO4
на одну формульную единицу Cr2(SO4)3 затрачивается 12 формульных единиц КОН. Следовательно, эквивалентное число Z(Cr2(SO4)3)=12, а Z(КОН)=1. Эквивалентом Cr2(SO4)3 будет являться условная частица 1/12 Cr2(SO4)3, а Э(КОН)=1КОН.
Для установления значений эквивалентных чисел Z(В) по уравнениям реакций обмена достаточно найти наименьшее общее кратное всех стехиометрических коэффициентов в уравнении реакции и разделить их на него. В рассматриваемом выше уравнении наименьшее общее кратное равно 12:
1/12Cr2(SO4)3 + KOH → 1/6K3[Cr(OH)6] + 1/4K2SO4
Для данной реакции эквивалентные числа равны: Z(Cr2(SO4)3)=12, Z(КОН)=1, Z(K3[Cr(OH)6])=6, а Z(K2SO4)=4.
В окислительно-восстановительных реакциях эквивалентные числа окислителя и восстановителя определяются числом электронов, которое принимает одна формульная единица окислителя или отдает одна формульная единица восстановителя.
Для окислительно-восстановительной реакции
K
 2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7h3O
2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7h3O
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7h3O 6 1
2Cl- - 2e → Cl2 3
Эквивалентные числа определяют по числу электронов, участвующих в соответствующих полуреакциях, в расчете на одну формульную единицу Cr2O72-, Cr3+, Cl-, Cl2, то есть Z(Cr2O72-)=6, Z(Cr3+)=3, Z(Cl-)=1, Z(Cl2)=2. Соответственно эквивалентные числа веществ также будут равны: Z(К2Cr2O7)=6, Z(Cr Cl3)=3, Z(НCl)=1.
studfiles.net
Определение эквивалента и эквивалентной массы металла по водороду
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть.
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами.
Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль- это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02 .1023). Например: 3 .1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль. Эквивалентом элемента называется такое его количество, которое соединяется 1с молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВг, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах, эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ, пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
 (1)
(1)
где: m, (V) - массы (объемы) реагирующих веществ;
Э, (Vэкв.) - эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
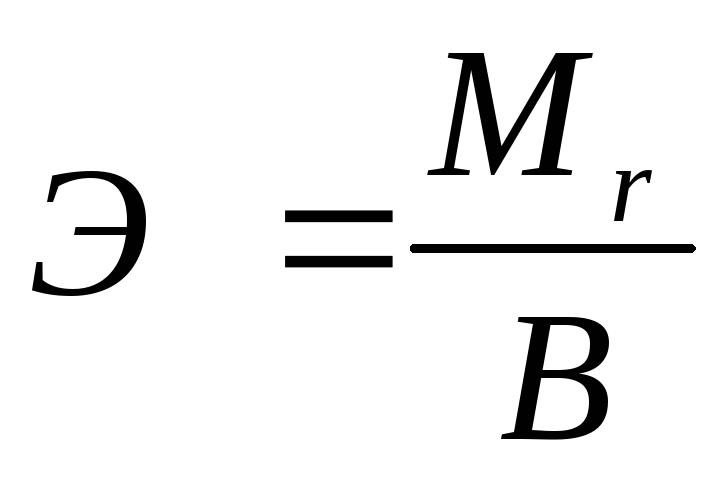
где  - мольная масса атома элемента,
- мольная масса атома элемента,
В - валентность элемента.
Так, например, эквивалентные массы водорода и кислорода соответственно равны:
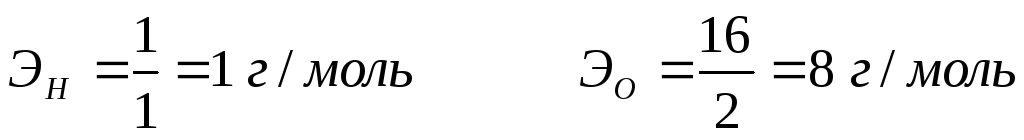
Эквивалентный объем газа можно вычислить по формуле:
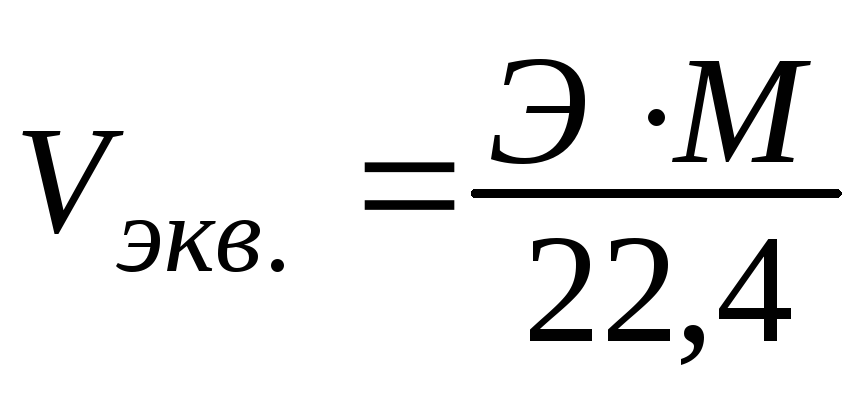
Так, например, эквивалентные объемы водорода и кислорода соответственно равны:

Эквивалентные массы сложных веществ можно вычислить по формулам:
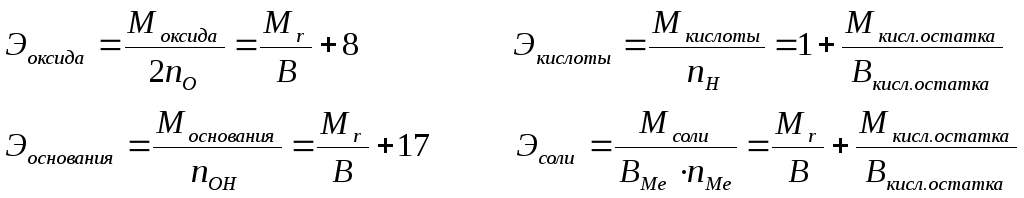 (2)
(2)
nO, nOH, nH, nMe– число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли; В – валентность, 8 – эквивалентная масса кислорода, 1 – эквивалентная масса водорода, 17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:

Затем по формуле (1) определяют эквивалентную массу.
Рисунок и описание прибора для определения эквивалента металла
Рис.1.1
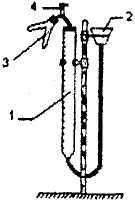
Прибор состоит из бюретки 1, соединенной резиновыми трубками с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.
Реактивы и посуда.
Прибор для определения эквивалента металла (рис.1.1), барометр, термометр, мерный цилиндр емкостью 10 мл, воронка, 10 % - ный раствор соляной кислоты, металлический магний.
Практическая часть
1. В одно колено пробирки 3 внесите магний, а в другое колено пробирки через воронку налейте около 12мл 10%- ного раствора соляной кислоты. Наденьте двухколенную пробирку на пробку, соединенную резиновой трубкой с бюреткой.
2. Необходимым условием протекания опыта является герметичность всей системы, поэтому проверьте прибор на герметичность. Для этого воронку 2 опустите или поднимите на 25-30 см и держите на одном уровне 1 -2 минуты. Если уровень воды в бюретке 1 не изменится за это время, то прибор герметичен. Если же уровень воды в бюретке будет снижаться или подниматься до уровня воды в воронке, то вращательными движениями добейтесь плотного прилегания всех пробок и снова проверьте герметичность прибора.
3. Убедившись в герметичности прибора, отметьте уровень воды в бюретке 1, а затем постепенно (первая порция кислоты должна быть небольшой во избежание бурного выделения газа) наклоните двухколенную пробирку так, чтобы кислота перелилась в колено с магнием.
4. По окончании реакции подождите 1 минуту, пока газ примет температуру помещения и измерьте объем водорода, вытесненного магнием. Для этого установите воронку на такой высоте, чтобы вода в воронке и бюретке была на одном уровне, то есть газ находился при атмосферном давлении. Деление бюретки, против которого установится уровень воды, будет соответствовать объему выделившегося водорода при условиях проведения опыта. ( Если в начале опыта уровень воды находился не на нулевой отметке, то из конечного показания уровня воды надо вычесть число, соответствующее начальному уровню воды). В таблицу 1.1 запишите значения указанных в ней величин.
Таблица 1.1 Параметры для расчета эквивалента металла.
| m, г | P, Па | Т, К | V , мл | Р0, Па | Т0, К | V0, мл | h, Па |
Определите давление Р по барометру и температуру Т по термометру.
Давление насыщенного водяного пара h, соответствующее температуре опыта Т, выпишите из следующей таблицы:
Таблица 1.2 Давление насыщенного водяного пара при различных температурах
| Т, К | h, Па |
| 293 | 2300 |
| 294 | 2500 |
| 295 | 2700 |
| 296 | 2900 |
| 297 | 3100 |
| 298 | 3300 |
| 299 | 3500 |
| 300 | 3700 |
Р0 - давление при нормальных условиях, равное 101325 Па;
Т0 - температура при нормальных условиях, равная 273 К.
Расчет
Напишите уравнение реакции магния с соляной кислотой.
Измеренный объем водорода V приведите к нормальным условиям по уравнению Клапейрона (3):
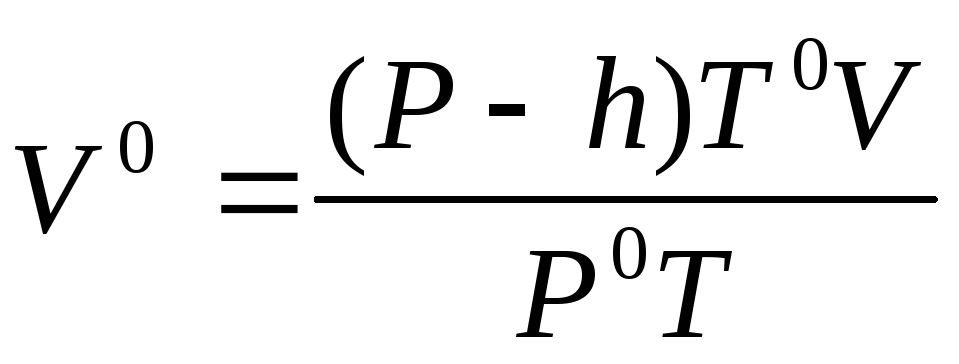
Из математического выражения (1) закона эквивалентов определите эквивалентную массу магния:
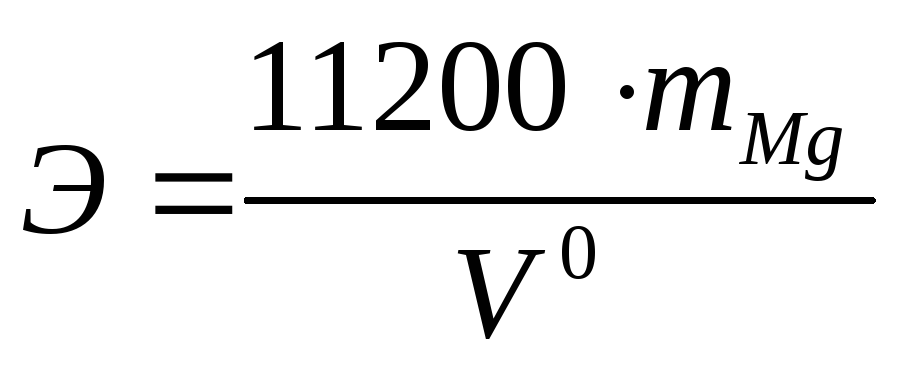
Определите теоретическое значение эквивалентной массы магния по формуле:
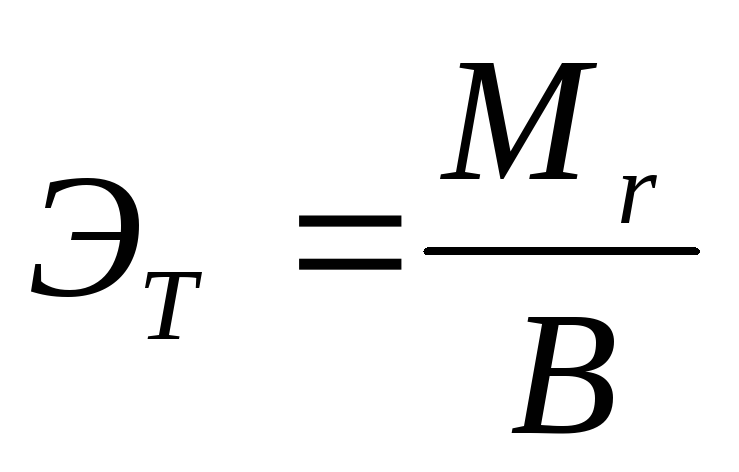
где 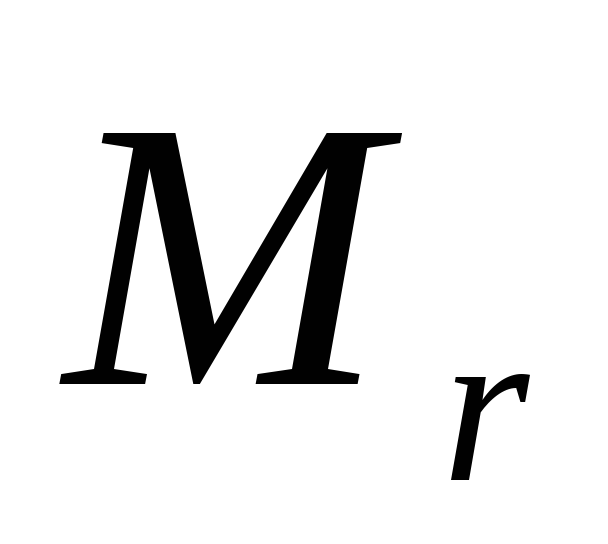 - мольная масса металла, В валентность металла.
- мольная масса металла, В валентность металла.
Сравните полученное практическое значение эквивалентной массы Э магния с теоретическим значением Эт.
Рассчитайте процент относительной ошибки опыта по формуле:
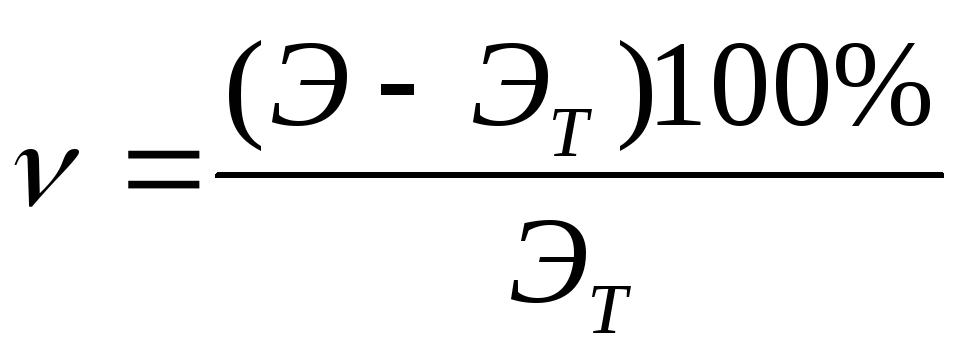
Указания по технике безопасности
Необходимым условием протекания опыта является герметичность всей системы. Она в основном определяется тем, насколько плотно прилегают пробки к двухколенной пробирке и бюретке. При проверке герметичности прибора во избежание порезов рук стеклом, которые могут возникнуть при чрезмерном нажиме пробки на стекло, необходимо двухколенную пробирку, пробку и бюретку держать полотенцем.
Лабораторная работа №2
studfiles.net
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
h4PO4 + 2KOH ® K2HPO4 + 2h3O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом h4PO4 будет являться условная частица 1/2h4PO4, т.к. если одна молекула h4PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы h4PO4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
|
fЭ (формульная единица вещества) º эквивалент |
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между h4PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
h4PO4 + 3KOH ® K3PO4 + 3h3O fЭ(h4PO4) = 1/3
h4PO4 + KOH ® KН2PO4 + h3O fЭ(h4PO4) = 1.
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
|
Частица |
Фактор эквивалентности |
Примеры |
|
Элемент |
где В(Э) – валентность элемента |
|
|
Простое вещество |
где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента |
fЭ(h3) = 1/(2×1) = 1/2; fЭ(O2) = 1/(2×2) = 1/4; fЭ(Cl2) = 1/(2×1) = 1/2; fЭ(O3) = 1/(3×2) = 1/6 |
|
Оксид |
где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента |
fЭ(Cr2O3) = 1/(2×3) = 1/6; fЭ(CrO) = 1/(1×2) = 1/2; fЭ(h3O) = 1/(2×1) = 1/2; fЭ(P2O5) = 1/(2×5) = 1/10 |
|
Кислота |
где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты) |
fЭ(h3SO4) = 1/1 = 1 (основность равна 1) или fЭ(h3SO4) = 1/2 (основность равна 2) |
|
Основание |
где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) |
fЭ(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или fЭ(Cu(OH)2) = 1/2 (кислотность равна 2) |
|
Соль |
где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка |
fЭ(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку)
|
|
Частица в окислительно-восстановительных реакциях |
где |
Fe2+
+ 2 fЭ(Fe2+) =1/2;
MnO4–
+ 8H+ + 5 fЭ(MnO4–) = 1/5 |
|
Ион |
где z – заряд иона |
fЭ(SO42–) = 1/2 |
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl2 (средняя соль):
 .
.
fЭ(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2.
б) КНСО3 (кислая соль):
 .
.
fЭ(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4 (основная соль):
 .
.
fЭ( (MgOH)2SO4 ) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
|
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8 МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка) МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17 МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка). |
Газообразные вещества помимо молярной массы эквивалента имеют
молярный объем эквивалента ( или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
|
|
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
|
nэ(реагента1) = … = nэ(реагентаn) = nэ(продукта1) = … = nэ(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
где m1 и m2 – массы реагентов и (или) продуктов реакции, г;
 ,
,  –
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
–
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
V1, V2 – объемы реагентов и (или) продуктов реакции, л;
 ,
, –
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
–
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
Л.А. Яковишин
www.sev-chem.narod.ru
Закон эквивалентов
В Большом толковом словаре слово эквивалент (на латинском звучит, как aequivalens) объясняется, как что-то равноценное, равносильное или равнозначащее другому, что сможет его вполне заменить. В химии закон эквивалентов (используется с конца 18 столетия, его изучают в школе, применяют химики и биологи разных стран в теории и на практике) устанавливает, что все химические вещества вступают в реакции в количествах, пропорциональных их эквивалентам. Открыт закон был немецким химиком И. В. Рихтером, труды которого долгое время были неизвестны. В своей трехтомной работе, опубликованной в период с 1792 по 1794 годы под названием «Начала стехиометрии, или способ измерения химических элементов», ученый показал, что химические вещества вступают в реакции в строгом соотношении. Им же был введен такой термин, как «стехиометрия». Сейчас это целый раздел химии, который описывает соотношение реагентов, вступающих в химическое взаимодействие.
Рихтер первым в своих работах привел количественные уравнения реакций. Они представляют собой условную запись, содержащую качественную и количественную информацию о процессах, происходящих при взаимодействии разных химических веществ, называемых реагентами. Еще во времена алхимической науки для обозначения простых элементов ученые пользовались различными символами, позже были открыты формулы сложных (состоящих из нескольких элементов) химических веществ. Но только И. В. Рихтер (под влиянием своего учителя и философа Иммануила Канта, утверждавшего, что отдельные направления естественных наук содержат столько истинной науки, сколько в ней есть математики) использовал в диссертации химические формулы и понятие «стехиометрия», описал количественные уравнения реакции и открыл Закон эквивалентов. Формула, его выражающая может быть записана: Э2 • m1 = Э1 • m2. Где m1 и m2 — это массы веществ «1» и «2», вступивших в реакцию, а Э1 и Э2 — это их химические эквиваленты.
Чтобы понять Закон эквивалентов, необходимо уточнить, что эквивалент — это условное или реальное количество вещества, которое может присоединить катион водорода в кислотно-щелочных реакциях или электрон в результате окислительно-восстановительных реакций. Эквивалентная масса — это масса одного эквивалента. Считается, что 1 эквивалент вещества реагирует (или вытесняет) с 1 граммом водорода или с 8 граммами кислорода, или 35,5 граммами хлора. На практике количество вещества в эквиваленте часто имеет очень малую величину, поэтому его принято выражать в молях. В 1 моле содержится постоянное количество частиц (атомов, ионов или молекул), оно равно числу Авагадро: NA = 6,02214179(30)·1023. Масса одного моля вещества, выраженная в граммах, численно равняется его массе в атомных единицах массы.
Опираясь на Закон эквивалентов, можно утверждать, что при кислотно-щелочном титровании, протекающем по уравнению реакции: KOH + HCl → KCl + h3O, в результате взаимодействия 1 моля гидроокиси калия с 1 молем соляной кислоты, получается 1 моль соли, называемой хлористый калий, и 1 моль воды. То есть эквивалентная масса гидроокиси калия равняется Э KOH = 39 + 16 + 1 = 56 г, соляной кислоты — Э HCl = 1 + 35 = 36 г, хлорида калия — Э KCl = 39 + 35 = 74 г, воды — Э h3O = 1 • 2 + 16 = 18 г. Для того чтобы полностью нейтрализовать 56 г гидроокиси калия, необходимо 36 г соляной кислоты. В результате получится 74 г хлорида калия и 18 г воды. Но так как законом установлено, что массы веществ, вступивших в реакцию пропорциональны их эквивалентам, то зная количество одного реагента можно посчитать, сколько вступит в реакцию второго реагента или рассчитать выход продукта.
Например, сколько получится хлорида калия, если известно, что соляной кислотой было полностью нейтрализовано 100 г гидроокиси калия? Используя закон эквивалентов, можно записать: 56 • mKCl = 74 • 100. Тогда mKCl = (74 • 100) / 56 = 132 г. А соляной кислоты для нейтрализации 100 гидроокиси калия потребуется 64 г. Если 100 г гидроокись калия нейтрализовать серной кислотой: 2KOH + h3SO4 → K2SO4 + 2h3O, то для этого потребуется совсем другое количество кислоты. Как указывают стехиометрические коэффициенты этой реакции, с 2 молями гидроокиси калия прореагирует 1 моль серной кислоты, а в результате получится 1 моль сернокислого калия и 2 моля воды. Зная, что массы прореагировавших веществ пропорциональны эквивалентным массам, можно записать: 2 •56 • mh3SO4 = 98 • 100, тогда для нейтрализации 100 гидроокиси калия потребуется mh3SO4 = 88 г серной кислоты. При этом образуется 155 г сульфата калия. Количество воды, выделенное в результате нейтрализации 100 г гидроокиси калия соляной или серной кислотами, будет одинаково и равняться 32 г.
Применяет Закон эквивалентов химия (аналитическая, неорганическая, органическая и прочее) для исследования веществ и других экспериментов, основанных на расчете баланса химических реакций. Кроме того, он используется (для составления материальных балансов) при проектировании и эксплуатации лабораторных, опытных или промышленных установок, предназначенных для синтеза химических веществ. Им постоянно пользуются специалисты химических, медицинских, биологических, санитарно-эпидемиологических лабораторий, так как он лежит в основе формул, с помощью которых осуществляется расчет многих результатов анализов.
fb.ru
Как определить эквивалент вещества | Сделай все сам.
Эквивалент вещества – это условная либо настоящая частица, которая может высвобождать, присоединять либо любым иным методом быть равнозначна катиону водорода, участвующему в ионно-обменных реакциях, либо электрону в окислительно-восстановительных реакциях. При решении задач под эквивалентом вещества подразумевают равнозначную молярную массу вещества .

Вам понадобится
- — молярная масса;
- — валентность;
- — кислотность;
- — основность.
Инструкция
1. Эквивалент ная масса является одной из важнейших колляций веществ. При решении задач она обозначается как M экв. Определяется молярная масса эквивалента какого-нибудь соединения, исходя из химической формулы исследуемого вещества и его принадлежности к определенному классу химических соединений.
2. Для того дабы удачно находить молярные массы эквивалентов, вам понадобится знать такие показатели, как молярная масса – масса одного моля вещества . Основность кислоты – число атомов водорода, которое кислота может присоединить. Кислотность основания определяется числом ионов OH-. Валентность – число химических связей, которое образует атом с другими элементами в соединении.
3. Формула нахождения равнозначной массы вещества зависит от того, к какому классу относится исследуемое соединение. К примеру, для нахождения эквивалента вещества у оксидов, вам будет нужно поделить молярную массу соединения на число атомов кислорода, заранее умноженное на два. К примеру, для оксида железа Fe2O3 равнозначная масса будет равняться 56*2 + 16*3/3*2 = 26,7 г/моль.
4. Для нахождения молярной массы эквивалента вещества у основания, поделите молярную массу основания на его кислотность. Так, для основания Ca(OH)2 эквивалент будет равняться 40 + (16+2)*2/2 = 37 г/моль.
5. Дабы обнаружить эквивалент вещества для кислоты, вам будет нужно сделать следующее действие: поделите молярную массу кислоты на ее основность. Для нахождения молярной массы эквивалента вещества серной кислоты h3SO4 поделите 1*2 + 32 + 16*4/2 = 49 г/моль.
6. Наконец, для нахождения эквивалента вещества соли поделите молярную массу вещества на число атомов металла, помноженное на его валентность. К примеру, молярная масса эквивалента вещества соли Al2(SO4)3 = 27*2 + (32 + 16*4)*3/1*2 = 171 г/моль.
Вначале определите химический состав и агрегатное состояние вещества. Если изучается газ, измерьте его температуру, объем и давление либо разместите в типичные данные и измерьте только объем. Позже этого рассчитайте количество молекул и атомов . Для определения числа атомов в твердом теле либо жидкости обнаружьте их массу и молярную массу, а после этого количество молекул и атомов .

Вам понадобится
- манометр, термометр, весы и таблица Менделеева, узнать непрерывную Авогадро.
Инструкция
1. Определение числа атомов в газеС подмогой манометра и термометра измерьте давление в Паскалях и температуру газа в Кельвинах. После этого геометрически определите объем газа в помещении либо посудине в кубических метрах. Позже этого перемножьте значения давления и объема и поделите на числовое значение температуры и число 8,31. Полученный итог умножьте на непрерывную Авогадро, которая равна 6,022*10^23.Если температура газа составляет 273,15 Кельвин (00С), а давление 760 мм.рт.ст., что является типичными условиями, довольно измерить объем газа, в котором определяется количество частиц в кубических метрах, поделить его на число 0,224 и умножить на 6,022*10^23. При обоих методах, если молекула газа многоатомная, умножьте полученное число на количество атомов в молекулах.
2. Определение числа атомов в твердом теле либо жидкости из чистого веществаНайдите массу исследуемого тела в граммах. Позже этого в таблице Менделеева обнаружьте молекулярную массу данного чистого вещества, которая будет равна его молярной массе, выраженной в граммах на моль. После этого значение массы поделите на молярную массу и умножьте на 6,022*10^23.
3. Число атомов в веществе с многоатомными молекуламиУзнайте химическую формулу вещества. После этого измерьте его массу в граммах. С подмогой таблицы Менделеева узнайте молярную массу всякого из элементов, которые входят в конструкцию молекулы исследуемого вещества. Скажем, для поваренной соли это натрий и хлор. Если в формуле не один атом одного элемента, умножьте молярную массу на их количество . Позже этого сложите все получившиеся массы – получите молярную массу данного вещества. Поделите массу вещества на его молярную массу и умножьте на 6,022*10^23. Полученное число умножьте на всеобщее число атомов в молекуле.
4. Определение числа атомов в смеси веществЕсли есть смесь, раствор либо расплав нескольких веществ, то узнайте их массовые доли в нем. После этого обнаружьте массы этих веществ. Скажем, в 10 % растворе поваренной соли содержится еще 90 % воды. Обнаружьте массу раствора, позже чего эту массу умножьте на 0,1, дабы узнать массу поваренной соли и на 0,9, дабы узнать массу воды. Позже этого действуйте как в пункте для веществ с многоатомными молекулами, а итоги по соли и воде сложите.
Видео по теме
Соли – это химические вещества, состоящие из катиона, то есть позитивно заряженного иона, металла и негативно заряженного аниона – кислотного остатка. Типов солей много: типичные, кислые, основные, двойные, смешанные, гидратные, комплексные. Это зависит от составов катиона и аниона. Как дозволено определить основание соли?

Инструкция
1. Представим, у вас есть четыре идентичные емкости с жгучими растворами. Вы знаете, что это – растворы углекислого лития, углекислого натрия, углекислого калия и углекислого бария. Ваша задача: определить, какая соль содержится в всякой емкости.
2. Припомните физические и химические свойства соединений этих металлов. Литий, натрий, калий – щелочные металлы первой группы, их свойства дюже схожи, активность усиливается от лития к калию. Барий – щелочноземельный металл 2-й группы. Его углекислая соль отлично растворяется в жгучей воде, но дрянно растворяется в холодной. Стоп! Вот и первая вероятность сразу определить, в какой емкости содержится углекислый барий.
3. Охладите емкости, скажем, разместив их в сосуд со льдом. Три раствора останутся прозрачными, а четвертый стремительно помутнеет, начнет выпадать белый осадок. Вот в нем-то и находится соль бария. Отложите эту емкость в сторону.
4. Дозволено стремительно определить углекислый барий и иным методом. Поочередно отливайте немножко раствора в иную емкость с раствором какой-нибудь сернокислой соли (скажем, сульфата натрия). Только ионы бария, связываясь с сульфат-ионами, мигом образуют плотный белый осадок.
5. Выходит, углекислый барий вы определили. Но как вам различить соли 3 щелочных металлов? Это достаточно легко сделать, вам потребуются фарфоровые чашки для выпаривания и спиртовка.
6. Отлейте малое число всего раствора в отдельную фарфоровую чашку и выпарите воду на огне спиртовки. Образуются мелкие кристаллики. Внесите их в пламя спиртовки либо горелки Бунзена – с поддержкой стального пинцета, либо фарфоровой ложечки. Ваша задача – подметить цвет запылавшего «язычка» пламени. Если это соль лития – цвет будет ясно-красным. Натрий окрасит пламя в интенсивный желтый цвет, а калий – в пурпурно-фиолетовый. Кстати, если бы таким же образом испытали соль бария – цвет пламени должен был быть зеленым.
Полезный совет Один известный химик в молодости приблизительно так же разоблачил алчную хозяйку пансиона. Он посыпал остатки недоеденного блюда хлористым литием – веществом, безусловно безопасным в мелких числах. На дальнейший день за обедом ломтик мяса из поданного к столу блюда был сожжен перед спектроскопом – и жильцы пансиона увидели ясно-красную полосу. Хозяйка готовила еду из вчерашних остатков.
Эквивалентом какого-нибудь химического элемента именуется такое его число, которое вступает во взаимодействие с одним молем атомов водорода. Взаимодействие может заключаться в соединении с водородом, либо его вытеснении (в реакциях замещения). Молярной массой эквивалента элемента именуется, соответственно, масса одного моля эквивалента .

Инструкция
1. Дабы осознать, как вычислить массу эквивалента , разглядите пример. Щелочной металл литий вступил в соединение с водородом, образовав гидрид лития: LiH. Требуется обнаружить массу эквивалента этого металла.
2. Ядерная масса лития составляет 6,94 а.е.м. (ядерных единиц массы), водорода – 1,008 а.е.м. Для облегчения расчетов, немножко округлите эти величины и примите их за 7 и 1.
3. Выходит, какова же массовая доля (массовый процент) обоих компонентов в этом веществе? 7/8 = 0,875 либо 87,5% для лития, и 1/8 = 0,125 либо 12, 5% для водорода. Согласно закону эквивалентов, открытому немецким химиком И.В. Рихтером в конце 18-го столетия, все вещества реагируют друг с ином в равнозначном соотношении, следственно, в вашем определенном случае массовая доля водорода во столько же раз поменьше массовой доли лития, во сколько раз равнозначная масса лития огромнее равнозначной массы водорода. Следственно, вычислите: 0,875/0,125 = 7. Задача решена: равнозначная масса лития в его гидриде равна 7г/моль.
4. Сейчас разглядите такие данные. Представим, какой-то металл (Ме) подвергся реакции окисления. Она протекла всецело, из 30 г металла в результате получилось 56, 64 г его оксида. Какова же равнозначная масса этого металла?
5. Припомните, какова равнозначная масса (МЭ) кислорода. Его молекула двухатомная, следственно, МЭ = 8г/моль. Сколько кислорода содержится в образовавшемся оксиде? Вычитая из всеобщей массы оксида изначальную массу металла, получите: 56,64 – 30 = 26,64 г.
6. По тому же закону эквивалентов, равнозначная масса металла определяется как произведение равнозначной массы кислорода на величину дроби: масса металла/масса кислорода. То есть 8г/моль * 30/26,64. Произведя эти вычисления, вы получите результат: 9,009 г/моль либо округленно 9 г/моль. Вот такова равнозначная масса этого металла.
Видео по теме
Полезный совет Вы пользовались округленными величинами для убыстрения расчетов. Если по условиям задачи требуется высокая точность, к округлениям прибегать невозможно.
Эквивалентом именуется частица, которая химически равноценна (равнозначна) в кислотно-основных реакциях одному иону водорода, а в реакциях окислительно-восстановительного типа — одному электрону. Эквивалент выражается числом без размерности, тогда как равнозначная масса измеряется в г/моль.

Вам понадобится
- — калькулятор;
- — периодическая таблица
Инструкция
1. Дабы дозволено было обнаружить эквивалент того либо другого вещества, вы обязаны применять формулу: 1/z (какое-то вещество),где 1/z – фактор эквивалентности (fэ), то есть число, которое показывает, какая доля частицы вещества равноценна эквиваленту. Эта величина неизменно поменьше либо равна единице. Проще говоря, фактор эквивалентности – это некоторый показатель, тот, что записывается непринужденно перед формулой вещества при нахождении эквивалента. Скажем, вам нужно обнаружить эквивалент фосфорной кислоты при ее взаимодействии с гидроксидом натрия. Запишите уравнение реакции:2NaOH + h4PO4 = Na2HPO4 + 2h3OОтсюда видно, что на атомы натрия замещаются только два атома водорода, то есть кислота является двуосновной (в реакции участвуют 2 иона Н+). Таким образом, согласно определению, эквивалентом фосфорной кислоты будет условная частица ? h4PO4.
2. Учтите, что эквивалент одного и того же вещества изменяется в зависимости типа реакции, в которую это вещество вступает. Помимо того, эквивалент элемента находится в зависимости от вида соединения, в состав которого входит. Возьмите те же вещества, что и в предыдущем случае, но реакция пускай пойдет по-иному:3NaOH + h4PO4 = Na 3PO4 + 3h3O.Тут fэ(h4PO4) = 1/3, fэ(NaOH) =1. Следственно, эквивалент фосфорной кислоты — частица 1/3 h4PO4, а эквивалент щелочи равен единице.
3. Для удачного нахождения эквивалентов разных веществ вам нужно запомнить формулы для нахождения fэ в зависимости от типа химического соединения. Так для примитивных элементов fэ = 1/ валентность элемента. Пример: fэ ( h3SO4) = 1/6, а эквивалент серы в h3SO4 равен 6.Для солей — fэ = 1/n (мет.) — B(мет.) = 1/ n (к.о.) — B(к.о.), гдеn (мет.) – число атомов металла,B(мет.) – валентность металла,n (к.о.) – число кислотных остатков,B(к.о.) — валентность кислотного остатка и т.д.
4. Труднее находить эквивалент вещества в реакциях окислительно-восстановительного типа, потому что расчет вы будете вести по числу электронов, которые принимают участие в процессе поправления либо окисления. Дано задание обнаружить эквивалент гидроксида марганца в реакции: 2Mn(OH)2 + 12NaOH + 5Cl2 = 2NaMnO4 + 10NaCl + 8h3OИз уравнения видно, что марганец отдает 5 электронов и переходит из Mn +2 в Mn +7. Значит, фактор эквивалентности Mn(OH)2 – 1/5, а эквивалент гидроксида равен 5.
Полезный совет При расчете не забывайте о том, что эквивалентом может быть сама молекула либо же какая-либо иная единица вещества.
jprosto.ru
водяной эквивалент - это... Что такое водяной эквивалент?
водяной эквивалент adj1) electr. Wasserphantom
2) food.ind. Wasserwert
Универсальный русско-немецкий словарь. Академик.ру. 2011.
- водяной эжектор
- водяной экономайзер
Смотреть что такое "водяной эквивалент" в других словарях:
водяной эквивалент калориметра — vandeninis kalorimetro ekvivalentas statusas T sritis Standartizacija ir metrologija apibrėžtis Šilumos kiekis, padidinantis kalorimetro temperatūrą vienu laipsniu. atitikmenys: angl. water equivalent of calorimeter vok. Wasserwert des… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
водяной эквивалент калориметра — vandeninis kalorimetro ekvivalentas statusas T sritis chemija apibrėžtis Šilumos kiekis, pakeliantis kalorimetro temperatūrą vienu laipsniu. atitikmenys: angl. water equivalent of calorimeter rus. водяной эквивалент калориметра; постоянная… … Chemijos terminų aiškinamasis žodynas
водяной эквивалент калориметра — vandeninis kalorimetro ekvivalentas statusas T sritis fizika atitikmenys: angl. water equivalent of calorimeter vok. Wasserwert des Kalorimeters, m rus. водяной эквивалент калориметра, m pranc. équivalent en eau du calorimètre, m … Fizikos terminų žodynas
водяной эквивалент калориметра — постоянная калориметра … Cловарь химических синонимов I
водяной смерч — Морской эквивалент торнадо, но меньшей интенсивности и продолжительности, смерч, возникающий в небольшом, но интенсивном тропическом циклоне над океаном или большим озером, обычно в тропических или субтропических широтах … Словарь по географии
постоянная калориметра — водяной эквивалент калориметра … Cловарь химических синонимов I
Калориметрия — (физ. и хим.). К. назыв. собрание способов количественного определения тепла, выделившегося или поглощенного при разного рода физических или химических явлениях. В начале калориметрические исследования почти исключительно относились к определению … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
КАЛОРИМЕТРИЯ — (от лат. calor тепло и греч. metron мера), количественное определение тепла, выделившегося или поглощенного при различного рода физ. или хим. процессах. Со времени развития термохимии для выяснения хода и направления различных реакций стали… … Большая медицинская энциклопедия
Wasserwert des Kalorimeters — vandeninis kalorimetro ekvivalentas statusas T sritis Standartizacija ir metrologija apibrėžtis Šilumos kiekis, padidinantis kalorimetro temperatūrą vienu laipsniu. atitikmenys: angl. water equivalent of calorimeter vok. Wasserwert des… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
vandeninis kalorimetro ekvivalentas — statusas T sritis Standartizacija ir metrologija apibrėžtis Šilumos kiekis, padidinantis kalorimetro temperatūrą vienu laipsniu. atitikmenys: angl. water equivalent of calorimeter vok. Wasserwert des Kalorimeters, m rus. водяной эквивалент… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
water equivalent of calorimeter — vandeninis kalorimetro ekvivalentas statusas T sritis Standartizacija ir metrologija apibrėžtis Šilumos kiekis, padidinantis kalorimetro temperatūrą vienu laipsniu. atitikmenys: angl. water equivalent of calorimeter vok. Wasserwert des… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
universal_ru_de.academic.ru

 ,
,

 ,
, ,
, ,
, ,
, ,
, –
число электронов, участвующих в процессе окисления или
восстановления
–
число электронов, участвующих в процессе окисления или
восстановления ®
Fe0
®
Fe0 ,
,




















