Определение общей щелочности воды. Щелочность воды
ЩЕЛОЧНОСТЬ ВОДЫ - это... Что такое ЩЕЛОЧНОСТЬ ВОДЫ?
ЩЕЛОЧНОСТЬ ВОДЫ свойство, обусловленное наличием анионов слабых кислот, главным образом угольной кислоты. Эти анионы гидролизуются с образованием гидроксил-ионов, например: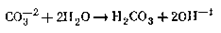
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат. Составитель: А. А. Маккавеев, редактор О. К. Ланге. 1961.
- ШУРФ
- ЩЕЛОЧНЫЕ ПАРЫ ВОДЫ
Смотреть что такое "ЩЕЛОЧНОСТЬ ВОДЫ" в других словарях:
Щелочность — Суммарная концентрация (С) гидроксил ионов в исследуемом растворе, обусловленная присутствием гидроксидов, карбонатов, бикарбонатов, фосфатов, силикатов, гуматов, выраженная в единицах молярной концентрации эквивалента кислоты С (1НСl) ммоль/дм3… … Словарь-справочник терминов нормативно-технической документации
щелочность А — 3.1 щелочность А: Показатель количественной оценки свойств водной среды реагировать с ионами водорода. Примечания 1 Щелочность воды является функцией концентрации гидрокарбоната, карбоната и гидроксида. Обычно акцепторы протона (X) не карбонатная … Словарь-справочник терминов нормативно-технической документации
щелочность, A — 3.1 щелочность, A (alkalinity, А): Показатель количественной оценки свойств водной среды реагировать с ионами водорода. Примечание Щелочность воды является функцией концентрации гидрокарбоната, карбоната и гидроксида. Обычно акцепторы протона (X) … Словарь-справочник терминов нормативно-технической документации
Щелочность морской воды — свойство морской воды, определяемое содержанием в ней анионов слабых кислот и катионов, эквивалентных этим кислотам. Численно равна количеству миллиграмм эквивалентов сильной кислоты, необходимому для нейтрализации 1 литра морской воды до… … Морской словарь
ВОДЫ ФРУКТОВЫЕ — и ягодные, газированные прохладительные напитки, обычно приготовляются из фруктовых и ягодных сиропов и чистой воды, насыщенной COs. Готовый сироп разливается в бутылки 40» (на бутылку емкостью в 240 куб. см берется 15 20 з сиропа), а затем … Большая медицинская энциклопедия
ЩЕЛОЧНОСТЬ морской воды — свойство морской воды, определяемое содержанием в ней анионов слабых кислот и катионов, эквивалентных этим кислотам. Общая Щелочность практически определяется двумя составляющими карбонатной Щелочностью, зависящей от суммарного содержания… … Морской энциклопедический справочник
Щелочность — Щёлочи гидроксиды щелочных и щёлочноземельных металлов. К щелочам относят растворимые в воде основания. При диссоциации щелочи образуют ионы OH и ион металла. К щелочам относятся гидроксиды металлов подгрупп Iа и IIа периодической системы,… … Википедия
АНАЛИЗ ВОДЫ — производится с целью выяснения качества воды и определения возможности использования ее для снабжения рыбоводных прудов. А. в. проводится четыре раза в год: весной (в период весеннего половодья), в середине лета (июль), осенью (в период осеннего… … Прудовое рыбоводство
МЕТОДЫ ГИДРОХИМИЧЕСКОГО АНАЛИЗА МОРСКОЙ ВОДЫ — химические и физико химические методы, используемые в океанологии для определения компонентов химического состава морской воды. При анализе проб морской воды устанавливают соленость, содержание растворенных газов (см. Газы) и биогенных элементов… … Морской энциклопедический справочник
свободная щелочность А р — 3.3 свободная щелочность А р: Щелочность, определяемая титрованием пробы воды до значения рН 8,3. Примечания 1 Свободная щелочность обусловлена содержанием в пробе воды гидроксид ионов и половины содержания карбонат ионов: Ар ≈ с (СО32 ) с… … Словарь-справочник терминов нормативно-технической документации
gidrogeology.academic.ru
Щелочность
15
Щелочностью называется содержание в воде веществ, вступающих в реакцию с сильными кислотами. К этим веществам относятся:
– сильные основания;
– слабые основания: аммиак, анилин, пиридин и т.п.;
– анионы слабых кислот: 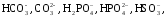
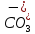
 , анионы гуминовых кислот.
, анионы гуминовых кислот.
Различают три формы щелочности: свободную, карбонатную и общую.
Свободная щелочность обусловлена гидроксильными и карбонатными ионами. Ее определяют количеством кислоты, идущей на титрование воды до pH 8,3.
Карбонатная щелочность зависит от наличия в воде только ионов угольной кислоты, т.е. карбонатных и гидрокарбонатных ионов, и определяется количеством кислоты, идущей на титрование воды до pH ≈ 4.
Общая щелочность обусловлена присутствием в воде анионов слабых кислот органического и неорганического происхождения, а также гидроксильных ионов.
В пресных незагрязненных водах карбонатная щелочность настолько велика по сравнению со щелочностью, вносимой другими анионами, что ее можно принимать равной общей щелочности.
Основным источником карбонатных и гидрокарбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, доломитов. Например,
СаСО3 + Н2О + СО2 ↔ Са2+ + 2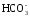 ;
;
МgCO3 + Н2О + СО2 ↔ Mg2+ + 2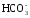 .
.
Некоторая часть гидрокарбонатных ионов появляется в результате метаморфизации продуктов химического выветривания изверженных пород:
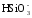 + CO2 →
+ CO2 → 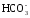 + SiO2;
+ SiO2;
OH– + CO2 → 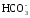 .
.
Значительные количества гидрокарбонатных ионов поступают с атмосферными осадками и грунтовыми водами.
Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние, образуя малорастворимые соединения с ионами кальция, могут выпадать в осадок:
Са(НСО3)2 → СаСО3↓ + Н2О + СО2;
Са2+ + 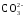 = СаСО3↓.
= СаСО3↓.
Этот процесс имеет очень важное значение в природе, поскольку от него зависит образование толщ карбонатных пород.
В поверхностных водах гидрокарбонатные и карбонатные ионы присутствуют главным образом в растворенном состоянии. Некоторая часть карбонатных ионов может находиться во взвешенном состоянии и близком к коллоидному состоянию в виде высокодисперсных частиц карбоната кальция.
В растворе между гидрокарбонатными и карбонатными ионами существует подвижное равновесие, определяемое константами диссоциации, характеризующими первую и вторую ступень диссоциации угольной кислоты
Н2СО3 ↔ Н+ + 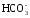 ↔ Н+ +
↔ Н+ + 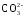 .
.
В речных водах содержание гидрокарбонатных ионов колеблется от 30 до 400 мг/дм3, в озерах – от 1 до 500 мг/дм3. Концентрация их в морских водах колеблется в более узких пределах от 100 до 200 мг/дм3, в атмосферных осадках она составляет 30 – 100 мг/дм3, в грунтовых водах − от 150 до 300 мг/дм3. В подземных водах их содержание заметно возрастает от 150 до 900 мг/дм3.
Щелочность является важной характеристикой поверхностных вод, по которой можно судить о важнейших гидрохимических и геохимических процессах, таких как формирование химического состава вод, эрозия земной поверхности, образование карбонатных пород и т.д.
В технике величина щелочности весьма существенна, поскольку от нее зависит коррозия бетона и выпадение карбонатной накипи в котлах, питающих различные паросиловые установки.
Для определения щелочности вод используют следующие методы: прямого титрования, обратного титрования и потенциометрические.
Методы прямого титрования основаны на титровании пробы воды сильной кислотой (НСl, h3SO4) в присутствии различных индикаторов, имеющих переход окраски в точке эквивалентности в области рН от 3 до 4. К ним относятся метиловый оранжевый, бромфеноловый синий, метиловый желтый. Недостатком этого наиболее простого и быстрого метода являются неопределенность значения рН в конечной точке титрования. Для определения свободной щелочности обычно используют фенолфталеин, имеющий интервал перехода рН и окраски индикатора 8,2 – 10,0.
Более точны методы обратного титрования, которые основаны на прибавлении к пробе воды избытка сильной кислоты и его титриметрическом определении в присутствии индикатора. Эти методы находят наибольшее распространение, однако при анализе вод с низкой величиной щелочности (менее 10 мг/дм3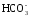 ), а также окрашенных и мутных вод, возможны значительные погрешности, составляющие до 20 %.
), а также окрашенных и мутных вод, возможны значительные погрешности, составляющие до 20 %.
В этих случаях предпочтительны различные варианты потенциометрических методов, в которых пробу исследуемой воды титруют сильной кислотой до определенного значения рН, определяемого с помощью рН-метра. На результаты не оказывают влияние следы активного хлора, мутность и окраска воды.
studfiles.net
Взаимосвязь pH, CO2, щелочности и жесткости в пруду
Качество воды в пруду изменяется под действием нескольких химических веществ. Концентрация углекислого газа, pH, щелочность и жесткость взаимосвязаны и оказывают серьезное влияние на продуктивность пруда, уровень стресса, здоровье рыб, количество доступного кислорода и токсичность аммония и некоторых металлов. Большинство характеристик воды не постоянны. Концентрация углекислого газа и pH подвержены ежедневным флуктуациям. Щелочность и жесткость относительно стабильны, однако могут меняться с течением времени, обычно в течение недель и месяцев. Их стабильность зависит от pH или минерального состава толщи воды и донной породы.
pH и углекислый газ
О том, является ли вода кислой или щелочной говорит водородный показатель – pH. Он обозначает концентрацию ионов водорода в воде и представляет собой её отрицательный десятичный логарифм — -log[H+]. Вода считается кислой, если pH ниже 7 единиц, и щелочной – если более 7. Значения pH, как правило, колеблются от 0 до 14 единиц. В аквакультуре диапазон кислотности составляет – 6.5-9.0.
Рыбы и другие позвоночные имеют кровь со значением pH 7.4. Кровь рыб находится в тесном контакте с водой (граница раздела – 1-2 клеточных слоя). В пруду рекомендуется поддерживать диапазон, близкий к pH крови рыб – 7.0-8.0. Если водородный показатель упадет ниже 5 единиц или поднимется выше 10 (т.е. низкая щелочность, вместе с активным фотосинтезом водорослей), рыба почувствует себя плохо и погибнет.
Значения pH в пруду варьируют в течение дня. Ночью концентрация растворенного кислорода снижается, потому что останавливается фотосинтез, растения и животные дышат и расходуют кислород. При плотной посадке концентрация углекислого газа становится высокой в результате дыхания. Свободный CO2 реагирует с водой, приводя к возникновению угольной кислоты (h3CO3), и pH снижается:
h3O + CO2 = h3CO3 = H+ + HCO3—
В таблице обобщены относительные изменения концентрации растворенного кислорода, CO2 и pH в течение 24 часов
| Время | Растворенный кислород | Растворенный углекислый газ | pH |
| День | Возрастает | Снижается | Возрастает |
| Ночь | Снижается | Возрастает | Снижается |
Углекислый газ редко напрямую оказывает токсическое влияние на рыб. Однако его высокие концентрации снижают pH и, вследствие снижения pH в крови жабр, ограничивают возможность крови рыб переносить кислород. При заданной концентрации кислорода (например, 2 мг/л) рыба может задохнуться, когда уровень CO2 высокий, либо остаться невредимой, когда уровень CO2 низкий. Сом толерантен к концентрации CO2 20-30 мг/л, если газ накапливается постепенно и уровень кислорода 5 мг/л. В водохранилище или естественном пруду концентрация CO2 редко превышает 5-10 мг/л.
Высокие значения концентрации углекислого газа практически всегда обусловлены низкими концентрациями растворенного кислорода (высокая дыхательная активность). Для повышения низких значений кислорода проводится аэрация воды. Она же помогает снизить высокий уровень CO2, вследствие обратной диффузии газа в атмосферу. Хронически высокая концентрация CO2 снижается внесением гидратной извести Ca(OH)2. Примерно 1 мг/л извести удаляет 1 мг/л углекислого газа. Однако такую обработку нельзя производить в воде с плохими буферными свойствами (низкая щелочность), потому что pH поднимется до смертельного для рыб уровня. Кроме того, возникает опасность для рыб, если известь вносится в воду с избытком уровнем аммония. Высокий pH усугубляет токсическое влияние аммония.
Щелочность
Общая щелочность характеризует количество оснований, присутствующих в воде. Как правило, в пруду присутствуют карбонаты, бикарбонаты, гидроксиды, фосфаты и бораты. Карбонаты и бикарбонаты самые распространенные и наиболее важные компоненты щелочности. Этот показатель измеряется по количеству кислоты (H+) в воде, которое может абсорбироваться (буферизация) перед достижением назначенного уровня pH. Общая щелочность выражается в мг/л или млн-1 карбоната кальция CaCO3. Щелочности 20 мг/л более чем достаточно для хорошей продуктивности пруда. Желателен диапазон общей щелочности 75-200 мг/л CaCO3.
Карбонатная-бикарбонатная щелочность (и жесткость) поверхностных и колодезных вод создается преимущественно в ходе взаимодействия растворенного в воде CO2 и извести грунта. Дождевая вода имеет естественную кислую реакцию, потому что насыщена атмосферным углекислым газом. Как только она проходит сквозь почву, каждая капля насыщается CO2, и pH снижается. Колодезная вода выкачивается из крупных, естественных подземных резервуаров (водоносный слой) или маленьких, локальных участков грунтовых вод (подземные воды). Обычно, грунтовая вода имеет высокую концентрацию CO2, низкие pH и концентрацию кислорода. Накопление CO2 в них обусловлено протеканием бактериальных процессов в почве и минеральных образованиях. Как только дождевая, подземная вода проходит пласт, содержащий кальциевый известняк CaCO3 или доломитизированный известняк CaMg(CO3)2, происходит растворение минералов с образованием кальциевых и магниевых бикарбонатных солей:
CaCO3 + h3O + CO2 = Ca+2 + 2HCO3—CaMg(CO3)2 + 2h3O + 2CO2 = Ca+2 + Mg+2 + 4HCO3—
В результате, возрастают щелочность, кислотность и жесткость воды.
Щелочность, pH и концентрация углекислого газа
В воде с умеренной или высокой щелочностью (хорошая буферная емкость) и схожим уровнем жесткости, pH был нейтральным или слегка основным (7.0 – 8.3) и не колебался в широких пределах. Более высокие концентрации CO2 (т.е. угольная кислота) или другие кислоты требуют для снижения pH больше оснований, которые могли бы нейтрализовать или буферизировать кислоту.
В таблице можно видеть взаимосвязь между щелочностью, pH и концентрацией CO2
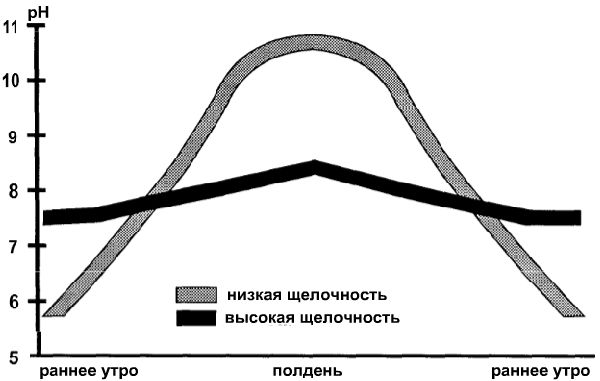 Изменения pH в течение 24 часов в воде с высокой и низкой щелочностью
Изменения pH в течение 24 часов в воде с высокой и низкой щелочностью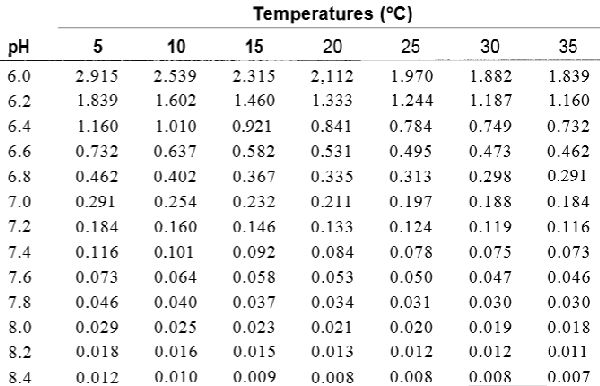 Значения фактора для расчета концентрации углекислого газа в воде с известным pH, температурой и щелочностью (Tucker (1984). При pH выше 8.4 концентрация CO2 незначительна
Значения фактора для расчета концентрации углекислого газа в воде с известным pH, температурой и щелочностью (Tucker (1984). При pH выше 8.4 концентрация CO2 незначительнаЧисло (фактор), отмеченный в таблице и соответствующий определенным значениям pH и температуры, умножается на значение щелочности (мг/л CaCO3). Результат этого уравнения позволяет оценить концентрацию CO2 (мг/л).
Например, в пруду с сомами pH = 7.2, температура = 25°C, и общая щелочность = 103 мг/л. Значение фактора = 0.124. Концентрация углекислого газа равна = 0.124 x 103 мг/л щелочности = 12.8 мг/л CO2.
Для минимизации ошибки этих расчетов необходимо в течение 30 минут регистрировать pH. Вследствие нескольких источников погрешности предпочтительно прямое измерение концентрации углекислого газа при помощи химических тестов.
Щелочность, pH и фотосинтез
Основания, обуславливающие щелочность, влияют и нейтрализую кислоты. Карбонаты и бикарбонаты могут реагировать с кислотами и щелочами, и буферизировать (минимизировать) изменения pH среды. Кислотность воды с высокими буферными свойствами колеблется в пределах 6.9-9 единиц. В воде с низкими буферными свойствами pH может достигать угрожающе низких (углекислый газ и угольная кислота образуются вследствие дыхания) или угрожающе высоких значений (высокая активность фотосинтеза).
Фитопланктон представляет собой микроскопические или около микроскопические водные растения, ответственные за продукцию значительной части кислорода в пруду и реализацию фотосинтеза. При стабильном значении pH около 6.5 или выше, щелочность улучшает продуктивность фитопланктона, потому что повышает доступность нутриентов (растворимые фосфаты). Щелочность выше 20 мг/л захватывает CO2 и увеличивает его концентрацию, доступную для фотосинтеза.
Так как фитопланктон использует CO2 в фотосинтезе, pH в воде возрастает со снижением концентрации углекислого газа и угольной кислоты. Кроме того, фитопланктон и другие растения переводят бикарбонаты (HCO3—) в углекислый газ для фотосинтеза и высвобождает карбонаты:
2HCO3— + фитопланктон = CO2 (фотосинтез) + CO3-2 + h3OCO3-2 + h3O = HCO3— + OH— (сильное основание)
Высокие значения pH также могут обуславливать снижение концентрации H+:CO3-2 + H+ = HCO3— илиHCO3— + H+ = h3O + CO2
Высвободившийся при посредничестве растительной биомассы карбонат из бикарбоната, может вызывать значительное возрастание pH (выше 9) в периоды активного фотосинтеза фитопланктона. Этот подъем pH наблюдается при низкой щелочности воды (20-50 мг/л) или в воде с умеренной и высокой карбонатной щелочностью (75-200 мг/л) и жесткостью менее 25 мг/л. Высокая бикарбонатная щелочность в мягкой воде обусловлена карбонатами натрия и калия, более водорастворимыми, чем карбонаты кальция и магния, влияющими на жесткость. Если присутствуют кальций, магний и образующийся фотосинтетический карбонат, когда pH выше 8.3, формируется известняк. Пруды с щелочностью ниже 20 мг/л обычно не имеют вспышек роста водорослей и, соответственно, вызванного фотосинтезом, резкого подъема pH.
Жесткость
Жесткость является важным показателем воды при культивировании рыб. В гидрохимическом анализе он обычно присутствует. Жесткость определяется по концентрации двухвалентных ионов — кальцием, магнием и/или железом. Она может включать смесь двухвалентных солей, но кальций и магний всегда преобладают.
Традиционно, жесткость измеряется в ходе химического титрования. Жесткость образцов воды выражается в миллиграммах на литр в эквиваленте карбоната кальция (мг/л CaCO3). Кальциевая карбонатная жесткость основной индикатор количества двухвалентных солей, который не проводит различий между кальцием, магнием и солями других двухвалентных элементов.
Часто жесткость путают с щелочностью (общая концентрация оснований). Путаница возникает из-за того, что оба параметра измеряются в мг/л эквивалента CaCO3. Если известняк ответственен за оба параметра, жесткость и щелочность, их концентрация будет схожей. Однако, если в растворе, где на щелочность влияет NaHCO3, жесткость будет низкой, а щелочность, напротив, высокой. Кислые, подземные и колодезные воды могут иметь низкую или высокую жесткость и очень низкую щелочность (либо вообще не иметь её).
Кальций и магний важны для протекания ряда биологических процессов в организме рыб (формирование костей и чешуи, свертывании крови и других метаболических реакциях). Рыбы способны абсорбировать кальций и магний непосредственно из воды или с кормом.
Кальций наиболее важный двухвалентный элемент в культуральной воде. Присутствие свободного (ион) кальция в воде помогает снизить потери других солей (т.е. натрия и калия) из внутренних жидкостей рыб (крови). Натрий и калий входят в состав крови рыб. Они участвуют в реализации ряда процессов, в том числе, деятельности сердца, иннервации и мышечной деятельности. Исследования показали, что кальций окружающей среды также требуется для ре-абсорбции потерянных солей натрия и калия. В воде с низкой концентрацией кальция моет наблюдаться утечка значительных количеств натрия и калия в воду. Для вторичного впитывания этих элементов затрачивается энергия тела. Для некоторых видов рыб (Sciaenops ocellatus, Morone saxatilis) для выживания важно высокое значение кальциевой жесткости.
Рекомендуемый диапазон свободного кальция в культуральной воде составляет 25-100 мг/л (65-250 мг/л CaCO3). Канальный сом толерантен к низкой концентрации кальция до тех пор, пока его корм содержит минимальный уровень кальция, однако скорость его роста низкая. Аналогично, радужная форель переносит низкие концентрации кальция (10 мг/л), если pH выше 6.5. Для выращивания Sciaenops ocellatus, Morone saxatilis или раков желательна концентрация свободного кальция 40-100 мг/л (100-250 мг/л CaCO3), что соответствует концентрации кальция в крови рыб (100 мг/л Ca или 250 мг/л CaCO3). Жесткость источников воды для этих видов должна быть проверена.
Низкая карбонатная жесткость надежный индикатор низкого содержания кальция. Однако высокая жесткость необязательно отражают высокую концентрацию этого элемента.
Карбонатная жесткость 100 мг/л включает 40 мг/л свободного кальция (делим CaCO3 на 2.5), в случае, если она обусловлена лишь присутствием кальция. Аналогично, если значение карбонатной жесткости 100 мг/л и представлена свободным магнием, концентрация магния составляет 24 мг/л (делим CaCO3 на 4.12). Эти факторы (2.5 и 4.12) связаны с молекулярной массой CaCO3 и различиями массы атомов магния и кальция. Там, где жесткость обусловлена присутствием известняка, значение CaCO3 обычно отражает смесь свободного кальция и магния. Но магния все равно преобладает в смеси.
Известняк может использоваться в сельском хозяйстве для повышения концентрации кальция (и карбонатной-бикарбонатной жесткости) в областях с кислой водой или почвой. Однако при pH 8.3 или выше известняк не растворяется. Мягкую, щелочную воду можно обогатить кальцием с помощью гипса (CaSO4) или CaCl2. Большие объемы обработки могут привести к серьезным расходам, и более практичным будет поиск другого источника воды.
Влияние pH, щелочности и жесткости на токсичность аммония и металлов
Аммоний становится более токсичным при возрастании pH. Высокие концентрации токсичной неионизированной формы аммония (Nh4) формируются в основной воде, тогда как Nh5+ преобладает в кислой воде. Так как щелочность повышается с ростом pH, аммоний становится более ядовитым в воде с высокой общей щелочностью. Жесткость обычно не связана с токсичностью аммония.
Металлы, такие как медь и цинк, более распространены в быту (в бассейнах, сантехнике и CuSO4). Они становятся лучше растворяются в кислой воде. Растворимость или свободная ионизированная форма этих металлов токсична для рыб. Высокая общая щелочность повышает pH и доступность оснований, которые способствуют образованию менее токсичных нерастворимых форм меди и цинка. Высокие концентрации кальция и магния (жесткость) блокируют эффекты меди и цинка в местах их токсического влияния. Поэтому, эти металлы более ядовиты для рыб в мягкой, кислой воде с низкой общей щелочностью.
В идеале, пруд с аквакультурой должен иметь pH 6.5-9.0, умеренную или высокую щелочность (75-200 мг/л, но не менее 20 мг/л) и кальциевую карбонатную жесткость 100-200 мг/л CaCO3. Многие принципы химизма абстрактны (буферизация, карбонатный-бикарбонатный) и их сложно понять. Но фундаментальное понимание взаимосвязи pH, CO2, щелочности и жесткости необходимо для эффективного управления аквакультурой.——www2.ca.uky.edu/wkrec/interactionsphetc.pdfWilliam A. Wurts and Robert M. Durborow. Interactions of pH, Carbon Dioxide, Alkalinity and Hardness in Fish Ponds. Southern Regional Aquaculture Center. SRAC Publication No. 464. 2012.
aquavitro.org
Определение общей щелочности воды — МегаЛекции
Сущность метода. В основе метода определения общей щелочности воды лежит принцип образования нейтральных солей при взаимодействии кислоты с гидратами, гидрокарбонатами и карбонатами щелочных и щелочнозечельных металлов, а также свойство различных индикаторов изменять свой цвет в зависимости от величины рН.
Учитывая эти свойства, исследуемую пробу воды подвергают титрованию раствором соляной или серной кислоты требуемой концентрации в присутствии индикаторов фенолфталеина и метилоранжа.
Применяемые реактивы:
децинормальный (0,1 н.) раствор соляной или серной кислоты;
1%-ный спиртовый раствор фенолфталеина для определения гидратной и карбонатной щелочности;
0,1%-ный раствор метилоранжа, служащий индикатором при определении карбонатной и гидрокарбонатной щелочности.
Подготовка_пробы воды. При титровании воды кислота вступает во взаимодействие как со щелочами, так и с веществами, которые могут находиться в воде во взвешенном состоянии и которые не обусловливают щелочность воды. Чтобы уменьшить расход кислоты на ненужные реакции и обеспечить правильность определения щелочности, анализируемую пробу охлаждают до 20°С, если она была горячей, и пропускают через бумажный фильтр.
Порядок анализа. К 100 мл соответственно подготовленной для титрования пробы воды добавляют 2-3 капли фенолфталеина.
При окрашивании пробу титруют раствором соляной или серной кислоты соответствующей нормальности (0,1 н. или 0,01 н.) до исчезновения окраски. Титрование проводят медленно, тщательно перемешивая пробу воды.
Количество 0,1 н. или 0,01 н. раствора соляной или серной кислоты, пошедшее на титрование с фенолфталеином, записывают с пометкой "фф". Если в процессе прибавления фенолфталеина окрашивания не наступает, значит, в воде отсутствуют гидратная и карбонатная щелочности. В этом случае титровать пробы воды раствором кислоты не нужно, так как щелочность по фенолфталеину отсутствует.
После этого в эту же пробу добавляют 2-3 капли метилоранжа и титруют 0,1 н. или 0,01 н. раствором кислоты до перехода окраски пробы из желтой в оранжевую. Количество раствора кислоты, пошедшее на титрование с метилоранжем, записывают с пометкой "МО".
Для расчета общей щелочности воды берут суммарный расход кислоты, пошедшей на титрование с фенолфталеином и метилоранжем.
Расчет результатов анализа. Расчет результатов анализа основан на том, что каждый 1 мл нормального раствора соляной или серной кислоты оттитровывают 1 мг×экв щелочности. Соответственно этому 1 мл децинорнального (0,1 н.) раствора соляной кислоты оттитровывает 0,1 мг×экв. щелочности, а 1 мл сантинормального (0,01 н.) раствора оттитровывает 0,01 мг×экв щелочности.
Следовательно, общая щелочность воды
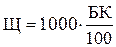 , (7)
, (7)
где Щ - общая щелочность воды, мг×экв/кг;
1000 - перерасчет результатов анализа на 1 л воды;
К - коэффициент нормальности раствора кислоты;
Б - суммарный расход кислоты на титрование, мл;
100 -объем пробы воды, взятой для анализа, мл.
При титровании 100 мл пробы воды децинормальным раствором кислоты (0,1 н.) формула упрощается:
Щ = Б, мг×экв/кг.
При использовании саитинормального раствора кислоты (0,01 н.):
Щ = 0.1 Б, мг×экв/кг.
Для воды типа конденсата щелочность принято выражать в микро-грамм эквивалентах на литр (мкг×экв/кг). В этом случае
Щ =Б 0.01 × 1000 × 1000/100
или Щ=100 Б мкг×экв/кг.
СОСТАВЛЕНИЕ ОТЧЕТА
Для оформления отчета необходимо заполнить табл. 3.
Таблица 3
Результаты расчетов
| № | Наименование параметра | По какой формуле определяется | Значение | Размерность |
| Карбонатная жесткость Некарбонатная жесткость Общая жесткость метод титрования метод комплексометрический Окисляемость Общая щелочность Сухой остаток Класс жесткости | табл.2 |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем обусловлена и в каких единицах измеряется карбонатная жесткость?
2. Чем обусловлена и в каких единицах измеряется некарбонатная жесткость?
3. Что такое общая жесткость?
4. Как определить класс жесткости воды?
5. Почему карбонатная жесткость устраняется при кипячении? Напишите, какие при этом протекают реакции.
6. Как устраняют жесткость воды в промышленных условиях?
7. Как определяют карбонатную жесткость?
8. Как определяют некарбонатную жесткость?
9. Как определяют общую жесткость?
10. Что такое окисляемоеть воды и чем она обусловлена, в каких единицах измеряется?
11. Как определяют окисляемоеть воды?
12. Что такое общая щелочность воды, в каких единицах измеряется?
13. Как определяют щелочность воды?
14. Что такое сухой остаток, в каких единицах измеряется и как определяется?
megalektsii.ru
Щелочность - вода - Большая Энциклопедия Нефти и Газа, статья, страница 1
Щелочность - вода
Cтраница 1
Щелочность воды, а также содержание в ней кремниевой кислоты и свободной углекислоты при катионном обмене не меняются. Содержащиеся в растворе ионы железа и алюминия замещаются натрием аналогично ионам магния и кальция, но если эти вещества находятся в коллоидном состоянии, то они могут адсорбироваться на поверхности зерен ионообменного материала, снижая таким образом его эффективность. Умягченная вода получается более коррозионноактивной, чем исходная, из-за полного отсутствия бикарбоната кальция, который при определенных условиях может образовать защитный слой карбоната кальция на поверхности металла, находящегося в контакте с водой. Если исходная вода содержит в больших количествах одновалентные ионы ( например, ионы натрия), то рабочая обменная емкость материала может снижаться. Жесткость обработанной воды может значительно превысить уровень, достигаемый при отсутствии ионов натрия, и, кроме того, возможен преждевременный проскок солей жесткости. Величина снижения рабочей обменной емкости зависит от концентрации одновалентных ионов и от вида применяемого ионообменного материала. [1]
Щелочность воды обусловлена присутствием в ней бикарбо-натных и карбонатных ионов и почти всегда соответствует величине карбонатной жесткости. [3]
Щелочность воды измеряется в тех же единицах, как и жесткость. Подпиточная вода для тепловых сетей не нормируется по щелочности, однако при пониженной щелочности воды усиливается процесс коррозии внутренних стенок труб и котлов. [4]
Щелочность воды должна быть достаточной для осуществления химической коагуляции, но не настолько высокой, чтобы вызывать физиологические расстройства у потребителей. Установить единый предел максимальной жесткости воды невозможно, так как она обусловлена естественными геологическими условиями, и приемлемость ее для людей неодинакова. Избыточные концентрации фосфора в природной воде связаны с эвтрофикацией водоемов. Присутствие в воде сложных фосфатов затрудняет процесс коагуляции. Рекомендуется для каждого конкретного вида водопотребления разрабатывать самостоятельные стандарты на содержание фосфора. [5]
Щелочность воды, как и ее жесткость, выражают в мг-экв. [6]
Щелочность воды обусловлена присутствием в ней солей щелочных ( натрий и калий) и щелочно-земельных ( кальций и магний) металлов. Для уменьшения щелочности воды, а также для удаления накопившегося шлама котлы периодически продувают, иначе они подвергаются щелочной коррозии и выходят из строя. [7]
Щелочность воды так же, как и жесткость, выражается в миллиграмм-эквивалентах в литре, но она отличается от жесткости воды тем, что в состав щелочей входят, кроме двууглекислых солей кальция и магния, и натриевые соли. Щелочность воды соответствует количеству миллилитров точно децинормаль-ной кислоты, необходимой для полной нейтрализации ( в присутствии индикатора метилоранжа) щелочных соединений, содержащихся в 100 мл воды. [8]
Щелочность воды обусловливается наличием бикарбонатов, карбонатов и гидроксидов. Измерение осуществляется путем нейтрализации некоторого объема воды неорганической кислотой в присутствии двух цветных индикаторов. [9]
Щелочность воды равна удвоенному числу миллиграмм-эквивалентов ионов слабых кислот. [10]
Щелочность воды, как и ее жесткость, выражают в мг-экв. [11]
Щелочность воды определяется нейтрализацией соединений, обладающих щелочными свойствами, сильными кислотами. Обычно щелочность природных вод обусловлена наличием гидрокарбонатов щелочных и щелочноземельных металлов. Если рН воды4 5, принято считать общую щелочность воды, равной нулю. Если рН исследуемого раствора 8 3, то количество сильной кислоты ( мг-экв / л), необходимое для снижения рН до этого значения, характеризует свободную щелочность. Свободная щелочность обусловлена наличием свободных оснований и растворимых солей - карбонатов, силикатов, сульфидов. Если рН исследуемого раствора 8 3, то свободная щелочность его будет равна нулю. [12]
Щелочность воды зависит от растворенных в ней бикарбонатов и карбонатов. [13]
Щелочность воды выражается количеством миллилитров нормального раствора соляной кислоты, затрачиваемых на разложение бикарбонатов и карбонатов, находящихся в 1 л воды. [14]
Щелочность вод несколько занижена в X горизонте и свите перерыва. Воды верхних горизонтов не являются типично щелочными. Содержание сульфатов в целом незначительное или они вовсе отсутствуют. Воды II, IV блоков отличаются от вод III, V блоков меньшей минерализацией. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
3.5. Кислотность (щелочность) воды.
Кислую или щелочную реакцию среды выражают концентрацией водородных ионов [Н+]которую легче определить, чем концентрацию гидроксильных ионов [ОН-] ; этот показатель обозначают рН. Оценка реакции воды по величине рН приведена в таблице 4.
Таблица 4.
Классификация воды по величине рН.
| Реакция воды | рН | Реакция воды | рН |
| Сильнокислая | < 1,9 | Слабощелочная | 7.0– 8,3 |
| Кислая | 1,9 – 4,1 | Щелочная | 8,3 –10.3 |
| Слабокислая | 4,1 – 7.0 | Сильно щелочная | >10,3 |
| Нейтральная | 7,0 |
3.6.Агрессивность подземных вод.
Разрушительное воздействие воды на бетон и металлы, возможное при определенном ее ионном и газовом составе, обозначают как агрессивность.
По отношению к бетону принято различать несколько видов агрессивности.
Агрессивность выщелачивания. Проявляется в частичном растворении карбоната кальция, входящего в состав бетона. Она возможна при малом содержании в воде НСО3-1 – 0,4-1,5 мг-экв/л.
Углекислая (углекислотная) агрессивность обусловлена действием агрессивного углекислого газа СО2 (именно газа, а не иона СО22- ). Опасное его содержание в воде зависит от количества аниона НСО3-1, минерализацииводы и от условий, в которых возможно проявление агрессивности (коэффициент фильтрации, напор, сорт цемента и т.п.). При наиболее опасных условиях максимально приемлемое содержание СО2 составляет 3 мг/л, при наименее опасных допустимо увеличение его количества до 8,3 мг/л.
Общекислотная агрессивность. Выражается в частичном растворении Са(ОН)2, входящего в состав бетона. Она характерна для кислых вод и возможна при значениях рН от 5,0 до 6,8.
Сульфатная агрессивность обусловлена взаимодействием сульфатов, содержащихся в воде, с карбонатом кальция бетона. Образующиеся кристаллы сульфатов кальция механически разрушают бетон. Допустимое содержаниеSО42-определяется с учетом условий, в которых находится бетон, а также зависит от содержания в воде ионов хлора. При обычных цементах агрессивность возможна, если в воде более 250 мг/лSО42-, а при сульфостойких - более 4000 мг/л.
Магнезиальная агрессивность проявляется при повышенном содержании (более 2000 мг/л) в водеMg2+. В результате обменных реакций в бетоне происходит формирование коллоидных соединенийMg(OH)2, понижающих его прочность.
Кислородная агрессивность свойственна водам богатым растворенным кислородом и проявляется преимущественно на металлических конструкциях.
4.Аналитическая обработка данных по ионному составу воды
4.1. Формула Курлова.
Эта формула дает обобщенную характеристику химического состава воды. Она настолько удобна и общепринята, что ее иногда называют паспортом воды. Основная часть формулы имеет вид дроби, в числителе которой в убывающем порядке записано процент-эквивалентное содержание анионов, а в знаменателе – катионов, например:
HCO31-59 SO4 2-29 Cl1-12
Ca2+59 (Na1++K1+) 25 Mg2+16
Ионы с содержанием менее 10% в формулу Курлова не включают. Перед формулой последовательно указывают содержаниемикрокомпонентов вмг/л(например,Feобщ.-0.04 мг/л),газов в мг/л(например,CO2= 4,2 мг/л), величинаобщей минерализации (М) в г/л(например, М=2,51г/л). После формулы приводят сведения орН (например, рН= 6,3),температурев 0С(например,t=100C) идебите (расходе воды) (D),источника (колодца, родника, скважины и т.п.)вм3/сутки(например,D=12,9 м3/сутки). При этом знак "=" и единицы измерения этих показателей (кроме температуры) в формуле не указывают. Полностью формула Курлова для воды с данными характеристиками выглядит так:
HCO31-59 SO4 2-29 Cl1-12
F eобщ.0,04 CO2 4,2 М2,51 рН6,3 t100C D12.9
eобщ.0,04 CO2 4,2 М2,51 рН6,3 t100C D12.9
Ca2+59 (Na1++K1+) 25Mg2+16
Формула Курлова в приведенном примере означает, что в анализируемой воде имеется 0,04 мг/л двух- и трехвалентного железа и 4,2 мг/л углекислого газа; она содержит 2,51 г растворенных солей в 1 литре: хлора – 12 %-экв, сульфат-иона – 29 %-экв, гидрокарбонат-иона - 59 %-экв; катионов магния, натрия (с калием) и кальция 16, 25 и 59 %-экв, соответственно; рН воды 6,3; температура - 100C, а расход воды (дебит) составляет 12,9 м3/сутки.
В краткое название водыпо формуле Курлова (название по ионному составу)включаютвсеионы, содержание которых равно или превышает 25процент-эквивалентов. Состав воды называютв возрастающем порядке – от ионов с низким содержанием к преобладающим ионам, сначала для анионов, а затем - для катионов.Название воды в приведенном примере -сульфатно-гидрокарбонатная, натриево-кальциевая. Преобладающему иону в названии соответствует полная форма прилагательного (гидрокарбонатнАЯ, кальциевАЯ) а остальным – краткая (сульфатнО-, натриевО-). Слово «калий» в название воды по формуле Курлова не входит, хотя символ этого иона в самой формуле и указан (вместе с натрием).
Можно дать и расширенное название воды по Курлову; в приведенном примере вода солоноватая сульфатно-гидрокарбонатная, натриево-кальциевая слабокислая холодная.
Пользуясь формулой Курлова удобно сравнивать и классифицировать подземные воды по их составу и состоянию.
studfiles.net



















