Химия, Биология, подготовка к ГИА и ЕГЭ. Циклопропан вода
Циклоалканы
Циклоалканы
Нелюбин Владислав, Бочков Иван 10А
Циклоалканы, также нафтены, циклоны или циклопарафины – ациклические насыщенные углеводороды, по химическим свойствам близки к предельным углеводородам. Входят в состав нефти. Циклоалканы открыты В.В. Марковниковым в 1883 году. (Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены)
Номенклатура:
Циклоалканы – это циклические углеводороды, не содержащие в молекуле кратных связей и соответствующие общей формуле: Cnh3n.
Циклопропан: Циклогексан:


Прочность связей в циклических соединениях зависит от числа атомов, участвующих в образовании цикла. Она определяется степенью его напряженности, обусловленной изменением валентных углов атомов цикла и отклонением этих атомов от нормального направления.Для циклопропана межъядерные углы составляют 60º, как в равностороннем треугольнике, для циклобутана – 90º, как в квадрате, а в циклопентане – 108º, как в правильном пятиугольнике. Нормальный валентный угол для атома углерода – 109,5º. Поэтому при расположении в названных соединениях всех атомов углерода в одной плоскости уменьшение валентных углов составляет в циклопропане – 49,5º, в циклобутане – 19,5º, в циклопентане – 1,5º.Чем больше отклонение валентного угла от нормального, тем более напряжены и, следовательно, непрочны циклы. Однако в отличие от циклопропана циклобутан и циклопентан имеют неплоские циклы. Один из атомов углерода непрерывно выходит из плоскости. Циклобутан существует в виде неплоских "сложенных" конформаций. Циклопентан характеризуется конформацией "конверт".
Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло:109,5º–120º = 10,5º.Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях "кресла" и "ванны". Конформация "кресла" менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию с промежуточным образованием конформера II:

ось симметрии II III I
Двенадцать связей С-Н, которые имеются у циклогексана в конформации "кресла", делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e- связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a- связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз)
Физические свойства:
При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 — С16) — жидкости, начиная с С17 — твёрдые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов Циклоалканы в воде практически не растворяются, зато растворяются в химических растворителях. При увеличении числа атомов углерода возрастает молярная масса, следовательно, увеличивается температура плавления.
Таблица физических свойств:
| Циклоалкан | Т. пл., °С | Т. кип., °С |
| циклопропан С3H6 | −127,5 | −32,7 |
| циклобутан С4H8 | −50 | 12 |
| циклопентан С5h20 | −93,9 | 49,3 |
| циклогексан С6h22 | 6,5 | 80 |
| циклогептан С7h24 | −12 | 118,5 |
| циклооктан С8h26 | 14,3 | 63 при 45 мм рт.ст. |
| циклононан С9h28 | 9,7 | 69 при 14 мм рт.ст. |
| циклодекан С10h30 | 10,8 | 201 |
| циклоундекан С11h32 | −7,2 | 91 при 12 мм рт.ст. |
| циклододекан С12h34 | 61,6 | 243 |
| циклотридеканС13h36 | 23,5 | 128 при 20 мм рт.ст. |
| циклотетрадекан С14h38 | 54 | 131 при 11 мм рт.ст. |
| циклопентадекан С15h40 | 62,1 | 147 при 12 мм рт.ст. |
Для циклоалканов характерна пространственная изомерия и изомерия углеродного скелета. Также, поскольку формулы циклоалканов и алкенов совпадают, то изомерами циклоалканов являются и алкены.


При наличии двух заместителей в циклических соединениях также возможна цис-транс-изомерия. Метильные группы в приведенных примерах могут располагаться по одну сторону плоскости кольца (такой изомер называется цис-изомером) и по разные стороны (такой изомер называется транс-изомером).
Естественно, что при наложении друг на друга моделей цис- и транс- изомеров они не совмещаются. Взаимные изомеризации требуют разрыва цикла с последующим его замыканием или разрыва связи заместителя с углеродным атомом цикла и образованием новой связи с другой стороны цикла.
Следует отметить, что в циклических соединениях возможно возникновение не только цис-транс-, но и зеркальной изомерии. При наложении модели молекулы цис-изомера с одинаковыми заместителями и ее зеркального отражения они совмещаются, в то время как таковое невозможно для цис-изомера с различными заместителями. Для транс-изомеров совмещение модели молекулы и ее зеркального отражения невозможно как при одинаковых, так и различающихся заместителях.

Химические свойства:
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
Реакции:
Малые циклы (C3, C4, C5) вступают в реакцию гидрирования:

Циклопропан вступает в реакции галогенирования и гидрогалогенирования:


В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения:

 Галогенирование Нитрование
Галогенирование Нитрование Им также характерны реакции дегидрирования, и окисления в присутствии катализатора:

Получение циклоалканов:
1) При переработке нефти:


2) Дегалогенирование дегалогенпроизводных:

3) Гидрирование бензола и его гомологов:

4)Получение пиролизом солей дикарбоновых кислот. Циклопентан и циклогексан образуются при пиролизе (нагревании без доступа воздуха) кальциевых солей соответственно гександикарбоновой и гептандикарбоновой кислот и воставлении образующихся кетонов:

Значение для человека.
Циклоалканы находят применение в разных областях хозяйства. Так, циклопентан используется в разных синтезах и как добавка к моторному топливу для повышения качества. Циклогексан используется для синтеза полупродуктов при производстве синтетических волокон нейлона и капрона.


Циклопропан используют в медицине как наркотический препарат (в соединении с кислородом), он оказывает сильнейшее обезболивающее действие. Также циклоалканы содержатся в сильнейших растительных ядах, зафиксировано примерно 100 тыс. смертей после отравление ими. Циклоалканы присутствуют в незаменимых гормонах, без которых человеку не выжить, в желчных кислотах, и в половых гормонах - тестостерон, — основной мужской половой гормон, без которого невозможно размножение.
ЗАДАНИЯ:Номенклатура1.1) Выберите из данных названий корректные:2,3-диметилциклопропан, 1-метил-4-бутилциклопентан, 1,5-диметилциклогексан, изопропил-циклобутан, 1-метил-3-этилциклобутан, циклоэтан, циклопентан, 1,2-диизобутанциклобутан, 1,2-дибутадиенциклопентан, бутил-циклобутан.1.2) Из предыдущего пункта выберите вещества, которые существуют, но имеют другое название. Дайте им правильное название.
Изомерия углеродного скелета2.1) Напишите всех изомеров циклопентана (и дайте название). К каким классам веществ они принадлежат?2.2) Чего больше – изомеров декана или циклодекана? Чего больше – алканов вида C100h302 или циклоалканов вида C100h300?
Химические свойства:3.1)Почему в реакции с малым циклом он распадается, в отличие от большого цикла? Какой цикл является самым устойчивым?3.2) Получите за несколько реакций из циклогексана фенолят натрия. Какое наименьшее число реакций вам понадобилось?
Напоминание: По правилам международной номенклатуры главной считается цепь углеродных атомов, образующая цикл. Название строится по названию этой замкнутой цепи с добавление приставки “цикло” (циклобутан, циклопентан). При наличии заместителей нумерацию углеродных атомов в кольце проводят так, чтобы номера заместителей были как можно меньше. Если заместитель один, его номер в цикле не пишется.
ОТВЕТЫ:
1.1) 1-метил-3-этилциклобутан, циклопентан, 1,2-диизобутанциклобутан, бутил-циклобутан.1.2) 2,3-диметилциклопропан – 1,2-диметилциклопропан, 1-метил-4-бутилциклопентан – 1-бутил-3-метилциклопентан.2.1) Это циклоалканы и алкены. Циклоалканы: метил – циклобутан, 1,2-диметилциклопропан,этил-циклопропан. Алкены: пентен-1, пентен-2, 2-метилбутен-1, 3-метилбутен-1, 2-метилбутен-2, 2,2-диметилпропен.2.2) Изомеров циклодекана, циклоалканов вида C100h300.3.1) В малых циклах большое напряжение, они стремятся раскрыться под действием реагентов. Самым устойчивым является шестичленный цикл.3.2) К примеру: циклогексан – бензол – хлорбензол - фенол – фенолят натрия. Возможно, можно получить быстрее, чем за 4 реакции
ВИДЕО:
Видео YouTube
Видео YouTube
sites.google.com
Урок №10. Циклоалканы - ХиМуЛя.com
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов Cnh3n. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.
 |  |  |  |
| Циклопропан | Циклобутан | Циклопентан | Циклогексан |
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами

Физические свойства
Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Физические свойства некоторых циклоалканов представлены в таблице.
Таблица. Физические свойства некоторых циклоалканов
| Соединение | t°пл.,°С | t°кип.,°С |
| Циклопропан | -126,9 | -33 |
| Метилциклопропан | -177,2 | 0,7 |
| Циклобутан | - 80 | 13 |
| Метилциклобутан | -149,3 | 36,8 |
| Циклопентан | - 94,4 | 49,3 |
| Метилциклопентан | -142,2 | 71,9 |
| Циклогексан | 6,5 | 80,7 |
Изомерия циклоалканов
Для циклоалканов характерны как структурная, так и пространственная изомерия.
Структурная изомеpия
1. Изомерия углеродного скелета:
а) кольца

б) боковых цепей

2. Изомерия положения заместителей в кольце:

3. Межклассовая изомерия с алкенами:

Пространственная изомерия
1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные анимация:

2. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение:

3. Конформационная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация "кресла".

Химические свойства
Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения.
Реакции горения:
Cnh3n + 3n/2O2 -t → nCO2 + nh3O +Q
| Малые циклы (n=3,4) |
| Реакции присоединения – сходство с алкенами. 1) Галогенирование: C3H6 + Br2 → C3H6Br2 (1,3-дибромпропан ) циклопропан 2) Гидрирование: C4H8 + h3 -t,Ni или Pt → C4h20 ( бутан ) циклобутан 3) Гидрогалогенирование (по правилу Марковникова): C3H6 + HI → Ch4-Ch3-Ch3I ( 1- йодпропан ) |
| Обычные циклы (n=5-7) |
| Реакции замещения – сходство с алканами. 1) Галогенирование: C6h22 + Br2 -t → C6h21Br + HBr бромциклогексан Реакции отщепления – дегидрирования циклогексана (р. Зелинского-Казанского): C6h22 -t=300˚С ,Pt,Pd→ C6H6 + 3h3 бензол |
Получение циклоалканов
| В промышленности |
| 1) Из нефти (пяти- и шестичленных) Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий - нафтены). При переработке нефти выделяют главным образом циклоалканы С5 - С7. 2) Из ароматических углеводородов – каталитическое гидрирование: C6H6 + h3-t,p,Ni→ C6h22  |
| В лаборатории |
| Из дигалогенпроизводных алканов (внутримолекулярная реакция Вюрца): Br-Ch3-Ch3-Ch3-Br + Mg -t → MgBr2 + C3H6 или Cl-Ch3-Ch3-Ch3-Ch3-Cl + 2Na → 2NaCl + C4H8  |
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
sites.google.com
это... Циклоалканы: получение, формула, химические и физические свойства
Циклоалканы - это углеводороды, которые в своем составе имеют замкнутые структуры. Рассмотрим особенности данных соединений, их области применения.
Особенности класса
Что собой представляют циклоалканы? Формула класса Cnh3n свидетельствует о недостатке атомов водорода. Подобная ситуация предполагает два развития сценария. Либо в структуре должна присутствовать двойная связь, либо в молекуле содержится замкнутая структура. Какое строение имеют циклоалканы? Формула их соответствует второму случаю, то есть наличию в молекуле замкнутой структуры. Именно специфика строения обуславливает особенности физических и химических свойств данного класса углеводородов.
Сколько различных циклоалканов соответствует составу С4Н8? Чтобы найти ответ на этот вопрос, необходимо проанализировать те виды изомерии, которые характерны для циклоалканов. Два изомера с таким качественным и количественным составом могут иметь циклическое строение: циклобутан, метилциклопропан. Подобный вариант называют изомерией боковой цепи.
Так как циклоалканы - это межклассовые изомеры непредельных олефинов, можно рассмотреть формулы веществ, в составе которых есть двойная связь. В таком виде могут существовать две структуры: бутен-1 и бутен-2. Отвечая на вопрос о том, сколько различных циклоалканов может существовать для предложенной формулы, необходимо рассмотреть не только циклоалканы, но и алкены. Только в этом случае можно будет представить правильный ответ.
Итак, циклоалканы - это углеводороды, которые имеют как минимум два вида изомерии.
Особенности номенклатуры
Названия конкретных углеводородов циклического состава дают в полном соответствии с международной номенклатурой. Для основы используют количество углеродов в замкнутой цепи. Далее, учитывают атомы, имеющиеся в боковой цепи. Например, метилциклопропан. Циклоалканы - это соединения, в которых атомы углерода находятся в sp3 гибридном состоянии, аналогично предельным углеводородам. Подобная особенность определяет основные способы получения и характерные свойства данного класса.
Варианты получения циклоалканов
Как можно получить циклоалканы? Примеры основных реакций свидетельствуют о том, что есть несколько вариантов их образования. Например, циклогексан образуется путем гидрирования ароматического бензола. Соединения с тремя, четырьмя атомами углерода в цикле можно получить путем отщепления галогенов из молекул дигалогенпроизводных алканов. Также циклоалканы получают при пиролизе солей дикарбоновых органических кислот. Нагревание без присутствия воздуха приводит к образованию циклопентана и циклогексана.

Химические свойства
По химическим свойствам нафтены схожи с предельными углеводородами. Для них свойственны реакции с галогенами по типу замещения. Кроме того, представители нафтенов вступают в химическое взаимодействие с азотной кислотой. Циклоалканы устойчивы к концентрированной серной кислоте. С хлорсерной кислотой и олеумом реакция также возможна: в итоге образуется оксид серы (4).
Нафтены, имеющие в молекулах по 5 и 6 атомов углерода, считаются химически стойкими соединениями. Но при воздействии на них бромидом или хлоридом алюминия, происходит их изомеризация, сопровождающаяся сужением либо расширением исходного цикла.
Изомеризация
Например, в процессе изомеризации, циклогексан образует метилциклопентан. В нефти были обнаружены разнообразные производные циклопентана и циклогексана, остальные представители нафтенов в ней практически отсутствуют.
Отличительными особенностями средних циклов считают способность образовывать такие конформации, в которых некоторые углеродные атомы направлены не наружу, а внутрь цикла. Подобные связи именуют интранулярными, а те, что находятся внутри кольца, именуют экстранулярными связями.
Например, для циклодекана в максимально выгодной конформации предполагается шесть интранулярных и четырнадцать экстранулярных водородных атомов. Это подразумевает неравноценность группировок СН2, что отражается на повышении энергии связи, способствует улучшению химических свойств данного соединения.
Для углеводородов, обладающих от 12 и более углеродными атомами, характерна конформационная подвижность. Так как по связи С-С возможно свободное вращение, для подобных соединений не предполагается существования транс- и цис-форм.
Цикланы (нафтены) могут содержаться с природной нефти в пределах от 25 до 75 процентов. Количественное содержание их зависит от утяжеления фракции. В масляных фракциях, которые имеют высокие температуры кипения, происходит повышение количества ароматических структур. Особенно много нафтенов выявлено в эмбенских и бакинских нефтях.
В количественном соотношении показатели составляют до 80 процентов. Выявлена зависимость между типами нефти и распределением циклоалканов по фракциям. Менее термодинамически стойкими считают моноциклические углеводороды, которые обладают длинной боковой алкильной цепочкой. Распределение Cnh3n по типам структур напрямую связано с температурами, используемыми при перегонке нефти.
Например, моноциклические нафтены не обнаруживаются при диапазоне температур 300-350 градусов по Цельсию, а бициклические соединения пропадают при превышении показателя температур в 400 градусов по Цельсию.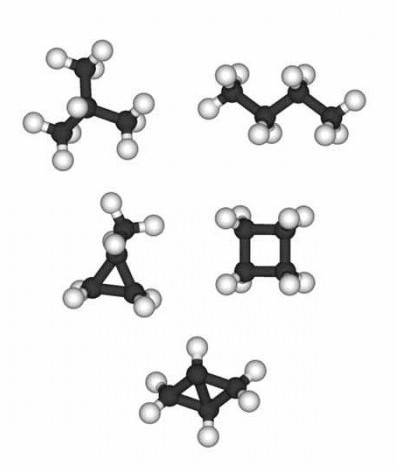
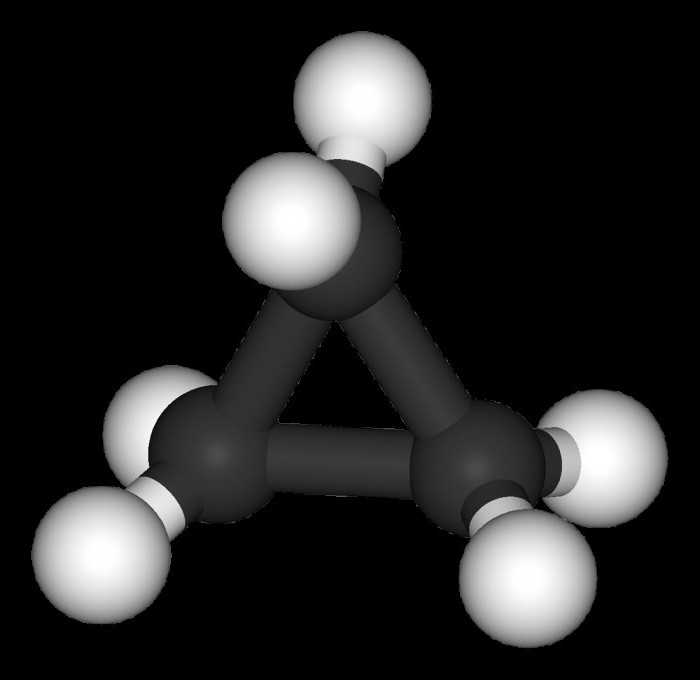
Характеристика циклопропана
С3Н6 является простейшим представителем нафтенов. Это газообразное вещество, имеющее незначительную растворимость в воде. Среди основных химических свойств, характерных для данного органического соединения, выделим каталитическое гидрирование. Продуктом такого взаимодействия будет предельный углеводород пропан. Кроме того, циклопропан, аналогично иным углеводородам, взаимодействует с кислородом воздуха, образуя углекислый газ, пары воды, достаточное количество энергии.
Особенности представителей данного класса
Если сравнивать температуры кипения представителей класса циклоалканов с показателями для алканов, имеющих аналогичное число углеродных атомов, то они будут немного выше. Причина заключается в циклическом строении данного класса. Плотность нафтенов больше показателя для алканов, но немного уступает аренам.
Чтобы понять, сколько различных циклоалканов соответствуют одной формуле, необходимо составить варианты изомеров не только циклического вида, но и с прямым скелетом, в составе которго есть двойная связь. При присутствии в молекуле заместителей в виде углеводородных радикалов, происходит снижение температуры плавления циклоалкана.
Если проанализировать физические и химические свойства данного класса углеводородов, можно выполнить условное подразделение веществ на соединения с малыми циклами (три-четыре), стандартными (пять, шесть, семь), средними (от восьми до двенадцати), а также с большими циклами (от двенадцати углеродов).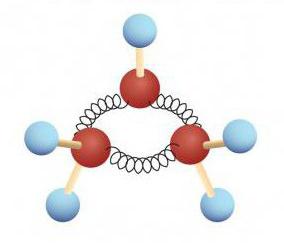
Сферы использования
Поговорим о том, каково основное применение циклоалканов. Нафтены применяют в медицине. Например, циклопропан является наркотическим препаратом. Циклопентан считается хорошим растворителем, он востребован в органическом синтезе. Циклогексан необходим в химической реакции синтеза нейлона, капрона (получении полиамидных волокон), кроме того, он востребован для получения бензена. Насыщенные алканы и циклоалканы обладают незначительной реакционной способностью. Объяснить данный факт можно незначительной полярностью связи С-С. Помимо этого, существенное количество циклоалканов применяется в химической промышленности.
Заключение
Смеси нафтенов и отдельные углеводороды применяют для изготовления смазочных средств. Представители данного класса углеводородов способны улучшать эксплуатационные характеристики дизельного топлива. Например, добавка циклоалканов существенно повышает октановое число, повышает вязкость, увеличивает теплоту сгорания двигателя. Именно поэтому циклоалканы не выделяют из продуктов нефтепереработки, а оставляют в составе бензиновой фракции.
Концентраты нафтенов применяют в виде органических растворителей. Циклоалканы со средними значениями молекулярных масс востребованы в производстве синтетических моющих средств. Достаточное количество нафтенов идет и в качестве топлива, так как при их сгорании выделяется немалое количество тепла.
fb.ru
Свойства циклоалканов | Дистанционные уроки
28-Ноя-2012 | Нет комментариев | Лолита Окольнова

Циклоалканы — интересные вещества. С одной стороны, они насыщенные, т.к. связь С-С — одинарная, с другой стороны, общая формула у них как у алкенов — Cnh3n. Помимо этого, внутри гомологического ряда есть вещества, имеющие немного разные химические свойства…
Общая формула циклоалканов:
Сnh3n
n = числу атомов углерода.
Название углеводородов строятся из двух частей.
Первая часть «говорит» о том, что это циклические соединения — «цикло-«, вторая — название самого алкана по количеству атомов углерода, с традиционным для алканов окончанием -ан.
Изомерия циклоалканов
Структурная и межклассовая — циклоалканы изомерны алкенам
(есть еще пространственная, но в школьном курсе ее не затрагивают)
Химические свойства циклоалканов:


Вот тут-то мы и поговорим о «внутренних противоречиях»:
первые члены гомологического ряда — циклопропан (с меньшим количеством атомов углерода уже не может быть) и циклобутан имеют довольно маленькие углы между связями — у циклопропана — 60°, у циклобутана — 90°. (Для сравнения — у алканов — 109°28’, у алкенов — 120) Поэтому эти соединения неустойчивы в цикле — при первой же возможности они становятся производными алканов:
Гидрирование: C3H6 + h3 = C3H8 — реакция похожа на реакции алкенов
Галогенирование:

Гидрогалогенирование — аналогично.
Циклоалканы с большим количеством атомов углерода вступают в реакции замещения:

Это реакция замещения — характерная реакция алканов
Реакции окисления: цикл разрывается и по концам образуется группа -COOH:
C5h20 + [O] → HOOC-(Ch3)3-COOH
(циклопропан и циклобутан устойчивы к окислению)
Горение: все как обычно — все органические веществ сгорают с образованием CO2 и h3O:
Сnh3n + 3n\2 O2 = nCO2 + nh3O
В общем, если подвести итог, то картина такая:
- циклоалканы с небольшим числом атомов углерода: 3 и 4 вступают в реакции присоединения с раскрытием цикла;
- циклоалканы с большим числом атомов углерода вступают в реакции замещения
Получение циклоалканов:
- из линейных соединений — алканов:
Запомните правило — циклизация любых линейных соединений состоит из этапов:
1) активация цепи с двух концов: Сh3Cl — Ch3 — Ch3Cl
2) замыкание в цикл дегалогенированием: Сh3Cl — Ch3 — Ch3Cl + Zn = C3H6 + ZnCl2
- из ароматических соединений гидрированием: С6H6 +3h3 = С6h22
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Категории: |
Обсуждение: "Свойства циклоалканов"
(Правила комментирования)distant-lessons.ru
Получение. Свойства - Циклоалканы - Предельные углеводороды - Органическая химия
Физические свойства. При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 — С16) — жидкости, начиная с />C17 — твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
Получение.
1./>/> Основной способ получения циклоалканов — отщепление двух атомов галогена от дигалогеналканов:
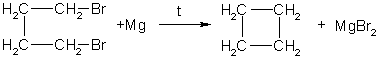
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
t°,P,NiC6H6 + 3h3 → C6h22.
Химические свойства. По химическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном):/>
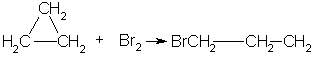
2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы.Присоединение происходит при нагревании в присутствии никелевого катализатора:/>
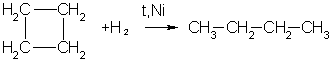
3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова:/>
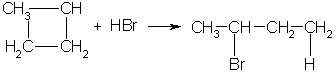
4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам:/>
t/>°С6Н12 + Вr2 → С6Н11Вr + НВr.
5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:/>
t° Ni C6h22 → C6H6 + 3h3.
6. При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота:
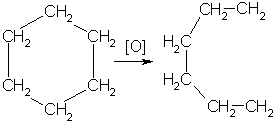
Особенности строения циклоалканов и их химическое поведение. Выше мы продемонстрировали неустойчивость малых циклов и их способность разрываться и вступать в реакции присоединения. Причины этого кроются в строении циклов. Так, циклопропан имеет плоское строение, поэтому атомы водорода у соседних атомов углерода располагаются над и под плоскостью цикла в энергетически невыгодном ("заслоненном") положении. Это — одна из причин "напряженности" цикла и его неустойчивости.
Исходя из того, что трехчленный цикл является плоским равносторонним треугольником, валентные углы между атомами углерода должны быть равными 60°, т.е. резко отличающимися от величины нормального валентного утла 109,5° для классического случая sp‘-гибридизации 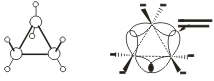 .
.
Установлено, что образование s-связей между атомами углерода происходит путем перекрывания sp3-гибридных орбиталей не по прямой, соединяющей ядра атомов, а вне ее.
Такое перекрывание не является осевым, характерным для образования s-связей, а несколько приближается к боковому перекрыванию, характерному для образования p-связей. Образовавшиеся s-связи с расположением максимальной электронной плотности вне прямой между ядрами связываемых атомов называют "банановыми". По свойствам они напоминают p-связи. Действительно, циклопропан способен вступать в реакции присоединения (с разрывом цикла).
Обычные циклы, наоборот, очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации.
Среди неплоских конформаций наиболее энергетически выгодной является конформация кресла, так как в ней все валентные углы между атомами углерода равны 109,5°, а атомы водорода у соседних атомов углерода находятся относительно друг друга в заторможенном положении.
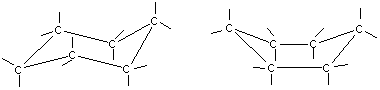
a б
Конформации шестичленного цикла: а — кресло: 6 — ванна.
Другое возможное для циклогексана расположение атомов соответствует конформации ванны, хотя оно менее устойчиво, чем конформация кресла. Следует отметить, что и в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
www.himhelp.ru

















