Содержание
Аммиак. Свойства аммиака. Получение аммиака. Соли аммония
Аммиак — одно из важнейших соединений азота.
Азот, входящий в состав белков и нуклеиновых кислот, является одним из компонентов, составляющих основу жизни. Поэтому очень важно было научиться синтезировать химические соединения с азотом. Сначала использовали электричество, но этот способ оказался очень дорогим. Более простым способом явилась химическая реакция соединения азота, находящегося в воздухе, с водородом в химическое соединение — аммиак!
Получение аммиака
Получение аммиака в промышленности связано с прямым его синтезом из простых веществ. Как уже отмечалось, источником азота служит воздух, а водород получают из воды.
3H2 + N2 → 2NH3 + Q
Аммиак. Водный раствор
Реакция синтеза аммиака обратима, поэтому важно подобрать условия, при которых выход аммиака в химической реакции будет наибольшим. Для этого реакцию проводят при высоком давлении (от 15 до 100 МПа). В ходе реакции объёмы газов (водорода и азота) уменьшаются в 2 раза, поэтому высокое давление позволяет увеличить количество образующегося аммиака. Катализатором в такой реакции может служить губчатое железо. При этом интересно то, что губчатое железо действует как катализатор только при температуре выше 5000C. Но увеличение температуры способствует распаду молекулы аммиака на водород и азот. Для избежания распада молекул, как только смесь газов проходит через губчатое железо, образовавшийся аммиак сразу охлаждают! Кроме того при сильном охлаждении аммиак превращается в жидкость.
Для этого реакцию проводят при высоком давлении (от 15 до 100 МПа). В ходе реакции объёмы газов (водорода и азота) уменьшаются в 2 раза, поэтому высокое давление позволяет увеличить количество образующегося аммиака. Катализатором в такой реакции может служить губчатое железо. При этом интересно то, что губчатое железо действует как катализатор только при температуре выше 5000C. Но увеличение температуры способствует распаду молекулы аммиака на водород и азот. Для избежания распада молекул, как только смесь газов проходит через губчатое железо, образовавшийся аммиак сразу охлаждают! Кроме того при сильном охлаждении аммиак превращается в жидкость.
Получение аммиака в лабораторных условиях производят из смеси твёрдого хлорида аммония (NH4Cl) и гашенной извести. При нагревании интенсивно выделяется аммиак.
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Свойства аммиака
Аммиак при обычных условиях — газ с резким и неприятным запахом.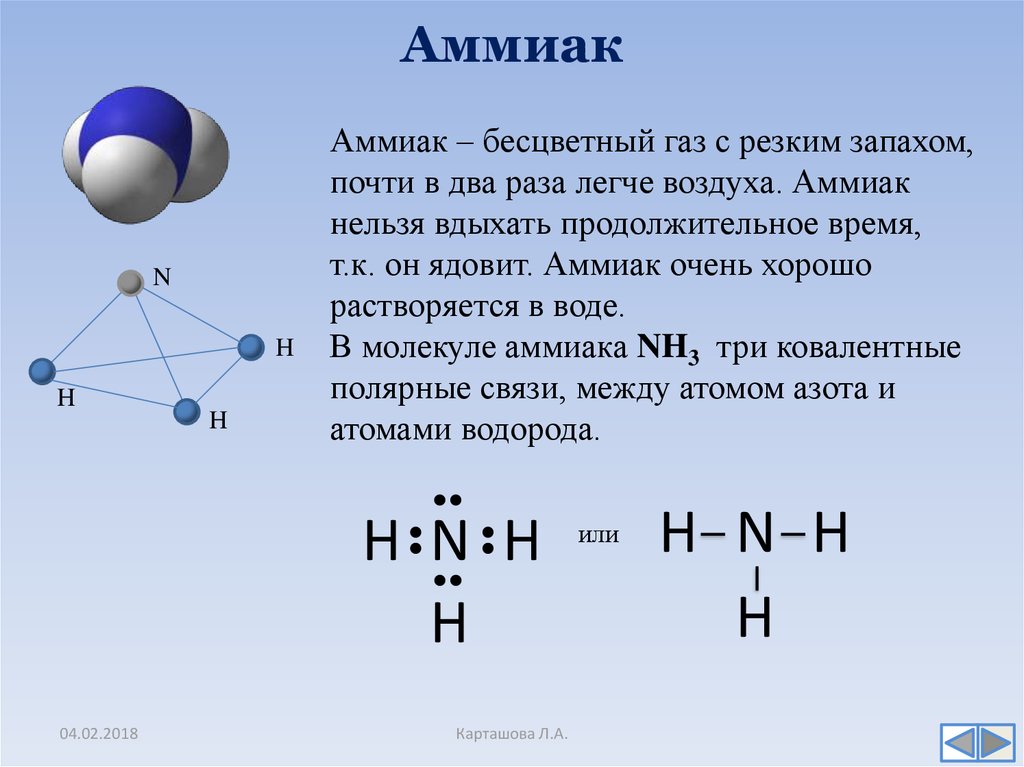 Аммиак ядовит! При 20 0C в воде растворяется 700 л аммиака. Полученный раствор называют аммиачной водой. Из-за такой растворимости аммиак нельзя собирать и хранить над водой.
Аммиак ядовит! При 20 0C в воде растворяется 700 л аммиака. Полученный раствор называют аммиачной водой. Из-за такой растворимости аммиак нельзя собирать и хранить над водой.
Аммиак — активный восстановитель. Такое свойство у него за счёт атомов азота, имеющих степень окисления «-3». Восстановительные свойства азота наблюдаются при горении аммиака на воздухе. Так как для азота наиболее устойчивая степень окисления — 0, то в результате этой реакции выделяется свободный азот.
Если в реакции горения использовать катализаторы (платину Pt и оксид хрома Cr2O3), то получают оксид азота.
4NH3 + 5 O2 → 4NO + 6H2O
Аммиак может восстанавливать металлы из их оксидов. Так реакцию с оксидом меди используют для получения азота.
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Реакция гидроксида меди с аммиаком
Аммиак обладает свойствами оснований и щелочей. При растворении его в воде образуется ион аммония и гидроксид-ион. При этом соединения NH4OH — не существует! Поэтому формулу аммиачной воды лучше записать, как формулу аммиака!
При растворении его в воде образуется ион аммония и гидроксид-ион. При этом соединения NH4OH — не существует! Поэтому формулу аммиачной воды лучше записать, как формулу аммиака!
Основные свойства аммиака проявляются также и в реакциях с кислотами.
NH3 + HCl → NH4Cl (нашатырь)
NH3 + HNO3 → NH4NO3 (аммиачная селитра)
Аммиак реагирует с органическими веществами. Например, искусственные аминокислоты получают с помощью реакции аммиака и A-хлорзамещёнными карбоновыми кислотами. Выделяющийся в результате реакции хлороводород (газ HCl) связывают с избытком аммиака, в результате которого образуется нашатырь (или хлорид аммония NH4Cl).
Многие комплексные соединения содержат в качестве лиганда аммиак. Аммиачный раствор оксида серебра, который используется для обнаружения альдегидов, представляет собой комплексное соединение — гидроксиддиаммин серебра.
Ag2O + 4NH3 + H2O →2[Ag(NH3)2]OH
Соли аммония
Соли аммония
— твёрдые кристаллические вещества, не имеющие окраски. Почти все они растворяются в воде, и им характерны все те же свойства, которые имеют известные нам соли металлов. Они взаимодействуют со щелочами, при этом выделяется аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
При этом, если дополнительно воспользоваться индикаторной бумагой, то эту реакцию можно использовать — как качественную реакцию на соли аммония. Соли аммония взаимодействуют с другими солями и кислотами. Например,
(NH4)2SO4 + BaCl2 → BaSO4 + 2NH4Cl
(NH4)2CO3 + 2HCl2 → 2NH4Cl + CO2 + H2O
Соли аммония неустойчивы к нагреванию. Некоторые из них, например хлорид аммония (или нашатырь), — возгоняются (испаряются при нагревании), другие, например нитрит аммония, — разлагаются
Некоторые из них, например хлорид аммония (или нашатырь), — возгоняются (испаряются при нагревании), другие, например нитрит аммония, — разлагаются
NH4Cl → NH3 + HCl
NH4NO2 → N2 + 2H2O
Последняя химическая реакция — разложение нитрита аммония — используется в химических лабораториях для получения чистого азота.
Аммиак — это слабое основание, поэтому соли, образованные аммиаком в водном растворе подвергаются гидролизу. В растворах этих солей имеется большое количество ионов гидроксония, поэтому реакция солей аммония — кислая!
NH4+ + H2O → NH3 + H3O+
Применение аммиака и его солей основано на специфических свойствах. Аммиак служит сырьём для производства азотосодержащих веществ, а также в составе солей широко применяется в качестве минеральных удобрений.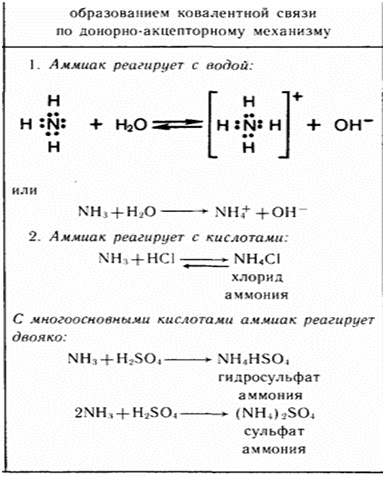 Водный раствор аммиака можно купить в аптеках под названием нашатырный спирт.
Водный раствор аммиака можно купить в аптеках под названием нашатырный спирт.
Аммиак газ, физические свойства аммиака, химические свойства аммиака.
ПродажаПроизводствоДоставка
Газообразный
марка 3.8марка 4.5
марка 5.0марка 6.0
Жидкий
технический марка Атехнический марка Ак
технический марка Б
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуяион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Химические свойства
- Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
- NH3 + H+ → NH4+
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
- NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
- Взаимодействуя с кислотами даёт соответствующие соли аммония:
- NH3 + HNO3 → NH4NO3
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды.
 Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
- 2NH3 + 2К = 2KNH2 + Н2
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
- NaNH2 + H2O → NaOH + NH3
- CaNH + 2H2O → Ca(OH)2 + NH3↑
- Zn3N2 + 6H2O → 3Zn(OH)2 + 2NH3↑
и в спиртах:
- KNH2 + C2H5OH → C2H5OK + NH3
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
- MNH2 → M+ + NH2−
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация.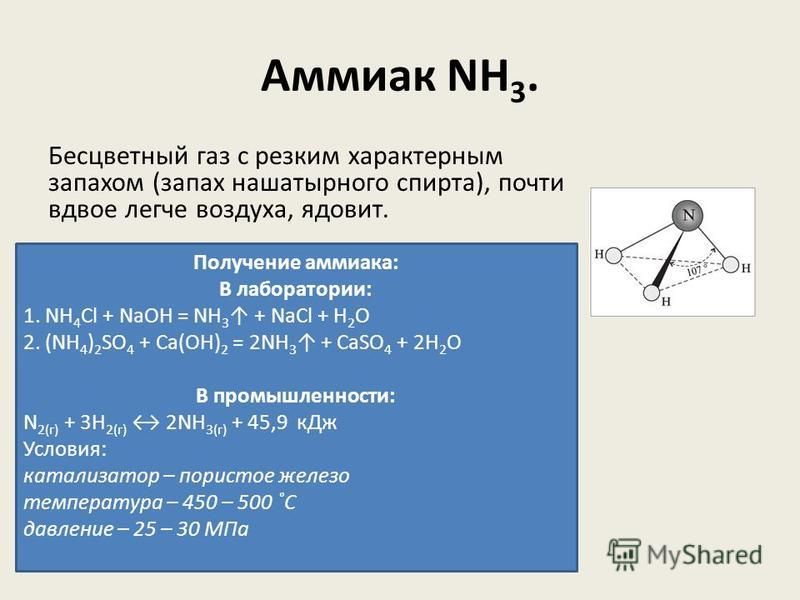 Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
- 4NH3 + 3O2 → 2N2 + 6H20
- 4NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
- 3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
- 2NH3 + NaClO → N2H4 + NaCl + H2O
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).

- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония)
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов(восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
- CH4 + NH3 + 1,5O2 → HCN + 3H2O
История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского словаамониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского словаамониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой:
- 2NH3 → NH4+ + NH2−
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
- 2Na + 2NH3 → 2NaNH2 + H2
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs.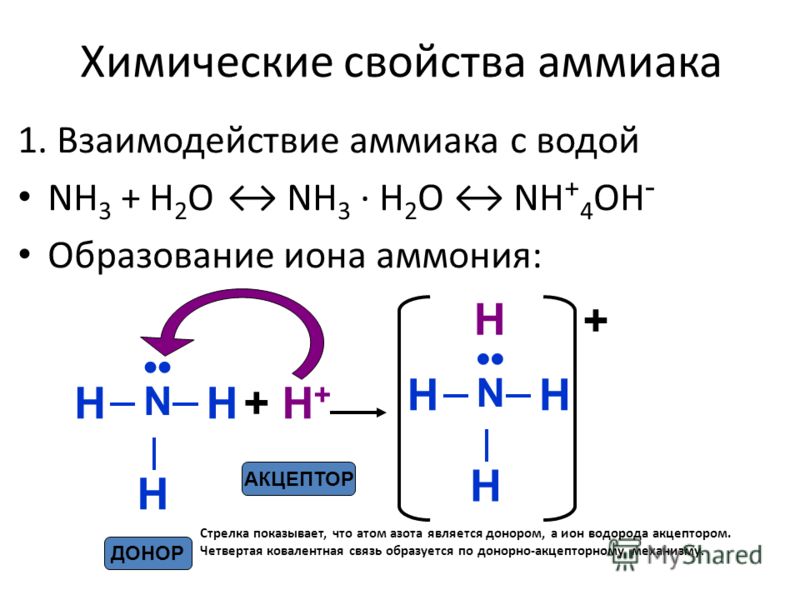 Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металловприводит к образованию их аминокомплексов:
- CuSO4 + 4NH3 → [Cu(NH3)4]SO4
- Ni(NO3)2 + 6NH3 → [Ni(NH2)6](NO3)2
Комплексообразование обычно сопровождается изменением окраски раствора, так в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую.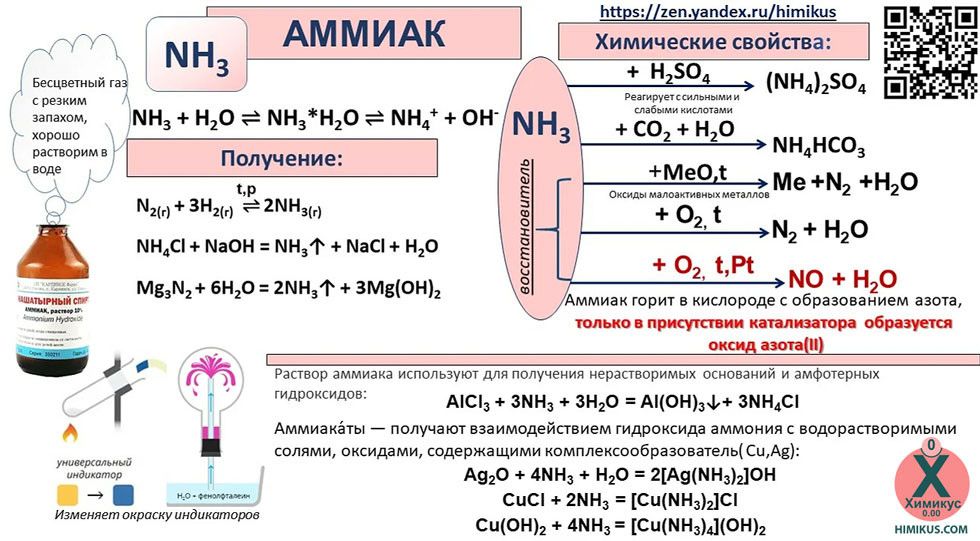 Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование». Таким образом из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой — глутаминовая и т. д.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзныйдерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов. Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов. Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области .
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5–1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку является слабым основанием при взаимодействии нейтрализует кислоты.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния.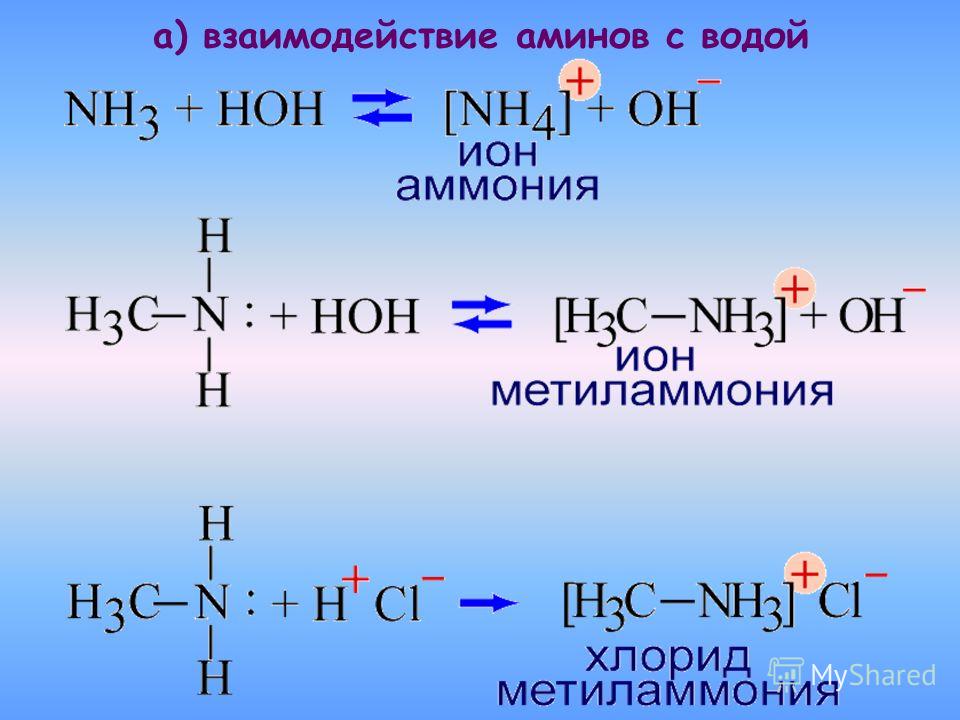 Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
Обычно лабораторным способом получают получают слабым нагреванием смеси хлорида аммония с гашеной известью. 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
Для осушения аммиака его пропускают через смесь извести с едким натром.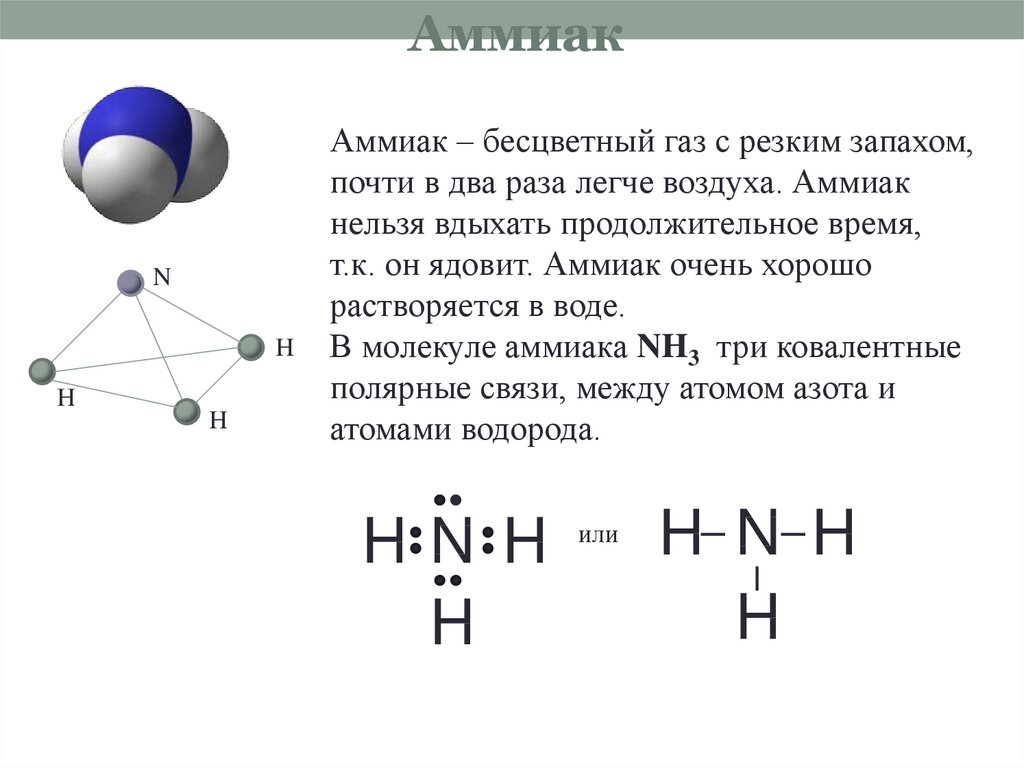
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление(при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер)[2]. В промышленности аммиак осушают в абсорбционных колоннах.
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания. Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов. При ингаляционном применении — рефлекторная остановка дыхания, при местном применении — раздражения, дерматиты, экземы в месте аппликации. Местное применение возможно только на неповрежденную кожу. При случайном поражении слизистой оболочки глаза промыть водой (по 15 мин через каждые 10 мин) или 5 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приема внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка. Взаимодействие с другими лекарственными средствами неизвестно. (Инструкция по применению)
Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приема внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка. Взаимодействие с другими лекарственными средствами неизвестно. (Инструкция по применению)
с реакцией нескольких элементов — Lambda Geeks
Nh4 — химическая формула аммиака, а h3O — химическая формула воды. Nh4 + h3O — это реакция гидролиза аммиака и воды.
Аммиак является природным соединением или может быть получен искусственно в лабораториях. Это прозрачный газ без цвета и с сильным резким запахом. Газообразный аммиак может смешиваться с водой и, будучи жидким аммиаком, даже жидкий аммиак может испаряться в газ при открытии на воздухе. Здесь мы обсуждаем реакцию Nh4 + h3O и ее факты.
Молекула аммиака состоит из двух элементов: одного центрального атома азота и трех атомов водорода, связанных с ним одинарными ковалентными связями N-H. Аммиак используется в различных бытовых и промышленных процессах, а также в качестве хладагента и удобрения в сельском хозяйстве. Это основной источник азота для различных растений и деревьев.
Аммиак используется в различных бытовых и промышленных процессах, а также в качестве хладагента и удобрения в сельском хозяйстве. Это основной источник азота для различных растений и деревьев.
Структура аммиака (Nh4)
Что происходит, когда Nh4 реагирует с h3O?
При растворении молекулы аммиака в воде происходит превращение газообразного аммиака в водный жидкий аммиак. Также, когда жидкий аммиак далее растворяется в воде, он может образовывать водный гидроксид аммония, который далее ионизируется в водный ион аммония и водный ион гидроксида.
Газообразный аммиак легко смешивается с водой. Его достаточно высокая растворимость в воде подтверждается водородными связями, образующимися между молекулами воды и аммиака. При растворении аммиака в воде образуется основной продукт. Если к воде добавить небольшое количество аммиака, он образует гидроксид аммония, который в дальнейшем диссоциирует на ион аммония (Nh5+) и ион гидроксида (OH-).
NH 3 (г) ⇔ NH 3 (водн.)
NH 3 (водн.) + H 2 O (ж) ⇔ NH 4 OH (водн.)
NH 4 OH (водн.) ⇔ NH 4 (водн.) + OH(водн.)
Какая реакция происходит?
Реакция воды с любым химическим соединением является реакцией гидролиза. Когда какое-либо вещество молекулы или химическое соединение добавляется к воде, если оно смешивается, тогда оно образует водородную связь с молекулой воды. Водородная связь — это слабая связь, которая легко разрывается и образует ионы H+ и OH-.
Также в этой реакции есть больше реагентов, но продукт только один. Означает, что есть два реагента, то есть аммиак (Nh4) и вода (h3O), но продукт только один, то есть гидроксид аммония (Nh5OH). Следовательно, эту реакцию также можно рассматривать как реакцию синтеза или реакцию химического соединения, потому что в реакции участвует много реагентов, но только один продукт.
Как сбалансировать Nh4 + h3O?
Чтобы сбалансировать любое химическое уравнение, мы должны выполнить несколько шагов. Чтобы сбалансировать уравнение Nh4 + h3O = Nh5OH, воспользуемся алгебраическим методом.
Шаг – 1 Пометьте каждую молекулу реакции Nh4 + h3O некоторыми переменными
Сначала мы должны пометить каждое соединение реакции Nh4 + h3O некоторой переменной, такой как A, B, C и т. д. Пометьте все реагенты, т. е. Nh4 и h3O, и продукт, т. е. Nh5OH уравнения с переменными A, B C для обозначения неизвестных коэффициентов.
(A) NH 3 + (B) H 2 O = (C) NH 4 OH
5 Шаг – 50006 Составьте систему или схему уравнений
Просто составьте уравнение каждого элемента или атома, присутствующих в реакции Nh4 + h3O, таких как атомы азота, водорода и кислорода (N, H, O), в котором каждый термин или символ обозначает количество атомы или элементы, присутствующие во всех реагентах и продуктах.
N =1A+0B=1C
H =3A+2B=5C
O =0A+1B=1C
Шаг – 3 Решить или вычислить все переменные, используя некоторые уравнения
Решить или вычислить каждую переменную используя некоторые возможные приемы или методы, такие как графический калькулятор или исключение Гаусса, для определения каждой переменной, такой как N, H и O
- 1. Методом исключения или замены Гаусса.
Здесь используйте функцию rref () в калькуляторе, чтобы преобразовать следующую матрицу в минимизированную низкоуровневую форму:
(1 0 -1 0)
(3 2 -5 0)
(3 1 -1 0)
(1 1 -1 5)
В последующей среде последний столбец должен содержать ответы для всех коэффициентов реакции Nh4 + h3O.
Таким образом, результаты показывают низкие или целые стандарты переменной или соединений реакции Nh4 + h3O.
A = 1(Nh4)
B = 1(h3O)
C = 1(Nh5OH)
Шаг – 4 На последнем шаге складываем коэффициенты и подтверждаем результаты реакции Nh4 + h3O.

1NH 3 + 1H 2 O = 1NH 4 OH
ATOMS LHS RHS
N 1 1
H 5 5
O 1 1
(где LHS = слева рука, RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS RHS. = правая часть)
Следовательно, в реагентах и продуктах уравнения NH 3 + H 2 9 имеется одинаковое количество всех атомов (N, H и O).0024 O = NH 4 OH, таким образом, уравнение сбалансировано.
Какой тип реакции Nh4 и h3O?
Когда аммиак реагирует с водой, Nh4 увеличивает концентрацию ионов гидроксида (OH-) в растворе. Аммиак не полностью растворяется в воде. Большинство молекул Nh4 присутствует в растворе в виде него. Таким образом, при взаимодействии с водой образуется меньше ионов ОН-.
В реакции Nh4 + h3O Nh4 ведет себя как кислота Бронстеда, а h3O ведет себя как основание. Аммиак является акцептором ионов H+, поэтому ведет себя как кислота Бронстеда, а вода является донором ионов H+, поэтому ведет себя как основание Бронстеда.
 Следовательно, аммиак является слабой кислотой, поэтому полностью не диссоциирует в воде.
Следовательно, аммиак является слабой кислотой, поэтому полностью не диссоциирует в воде.Nh4 + h3O результирующее ионное уравнение?
Чистое ионное уравнение реакции NH4 + H3O показано следующим образом:
NH 3 (AQ) + H 2 O (L) ⇔ NH 4 + + + + + + + + + + + + + + + + + + + + + + + + + + . OH – (aq)
Здесь аммиак (Nh4) полностью не диссоциирует в воде, поэтому он создает очень мало ионов OH- в растворе, и большая часть молекул Nh4 остается в этом растворе.
Межмолекулярные силы Nh4 и h3O
Nh4 – В молекуле Nh4 центральный атом N принадлежит к семейству трех элементов, которые могут образовывать водородные связи, когда он непосредственно присоединен к атому H.
 Таким образом, он имеет сильные межмолекулярные силы внутри молекул аммиака и воды, поскольку они могут образовывать водородные связи. Следовательно, и аммиак, и вода имеют более высокие температуры кипения.
Таким образом, он имеет сильные межмолекулярные силы внутри молекул аммиака и воды, поскольку они могут образовывать водородные связи. Следовательно, и аммиак, и вода имеют более высокие температуры кипения. Водородная связь и сильные межмолекулярные силы между аммиаком и водой
Как сбалансировать Zn+NO3+OH=ZnO2+Nh4+h3O?
Шаг — 1 Напишите несбалансированное уравнение или уравнение скелета, и для хороших результатов реакция должна быть в ионной форме
NO 3 — + Zn+ OH — → NH 3 + o — → NH 3 + o. 2- + H 2 O
Этап – 2 Разделить полуреакции. В окислительно-восстановительной реакции разделите реакции окисления и восстановления.
- Обозначьте степень окисления каждого атома в уравнении.
N+5o-2 3 —+Zn0+O-2H+1 — → N-3H+1 3 +Zn+2-2 2 2- +H+H+H+H+ 1 2 O-2
- Распознать и записать все пары окислительно-восстановительных реакций в реакции, значит определить, какая реакция окисляется, а какая восстанавливается.
 Также напишите перенос электрона, а также сделайте равное количество окисленных и восстановленных атомов как левой, так и правой сторон окислительно-восстановительных реакций, поставив, если необходимо, некоторые коэффициенты.
Также напишите перенос электрона, а также сделайте равное количество окисленных и восстановленных атомов как левой, так и правой сторон окислительно-восстановительных реакций, поставив, если необходимо, некоторые коэффициенты.
Oxidation: Zn0 → Zn+2O-2 2 2- + 2e – (Zn)
Reduction: N+5O-2 3 – + 8e – → N- 3H+1 3 (n)
- Реакция окислительно-восстановительного привода должна быть объединена в две половину реакции: одно окисление и еще одно восстановление
: Zn0 → Zn+2o-2 2 2- +2E 3 2 2- +2E 3 –
Сокращение: N+5O-2 3 – + 8e – → N-3H+1 3
Стадия – 3 .
окисление: Zn0 → Zn+2o-2 2 2- +2E —
РЕЗУМЕНТ: N+5O-2 3 —+8E – ° С 3 —+8E – ° С. ° С. ° С. ——+8E – ° С. . 3
° С. ° С. ——+8E – ° С. . 3
- Сбалансируйте заряд, присутствующий на левой и правой сторонах реакции.
Oxidation: Zn0 + 4OH – → Zn+2O-2 2 2- + 2e –
Reduction: N+5O-2 3 – + 8e – → N-3H+1 3 + 9OH –
- Сбалансируйте все атомы кислорода, присутствующие в левой и правой частях уравнения.
Окисление: Zn0 + 4OH – → Zn+2O-2 2 2- + 2e – + 2H 2 0 9 N O 90 90 90 90
3 3 – + 8e – + 6H 2 O → N-3H+1 3 + 9OH –
0 Сделать равной потерю электронов в реакции окисления и полувосстановления – 60
0 половинчатая реакция. Умножьте коэффициенты всех молекул на целые числа, вызывающие наименьшее общее кратное в пределах полуреакций, чтобы сделать их обе равными.
Окисление: Zn0 + 4OH – → Zn+2O-2 2 2- + 2e – + 2H 2 О | x 4
Восстановление: N+5O-2 3 – + 8e – + 6H 2 O → N-3H+1 3 + 9OH – | x 1
Таким образом, мы получаем,
Окисление: 4ZN0+ 16OH — → 4ZN+ 2-2 2 2-+ 8E — + 8H 2 O
RETED: N+ 5 5OO-RETED: N+ 5 5OO-RETED: N+ 5 5OO. 2 3 – + 8e – + 6H 2 O → N-3H+1 3 + 9OH –
–5 09 Шаг0006 Объединить или добавить обе полуреакции вместе.
4ZN0+N+5O-2 3 —+16OH —+8E —+6H 2 O → 4ZN+2-2 2 2- +2-3-3-3h+2-3. 3 + 8e – + 9OH – + 8H 2 O
Шаг – 6 Упростите уравнение, сократив общие элементы с обеих сторон уравнения, поэтому коэффициенты и напишите с возможными малыми целыми числами.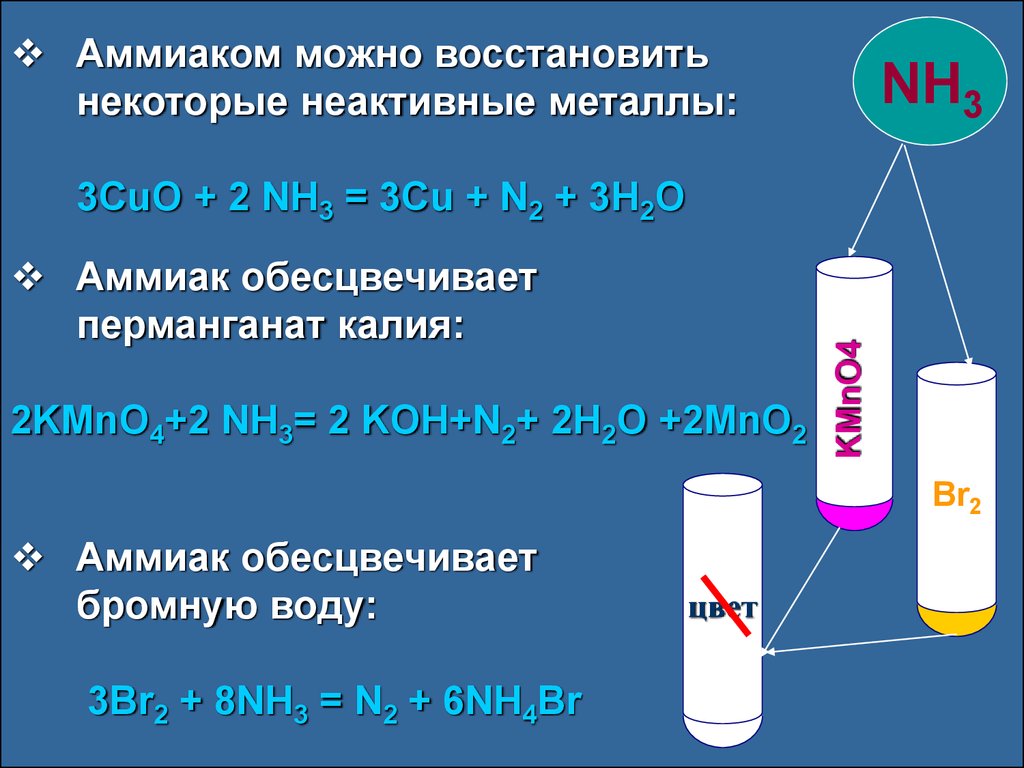
4zn0+n+5o-2 3 —+7OH — → 4ZN+2-2 2 2- +N-3H+1 3 +2H 2 434.3H+1 3 +2H 2 9344434434434.3H+1 3 +2H 2 4 29344. При последней проверке уравнение сбалансировано или нет
Atoms LHS RHS
Zn 4 4
N 1 1
O 1 × 3+7 × 1 4 × 2+2 × 1
H 7 × 1 1 × 3+2×2
Проверить сумму зарядов, присутствующих в обеих частях уравнения, на равенство или нет.
4×0 + 1x-1 + 7x-1 = 4x-2 + 1×0 + 2×0
-8 = -8
Поскольку все атомы и заряды равны с обеих сторон, уравнение сбалансировано .
NO 3 — + 4ZN+ 7OH — → NH 3 + 4ZNO 2 2- + 2H 2 O 9003
+ 2H 2 o
+ 2HANH 2 h 9003
9001 2 .
Шаг – 1 Подпишите каждую молекулу реакции Ch4CHO+AgNO3+Nh4+h3O с некоторыми переменными
Сначала мы должны пометить каждое соединение реакции какой-либо переменной, такой как A, B, C и т. д. Пометить все реагенты и продукт уравнения переменными A, B C для обозначения неизвестных коэффициентов.
д. Пометить все реагенты и продукт уравнения переменными A, B C для обозначения неизвестных коэффициентов.
A CH 3 CHO+B AGNO 3 +C NH 3 +D H 2 O = F CH 3 COONH 4 +G NH 4 NO 3 3 3 3 3 3 3 3 +H NH 4 NA 3 3 +H NH 4 NA 3 3 +G NH 4 . Ag
Шаг – 2 Составьте систему или схему уравнений
Просто сделайте уравнение каждого элемента или атома, доступного в реакции, например C, N, H, O, Ag, NO, в котором каждый термин или символ обозначает количество атомов или элементов, присутствующих во всех реагентах и продуктах.
C = 2A+0B +0C+0D=2F+0G+0H
N = 0A+0B+1C+0D=1F+1G+0H
H = 4A+0B+3C+2D=7F+4G+ 0H
O = 1A+0B+0C+1D=2F+0G+0H
Ag = 0A+1B+0C+0D=0F+0G+1H
NO = 0A+3B+0C+0D=0F+3G +0H
Шаг – 3 Решите или рассчитайте все переменные, используя некоторые уравнения
Решите или вычислите каждую переменную, используя некоторые возможные приемы или методы, такие как графический калькулятор или исключение Гаусса, чтобы найти каждую переменную, такую как C, N, H, O, Ag, NO.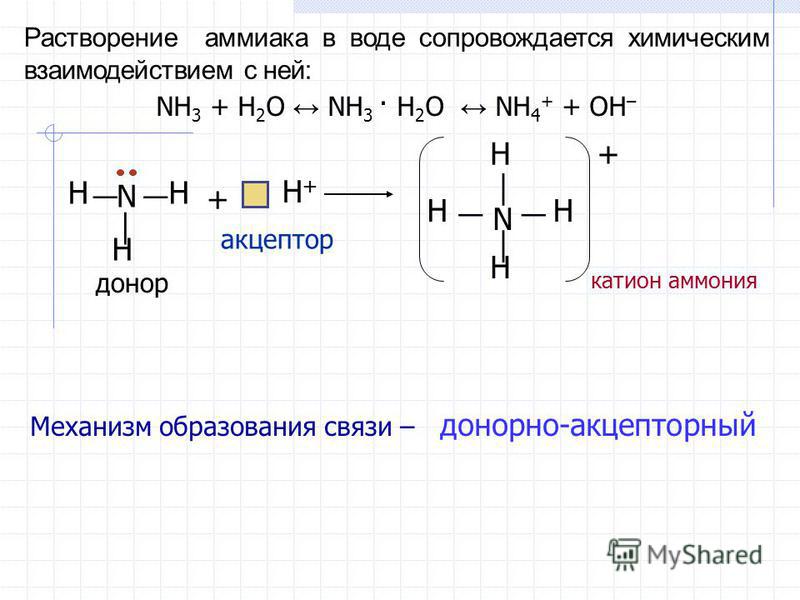
- 1. Методом исключения или подстановки Гаусса
2A–2F=0
1C-1F-1G=0 0
1B-1H=0
3B-3G=0
- 2. Используя калькулятор или метод графического калькулятора
Здесь используйте функцию Rref() в калькуляторе, чтобы преобразовать следующую матрицу в минимизированную уровень-форма:
(2 0 0 0 -2 0 0 0)
(0 0 1 0 -1 -1 0 0)
(4 0 3 2 -7 -4 0 0)
(1 0 0 1 -2 0 0 0)
(0 1 0 0 0 0 -1 0)
(1 1 1 1 -1 -1 -1 7)
(0 3 0 0 0 -3 0 0)
В последующем средстве последний столбец должен содержать ответы для всех младших стандартов или целых чисел реакции. переменная или соединения реакции Nh4 + h3O.
A = 1 (Ch4CHO)
B = 2 (AgNO3)
C = 3 (Nh4)
D = 1 (h3O)
F = 1 (Ch4COONh5)
G = 3 (NО)
H = 2 (Ag)
Шаг – 4 На последнем шаге складываем коэффициенты и подтверждаем результаты реакции.
CH 3 CHO + 2 AgNO 3 + 3 NH 3 + H 2 O = CH 3 COONH 4 + 2 NH 4 NO 3 + 2 AG
Atoms LHS RHS
C 2 2
N 3 3 3
H 15 15
O 2 2
AG 2 2
NO 6 6
(где, LHS = левая сторона, RHS = правая сторона)
Следовательно, существует одинаковое количество всех атомов (RHS = правая)
C, N, H, O, Ag, NO) присутствует в реагентах и продуктах уравнения CH 3 CHO + 2 AgNO 3 + 3 NH 3 + H 2 O = CH 3 COONH 4 + 2 NH 4 NO 3 + 2 Ag, поэтому уравнение сбалансировано.
Заключение:
Nh4 + h3O – это реакция гидролиза, в которой молекула аммиака взаимодействует с водой и Nh4 ведет себя как кислота Бронстеда, а h3O ведет себя как основание Бронстеда. Когда аммиак растворяется в воде, он образует водородную связь, благодаря которой он обладает сильными межмолекулярными силами. Здесь мы успешно сбалансировали реакцию Nh4 + h3O.
Когда аммиак растворяется в воде, он образует водородную связь, благодаря которой он обладает сильными межмолекулярными силами. Здесь мы успешно сбалансировали реакцию Nh4 + h3O.
Почему в реакции с аммиаком вода является кислотой?
Почему в реакции с аммиаком вода является кислотой?
Это важная общехимическая реакция, имеющая важное значение для органической химии. Другой похожий вопрос: почему вода в реакции с «кислотой» становится основанием? Ответ на оба вопроса: все относительно! Здесь, в StudyOrgo, мы часто получаем подобные вопросы по темам органической химии, которые обычно быстро освещаются, плохо описываются или ожидаются от предыдущих курсов. Эти концепции действительно важны для понимания более сложных тем. С членством в StudyOrgo вы получите еще больше советов и рекомендаций по темам органической химии и подробных механизмов с пояснениями. Сегодняшний блог представляет собой предварительный просмотр подробных тем и доступных материалов. Проверьте членство на StudyOrgo.com и зарегистрируйтесь сегодня!
Проверьте членство на StudyOrgo.com и зарегистрируйтесь сегодня!
Помните, что у кислот и оснований есть два определения; определение Бренстеда и Льюиса. Кислоты Бренстеда определяются как доноры протонов , тогда как Кислоты Льюиса определяются как акцепторы электронов . Оба являются кислотами, но мы по-разному думаем о том, участвуют ли протоны или электроны. В водном растворе, общей химии или биохимии, мы в основном думаем об определении Бренстеда, потому что диссоциация протонов из кислот изменяет концентрацию H+ в растворе, что мы интерпретируем как изменение pH и «кислотности» раствора. Мы измеряем диссоциацию протонов от кислот или принятие протонов основаниями с числовым значением, которое представляет собой pKa. Чем больше pKa, тем слабее кислота и сильнее основание. Чем ниже pKa, тем сильнее кислота и слабее основание. Легкий трюк для размышления о pKa заключается в том, чтобы поместить протонированную версию молекулы слева и думать о ней как о доноре протонов. pKa говорит вам, насколько легким будет это пожертвование, чем меньше число, тем легче будет пожертвование протона.
pKa говорит вам, насколько легким будет это пожертвование, чем меньше число, тем легче будет пожертвование протона.
Давайте посмотрим на реакцию аммиака и воды; pKa для воды определяется как 14. PKa для аммиака составляет ~ 37.
Следовательно, поскольку pKa воды ниже, чем у аммиака, она является более сильной кислотой, чем аммиак, и отдает протоны аммиачному основанию. Эта реакция приводит к тому, что вода становится сопряженным основанием OH-, а аммиак становится сопряженной кислотой Nh5+. Интересно, что именно поэтому аммиак является едким веществом, он образует гидроксид, который вступает в реакцию с пятнами и микроорганизмами, эффективно очищая и дезинфицируя предметы домашнего обихода.
Это важно как концепция органической химии, потому что сила кислот и оснований с точки зрения электронов или определение Льюиса — это именно то, как мы думаем о механизмах разрыва и образования связи; поток электронов. Сила кислот Льюиса и сопряженных кислот может помочь определить, в каком направлении пойдет реакция.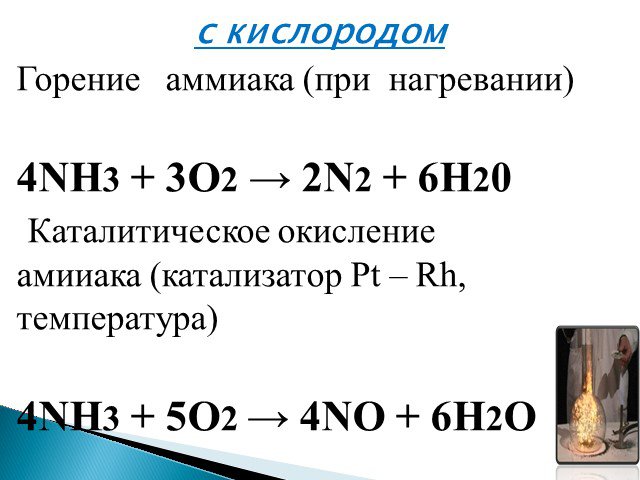

 Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:

 Следовательно, аммиак является слабой кислотой, поэтому полностью не диссоциирует в воде.
Следовательно, аммиак является слабой кислотой, поэтому полностью не диссоциирует в воде. Таким образом, он имеет сильные межмолекулярные силы внутри молекул аммиака и воды, поскольку они могут образовывать водородные связи. Следовательно, и аммиак, и вода имеют более высокие температуры кипения.
Таким образом, он имеет сильные межмолекулярные силы внутри молекул аммиака и воды, поскольку они могут образовывать водородные связи. Следовательно, и аммиак, и вода имеют более высокие температуры кипения.  Также напишите перенос электрона, а также сделайте равное количество окисленных и восстановленных атомов как левой, так и правой сторон окислительно-восстановительных реакций, поставив, если необходимо, некоторые коэффициенты.
Также напишите перенос электрона, а также сделайте равное количество окисленных и восстановленных атомов как левой, так и правой сторон окислительно-восстановительных реакций, поставив, если необходимо, некоторые коэффициенты.