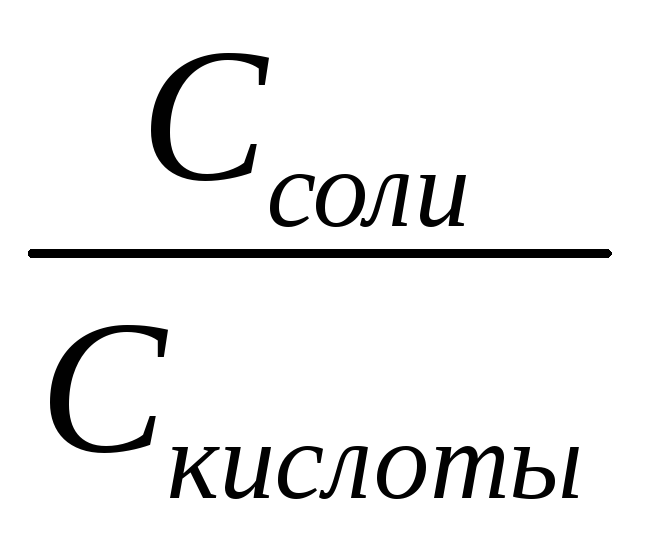Амфотерность. Амфотерность воды
Амфотерность - это... Что такое Амфотерность?
Амфоте́рность (от др.-греч. (ἀμφότεροι — «двойственный», «обоюдный») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бор, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно описать схемой:
H+ + RO– ROH
ROH  R+ + OH–
R+ + OH– 
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2 H+ + NO2- (Ka ~ 105) HNO2
H+ + NO2- (Ka ~ 105) HNO2 NO+ + OH- (Kb ~ 107).
NO+ + OH- (Kb ~ 107). Идеальным амфолитом будет вода:
h3O H+ + OH-
H+ + OH- Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
h3O + h3O h4O+ + OH-
h4O+ + OH- Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –Nh3. В растворе эти группы подвергаются частичной ионизации:
R–COOH + h3O R–COO– + h4O+ R–Nh3 + h3O
R–COO– + h4O+ R–Nh3 + h3O  R–Nh4+ + OH-
R–Nh4+ + OH- Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–Nh4+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–Nh3 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Cr(Oh4) (тв) + 3HCl (р-р) CrCl3 (р-р) + 3h3O Cr(Oh4) (тв) + NaOH (р-р) + 2h3O
CrCl3 (р-р) + 3h3O Cr(Oh4) (тв) + NaOH (р-р) + 2h3O  Na[Cr(OH)4(h3O)2] (р-р) Cr2O3 (тв) + 6HCl (р-р)
Na[Cr(OH)4(h3O)2] (р-р) Cr2O3 (тв) + 6HCl (р-р)  2CrCl3 (р-р) + 3h3O Cr2O3 (тв) + Na2CO3 (плавл)
2CrCl3 (р-р) + 3h3O Cr2O3 (тв) + Na2CO3 (плавл)  2NaCrO2 + CO2 (газ)
2NaCrO2 + CO2 (газ) Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами h3O и OH–. Например, для Al(Oh4) ионные равновесия могут быть записаны следующим образом:
[Al(OH)3(h3O)3] + 3h4O+ Al(h3O)63+ + 3h3O (в кислой среде) [Al(OH)3(h3O)3] + 3OH-
Al(h3O)63+ + 3h3O (в кислой среде) [Al(OH)3(h3O)3] + 3OH- Al(OH)63-. (в щелочной среде)
Al(OH)63-. (в щелочной среде) 4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(h3O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
См. также
Ссылки
Литература
- Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. - М.: Просвещение, 1982. - 271 с.
- Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с
Примечания
- ↑ Танганов Б.Б. Химические методы анализа. - Улан-Удэ, 2005.- 550 с.
- ↑ 1 2 3 Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. - М.: Просвещение, 1982. - 271 с.
- ↑ 1 2 Угай Я. А. Общая и неорганическая химия. - М.: Высшая школа, 1997. - 527 с.
- ↑ Автопротолиз воды / Жуков С. Т. Химия. 8-9 класс
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. – М.: Химия, 2000. – 480 с.: ил.
- ↑ Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с .
dic.academic.ru
Амфотерные соединения | Дистанционные уроки
05-Дек-2014 | комментария 4 | Лолита Окольнова
и их свойства

Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + h3O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид h3SO4 (серную кислоту):

Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
h3SO4 + 2KOH → K2SO4 + 2h3O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Наиболее часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды): ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, Al2O3, Al(OH)3, Fe2O3, Fe(OH)3, Cr2O3, Cr(OH)3.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами.
- с взаимодействием с кислотами все просто, в этих реакциях амфотерные соединения ведут себя как основные:
Оксиды:
Al2O3 + 6HCl → 2AlCl3 + 3h3O
ZnO + h3SO4 → ZnSO4 + h3O
BeO + HNO3 → Be(NO3)2 + h3O
Точно так же реагируют гидроксиды:
Fe(OH)3 + 3HCl → FeCl3 + 3h3O
Pb(OH)2 + 2HCl → PbCl2 + 2h3O
- С взаимодействием со щелочами немного сложнее. В этих реакциях амфотерные соединения ведут себя как кислоты, и продукты реакции могут быть различными, все зависит от условий.
Или реакция происходит в растворе, или реагирующие вещества берутся твердые и сплавляются.
Разберем на примере гидроксида цинка. Как уже говорилось ранее, амфотерные соединения взаимодействуя с основными, ведут себя как кислоты. Вот и запишем гидроксид цинка Zn(OH)2 как кислоту. У кислоты водород спереди, вынесем его: h3ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он – кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + h3ZnO2(тв.) (t,сплавление)→ K2ZnO2 + 2h3O
Полученное вещество K2ZnO2 называется метацинкат калия (или просто цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» h3ZnO2 (солями такие соединения называть не совсем правильно, но для собственного удобства мы про это забудем). Только гидроксид цинка записывать вот так: h3ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
2KOH(тв.) + Zn(OH)2(тв.) (t,сплавление)→ K2ZnO2 + 2h3O
С гидроксидами, в которых 2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2h3O + Na2BeO2 (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2h3O + Na2PbO2 (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя группами OH (Al(OH)3, Cr(OH)3, Fe(OH)3) немного иначе.
Разберем на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: h4AlO3, но в таком виде не оставляем, а выносим оттуда воду:
h4AlO3 – h3O → HAlO2 + h3O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH → h3O + KAlO2 (метаалюминат калия, или просто алюминат)
Но гидроксид алюминия вот так HAlO2 записывать нельзя, записываем как обычно, но подразумеваем там «кислоту»:
Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2h3O + KAlO2(метаалюминат калия)
То же самое и с гидроксидом хрома:
Cr(OH)3 → h4CrO3 → HCrO2
Cr(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2h3O + KCrO2(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли хромовой кислоты).
С гидроксидами содержащими четыре группы ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → h5SnO4 → h3SnO3
Pb(OH)4 → h5PbO4 → h3PbO3
Следует помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4, Pb(OH)4).
И эти гидроксиды будут образовывать разные «соли»:
| Степень окисления | +2 | +4 | ||
| Формула гидроксида | Sn(OH)2 | Pb(OH)2 | Sn(OH)4 | Pb(OH)4 |
| Формула гидроксида в виде кислоты | h3SnO2 | h3PbO2 | h3SnO3 | h3PbO3 |
| Соль (калиевая) | K2SnO2 | K2PbO2 | K2SnO3 | K2PbO3 |
| Название соли | станнИТ | блюмбИТ | метастаннАТ | метаблюмбАТ |
Те же принципы, что и в названиях обычных «солей», элемент в высшей степени окисления – суффикс АТ, в промежуточной – ИТ.
Такие «соли» (метахроматы, метаалюминаты, метабериллаты, метацинкаты и т.д.) получаются не только в результате взаимодействия щелочей и амфотерных гидроксидов. Эти соединения всегда образуются, когда соприкасаются сильноосновный «мир» и амфотерный (при сплавлении). То есть точно так же как и амфотерные гидроксиды со щелочами будут реагировать и амфотерные оксиды, и соли металлов, образующих амфотерные оксиды (соли слабых кислот). И вместо щелочи можно взять сильноосновный оксид, и соль металла, образующего щелочь (соль слабой кислоты).

Взаимодействия:
Запомните, реакции, приведенные ниже, протекают при сплавлении.
-
Амфотерного оксида с сильноосновным оксидом:
ZnO(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия, или просто цинкат калия)
-
Амфотерного оксида со щелочью:
ZnO(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + h3O↑
-
Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
ZnO(тв.)+ K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
-
Амфотерного гидроксида с сильноосновным оксидом:
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + h3O↑
-
Амфотерного гидроксида со щелочью:
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2h3O↑
-
Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
Zn(OH)2(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + h3O↑
-
Соли слабой кислоты и металла, образующего амфотерные соединение с сильноосновным оксидом:
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
-
Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + h3O↑
-
Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой кислоты и металла, образующего щелочь:
ZnCO3(тв.)+ K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
Ниже представлена информация по солям амфотерных гидроксидов, красным помечены наиболее встречающиеся в ЕГЭ.
| Оксид | Гидроксид | Гидроксид в виде кислоты | Кислотный остаток | Соль | Название соли |
| BeO | Be(OH)2 | h3BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
| ZnO | Zn(OH)2 | h3ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
| Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
| Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
| SnO | Sn(OH)2 | h3SnO2 | SnO22- | K2SnO2 | СтаннИТ |
| PbO | Pb(OH)2 | h3PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
| SnO2 | Sn(OH)4 | h3SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
| PbO2 | Pb(OH)4 | h3PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
| Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ) |
В ЕГЭ это называют «растворением гидроксида алюминия (цинка, бериллия и т.д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
Мы будем рассматривать два случая: когда металл окружен четырьмя гидроксид-ионами, и когда он окружен шестью гидроксид-ионами.
Запишем сокращенное ионное уравнение этих процессов:
Al(OH)3 + OH— → Al(OH)4—
Образовавшийся ион называется Тетрагидроксоалюминат-ион. Приставка «тетра-» прибавляется, потому что гидроксид-иона четыре. Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Al(OH)3 + 3OH— → Al(OH)63-
Образовавшийся в этой реакции ион называется гексагидроксоалюминат ион. Приставка «гексо-» прибавляется, потому что гидроксид-иона шесть.
Прибавлять приставку, указывающую на количество гидроксид-ионов обязательно. Потому что если вы напишете просто «гидроксоалюминат», не понятно, какой ион вы имеете в виду: Al(OH)4— или Al(OH)63-.
При взаимодействии щелочи с амфотерным гидроксидом в растворе образуется соль. Катион которой – это катион щелочи, а анион – это сложный ион, образование которого мы рассмотрели ранее. Анион заключается в квадратные скобки.
Al(OH)3 + KOH → K[Al(OH)4] (тетрагидроксоалюминат калия)
Al(OH)3 + 3KOH → K3[Al(OH)6] (гексагидроксоалюминат калия)
Какую именно (гекса- или тетра-) соль вы напишете как продукт – не имеет никакого значения. Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Кроме амфотерных гидроксидов, со щелочами реагируют амфотерные оксиды. Продукт будет тот же. Только вот если вы запишете реакцию вот так:
Al2O3 + NaOH → Na[Al(OH)4]
Al2O3 + NaOH → Na3[Al(OH)6]
Но эти реакции у вас не уравняются. Надо добавить воду в левую часть, взаимодейтсиве ведь происходит в растворе, воды там дотаточно, и все уравняется:
Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4]
Al2O3 + 6NaOH + 3h3O → 2Na3[Al(OH)6]
Помимо амфотерных оксидов и гидроксидов, с растворами щелочей взаимодействуют некоторые особо активные металлы, которые образуют амфотерные соединения. А именно это: алюминий, цинк и бериллий. Чтобы уравнялось, слева тоже нужна вода. И, кроме того, главное отличие этих процессов – это выделение водорода:
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑
2Al + 6NaOH + 6h3O → 2Na3[Al(OH)6] + 3h3↑
В таблице ниже приведены наиболее распространенные в ЕГЭ примеры свойства амфотерных соединений:
| Амфотерное вещество | Соль | Название соли | Реакции |
| Al Al2O3 Al(OH)3 | Na[Al(OH)4] | Тетрагидроксоалюминат натрия | Al(OH)3 + NaOH → Na[Al(OH)4] Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4] 2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑ |
| Na3[Al(OH)6] | Гексагидроксоалюминат натрия | Al(OH)3 + 3NaOH → Na3[Al(OH)6] Al2O3 + 6NaOH + 3h3O → 2Na3[Al(OH)6] 2Al + 6NaOH + 6h3O → 2Na3[Al(OH)6] + 3h3↑ | |
| Zn ZnO Zn(OH)2 | K2[Zn(OH)4] | Тетрагидроксоцинкат натрия | Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] ZnO + 2NaOH + h3O → Na2[Zn(OH)4] Zn + 2NaOH + 2h3O → Na2[Zn(OH)4]+ h3↑ |
| K4[Zn(OH)6] | Гексагидроксоцинкат натрия | Zn(OH)2 + 4NaOH → Na4[Zn(OH)6] ZnO + 4NaOH + h3O → Na4[Zn(OH)6] Zn + 4NaOH + 2h3O → Na4[Zn(OH)6]+ h3↑ | |
| Be BeO Be(OH)2 | Li2[Be(OH)4] | Тетрагидроксобериллат лития | Be(OH)2 + 2LiOH → Li2[Be(OH)4] BeO + 2LiOH + h3O → Li2[Be(OH)4] Be + 2LiOH + 2h3O → Li2[Be(OH)4]+ h3↑ |
| Li4[Be(OH)6] | Гексагидроксобериллат лития | Be(OH)2 + 4LiOH → Li4[Be(OH)6] BeO + 4LiOH + h3O → Li4[Be(OH)6] Be + 4LiOH + 2h3O → Li4[Be(OH)6]+ h3↑ | |
| Cr2O3 Cr(OH)3 | Na[Cr(OH)4] | Тетрагидроксохромат натрия | Cr(OH)3 + NaOH → Na[Cr(OH)4] Cr2O3 + 2NaOH + 3h3O → 2Na[Cr(OH)4] |
| Na3[Cr(OH)6] | Гексагидроксохромат натрия | Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] Cr2O3 + 6NaOH + 3h3O → 2Na3[Cr(OH)6] | |
| Fe2O3 Fe(OH)3 | Na[Fe(OH)4] | Тетрагидроксоферрат натрия | Fe(OH)3 + NaOH → Na[Fe(OH)4] Fe2O3 + 2NaOH + 3h3O → 2Na[Fe(OH)4] |
| Na3[Fe(OH)6] | Гексагидроксоферрат натрия | Fe(OH)3 + 3NaOH → Na3[Fe(OH)6] Fe2O3 + 6NaOH + 3h3O → 2Na3[Fe(OH)6] |
Полученные в этих взаимодействиях соли реагируют с кислотами, образуя две другие соли (соли данной кислоты и двух металлов):
2Na3[Al(OH)6] + 6h3SO4 → 3Na2SO4 + Al2(SO4)3 + 12h3O
Вот и все! Ничего сложного. Главное не путайте, помните что образуется при сплавлении, что в растворе. Очень часто задания по этому вопросу попадаются в B части.
Еще на эту тему:
Обсуждение: "Амфотерные соединения"
(Правила комментирования)distant-lessons.ru
Амфотерность — WiKi
Амфоте́рность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
H++XO−⇄XOH⇄X++OH−{\displaystyle {\mathsf {H^{+}+XO^{-}\rightleftarrows XOH\rightleftarrows X^{+}+OH^{-}}}}Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2⇄H++NO2− Ka≈10−5{\displaystyle {\mathsf {HNO_{2}\rightleftarrows H^{+}+NO_{2}^{-}\ \ K_{a}\approx 10^{-5}}}} HNO2⇄NO++OH− Kb≈10−7{\displaystyle {\mathsf {HNO_{2}\rightleftarrows NO^{+}+OH^{-}\ \ K_{b}\approx 10^{-7}}}}Идеальным амфолитом будет вода:
h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
2h3O→h4O++OH−{\displaystyle {\mathsf {2H_{2}O\rightarrow H_{3}O^{+}+OH^{-}}}}Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –Nh3. В растворе эти группы подвергаются частичной ионизации:
h3N-CH(R)-COOH+h3O⇄h3N-CH(R)-COO−+h4O+{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows H_{2}N{\text{-}}CH(R){\text{-}}COO^{-}+H_{3}O^{+}}}} h3N-CH(R)-COOH+h3O⇄[h4N-CH(R)-COOH]++OH−{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows [H_{3}N{\text{-}}CH(R){\text{-}}COOH]^{+}+OH^{-}}}}Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–Nh4+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–Nh3 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Cr(OH)3+3HCl→CrCl3+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3HCl\rightarrow CrCl_{3}+3H_{2}O}}} Cr(OH)3+3NaOH→Na3[Cr(OH)6]{\displaystyle {\mathsf {Cr(OH)_{3}+3NaOH\rightarrow Na_{3}[Cr(OH)_{6}]}}} Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}} Cr2O3+2NaOH→ot2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH{\xrightarrow[{}]{^{o}t}}2NaCrO_{2}+H_{2}O}}}Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами h3O и OH–. Например, для Al(OH)3 ионные равновесия могут быть записаны следующим образом:
[Al(OH)3(h3O)3]+3h4O+⇄[Al(h3O)6]3++3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3H_{3}O^{+}\rightleftarrows [Al(H_{2}O)_{6}]^{3+}+3H_{2}O}}} [Al(OH)3(h3O)3]+3OH−⇄[Al(OH)6]3−+3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3OH^{-}\rightleftarrows [Al(OH)_{6}]^{3-}+3H_{2}O}}}4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(h3O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
ru-wiki.org
Амфотерность Википедия
Амфоте́рность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
H++XO−⇄XOH⇄X++OH−{\displaystyle {\mathsf {H^{+}+XO^{-}\rightleftarrows XOH\rightleftarrows X^{+}+OH^{-}}}}Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2⇄H++NO2− Ka≈10−5{\displaystyle {\mathsf {HNO_{2}\rightleftarrows H^{+}+NO_{2}^{-}\ \ K_{a}\approx 10^{-5}}}} HNO2⇄NO++OH− Kb≈10−7{\displaystyle {\mathsf {HNO_{2}\rightleftarrows NO^{+}+OH^{-}\ \ K_{b}\approx 10^{-7}}}}Идеальным амфолитом будет вода:
h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
2h3O→h4O++OH−{\displaystyle {\mathsf {2H_{2}O\rightarrow H_{3}O^{+}+OH^{-}}}}Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –Nh3. В растворе эти группы подвергаются частичной ионизации:
h3N-CH(R)-COOH+h3O⇄h3N-CH(R)-COO−+h4O+{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows H_{2}N{\text{-}}CH(R){\text{-}}COO^{-}+H_{3}O^{+}}}}h3N-CH(R)-COOH+h3O⇄[h4N-CH(R)-COOH]++OH−{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows [H_{3}N{\text{-}}CH(R){\text{-}}COOH]^{+}+OH^{-}}}}Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–Nh4+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–Nh3 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Cr(OH)3+3HCl→CrCl3+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3HCl\rightarrow CrCl_{3}+3H_{2}O}}}Cr(OH)3+3NaOH→Na3[Cr(OH)6]{\displaystyle {\mathsf {Cr(OH)_{3}+3NaOH\rightarrow Na_{3}[Cr(OH)_{6}]}}}Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}}Cr2O3+2NaOH→ot2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH{\xrightarrow[{}]{^{o}t}}2NaCrO_{2}+H_{2}O}}}Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами h3O и OH–. Например, для Al(OH)3 ионные равновесия могут быть записаны следующим образом:
[Al(OH)3(h3O)3]+3h4O+⇄[Al(h3O)6]3++3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3H_{3}O^{+}\rightleftarrows [Al(H_{2}O)_{6}]^{3+}+3H_{2}O}}}[Al(OH)3(h3O)3]+3OH−⇄[Al(OH)6]3−+3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3OH^{-}\rightleftarrows [Al(OH)_{6}]^{3-}+3H_{2}O}}}4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(h3O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
См. также
Ссылки
Литература
- Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. - М.: Просвещение, 1982. - 271 с.
- Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с
Примечания
- ↑ Танганов Б.Б. Химические методы анализа. - Улан-Удэ, 2005.- 550 с.
- ↑ 1 2 3 Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. - М.: Просвещение, 1982. - 271 с.
- ↑ 1 2 Угай Я. А. Общая и неорганическая химия. - М.: Высшая школа, 1997. - 527 с.
- ↑ Автопротолиз воды / Жуков С. Т. Химия. 8-9 класс
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. – М.: Химия, 2000. – 480 с.: ил.
- ↑ Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с .
wikiredia.ru
Амфотерность - Амфотерность как химическое свойство
Химия - Амфотерность - Амфотерность как химическое свойство
28 февраля 2011Оглавление:1. Амфотерность2. Амфотерность как химическое свойство
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот, так и по механизму оснований. Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно описать схемой:
H + RO ROH
ROH  R + OH
R + OH 
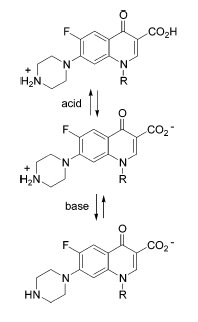
Амфотерное поведение фторхинолонов
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2 H + NO2 HNO2
H + NO2 HNO2 NO + OH.
NO + OH. Идеальным амфолитом будет вода:
h3O H + O
H + O Также к числу идеальных амфолитов относят гидроксид галлия Ga3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы.
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз:
h3O + h3O h4O + OH
h4O + OH Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –Nh3. В растворе эти группы подвергаются частичной ионизации:
R–COOH + h3O R–COO + h4O R–Nh3 + h3O
R–COO + h4O R–Nh3 + h3O  R–Nh4 + OH
R–Nh4 + OH Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной и незаряженной. В этих комбинациях R–COOH и R–Nh4 являются потенциальными кислотами, а R–COO и R–Nh3 – сопряженными потенциальными основаниями.
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома известны реакции:
Cr + 3HCl CrCl3 + 3h3O Cr + NaOH + 2h3O
CrCl3 + 3h3O Cr + NaOH + 2h3O  Na Cr2O3 + 6HCl
Na Cr2O3 + 6HCl  2CrCl3 + 3h3O Cr2O3 + Na2CO3
2CrCl3 + 3h3O Cr2O3 + Na2CO3 2NaCrO2 + CO2
2NaCrO2 + CO2 Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам. В общем виде амфотерное поведение нерастворимых гидроксидов хрома, алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами h3O и OH. Например, для Al ионные равновесия могут быть записаны следующим образом:
+ 3h4O Al6 + 3h3O + 3OH
Al6 + 3h3O + 3OH  Al6.
Al6. 4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка: ZnCl2,SO4 и Na2ZnO2, Na24).
Просмотров: 2644
4108.ru
Амфотерность — Википедия РУ
Амфоте́рность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
H++XO−⇄XOH⇄X++OH−{\displaystyle {\mathsf {H^{+}+XO^{-}\rightleftarrows XOH\rightleftarrows X^{+}+OH^{-}}}}Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2⇄H++NO2− Ka≈10−5{\displaystyle {\mathsf {HNO_{2}\rightleftarrows H^{+}+NO_{2}^{-}\ \ K_{a}\approx 10^{-5}}}} HNO2⇄NO++OH− Kb≈10−7{\displaystyle {\mathsf {HNO_{2}\rightleftarrows NO^{+}+OH^{-}\ \ K_{b}\approx 10^{-7}}}}Идеальным амфолитом будет вода:
h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
2h3O→h4O++OH−{\displaystyle {\mathsf {2H_{2}O\rightarrow H_{3}O^{+}+OH^{-}}}}Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –Nh3. В растворе эти группы подвергаются частичной ионизации:
h3N-CH(R)-COOH+h3O⇄h3N-CH(R)-COO−+h4O+{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows H_{2}N{\text{-}}CH(R){\text{-}}COO^{-}+H_{3}O^{+}}}} h3N-CH(R)-COOH+h3O⇄[h4N-CH(R)-COOH]++OH−{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows [H_{3}N{\text{-}}CH(R){\text{-}}COOH]^{+}+OH^{-}}}}Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–Nh4+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–Nh3 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Cr(OH)3+3HCl→CrCl3+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3HCl\rightarrow CrCl_{3}+3H_{2}O}}} Cr(OH)3+3NaOH→Na3[Cr(OH)6]{\displaystyle {\mathsf {Cr(OH)_{3}+3NaOH\rightarrow Na_{3}[Cr(OH)_{6}]}}} Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}} Cr2O3+2NaOH→ot2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH{\xrightarrow[{}]{^{o}t}}2NaCrO_{2}+H_{2}O}}}Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами h3O и OH–. Например, для Al(OH)3 ионные равновесия могут быть записаны следующим образом:
[Al(OH)3(h3O)3]+3h4O+⇄[Al(h3O)6]3++3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3H_{3}O^{+}\rightleftarrows [Al(H_{2}O)_{6}]^{3+}+3H_{2}O}}} [Al(OH)3(h3O)3]+3OH−⇄[Al(OH)6]3−+3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3OH^{-}\rightleftarrows [Al(OH)_{6}]^{3-}+3H_{2}O}}}4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(h3O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
http-wikipediya.ru


 HNO2⇄NO++OH− Kb≈10−7{\displaystyle {\mathsf {HNO_{2}\rightleftarrows NO^{+}+OH^{-}\ \ K_{b}\approx 10^{-7}}}}
HNO2⇄NO++OH− Kb≈10−7{\displaystyle {\mathsf {HNO_{2}\rightleftarrows NO^{+}+OH^{-}\ \ K_{b}\approx 10^{-7}}}}


 h3N-CH(R)-COOH+h3O⇄[h4N-CH(R)-COOH]++OH−{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows [H_{3}N{\text{-}}CH(R){\text{-}}COOH]^{+}+OH^{-}}}}
h3N-CH(R)-COOH+h3O⇄[h4N-CH(R)-COOH]++OH−{\displaystyle {\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows [H_{3}N{\text{-}}CH(R){\text{-}}COOH]^{+}+OH^{-}}}}![{\mathsf {H_{2}N{\text{-}}CH(R){\text{-}}COOH+H_{2}O\rightleftarrows [H_{3}N{\text{-}}CH(R){\text{-}}COOH]^{+}+OH^{-}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/6560c9779c0151e38468609d680cce17c09b5aec)
 Cr(OH)3+3NaOH→Na3[Cr(OH)6]{\displaystyle {\mathsf {Cr(OH)_{3}+3NaOH\rightarrow Na_{3}[Cr(OH)_{6}]}}}
Cr(OH)3+3NaOH→Na3[Cr(OH)6]{\displaystyle {\mathsf {Cr(OH)_{3}+3NaOH\rightarrow Na_{3}[Cr(OH)_{6}]}}}![{\mathsf {Cr(OH)_{3}+3NaOH\rightarrow Na_{3}[Cr(OH)_{6}]}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/dec2c40000ec9290f591073f3abce87f6dc82854) Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}}
Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}} Cr2O3+2NaOH→ot2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH{\xrightarrow[{}]{^{o}t}}2NaCrO_{2}+H_{2}O}}}
Cr2O3+2NaOH→ot2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH{\xrightarrow[{}]{^{o}t}}2NaCrO_{2}+H_{2}O}}}![{\mathsf {Cr_{2}O_{3}+2NaOH{\xrightarrow[ {}]{^{o}t}}2NaCrO_{2}+H_{2}O}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/30fb0c2af546eb92d64d396daeacb7b3e7ed998b)
![{\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3H_{3}O^{+}\rightleftarrows [Al(H_{2}O)_{6}]^{{3+}}+3H_{2}O}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/5ea315ed0adc828c32124497c1eb071ff6176129) [Al(OH)3(h3O)3]+3OH−⇄[Al(OH)6]3−+3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3OH^{-}\rightleftarrows [Al(OH)_{6}]^{3-}+3H_{2}O}}}
[Al(OH)3(h3O)3]+3OH−⇄[Al(OH)6]3−+3h3O{\displaystyle {\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3OH^{-}\rightleftarrows [Al(OH)_{6}]^{3-}+3H_{2}O}}}![{\mathsf {[Al(OH)_{3}(H_{2}O)_{3}]+3OH^{-}\rightleftarrows [Al(OH)_{6}]^{{3-}}+3H_{2}O}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/e3786a07f6660518a28dbe89ea8f81ed224632f7)