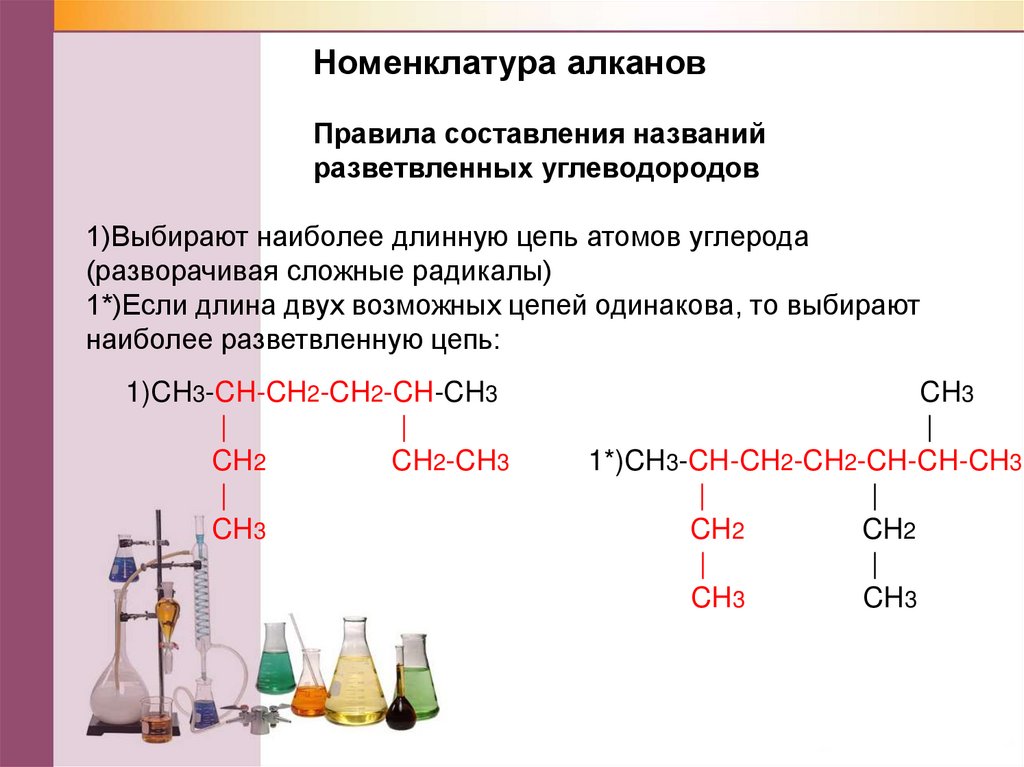
Содержание
Что происходит, когда алкан смешивается с бромной водой?
Бромная вода не реагирует с алканами при стандартных условиях. Бромная вода используется, чтобы отличить алканы от алкенов, поскольку она реагирует с алкенами с образованием бромированного углеводорода и превращает бромную воду из желто-коричневой в бесцветную.
Алканы реагируют с бромной водой в присутствии ультрафиолета. В этом случае они производят бромированный углеводород с бромистым водородом. Если рассматриваемый алкан имеет более двух атомов углерода, образуется множество соединений. Алкины, углеводороды, содержащие по крайней мере одну тройную углерод-углеродную связь, также подвергаются бромированию, поэтому этот метод нельзя использовать для определения разницы между ними и алкенами.
Похожие посты
Какие твердые вещества растворяются в воде?
Растворим ли аспирин в воде?
Проводит ли нефть электричество?
Почему соль быстрее растворяется в горячей воде?
Другие интересные посты
Почему мы солим ледяные дороги зимой?
Почему синий метилен используется в лаборатории по изучению клеток щек?
Как прогнозируются или прогнозируются метели?
Для чего в организме используются липиды?
Что образуется при взаимодействии оксидов металлов с водой?
Почему мужчины во время полового акта потеют больше, чем женщины?
Как называются некоторые составные вулканы?
В каком биоме находится Флорида?
Какая самая длинная кость в теле человека?
Какая плотность резины?
Как эрозия почвы влияет на людей?
Какие газы составляют воздух?
Каковы примеры повседневных химических реакций?
Что такое дециметр на линейке?
Качественные реакции органической химии | Консультация по химии (10 класс) по теме:
Качественные реакции органической химии.
1. Качественная реакция на алканы. Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
2. Качественная реакция на алкены. Чтобы убедиться в наличии алкена, нужно пропустить его в раствор перманганата калия (реакция Вагнера). В ходе реакции раствор обесцветится, выпадает бурый диоксид марганца MnO2 (реакция на примере этилена):
3C2h5 + 2KMnO4 + 4h3O ——> 3Ch3OH-Ch3OH + 2KOH + 2MnO2↓
Так же, алкены обесцвечивают бромную воду:
C2h5 + Br2 ——> C2h5Br2
Бромная вода обесцвечивается, образуется дибромпроизводное.
3. Качественная реакция на алкины. Алкины можно выявить и по реакции Вагнера или с помощью бромной воды:
3C2h3 + 8KMnO4 ——> 3KOOC-COOK + 8MnO2↓ + 2KOH + 2h3O
C2h3 + 2Br2 —-> C2h3Br4
Алкины с тройной связью у крайнего атома углерода реагируют с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса):
C2h3 + 2[Ag(Nh4)2]OH ——-> Ag2C2↓ + 4Nh4↑ + 2h3O
Получившийся ацетиленид серебра (I) выпадает в осадок.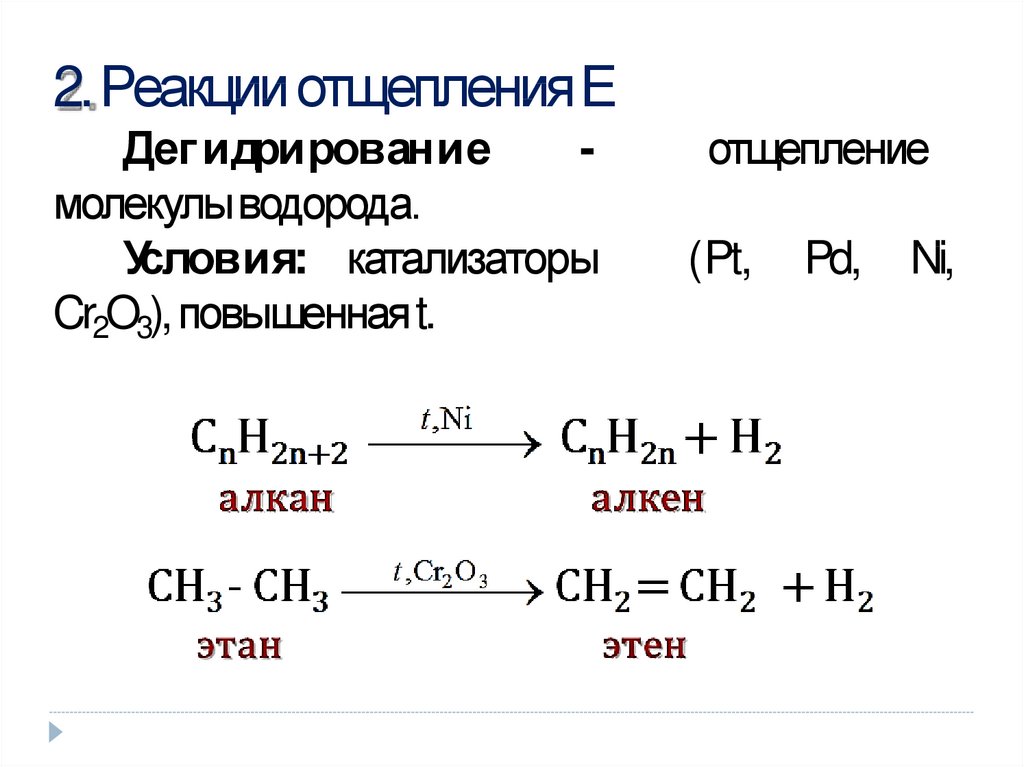
Алкины, у которых тройная связь в середине (R-C-=C-R) в эту реакцию невступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогощается электронной плотностью и протон становится подвижным.
4. Качественная реакция на альдегиды. Одна из самых интересных качественных реакций в органической химии — на альдегиды, предназначена исключительно для выявления соединений, содержащих альдегидную группу. К альдегиду приливают аммиачный раствор оксида серебра, реакция идет при нагревании:
Ch4-CHO + 2[Ag(Nh4)2]OH —t—> Ch4-COOH + 2Ag↓ + 4Nh4↑ + h3O
Если опыт проведен грамотно, то выделяющееся серебро покрывает колбу ровным слоем, создавая эффект зеркала. Именно поэтому реакция называется реакцией серебряного зеркала.
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
HCOOH + 2[Ag(Nh4)2]OH —t—> CO2↑ + 2h3O + 4Nh4↑ + 2Ag↓
Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH)2. Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CuSO4 + 2NaOH ——> Na2SO4 + Cu(OH)2↓
Ch4-CHO + 2Cu(OH)2 —t—> Ch4-COOH + Cu2O↓ + 2h3O
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
Еще один метод определения альдегидов — реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера:
Ch4-CHO + K2[HgI4] + 3KOH ——> Ch4-COOK + Hg↓ + 4KI + 2h3O
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.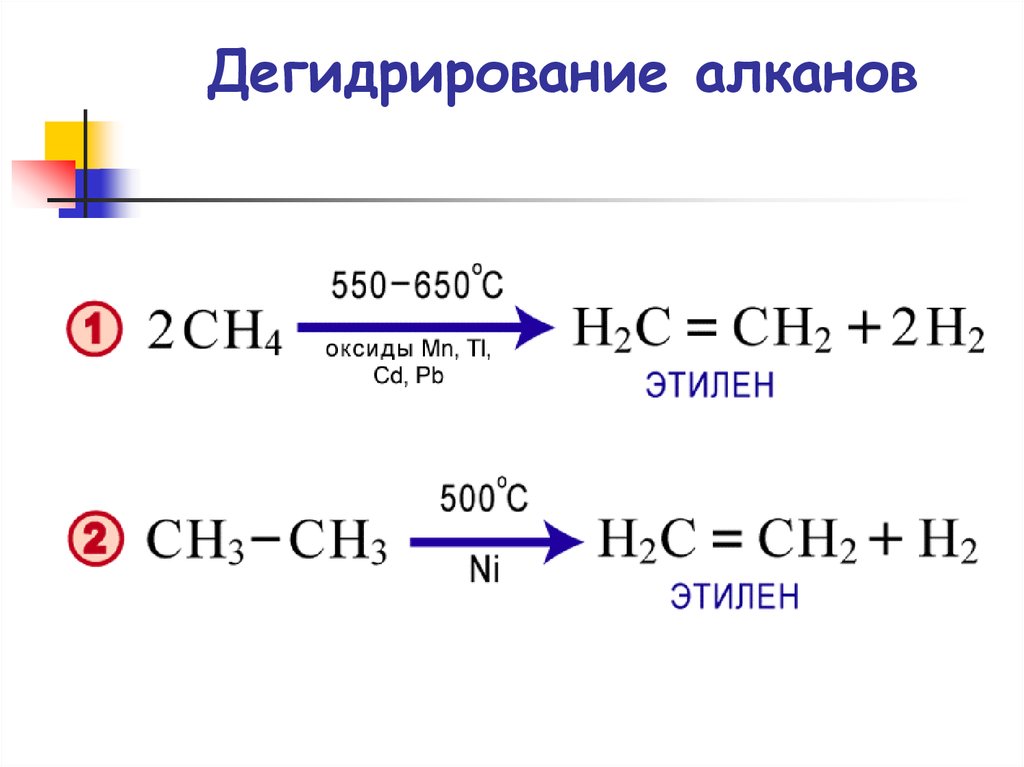
5. Качественные реакции на спирты. Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных реакции различны.
Качественные реакции на одноатомные спирты:
Простейшая качественная реакция на спирты — окисление спирта оксидом меди. Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
Ch4-Ch3-OH + CuO —t—> Ch4-CHO + Cu + h3O
Спирты идентифицируются пробой Лукаса — конц. раствор соляной кислоты и хлорида цинка. При пропускании вторичного или третичного спирта в такой раствор образуется маслянистый осадок соответствующего алкилхлорида:
Ch4-CHOH-Ch4 + HCl —ZnCl2—> Ch4-CHCl-Ch4↓ + h3O
Первичные спирты в реакцию не вступают.
Еще одним известным методом является иодоформная проба:
Ch4-Ch3-OH + 4I2 + 6NaOH ——> CHI3↓ + 5NaI + HCOONa + 5h3O
Качественные реакции на многоатомные спирты.
Наиболее известная качественная реакция на многоатомные спирты — взаимодействие их с гидроксидом меди (II). Гидроксид растворяется, образуется хелатный комплекс темно-синего цвета. Обратите внимание на то, что в отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания. К примеру, при приливании глицерина образуется глицерат меди (II):
Гидроксид растворяется, образуется хелатный комплекс темно-синего цвета. Обратите внимание на то, что в отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания. К примеру, при приливании глицерина образуется глицерат меди (II):
6. Качественные реакции на карбоновые кислоты. На карбоновые кислоты обычно подчеркивают образование цветных осадков с тяжелыми металлами. Но наиболее осуществимая качественная реакция на метановую кислоту HCOOH. При добавлении концентрированной серной кислоты h3SO4 к раствору муравьиной кислоты образуется угарный газ и вода:
HCOOH —h3SO4—> CO↑ + h3O
Угарный газ можно поджечь. Горит синем пламенем:
2CO + O2 —t—> 2CO2
Из многоосновных кислот рассмотрим качественную реакцию на щавелевую h3C2O4(HOOC-COOH). При добавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадок оксалата меди (II):
Cu2+ + C2O42- ——> CuC2O4↓
Щавелевая кислота также, как и муравьиная, разлагается концентрированной серной кислотой:
h3C2O4 —-h3SO4—> CO↑ + CO2↑ + h3O
7. Качественные реакции на амины. На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин от вторичного путем взаимодействия с азотистой кислотой HNO2. Для начала нужно ее приготовить, а затем добавить амин:
Качественные реакции на амины. На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин от вторичного путем взаимодействия с азотистой кислотой HNO2. Для начала нужно ее приготовить, а затем добавить амин:
NaNO2 + HCl ——> NaCl + HNO2
Первичные дают азот N2:
Ch4-Nh3 + HNO2 ——> Ch4-OH + N2↑ + h3O
Вторичные — алкилнитрозоамины — вещества с резким запахом (на примере диметилнитрозоамина):
Ch4-NH-Ch4 + HNO2 ——> Ch4-N(NO)-Ch4 + h3O
Третичные амины в мягких условиях с HNO2 не реагируют.
Анилин образует осадок при добавлении бромной воды:
C6H5Nh3 + 3Br2 ——> C6h3Nh3(Br)3↓ + 3HBr
Анилин также можно обнаружить по сиреневой окраске при добавлении хлорной извести.
8. Качественные реакции на фенол. Фенол лучше всего обнаруживает хлорид железа (III) — образуется фиолетовое окрашивание раствора. Это лучший метод обнаружения фенола, т. к. реакция очень чувствительна.
к. реакция очень чувствительна.
Также фенол наряду с анилином дает осадок желтоватого цвета при пропускании в водный раствор брома — 2,4,6 — трибромфенол:
C6H5OH + 3Br2 ——> C6h3OH(Br)3↓ + 3HBr
Фенолы дают фенол-альдегидные смолы при реакции с альдегидом в кислой среде. При этом образуются мягкие пористые массы фенол-альдегидных смол (реакция поликонденсации).
9. Качественная реакция на алкилхлориды. Вещества, содержащие хлор, могут окрашивать пламя в зеленый цвет. Для этого нужно обмакнуть медную проволоку в алкилхлориде и поднести к пламени (проба Бельштейна).
10. Качественная реакция на углеводы. Большинство углеводов имеют альдегидные и гидроксильные группы, поэтому для них характерны все реакции альдегидов и многоатомных спиртов.
Существует способ, который помогает различить глюкозу от фруктозы — проба Селиванова. Для того, чтобы различить эти углеводы, к ним приливают смесь резорцина и соляной кислоты. Реагирует со смесью фруктоза, при этом раствор окрашивается в малиновый цвет.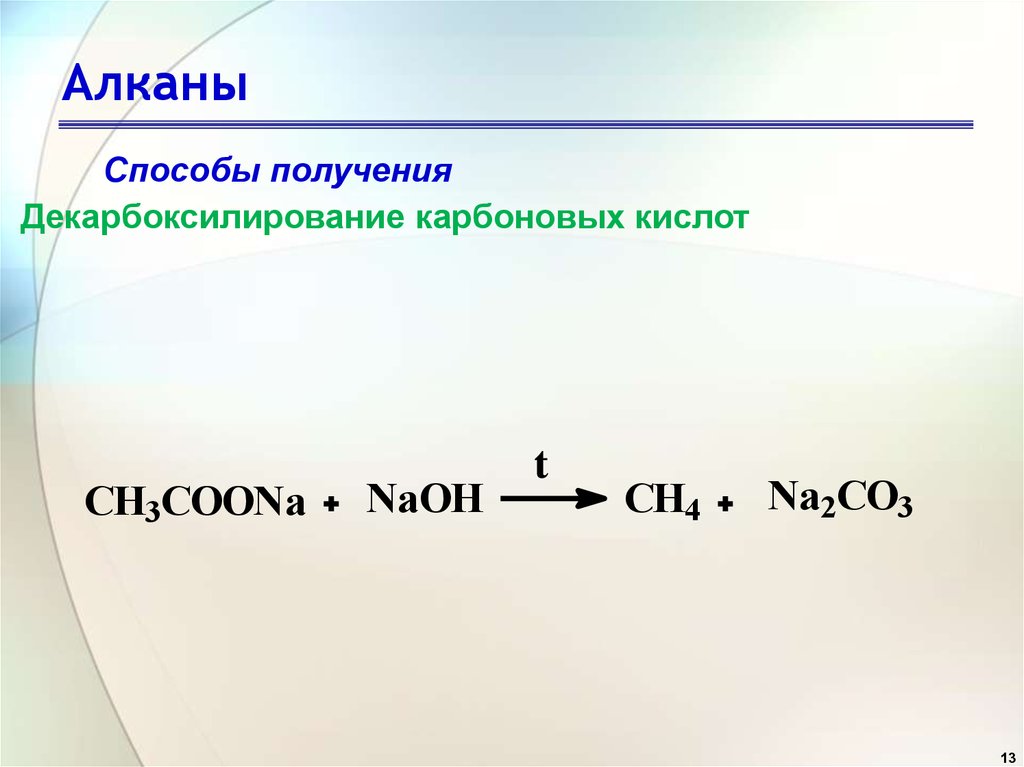
Крахмал в присутствии иода окрашивается в темно-синий цвет. При нагревании окраска исчезает, при охлаждении появляется вновь.
11. Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.
Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина):
(OH)C6h5CH(Nh3)COOH + HNO3 —-h3SO4——> (OH)C6h4(NO2)CH(Nh3)COOH↓ + h3O — выпадает осадок желтого цвета.
(OH)C6h4(NO2)CH(Nh3)COOH + 2NaOH ——-> (ONa)C6h4(NO2)CH(Nh3)COONa + h3O — раствор становится оранжевым.
Обнаружение серосодержащих аминокислот:
Белок + (Ch4COO)2Pb —NaOH—> PbS↓ (осадок черного цвета).
Биуретовая реакция для обнаружения пептидной связи (CO-NH):
Белок + CuSO4 + NaOH ——> красно-фиолетовое окрашивание.
Спецефический запах при горении:
Белок —-обжиг—-> запах паленой шерсти.
Реакции алканов,
Реакции алканов,
Реакции алканов, алкенов и алкинов
| Алканы | Алкены и алкины |
Алканы
В отсутствие искры или источника света высокой интенсивности алканы обычно инертны.
к химическим реакциям. Однако любой, кто воспользовался спичкой, чтобы зажечь газовую горелку, или
бросили спичку на уголь, покрытый жидкостью для зажигалок, должны признать, что алканы
загореться при наличии искры. Неважно, начинается ли
материал — метан, содержащийся в природном газе,
CH 4 ( г ) + 2 O 2 ( г ) CO 2 ( г )
+ 2 H 2 O( г )
смесь бутана и изобутана, используемая в одноразовых зажигалках,
2 C 4 H 10 ( г ) + 13 O 2 ( г )
8 CO 2 ( г )
+ 10 Н 2 О( г )
смесь углеводородов от C 5 до C 6 в жидкости для зажигалок,
C 5 H 12 ( г ) + 8 O 2 ( г ) 5 CO 2 ( г )
+ 6 H 2 O( г )
или комплексная смесь углеводородов от С 6 до С 8 в бензине.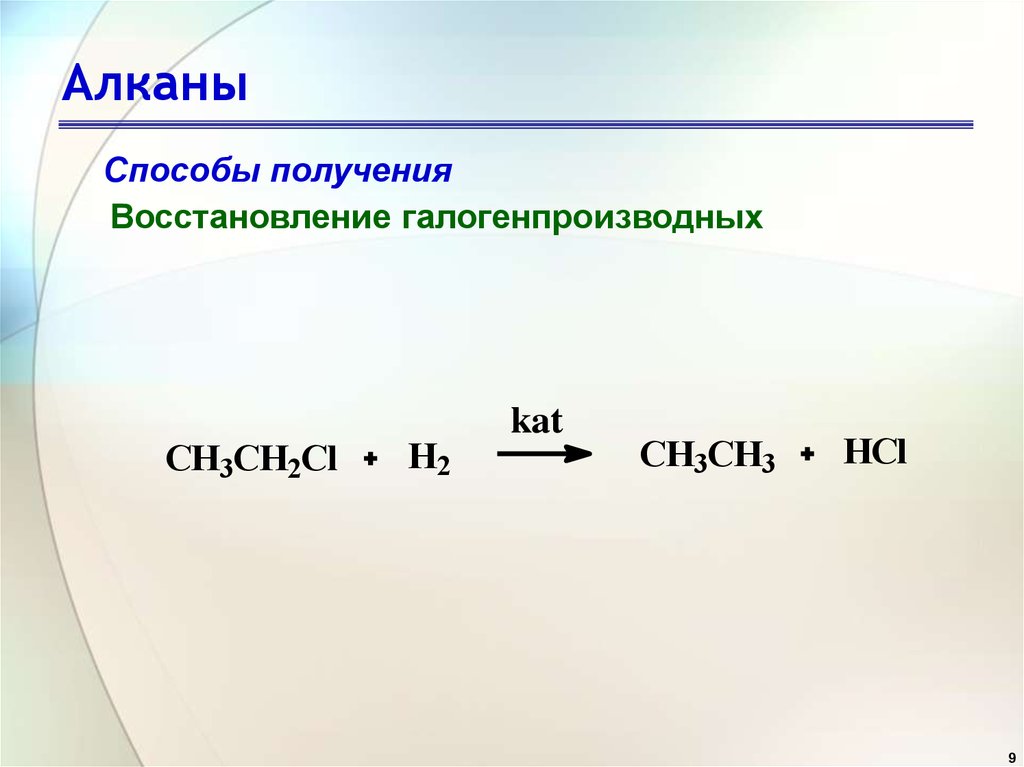
2 C 8 H 18 ( л ) + 25 O 2 ( г )
16 CO 2 ( г )
+ 18 Н 2 О( г )
Как только реакция зажигается искрой, эти углеводороды сгорают с образованием CO 2
и H 2 O и выделяют от 45 до 50 кДж энергии на грамм потребляемого топлива.
В присутствии света или при высоких температурах алканы реагируют с галогенами с образованием алкила
галогениды . Реакция с хлором дает алкилхлорид .
| светлый | ||
| CH 4 ( г ) + Cl 2 ( г ) | CH 3 Cl( г ) + HCl( г ) |
Реакция с бромом дает алкилбромид .
| светлый | ||
| CH 4 ( г ) + Br 2 ( л ) | CH 3 Br( г ) + HBr( г ) |
Алкены и алкины
Ненасыщенные углеводороды, такие как алкены и алкины, гораздо более реакционноспособны, чем
исходные алканы.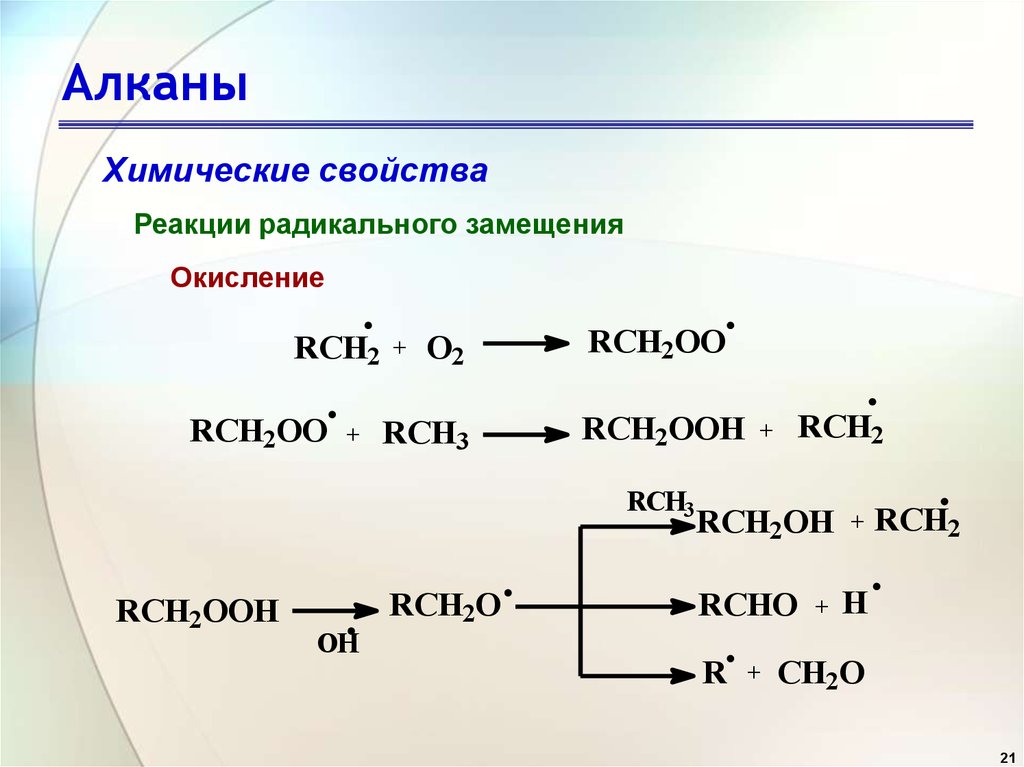 Они быстро реагируют с бромом, например, присоединяя Br 2
Они быстро реагируют с бромом, например, присоединяя Br 2
молекулы по двойной связи С=С.
Эта реакция дает возможность проверить наличие алкенов или алкинов. Растворы брома в
CCl 4 имеют интенсивный красно-оранжевый цвет. Когда Br 2 в CCl 4
смешивается с образцом алкана, первоначально не наблюдается никаких изменений. Когда это смешано
с алкеном или алкином окраска Br 2 быстро исчезает.
Реакция между 2-бутеном и бромом с образованием 2,3-дибромбутана является лишь одним из примеров.
из реакции присоединения алкенов и алкинов. Бромоводород (HBr)
присоединяется по двойной связи C=C с образованием соответствующего алкилбромида, в котором
водород заканчивается на атоме углерода, у которого изначально было больше атомов водорода. Добавление
превращение HBr в 2-бутен, например, дает 2-бромбутан.
H 2 присоединяет по двойным (или тройным) связям в присутствии подходящего
катализатор для превращения алкена (или алкина) в соответствующий алкан.
В присутствии кислотного катализатора возможно даже добавление молекулы воды
через двойную связь С=С.
Реакции присоединения позволяют добавлять новые заместители в углеводородную цепь и
тем самым производят новые производные исходных алканов.
Теоретически, когда несимметричный реагент, такой как
HBr присоединяется к несимметричной двойной связи C=C. На практике получается только один продукт.
Например, при добавлении HBr к 2-метилпропену продуктом является 2-бром-2-метилпропан,
не 1-бром-2-метилпропан.
В 1870 г., после тщательного изучения многих примеров реакций присоединения,
Русский химик Владимир Марковников сформулировал правило для предсказания продукта этих
реакции. Правило Марковникова гласит, что атома водорода присоединяется к углероду.
атом, который уже имеет большее число атомов водорода, когда HX присоединяется к алкену .
Таким образом, вода (H OH) присоединяется к пропилену до
образуют продукт, в котором ОН-группа находится у среднего атома углерода.
Органическая химия: строение и номенклатура углеводородов
Структура и номенклатура
Углеводороды |
Изомеры
| Реакции алканов, алкенов и алкинов
| Углеводороды
| Нефть и уголь
|
Хиральность и оптическая активность
Периодический
Таблица |
Периодическая таблица |
Глоссарий
| Классные апплеты
Тематический обзор Gen Chem
|
Домашняя страница справки по общей химии
|
Поиск:
сайт общей химии.
Фотография | Алкан алкен в бромной воде
{{ Элемент.Сообщение об ошибке }}
Этот товар недоступен в вашем регионе.
Товар не найден.
ВЫБЕРИТЕ ВИДЕОЛИЦЕНЗИЮ
{{ item.PlusItemLicenseSmall }}
TIMESLICES
Создать квант времени
Просмотр временных интервалов (поставляется с 1-секундными дескрипторами)
Просмотр интервалов времени
ТЕГИ
{{Ключевое слово}}
{{Ключевое слово}}
ПОДЕЛИТЬСЯ ЭТОЙ СТРАНИЦЕЙ
Описание:
Описание:
Узнать больше
Кредит:
{{ item. ImgCredit }}
ImgCredit }}
Нет в наличии
Уникальный идентификатор:
{{ item.ItemID }}
Устаревший идентификатор:
{{ элемент.ItemSource }}
Нет в наличии
Тип:
{{item.MediaType}}
Лицензия:
{{item.LicenseModel}}
ЦЕНЫ РФ
{{item.aText[i]}}
{{ item.aPrice[i] }}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
toLowerCase()» aria-label=»‘Add to ‘ + site.LabelPB.toLowerCase()»/>
Добавить на доску
Заказать печать
Заказать печать
Скачать в высоком разрешении
Загрузка видео в настоящее время недоступна. Пожалуйста, сообщите нам, какие файлы вам нужны, по адресу [email protected], и мы предоставим их вам как можно скорее.
Размер без сжатия:
ЛИЦЕНЗИЯ
ТОВАР НЕ ДОСТУПЕН
Назначение: {{item.ImgPurpose}}
{{ item.PlusItemLicenseSmall }}
Запрос товара
ПРОСТАЯ ЦЕНА RM
ПРОСТАЯ ЦЕНА RM
ТОВАР НЕ ДОСТУПЕН
Запрос элемента
Назначение: {{ item.ImgPurpose }}
{{Имя}}
{{ FormatCurrency(item.aStandardPricingPrice[i]) }}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
LabelPB.toLowerCase()» :alt=»‘Add to ‘ + site.LabelPB.toLowerCase()» aria-label=»‘Add to ‘ + site.LabelPB.toLowerCase()»/>
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Заказать печать
Скачать в высоком разрешении
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ — $’ + item.PlusCodeAmount }}
{{ item.PlusItemLicenseSmall }}
Перейти к оформлению заказа
Скопировать URL
Скачать Комп
LabelPB.toLowerCase()» :alt=»‘Add to ‘ + site.LabelPB.toLowerCase()» aria-label=»‘Add to ‘ + site.LabelPB.toLowerCase()»/>
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Скачать в высоком разрешении
Загрузка видео в настоящее время недоступна. Пожалуйста, сообщите нам, какие файлы вам нужны, по адресу [email protected], и мы доставим их вам, как только
возможный.
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ — $’ + item.PlusCodeAmount }}
Перейти к оформлению заказа
Размер без сжатия:
ТОВАР НЕ ДОСТУПЕН
Запрос товара
Назначение: {{item. ImgPurpose}}
ImgPurpose}}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Скачать в высоком разрешении
ТОВАР НЕ ДОСТУПЕН
Запрос товара
Назначение: {{item. ImgPurpose}}
ImgPurpose}}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Скачать в высоком разрешении
Загрузка видео в настоящее время недоступна. Пожалуйста, сообщите нам, какие файлы вам нужны, по адресу [email protected], и мы доставим их вам, как только
возможный.
Время начала:
{{ SecondsToTime(StartTime) }} Установить
Время окончания:
{{ SecondsToTime(EndTime) }} Установить
Продолжительность: {{ Продолжительность}}
Текущий: {{ Текущий }}
Продолжительность: {{DurationTime}}
Текущее: {{ ТекущееВремя}}
{{ SecondsToTime(Value. StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
Посмотреть
Удалить
Для этого элемента не заданы временные интервалы, поэтому по умолчанию это весь клип.
{{ SecondsToTime(0) }} до {{ SecondsToTime(videocontrols.Duration) }}
Общее время: {{ Math.round(TotalTime * 100) / 100 }}
Цена/сек: {{ FormatCurrency(item.PricePerSec) }}
Цена: {{ ItemPrice }}
{{ сайт.LabelPB }}
{{ сайт.LabelCT }}
{{ сайт.LabelPB }}
{{ сайт.LabelCT }}
{{ Lightbox.Name }} ({{ Lightbox.NumPix }})
Вид
Управлять
Новый
{{ site.LabelCT }}: {{ user.nCartItems }} {{ user.nCartItems == 1 ? «предмет» : «элемент» }}
{{ XXText }}
{{ XXSText }}
{{ XSText }}
{{ SMText }}
{{ MDText }}
{{ LGText }}
XLText
} {{ LGText }}
XLText
} { {{ XXLText }}
{{ HDText }}
{{ QHDText }}
{{ K4Text }}
{{ K8Text }}
Мы используем файлы cookie, чтобы улучшить ваш опыт на нашем веб-сайте.