/ Пищевые вещества и их значение. Органическое вещество питьевая вода крахмал
Что же это за вещество?
Если спросить у химика, что такое крахмал, он ответит так: крахмал — органическое вещество.
Но нам тотчас придется спросить: а что такое «органическое вещество?»
На этот вопрос ответить уже труднее.
Было время, когда целой группе веществ дали такое название. Это крахмал, сахар, жиры, белки. Эти вещества находили только в живых организмах, потому и назвали их органическими.
Вещества, из которых состоят камни, вода, воздух, назвали неорганическими.
На первый взгляд это кажется справедливым.
Действительно, ни в одном минерале, ни в одной руде не найдешь ни сахара, ни жира, ни крахмала, ни белка.
А вот в моркови, в свекле, в яблоке много сахара. В картошке много крахмала. В зернах конопли, подсолнечника много жира. В мясе, в молоке, в хлебе, в орехах, в рыбьей икре много белка.
Кроме крахмала, сахара, жира и белка, есть много других веществ, которые встречаются только в живой природе. Например, ни один камень не содержит в себе тех чудесных пахучих веществ, какие выделяют растения.
Но вот с некоторых пор ученые в лабораториях начали искусственно изготовлять то, что прежде находили только в теле растения, животного или человека.
Я расскажу вам, например, коротенькую историю одного растения. Называется оно «вайда». Растет в Южной Европе, а у нас — на Кавказе и в Средней Азии. У вайды скромный желтоватый цветок, узкие, длинные листья. Было время, когда вайда очень высоко ценилась. Ее специально сеяли. Из листьев вайды получали Красивую темносинюю краску, Которую называли «индиго». Этой краской окрашивали сукно.
Теперь вайдой мало кто интересуется. Если и разводят ее, то просто как кормовую траву.
Почему же вайда попала в немилость? Причина кроется в том, что за последние сто лет очень развилась химия.
Но какое же отношение химия имеет к вайде?
Дело в том, что химики научились искусственно изготовлять индиго. И оказалось, что искусственное получение краски стоит дешевле. Не надо занимать большие площади земли под посевы растений. И, кроме того, химики в лабораториях изготовляют такие удивительно красивые оттенки этой краски, какие вайда не дает.
Выведав у природы ее секреты, химики вступили в соревнование с ней.
Химик в лаборатории действует как строитель и архитектор: он не только разлагает вещества на составные части, он, подобно строителю и архитектору, имеет свои «химические чертежи», по которым может создавать новые органические вещества.
Например, в каждой аптеке можно купить витамины.
Эти круглые или плоские пилюли, очень полезные для здоровья, получают искусственно на заводах.
А ведь совсем недавно витамины считались загадочными веществами, которые образуются только в растениях.
Но, конечно, у каждого может возникнуть такой вопрос: а умеют ли химики изготовлять крахмал, сахар или жиры?
И на этот вопрос можно ответить утвердительно. Да, вещества, похожие на сахар, на жиры, химиками в лабораториях получены. Но заниматься их изготовлением на заводах невыгодно. Это трудная и дорогая работа. Легче
и дешевле сеять свеклу и коноплю или выращивать поросят.
Но для науки все эти опыты по получению искусственных органических веществ очень важны.
Теперь понятно, почему трудно сразу ответить на вопрос: что такое органическое вещество?
Прежний ответ, что органические вещества вырабатываются только организмами, устарел, а название осталось.
Под этим названием теперь объединяют все, что может гореть, обугливаться.
Помните опыт с куском хлеба, сахара, дерева? Все они содержат углерод.
Все они — органические вещества.
Органические вещества — белки, жиры, крахмал, сахар — составляют тело растения.
Мы видели, как образуется одно из этих веществ — крахмал. Для этого зеленому листу нужны были углекислый газ, вода и солнечный свет.
Мы видели, как поглощается зелеными листьями углекислый газ, как выделяется кислород, как появляется крахмал в той части листа, которая не закрыта черной бумагой.
А с помощью микроскопа мы познакомились и с другими подробностями этого удивительного строительства. Крахмал появился только на зеленых хлорофилловых крупинках, которые обладают замечательной способностью поглощать солнечную энергию. С помощью солнечной энергии растение и создает органические вещества из неорганических.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Крахмал: свойства, польза и применение
 Существуют три вида углеводов: клетчатка, глюкоза и крахмал. В то время как многие диеты для потери веса предлагают ограничить потребление крахмалов и других углеводов, исследователи все чаще говорят, что это не что иное, как миф. А при правильно продуманном питании даже крахмалистое мучное не осядет жиром на боках. Свое слово об этом веществе сказали и медики. Причем оно также неоднозначно. Так что такое крахмал, чем является наиболее популярный – картофельный крахмал, польза и вред которого служат темами научных дискуссий?
Существуют три вида углеводов: клетчатка, глюкоза и крахмал. В то время как многие диеты для потери веса предлагают ограничить потребление крахмалов и других углеводов, исследователи все чаще говорят, что это не что иное, как миф. А при правильно продуманном питании даже крахмалистое мучное не осядет жиром на боках. Свое слово об этом веществе сказали и медики. Причем оно также неоднозначно. Так что такое крахмал, чем является наиболее популярный – картофельный крахмал, польза и вред которого служат темами научных дискуссий?
Биохимические свойства
Крахмал (формула – (С6Н10О5)n) – это белое гранулированное органическое вещество, которое вырабатывается всеми зелеными растениями.
Являет собой безвкусный порошок, нерастворимый в холодной воде, спирте и большинстве других растворителей. Эта субстанция принадлежит к группе полисахаридов. Наипростейшая форма крахмала – линейный полимер амилозы. Разветвленная форма представлена амилопектином. В реакции с водой образовывает клейстер. Гидролиз крахмала происходит при наличии кислот и повышения температуры, в результате образовывается глюкоза. Используя йод, легко проверить завершение реакции гидролиза (больше не будет появляться синий цвет).
В зеленых растениях крахмал производится от избытка глюкозы, полученной в результате фотосинтеза. Для растений это вещество служит источником энергии. Крахмал в форме гранул хранится в хлоропластах. В некоторых растениях наивысшая концентрация вещества содержится в корнях и клубнях, в других – в стеблях, семенах. Если возникает такая необходимость, это вещество может распадаться (под воздействием ферментов и воды), создавая глюкозу, которую растения используют в качестве подпитки. В человеческом организме, а также в телах животных молекула крахмала также распадается на сахара, а они также служат источником энергии.
Как работает в человеческом организме
Углеводы являются главным источником «топлива» для нашего организма. После того как пищеварительная система преобразовала еду в глюкозу, тело использует ее для активации всех клеток и органов. Остатки хранятся в печени и мышцах. В качестве универсального источника «топлива» называют мучные продукты, содержащие крахмалы и клетчатку – углеводы, способствующие здоровому перевариванию пищи и контролирующие сахар в крови. Такие источники углеводов расщепляются медленнее, чем простые, надолго обеспечивают поставки энергии и чувство сытости между приемами пищи.
Функции в организме
Единственная роль крахмала в рационе человека – превращение в глюкозу для получения дополнительной энергии.
 Этот процесс начинается уже в тот момент, когда крахмалистая пища попадает в ротовую полость. На этом этапе слюна окружает молекулы крахмала, воздействуя на них, так возникает продукт расщепления – мальтоза, более простой углевод. Затем новое вещество попадает в тонкую кишку, где проходит очередные трансформации и превращается в глюкозу. И только после этого организм поглощает глюкозу (стенками кишечника), вещество попадает в кровь и уже по сосудам передвигается по всему организму, снабжая каждую клетку энергией.
Этот процесс начинается уже в тот момент, когда крахмалистая пища попадает в ротовую полость. На этом этапе слюна окружает молекулы крахмала, воздействуя на них, так возникает продукт расщепления – мальтоза, более простой углевод. Затем новое вещество попадает в тонкую кишку, где проходит очередные трансформации и превращается в глюкозу. И только после этого организм поглощает глюкозу (стенками кишечника), вещество попадает в кровь и уже по сосудам передвигается по всему организму, снабжая каждую клетку энергией.
Меж тем организм не способен использовать за один «присест» сразу всю порцию глюкозы, полученной из крахмалов. Лишнее хранится в виде гликогена в тканях печени и мышц. И когда организм переживает упадок сил, гликоген приходит ему на помощь.
Резистентный крахмал
Большинство углеводов, потребляемых с пищей – это крахмалы. Они представляют собой долгие цепи глюкозы, содержащиеся в злаках, картофеле и множестве другой пищи. Но далеко не все крахмалы, которые мы кушаем, организм способен переварить. Иногда небольшая часть крахмалистой еды проходит через пищеварительный тракт без изменений. Другими словами, это вещество устойчиво к перевариванию. Биологи называют этот тип крахмала резистентным. А в организме он функционирует как растворимая клетчатка. Как показывают многие исследования, именно этот вид весьма положительно сказывается на здоровье. В частности он улучшает чувствительность к инсулину, снижает уровень сахара в крови, уменьшает аппетит и это еще далеко не все преимущества устойчивых крахмалов для человека. Также резистентный крахмал помогает очищать организм от «плохого» холестерина и снижает уровень триглицеридов.
Виды резистентных крахмалов
 Но не все резистентные крахмалы одинаковые. Существуют 4 типа этого вещества:
Но не все резистентные крахмалы одинаковые. Существуют 4 типа этого вещества:
- тип 1 – содержится в зерновых, семенах, бобовых;
- тип 2 – есть в некоторых видах мучного, в сыром картофеле и зеленых бананах;
- тип 3 – образовывается, когда крахмалистые продукты, в том числе рис и картофель, варят, а затем охлаждают;
- тип 4 – результат химических реакций.
Однако важно заметить, что крахмалы разных типов могут встречаться в одной и той же пище. Например, по мере дозревания бананов резистентные крахмалы превращаются в обычные. Также на количество устойчивого вещества в пище влияет и способ ее приготовления.
Польза и вред для организма
 В человеческом организме резистентный крахмал работает по принципу растворимого волокна. Он проходит через желудок и тонкую кишку в непереваренном виде, а в кишечнике служит пищей для полезных бактерий (кишечной флоры). Существует сотни видов бактерий, которые оказывают влияние на здоровье, без некоторых из них невозможно бы было функционирование организма. И резистентный крахмал питает эти микроорганизмы. В результате такого взаимодействия образуются разные типы полезных соединений – от газов до жирных кислот, одна из которых – бутират. Крахмал, таким образом, питает полезные бактерии и косвенно клетки толстой кишки за счет увеличения количества бутирата.
В человеческом организме резистентный крахмал работает по принципу растворимого волокна. Он проходит через желудок и тонкую кишку в непереваренном виде, а в кишечнике служит пищей для полезных бактерий (кишечной флоры). Существует сотни видов бактерий, которые оказывают влияние на здоровье, без некоторых из них невозможно бы было функционирование организма. И резистентный крахмал питает эти микроорганизмы. В результате такого взаимодействия образуются разные типы полезных соединений – от газов до жирных кислот, одна из которых – бутират. Крахмал, таким образом, питает полезные бактерии и косвенно клетки толстой кишки за счет увеличения количества бутирата.
Кроме того, резистентное вещество обладает несколькими полезными свойствами для кишечника. Во-первых, снижает уровень рН, уменьшает воспаления, а также снижает риск развития рака толстой кишки. Из-за лечебного воздействия на толстую кишку крахмал может быть полезным при расстройствах пищеварения, в том числе воспалениях кишечника, болезни Крона, запорах, дивертикулезе и диарее. Также исследования показали, что устойчивый крахмал улучшает поглощение минералов. Защищает организм от токсичных веществ, предотвращая их всасывание кишечником.
Но так ли полезный резистентный крахмал, как говорят некоторые исследователи? Пока однозначного ответа на этот вопрос нет, так как научные опыты продолжаются. И не исключено, что вся гипотетическая чудодейственность резистентного крахмала может и не подтвердиться. Но то, что крахмал обязательно должен быть частью вашего рациона – это однозначно.
 Резистентный крахмал важен для здорового метаболизма. Как показали некоторые исследования, это вещество обостряет чувствительность организма к инсулину, эффективно для снижения сахара после приемов пищи. Кроме того, обладает еще одной уникальной способностью. Если завтрак состоял из крахмалистой пищи, то это вещество предотвратит всплеск уровня сахара и после обеденной трапезы.
Резистентный крахмал важен для здорового метаболизма. Как показали некоторые исследования, это вещество обостряет чувствительность организма к инсулину, эффективно для снижения сахара после приемов пищи. Кроме того, обладает еще одной уникальной способностью. Если завтрак состоял из крахмалистой пищи, то это вещество предотвратит всплеск уровня сахара и после обеденной трапезы.
Влияние крахмалов на глюкозу и метаболизм инсулина не перестает удивлять исследователей. Опыт показал, что достаточно на протяжении 4 недель принимать по 15-30 г вещества, чтобы повысить чувствительность к инсулину на 33-50 процентов. Невосприимчивость к этому гормону вызывает сахарный диабет 2 типа, ожирение, кардиологические заболевания и болезнь Альцгеймера. За счет повышения чувствительности к инсулину и снижения уровня сахара в крови можно избежать многих хронических болезней.
Меж тем, исследователи соглашаются, положительное влияние резистентных крахмалов на организм зависит от индивидуальных особенностей.
Крахмал для похудения
По сравнению с обычным крахмалом, резистентный содержит наполовину меньше килокалорий – 2 против 4 на грамм продукта. Так что пища, содержащая резистентный крахмал, может по праву считаться диетической, при этом поддерживать чувство сытости надолго.
Как получить резистентный крахмал
 Некоторые продукты из традиционного для многих рациона являются источниками резистентного крахмала. Среди наиболее концентрированных – сырой, вареный, а затем охлажденный картофель, зеленые бананы.
Некоторые продукты из традиционного для многих рациона являются источниками резистентного крахмала. Среди наиболее концентрированных – сырой, вареный, а затем охлажденный картофель, зеленые бананы.
Другой путь получения этого вещества – обычная картофельная мука, столовая ложка которой содержит примерно 8 г резистентного вещества и при этом почти не имеет углеводов, а значит, ее калорийность не страшна даже соблюдающим диету. Картофельный крахмал можно добавлять в готовую пищу, смешивать с напитками. Но не стоит превышать 50-граммовую порцию в сутки, так как возможен метеоризм и дискомфорт в желудке. Программа «крахмализации» может длиться около 2-4 недель.
Источниками резистентного крахмала могут послужить бананы, кукуруза, картофель, батат, перловка, овсянка, чечевица, коричневый рис.
Процесс перехода обычного крахмала в резистентный напрямую зависит от температурного воздействия. И что интересно, в горячих крахмальных блюдах содержится больше обычного вещества, в охлажденных – резистентного. Это значит, что если переживаете за свою фигуру, то можете не кушать картофельное пюре, но без угрызений совести налегать на картофельный салат.
И по этому поводу несколько интересных цифр. Охлажденный картофель содержит немного больше чем 3 процента резистентного крахмала, а это уже в 4 раза меньше, нежели обычного. Чечевица на 75 процентов – это крахмал, а вот количество резистентного уже не превышает 25 %.
Плохие крахмалы
Это может показаться странным, но не все крахмалистые продукты могут служить источниками крахмалов для человека. В первую очередь это касается белой муки и риса быстрого приготовления. В результате механической обработки эти продукты теряют значительное количество питательных веществ, в том числе и крахмала. Диетологи советуют избегать продуктов такого типа, поскольку они не то, что не принесут пользы, а еще могут и стать причиной проблем со здоровьем. Также не стоит заглядываться на пирожные, печенья, кренделя и кукурузные хлопья – полезных крахмалов в этих продуктах вы точно не найдете.
Сколько надо?
 Для того чтобы удовлетворить суточные потребности организма в крахмальном продукте, достаточно потреблять по 100 г цельного зерна. Это показатель для женщин. Мужчинам желательно увеличить порцию к 120-130 г. В целом углеводы должны составлять примерно 45-65 процентов от суточного рациона.
Для того чтобы удовлетворить суточные потребности организма в крахмальном продукте, достаточно потреблять по 100 г цельного зерна. Это показатель для женщин. Мужчинам желательно увеличить порцию к 120-130 г. В целом углеводы должны составлять примерно 45-65 процентов от суточного рациона.
Для того чтобы получить достаточное количество вещества, примерно треть рациона должны быть продукты, содержащие это вещество. Меж тем, эти показатели могут изменяться, например во время болезней.
Медики говорят, что взрослые люди ежедневно нуждаются в 300-450 г крахмала. Но его употребление оправдано только накануне тяжелой физической нагрузки или перед тем, как частые приемы пищи будут невозможны. Меньшие порции также полезны – защищают стенки желудка от пищеварительной кислоты. А вот чрезмерное потребление этого вещества может послужить причиной образования каловых камней.
Крахмалистые продукты и клетчатка
Мучные изделия, для производства которых было использовано цельное зерно, а также картофель (особенно с кожурой) являются ценными источниками клетчатки. Также комбинация крахмала и пищевого волокна есть в некоторых фруктах, бобовых и зерновых культурах, в кожуре некоторых овощей. Все они благотворно влияют на пищеварение, а также помогают снизить концентрацию холестерина в крови.
Пищевые источники
Крахмалистые продукты являются основным источником углеводов и важны для поддержания здоровой диеты. Такие продукты как картофель, хлеб, рис, макаронные изделия, крупы, согласно советам диетологов, должны составлять немного больше чем треть от всей пищи. Большинство из них содержат в себе клетчатку, кальций, железо и многие витамины.
Продукты с высоким содержанием крахмала – это в первую очередь бобовые культуры (фасоль, чечевица), овощи (картофель, кабачки), орехи, злаки и мука из них.
 Цельные продукты богатые крахмалом ко всему еще являются источниками клетчатки, витаминов и многих минералов.
Цельные продукты богатые крахмалом ко всему еще являются источниками клетчатки, витаминов и многих минералов.
Существует несколько источников, богатых крахмалом, которые можно ввести в свой ежедневный рацион. Крахмалистые овощи, такие как картофель, кукуруза, горох, кабачок, содержат довольно высокие запасы вещества. Также важными источниками являются хлеб из цельного зерна, темный рис, макаронные изделия. Порция мучной пищи способна обеспечить организм 15 граммами крахмала.
Характеристика популярных крахмалистых продуктов

Хлеб
Особенно полезный – из муки грубого помола и ржаной. В обеих вариантах есть витамины группы В, Е, клетчатка, а также широкий спектр полезных минералов. В белом хлебе также есть много питательных веществ, необходимых организму, но количество клетчатки в этом продукте значительно ниже.
Некоторые люди отказываются от хлебобулочных изделий, боясь набрать лишние килограммы. Меж тем, нельзя полностью вычеркивать из своего меню этот продукт, так как вместе с ним человек лишает себя многих полезных элементов.
Кстати, полезным является только свежий хлеб, который хранится при комнатной температуре.
Злаки
Цельнозерновые крупы – кладезь железа, клетчатки, протеинов, витаминов группы В. Среди наиболее полезных – крупы из овса, ячменя, рожи. Продукты из зерновых – превосходный вариант для приготовления питательного и полезного завтрака. Помимо этого, не стоит забывать о ячмене, кукурузе и других зерновых, которые также считаются важными для организма.
Рис
 Рис и пища из него – отличный выбор среди крахмалистых вариантов. Этот злак обеспечит энергией и при этом практически не содержит жира.
Рис и пища из него – отличный выбор среди крахмалистых вариантов. Этот злак обеспечит энергией и при этом практически не содержит жира.
Существуют разные сорта риса, и все они полезны для человека, так как содержат витамины, клетчатку и белок. Этот продукт можно употреблять как в виде горячих блюд, так и холодных закусок. Но дабы он был по-настоящему полезным, лучше повторно не подогревать приготовленное блюдо, а если понадобится, то между разогревами хранить в холодильнике, что убережет от размножения вредных бактерий. Но при любых обстоятельствах готовое рисовое блюдо нельзя хранить дольше 24 часов. А во время повторного разогревания на протяжении 2 минут держать в температуре около 70 градусов по Цельсию (можно над паром).
Макаронные изделия
Лучше отдавать предпочтение тесту, приготовленному из твердых сортов пшеницы и воды. Оно содержит железо и витамины В-группы. Еще более полезными являются макароны из цельнозерновой основы.
| Рис | 78 |
| Спагетти | 75 |
| Кукурузные хлопья | 74 |
| Мука (пшеничная, ячменная) | 72 |
| Просо | 69 |
| Хлеб свежий | 66 |
| Кукуруза | 65 |
| Лапша | 65 |
| Гречка | 64 |
| Пшеница | 60 |
| Рожь | 54 |
| Чипсы картофельные | 53 |
| Горох | 45 |
| Ржаной хлеб | 45 |
| Слоеное тесто | 37 |
| Картофель фри | 35 |
| Сырая картошка | 15,4 |
| Вареный картофель | 14 |
Акриламид в крахмалистой пище
Акриламид – это химическое вещество, которое можно найти в некоторых видах мучных продуктов, после жарки, запекания на гриле или разогревания при очень высоких температурах.
Некоторые исследования показали, что это вещество может быть опасным для человека. Поэтому диетологи выступают против поджаривания (и особенно подгорания) крахмалистых продуктов, таких как картофель, гренки, корнеплоды.
Акриламид практически не вырабатывается в процессе варки, пропаривания или запекания в микроволновке. И кстати, хранение картофеля при очень низких температурах, увеличивает в его составе концентрацию сахара, что также способствует выделению большой порции акриламида во время готовки.
Сочетание с другими веществами и усвоение
Крахмалы в плане сочетания с другими питательными веществами весьма требовательны. Обычно, они плохо взаимодействуют с другими продуктами, и хорошо сочетаются только между собой. Для максимальной пользы крахмалистую пищу лучше комбинировать с сырыми овощами в виде салатов. И кстати, организм легче переварит сырой крахмал, нежели после термической обработки. А также это вещество быстрее метаболизуется, если в организме достаточно витаминов В.
Использование в промышленности
В промышленности встречается крахмал рисовый, кукурузный, пшеничный, тапиоковый, но картофельный, пожалуй, наиболее популярный.
 Его получают путем измельчения клубней и перемешивания мякоти с водой. Затем мякоть отделяют от жидкости и высушивают. Помимо этого, крахмал применяют в пивоварении, в кондитерских изделиях как загуститель. Также он способен увеличить прочность бумаги, используется для изготовления гофрированного картона, бумажных пакетов, коробок, прорезиненной бумаги. В текстильной промышленности – как проклейка, придающая прочность нитям.
Его получают путем измельчения клубней и перемешивания мякоти с водой. Затем мякоть отделяют от жидкости и высушивают. Помимо этого, крахмал применяют в пивоварении, в кондитерских изделиях как загуститель. Также он способен увеличить прочность бумаги, используется для изготовления гофрированного картона, бумажных пакетов, коробок, прорезиненной бумаги. В текстильной промышленности – как проклейка, придающая прочность нитям.
Также в пищевой промышленности активно применяют амилопектиновый крахмал, полученный из восковидной кукурузы. Используется как загуститель в соусах, заправках, фруктово-молочных десертах. В отличие от картофельного аналога, это вещество прозрачное, не имеет привкуса, а его уникальные химические свойства допускают многократное замораживание и нагревание крахмалистого продукта.
Наличие в списке ингредиентов продукта Е1400, Е1412, Е1420 или Е1422 говорит, что при производстве этой пищи использовали модифицированный кукурузный крахмал. От других видов его отличает способность к набуханию и образованию клейстеризованных растворов. В пищевой промышленности применяется как средство против комкования, для создания необходимой текстуры соусов, кетчупов, йогуртов и молочных десертов. Также применяют в хлебобулочных изделиях.
Тапиоковый крахмал также являет собой ингредиент пищевой промышленности. Но в качестве сырья для него используют не привычные нам картофель или кукурузу, а плоды маниока. По своим способностям этот продукт напоминает картофельный. Применяется в качестве загустителя и средства против образования комков.
Крахмал принадлежит к числу продуктов, о пользе и вреде которых пока нет однозначного мнения. Меж тем, существует отличный совет, которым руководствовались люди в разные времена: всего должно быть в меру и тогда пища не будет во вред. Это касается и крахмалов.
foodandhealth.ru
формула, химические свойства, применение :: SYL.ru
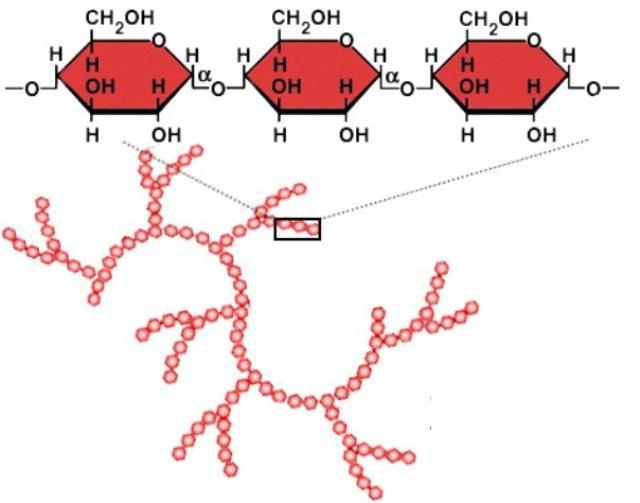
Формула крахмала – (С6Н10О5)n. Это полисахарид, состоящий из амилозы и амилопектина. Мономером ее является альфа-глюкоза. Крахмал в природе производится растениями в процессе фотосинтеза, но в разных культурах он отличается по структуре, полимеризации и строению цепей. А иногда и по своим свойствам.
Физические свойства
Крахмал (формула (С6Н10О5)n) представляет собой белый аморфный порошок, который не растворяется в холодной воде, но при нагревании равномерно распределяется в жидкости, образуя мутную клейкую субстанцию.
Если положить небольшое количество порошка под микроскоп, то можно увидеть, что он состоит из небольших отдельных кристалликов или зерен, которые при сжатии издают характерный скрип. Вкуса и запаха не имеет, температура воспламенения равняется четырёхстам десяти градусам по Цельсию.
Химические свойства

Структурная формула крахмала представляет собой соединение глюкозных остатков, которые образуют две комбинации – амилозу и амилопектин. Молекулы его могут быть расположены не только линейно, но и разветвленно, что объясняет его зернистую структуру.
В горячей воде крахмал набухает и превращается в клейстер, но после добавления сильных кислот гидролизуется и полностью растворяется, вплоть до образования молекул глюкозы.
Химическая формула крахмала – С6Н10О5, то есть он относится к органическим веществам. Чтобы выявить его наличие в растворе, необходимо добавить в колбу несколько капель йода. Если жидкость поменяет цвет на синий, значит, реакция положительная. Есть и другие качественные реакции. Так, например, крахмал не восстанавливает серебро из его аммиачного раствора и не проделывает то же самое с трехвалентным оксидом меди.
Биосинтез

Крахмал (формула С6Н10О5), как уже говорилось выше, синтезируется в растительных клетках в процессе фотосинтеза. Глюкоза соединяется с молекулами воды, в результате этой реакции получается молекула крахмала и кислород.
Это вещество является хорошим энергетическим материалом для растений, поэтому они накапливают его на случай возникновения сложных условий жизни. Обычно они хранят его в клубнях (картофель), плодах и семенах (злаковые). Наибольшее количество крахмала находится в зернах риса, на втором месте кукуруза, затем пшеница и только потом – картофель.
Пищевое значение

Крахмал (формула С6Н10О5), попадая в желудок человека или животного, подвергается воздействию соляной кислоты и распадается на молекулы глюкозы, которые способны усваиваться организмом.
В пищевой промышленности он используется для загустения киселей, соусов, различных заправок и так далее. Наиболее распространенными и простыми блюдами, содержащими крахмал, являются хлеб, блины, лапша, каши и многие другие изделия из семян злаковых растений или их производных.
Крахмал в неизмененном виде плохо переваривается в желудке и тонком кишечнике. Для его расщепления необходимы бактерии, которые колонизируют толстую кишку. Но даже в таком виде этот продукт может снижать уровень глюкозы в крови, а также образует органические кислоты, необходимые для построения эпителия толстого кишечника. Поэтому для лучшей усваиваемости необходимо термически обрабатывать продукты, содержащие крахмал.
Применение в промышленных масштабах

Крахмал (химическая формула – С6Р10О5) широко применяется в производстве бумаги, обоев, картона и другой подобной продукции. Ежегодно выпускаются десятки миллионов метрических тонн целлюлозно-бумажной продукции.
Пищевая промышленность использует крахмал как загуститель, а также в качестве сырья для получения глюкозы, патоки и этилового спирта. Известно, что это вещество входит в состав колбасных изделий, майонеза, кетчупа и других соусов. На текстильном производстве крахмалом обрабатывают ткани, делая их более жесткими и прочными.
Модифицированный вариант крахмала широко применяется для производства обойного клея. В фармацевтической отрасли его используют в качестве наполнителя для таблетированных форм лекарственных средств. А также для изготовления оболочек капсул и таких растворов, как гемодез, реополиглюкин и других.
Модификация крахмала
Для того чтобы крахмал превратился обратно в глюкозу, его несколько часов кипятят в растворе серной кислоты. Когда гидролиз произошел, из полученной массы необходимо убрать катализатор. Для этого в жидкость добавляют мел. Серная кислота осаждается, превращаясь в нерастворимый сульфат кальция, а глюкоза остается в виде раствора.
После этого жидкость несколько раз переливают и отфильтровывают, затем выпаривают. В конце процесса получается густая и очень сладкая жидкость – патока. Она используется в дальнейшем для кондитерских и технических нужд.
Если необходимо получить абсолютно чистую глюкозу, без других продуктов гидролиза крахмала, то кипятить его нужно гораздо дольше. Серную кислоту вновь осаждают, раствор фильтруют и сгущают до того момента, пока на стенках посуды не начнут появляться кристаллы глюкозы. На современном этапе чистую глюкозу также можно получить ферментированием. Для этого в раствор крахмала добавляют альфа-амилазу. Она расщепляет молекулы вещества на более простые цепи, получая декстрины и глюкоамилазы.
Если нагреть сухой крахмал до температуры более двухсот градусов Цельсия, то он частично распадется на полисахариды, такие как декстрин. Некоторые физические изменения позволяют получить крахмал, который хорошо впитывает и удерживает влагу. Это позволяет загустить продукт до желаемой консистенции.
www.syl.ru
Пищевые вещества и их значение
6
Пищевые вещества и их значение
Организм человека состоит из белков (19,6 %), жиров (14,7 %), углеводов (1 %), минеральных веществ (4,9 %), воды (58,8 %). Он постоянно расходует эти вещества на образование энергии, необходимой для функционирования внутренних органов, поддержания тепла и осуществления всех жизненных процессов, в том числе физической и умственной работы. Одновременно происходят восстановление и создание клеток и тканей, из которых построен организм человека, восполнение расходуемой энергии за счет веществ, поступающих с пищей. К таким веществам относят белки, жиры, углеводы, минеральные вещества, витамины, воду и др., их называют пищевыми. Следовательно, пища для организма является источником энергии и пластических (строительных) материалов.
Белки
Это сложные органические соединения из аминокислот, в состав которых входят углерод (50—55 %), водород (6—7 %), кислород (19-24 %), азот (15—19 %), а также могут входить фосфор, сера, железо и другие элементы.
Белки — наиболее важные биологические вещества живых организмов. Они служат основным пластическим материалом, из которого строятся клетки, ткани и органы тела человека. Белки составляют основу гормонов, ферментов, антител и других образований, выполняющих сложные функции в жизни человека (пищеварение, рост, размножение, иммунитет и др.), способствуют нормальному обмену в организме витаминов и минеральных солей. Белки участвуют в образовании энергии, особенно в период больших энергетических затрат или при недостаточном количестве в питании углеводов и жиров, покрывая 12 % от всей потребности организма в энергии. Энергетическая ценность 1 г белка составляет 4 ккал. При недостатке белков в организме возникают серьезные нарушения: замедление роста и развития детей, изменения в печени взрослых, деятельности желез внутренней секреции, состава крови, ослабление умственной деятельности, снижение работоспособности и сопротивляемости к инфекционным заболеваниям. Белок в организме человека образуется беспрерывно из аминокислот, поступающих в клетки в результате переваривания белка пищи. Для синтеза белка человека необходим белок пищи в определенном количестве и определенного аминокислотного состава. В настоящее время известно более 80 аминокислот, из которых 22 наиболее распространены в пищевых продуктах. Аминокислоты по биологической ценности делят на незаменимые и заменимые.
Незаменимых аминокислот восемь — лизин, триптофан, метионин, лейцин, изолейцин, валин, треонин, фенилаланин; для детей нужен также гистидин. Эти аминокислоты в организме не синтезируются и должны обязательно поступать с пищей в определенном соотношении, т.е. сбалансированными. Заменимые аминокислоты (аргинин, цистин, тирозин, аланин, серин и др.) могут синтезироваться в организме человека из других аминокислот.
Биологическая ценность белка зависит от содержания и сбалансированности незаменимых аминокислот. Чем больше в нем незаменимых аминокислот, тем он ценней. Белок, содержащий все восемь незаменимых аминокислот называют полноценным. Источником полноценных белков являются все животные продукты: молочные, мясо, птица, рыба, яйца.
Суточная норма потребления белка для людей трудоспособного возраста составляет всего 58—117 г в зависимости от пола, возраста и характера труда человека. Белки животного происхождения должны составлять 55 % суточной нормы.
О состоянии белкового обмена в организме судят по азотистому балансу, т.е. по равновесию между количеством азота вводимого с белками пищи и выводимого из организма. У здоровых взрослых людей, правильно питающихся, наблюдается азотистое равновесие. У растущих детей, молодых людей, у беременных и кормящих женщин отмечается положительный азотистый баланс, т.к. белок пищи идет на образование новых клеток и введение азота с белковой пищей преобладает над выведением его из организма. При голодании, болезнях, когда белков пищи недостаточно, наблюдается отрицательный баланс, т.е. азота выводится больше, чем вводится, недостаток белков пищи ведет к распаду белков органов и тканей.
Жиры
Это сложные органические соединения, состоящие из глицерина и жирных кислот, в которых содержатся углерод, водород, кислород. Жиры относят к основным пищевым веществам, они являются обязательным компонентом в сбалансированном питании.
Физиологическое значение жира многообразно. Жир входит в состав клеток и тканей как пластический материал, используется организмом как источник энергии (30 % всей потребности
организма в энергии). Энергетическая ценность 1 г жира составляет 9 ккал. Жиры снабжают организм витаминами А и D, биологически активными веществами (фосфолипиды, токоферолы, стерины), придают пище сочность, вкус, повышают ее питательность, вызывая у человека чувство насыщения.
Остаток поступившего жира после покрытия потребности организма откладывается в подкожной клетчатке в виде подкожно-жирового слоя и в соединительной ткани, окружающей внутренние органы. Как подкожный, так и внутренний жир являются основным резервом энергии (запасной жир) и используется организмом при усиленной физической работе. Подкожно-жировой слой предохраняет организм от охлаждения, а внутренний жир защищает внутренние органы от ударов, сотрясений и смещений. При недостатке в питании жиров наблюдается ряд нарушений со стороны центральной нервной системы, ослабевают защитные силы организма, снижается синтез белка, повышается проницаемость капиляров, замедляется рост и т.д.
Жир, свойственный человеку, образуется из глицерина и жирных кислот, поступивших в лимфу и кровь из кишечника в результате переваривания жиров пищи. Для синтеза этого жира необходимы пищевые жиры, содержащие разнообразные жирные кислоты, которых в настоящее время известно 60. Жирные кислоты делят на предельные или насыщенные (т.е. до предела насыщенные водородом) и непредельные или ненасыщенные.
Насыщенные жирные кислоты (стеариновая, пальмитиновая, капроновая, масляная и др.) обладают невысокими биологическими свойствами, легко синтезируются в организме, отрицательно влияют на жировой обмен, функцию печени, способствуют развитию атеросклероза, так как повышают содержание холестерина в крови. Эти жирные кислоты в большом количестве содержатся в животных жирах (бараньем, говяжьем) и в некоторых растительных маслах (кокосовом), обусловливая их высокую температуру плавления (40—50°С) и сравнительно низкую усвояемость (86—88%).
Ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая, арахидоновая и др.) представляют собой биологически активные соединения, способные к окислению и присоединению водорода и других веществ. Наиболее активны из них: линолевая, линоленовая и арахидоновая, называемые полиненасыщенными жирными кислотами. По своим биологическим свойствам их относят к жизненно важным веществам и называют витамином F. Они принимают активное участие в жировом и холестериновом обмене, повышают эластичность и снижают проницаемость кровеносных сосудов, предупреждают образование тромбов. Полиненасыщенные жирные кислоты в организме человека не синтезируются и должны вводиться с пищевыми жирами. Содержатся они в свином жире, подсолнечном и кукурузном масле, жире рыб. Эти жиры имеют низкую температуру плавления и высокую усвояемость (98 %).
Биологическая ценность жира зависит также от содержания в нем различных жирорастворимых витаминов А и D (жир рыбы, сливочное масло), витамина Е (растительные масла) и жироподобных веществ: фосфатидов и стеринов.
Фосфатиды являются наиболее биологически активными веществами. К ним относят лецитин, кефалин и др. Они влияют на проницаемость клеточных мембран, на обмен веществ, на секрецию гормонов, процесс свертывания крови. Фосфатиды содержатся в мясе, желтке яйца, печени, в пищевых жирах, сметане.
Стерины являются составной частью жиров. В растительных жирах они представлены в виде бета-стерола, эргостерола, влияющих на профилактику атеросклероза.
В животных жирах стерины содержатся в виде холестерина, который обеспечивает нормальное состояние клеток, участвует в образовании половых клеток, желчных кислот, витамина D3 и т.д.
Холестерин, кроме того, образуется в организме человека. При нормальном холестериновом обмене количество поступающего с пищей и синтезируемого в организме холестерина равно количеству холестерина распадающегося и выводимого из организма. В пожилом возрасте, а также при перенапряжении нервной системы, избыточном весе, при малоподвижном образе жизни холестериновый обмен нарушается. В этом случае поступающий с пищей холестерин повышает его содержание в крови и приводит к изменению кровеносных сосудов и развитию атеросклероза.
Суточная норма потребления жира для трудоспособного населении составляет всего 60—154 г в зависимости от возраста, пола, характера груда и климатических условий местности; из них жиры животного происхождения должны составлять 70 %, а растительного — 30 %.
Углеводы
Это органические соединения, состоящие из углерода, водорода и кислорода, синтезирующиеся в растениях из углекислоты и воды под действием солнечной энергии.
Углеводы, обладая способностью окисляться, служат основным источником энергии, используемой в процессе мышечной деятельности человека. Энергетическая ценность 1 г углеводов составляет 4 ккал. Они покрывают 58 % всей потребности организма в энергии. Кроме того, углеводы входят в состав клеток и тканей, содержатся в крови и в виде гликогена (животного крахмала) в печени. В организме углеводов мало (до 1 % массы тела человека). Поэтому для покрытия энергетических затрат они должны поступать с пищей постоянно.
В случае недостатка в питании углеводов при больших физических нагрузках происходит образование энергии из запасного жира, а затем и белка организма. При избытке углеводов в питании жировой запас пополняется за счет превращения углеводов в жир, что приводит к увеличению массы человека. Источником снабжения организма углеводами являются растительные продукты, в которых они представлены в виде моносахаридов, дисахаридов и полисахаридов.
Моносахариды - самые простые углеводы, сладкие на вкус, растворимые в воде. К ним относят глюкозу, фруктозу и галактозу. Они быстро всасываются из кишечника в кровь и используются организмом как источник энергии, для образования гликогена в печени, для питания тканей мозга, мышц и поддержания необходимого уровня сахара в крови.
Дисахариды (сахароза, лактоза и мальтоза) — это углеводы, сладкие на вкус, растворимые в воде, расщепляются в организме человека на две молекулы моносахаридов с образованием из сахарозы — глюкозы и фруктозы, из лактозы — глюкозы и галактозы, из мальтозы — двух молекул глюкозы.
Моно- и дисахариды легко усваиваются организмом и быстро покрывают энергетические затраты человека при усиленных физических нагрузках. Избыточное потребление простых углеводов может привести к повышению содержания сахара в крови, следовательно, к отрицательному действию на функцию поджелудочной железы, к развитию атеросклероза и ожирению.
Полисахариды — это сложные углеводы, состоящие из многих молекул глюкозы, не растворимые в воде, обладают несладким вкусом. К ним относят крахмал, гликоген, клетчатку.
Крахмал в организме человека под действием ферментов пищеварительных соков расщепляется до глюкозы, постепенно удовлетворяя потребность организма в энергии на длительный период. Благодаря крахмалу многие продукты, содержащие его (хлеб, крупы, макаронные изделия, картофель), вызывают у человека чувство насыщения.
Гликоген поступает в организм человека в малых дозах, так как он содержится в небольших количествах в пище животного происхождения (печени, мясе).
Клетчатка в организме человека не переваривается из-за отсутствия в пищеварительных соках фермента целлюлозы, но, проходя по органам пищеварения, стимулирует перистальтику кишечника, выводит из организма холестерин, создает условия для развития полезных бактерий, способствуя тем самым лучшему пищеварению и усвоению пищи. Содержится клетчатка во всех растительных продуктах (от 0,5 до 3 %).
Пектиновые (углеводоподобные) вещества, попадая в организм человека с овощами, фруктами, стимулируют процесс пищеварения и способствуют выведению из организма вредных веществ. К ним относят протопектин — находится в клеточных мембранах свежих овощей, плодов, придавая им жесткость; пектин — желеобразующее вещество клеточного сока овощей и плодов; пектиновая и пектовая кислоты, придающие кислый вкус плодам и овощам. Пектиновых веществ много в яблоках, сливе, крыжовнике, клюкве.
Суточная норма потребления углеводов для трудоспособного населения составляет всего 257—586 г в зависимости от возраста, пола и характера труда.
Витамины
Это низкомолекулярные органические вещества различной химической природы, выполняющие роль биологических регуляторов жизненных процессов в организме человека.
Витамины участвуют в нормализации обмена веществ, в образовании ферментов, гормонов, стимулируют рост, развитие, выздоровление организма.
Они имеют большое значение в формировании костной ткани (вит. D), кожного покрова (вит. А), соединительной ткани (вит. С), в развитии плода (вит Е), в процессе кроветворения (вит. В|2, В9) и т.д.
Впервые витамины были обнаружены в пищевых продуктах в 1880 г. русским ученым Н.И. Луниным. В настоящее время открыто более 30 видов витаминов, каждый из которых имеет химическое название и многие из них — буквенное обозначение латинского алфавита (С — аскорбиновая кислота, В, — тиамин и т.д.). Некоторые витамины в организме не синтезируются и не откладываются в запас, поэтому должны обязательно вводиться с пищей (С, В,, Р). Часть витаминов может синтезироваться в
организме (В2, в6, в9, РР, К).
Отсутствие витаминов в питании вызывает заболевание под общим названием авитаминозы. При недостаточном потреблении витаминов с пищей возникают гиповитаминозы, которые проявляются в виде раздражительности, бессонницы, слабости, снижения трудоспособности и сопротивляемости к инфекционным заболеваниям. Избыточное потребление витаминов А и D приводит к отравлению организма, называемому гипервитаминозом.
Витамины содержатся почти во всех пищевых продуктах. Однако некоторые продукты для повышения их пищевой ценности подвергают искусственной витаминизации: молоко, кефир, сливочное масло, кондитерские изделия, муку и др.
В зависимости от растворимости все витамины делят на: 1) водорастворимые С, Р, В1, В2, В6, В9, РР и др; 2) жирорастворимые — A, D, Е, К; 3) витаминоподобные вещества — U, F, В4 (холин), В15 (пангамовая кислота) и др.
Витамин С (аскорбиновая к и с л о та) играет большую роль в окислительно-восстановительных процессах организма, влияет на обмен веществ. Недостаток этого витамина снижает сопротивляемость организма к различным заболеваниям. Отсутствие его приводит к заболеванию цингой. Норма потребления в сутки витамина С 70—100 мг. Он содержится во всех растительных продуктах, особенно его много в шиповнике, черной смородине, красном перце, зелени петрушки, укропе.
Витамин Р (биофлавоноид) укрепляет капилляры и снижает проницаемость кровеносных сосудоЕ. Он содержится в тех же продуктах, что и витамин С. Суточная норма потребления 35—50 мг.
Витамин В, (тиамин) регулирует деятельность нервной системы, участвует в обмене веществ, особенно углеводном. В случае недостатка этого витамина отмечается расстройство нервной системы. Потребность в витамине В, составляет 1,1-2,1 мг в сутки. Содержится витамин в пище животного и растительного происхождения, особенно в продуктах из зерна, в дрожжах, печени, свинине.
Витамин В2 (рибофлавин) участвует в обмене веществ, влияет на рост, зрение. При недостатке витамина снижается функция желудочной секреции, зрение, ухудшается состояние кожи. Суточная норма потребления 1,3—2,4 мг. Содержится витамин в дрожжах, хлебе, гречневой крупе, молоке, мясе, рыбе, овощах, фруктах.
Витамин РР (никотиновая к и с л о т а) входит в состав некоторых ферментов, участвует в обмене веществ. Недостаток этого витамина вызывает утомляемость, слабость, раздражительность. При его отсутствии возникает болезнь пеллагра («шершавая кожа»). Норма потребления в сутки 14—28 мг. Содержится витамин РР во многих продуктах растительного и животного происхождения, может синтезироваться в организме человека из аминокислоты — триптофан.
Витамин В6 (пиридоксин) участвует в обмене веществ. При недостатке этого витамина в пище отмечаются расстройства нервной системы, изменения состояния кожи, сосудов. Норма потребления витамина В6 составляет 1,8-2 мг в сутки. Он содержится во многих пищевых продуктах. При сбалансированном питании организм получает достаточное количество этого витамина.
Витамин В9 (фолиевая к и с л о т а) принимает участие в кроветворении и обмене веществ в организме человека. При недостатке этого витамина развивается малокровие. Норма его потребления 0,2 мг в сутки. Он содержится в листьях салата, шпината, петрушки, зеленом луке.
Витамин В12 (к о б а л а м и н) имеет большое значение в кроветворении, обмене веществ. При недостатке этого витамина у людей развивается злокачественное малокровие. Норма его потребления 0,003 мг в сутки. Он содержится только в пище животного происхождения: мясе, печени, молоке, яйцах.
Витамин В15 (пангамовая кислота) оказывает действие на работу сердечно-сосудистой системы и окислительные процессы в организме. Суточная потребность в витамине 2 мг. Он содержится в дрожжах, печени, рисовых отрубях.
Xолин участвует в обмене белков и жиров в организме. Отсутствие холина способствует поражению почек и печени. Норма потребления его 500 — 1000 мг в сутки. Он содержится в печени, мясе, яйцах, молоке, зерне.
Витамин А (ретинол) способствует росту, развитию скелета, влияет на зрение, кожу и слизистую оболочку, повышает сопротивляемость организма к инфекционным заболеваниям. При недостатке его замедляется рост, слабеет зрение, выпадают волосы. Он содержится в продуктах животного происхождения: рыбьем жире, печени, яйцах, молоке, мясе. В растительных продуктах желто-оран- жевого цвета (морковь, помидоры, тыква) есть провитамин А — каротин, который в организме человека превращается в витамин А в присутствии жира пищи.
Витамин D (кальциферол) принимает участие в образовании костной ткани, стимулирует
рост. При недостатке этого витамина у детей развивается рахит, а у взрослых изменяется костная ткань. Витамин D синтезируется из провитамина, имеющегося в коже, под воздействием ультрафиолетовых лучей. Он содержится в рыбе, говяжьей печени, сливочном масле, молоке, яйцах. Суточная норма потребления витамина 0,0025 мг.
Витамин Е (токоферол) участвует в работе желез внутренней секреции, влияет на процессы размножения и нервную систему. Норма потребления 8—10 мг в сутки. Много его в растительных маслах и злаках. Витмамин Е предохраняет растительные жиры от окисления.
Витамин К (филлохинон) действует на свертываемость крови. Суточная потребность его 0,2-0,3 мг. Содержится в зеленых листьях салата, шпината, крапивы. Этот витамин синтезируется в кишечнике человека.
Витамин F (линолевая, линоленовая, арихидоновая жирные кислоты) участвует в жировом и холестериновом обмене. Норма потребления 5—8 г в сутки. Содержится в свином сале, растительном масле.
Витамин U действует на функцию пищеварительных желез, способствует заживлению язв желудка. Содержится в соке свежей капусты.
Сохранение витаминов при кулинарной обработке. В процессе хранения и кулинарной обработки пищевых продуктов некоторые витамины разрушаются, особенно витамин С. Отрицательными факторами, снижающими С-витаминную активность овощей и плодов, являются: солнечный свет, кислород воздуха, высокая температура, щелочная среда, повышенная влажность воздуха и вода, в которой витамин хорошо растворяется. Ускоряют процесс его разрушения ферменты, содержащиеся в пищевых продуктах.
Витамин С сильно разрушается в процессе приготовления овощных пюре, котлет, запеканок, тушеных блюд и незначительно — при жарке овощей в жире. Вторичный подогрев овощных блюд и соприкосновение их с окисляющимися частями технологического оборудования приводят к полному разрушению этого витамина. Витамины группы В при кулинарной обработке продуктов в основном сохраняются. Но следует помнить, что щелочная среда разрушает эти витамины, в связи с чем нельзя добавлять питьевую соду при варке бобовых.
Для улучшения усвояемости каротина необходимо все овощи оранжево-красного цвета (морковь, томаты) употреблять с жиром (сметана, растительное масло, молочный соус), а в супы и другие блюда вводить их в пассерованном виде.
Витаминизация пищи.
В настоящее время на предприятиях общественного питания довольно широко используется метод искусственного витаминизирования готовой пищи..
Готовые первые и третьи блюда обогащают аскорбиновой кислотой перед раздачей пищи. Аскорбиновую кислоту вводят в блюда в виде порошка или таблеток, предварительно растворенных в небольшом количестве пищи. Обогащение пищи витаминами С, В, РР организуют в столовых для работников некоторых химических предприятий с целью профилактики заболеваний, связанных с вредностями производства. Водный раствор этих витаминов объемом 4 мл на одну порцию вводят ежедневно в готовую пищу.
Пищевая промышленность выпускает витаминизированную продукцию: молоко и кефир, обогащенные витамином С; маргарин и детскую муку, обогащенные витаминами А и D, сливочное масло, обогащенное каротином; хлеб, высших сортов муку, обогащенные витаминами Вр В2, РР и др.
Минеральные вещества
Минеральные, или неорганические, вещества относят к числу незаменимых, они участвуют в жизненно важных процессах, протекающих в организме человека: построении костей, поддержании кислотно-щелочного равновесия, состава крови, нормализации водносолевого обмена, деятельности нервной системы.
В зависимости от содержания в организме минеральные вещества делят на:
Макроэлементы, находящиеся в значительном количестве (99% от общего количества минеральных веществ, содержащихся в организме): кальций, фосфор, магний, железо, калий, натрий, хлор, сера.
Микроэлементы, входящие в состав тела человека в малых дозах: йод, фтор, медь, кобальт, марганец;
Ультрамикроэлементы, содержащиеся в организме в ничтожных количествах: золото, ртуть, радий и др.
Кальций участвует в построении костей, зубов, необходим для нормальной деятельности нервной
системы, сердца, влияет на рост. Солями кальция богаты молочные продукты, яйца, капуста, свекла. Суточная потребность организма в кальции 0,8 г.
Фосфор участвует в обмене белков и жиров, в формировании костной ткани, влияет на центральную нервную систему. Содержится в молочных продуктах, яйцах, мясе, рыбе, хлебе, бобовых. Потребность в фосфоре составляет 1,2 г в сутки.
Магний влияет на нервную, мышечную и сердечную деятельность, обладает сосудорасширяющим свойством. Содержится в хлебе, крупах, бобовых, орехах, какао-порошке. Суточная норма потребления магния 0,4 г.
Железо нормализует состав крови (входя в гемоглобин) и является активным участником окислительных процессов в организме. Содержится в печени, почках, яйцах, овсяной и гречневой крупах, ржаном хлебе, яблоках. Суточная потребность в железе 0,018 г.
Калий участвует в водном обмене организма человека, усиливая выведение жидкости и улучшая работу сердца. Содержится в сухих фруктах (кураге, урюке, черносливе, изюме), горохе, фасоли, картофеле, мясе, рыбе. В сутки человеку необходимо до 3 г калия.
Натрий вместе с калием регулирует водный обмен, задерживая влагу в организме, поддерживает нормальное осмотическое давление в тканях. В пищевых продуктах натрия мало, поэтому его вводят с поваренной солью (NaCl). Суточная потребность 4—6 г натрия или 10—15 г поваренной соли.
Хлор участвует в регуляции осмотического давления в тканях и в образовании соляной кислоты (НС1) в желудке. Поступает хлор споваренной солью. Суточная потребность 5—7г.
Сера входит в состав некоторых аминокислот, витамина В,, гормона инсулина. Содержится в горохе, овсяной крупе, сыре, яйцах, мясе, рыбе. Суточная потребность 1 г. '
Йод участвует в построении и работе щитовидной железы. Больше всего йода сконцентрировано в морской воде, морской капусте и морской рыбе. Суточная потребность 0,15 мг.
Фтор принимает участие в формировании зубов и костного скелета, содержится в питьевой воде. Суточная потребность 0,7-1,2 мг.
Медь и кобальт участвуют в кроветворении. Содержатся в небольших количествах в пище животного и растительного происхождения.
Общая суточная потребность организма взрослого человека в минеральных веществах составляет 20—25 г, при этом важна сбалансированность отдельных элементов. Так, соотношение кальция, фосфора и магния в питании должно составлять 1:1,3:0,5, что определяет уровень усвоения этих минеральных веществ в организме.
Для поддержания в организме кислотно-щелочного равновесия необходимо правильно сочетать в питании продукты, содержащие минеральные вещества щелочного действия (Са, Mg, К, Na), которыми богаты молоко, овощи, фрукты, картофель, и кислотного действия (Р, S, Сl которые содержатся в мясе, рыбе, яйцах, хлебе, крупе.
Вода
Вода играет важную роль в жизнедеятельности организма человека. Она является самой значительной по количеству составной частью всех клеток (2/3 массы тела человека). Вода — это среда, в которой существуют клетки и поддерживается связь между ними, это основа всех жидкостей в организме (крови, лимфы, пищеварительных соков). При участии воды происходят обмен веществ, терморегуляция и другие биологические процессы. Ежедневно человек выделяет воду с потом (500 г), выдыхаемым воздухом (350 г), мочой (1500 г) и калом (150 г), выводя из организма вредные продукты обмена. Для восстановления потерянной воды ее необходимо вводить в организм. В зависимости от возраста, физической нагрузки и климатических условий суточная потребность человека в воде составляет 2-2,5 л, в том числе поступает с питьем 1 л, с пищей 1,2 л, образуется в процессе обмена веществ 0,3 л. В жаркое время года, при работе в горячих цехах, при напряженной физической нагрузке наблюдаются большие потери воды в организме с потом, поэтому потребление ее увеличивают до 5—6 л в сутки. В этих случаях питьевую воду подсаливают, так как вместе с потом теряется много солей натрия. Избыточное потребление воды является дополнительной нагрузкой для сердечно-сосудистой системы и почек и наносит ущерб здоровью. В случае нарушения функции кишечника (поносы) вода не всасывается в кровь, а выводится из организма человека, что приводит к сильному его обезвоживанию и представляет угрозу для жизни. Без воды человек может прожить не боле 6 суток.
studfiles.net
Органические вещества - Справочник химика 21
Так вот, атом водорода карбоксильной группы отделяется от нее в миллион раз легче, чем от гидроксильной группы фенола. Поэтому всякое органическое вещество, содержащее карбоксильную группу, обладает ярко выраженными кислотными свойствами. Такие вещества носят название карбоновых кислот. [c.153]Химики делят все вещества на два класса. К одному относятся, например, масло, сахар, крахмал, клей, желатин, шелк, каучук, бумага и пенициллин. Все это органические вещества. К, другому относятся воздух, вода, песок, глина, соль, золото, серебро, железо, латунь, стекло и цемент. Это неорганические вещества. [c.9]
Еще более заметным для первых химиков было другое различие. Органические вещества можно было обработать теплом или какими-нибудь другими способами и превратить в неорганические. Однако не было известно такого способа, чтобы взять неорганическое вещество и превратить его в органическое. [c.10]Поэтому Берцелиус и назвал вещества, которые можно добыть из живых организмов, органическими, а все остальные— неорганическими. Первые — продукт жизни, а вторые — нет. Если вы знаете детскую игру про животное, растительное и минеральное царства, то органические вещества вы отнесете к царству животных или [c.9]
В 1807 г. Берцелиус предложил вещества, подобные оливковому маслу или сахару, которые типичны для живой природы, называть органическими. Вещества, подобные воде и соли, которые характерны для неживой природы, он назвал неорганическими. [c.69]
Химиков не переставало удивлять, что органические вещества при нагревании или каком-либо другом жестком воздействии легко превращаются в неорганические вещества. (Возможность обратного превращения, т. е. превращения неорганического вещества в органическое, была установлена несколько позднее.) То время было временем господства витализма — учения, рассматривающего жизнь [c.69]
Немецкий химик Юстус Либих (1803—1873) усовершенствовал методику анализа и в 1831 г. смог получить весьма достоверные эмпирические формулы . Два года спустя французский химик Жан Батист Андре Дюма (1800—1884) модифицировал метод Либиха. Пользуясь разработанным им методом, можно было наряду с прочими продуктами сгорания собирать также и азот и, следовательно, определять содержание азота в органическом веществе. [c.75]
Однако в 1827 году было сделано великое открытие. Оно касалось органического вещества, называемого мочевина. Это твердое вещество белого цвета, которое содержится в выделениях организма. Взрослый человек в день выделяет примерно 30 г этого вещества с мочой. [c.10]
А вскоре химики получали в лаборатории уже много других органических веществ из неорганических. Разделение химических веществ на два класса утратило свой первоначальный смысл. [c.11]
Однако гораздо больше его в другой фракции того же угля. После того как уголь нагрет и из него выделился коксовый газ, в угле еще остается немного органического вещества. Если еще сильнее нагреть уголь, выделяется и оно если его собрать, получится густая черная жидкость, которая называется каменноугольной смолой. Тонна угля может дать около 60 фунтов каменноугольной смолы. [c.62]
С органическими соединениями, молекулы которых отличались внушительными размерами, дело обстояло сложнее. Используя методы начала XIX в., было очень тяжело, вероятно и невозможно, установить точную эмпирическую формулу даже такого довольно простого по сравнению, например, с белками органического соединения, как морфин. В настоящее время известно, что в молекуле морфина содержатся 17 атомов углерода, 19 атомов водорода, 3 атома кислорода и 1 атом азота ( ijHisNOa). Эмпирическая формула уксусной кислоты (С2Н4О2) намного проще, чем формула морфина, но и относительно этой формулы в первой половине XIX в. не было единога мнения. Однако, поскольку химики собирались изучать строение молекул органических веществ, начинать им необходимо было с установления эмпирических формул. [c.74]
Органические вещества во многом отличаются от неорганических. Например, они гораздо менее прочны и менее долговечны, чем неорганические. Воду (а это неорганическое вещество) можно вскипятить, а получившийся пар нагреть до тысячи градусов без всякого для него вреда. Если вы охладите пар, из него снова получится вода. А если нагревать растительное масло (это — органическое вещество), то оно начнет дымить и гореть и перестанет быть растительным маслом. Соль (неорганическое вещество) вы можете нагревать до тех пор, пока она не расплавится и не раскалится докрасна. Охладите ее — и она останется той же солью. Если же нагревать сахар (органическое вещество), начнут выделяться газы, а потом сахар обуглится и почернеет. После охлаждения уже никогда не удастся снова получить сахар. [c.10]
Однако до Дюма никто не подумал объединить и обобщить все эти отдельные наблюдения в революционное для тогдашнего времени учение о способности атома хлора заменять атом водорода в органическом веществе. Ведь тогда еще считали, что хлор соединяется с органическим веществом только в двойные комплексы, и сомневались в том, что отрицательный элемент хлор может вступить на место положительного элемента водорода. [c.530]
Казалось, что органические вещества могут быть только составной частью живой ткани. Первые химики думали, что для их получения нужна некая таинственная жизненная сила . Они полагали, что жизненная сила содержится только в живой ткани и что воспроизвести природные процессы в лаборатории невозможно. [c.10]
Сравнительно недавно удалось получить фумаровую кислоту пропусканием см еси 1 г-мол паров дихлорпентана со 188 г-мол воздуха над пятиокисью ванадия при 425° и объемной скорости 50—60 час (около 57 л газа на 1 л катализатора в час в пересчете на органическое вещество). Выход достигает около 28,4% вес. [208]. [c.229]
В настоящее время разработаны стабилизаторы перекиси водорода. В качестве стабилизаторов используются ортофосфорная и пи-рофосфорная кислоты и их соли. Смеси концентрированной перекиси водорода с органическими веществами (бензолом, толуолом, спиртами) являются взрывчатыми веществами. Попадание концентрированной перекиси водорода на кожу вызывает сильные ожоги. Лучшей помощью в этом случае является обильное промывание водой пораженных мест. [c.126]
В ЭТОЙ книге я время от времени буду пользоваться такими формулами. Не нужно их пугаться. Каждую формулу я буду объяснять по ходу дела, и вы поймете, что разобраться в них не так уж трудно. Больше того, вам будет очень трудно, даже невозможно узнать что-нибудь об органических веществах, не прибегая к таким формулам. Это то же самое, что пытаться собрать сложную машину, которую вы до сих пор никогда не видели, без всяких чертежей. [c.16]
Каждое органическое соединение, для которого известно строение молекулы, имеет официальное название по женевской номенклатуре. Впрочем, ими пользуются не всегда. Во-первых, многие органические вещества получили имена задолго до 1892 года, и к этим традиционным названиям химики привыкли. А во-вторых, названия, соответствующие правилам женевской номенклатуры, нередко оказываются такими сложными и длинными, что химики удобства ради придумывают более короткие и пользуются ими. [c.43]
В 1845 г. Адольф Вильгельм Герман Кольбе (1818—1884), ученик Вёлера, успешно синтезировал уксусную кислоту, считавшуюся в его время несомненно органическим веществом. Более того, он синтезировал ее таким методом, который позволил проследить всю цепь химических превращений — от исходных элементов (углерода, водорода и кислорода) до конечного продукта — уксусной кислоты. Именно такой синтез из элементов, или полный синтез, и был необходим. Если синтез мочевины Вёлера породил сомнения относительно существования жизненной силы , то синтез уксусной кислоты Кольбе позволил решить этот вопрос. [c.71]
Из-за -Таких геометрических фигур большинство формул органических веществ кажутся не специалистам такими сложными. На самом же деле если вы запомнит [c.57]
Некоторые полезные органические вещества представляют собой природные соединения — их извлекают из тканей какого-нибудь живого организма, или в результате действия живого организма на окружающую его среду, или из остатков живых организмов. Другие органические вещества в природе не существуют — их создают химики, это синтетические соединения. Примером их может служить и ДДТ. [c.76]
Когда органическая молекула полностью окислена, все ее атомы углерода превращаются в двуокись углерода, или углекислый газ. Его молекула состоит из одного атома углерода и двух атомов кислорода. А водородные атомы, входившие в состав органического вещества, превращаются в воду, молекулы которой состоят из двух молекул водорода и одной молекулы кислорода. [c.83]
У нижнего конца кварцевой трубки в ходе процесса можно отбирать пробы. Когда определение гидролизующегося хлора титрованием пробы покажет, что желательная степень превращения уже достигнута, то реакцию прекращают, содержимое трубки спускают и перерабатывают. Такая установка пригодна также и для испытания небольших количеств других органических веществ в отношении их способности к сульфохлорированию. [c.399]
Этим еще раз был подтвержден факт, установленный ранее Гей-Люссаком и другими, что органическое вещество, обработанное хлором, обладает способностью удерживать этот элемент. Некоторые исследователи указывали также, что количество поглощенного хлора эквивалентно выделившемуся хлористому водороду. [c.530]
Вёлер, Кольбе и Бертло синтезировали относительно простые органические соединения, тогда как для живой природы характерны значительно более сложные соединения типа крахмала, жиров и белков. Изучать такие соединения гораздо труднее непросто даже установить их точный элементный состав. В целом изучение органических веществ обещало разгадку многих проблем, но подступиться к этим веществам химику прошлого века было совсем непросто. [c.71]
В 80-х годах XVIII столетия Лавуазье пытался определить относительное содержание углерода и водорода в органических соединениях. Он сжигал изучаемое соединение и взвешивал выделившиеся углекислый газ и воду. Результаты такого определения были не очень точными. В первые годы XIX в. Гей-Люссак (автор закона объемных отношений, см. гл. 5) и его коллега французский химик Луи Жак Тенар (1777—1857) усовершенствовал этот метод. Они сначала смешивали изучаемое органическое соединение с окислителем и лишь потом сжигали. Окислитель, например хлорат калия, при нагревании выделяет кислород, который хорошо смешивается с органическим веществом, в результате чего сгорание происходит быстрее и полнее. Собирая выделяющиеся при сгорании углекислый газ и воду, Гей-Люссак и Тенар могли определить соотношение углерода и водорода в исходном соединении. С помощью усовершенствованной к тому времени теории Дальтона это соотношение можно было выразить в атомных величинах. [c.74]
Но все это не годится, когда речь идет об органических веществах. Их так много, что часто у двух или нескольких разных соединений молекулы состоят из одних и тех же атомов в одних и тех же количествах. Например, у двух органических соединений — этилового спирта и диметилового эфира — молекулы состоят из двух атомов углерода, шести атомов водорода и одного атома, кислорода. Формула обоих соединений оказывается одинаковой — СаНбО (такие вeцie твa получили [c.14]
Органические смазки. В качестве загустителей консистентных смазок было предложено несколько органических веществ, таких как фталоцианиновые соединения, производные мочевины, гетероциклические соединения и др. Органические смазки имеют очень хорспиие эксплуатационные свойства и могут применяться как универсальные для различных механизмов и условий применения. [c.190]
Ароматические углеводороды могут быть получены и из некоторых сортов каменного угля. Такой уголь, обычно называемый жирным , на 70—80 процентов состоит из углерода, Остальные же 20—30 процентов — это водород и органические вещества, преимущественно углеводороды. Если такой уголь нагревать без доступа воздуха (чтобы он не загорелся), из него выделяется все, кроме углерода. Остающийся чистый углерод называют коке м. А вещества, выделившиеся из угля под действием нагревания, образуют газ, получивший название коксового газа. Он состоит в основном из водброда и метана, но есть в нем и пары более сложных соединений, которые можно отделить. Это главным образом бензол, толуол и ксилолы. Каждая тонна такого угля может дать их примерно 3 галлона. [c.60]
Так как при окислении парафина кислород распределяется по всем метиленовым группам примерно равномерно, нри окислении получаются кислоты разного молекулярного веса, из которых нерегопкой отделяют кислоты, пригодные для мыловарения. Окисление проводят при возможно низких температурах порядка 105—120° [69]. Образующиеся жирные кислоты, особенно высокомолекулярные, окисляются далее, при этом образуются оксикислоты, кетокислоты и двухосновные жирные кислоты, не растворимые в бензине. Чтобы свести к минимуму образование этих нежелательных побочных продуктов, окисление ограничивают 30—50%-ным превращением всей окисляемой углеводородной смеси. В качестве катализатора применяют в большинстве случаев перманганат калия в количестве 0,3% вес. от всего парафина. Перманганат калия вводят нри перемешивании в нагретый до 150° парафин в виде концентрированного водного раствора, вода испаряется, а перманганат восстанавливается органическим веществом до двуокиси марганца, которая распределяется в реакционной смеси в исключительно тонко распыленном состоянии. Окисление ведут без применения давления. Важно, чтобы применяемый для окисления воздух поступал в парафин в возможно тонко распыленном состоянии. [c.162]
Наилучшие результаты дает омыление содовым раствором, так как в этом случае сводится к минимуму образование побочного продукта — диаллилового эфира, которого получается тем больше, чем концентрированное омыляющип раствор щелочи. При применении соды в качестве омыляю-щего раствора необходимо непрерывно удалять образующуюся углекислоту. При этом имеют место значительные потери органического вещества. Для избежания этого в реакционную смесь непрерывно добавляют натриевую щелочь в количестве, необходимом для поддержания щелочности среды, [c.174]
Достижение равновесия 502С12 502+ СЬ ускоряется не только твердыми катализаторами, ш и многочисленными органическими веществами. [c.185]
Синтетические моющие средства, особенно соли сульфокислот и алкилсульфлты, пе обладают способностью удерживать смытую грязь в растворе, т. е. способностью предотвращать товторное поглощение волокном окрашенной грязи — свойством, которым мыло обладает в очень высокой мере. Окрашенные загрязнения, состоящие из пыли и прочих неорганических составных частей, частично удерживаются на ткани органическими веществами, именно как жиры, масла и пот. Если эти вещества моющим средством извлекаются из ткани, переходя в эмульгированное состояние, то загрязнения в значительной мере теряют свою связь и также отделяются от волокна и связываются с мицеллами натурального мыла, что препятствует их обратному поглощению волокном. В случае синтетических средств типа солей сульфокислот, у которых вследствие слабовыраженного коллоидного характера мицеллы образуются лишь в меньшей мере, способность удержания смытой грязи в растворе выражена значительно слабее. Синтетические моющие средства обладают большой диспергирующей способностью, в результате чего грязь, переходя в раствор, оказывается сильно диспергированной и в таком виде вновь частично поглощается хлопчатобумажным волокном. Это приводит к тому, что со временем наблюдается посерение белья, которое, правда, становится заметным лишь после повторных стирок. Чтобы предупредить такое посерение белья, необходимо к синтетическим моющим веществам, не обладающим способностью удержания смытой грязи в растворе, прибавлять вещества, способные выполнить роль мицелл мыла. Такие вещества были найдены, -например, в виде тилозы НВК (эфира целлюлозы и гликолевой кислоты, являющегося продуктом реакции алкилцеллюлозы с моно-хлоруксуснокислым натрием — карбоксиметилцеллюлозы), применяемой либо самостоятельно, либо в смеси с силикатом натрия. В настоящее время их прибавляют в определенном количестве к каждому синтетическому моющему средству, особенно к мыльным порошкам. [c.409]
Перманганат калия вводят в виде концентрированного водносо раствора в нагретый до 150° парафин. Вода испаряется, и перманганат, находящийся в жидкости в результате хорошего перемешивания в виде очень тонкой взвеси, частично восстанавливается органическим веществом в чрезвычайно дисперсный МпОг. Таким образом удается снизить температуру до ПО—120° и тем не менее сохранить технически приемлемую скорость лроцесса. [c.450]
Из 1000 весовых частей синтетического парафинового гача получают 270 весовых частей водного конденсата, из которых органических веществ 90—120 весовых частей. Прюкнер приводит следующий состав (в %) конденсаторной воды [68]. [c.469]
Караш, Уоллинг и Майо [53] смогли подтвердить результаты Лауера и Стодола и показали, что ни присутствие перекисей или других органических веществ, ни температура, растворитель или природа галоидоводорода не оказывают никакого влияния на количественное соотнощение, в котором образуются изомерные бромпентаны [c.551]
В заключение следует сказать несколько слов о технике безопасности в лаборатории количественного анализа. Все операции с ядовитыми газами и жидкостями (НгЗ, Вгг, СЬ, ртуть и ее соединения, соединения мышьяка и т. п.) необходимо проводить под тягой. С большой осторожностью нужно работать с фтористоводородной и хлорной кислотами. Первая может причинить серьезные ожоги, вторая взрывается при нагревании в присутствии органических веществ. Выпаривание всех сильных кислот и растворов, содержащих пахучие вещества, необходимо проводить в вытяжном шкафу, при отмеривании едких и ядовитых жидкостей нужно пользоваться мерными цилиндрами и специальными пипет ками. [c.41]
С1пределение описанным методом далеко не всегда дает достаточно правильное представление о количестве гигроскопической воды. Действительно, потеря в массе во время высушивания зависит от удаления из вещества не только гигроскопической, но и кристаллизационной воды, равно как и других летучих составнЬ1Х частей вещества. Другим часто встречающимся источником погрешностей рассматриваемого метода является окисление исследуемого вещества кислородом воздуха при нагревании. Потеря в массе вследствие этого оказывается меньшей, чем должна была бы быть, судя по действительному содержанию гигроскопической воды. Это наблюдается при анализе многих органических веществ, например муки, кожи и т. п. [c.165]
Органическая химия (1968) -- [ c.22 ]Качественный полумикроанализ (1949) -- [ c.0 ]
Аналитическая химия висмута (1953) -- [ c.0 ]
Аналитическая химия брома (1980) -- [ c.0 ]
Очистка сточных вод (2004) -- [ c.0 ]
Санитарно-химический контроль воздушной среды (1978) -- [ c.32 ]
Двойной слой и кинетика электродных процессов (1967) -- [ c.0 ]
Химия промышленных сточных вод (1983) -- [ c.0 ]
Аналитическая химия промышленных сточных вод (1984) -- [ c.0 ]
Перекись водорода (1958) -- [ c.0 ]
Курс органической химии (1979) -- [ c.0 ]
Эмиссионный спектральный анализ Том 2 (1982) -- [ c.0 ]
Очерк общей истории химии (1969) -- [ c.40 , c.69 , c.94 , c.152 , c.161 , c.173 , c.358 , c.359 ]
Технический анализ Издание 2 (1958) -- [ c.0 ]
Неорганическая химия (1950) -- [ c.193 ]
Курс органической химии (1970) -- [ c.0 ]
Объёмный анализ Том 2 (1952) -- [ c.0 ]
Органическая химия (1972) -- [ c.14 ]
Фотометрический анализ методы определения неметаллов (1974) -- [ c.0 ]
Курс химического качественного анализа (1960) -- [ c.621 ]
Органическая химия (1972) -- [ c.14 ]
Курс химического и качественного анализа (1960) -- [ c.62 ]
Краткий справочник химика Издание 4 (1955) -- [ c.0 ]
Курс органической химии _1966 (1966) -- [ c.0 ]
Органическая химия Издание 4 (1970) -- [ c.0 ]
Методы аналитической химии - количественный анализ неорганических соединений (1965) -- [ c.0 ]
Биохимия Издание 2 (1962) -- [ c.6 , c.8 , c.15 , c.229 ]
Происхождение жизни Естественным путем (1973) -- [ c.14 , c.68 , c.74 , c.75 , c.82 , c.94 , c.96 , c.104 , c.129 , c.131 , c.139 , c.148 , c.175 , c.177 , c.179 , c.191 , c.192 , c.200 , c.207 , c.221 , c.271 , c.285 , c.287 , c.304 , c.305 , c.310 , c.311 , c.367 , c.380 , c.385 , c.387 , c.389 , c.390 , c.392 ]
chem21.info
Крахмал вещества - Справочник химика 21
Трибутират крахмала с 25% пластификатора применяется в качестве замазки в авиастроении. Капроновый эфир крахмала — вещество мягкое и клейкое даже без пластификатора. [c.82]В то время как гигантские молекулы таких веществ, как крахмал или клетчатка древесины, построены из одного многократно повторяемого блока, молекула белка строится из двадцати различных, но тесно связанных блоков — различных аминокислот (см. гл. 6). Именно по этой причине молекулы белков так разнообразны, но это же создает большие трудности при попытке их характеризовать. [c.129]
Химики делят все вещества на два класса. К одному относятся, например, масло, сахар, крахмал, клей, желатин, шелк, каучук, бумага и пенициллин. Все это органические вещества. К, другому относятся воздух, вода, песок, глина, соль, золото, серебро, железо, латунь, стекло и цемент. Это неорганические вещества. [c.9]В виде крахмала растения хранят свои запасы питательных веществ, особенно предназначенные для будущего поколения. Много крахмала в семенах, например в кукурузных початках или зернах пшеницы, а также в клубнях картофеля или корнеплодах моркови, из которых вырастают новые растения. Крахмал очень удобен для сохранения глюкозы, потому что он хранит ее остатки в нерастворимом виде. А когда нужно, растение может снова разложить крахмал на молекулы глюкозы — гидролизовать его. [c.145]
Например, молекулы глюкозы могут конденсироваться не только в молекулы крахмала, но и несколько иным способом. При этом получаются гигантские молекулы вещества, которое называется целлюлозой. [c.147]
Иод — вещество летучее, поэтому титрование ведут на. w-лоду. Это необходимо также и потому, что с повышением температуры понижается чувствительность крахмала как индикатора. Если нагреть посиневший от капли иода раствор крахмала, то синяя окраска его исчезнет при охлаждении она вновь появляется. [c.399]
Ход определения. Взвешивают на аналитических весах около 2,5 г белильной извести в бюксе с закрытой крышкой. Навеску тщательно растирают с небольшой порцией воды в ступке с носиком, после чего количественно переносят через воронку в мерную колбу емкостью 250 мл. Тщательно смывают туда же остаток вещества с пестика, ступки и воронки. Содержимое колбы разбавляют водой до метки и хорошо взбалтывают. Сразу же, пока частицы извести не успели осесть, отбирают пипеткой 25,00 мл полученной суспензии в колбу для титрования, прибавляют 10 мл 20%-ного раствора KI и 20 лл 4 н. раствора НС1. Выделившийся иод оттитровывают, как обычно, раствором тиосульфата, прибавляя раствор крахмала (5 мл) в самом конце титрования. Определение повторяют еще 2—3 раза, не забывая хорошо взбалтывать суспензию перед взятием аликвотной части для анализа. [c.407]
Углеводы — это обширный класс органических соединений с эмпирической формулой С (Н, 0) , образование которых связано с процессом фотосинтеза. Углеводы в растениях находятся в виде моносахаридов (глюкоза — С Н О ), олигосахаридов (крахмал) и полисахаридов (целлюлоза — (С Н О ) , где п > 10000. Целлюлоза — основной строительный материал растительных тканей. Она выполняет в растениях опорные функции и придает им механическую прочность. По распространенности органических веществ на земном шаре она занимает первое место. [c.47]
Исходным веществом для установки титра тиосульфата является свежевозогнанный йод, а индикатором свежеприготовленный крахмал. В двух-трех маленьких бюксах с притертыми пробками берут примерно по 0,25 г йода и определяют их точный вес на аналитических весах. [c.142]
Пористость катализаторов повышают добавлением к ним горючих материалов (выгорающие добавки) древесный уголь, газовую сажу, смолистые вещества, древесную муку, целлюлозу, крахмал. В случае формования катализаторов таблетированием к ним иногда добавляют графит, выполняющий роль смазки. При гранулировании катализаторов используется добавка (3%) сульфитного щелока — продукта, образующегося при обработке целлюлозы бисульфитом кальция. [c.20]
В качестве связующих применяют также вещества, придающие исходной массе пластичность. Это свойство позволяет придать массе определенную форму. На последующих стадиях обработки носителя эти вещества могут удаляться тем или иным способом. К такому типу удаляемых связующих относится парафин (до 20%), стеариновая кислота, стеарат алюминия, декстриновый и крахмальный клеи (7—15%). При использовании крахмала в качестве связки его обрабатывают молочной кислотой и нагревают до температуры 100—200° С. [c.29]
По химическому составу вещество клеточной оболочки, или клетчатка, принадлежит к группе углеводов, куда, между прочим, относятся хорошо знакомые нам сахар и крахмал. Элементный анализ клетчатки показывает, что она состоит из углерода в количестве 44%, водорода — около 6% и кислорода — 50%. [c.22]
Правило А. В. Думанского (Р/Л й 6050 Дж/моль) применимо лишь для тех веществ, с которыми молекулы воды взаимодействуют с помощью водородных связей (целлюлоза, крахмал, дегидратированный при 110°С палыгорскит). Если основными центрами адсорбции воды являются не гидроксильные группы или атомы кислорода, а обменные катионы (как в случае цеолитов, вермикулита и др.) или координационно ненасыщенные ионы (как в случае палыгорскита, дегидратированного при 180—250°С), то правило А. В. Думанского становится неприменимым [66]. [c.32]
Как используются в растениях два полимера-крахмал и целлюлоза Какие вещества играют аналогичные роли в человеческом организме [c.342]
На практике увеличение размера частиц уже имеющейся суспензии обычно достигается их агрегацией в результате добавления к суспензии различных неорганических или органических веществ. Эти вещества должны обладать такими свойствами, которые сводят к минимуму обратные процессы пептизации и улучшают условия разделения суспензии на фильтре, а также позволяют быстро приготовить их в удобном для использования виде и смещать с суспензией. Подобные вещества, применяемые в промышленности, предложено объединить в следующие группы неорганические соли, крахмал и его производные, полиэлектролиты. Агре- [c.190]
Рассмотрены особенности предварительной обработки суспензий, выполняемой с целью увеличения размеров твердых частиц и улучшения условий фильтрования [213]. Описано действие на суспензии различных видов агрегирующих веществ органических — крахмала, протеина, клея неорганических — кислот, оснований, солей высокомолекулярных полиэлектролитов. Отмечено наличие резко выраженного оптимума в количестве агрегирующего вещества, обеспечивающем наибольшее увеличение размера частиц. Изложены методы экспериментального определения оптимальных условий агрегации частиц — вида и количества агрегирующего вещества, концентрации суспензии, pH среды, интенсивности перемешивания, продолжительности агрегации. Даны сведения о лабораторных устройствах для исследования предварительной обработки суспензий. [c.193]
С.>ш ку, ио растворимую в углеводородах, а также галоидалкилах. эфира с п других неполярных веществах, готовят растворением 4 г картофельного крахмала и 2 г сахара в глицерине при 140 С. [c.150]
Высокомолекулярные соединения. Пластмассы. Высокомолекулярными называются соединения, молекулы которых построены из нескольких тысяч или даже десятков тысяч атомов. Такие вещества содержатся и в природных материалах (целлюлоза, крахмал и др.), и получаются искусственно (например, синтетический каучук). [c.159]
Трубчатые сушилки применяются в тех случаях, когда обрабатываемые материалы не могут быть высушены в прямом контакте с горячим воздухом и когда температура материала должна быть ниже 100° С. Они используются для сушки органических веществ, пластмасс, крахмала и др. [c.160]
Растительное и животное сырье уже вытеснено в основном минеральным и синтетическим в производстве красителей, лаков, лекарственных веществ, душистых веществ, большинства пластических масс и ряда других материалов. Вытесняется растительное сырье веществами, полученными из природных газов, нефти и угля, в производстве каучука, химического волокна, спиртов, органических кислот, моющих средств. На очереди стоит получение из непищевых веществ основных продуктов питания крахмала и сахара и, наконец, синтез составных частей белков. Ныне уже получают биохимическим превращением отходов нефтеперерабатывающей и целлюлозно-бумажной промышлеиности белковые дрожжи для кормления скота. Замена пищевого сырья — растительного и животного — минеральным ведет к значительному удешевлению сырья. Умеща-шение же стоимости сырья значительно снижает основной производственный показатель — себестоимость химической продукции. [c.23]
При помощи серной кислоты производятся этиловый и другие спирты, некоторые эфиры, синтетические моющие средства, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными травами. Разбавленные растворы серной кислоты и ее солей применяют в производстве искусственного шелка, в текстильной промышленности для обработки волокна или тканей перед их крашением, а также в других отраслях легкой промышленности. В пищевой промышлеиности серная кислота применяется при получении крахмала, патоки и ряда других продуктов. Транспорт использует свинцовые сернокислотные аккумуляторы. Серную кислоту используют для осушки газов и при концентрировании кислот. Наконец, серную кислоту применяют в процессах нитрования и при производстве большей части взрывчатых веществ. [c.115]
Минеральными удобрениями называют соли, содержащие элементы, необходимые для питания растений и вносимые в почву для получения высоких и устойчивых урожаев. В состав растений входят около 60 химических элементов. Для образования ткани растения, его роста и развития требуются в первую очередь углерод, кислород и водород, образующие основную часть растительной массы, далее азот, фосфор, калий, магний, сера, кальций и железо. Источниками веществ, необходимых для питания растений, служат воздух и почва. Из воздуха растения извлекают основную массу углерода в виде диоксида углерода, усваиваемого путем фотосинтеза, а из почвы — воду и минеральные вещества. Некоторое количество диоксида углерода воспринимается корневой системой растений из почвы. Среди минеральных веществ особенно важны для жизнедеятельности растений азот, фосфор и калий. Эти элементы способствуют обмену веществ в растительных клетках, росту растений и особенно плодов, повышают содержание ценных веществ (крахмала в картофеле, сахара в све-кле, фруктах и ягодах, белка в зерне), повышают морозостойкость и засухоустойчивость растений, а также их стойкость к заболеваниям. При интенсивном земледелии почва истощается, т. е. в ней резко снижается содержание усваиваемых растениями минеральных веществ, в первую очередь растворимых в воде и почвенных кислотах соединений азота, фосфора и калия. Истощение почвы снижает урожайность и качество сельскохозяйственных культур. Уменьшение содержания питательных веществ в почве необходимо постоянно компенсировать внесением удобрений. Ввиду огромных масштабов потребления минеральные удобрения— наиболее крупнотоннажный вид химической продукции, годовое количество которой составляет десятки миллионов тонн. [c.143]
Как видно из таблицы, второе. место по процентному содержанию в составе зерна пшеницы заним ает белок. 0,н является наиболее ценным и наиболее трудноотделимым от крахмала веществом. [c.32]
Крахмал. В зеленых частях растений на солнечном свету из углекислого газа и воды образуются моносахариды, которые путем сложных процессов полимеризации превращаются в первичные зерна крахмала — вещества (С0НюО5) , где п того же порядка, что и у целлюлозы. В технике крахмал добывают или из клубней картофеля, или из зерен риса, пшеницы, кукурузы и других растений. [c.307]
Широко применяется в аэрозольных упаковках. Хотя синтетические препараты, заменяющие крахмал, — вещества доступные, их применяют мало, так как они обладают способностью выводить из строя клапаны баллонов. В связи с этим значительно чаще используют натуральный крахмал, к которому добавляют воду и иногда силиконовую эмульсию или буру, а также консервирующее средство. В качестве пропеллента обычно применяют бутан. Можно однако пользоваться и смесью фреонов 114 и 12 (в соотношениях 3 2 или 1 1), если ввести в состав аэрозоля подходящее поверхностно-активное вещество. Рецептуры (в %) [c.345]
Целлюлоза и крахмал, вещества с совершенно различными свойствами, в конце концов оба построены из глюкозы, которую получают при полной их деструкции. Осторожная деструкция обоих высокополимеров приводит к ДВУМ разным дисахаридам, к целлобиозе из целлюлозы и к мальтозе из крахмала. Однако разница в строении обоих этих дисахаридов состоит только в тонком отличии пространственного строения из этого отличия никогда не вывели бы столь различного поведения обоих высокополимеров, какое обнаруживают целлюлоза и крахмал. Целлобиоза является /3-1,4-глюкозидглюкозой, мальтоза — а-1,4-глюкозидглюкозой (ср. т. 1, стр. 213) в соответствии с приводимыми [c.306]
Вёлер, Кольбе и Бертло синтезировали относительно простые органические соединения, тогда как для живой природы характерны значительно более сложные соединения типа крахмала, жиров и белков. Изучать такие соединения гораздо труднее непросто даже установить их точный элементный состав. В целом изучение органических веществ обещало разгадку многих проблем, но подступиться к этим веществам химику прошлого века было совсем непросто. [c.71]
Общие сведения. Хлористый аллил является важнейшим промежуточным продуктом нефтехимической промышленности. Он легко омыляется в аллиловый спирт, являющийся исходным материалом для получения синтетического глицерина и многих эфиров, из которых важнейшими являются эфиры фталевой, фосфорной и угольной кислот. Эфиры аллило-вого спирта и низших жирных кислот, таких как уксусная, масляная или капроновая, а также коричной и фенилуксусной кислот, имеют особое значение для промышленности душистых веществ. Представляют интерес также эфиры аплилового спирта и крахмала или сахаров. Их получают взаимодействием спиртовых гидроксильных групп с хлористым аллилом. На рис. 100 показаны важнейшие направления использования хлористого аллила в нефтехимическом синтезе. [c.172]
Метод [53—58], который не служит для получения чистого глицерина, а дает скорее смесь глицерина с другими гликолями, основан на углеводах как исходных веществах (крахмал, древесная мука и сахар, особенно тростниковый). Из углеводов в результате гидролиза получают сначала гексозы, которые затем гидрируют в 40— 50% водном растворе в присутствии 6% никеля под давлением водорода 300 кгс/см2 и при температуре, повышающейся от 80 до 180 °С. После выпаривания реакционная смесь — глицероген — состоит примерно из 35—40% глицерина, 25—30% пропиленгликоля, 5—10% этиленликоля, 1—6% воды и гекситов. [c.192]
Флокуляция [5.3, 5.4, 5.33, 5.38, 5.55, 5.64]. Под флокуляцией понимают процесс агрегирования взвешенных частиц при добавлении в воду высокомолекулярных веществ, называемых флокулян-iaMH. Последние подразделяются на три основные группы неорга-Ьические (кремниевая кислота), природные (крахмал, декстрин, афиры целлюлозы) и синтетические органические (полиакриламид, [c.480]
Катализатор содержит 15—30 мас.% закиси никеля, каолинито-вую глину, портланд-цемент, цемент (гидравлический, циркониевый или магнезиальный), 12—30 мае. % окиси магния и окиси других металлов второй группы периодической системы, 1—5 мас.% промотирующих окислов хрома или алюминия. Прочность катализатора повышается добавкой материала с игольчатой микроструктурой, а пористость — добавкой древесного угля, крахмала, ме-тилцеллюлозы, газовой сажи, смолистых веществ. Второй способ позволяет получить более прочный катализатор. Применяют при разложении углеводородов с целью получения водорода [c.59]
Глюкоза получается при гидролизе полиспхаридов крахмала и целлюлозы (под действием ферментов или минеральных кислот). Применяется как средство усиленного питания или как лекарственное вещество, при отделке тканей, как восстановитель — в производстве зеркал. [c.491]
Энергию дает практически любая пища, но углеводы (сахар и крахмал) содержат ее больше других продуктов. Чтобы успешно строить клетки нашего организма, нужны более специфичные вещества. Основной строительный материал в этом сллчае — белки и жиры. Также абсолютно необходимы витамины и минер 1льные соли, хотя и в очень небольших количествах. [c.233]
Полимерные молекулы, состоящие из мономеров - сахаров, называются полисахаридами >ис. IV.5). (Вспомните, что приставка поли обозначает молекулу, содержащую повторяющиеся молекулы меньшего размера, соединенные вместе.) Крахмал -- основной компонент зерна и многих овощей это полисахарид, состс яии й из глюкозных остатков. Целлюлоза — волокнистое структурное вещество растений это еще один полисахарид, образованный глюкозой. Некоторые ипы углеводов перечислены в табл. IV.3. [c.245]
Пища дает нам все исходные вещества, необходимые, чтобы организм жил и нормально функционировал. При переваривании крупные молекулы пищи распадаются ri.i отдельные строительные блоки, например крахмал распадается до глюкозы. Эти блоки затем проникают через стенки кишечника и попадают в кров1>, которая переносит их к соответствующим клеткам, где они становятся исходными веществами в цепи химических превращений, поддерживающих жишь и здоровье человека. Область химии, изучающая химические рсакции I живых системах, называется биохимией. [c.253]
Образованию стойкой эмульсии предшествуют понижение новерх-HO THOI O натяжения на границе раздела фаз и создание вокруг частиц дисперсной фазы прочного адсорбционного слоя. Такие слои образуют в системе третьи веш ества — эмульгаторы. Растворимые в воде (гидрофильные) эмульгаторы способствуют образованию эмульсий тина нефть в воде, а растворимые в нефтепродуктах (гидрофобные) — вода в нефти. Последний тип эмульсий чаще всего встречается в промысловой практике. К гидрофильным эмульгаторам относятся такие поверхностно-активные вещества, как щелочные мыла, желатин, крахмал. Гидрофобными являются хорошо растворимые в нефтепродуктах щелочноземельные соли органических кислот, смолы, а также мелкодисперсные частицы сажи, глины, окислов металлов и т. п., легче смачиваемые нефтью, чем водой. Введение в эмульсию данного типа эмульгатора, способствующего образованию эмульсии противоположного типа, облегчает ее расслоение. [c.178]
В растениях молекула глюкозы полимеризуется в цепи, состоящие из тысяч мономерных единиц, в результате чего получается целлюлоза, а если полимеризация происходит несколько иным образом, получается крахмал. Близкородственный к глюкозе К-ацетилглюкозамин в результате полимеризации образует хитин - вещество, из которого состоит роговица насекомых. Другое близкое по составу вещество, Ы-ацетилмурановая кислота, сополимеризуется в другую последовательность цепей, из которых построены стенки бактериальных клеток. Глюкоза разлагается в несколько стадий, выделяя энергию, которая требуется живому организму. Избыток глюкозы переносится кровотоком в печень и превращается в животный крахмал - гликоген, который при необходимости снова превращается в глюкозу. Глюкоза, целлюлоза, крахмал и гликоген относятся к углеводам. [c.308]
Ультрафильтрация представляет большой интерес для выделения декстринов из крахмала, спиртов из растворов, получающихся при брожении различных продуктов, аминокислот и многих других веществ из различных отходов пищевой промышленности. При непрерывной ульт-рафильтрацни через мембрану могут проникать целевой продукт и низкомолекулярные вещества, которые при необходимости можно разделить последующей ультрафнльтрацией через более микропористые ультрафильтры. Образующийся концентрат возвращается в реактор. Такой процесс не сложен, но позволяет получать чистый продукт и сохранять в реакторе оптимальную концентрацию микроорганизмов и ферментов. Количество отходов при этом мало. [c.293]
Максимум иабухаемости клейковины имеет место при температуре 28—30 °С, а при 60—70 °С белковые вещества тесто.-хлеба дена-гурируются и свертываются, освобождая при этом воду, поглощенную при набухании. При повышении температуры до 50—60 °С крахмал муки интенсивно набухает и начинается клейстеризация крахмала и разрушение внутренней мицеллярной структуры. При температуре 50—70 °С протекают процессы клейстеризации крахмала и коагуляция белков, которые обусловливают переход тесто-хлеба в состояние мякиша. Повышение температуры до 60—70 °С приводит к резкому изменению консистенции — сгущению теста. Мякиш хлеба выдерживают в печи до температуры 92—98 °С в центре для придания ему необходимой упругости [24, 251. [c.50]
Данная реакция протекает строго количественно и лежит в основе 0ДН0Г0 из методов титриметрического анализа — иодометрии. Этим методом можно определять содержание самых разнообразных окислителей. К анализируемому веществу добавляют избыток раствора KI и выделившийся при действии окислителя Ь оттитровывают раствором ЫзгЗаОа, используя в качестве индикатора крахмал. Тетратионат натрия N328406 является солью тетратионо-вой кислоты — одной из политионовых кислот, общая формула которых HaS Oe (rt > 2) они имеют строение [c.450]
Механизм действия коллоидных растворов поверхностно-активных веществ также основан на понижении поверхностной энергии на границе раздела фаз, однако при использовании этих коагулянтов на поверхности поляризуются не отдельные ионы или молекулы, а коллоидные частицы. В качестве коллоидных растворов поверхностно-активных веществ применяют вещества растительного происхождения (крахмал и его производные, щелочные вытяжки из торфа и бурого угля, сульфитноспиртовая барда), а также синтетические соединения, главным образом производные эфиров целлюлозы (например, карбоксилметилцеллюлоза). [c.119]
Химические реакции лежат в основе всех жизненных процессов, протекающих в организмах растений и животных. Все продукты жизнедеятельности, как то целлюлоза, крахмал, сахар, жиры, белки и прочие вещества — получаются из исходных веществ, содержащихся в окр жающей среде, — углекислого газа, воды, минеральных солей и пр. Оргаинческне вещества растительного иро-исхо -кдення служат пищей для животных. В их организме путем химических превращений эти вещества преобразуются в еще более сложные вещества. [c.6]
chem21.info











