Очистка воды от молибдена: необходимость проведения и способы очистки. Молибден в питьевой воде
Молибден
Соединения молибдена попадают в поверхностные воды в результате выщелачивания их из экзогенных минералов, содержащих молибден. Молибден попадает в водоемы также со сточными водами обогатительных фабрик, предприятий цветной металлургии. Понижение концентраций соединений молибдена происходит в результате выпадения в осадок труднорастворимых соединений, процессов адсорбции минеральными взвесями и потребления растительными водными организмами.
Молибден в поверхностных водах находится в основном в форме МоО42-. Весьма вероятно существование его в виде органоминеральных комплексов. Возможность некоторого накопления в коллоидном состоянии вытекает из того факта, что продукты окисления молибденита представляют рыхлые тонкодисперсные вещества.
В речных водах молибден обнаружен в концентрациях от 2.1 до 10.6 мкг/дм3. В морской воде содержится в среднем 10 мкг/дм3 молибдена.
В малых количествах молибден необходим для нормального развития растительных и животных организмов. Молибден входит в состав фермента ксантиноксидазы. При дефиците молибдена фермент образуется в недостаточном количестве, что вызывает отрицательные реакции организма. В повышенных концентрациях молибден вреден. При избытке молибдена нарушается обмен веществ.
Предельно допустимая концентрация молибдена в водоемах санитарно-бытового использования составляет 0.25 мг/дм3.
Мышьяк
В природные воды мышьяк поступает из минеральных источников, районов мышьяковистого оруднения (мышьяковый колчедан, реальгар, аурипигмент), а также из зон окисления пород полиметаллического, медно-кобальтового и вольфрамового типов. Некоторое количество мышьяка поступает из почв, а также в результате разложения растительных и животных организмов. Потребление мышьяка водными организмами является одной из причин понижения концентрации его в воде, наиболее отчетливо проявляющегося в период интенсивного развития планктона.
Значительные количества мышьяка поступают в водные объекты со сточными водами обогатительных фабрик, отходами производства красителей, кожевенных заводов и предприятий, производящих пестициды, а также с сельскохозяйственных угодий, на которых применяются пестициды.
В природных водах соединения мышьяка находятся в растворенном и взвешенном состоянии, соотношение между которыми определяется химическим составом воды и значениями рН. В растворенной форме мышьяк встречается в трех- и пятивалентной форме, главным образом в виде анионов.
В речных незагрязненных водах мышьяк находится обычно в микрограммовых концентрациях. В минеральных водах его концентрация может достигать нескольких миллиграммов в 1 дм3, в морских водах в среднем содержится 3 мкг/дм3, в подземных - встречается в концентрациях n.105 мкг/дм3. Соединения мышьяка в повышенных концентрациях являются токсичными для организма животных и человека: они тормозят окислительные процессы, угнетают снабжение кислородом органов и тканей.
ПДКв мышьяка составляет 0.05 мг/дм3 (лимитирующий показатель вредности — санитарно-токсикологический) и ПДКвр - 0.05 мг/дм3.
Никель
Присутствие никеля в природных водах обусловлено составом пород, через которые проходит вода: он обнаруживается в местах месторождений сульфидных медно-никелевых руд и железо-никелевых руд. В воду попадает из почв и из растительных и животных организмов при их распаде. Повышенное по сравнению с другими типами водорослей содержание никеля обнаружено в сине-зеленых водорослях. Соединения никеля в водные объекты поступают также со сточными водами цехов никелирования, заводов синтетического каучука, никелевых обогатительных фабрик. Огромные выбросы никеля сопровождают сжигание ископаемого топлива.
Концентрация его может понижаться в результате выпадения в осадок таких соединений, как цианиды, сульфиды, карбонаты или гидроксиды (при повышении значений рН), за счет потребления его водными организмами и процессов адсорбции.
В поверхностных водах соединения никеля находятся в растворенном, взвешенном и коллоидном состоянии, количественное соотношение между которыми зависит от состава воды, температуры и значений рН. Сорбентами соединений никеля могут быть гидроксид железа, органические вещества, высокодисперсный карбонат кальция, глины. Растворенные формы представляют собой главным образом комплексные ионы, наиболее часто с аминокислотами, гуминовыми и фульвокислотами, а также в виде прочного цианидного комплекса. Наиболее распространены в природных водах соединения никеля, в которых он находится в степени окисления +2. Соединения Ni3+ образуются обычно в щелочной среде.
Соединения никеля играют важную роль в кроветворных процессах, являясь катализаторами. Повышенное его содержание оказывает специфическое действие на сердечно-сосудистую систему. Никель принадлежит к числу канцерогенных элементов. Он способен вызывать респираторные заболевания. Считается, что свободные ионы никеля (Ni2+) примерно в 2 раза более токсичны, чем его комплексные соединения.
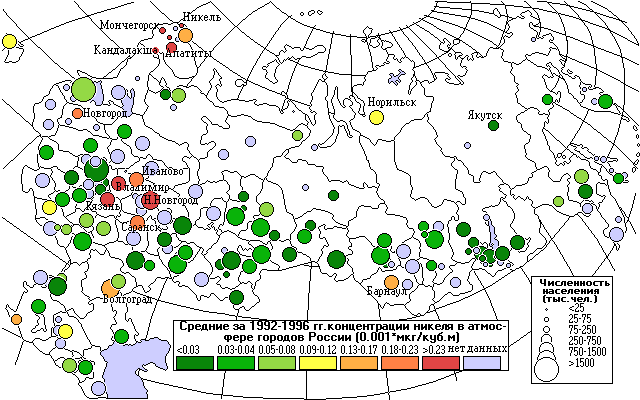 В речных незагрязненных и слабозагрязненных водах концентрация никеля колеблется обычно от 0.8 до 10 мкг/дм3; в загрязненных она составляет несколько десятков микрограммов в 1 дм3. Средняя концентрация никеля в морской воде 2 мкг/дм3, в подземных водах - n.103 мкг/дм3. В подземных водах, омывающих никельсодержащие горные породы, концентрация никеля иногда возрастает до 20 мг/дм3.
В речных незагрязненных и слабозагрязненных водах концентрация никеля колеблется обычно от 0.8 до 10 мкг/дм3; в загрязненных она составляет несколько десятков микрограммов в 1 дм3. Средняя концентрация никеля в морской воде 2 мкг/дм3, в подземных водах - n.103 мкг/дм3. В подземных водах, омывающих никельсодержащие горные породы, концентрация никеля иногда возрастает до 20 мг/дм3.
Содержание никеля в водных объектах лимитируется: ПДКв составляет 0.1 мг/дм3 (лимитирующий признак вредности — общесанитарный), ПДКвр — 0.01 мг/дм3 (лимитирующий признак вредности — токсикологический).
Никель поступает в атмосферу от предприятий цветной металлургии, на долю которых приходится 97% всех выбросов никеля, из них 89% на долю предприятий концерна “Норильский никель”, расположенных в Заполярном и Никеле, Мончегорске и Норильске.
П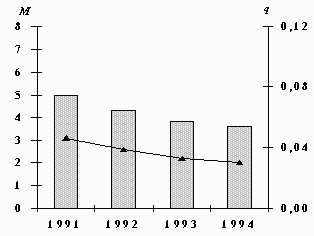 овышенное содержание никеля в окружающей среде приводит к появлению эндемических заболеваний, бронхиального рака. Соединения никеля относят к 1 группе канцерогенов.
овышенное содержание никеля в окружающей среде приводит к появлению эндемических заболеваний, бронхиального рака. Соединения никеля относят к 1 группе канцерогенов.
На карте видно несколько точек с высокими средними концентрациями никеля в местах расположения концерна Норильский никель: Апатиты, Кандалакша, Мончегорск, Оленегорск.
Выбросы никеля от промышленных предприятий снизились на 28%, средние концентрации – на 35%.
Выбросы М (тыс.т/год) и среднегодовые концентрации q (мкг/м3) никеля.
Олово
В природные воды поступает в результате процессов выщелачивания оловосодержащих минералов (касситерит, станнин), а также со сточными водами различных производств (крашение тканей, синтез органических красок, производство сплавов с добавкой олова и др.).
Токсическое действие олова невелико.
В незагрязненных поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограммов в 1 дм3. ПДКв составляет 2 мг/дм3.
Ртуть
В поверхностные воды соединения ртути могут поступать в результате выщелачивания пород в районе ртутных месторождений (киноварь, метациннабарит, ливингстонит), в процессе разложения водных организмов, накапливающих ртуть. Значительные количества поступают в водные объекты со сточными водами предприятий, производящих красители, пестициды, фармацевтические препараты, некоторые взрывчатые вещества. Тепловые электростанции, работающие на угле, выбрасывают в атмосферу значительные количества соединений ртути, которые в результате мокрых и сухих выпадений попадают в водные объекты.
Понижение концентрации растворенных соединений ртути происходит в результате извлечения их многими морскими и пресноводными организмами, обладающими способностью накапливать ее в концентрациях, во много раз превышающих содержание ее в воде, а также процессов адсорбции взвешенными веществами и донными отложениями.
В поверхностных водах соединения ртути находятся в растворенном и взвешенном состоянии. Соотношение между ними зависит от химического состава воды и значений рН. Взвешенная ртуть представляет собой сорбированые соединения ртути. Растворенными формами являются недиссоциированные молекулы, комплексные органические и минеральные соединения. В воде водных объектов ртуть может находиться в виде метилртутных соединений.
Содержание ртути в речных незагрязненных, слабозагрязненных водах составляет несколько десятых долей микрограмма в 1 дм3, средняя концентрация в морской воде 0.03 мкг/дм3, в подземных водах 1-3 мкг/дм3.
Соединения ртути высоко токсичны, они поражают нервную систему человека, вызывают изменения со стороны слизистой оболочки, нарушение двигательной функции и секреции желудочно-кишечного тракта, изменения в крови и др. Бактериальные процессы метилирования направлены на образование метилртутных соединений, которые во много раз токсичнее минеральных солей ртути. Метилртутные соединения накапливаются в рыбе и могут попадать в организм человека.
ПДКв ртути составляет 0.0005 мг/дм3 (лимитирующий признак вредности — санитарно-токсикологический), ПДКвр 0.0001 мг/дм3.
Свинец
Естественными источниками поступления свинца в поверхностные воды являются процессы растворения эндогенных (галенит) и экзогенных (англезит, церуссит и др.) минералов. Значительное повышение содержания свинца в окружающей среде (в т.ч. и в поверхностных водах) связано со сжиганием углей, применением тетраэтилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д. Существенными факторами понижения концентрации свинца в воде является адсорбция его взвешенными веществами и осаждение с ними в донные отложения. В числе других металлов свинец извлекается и накапливается гидробионтами.
Свинец находится в природных водах в растворенном и взвешенном (сорбированном) состоянии. В растворенной форме встречается в виде минеральных и органоминеральных комплексов, а также простых ионов, в нерастворимой - главным образом в виде сульфидов, сульфатов и карбонатов.
В речных водах концентрация свинца колеблется от десятых долей до единиц микрограммов в 1 дм3. Даже в воде водных объектов, прилегающих к районам полиметаллических руд, концентрация его редко достигает десятков миллиграммов в 1 дм3. Лишь в хлоридных термальных водах концентрация свинца иногда достигает нескольких миллиграммов в 1 дм3.
Лимитирующий показатель вредности свинца - санитарно-токсилогический. ПДКв свинца составляет 0.03 мг/дм3, ПДКвр - 0.1 мг/дм3.
Свинец содержится в выбросах предприятиями металлургии, металлообработки, электротехники, нефтехимии и автотранспорта.
Влияние свинца на здоровье происходит при вдыхании воздуха, содержащего свинец, и поступлении свинца с пищей, водой, на пылевых частицах. Свинец накапливается в теле, в костях и поверхностных тканях. Свинец влияет на почки, печень, нервную систему и органы кровообразования. Пожилые и дети особенно чувствительны даже к низким дозам свинца.
Выбросы М (тыс.т/год) и среднегодовые концентрации q (мкг/м3) свинца.
З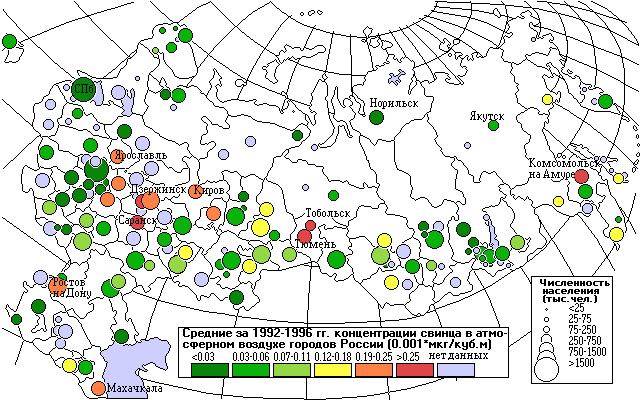 а семь лет выбросы свинца от промышленных источников снизились на 60% вследствие сокращения производства и закрытия многих предприятий. Резкое снижение промышленных выбросов не сопровождается снижением выбросов автотранспорта. Средние концентрации свинца снизились только на 41%. Различие в степени снижения выбросов и концентраций свинца можно объяснить неполным учетом выбросов от автомобилей в предыдущие годы; в настоящее время увеличилось количество автомобилей и интенсивность их движения.
а семь лет выбросы свинца от промышленных источников снизились на 60% вследствие сокращения производства и закрытия многих предприятий. Резкое снижение промышленных выбросов не сопровождается снижением выбросов автотранспорта. Средние концентрации свинца снизились только на 41%. Различие в степени снижения выбросов и концентраций свинца можно объяснить неполным учетом выбросов от автомобилей в предыдущие годы; в настоящее время увеличилось количество автомобилей и интенсивность их движения.
Свинцовая интоксикация
В настоящее время свинец занимает первое место среди причин промышленных отравлений. Это вызвано широким применением его в различных отраслях промышленности. Воздействию свинца подвергаются рабочие, добывающие свинцовую руду, на
свинцово-плавильных заводах, в производстве аккумуляторов, при пайке, в типографиях, при изготовлении хрустального стекла или керамических изделий, этилированного бензина, свинцовых красок и др. Загрязнение свинцом атмосферного воздуха, почвы и воды в окресности таких производств, а также вблизи крупных автомобильных дорог создает угрозу поражения свинцом населения, проживающего в этих районах, и прежде всего детей, которые более чувствительны к воздействию тяжелых металлов.
С сожалением надо отметить, что в России отсутствует государственная политика по правовому, нормативному и экономическому регулированию влияния свинца на состояние окружающей среды и здоровье населения, по снижению выбросов (сбросов, отходов) свинца и его соединений в окружающую среду, полному прекращению производства свинецсодержащих бензинов.
Вследствие чрезвычайно неудовлетворительной просветительной работы по разъяснению населению степени опасности воздействия тяжелых металлов на организм человека, в России не снижается, а постепенно увеличивается численность контингентов, имеющих профессиональный контакт со свинцом. Случаи хронической свинцовой интоксикации зафиксированы в 14 отраслях промышленности России. Ведущими являются электротехническая промышленность (производство аккумуляторов), приборостроение, полиграфия и цветная металлургия, в них интоксикация обусловлена превышением в 20 и более раз предельно допустимой концентрации (ПДК) свинца в воздухе рабочей зоны.
Значительным источником свинца являются автомобильные выхлопные газы, так как половина России все еще использует этилированный бензин. Однако металлургические заводы, в частности медеплавильные, остаются главным источником загрязнений окружающей среды. И здесь есть свои лидеры. На территории Свердловской области находятся 3 самых крупных источника выбросов свинца в стране: в городах Красноуральск, Кировград и Ревда.
Дымовые трубы Красноуральского медеплавильного завода, построенного еще в годы сталинской индустриализации и использующего оборудование 1932 года, ежегодно извергают на 34-тысячный город 150 -170 тонн свинца, покрывая все и вся свинцовой пылью.
Концентрация свинца в почве Красноуральска варьируется от 42,9 до 790,8 мг/кг при предельно допустимой концентрации (ПДК)= 130 мк/кг. Пробы воды в водопроводе соседнего пос. Октябрьский, питаемого подземным водоисточником, фиксировали превышение ПДК до двух раз.
Загрязнение окружающей среды свинцом оказывает влияние на состояние здоровья людей. Воздействие свинца нарушает женскую и мужскую репродуктивную систему. Для женщин беременных и детородного возраста повышенные уровни свинца в крови представляют особую опасность, так как под действием свинца нарушается менструальная функция, чаще бывают преждевременные роды, выкидыши и смерть плода вследствие проникновения свинца через плацентарный барьер. У новорожденных детей высока смертность.
Отравление свинцом чрезвычайно опасно для маленьких детей - он действует на развитие мозга и нервной системы. Проведенное тестирование 165 красноуральских детей от 4 лет выявило существенную задержку психического развития у 75,7%, а у 6,8% обследованных детей обнаружена умственная отсталость, включая олигофрению.
Дети дошкольного возраста наиболее восприимчивы к вредному воздействию свинца, поскольку их нервная система находится в стадии формирования. Даже при низких дозах свинцовое отравление вызывает снижение интеллектуального развития, внимания и умения сосредоточиться, отставание в чтении, ведет к развитию агрессивности, гиперактивности и другим проблемам в поведении ребенка. Эти отклонения в развитии могут носить длительный характер и быть необратимыми. Низкий вес при рождении, отставание в росте и потеря слуха также являются результатом свинцового отравления. Высокие дозы интоксикации ведут к умственной отсталости, вызывают кому, конвульсии и смерть.
Белая книга, опубликованная российскими специалистами, сообщает, что свинцовое загрязнение покрывает всю страну и является одним из многочисленных экологических бедствий в бывшем Советском Союзе, которые стали известны в последние годы. Большая часть территории России испытывает нагрузку от выпадения свинца, превышающую критическую для нормального функционирования экосистемы. В десятках городов отмечается превышение концентраций свинца в воздухе и почве выше величин, соответствующих ПДК.
Наибольший уровень загрязнения воздуха свинцом, превышающий ПДК, отмечался в городах Комсомольск-на-Амуре, Тобольск, Тюмень, Карабаш, Владимир, Владивосток.
Максимальные нагрузки выпадения свинца, ведущие к деградации наземных экосистем, наблюдаются в Московской, Владимирской, Нижегородской, Рязанской, Тульской, Ростовской, Ленинградской областях.
Стационарные источники ответственны за сброс более 50 тонн свинца в виде различных соединений в водные объекты. При этом 7 аккумуляторных заводов сбрасывают ежегодно 35 тонн свинца через канализационную систему. Анализ распределения сбросов свинца в водные объекты на территории России показывает, что по этому виду нагрузки лидируют Ленинградская, Ярославская, Пермская, Самарская, Пензенская и Орловская области.
В стране необходимы срочные меры по снижению свинцового загрязнения, однако пока экономический кризис России затмевает экологические проблемы. В затянувшейся промышленной депрессии Россия испытывает недостаток средств для ликвидации прежних загрязнений, но если экономика начнет восстанавливаться, а заводы вернутся к работе, загрязнение может только усилиться.
Тетраэтилсвинец
Поступает в природные воды в связи с использованием в качестве антидетонатора в моторном топливе водных транспортных средств, а также с поверхностным стоком с городских территорий.
Данное вещество характеризуется высокой токсичностью, обладает кумулятивными свойствами.
Содержание тетраэтилсвинца в воде водоемов хозяйственно-питьевого, культурно-бытового и рыбохозяйственного назначения не допускается (ПДК — полное отсутствие).
studfiles.net
необходимость проведения и способы очистки
Молибден представляет собой серебристо-белый металл, который не встречается в свободном виде, тем не менее, в природе он обнаруживается довольно часто и входит в состав большого числа различных минералов, а также содержится в растениях и тканях животных.
Стоит отметить, что этот металл в определенных дозах необходим для нормального функционирования человеческого организма, суточная потребность для взрослых людей и подростков варьируется в пределах от 75 до 300 мкг и зависит от массы тела человека.
Дефицит молибдена в организме может стать причиной дезориентации человека в пространстве, пороков мозга, умственной отсталости, нарушения чувствительности. Кроме того, доказано, что недостаток молибдена может спровоцировать образование камней в почках, снизить иммунитет, спровоцировать появление отеков и даже ухудшить состав крови.
Но не только дефицит молибдена в организме имеет малоприятные последствия, не менее опасным является избыток этого металла. Избыток молибдена сопровождается такими побочными эффектами, как пигментация кожи, раздражение слизистых оболочек, нарушение работы почек и пищеварительного тракта, поражения проявляются и в структуре легочной ткани, а кроме того не исключены сбои в процессах оплодотворения. Одной из основных причин избытка молибдена в организме является употребление воды, чрезмерно обогащенной этим металлом. Поэтому очистка воды от молибдена является обязательной при водоподготовке в тех случаях, когда концентрация металла превышает норму.
На сегодняшний день практикуют несколько эффективных способов, предназначенных для решения проблемы воды с повышенной концентрацией молибдена. Одним из наиболее распространенных методов является применение так называемых ионитных фильтров. Ионитами или ионообменниками принято называть твердые нерастворимые вещества, которые имеют способность обменивать свои ионы с другими ионами из внешней среды.
Обратимую химическую реакцию, в процессе которой осуществляется обмен ионами между ионитами и раствором электролита, именуют ионным обменом. Ионный обмен применяется в целях очистки и обессоливания воды, а также он является неотъемлемой частью гидрометаллургии и используется в хроматографии. В настоящее время в целях очистки воды посредством ионообменников применяются синтетические иониты, так называемые, ионообменные смолы.
Специалисты классифицируют ионитные фильтры в зависимости от целей, которые необходимо достигнуть при пропускании жидкости через них, и, следовательно, от принципа их действия. Для очистки воды от молибдена и других небезопасных для человеческого организма веществ, а также для целей хроматографии и гидрометаллургии может быть применен один из нескольких основных видов ионитных фильтров для водоподготовки питьевой воды. Различают следующие виды фильтров, отличающиеся своими конструкционными особенностями и назначением:
- Ионитные фильтры параллельно-точные первой ступени;
- Ионитные фильтры параллельно-точные второй ступени;
- Противоточные ионитные фильтры;
- Ионитные фильтры смешанного действия.
Ионообменные смолы, применяемые с целью очистки вод от повышенной концентрации молибдена и других веществ, которые оказывают негативное влияние на состояние человеческого организма, расщепляют молекулы этих веществ на анионы и катионы. Этот способ очистки воды пользуется большой популярностью в виду его высокой эффективности и экономической выгоды, ведь стоимость этого метода снижения повышенной концентрации опасных веществ в питьевой воде доступна каждому.
Кроме того современные фильтрующие системы могут включать нитратселиктивные смолы, которые способны избирательно разрушать молекулы нитратных соединений, что тоже немаловажно в наше время. В качестве способа очистки воды от молибдена и нитратов применяют также электрохимические методы, которые основаны на распаде молекул вредных веществ в результате воздействия электрического тока. Для того, чтобы эффект от последних методов был максимальным необходимо также использовать УФ-излучение на финальном этапе очистки и фильтрации.
Прежде чем приступить к выбору метода водоочистки, важно убедиться, что в воде действительно превышена концентрация молибдена, делается это при помощи специальных анализов и лабораторных исследований.
Смотрите также:
www.bwt.ru
Загрязнение тяжелыми металлами: содержание и предельно-допустимые концентрации в воде
Тяжелые металлы - очень опасные токсические вещества. В наши дни, мониторинг уровня разных таких веществ особо важен в промышленных и городских районах.
Хотя все знают, что такое тяжелые металлы, не все знают какие химические элементы всё-таки входят в эту категорию. Есть очень много критерий, по которому, разные учёные определяют тяжелые металлы: токсичность, плотность, атомная масса, биохимические и геохимические циклы, распространение в природе. По одним критериям в число тяжелых металлов входят мышьяк (металлоид) и висмут (хрупкий металл).
Содержание:
Общие факты про тяжелые металлы
Известно более 40 элементов, которые относят к тяжелым металлам. Они имеют атомную массу больше 50 а.е. Как не странно именно эти элементы обладают большой токсичностью даже при малой кумуляции для живых организмов. V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo...Pb, Hg, U, Th...все они входят в эту категорию. Даже при их токсичности, многие из них являются важными микроэлементами, кроме кадмия, ртути, свинца и висмута для которых не нашли биологическую роль.

По другой классификации (а именно Н. Реймерса) тяжелые металлы - это элементы которые имеют плотность больше 8 г/см3. Таким образом получится меньше таких элементов: Pb, Zn, Bi, Sn, Cd, Cu, Ni, Co, Sb.
Теоретически, тяжелыми металлами можно назвать всю таблицу элементов Менделеева начиная с ванадия, но исследователи нам доказывают, что это не совсем так. Такая теория вызвана тем, что не все они присутствуют в природе в токсических пределах, да и замешательство в биологических процессах для многих минимальна. Вот почему в эту категорию многие включают только свинец, ртуть, кадмий и мышьяк. Европейская Экономическая Комиссия ООН не согласна с этим мнением и считает что тяжелые металлы это - цинк, мышьяк, селен и сурьма. Тот же Н. Реймерс считает, что удалив редкие и благородные элементы из таблицы Менделеева, остаются тяжелые металлы. Но и это тоже не правило, другие к этому классу добавляют и золото, платину, серебро, вольфрам, железо, марганец. Вот почему я вам говорю, что не всё ещё понятно по этой теме...
Обсуждая про баланс ионов различных веществ в растворе, мы обнаружим, что растворимость таких частиц связанно со многими факторами. Главные факторы солюбилизации являются рН, наличие лигандов в растворе и окислительно-восстановительный потенциал. Они причастны к процессам окисления этих элементов с одной степени окисления к другой, в которой растворимость иона в растворе выше.
В зависимости от природы ионов, в растворе могут происходить различные процессы:
Из-за этих процессов, ионы могут переходить в осадок или оставаться стабильными в растворе. От этого зависит и каталитические свойства определённого элемента, и его доступность для живых организмов.
Многие тяжелые металлы образуют с органическими веществами довольно стабильные комплексы. Эти комплексы входят в механизм миграции этих элементов в прудах. Почти все хелатные комплексы тяжелых металлов устойчивы в растворе. Также, комплексы почвенных кислот с солями разных металлов (молибден, медь, уран, алюминий, железо, титан, ванадий) имеют хорошую растворимость в нейтральной, слабощелочной и слабокислой среды. Это факт очень важен, потому что такие комплексы могут продвигаться в растворенном состоянии на большие расстояния. Самые подверженные водные ресурсы - это маломинерализованные и поверхностные водоёмы, где не происходит образование других таких комплексов. Для понимания факторов, которые регулируют уровень химического элемента в реках и озерах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю свободных и связанных форм металла.
В результате миграции тяжелых металлов в металлокомплексы в растворе могут произойти такие последствия:
- В первых, увеличивается кумуляция ионов химического элемента за счёт перехода этих из донных отложений в природные растворы;
- Во вторых, возникает возможность изменения мембранной проницаемости полученных комплексов в отличие от обычных ионов;
- Также, токсичность элемента в комплексной форме может отличаться от обычной ионной формы.
Например, кадмий, ртуть и медь в хелатные формы, имеют меньшую токсичность, чем свободные ионы. Вот почему не правильно говорить о токсичности, биологической доступности, химической реакционной способности только по общему содержанию определённого элемента, при этом, не учитывая долю свободных и связанных форм химического элемента.
Откуда же берутся тяжелые металлы в нашу среду обитания? Причины присутствия таких элементов могут быть сточные воды с разных промышленных объектов занимающийся черной и цветной металлургией, машиностроением, гальванизацией. Некоторые химические элементы входят в состав пестицидов и удобрений и таким образом могут быть источником загрязнения местных прудов.
А если войти в тайны химии, то самым главным виновником повышения уровня растворимых солей тяжелых металлов является кислотные дожди (закисление). Понижение кислотности среды (уменьшение рН) тянет за собою переход тяжелых металлов из малорастворимых соединений (гидроксиды, карбонаты, сульфаты) в более хорошо растворимые (нитраты, гидросульфаты, нитриты, гидрокарбонаты, хлориды) в почвенном растворе.
Ванадий (V)
Надо отметить в первую очередь, что загрязнение этим элементом натуральными способами маловероятна, потому что этот элемент очень рассеян в Земной коре. В природе обнаруживается в асфальтах, битумах, углях, железных рудах. Важным источником загрязнения является нефть.
Содержание ванадия в природных водоёмах
Природные водоёмы содержит ничтожное количество ванадия:
В процессах перехода ванадия в растворённом состоянии очень важны анионные комплексы (V10O26)6- и (V4O12)4-. Также очень важны растворимые ванадиевые комплексы с органическими веществами, типа гумусовых кислот.
Предельно-допустимая концентрация ванадия для водной среды
Ванадий в повышенных дозах очень вреден для человека. Предельно-допустимая концентрация для водной среды (ПДК) составляет 0,1 мг/л, а в рыбохозяйственных прудах, ПДКрыбхоз ещё ниже - 0,001 мг/л.
Висмут (Bi)
Главным образом, висмут может поступать в реки и озера в результате процессов выщелачивания минералов содержащих висмут. Есть и техногенные источники загрязнения этим элементом. Это могут быть предприятия по производству стекла, парфюмерной продукций и фармацевтические фабрики.
Содержание висмута в природных водоёмах
Предельно-допустимая концентрация висмута для водной среды
ПДК висмута для водной среды - 0,1 мг/л.
Железо (Fe)
Железо - химический элемент не редкий, оно содержится во многих минералах и пород и таким образом в природных водоёмах уровень этого элемента повыше других металлов. Оно может происходить в результате процессов выветривания горных пород, разрушения этих пород и растворением. Образуя разные комплексы с органическими веществами из раствора, железо может быть в коллоидальном, растворённом и в взвешенном состояниях. Нельзя не упомнить про антропогенные источники загрязнения железом. Сточные воды с металлургических, металлообрабатывающих, лакокрасочных и текстильных заводов зашкаливают иногда из-за избытка железа.
Количество железа в реках и озерах зависит от химического состава раствора, рН и частично от температуры. Взвешенные формы соединений железа имеют размер более 0,45 мкг. Основные вещества которые входят в состав этих частиц являются взвеси с сорбированными соединениями железа, гидрата оксида железа и других железосодержащих минералов. Более малые частицы, то есть коллоидальные формы железа, рассматриваются совместно с растворенными соединениями железа. Железо в растворённом состоянии состоит из ионов, гидроксокомплексов и комплексов. В зависимости от валентности замечено что Fe(II) мигрирует в ионной форме, а Fe(III) в отсутствии разных комплексов остаётся в растворённом состоянии.
В балансе соединений железа в водном растворе, очень важно и роль процессов окисления, так химического так и биохимического (железобактерии). Эти бактерии ответственны за переход ионов железа Fe(II) в состояние Fe(III). Соединения трехвалентного железа имеют склонность гидролизовать и выпадать в осадок Fe(OH)3. Как Fe(II), так и Fe(III) склоны к образованию гидроксокомплексов типа [Fe(OH)3]-, [Fe(OH)2]+, [Fe2(OH)3]3+, [Fe2(OH)2]4+, [Fe(OH)3]+, в зависимости от кислотности раствора. В нормальных условиях в реках и озерах, Fe(III) находятся в связи с разными растворёнными неорганическими и органическими веществами. При рН больше 8, Fe(III) переходит в Fe(OH)3. Коллоидные формы соединений железа самые малоизучены.
Содержание железа в природных водоёмах
В реках и озерах уровень железа колеблется на уровне n*0,1 мг/л, но может повыситься вблизи болот до несколько мг/л. В болотах железо концентрируется в форме солей гуматов (соли гуминовых кислот).
Подземные водохранилища с низким рН содержат рекордные количества железа - до нескольких сотен миллиграммов на литр.
Железо - важный микроэлемент и от него зависят разные важные биологические процессы. Оно влияет на интенсивность развития фитопланктона и от него зависит качество микрофлоры в водоёмах.
Уровень железа в реках и озерах имеет сезонный характер. Самые высокие концентрации в водоёмах наблюдаются зимою и летом из-за стагнации вод, а вот весною и осенью заметно снижается уровень этого элемента по причине перемешивания водных масс.
Таким образом, большое количество кислорода ведёт к окислению железа с двухвалентной формы в трехвалентной, формируясь гидроксид железа, который падает в осадок.
Предельно-допустимая концентрация железа для водной среды
Вода с большим количеством железа (больше 1-2 мг/л) характеризуется плохими вкусовыми качествами. Она имеет неприятный вяжущий вкус и непригодна для промышленных целей.
ПДК железа для водной среды - 0,3 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз - 0,1 мг/л.
Кадмий (Cd)
Загрязнение кадмием может возникнуть во время выщелачивания почв, при разложения разных микроорганизмов которые его накапливают, а также из-за миграции из медных и полиметаллических руд.
Человек тоже виноват в загрязнении этим металлом. Сточные воды с разных предприятий занимающеюся рудообогащением, гальваническим, химическим, металлургическим производством могут содержать большие количества соединений кадмия.
Естественные процессы по снижению уровня соединений кадмия являются сорбция, его потребление микроорганизмами и выпадение в осадок малорастворимого карбоната кадмия.
В растворе, кадмий находится, как правило, в форме органо-минеральных и минеральных комплексов. Сорбированные вещества на базе кадмия - важнейшие взвешенные формы этого элемента. Очень важна миграция кадмия в живых организмов (гидробиониты).
Содержание кадмия в природных водоёмах
Уровень кадмия в чистых реках и озерах колеблется на уровне меньше микрограмма на литр, в загрязнённых водах уровень этого элемента доходит до нескольких микрограммов на литр.
Некоторые исследователи считают, что кадмий, в малых количествах, может быть важным для нормального развития животных и человека. Повышенные концентрации кадмия очень опасных для живых организмов.
Предельно-допустимая концентрация кадмия для водной среды
ПДК для водной среды не превышает 1 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз - меньше 0,5 мкг/л.
Кобальт (Co)
Реки и озера могут загрязниться кобальтом как следствие выщелачивания медных и других руд, из почв во время разложения вымерших организмов (животные и растения), ну и конечно же в результате активности химических, металлургических и металлообрабатывающих предприятии.
Главные формы соединений кобальта находится в растворенном и взвешенном состояниях. Вариации между этими двумя состояниями могут происходить, из-за изменений рН, температуры и состава раствора. В растворённом состоянии, кобальт содержится в виде органических комплексов. Реки и озера имеют характерность, что кобальт представлен двухвалентным катионом. При наличии большого количества окислителей в растворе, кобальт может окисляться до трехвалентного катиона.
Он входит в состав растений и животным, потому что играет важную роль в их развитии. Входит в число основных микроэлементов. Если в почве наблюдается дефицит кобальта, то его уровень в растениях будет меньше обычного и как следствие могут появиться проблемы со здоровьем у животных (возникает риск возникновения малокровия). Этот факт наблюдается особенно в таежно-лесной нечерноземной зоне. Он входит в состав витамина В12, регулирует усвоение азотистых веществ, повышает уровень хлорофилла и аскорбиновой кислоты. Без него растения не могут наращивать необходимое количество белка. Как и все тяжелые металлы, он может быть токсичным в больших количествах.
Содержание кобальта в природных водоёмах
Предельно-допустимая концентрация кобальта для водной среды
ПДК кобальта для водной среды - 0,1 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз - 0,01 мг/л.
Марганец (Mn)
Марганец поступает в реки и озера по таким же механизмам, как и железо. Главным образом, освобождение этого элемента в растворе происходит при выщелачивании минералов и руд, которые содержат марганец (черная охра, браунит, пиролюзит, псиломелан). Также марганец может поступать вследствие разложения разных организмов. Промышленность имеет, думаю, самую большую роль в загрязнении марганцем (сточные воды с шахт, химическая промышленность, металлургия).
Снижение количества усваиваемого металла в растворе происходит, как и в случае с другими металлами при аэробных условиях. Mn(II) окисляется до Mn(IV), вследствие чего выпадает в осадок в форме MnO2. Важными факторами при таких процессах считаются температура, количество растворённого кислорода в растворе и рН. Снижение растворённого марганца в растворе может возникнуть при его употреблении водорослями.
Мигрирует марганец в основном в форме взвеси, которые, как правило, говорят о составе окружающих пород. В них он содержится как смесь с другими металлами в виде гидроксидов. Преобладание марганца в коллоидальной и растворенной форме говорят о том что он связан с органическими соединениями образуя комплексы. Стабильные комплексы замечаются с сульфатами и бикарбонатами. С хлором, марганец образует комплексы реже. В отличие от других металлов, он слабее удерживается в комплексах. Трехвалентный марганец образует подобные соединения только при присутствии агрессивных лигандов. Другие ионные формы (Mn4+, Mn7+)менее редки или вовсе не встречаются в обычных условиях в реках и озерах.
Содержание марганца в природных водоёмах
Самыми бедными в марганце считаются моря - 2 мкг/л, в реках содержание его больше - до 160 мкг/л, а вот подземные водохранилища и в этот раз являются рекордсменами - от 100 мкг до несколько мг/л.
Для марганца характерны сезонные колебания концентрации, как и у железа.
Выявлено множество факторов, которые влияют на уровень свободного марганца в растворе: связь рек и озер с подземными водохранилищами, наличие фотосинтезирующих организмов, аэробные условия, разложение биомассы (мертвые организмы и растения).
Немаловажная биохимическая роль этого элемента ведь он входит в группу микроэлементов. Многие процессы при дефиците марганца угнетаются. Он повышает интенсивность фотосинтеза, участвует в метаболизме азота, защищает клетки от негативного воздействия Fe(II) при этом окисляя его в трехвалентную форму.
Предельно-допустимая концентрация марганца для водной среды
ПДК марганца для водоёмов - 0,1 мг/л.
Медь (Cu)
Такой важной роли для живых организмов не имеет ни один микроэлемент! Медь - один из самых востребованных микроэлементов. Он входит в состав многих ферментов. Без него почти ничего не работает в живом организме: нарушается синтез протеинов, витаминов и жиров. Без него растения не могут размножаться. Всё-таки избыточное количество меди вызывает большие интоксикации во всех типов живых организмов.
Уровень меди в природных водоёмах
Содержание меди в реках, как правило, 2 - 30 мкг/л, в морях - 0,5 - 3,5 мкг/л. Высокий уровень меди в реках и озерах говорит о загрязнении.
Хотя медь имеет две ионные формы, чаще всего в растворе встречается Cu(II). Обычно, соединения Cu(I) трудно растворимые в растворе (Cu2S, CuCl, Cu2O). Могут возникнуть разные акваионны меди при наличии всяких лигандов.
При сегодняшнем высоком употреблении меди в промышленности и сельское хозяйство, этот металл может послужить причиной загрязнения окружающей среды. Химические, металлургические заводы, шахты могут быть источниками сточных вод с большим содержанием меди. Процессы эрозии трубопроводов тоже имеют свои вклад в загрязнении медью. Самыми важными минералами с большим содержанием меди считаются малахит, борнит, халькопирит, халькозин, азурит, бронтантин.
Предельно-допустимая концентрация меди для водной среды
ПДК меди для водной среды считается 0,1 мг/л, в рыбохозяйственных прудах ПДКрыбхоз меди уменьшается до 0,001 мг/л.
Молибден (Mo)
Во время выщелачивания минералов с высоким содержанием молибдена, освобождаются разные соединения молибдена. Высокий уровень молибдена может замечаться в реках и озерах, которые находятся рядом с фабриками по обогащению и предприятиями занимающиеся цветной металлургией. Из-за разных процессов осаждения труднорастворимых соединений, адсорбции на поверхности разных пород, а также употребления водными водорослями и растениями, его количество может заметно уменьшится.
В основном в растворе, молибден может находиться в форме аниона MoO42-. Есть вероятность присутствия молибденоорганических комплексов. Из-за того что при окисления молибденита формируются рыхлые мелкодисперсные соединения, повышается уровень коллоидального молибдена.
Содержание молибдена в природных водоёмах
Уровень молибдена в реках колеблется между 2,1 и 10,6 мкг/л. В морях и океанах его содержание - 10 мкг/л.
При малых концентрациях, молибден помогает нормальному развитию организма (так растительного, как и животного), ведь он входит в категорию микроэлементов. Также он является составной частью разных ферментов как ксантиноксилазы. При недостатке молибдена возникает дефицит этот фермента и таким образом могут проявляться отрицательные эффекты. Избыток этого элемента тоже не приветствуется, потому что нарушается нормальный обмен веществ.
Предельно-допустимая концентрация молибдена для водной среды
ПДК молибдена в поверхностных водоёмах должен не превышать 0,25 мг/л.
Мышьяк (As)
Загрязнены мышьяком в основном районы, которые находятся близко к минеральным рудников с высоким содержанием этого элемента (вольфрамовые, медно-кобальтовые, полиметаллические руды). Очень малое количество мышьяка может произойти при разложении живых организмов. Благодаря водным организмам, он может усваиваться этими. Интенсивное усваивание мышьяка из раствора замечается в период бурного развития планктона.
Важнейшими загрязнителями мышьяком считаются обогатительная промышленность, предприятия по производству пестицидов, красителей, а также сельское хозяйство.
Озера и реки содержат мышьяк в два состояния: во взвешенном и растворённом. Пропорции между этими формами может меняться в зависимости от рН раствора и химической композиции раствора. В растворённом состоянии, мышьяк может быть трехвалентном или пятивалентном, входя в анионные формы.
Уровень мышьяка в природных водоёмах
В реках, как правило, содержание мышьяка очень низкое (на уровне мкг/л), а в морях - в среднем 3 мкг/л. Некоторые минеральные воды могут содержать большие количества мышьяка (до несколько миллиграммов на литр).
Больше всего мышьяка могут, содержат подземные водохранилища - до несколько десяток миллиграммов на литр.
Его соединения очень токсичны для всех животных и для человека. В больших количествах, нарушаются процессы окисления и транспорт кислорода к клеткам.
Предельно-допустимая концентрация мышьяка для водной среды
ПДК мышьяка для водной среды - 50 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз - тоже 50 мкг/л.
Никель (Ni)
На содержание никеля в озерах и реках влияют местные породы. Если рядом с водоёмом находятся месторождения никелевых и железно-никелевых руд концентрации могут быть и ещё больше нормального. Никель может поступить в озера и реки при разложении растениях и животных. Сине-зеленые водоросли содержат рекордные количества никеля по сравнению с другими растительными организмами. Важные отходные воды с высоким содержанием никеля освобождаются при производстве синтетического каучука, при процессах никелирования. Также никель в больших количествах освобождается во время сжигания угля, нефти.
Высокий рН может послужить причиной осаждения никеля в форме сульфатов, цианидов, карбонатов или гидроксидов. Живые организмы могут снизить уровень подвижного никеля, употребляя его. Важны и процессы адсорбции на поверхности пород.
Вода может содержать никель в растворённой, коллоидальной и взвешенной формах (баланс между этими состояниями зависит от рН среды, температуры и состава воды). Гидроксид железа, карбонат кальция, глина хорошо сорбируют соединения содержащие никель. Растворённый никель находится в виде комплексов с фульвовой и гуминовой кислот, а также с аминокислотами и цианидами. Самой стабильной ионной формой считается Ni2+. Ni3+, как правило, формируется при большом рН.
В середине 50ых годов никель был внесён в список микроэлементов, потому что он играет важную роль в разных процессах как катализатор. В низких дозах он имеет положительный эффект на кроветворные процессы. Большие дозы всё-таки очень опасны для здоровья, ведь никель - канцерогенный химический элемент и может спровоцировать разные заболевания дыхательной системы. Свободный Ni2+ более токсичный, чем в форме комплексов (примерно в 2 раза).
Уровень никеля в природных водоёмах
В реках, содержание никеля - 0,8 - 10 мкг/л, а при загрязнении даже несколько десяток микрограммов на литр. В морях в среднем содержание этого металла - 2 мкг/л, а в подземных водохранилищах даже несколько миллиграммов на литр воды. Рядом с породами содержащие никелевые минералы, подземные водохранилища могут содержать до 20 г/л.
Предельно-допустимая концентрация никеля для водной среды
ПДК никеля для водной среды - 0,1 мг/л, а вот в рыбохозяйственных прудах ПДКрыбхоз - 0,01 мг/л.
Олово (Sn)
Природными источниками олова являются минералы, которые содержат этот элемент (станнин, касситерит). Антропогенными источниками считаются заводы и фабрики по производству разных органических красок и металлургическая отрасль работающая с добавлением олова.
Олово - малотоксичный металл, вот почему употребляя пищу из металлических консервов мы не рискуем своим здоровьем.
Содержание олова в природных водоёмах
Озера и реки содержат меньше микрограмма олова на литр воды. Подземные водохранилища могут содержать и несколько микрограммов олова на литр.
Предельно-допустимая концентрация олова для водной среды
ПДК олова для водной среды - 2 мг/л.
Ртуть (Hg)
Главным образом, повышенный уровень ртути в воде замечается в районах где есть месторождения ртути. Самые частые минералы - ливингстонит, киноварь, метациннабарит. Сточная вода с предприятий по производству разных лекарств, пестицидов, красителей может содержать важные количества ртути. Другим важным источником загрязнения ртутью считаются тепловые электростанции (которые используют как горючее уголь).
Его уровень в растворе уменьшается главным образом за счёт морских животных и растений, которые накапливают и даже концентрировать ртуть! Иногда содержание ртути в морских обитателей поднимается в несколько раз больше чем в морской среде.
Природная вода содержит ртуть в две формы: взвешенную (в виде сорбированных соединений) и растворённую (комплексные, минеральные соединения ртути). В определённых зонах океанов, ртуть может появляться в виде метилртутных комплексов.
Содержание ртути в природных водоёмах
Содержание ртути в реках в среднем - десятки доли микрограмма на литр воды, в морях - 0,03 мкг/л. Самый большой уровень ртути содержится в подземной воде - 1 - 3 мкг/л.
Ртуть и его соединения очень токсичны. При больших концентрациях, имеет отрицательное действие на нервную систему, провоцирует изменения в крови, поражает секрецию пищеварительного тракта и двигательную функцию. Очень опасны продукты переработки ртути бактериями. Они могут синтезировать органические вещества на базе ртути, которые во много раз токсичнее неорганических соединений. При употреблении рыбы, соединения ртути могут попасть в наш организм.
Предельно-допустимая концентрация ртути для водной среды
ПДК ртути в обычной воде - 0,5 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз - меньше 0,1 мкг/л.
Свинец (Pb)
Реки и озера могут загрязняться свинцом натуральным путём при смывании минералов свинца (галенит, англезит, церуссит), так и антропогенным путём (сжигание угля, применение тетраэтилсвинца в топливе, сбросы фабрик по рудообогащению, сточные воды с шахт и металлургических заводов). Осаждение соединений свинца и адсорбция этих веществ на поверхности разных пород являются важнейшими натуральными методами понижения его уровня в растворе. Из биологических факторов, к уменьшению уровня свинца в растворе ведут гидробионты.
Свинец в реках и озерах находится во взвешенной и растворённой форме (минеральные и органоминеральные комплексы). Также свинец находится в виде нерастворимых веществ: сульфаты, карбонаты, сульфиды.
Содержание свинца в природных водоёмах
Содержание свинца в реках - несколько микрограммов на литр. В реках и озерах, находящийся рядом с полиметаллическими рудниками, уровень свинца может подниматься до несколько десятков миллиграммов на литр. Термальные хлорные воды тоже могут содержать до несколько миллиграммов свинца на литр.
Про токсичность этого тяжелого металла мы наслышаны. Он - очень опасный даже при малых количествах и может стать причиной интоксикации. Проникновение свинца в организм осуществляется через дыхательную и пищеварительную систему. Его выделение из организма протекает очень медленно, и он способен накапливаться в почках, костях и печени.
Предельно-допустимая концентрация свинца для водной среды
ПДК свинца для водной среды - 0,03 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз - 0,1 мг/л.
Тетраэтилсвинец
Он служит в качестве антидетонатора в моторном топливе. Таким образом, основными источниками загрязнения этим веществом - транспортные средства.
Это соединение - очень токсичное и может накапливаться в организме.
Предельно-допустимая концентрация тетраэтилсвинца для водной средыПредельно-допустимый уровень этого вещества приближается к нулю.
Тетраэтилсвинец вообще не допускается в составе вод.
Серебро (Ag)
Серебро главным образом попадает в реки и озера из подземных водохранилищах и как следствие сброса сточных вод с предприятий (фотопредприятия, фабрики по обогащению) и рудников. Другим источником серебра могут быть альгицидные и бактерицидные средства.
В растворе, самые важные соединения являются галоидные соли серебра.
Содержание серебра в природных водоёмах
В чистых реках и озерах, содержание серебра - меньше микрограмма на литр, в морях - 0,3 мкг/л. Подземные водохранилища содержат до несколько десяток микрограммов на литр.
Серебро в ионной форме (при определённых концентрациях) имеет бактериостатический и бактерицидный эффект. Для того чтобы можно было стерилизовать воду при помощи серебра, его концентрация должна быть больше 2*10-11 моль/л. Биологическая роль серебра в организм ещё недостаточно известна.
Предельно-допустимая концентрация серебра для водной среды
Предельно-допустимая серебра для водной среды - 0,05 мг/л.
www.net-bolezniam.ru
Тяжелые металлы в водопроводной воде
Тяжелые металлы в водопроводной воде или Нужен ли нам металлолом в организме?
Свинец в водопроводной водеВо многих домах до сих пор используются свинцовые водопроводные трубы - они очень долговечные. Там, где свинцовых труб нет, обязательно есть свинцовый припой. В результате употребления этих материалов и появляется в питьевой воде свинец.
Свинец не имеет ни вкуса ни запаха, поэтому определить есть он в питьевой воде или нет, можно только проведя химический анализ. Но в принципе, можно обойтись и без него: посмотрев на свои водопроводные трубы вы сами без труда сможете определить стоит ли вам опасаться за свое здоровье. Если трубы серые на вид и их можно легко поцарапать острым предметом - это свинец, и естественная коррозия происходящая в водопроводе обязательно приводет к попаданию его в питьевую воду.Предельно допустимая концентрация свинца в водопроводной воде не должна превышать 0,01-0,03 мг/л. Вода с повышенным содержанием свинца может вызывать острые или хронические отравления у человека. Острое отравление опасно тем, что может привести к смерти. Хроническое отравление свинцом развивается при постоянном употреблении малых концентраций свинца. Свинец имеет свойство накапливаться в тканях организма, его излюбленная локализация в теле - это волосы, ногти и слизистая оболочка десен ( при этом образуется так называемая свинцовая кайма на деснах). Свинец также очень часто поражает центральную и периферическую нервную систему, кишечник, почки. Основным механизмом действия свинца блокада им работы ферментов, которые участвуют в синтезе гемоглобина. В результате этого гемоглобин утрачивают способность переносить кислород, что приводит к развитию анемии и хронической недостаточности кислорода в организме.Помимо нарушения кислородного транспорта свинец блокирует образование витамина D, который необходим, для усвоения кальция в костях. Употребление воды с высоким содержанием свинца беременными женщинами повышает риск преждевременных родов и развития врожденных уродств у плода, приводит к возникновению бесплодия. У детей, в организм которых попадает повышенное количество свинца – снижается IQ, часто развиваются пороки сердца. Превышение ПДК свинца отмечается в питьевой воде Калужской и Рязанской областей. Избавиться от свинца в питьевой воде можно только путем фильтрации или электролиза, кипячение воды в этом случае бесполезно.
Ртуть в водопроводной воде.
Предельно допустимая концентрация ртути в водопроводной питьевой воде составляет 0,0005 мг/ л. Ртуть повреждает любую ткань, с которой она контактирует, но самый большой вред она наносит нервной системе и почкам.Употребление внутрь дозы ртути, превышающей предельно допустимую, вызывает нарушение психики, потерю кожной чувствительности, слуха, зрения, речи, клинические судороги, сердечно-сосудистый коллапс. Поступление небольшого количества ртути провоцирует развитие острой почечной недостаточности, тяжелых заболеваний пищеварительного тракта. Опасны даже малые дозы: нижние границы содержания ртути в питьевой воде при которых она бы не накапливалась в организме до сих пор не установлены. При употреблении малых доз ртути беременными женщинами у новорожденных детей обнаруживают уродства развития и врожденные тяжелые заболевания головного мозга. Одним из основных источников ртути (на 85 %) в окружающей среде является деятельность промышленных предприятий. Превышение гигиенических норм ртути выявлено в Белгородской, Московской и Вологодской областях. Играет роль и естественное повышенное содержание ртути в воде некоторых регионов, например на Горном Алтае.
Молибден в питьевой водеРекомендуемое содержание молибдена в питьевой воде составляет 0,07 мг/ л.Молибден придает воде слабо вяжущий вкус. В дозах 10-15 мг/л этот элемент вызывает повышение уровня мочевой кислоты в крови человека, остеопороз костей, боли в кистях и стопах, увеличение размеров печени (гепатомегалия), функциональные расстройства пищеварительного тракта, печени и почек.
Селен в питьевой водеПредельно допустимое содержание селена в питьевой воде составляет 0,01 мг/л. При однократном поступлении в организм большой дозы селена возникают признаки острого отравления, такие как рвота, диарея, боль в животе, озноб, дрожание и онемение конечностей. Постоянное употребление повышенных концентраций селена приводит к развитию заболевания, называемого селеноз. Оно проявляется расстройствами в работе органов пищеварительного тракта, обесцвечиванием и повышенным выпадением волос, истончением и ломкостью ногтей, различными дерматитами, кариесом зубов.
Медь в водопроводной водеБезопасная суточная доза меди составляет 0,5 мг/кг массы тела. Исходя из этой дозы рассчитывается предельно допустимая концентрация меди в питьевой воде: 1-2 мг/л. Концентрация меди более 3 мг/л может вызвать острое нарушение функции желудочно-кишечного тракта, которое будет сопровождаться тошнотой, рвотой, диареей. Особенно осторожно нужно относится к питьевой воде людям, страдающим или перенесшим заболевания печени (например, вирусный гепатит). Т.к собственный обмен меди в организме у них нарушен, даже небольшие ее концентрации, содержащиеся в воде приводят к развитию цирроза печени.Наиболее чувствительны к повышенной концентрации меди в воде грудные дети, находящиеся на искусственном вскармливании. У них еще в младенческом возрасте при употреблении такой воды существует реальная, угроза развития цирроза печени.
Железо в водопроводной водеПовышенная концентрация железа возникает при использовании стальных и чугунных водопроводных труб, разрушающихся из-за коррозии. Особенно неблагополучными в данном отношении считаются Москва и Санкт-Петербург, где мягкая вода усиливает коррозию. «Железистая вода» первоначально прозрачна, но при отстаивании или нагреве приобретает желтовато-бурую окраску, что является причиной ржавых подтеков на сантехнике. На вкус такая вода приобретает характерный "железистый" привкус.Регулярное употребление питьевой воды с повышенным содержанием железа, может привести к развитию заболевания, которое носит название гемохроматоз и характеризуется отложением соединений железа в органах и тканях человека.Железо природного происхождения попадает в питьевую воду из подземных источников центральных и южных областей России, а также Сибирского региона. Железо в концентрации, троекратно превышающей норму (ПДК – 0,3 мг/л), присутствует в водопроводах Томской, Вологодской, Тамбовской, Архангельской, Челябинской, Тверской, Новосибирских области.
Марганец в водопроводной воде В ряде научных исследований установлено, что количество марганца в питьевой воде, превышающего норму (ПДК – 0,1 мг/л) негативно влияет на развитие беременности, оказывает токсический и мутагенный эффект на организм человека. Содержание марганца в питьевой воде напрямую зависит от деятельности расположенных поблизости промышленных предприятий. Марганец в концентрации, превышающей норму в три раза, содержится в водопроводной воде Томской, Вологодской, Тамбовской, Архангельской, Челябинской, Тверской, Новосибирской области.
Алюминий в водопроводной водеОсновным источником алюминия в водопроводной воде являются вещества, применяемые в процессе обработки воды на очистных станциях – коагулянты. Ежедневно в организм человека поступает от 5 до 20 мг алюминия, значительная часть которого приходится на питьевую воду. Было установлено, что в повышенных дозах алюминий обладает нейротоксическим эффектом, вызывающим старческое слабоумие. Кроме того, алюминий вымывает из организма кальций, что особенно опасно для растущего организма. Превышение ПДК алюминия зафиксировано в питьевой воде Архангельской, Самарской и Омской областей.При подготовке статьи использованы материалы информационного пособия «Питьевая вода и здоровье населения» (выпуск 1: «Влияние химического состава питьевой воды на здоровье человека»). М., 2002, под общей редакцией профессора Е.Н. Беляева. Как удалить тяжелые металлы из водопроводной воды?Тяжелые металлы из водопроводной воды можно удалить, используя любой из аппаратов, производимых фирмой „ESPERON“, так как они выполняют две основные функции: фильтра и ионизатора.В качестве фильтров они очищают воду от:
- Хлора
- Тяжелых металлов
- Солей жесткости
- Лекарственных средств и гормоновВ качестве ионизаторов они:
- разделяют нейтральные молекулы воды на положительно и отрицательно заряженные ионы (аппараты, действующие на основе электролиза) или же насыщают воду отрицательными ионами (аппараты на основе керамики полудрагоценных камней )
Бесплатный векторный CSS-код beautifier заботится о вашем грязном коде и удаляет все нежелательные беспорядки. Чтобы начать работу, перейдите в Очиститель CSS.
dina-aschbach.com
ГОСТ 18308-72 Вода питьевая. Метод определения содержания молибдена, ГОСТ от 28 декабря 1972 года №18308-72
ГОСТ 18308-72
Группа Н09
ВОДА ПИТЬЕВАЯ
Метод определения содержания молибдена Drinking water. Method for determination of molybdenum content
Дата введения 1974-01-01
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 28.12.72 N 2356
2. ВВЕДЕН ВПЕРВЫЕ
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
4. Ограничение срока действия снято Постановлением Госстандарта СССР от 25.12.91 N 2121
5. ПЕРЕИЗДАНИЕНастоящий стандарт распространяется на питьевую воду и устанавливает колориметрический роданидный метод определения содержания молибдена.Метод основан на образовании окрашенного в оранжево-красный цвет комплексного соединения пятивалентного молибдена с роданидом. Восстановление 



1. МЕТОДЫ ОТБОРА ПРОБ
1.1. Пробы воды отбирают по ГОСТ 2874* и ГОСТ 24481**.________________* На территории Российской Федерации действует ГОСТ Р 51232-98. ** На территории Российской Федерации действует ГОСТ Р 51593-2000.
1.2. Объем пробы воды для определения содержания молибдена должен быть не менее 200 см
1.3. Срок между отбором пробы и выполнением анализа должен быть возможно коротким, так как отобранные пробы воды, предназначенные для определения молибдена, не консервируют.
2. АППАРАТУРА, МАТЕРИАЛЫ, РЕАКТИВЫ
Фотоэлектроколориметр, кюветы с толщиной рабочего слоя 10 мм.Посуда мерная лабораторная стеклянная по ГОСТ 1770, ГОСТ 29169 и ГОСТ 29251 вместимостью: колбы мерные 100 и 1000 см




3. ПОДГОТОВКА К АНАЛИЗУ
3.1. Приготовление основного стандартного раствора молибденовокислого аммония0,184 г 



3.2. Приготовление рабочего стандартного раствора молибденовокислого аммония
10 см



3.3. Приготовление 0,1 н. раствора марганцовокислого калия Раствор готовится из фиксанала.
3.4. Приготовление 33%-ного раствора виннокислого калия-натрия (сегнетовой соли)
50 г 

3.5. Приготовление 25%-ного раствора роданистого калия
25 г 

3.6. Приготовление 20%-ного раствора двухлористого олова
20 г 



4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1. Для повышения чувствительности метода и устранения мешающего влияния большинства элементов окрашенный молибденово-роданидный комплекс экстрагируют в малый объем органического растворителя. Определение состоит из двух операций: первая - удаление органических веществ, при этом происходит насыщение исследуемой воды изоамиловым спиртом; вторая - экстракция органическим растворителем роданидного комплекса молибдена.Для выполнения первой операции 100 см







4.2. Для приготовления стандартной шкалы в мерные колбы вместимостью 100 см




4.3. Интенсивность полученной окраски измеряют фотометрически. В этом случае для экстрагирования окрашенного молибденово-роданидного комплекса применяют 5 см

4.4. Для приготовления стандартной шкалы в мерные колбы вместимостью 100 см



5. ОБРАБОТКА РЕЗУЛЬТАТОВ
5.1. Содержание молибдена (

где 


официальное издание
Контроль качества воды: Сб. ГОСТов. - М.: ФГУП"СТАНДАРТИНФОРМ", 2010
docs.cntd.ru
ГОСТ 18308-72 Вода питьевая. Метод определения содержания молибдена
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
ВОДА ПИТЬЕВАЯ Метод определения содержания молибдена Drinking water. Method for determination of molybdenum content |
ГОСТ 18308-72 |
Дата введения 01.01.74
Настоящий стандарт распространяется на питьевую воду и устанавливает колориметрический роданидный метод определения содержания молибдена.
Метод основан на образовании окрашенного в оранжево-красный цвет комплексного соединения пятивалентного молибдена с роданидом. Восстановление Мо6+ до Мо5+ производится двухлористым оловом. Чувствительность метода составляет (объем исследуемой воды 100 см3) 2,5 мкг/дм3.
1.1. Пробы воды отбирают по ГОСТ 2874* и ГОСТ 24481**.
_______
* На территории Российской Федерации действует ГОСТ Р 51232-98.
** На территории Российской Федерации действует ГОСТ Р 51593-2000.
1.2. Объем пробы воды для определения содержания молибдена должен быть не менее 200 см3.
1.3. Срок между отбором пробы и выполнением анализа должен быть возможно коротким, так как отобранные пробы воды, предназначенные для определения молибдена, не консервируют.
Фотоэлектроколориметр, кюветы с толщиной рабочего слоя 10 мм.
Посуда мерная лабораторная стеклянная по ГОСТ 1770, ГОСТ 29169 и ГОСТ 29251, вместимостью: колбы мерные 100 и 1000 см3, пипетки 10, 50 и 100 см3 без делений; цилиндры мерные 10 и 100 см3; пробирки колориметрические с притертыми пробками; бюретки с краном вместимостью 25 см3.
Делительные воронки вместимостью 250 см3 по ГОСТ 25336.
Аммоний молибденовокислый по ГОСТ 3765.
Спирт изоамиловый по ГОСТ 5830.
Калий марганцовокислый по ГОСТ 20490.
Кислота серная по ГОСТ 4204.
Кислота соляная по ГОСТ 3118.
Калий роданистый по ГОСТ 4139.
Калий-натрий виннокислый (сегнетовая соль) по ГОСТ 5845.
Олово двухлористое по ТУ 6-09-5384.
Олово металлическое по ГОСТ 860.
Углерод четыреххлористый по ГОСТ 20288.
Вода дистиллированная по ГОСТ 6709.
Все реактивы должны быть квалификации ч.д.а.
3.1. Приготовление основного стандартного раствора молибденовокислого аммония
0,184 г (Nh5)6Mo7O24× 4Н2О растворяют в небольшом объеме горячей дистиллированной воды, переносят в мерную колбу вместимостью 1000 см3, охлаждают и доводят объем раствора до метки дистиллированной водой. 1 см3 раствора содержит 100 мкг Мо6+.
3.2. Приготовление рабочего стандартного раствора молибденовокислого аммония
10 см3 основного стандартного раствора разбавляют дистиллированной водой до 1 дм3. 1 см3 раствора содержит 1 мкг Мо6+.
Необходимо применять свежеприготовленный раствор.
3.3. Приготовление 0,1 н раствора марганцовокислого калия
Раствор готовится из фиксанала.
3.4. Приготовление 33 %-ного раствора виннокислого калия-натрия (сегнетовой соли)
50 г KNaC4h5O × 4h3O растворяют в 100 см3 дистиллированной воды.
3.5. Приготовление 25 %-ного раствора роданистого калия
25 г KCNS растворяют в 75 см3 дистиллированной воды.
3.6. Приготовление 20 %-ного раствора двухлористого олова
20 г SnCl2× 2Н2О растворяют при нагревании в 20 см3 соляной кислоты (плотностью 1,19 г/см3) и разбавляют дистиллированной водой до 100 см3.
Для стабилизации восстановительного действия в раствор добавляют несколько кусочков металлического олова.
4.1. Для повышения чувствительности метода и устранения мешающего влияния большинства элементов окрашенный молибденово-роданидный комплекс экстрагируют в малый объем органического растворителя. Определение состоит из двух операций: первая - удаление органических веществ, при этом происходит насыщение исследуемой воды изоамиловым спиртом; вторая - экстракция органическим растворителем роданидного комплекса молибдена.
Для выполнения первой операции 100 см3 исследуемой воды помещают в делительную воронку вместимостью 250 см3. Затем добавляют 8 - 10 см3 серной кислоты (1:1), по каплям 0,1 н. раствор марганцовокислого калия до устойчивой розовой окраски (не исчезающей в течение 5 мин) и 2 см3 смеси изоамилового спирта с четыреххлористым углеродом (1:1). Раствор в воронке взбалтывают в течение 30 с и оставляют в покое до разделения слоев. Если слой органического растворителя, отделенный после экстракции в пробирку, бесцветен, приступают ко второй операции. При наличии окрашенного слоя экстракцию органического вещества повторяют до получения бесцветного слоя.
Затем приступают к выполнению второй операции. Для этого после удаления органического вещества к раствору в делительной воронке добавляют 2 см3 33 %-ного раствора сегнетовой соли, 4 см3 25 %-ного раствора роданистого калия и 2 см3 20 %-ного раствора двухлористого олова. После прибавления каждого реактива производят перемешивание. Затем добавляют из бюретки точно 1 см3 смеси изоамилового спирта с четыреххлористым углеродом (1:1). Раствор встряхивают в воронке в течение 30 с и оставляют до разделения слоев. Органический слой с небольшим количеством водного слоя сливают в колориметрическую пробирку и сравнивают со шкалой стандартных растворов.
4.2. Для приготовления стандартной шкалы в мерные колбы вместимостью 100 см3 отбирают 0,0; 0,25; 0,5; 1,0; 2,0; 4,0; 6,0; 8,0 см3 рабочего стандартного раствора молибдена, доводят объем дистиллированной водой до 100 см3 и обрабатывают так же, как исследуемую воду. Шкала устойчива в течение одних суток при условии хранения в темном месте при температуре не выше 20 °С.
Если окраска слоя органического растворителя окажется ярче окраски исследуемого образца, соответствующего 6 мкг Мо6+, то определение повторяют из меньшего объема исследуемой воды, доводят объем его до 100 см3 дистиллированной водой.
4.3. Интенсивность полученной окраски измеряют фотометрически. В этом случае для экстрагирования окрашенного молибденово-роданидного комплекса применяют 5 см3 растворителя (смесь изоамилового спирта с четыреххлористым углеродом (1:1)). Оптическую плотность измеряют с голубым светофильтром (l = 470 - 480 нм), используя кювету толщиной рабочего слоя 10 мм.
4.4. Для приготовления стандартной шкалы в мерные колбы вместимостью 100 см3 отбирают 0,0; 1,0; 2,0; 4,0; 8,0; 16,0 см3 рабочего стандартного раствора Мо6+, доводят объем до 100 см3 дистиллированной водой и обрабатывают так же, как исследуемую воду.
При составлении калибровочного графика из значений оптических плотностей исследуемой воды вычитают оптическую плотность контрольной пробы и полученные разности наносят на график против соответствующих концентраций молибдена. Затем из измеренной оптической плотности исследуемой воды вычитают оптическую плотность контрольной пробы.
5.1. Содержание молибдена (X), мг/дм3, определяют по формуле

где С - содержание молибдена, найденное по стандартной шкале или по калибровочному графику, мкг;
V - объем исследуемой воды, взятый для определения, см3.
Допустимое расхождение между повторными определениями 25 отн. %.
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 28.12.72 № 2356
2. ВВЕДЕН ВПЕРВЫЕ
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
4. Ограничение срока действия снято Постановлением Госстандарта СССР от 25.12.91 № 2121
5. ПЕРЕИЗДАНИЕ
СОДЕРЖАНИЕ
files.stroyinf.ru
Молибден определение в воде
Определению марганца мешает медь, определению титана— молибден, определению молибдена — титан и вольфрам. Возможность определения Сг6+ достигается отделением его от сопутствующих компонентов путем растворения в воде при подготовке проб к анализу.[ ...]
В природных водах молибден, как правило, содержится в очень низких концентрациях (порядка л-10-7 — п-10 3г/л), и прямое количественное определение его сравнительно несложными методами затруднено. Поэтому требуется предварительное концентрирование. В описываемом методе концентрирование молибдена производится соосаждением его с гидратом двуокиси марганца с последующим колориметрированием молибденроданидного комплекса [1].[ ...]
Молибден нередко встречается в сточных водах предприятий цветной металлургии, обычно в виде ионов МоО?’. Предельно Допустимая концентрация его в воде водоемов довольно высока — 0,5 мг/л, поэтому для его определения не требуются особо чувствительные методы. Рекомендуется роданидный метод в двух вариантах (в зависимости от концентрации молибдена в воде) с -использованием тиокарбамида для восстановления молибдена.[ ...]
При определении пригодности подземного водоисточника для хозяйственно-питьевых целей ГОСТ 2761-84 подчеркивает необходимость аналитического изучения содержания в воде химических элементов и показателей природного состава (бериллий, бор, железо, марганец, медь, молибден, мышьяк, нитраты, общая жесткость, окисляемость, свинец, селен, сероводород, стронций, сульфаты, сухой остаток, углекислота свободная, фтор, хлориды, цинк), а также наличия промышленных, сельскохозяйственных и бытовых загрязнений. Перечень этих показателей устанавливается по согласованию с санитарно-эпидемиологической службой в зависимости от гидрогеологических и санитарно-эпидемиологических условий.[ ...]
В(Ге вредные вещества, имеющиеся в составе сточных вод и природной воде, относятся к определенным группам ЛПВ. К группе санитарно-токсикологического ЛПВ относят бензол, мышьяк, молибден, ванадий, а к группе общесанитарного ЛПВ — кобальт.[ ...]
Характерно, что в воде рассматриваемых озер (см. рис. 6), когда концентрация фосфора достигает нулевой точки (пересечение линии корреляции с ординатой), нитраты еще присутствуют в значительных количествах. Поэтому подтверждается предположение, что, за исключением местных кратковременных отклонений, именно в таких водоемах фосфор быстрее, чем азот, ограничивает синтез биомассы [5]. Использование всего водоема как «целостной системы» для определения потенциального роста водорослей дает некоторые преимущества перед экспериментами, выполненными в емкостях. Водоемы постоянно пополняются питательными веществами (перенос этих веществ из более глубоких вод и отложений и т. д.). Например, некоторые микроэлементы (марганец, молибден и т. д.), ограничивающие продуктивность в емкостях, редко обнаруживают аналогичные эффекты в природных водоемах. Недостаток микроэлементов в водоеме обычно встречается только как временное явление. Неорганические и органические «факторы роста», особенно гормоны, больше влияют на состав водорослей, чем на биомассу. Необходимо различать количественную и качественную роли таких факторов роста. Отмечено, что еще [3] нет экспериментальных данных, доказывающих, что эти вещества могут определять процессы эвтрофи-кации.[ ...]
Мешающие влияния. Определению мешают присутствующие в высоких концентрациях (свыше 200 мг1л) Hg2+- и Hg -ионы; с дифенилкарбазидом вступают в реакцию и окрашивают раствор также ванадий и молибден (VI), но они обычно отсутствуют в воде.[ ...]
Мешающие вещества. Определению мешают нитраты в концентрациях, превышающих 20 мг/л, и соли жесткости в количествах, превышающих 2 мэкв/л. Мешающее влияние последних состоит в том, что, будучи малорастворимыми в спирте, они выпадают в осадок. Этот осадок надо отфильтровать перед определением оптической плотности. Определению мешают титан, цирконий, молибден, вольфрам, бериллий и германий, редко встречающиеся в водах. Их можно предварительно отделить с помощью ионитов.[ ...]
ИСО 11885 устанавливает метод определения растворенных и нера-створенных элементов, а также их общего количества в питьевой воде и в природных и сточных водах атомно-эмиссионной спектроскопией. Данным методом можно определять алюминий, барий, бериллий, бор, ванадий, висмут, вольфрам, железо, кадмий, калий, кальций, кобальт, кремний, литий, магний, марганец, медь, молибден, мышьяк, натрий, никель, олово, свинец, селен, серебро, серу, стронций, сурьму, титан, фосфор, хром, цинк, цирконий.[ ...]
Токсичные соединения. К числу токсичных веществ, присутствие которых в питьевой воде строго лимитируется, отнесены бериллий, молибден, мышьяк, свинец, селен, стронций, нитраты. Определение их в воде, как правило, производится в случаях, когда предполагается наличие этих веществ в воде водоисточника. Кроме того, установлен ПДК алюминия и полиакриламида, добавляемых к воде в процессе обработки.[ ...]
Эйстер (1964) перечисляет следующие 10 микроэлементов, заведомо необходимых для растений: железо, марганец, медь, цинк, бор, кремний, молибден, хлор, ванадий и кобальт. С физиологической точки зрения их можно разделить на три группы: 1) необходимые для фотосинтеза — Мп, Ре, С1, 2п, V; 2) необходимые для азотистого обмена — Мо, В, Со, Ре; 3) необходимые для других метаболических функций — Мп, В, Со, Си и 81. Большинство из них требуется также животным; некоторые другие элементы нужны лишь определенным животным, например иод необходим позвоночным. Само собой разумеется, что между макро- и микроэлементами нельзя провести резкую границу; мало того, в потребностях разных групп организмов имеются весьма существенные различия. Например, натрия и хлора позвоночным требуется значительно больше, чем растениям; натрий часто вносят в список микроэлементов для растений. Многие из микроэлементов сходны с витаминами; подобно витаминам, они действуют как катализаторы. Следовые металлы часто входят в состав органических соединений; так, кобальт — необходимая составная часть витамина В]2- Голдмен (1965) описал экосистему, в которой лимитирующим фактором служит молибден. Добавка молибдена в количестве 100 ч. на 1 млрд. к воде горного озера приводила к увеличению численности фитопланктона. Как и в случае макроэлементов, излишек микроэлементов тоже может оказать лимитирующее действие.[ ...]
Следует отметить, что разные макрокомпоненты при концентрациях от 1 до 10 г/л неодинаково увеличивают интенсивность линий микропримесей. Это видно из рис. 4, где приведены данные о влиянии кальция, магния, натрия, калия и их суммы на интенсивность линий меди, кобальта, свинца, ванадия, молибдена, хрома. По оси ординат отложена относительная величина почернения п - А5ша1М5т1сг0‘, показывающая степень увеличения интенсивности линий примесей при сравнении сильно минерализованных (дающих максимальную интенсивность по каждому микрокомпоненту) и разбавленных растворов. Из рис. 4 также видно, что при увеличении концентрации отдельных макрокомпонентов и их суммы от 0 до 3—7 г!л интенсивность линий микропримесей увеличивается от 2 до 80 раз. Исследования показали, что наибольшее влияние на увеличение чувствительности микропримесей оказывает сумма макрокомпонентов в пределах от 1 до 5 г/д, особенно на хром, свинец, ванадий, молибден и олово. Таким образом, следует проводить обогащение природных вод частичным упариванием в 6—30 раз в зависимости от минерализации вод (300— 1500 мг/л), а не упаривание вод до сухого остатка [1, 2]. В этом случае достигается область содержания суммы макрокомпонентов от 1 до 5 г/л, отвечающая оптимальным условиям определения микропримесей.[ ...]
ru-ecology.info












