Связь между жесткостью воды и здоровьем рыб. Жесткость воды норма
Химические показатели воды – жесткость
Жесткость воды определяется содержанием в воде солей жесткости (кальция и магния). Она выражается в миллиграмм-эквивалентах на литр (мг-экв/л). Различают карбонатную (временную) жесткость, некарбонатную (постоянную) жесткость и общую жесткость воды.
Карбонатная жесткость (устранимая), определяется наличием в воле двууглекислых солей кальция и магния - характеризуется содержанием в воде гидрокарбоната кальция, который при нагревании или кипячении воды разлагается на практически нерастворимый карбонат и углекислый газ. Поэтому её еще называют временной жесткостью.
Некарбонатная или постоянная жесткость - содержание некарбонатных солей кальция и магния - сульфаты, хлориды, нитраты. При нагревании или кипячении воды они остаются в растворе.
Общая жесткость - определяется как суммарное содержание в воде солей кальция и магния, выражается как сумма карбонатной и некарбонатной жесткости. При оценке жесткости воды обычно воду характеризуют следующим образом:
Очень мягкая вода - до 1,5 мг-экв/л
Мягкая вода - от 1,5 до 4,0 мг-экв/л
Вода средней жесткости - от 4,0 до 8,0 мг-экв/л
Жесткая вода - от 8,0 до 12,0 мг-экв/л
Очень жесткая вода - более 12 мг-экв/л
Вода поверхностных источников, как правило, относительно мягкая (3...6 мг-экв/л) и зависит от географического положения - чем южнее, тем жесткость воды выше. Жесткость подземных вод зависит от глубины и расположения горизонта водоносного слоя и годового объема осадков.
Жесткость воды из слоёв известняка составляет обычно 6 мг-экв/л и выше.
По нормам СанПиН 2.1.4.1074-01 жесткость питьевой воды должна быть не выше 7,0 мг-экв/л.
Жесткая вода просто неприятна на вкус, в ней излишне много кальция. Постоянное употребление внутрь воды с повышенной жесткостью приводит к снижению моторики желудка, к накоплению солей в организме, и, в конечном итоге, к заболеванию суставов (артриты, полиартриты) и образованию камней в почках и желчных путях. Хотя очень мягкая вода не менее опасная, чем излишне жесткая. Самая активная - это мягкая вода. Мягкая вода способна вымывать из костей кальций. У человека может развиться рахит, если пить такую воду с детства, у взрослого человека становятся ломкие кости. Есть еще одно отрицательное свойство мягкой воды. Она, проходя через пищеварительный тракт, не только вымывает минеральные вещества, но и полезные органические вещества, в том числе и полезные бактерии. Вода должна быть жесткостью 1,5-2 мг-экв/л. Использование воды с большой жесткостью для хозяйственных целей также нежелательно. Жесткая вода образует налет на сантехнических приборах и арматуре, образует накипные отложения в водонагревательных системах и приборах. В первом приближении это заметно на стенках, например, чайника.
При хозяйственно-бытовом использовании жесткой воды значительно увеличивается расход моющих средств и мыла вследствие образования осадка кальциевых и магниевых солей жирных кислот, замедляется процесс приготовления пищи (мяса, овощей и др.), что нежелательно в пищевой промышленности. Во многих случаях использование жесткой воды для производственных целей (для питания паровых котлов, в текстильной бумажной промышленности, на предприятиях искусственного волокна и др.) не допускается, так как это связано с рядом нежелательных последствий.
В системах водоснабжения - жесткая вода приводит к быстрому износу водонагревательной технике (бойлеров, батарей центрального водоснабжения и др.). Соли жесткости (гидрокарбонаты Ca и Mg), отлагаясь на внутренних стенках труб, и образуя накипные отложения в водонагревательных и охлаждающих системах, приводят к занижению проходного сечения, уменьшают теплоотдачу. Не допускается использовать воду с высокой карбонатной жесткостью в системах оборотного водоснабжения.
Возврат к спискуwww.sibecolog.ru
Жесткость воды в аквариуме
 Поделитесь статьей:
Поделитесь статьей: Очень часто, решив заняться аквариумистикой, любители тщательно выбирают емкость для домашнего водоема, продумывают, где ее разместить, какими рыбками и растениями наполнить. Однако напрочь забывают об основном и самом важном компоненте всей этой системы – воде. Как правило, аквариумы наполняются наиболее легкодоступной водой, чаще всего водопроводной. О ее параметрах мало кто задумывается. А если и задумывается, то лишь о том, подойдет ли она рыбкам. Однако растения не менее требовательны к воде, хотя и медленнее реагируют на ее качество.
В данной статье мы затронем один из важных параметров – жесткость. Ведь от нее не в последнюю очередь зависит, станет аквариум таким, как он задуман, или нет.
Что такое жесткость воды в аквариуме?
 Ее считают вторым по важности параметром воды после кислотности. От нее зависит возможность содержания и разведения рыб и растений. Она оказывает влияние на остальные свойства воды.
Ее считают вторым по важности параметром воды после кислотности. От нее зависит возможность содержания и разведения рыб и растений. Она оказывает влияние на остальные свойства воды.
Определяется этот параметр наличием некоторых минералов, которые растворены в воде. Общая жесткость складывается из двух частей:
Постоянной (GH). Она первостепенна, так как определяет мягкость или жесткость воды и степень ее пригодности для обитателей аквариума. GH определяет концентрация ионов Ca++ и Mg++ в воде. Кипячение приводит к разрушению гидрокарбонатов и выпадению в осадок кальция и магния.
Жесткость, которая сохраняется после кипячения, и называется постоянной. Ее измеряют в градусах жесткости. И все тесты выпускаются именно в них.
Переменная или карбонатная (KH). Ее определяет концентрация карбонатов CO3- и бикарбонатов HCO3- в воде.
Жесткость воды в аквариуме норма
 Значение жесткости воды в жизни обитателей домашнего водоема велико:
Значение жесткости воды в жизни обитателей домашнего водоема велико:
- соли магния и кальция участвуют в построении скелета и костной системы рыб;
- у моллюсков и ракообразных они обеспечивают твёрдость раковины или панциря;
- жесткость способствует нормальной жизнедеятельности и развитию половых органов;
- она влияет на успешность роста и развития растений и т. д.
Жесткость может быть разной степени интенсивности: 0-4 – очень мягкая, 5-8 – мягкая, 9-16 – средней жесткости, 17-32 – жесткая, 33 и более – очень жесткая. Водопроводная вода, как правило, имеет жесткость не более 20.
Жесткость воды в аквариуме должна быть в определенных пределах, обычно этот диапазон составляет 3-15 градусов.
Лучше, если для каждого конкретного вида показатели будут приближенными к природным условиям родных водоемов.
Например,
- улиткам требуется жесткая вода, так как в мягкой воде у них разрушаются раковины;
- живородящие рыбы будут себя хорошо чувствовать при 10,
- неоновые при 6,
- сагиттария и папоротник при 10-14 градусах и т. д. Эту информацию можно узнать из рекомендаций по уходу за тем или иным видом.
Также нужно учитывать, что жители аквариума усваивают кальций, поэтому его количество в воде будет постепенно снижаться. Поддерживать жесткость на одном и том же уровне легче, если грунтом является галька или крупный песок. И, разумеется, потребуются регулярные измерения.
Как определить жесткость воды в аквариуме?
 Основные способы такие:
Основные способы такие:
Химический реагент Трилон «Б»
Это очень точный метод, но его недостаток в чрезмерной сложности для людей, не очень интересующихся химией, да и дополнительным химическим оборудованием дома не каждый захочет обзаводиться.
TDS-метр
Он же кондуктометр, он же солемер. Метод очень простой. Однако этот электронный прибор измеряет не саму жесткость, а электропроводность воды, по которой лишь косвенно можно судить о жесткости.
Тест-полоски
Они были специально разработаны для измерения жесткости воды в аквариумах. Просты и удобны в использовании. Есть вариант, где в указанный объем воды добавляют реактив и по изменившейся окраске судят о жесткости. Все расчеты производятся по инструкции, входящей в комплект. Недостаток у этого способа один – такие наборы сложновато купить, так как они нечасто бывают в продаже.
Хозяйственное мыло
Это самый доступный, дешевый и точный в домашних условиях метод. В его основе лежит свойство мыла: оно трудно растворяется в жесткой воде и дает пену при избытке солей кальция и магния.
Как проводятся исследования:

1. Хозяйственное мыло (1 грамм) измельчить и осторожно всыпать в малое количество подогретой дистиллированной воды (продается в автомагазинах).
2. Полученный раствор вылить в стакан и добавить дистиллят так, чтобы высота его достигла 6 см для 60-процентного и 7 см для 72-процентного мыла. В каждом сантиметре такого раствора содержится столько мыла, сколько требуется, чтобы связать соли, количество которых равно 1°dH в 1 л воды.
3. Банку емкостью 1 л наполовину заполнить водой из аквариума.
4. По чуть-чуть вливать в нее подготовленный раствор, постоянно помешивая. Сначала появятся хлопья на поверхности, а затем устойчивая мыльная пена, которая свидетельствует о том, что все соли в воде связаны.
Оценка результата. Сосчитать, сколько сантиметров раствора было вылито в воду. 1 см связал в 0, 5 л воды 2°dH солей. То есть, если вылито 4 см, то жесткость 8 градусов и т. д. Если вылит весь раствор, но пены нет, то жесткость выше 12 градусов. Тогда воду для исследования разбавить дистиллятом в два раза, анализ повторить, умножая полученные результаты на два.
Результаты могут иметь погрешность в 1-2 градуса, но это не критично и не приведет к болезням или гибели обитателей аквариума.
Если жесткость воды, имеющейся в распоряжении аквариумиста, не соответствует той, которая нужна ему для содержания аквариумных обитателей, то ее можно изменить. Но делать это нужно плавно, чтобы не вызвать у питомцев стресс или иные проблемы.
Как повысить жесткость воды в аквариуме?

1. Смешать аквариумную воду с более жесткой.
2. Кипятить воду примерно час. Лучше взять эмалированную посуду. Далее остудить ее и осторожно слить две верхние части объема. Нижнюю треть, богатую солями кальция, порциями влить в аквариум, контролируя жесткость измерениями.
3. Поместить в аквариум кусочки ракушек, мрамора или известняковых пород для повышения общей жесткости на 2-4 градуса. Недостатком способа является невозможность контролировать уровень жесткости. Более предпочтительно фильтровать воду в аквариуме через слой раскрошенного мрамора, уменьшая или увеличивая количество воды, проходящей через фильтр.
4. Добавить пищевую соду в количестве 1 ч. л. на 50 л воды для увеличения переменной жесткости (KH) на 4 градуса.
5. Добавить карбонат кальция из расчета 2 ч. л. на 50 л воды для повышения постоянной (GH) и переменной (KH) жесткости на 4 градуса.
6. Добавить в воду десятипроцентный раствор хлористого Ca (можно приобрести в аптеке) и сульфата магния (приготовить самостоятельно: 50 г горькой соли растворить, получив 750 мл раствора) в одинаковых пропорциях (на 1 литр по 1 мл каждого). Жесткость увеличится примерно на 4 градуса.
7. Влить магнезию в 25% растворе (1 мл на 1 литр воды). Это поднимет жесткость на 4 градуса.
Как понизить жесткость воды в аквариуме?
Это сделать гораздо сложнее. Способы следующие:
1. Добавить дистиллированную, талую или чистую дождевую воду.
2. Прокипятить воду, остудить ее, не перемешивая, и слить с поверхности 2\3. Эту верхнюю воду добавить в аквариум.
3. Произвести вымораживание. Воду налить в низкую посуду, например, в таз. Поставить в холод. После замерзания половины лед пробить, незамерзшую воду вылить, лед растопить. Полученную воду добавить в аквариум.
4. Прогнать воду через специальные фильтры (осмотический и деионизация).
5. Отфильтровать воду через торф, добавленный во внешний или внутренний фильтр или помещенный в мешочке в емкость с отстаиваемой водой. Предварительно торф для грунта требуется прокипятить. В некоторых нерестовиках торф используют в качестве грунта.
Желтый оттенок воды, который он дает, можно убрать при помощи фильтрации через активированный уголь.
6. Можно добавить отвар ольховых шишек. Но жесткость от нее снижается незначительно и может измениться состав воды, что не во всех случаях хорошо.
7. Использовать Трилон-Б и ЭДТА согласно инструкции.
8. Посадить элодею, эгропилу и роголистник.
Теперь вы знаете, что такое жёсткость воды в аквариуме, как она важна для его обитателей, имеете представление, как ее измерять и изменять. Мы надеемся, что эта информация поможет вам в создании аквариума вашей мечты. Удачи!
aquariumguide.ru
Жесткость воды и здоровье рыб
Жесткость воды является одним из важнейших показателей качества воды, так как она серьёзно влияет на здоровье рыб. Несмотря на это, ей не уделяется должное внимание, и чаще всего, аквариумисты никогда не проводят диагностику данного параметра. Жесткость воды оказывает выраженное воздействие на рН среды, который, в свою очередь, влияет на токсичность многих веществ. В частности, даже у ухоженном аквариуме при низкой жесткости может наблюдаться повышенное содержание нитратов. Кроме того, сопутствующие колебания кислотности серьёзно сказываются на осморегуляции и осмотическом давлении рыбок.Что такое жесткость воды ?В воде, которая течет из наших кранов, растворено большое количество разных веществ. Жесткость характеризуется концентрацией в воде двухвалентных ионов металлов, таких как кальций, магний, железо, цинк и т.д. В основном, они накапливаются, когда дождевая вода просачивается через камни. Большую часть жесткости в воде составляют кальциевые и магниевые соли, с незначительной примесью других металлов.
Два вида жесткостиНекоторую путаницу в этот вопрос вносит наличие двух типов жесткости, что следует принять во внимание. К ним относится постоянная жесткость и уровень щелочей, который часто упоминается как уровень карбонатов или временная жесткость. В совокупности они называются общей или суммарной жесткостью.
Под уровнем щелочей подразумевается жесткость, появляющаяся вследствие накопления ионов карбонатов и бикарбонатов. Данный показатель непосредственно влияет на растворимую емкость воды. Он также называется уровнем карбонатов или временной жесткостью, потому что нейтрализуется обычным кипячением воды. Результатом высокой временной жесткости является, в частности, накипь в чайниках.
Постоянная жесткость характеризуется концентрацией таких ионов как нитраты, сульфаты, хлориды и т.д., которые не удаляются из воды простой процедурой кипячения. В основном они не влияют на буферизацию воды, но могут влиять на уровень рН.
В следствие того, что величина постоянной жесткости достаточно мала, уровень общей жесткости воды ненамного выше величины временной жесткости (выражается как количество СаСО3 на литр воды).
Хотя существует тесная связь между буферной емкостью и жесткостью воды, следует помнить, что первая связана с концентрацией карбонатов и бикарбонатов, в то время как последняя, в основном, определяется наличием ионов кальция и магния. В свою очередь, взаимосвязь двух данных показателей вызвана тем, что жесткость в основном является производной кальциевых и магниевых карбонатов.
Из вышесказанного можно сделать вывод: жесткая вода имеет большую буферную ёмкость по сравнению с мягкой. Тем не менее, иногда даже жесткая вода обладает низкой буферизацией, например, при очень высокой постоянной жесткости. Случается и обратная ситуация, когда мягкая вода, имеющая высокий уровень натриевых и калиевых карбонатов, но не кальциевых и магниевых, обладает высокой буферной емкостью. Очевидно, наиболее простым методом контроля обоих типов жесткости является диагностика воды при помощи различных тестов.
Карбонатная, бикарбонатная и CO2 буферные системы Исходная кислотность воды определяется манипуляциями и типом веществ, которые аквариумист добавляет в неё перед запуском системы, а также химическими и физическими процессами, происходящими с водой до момента её поступления в кран. После попадения в аквариум вода находится под воздействием других факторов, например, фотосинтеза, дыхания растений и животных. Благодаря буферным механизмам, естественные процессы, происходящие в искусственной биосистеме, не вызывают серьёзных колебаний рН среды.
Наиболее простые буферные системы включают карбонаты, бикарбонаты и углекислый газ. Данные вещества способны поглощать избыточное количество ионов водорода, тем самым, не допуская повышение кислотности, либо выделяют их в среду, повышая её p.CO2 + h3O —> h3CO3—> HCO— + H+—> CO32- (в осадке) + 2H+
Это уравнение демонстрирует превращение углекислого газа, выделяемого живыми существами, в угольную кислоту (Н2СО3). Во время повышения рН среды, например, при фотосинтезе растений, угольная кислота разлагается на бикарбонаты и ионы водорода (НСО3— +Н+). Ионы водорода являются кислото-формирующими ионами и поэтому противодействуют защелачиванию. Дальнейшее возрастание рН приводит к диссоциации бикарбонатов, которые осаждаются и выделяют ионы водорода (CO32- (в осадке) + 2H+). При активном закислении среды буферные механизмы начинают функционировать в обратном порядке. В сбалансированном аквариуме, в котором уровень рН находится в диапазоне 7-8, присутствуют все вещества из уравнения с доминированием бикарбоната (СО2). Карбонат начинает преобладать в среде, когда рН превышает 9 единиц.
Буферная емкость воды зависит от общего количества карбонатов и бикарбонатов. Вода с низким содержанием этих ионов очень быстро теряет способность противодействовать изменениям кислотности.
Какой уровень жесткости является оптимальным ?Данный вопрос довольно непростой, потому что каждый вид рыбок предпочитает среду с определенными показателями воды. Кроме того, аквариумиста может смутить наличие различных единиц измерения жесткости. Наиболее часто, как для временной, так и для постоянной жесткости, используется концентрация карбоната кальция (СаСО3) в миллиграммах на литр воды. В некоторых случаях, например, в случае компании «Тетра», применяется, так называемая, «Германская жесткость», которая измеряется в °dH. Обе единицы измерения приведены в таблице 1.
Вода | Концентрация карбоната кальция (мг\Л) | °dH |
мягкая | 0-75 | 0° — 4° |
средней жесткости | 75-150 | 4° — 8° |
жесткая | 150-300 | 8° — 16° |
очень жесткая | >300 | >16° |
Таблица 1. Диапазоны уровней жесткости воды.
Для того, чтобы перевести из °dH в концентрацию CaCO3, умножьте на 17,9.
Жесткость воды и здоровье рыбРазличные виды рыб предпочитают воду со специфическим показателем жесткости. Для многих аквариумных рыб, таких как Кои и золотые рыбки, больше всего подходит вода средней жесткости. Из таблицы 1 видно, что оптимальным уровнем для большинства рыб является диапазон от 100 до 300 мг СаСО3 на литр.
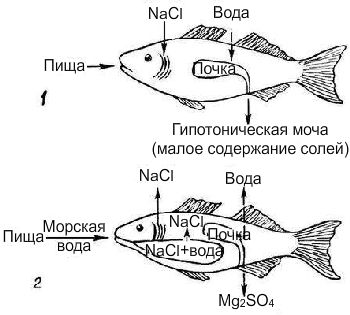 На рисунке 1. Осморегуляция у пресноводных рыбок. 2. Осморегуляция у морских рыбок.
На рисунке 1. Осморегуляция у пресноводных рыбок. 2. Осморегуляция у морских рыбок.Здоровье рыб зависит от жесткости воды, так как она влияет на их осморегуляцию. Обитая в водной среде, рыбки постоянно находятся под влиянием растворенных в ней веществ. В следствие осмоса, у пресноводных рыбок наблюдается постоянный приток воды в организм, в то время как морские рыбы живут с постоянным оттоком воды.
Для того, чтобы снизить воздействие постоянного перемещения воды извне и внутрь своего тела, рыбам приходится контролировать концентрацию жидкостей внутри себя – данный процесс называется осморегуляцией. Чем больше разница между концентрацией жидкостей снаружи и внутри рыбы, тем больше осмотический эффект. Так как жесткая вода более концентрированная, чем мягкая, данная разница будет меньше, и, как следствие, приток воды будет ниже, а значит, рыбе проще осуществлять осморегуляцию. Это особенно важно для противодействия развитию бактериальных язв, которые являются следствием проникновения большого количества воды в раны рыб.
Жесткость воды и лечение болезней
Жесткость воды серьезно влияет на процесс лечения некоторые болезней рыб, что необходимо иметь в виду при расчете дозы лекарств. Пожалуй, самым чувствительным лекарством является хлорамин-Т, который довольно токсичен в мягкой воде с высокой концентрацией кислот.
Как изменить жесткость воды ?
В первую очередь, следует учесть, что процесс нитрификации постоянно снижает концентрацию щелочей в воде, поэтому необходимо постоянно наблюдать за жесткостью воды и проверять её хотя бы один раз в месяц. Если уровень щелочей или общая жесткость падает ниже оптимального уровня, то они могут быть восстановлены добавлением кальцийсодержащих веществ, таких как перемолотые ракушки устриц, в фильтр, или добавлением дополнительного раствора в воду. Если уровень щелочей слишком низкий, то в среду добавляют раствор карбоната. Если общая жесткость воды слишком низкая, тогда следует добавить раствор кальция или магния.
aquavitro.org
Как определить жесткость воды – домашние методы и приборы
Жёсткость – одна из важнейших характеристик воды. Это свойство воде придают соли магния и кальция (Mg и Ca), которые называют солями жёсткости. Чем меньше их концентрация, тем мягче вода.
Единицы измерения. Единой единицы измерения жёсткости воды в мире не существует. Этот показатель измеряют в градусах, наиболее часто используют немецкие, французские и американские единицы.
В соответствии с ГОСТом 31865-2012 за единицу измерения жёсткости в России принят градус (ºЖ), величина которого равна 1 мг-экв/л (в числовом выражении это соответствует концентрации Ca или Mg, эквивалентной 1/2 миллимоля на литр).
Для определения соотношения градусов разных стран используют условную единицу ppm (part per million, или пропромилле), то есть миллионную долю базовой массы: 1 ppm = 0,0001 % (1 мг на килограмм).
Показания бытовых приборов обычно выражены в единицах страны-производителя. Чтобы сравнить их с указанными в нормативных документах, полученные значения переводят в принятые в стране единицы измерения.
Значения градусов жёсткости, приведенных к ppm:
- 1 dH (немецкий градус) = 17,8 ppm;
- 1 f (французский градус) = 10 ppm;
- 1 (английский градус, Clark) = 14,3 ppm;
- 1 A (американский градус) = 1 ppm;
- 1 мг-экв/л (1ºЖ) = 50,05 ppm.
Калькулятор перерасчета единиц жесткости воды
Исходная единица измерения:
°Ж (Россия)°DH (Германия)°Clark (Великобритания)°F (Франция)ppm (США)
Необходимая единица измерения:
°Ж (Россия)°DH (Германия)°Clark (Великобритания)°F (Франция)ppm (США)
Виды жёсткости воды
Выделяют три вида жёсткости:
- временная (карбонатная), обусловленная содержанием гидрокарбонатов кальция и магния – солей слабой угольной кислоты. При кипячении соли распадаются, в результате образуется нерастворимый осадок из карбоната кальция (СаСО3) и гидроокиси магния (Мg(OH)2;
- постоянная (некарбонатная), от которой невозможно избавиться кипячением. В воде находят соли двухвалентных металлов (кальция, магния, бария и стронция), образованных сильными кислотами: соляной (HCl), серной (h3 SO4), азотной (HNO3). Соли бария и стронция для расчета степени жёсткости воды не учитывают, поскольку их количества незначительны;
- общая – определяется как суммарная концентрация ионов кальция и магния в воде.
В России воду классифицируют в зависимости от величины показателя общей жёсткости:
- до 2°Ж – мягкая;
- от 2 до 10°Ж – средней жёсткости;
- более 10°Ж – жёсткая.
 Как и почему меняется жесткость воды
Как и почему меняется жесткость водыПочему нужно уметь измерять жёсткость воды
Слишком жёсткая или слишком мягкая вода может нанести непоправимый вред как бытовым приборам, так и здоровью людей. Мягкая вода вымывает из организма кальций, из-за чего разрушаются кости и зубы. В такой воде активно коррозируют металлические поверхности. Чтобы этого избежать, используют ингибитор коррозии.
Вред жёсткой воды:
- создает слишком большую солевую нагрузку для мочеполовой системы. Возможно появление мочекаменной болезни, ухудшение состояния волос и кожи;неблагоприятно действует на теплотехнические и сантехнические системы, приносит немалый вред бытовой технике;
- приходится тратить больше тепла на нагрев воды: слой накипи (осадок из солей жесткости), появившийся на ТЭНах, обладает низкой теплопроводностью. Из-за недостаточного отвода тепла нагревательные элементы часто сгорают;
- увеличивается расход моющих средств из-за того, что поверхностно-активные вещества (ПАВ), входящие в состав, дают с солями кальция и магния нерастворимые соединения и не образуют достаточного для удаления загрязнений количества пены;
- стенки трубопроводов быстро зарастают известковыми отложениями, поэтому в водопроводной системе снижается напор, трубы приходится менять.
Следите за показателями жёсткости воды, поступающей из водопровода или местного источника. Если пользоваться доступными средствами смягчения воды, водопроводная система, нагреватели, стиральная и посудомоечная машины прослужат намного дольше.
Прежде чем покупать дорогие устройства и реагенты, выясните, какие соли и в каком количестве присутствуют в водопроводной воде. Показатель общей жёсткости меняется в зависимости от количества осадков, таяния снега и других явлений, влияющих на концентрацию солей. Чтобы правильно выбрать умягчители, сначала сделайте анализ на определение жёсткости воды.
Для бытовых целей: умывания, стирки и уборки, – достаточно выяснить показатель жесткости воды один раз и в случае необходимости использовать подходящие средства. Для приготовления пищи, если водопроводная слишком вода жёсткая, целесообразно использовать бутилированную воду хорошего качества, которую периодически проверять портативным и несложным в обращении прибором для определения общей и карбонатной жёсткости.
Определение жесткости воды приборами и «на глаз»
Предположить, что вода содержит большое количество солей щелочноземельных металлов, можно по следующим признакам:
- плохо пенится мыло и стиральный порошок;
- на поверхности нагревательных приборов образуется известковый налет;
- вода имеет горьковатый вкус и дольше обычного заваривается чай;
- при кипячении на поверхности воды образуется характерная пленка;
- плохо развариваются мясные продукты.
1. Полоски жесткости воды. Продаются в аптечных магазинах «Медтехника», показывают результат измерения с точностью 1-2°Ж.

Инструкция: опустить полоску жесткости в стакан с водой, подождать, пока индикатор, которым она пропитана, изменит цвет, затем сравнить с эталонной шкалой.
2. Экспресс-тесты для аквариумов. Этот способ основан на методе титрования.
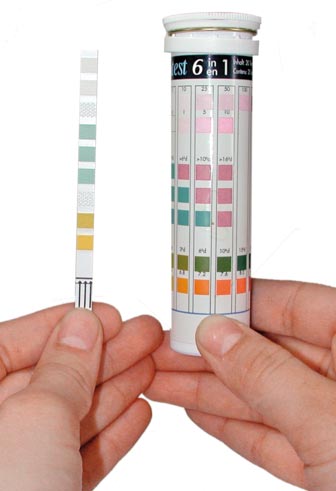 Пример аквариумного теста жесткости
Пример аквариумного теста жесткостиИнструкция: в пробирку налить 5 мл воды и по каплям добавить реагент, содержащий индикатор. Число капель реагента, необходимых для того, чтобы раствор из жёлтого стал синим, равно количеству градусов жёсткости, каких именно – указано в инструкции к тесту.
3. Специальные приборы. Самый простой и точный метод определения жёсткости воды – титрование. Основан на реакции индикаторов, их способности менять цвет при достижении той или иной концентрации в строго определенном количестве воды, содержащей соли. В лабораториях результаты титрования обрабатывают с помощью фотоколориметра.
Существуют приборы, принцип действия которых заключается в измерении электропроводности воды. Уровень проводимости прямо пропорционально зависит от концентрации солей кальция и магния, растворённых в воде. В продаже есть приборы типа TDS-метр (total dissolved solids, или «солемер») и EC-метр (кондуктометр).
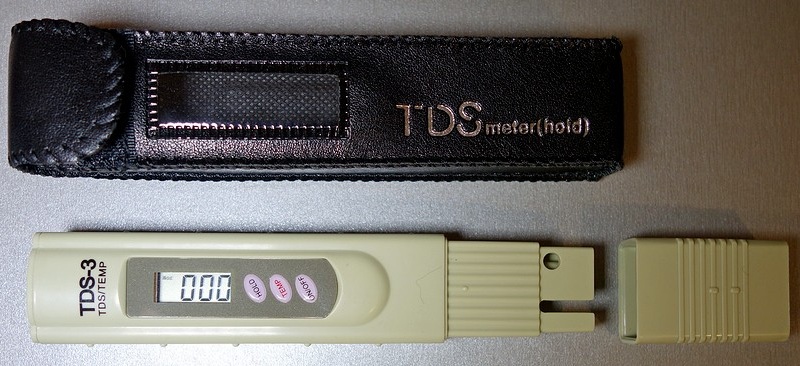 Пример TDS-метра
Пример TDS-метраTDS-метр выдаёт результат в ppm. Устройство показывает общее содержание солей и удельную электропроводность воды. EC-метр дополнительно показывает и удельное сопротивление раствора в мкСм/см (микро Сименс). Результат TDS = k * EC, где коэффициент k в пределах 0,55–0,80 (среднее значение 0,67).
 TDS и EC-метр в одном приборе. Дороже, но удобнее
TDS и EC-метр в одном приборе. Дороже, но удобнееС помощью таких приборов удобно следить и поддерживать требуемое качество воды в аквариумах или для полива растений, чувствительных к повышенной жёсткости.
 Автор статьи:
Автор статьи: мастер на все руки
chistodar.com
Показатель жесткости воды
Жесткость воды представляет собой традиционную меру способности воды реагировать с мылом: жесткая вода требует для образования пены значительного количества мыла. Отложение накипи в трубах горячего водоснабжения, котлах и других бытовых устройствах вызывается жесткой водой. Жесткость воды обусловливается растворенными ионами поливалентных металлов. В пресной воде основными ионами, вызывающими жесткость, являются кальций и магний; имеют значение также ионы стронция, железа, бария и марганца. Жесткость воды обычно определяется с помощью реакции ионов поливалентных металлов, присутствующих в воде, с хелатирующими агентами, например, ЭДТА, и выражается как эквивалентная концентрация карбоната кальция. Жесткость может оцениваться также путем определения индивидуальных концентраций образующих ее компонентов, сумма которых выражается через эквивалентное количество карбоната кальция. Степень жесткости питьевой воды классифицируется, исходя из эквивалентных концентраций CaCO3 в ней, следующим образом:
► мягкая - 0-60 мг/л
► средней жесткости - 60-120 мг/л
► жесткая - 120-180 мг/л
► очень жесткая - 180 мг/л и выше.
Жесткость классифицируется также на основе эквивалентных концентраций CaO или Ca (OH)2. В системе СИ рекомендуется также выражать жесткость в молях Ca 2+ на м3.
Несмотря на то, что жесткость обусловливается катионами, она может рассматриваться также как карбонатная (устранимая) и некарбонатная (постоянная) жесткость. Карбонатная жесткость показывает количество карбонатов и бикарбонатов в растворе, которое может быть удалено или осаждено кипячением. Этот тип жесткости ответствен за отложение накипи в трубопроводах горячего водоснабжения и котлах. Некарбонатная жесткость обуславливается сочетанием ионов, вызывающих жесткость, с сульфатами, хлоридами и нитратами и определяется как "постоянная жесткость", поскольку она не может быть устранена кипячением.
Щелочность, как показатель буферности воды, тесно связана с жесткостью. Щелочность большей частью вызывается анионами или молекулярными формами слабых кислот, главным образом, гидроксидами, бикарбонатами и карбонатами; при наличии в воде других форм, таких как бораты, фосфаты, силикаты и органические кислоты, они также вносят небольшую лепту в показатель щелочности воды. Независимо от того, какие растворенные формы обеспечивают щелочность воды, она всегда выражается в виде эквивалентного количества карбоната кальция.
В случаях, когда щелочность поверхностных вод обусловливается присутствием карбонатов и/или бикарбонатов, ее величина обычно близка к величине жесткости.
Распространение жёсткой воды
Основными природными источниками жесткости воды являются осадочные породы, фильтрация и сток с почвы. Жесткая вода обычно образуется в районах с плотным пахотным слоем и известковыми образованиями. Для подземных вод обычно характерна большая жесткость, чем для поверхностных. Подземные воды богатые карбоновыми кислотами, обычно обладают высокой растворяющей способностью по отношению к почвам и породам, содержащим измеримые количества минералов кальцита, гипса и доломита, вследствие чего уровни жесткости могут достигать нескольких тысяч мг/л.
Основными промышленными источниками жесткости являются стоки предприятий, производящих неорганические химические вещества, и горнодобывающая промышленность. Оксид кальция используется в строительной промышленности в известковом растворе, штукатурке и других материалах. Он находит применение также в производстве бумажной массы и бумаги, рафинировании сахара, очистке нефти, дублении, очистке воды и сточных вод. Магний также используется в различных процессах в текстильной, дубильной и бумажной промышленности. Сплавы магния находят широкое применение в литейном и штамповочном производстве, портативных станках, багажном оборудовании и бытовых продуктах широкого применения. Соли магния используются также в производстве металлического магния, удобрений, керамики, взрывчатых веществ и медикаментов.
Влияние на жёсткой воды на здоровье
Как отмечено в статье про кальций и магний, основными факторами, определяющими жесткость воды, являются ионы кальция и магния. Данные об отрицательном влиянии на здоровье, специфически связываемом с высокими уровнями кальция или магния в питьевой воды, отсутствуют.
Помимо бытовых неудобств в результате использования воды с высокой степенью жесткости, другое возможное неудобство может возникать при связывании магния с сульфат-ионом, в результате чего вода приобретает слабительные свойства.
Порог привкуса для иона кальция в питьевой воде колеблется от присутствующих анионов; для иона магния порог привкуса меньше. С дальнейшими подробностями относительно зависимости между жесткостью воды и сердечно-сосудистыми заболеваниями можно ознакомиться в части III, где рассматриваются аспекты, касающиеся здоровья, для неорганических компонентов воды. Рекомендуемые величины содержания в воде для кальция и магния не предлагаются, поскольку такая величина предлагается для общей жесткости на основе эстетических соображений.
Другие аспекты
Мягкая вода в большей степени склонна вызывать коррозию труб, и вследствие этого в питьевой воде в распределительной системе могут присутствовать некоторые тяжелые металлы, такие как медь, цинк, свинец и кадмий. Степень такой коррозии и растворения металлов является также функцией значения рН, щелочности и концентрации растворенного кислорода. В некоторых населенных пунктах коррозия настолько сильна, что в системе водоснабжения приходится предпринимать специальные меры предосторожности.
В районах с очень жесткой водой внутридомовые трубы могут забиваться отложившейся окалиной; жесткая вода также образует накипь на кухонной посуде и увеличивает потребление мыла. Таким образом, жесткая вода может быть не только неприятной, но и экономически обременительной для потребителя. Восприятие жесткости воды населением неодинаково в разных населенных пунктах часто оно связано с той жесткостью, к которой потребитель привык на протяжении ряда лет, и во многих населенных пунктах возражения не вызывает вода с жесткостью, более 500 мг/л. Хотя, приемлемое равновесие между коррозией и проблемами накипи обеспечивает уровень жесткости приблизительно 100 мг CaCO3 /л.
biofile.ru
Что такое жесткость воды? Степень жесткости воды
Что такое жесткость воды?
Многие удивляются, вот почему иногда моешь руки или тело, а чувства чистоты, как говорится «до скрипа» нет. И вообще складывается впечатление, что руки жирные и скользкие от воды. Или наоборот помыл волосы, а они дубовые, как солома. И причина вовсе не в средствах гигиены, гелях для душа и шампунях, причина в качестве водопроводной воды. Излишняя мягкость (как в первом случае со скользкими руками) или излишняя жесткость (в случае с волосами) является постоянным «спутником» водопроводной воды. Причем эта проблема касается не только городских квартир с централизованным водоснабжением, но и загородных домов, где обеспечение водой происходит в автономном режиме.
Какая вода жесткая? Чаще всего, конечно же, мы сталкиваемся с проблемой чрезмерной жесткости воды. Ее степень зависит от присутствия в воде солей магния и кальция и измеряется мг-экв/л (миллиграмм-эквивалент на литр). Американская классификация разделяет воду на четыре типа: мягкую, нормальную, жесткую и очень жесткую. Вода будет считаться «мягкой», если содержание солей в ней не превышает 2 мг-экв/л, нормальной – от 2 до 4 единиц, от 4 до 6 мг-экв/л – жесткой, от 6 и выше мг-экв/л очень жесткой. Для приема в пищу идеальна нормальная по жесткости вода, где показатель солей не ниже 2 мг-экв/л, но и не превышает 4 мг-экв/л
Жесткость воды не сыграет особой роли, к примеру, при поливе растений на огороде или для тушения пожаров, но в ряде случаев повышенная жесткость может доставить немало проблем и хлопот. Мытье посуды, принятие водных процедур с использованием жесткой воды будет менее эффективным, чем с мягкой. Чем жестче вода, тем больше моющих средств придется использовать при стирке белья или во время мытья посуды.
При взаимодействии жесткой воды с мыльными средствами, образуются разводы на сантехнике а также на поверхности посуды. Те же «мыльные» шлаки от жесткой воды не смываются с человеческой кожи, покрывая ее невидимой пленкой, забивая поры и покрывая каждый волос на теле. Не удивляйтесь, если у Вас на теле появился зуд, неприятная сыпь, а в волосах – перхоть. Причина всему – повышенное содержание солей в воде.
В процессе нагревания соли, содержащиеся в воде, кристаллизируются и выпадают в виде накипи, которая в свою очередь является в 90% случаях причиной поломки водонагревательных приборов. Именно по этой причине производители бойлеров, водонагревательных котлов и другого оборудования, предъявляются высочайшие требования к жесткости воды. Жесткость воды определяет пригодность воды для использования не только в промышленных целях, но и для бытовых нужд.
Выделяют два типа жесткости воды:
- временная – в воде наряду с кальцием, железом и магнием присутствуют гидрокарбонатные анионы;
- постоянная – характеризуется присутствием нитратных, сульфатных и хлоридных анионов, соли магния и кальция, которые легко растворяются в воде.
В чем причина повышенной жесткости воды? Основная причина жесткости воды – подземные залежи гипса, известняков, доломитов, которые беспроблемно растворяются в подземных водах. Чаще всего маломинерализованная вода имеет жесткость до 70-80% преобладания ионов кальция. В некоторых случаях магниевая жесткость может достигать более 50%.
Жесткость поверхностных вод намного меньше жесткости подземных источников влаги. Причина в том, что поверхностные источники подвержены заметным колебаниям, в зависимости от поры года. Максимальное значение жесткости воды чаще всего проявляется в конце зимы, а самое маленькое – во время половодья, когда вода в реках разбавляется достаточно мягкой талой водой. Самая высокая жесткость в морской и океанической воде.
Жесткую воду легко различить – она горькая на вкус, а также оказывает негативное воздействие на органы пищеварения, не исключены расстройство желудка, повышенное газообразование. Так мягкая или жесткая?
Не стоит надеяться, что слишком мягкая вода, где показатели содержания солей ниже 2 мг-экв/л, намного лучше для применения. Мягкая вода в зависимости от уровня pH, а также ряда других параметров влияет на коррозионную активность водородов.
К примеру, в теплотехнике зачастую проводят специальную химическую подготовку воды для достижения оптимального, а самое главное – эффективного соотношения между коррозионной активностью воды и ее жесткостью.
www.watermap.ru











