1.7. Водородный показатель среды растворов – pH. Водородный показатель воды ph норма
Водородный показатель (рН) воды - Територия Здоровья
Водородный показатель (рН) - содержание ионов водорода в растворах. Для удобства выражения содержания водородных ионов была введена величина, представляющая собой логарифм их концентрации, взятый с обратным знаком: pH = -lg[H+].
Значение водородного показателя (pH ) в речных водах обычно варьирует в пределах 6,5-8,5, в атмосферных осадках 4,6-6,1, в болотах 5,5-6,0, в морских водах 7,9-8,3.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения, величина водородного показателя (pH) не должна выходить за пределы интервала значений 6,5-8,5.
Природные воды в зависимости от водородного показателя (рН) рационально делить на семь групп.
Группы природных вод в зависимости от водородного показателя (рН)
| Группа | рН | Примечание |
| Сильнокислые воды | <3 | результат гидролиза солей тяжелых металлов (шахтные и рудничные воды) |
| Кислые воды | 3-5 | поступление в воду угольной кислоты, фульвокислот и других органических кислотв результате разложения органических веществ |
| Слабокислые воды | 5-6,5 | присутствие гумусовых кислот в почве и болотных водах (воды лесной зоны) |
| Нейтральные воды | 6,5-7,5 | наличие в водах Ca(HCO3)2, Mg(HCO3)2 |
| Слабощелочные воды | 7,5-8,5 | наличие в водах Ca(HCO3)2, Mg(HCO3)2 |
| Щелочные воды | 8,5-9,5 | присутствие Na2CO3 или NaHCO3 |
| Сильнощелочные воды | 9,5 | присутствие Na2CO3 или NaHCO3 |
Водородный показатель (рН) и наше здоровье
viktorcoral.jimdo.com
Водородный показатель pH. Таблицы показателей pH.
Что такое pH . Водородный показатель. Кислые и основные (щелочные) свойства растворов / сред.
pH = -log [H+], или еще строже говоря pH = -log [h4O+] (химики утверждают, что именно в таком виде положительный ион водорода живет в водном растворе). pH показывает кислотно / щелочной балласнс раствора, а не кислотность или щелочность (основность) отдельно.
pH измеряется в степенях числа 10. Концентрация ионов водорода в растворесс pH 1.0 в 10 раз выше, чем концентрация ионов водорода в растворе с pH 2.0. Чем выше концентрация ионов водорода, тем ниже pH
- при pH > 7 раствор щелочной (основной)
- при pH < 7 раствор кислый, или кислотный
В чистой нейтральной воде концентрация ионов водорода и гидроксильных ионов = гидроксид-ионов = OH- обе равны 10-7 моль/л.
| pH | Концентрация ионов моль/л | Тип раствора / какие ионы |
| 0 | 1.0 | Кислотный раствор (кислый) /Ионы водородаH+ |
| 1 | 0.1 | |
| 2 | 0.01 | |
| 3 | 0.001 | |
| 4 | 0.0001 | |
| 5 | 0.00001 | |
| 6 | 0.000001 | |
| 7 | 0.0000001 | Нейтральный раствор |
| 8 | 0.000001 | Основной (щелочной) раствор /гидроксильные ионыOH- |
| 9 | 0.00001 | |
| 10 | 0.0001 | |
| 11 | 0.001 | |
| 12 | 0.01 | |
| 13 | 0.1 | |
| 14 | 1.0 |
В целом химическая теория - сложнее, но pH отличный практический показатель "кислотности" ," щелочности" и "нейтральности".
Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора. Лакмус, фенолфтолеин, метилоранж.
| Название | Окраска индикатора в среде | ||
| Кислая [H+]* > [OH-]рН < 7 | Нейтральная[H+] = [OH-]рН = 7 | Щелочная [OH-] > [H+]рН > 7 | |
| Лакмус | красный | фиолетовый | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | розовый | оранжевый | желтый |
* [ x ] - концентрация ионов 'x'
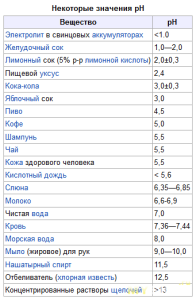
Таблица pH бытовых веществ, материалов и продуктов.
| Электролит в свинцовых аккумуляторах | <1.0 |
| Желудочный сок | 1,0—2,0 |
| Лимонный сок | 2,5±0,5 |
| Лимонад Кола | 2,5 |
| Уксус | 2,9 |
| Яблочный сок | 3,5±1,0 |
| Пиво | 4,5 |
| Кофе | 5,0 |
| Модный шампунь | 5,5 |
| Чай | 5,5 |
| Кислотный дождь | < 5,6 |
| Кожа здорового человека | ~6,5 |
| Слюна | 6,35—6,85 |
| Молоко | 6,6-6,9 |
| Чистая вода | 7,0 |
| Кровь | 7,36—7,44 |
| Морская вода | 8,0 |
| Мыло (жировое) для рук | 9,0—10,0 |
| Нашатырный спирт | 11,5 |
| Отбеливатель (хлорка) | 12,5 |
| Раствор соды | 13,5 |
Водородный показатель (pH) некоторых распространенных продуктов питания.
| Продукт | Приблизительныйуровень pH | Продукт | Приблизительныйуровень pH |
| Абрикосовый нектар | 3.8 | Малина | 3.2 - 3.6 |
| Абрикосы | 3.3 - 4.8 | Мамалыга | 6.8 - 8.0 |
| Авокадо | 6.3 - 6.6 | Манго | 5.8 - 6.0 |
| Алое Вера | 6.1 | Маслины | 6.0 - 7.0 |
| Апельсины | 3.0 - 4.0 | Масло | 6.1 - 6.4 |
| Арахисовое масло | 6.3 | Меласса (черная патока) | 4.9 - 5.4 |
| Арбуз | 5.2 - 5.6 | Молоко | 6.4 - 6.8 |
| Артишоки | 5.5 - 6.0 | Морковь | 5.9 - 6.3 |
| Бананы | 4.5 - 5.2 | Морское ушко | 6.1 - 6.5 |
| Батат (сладкий картофель) | 5.3 - 5.6 | Мука пшеничная | 5.5 - 6.5 |
| Батат (сладкийкартофель), вареный. | 5.5 - 6.8 | Мякоть томата | 4.3 - 4.5 |
| Белый хлеб | 5.0 - 6.2 | Нектарины | 3.9 - 4.2 |
| Бобы | 5.6 - 6.5 | Овощной сок | 3.9 - 4.3 |
| Брокколи | 5.3 | Окунь, морской, жаренный | 6.6 - 6.8 |
| Вино | 2.8 - 3.8 | Оливки | 3.6 - 3.6 |
| Виноград | 3.5 - 4.5 | Пахта | 4.4 - 4.8 |
| Вишня | 3.2 - 4.5 | Персики | 3.4 - 4.1 |
| Газированные напитки | 2.0 - 4.0 | Печень трески | 6.2 |
| Горох | 5.8 - 6.4 | Пиво | 4.0 - 5.0 |
| Горчица | 3.5 - 6.0 | Питьевая вода | 6.5 - 8.0 |
| Грейпфрут | 3.0 - 3.7 | Помидоры | 4.3 - 4.9 |
| Груши | 3.6 - 4.0 | Ревень | 3.1 - 3.2 |
| Дыня | 6.0 - 6.7 | Сардины | 5.7 - 6.6 |
| Ежевика | 3.9 - 4.5 | Свежие яйца | 7.6 - 8.0 |
| Изюм | 2.8 - 3.0 | Свекла | 4.9 - 6.6 |
| Кактус | 4.7 | Сельдерей | 5.7 - 6.0 |
| Кальмары | 5.8 | Сельдь | 6.1 |
| Каперсы | 6.0 | Сидр | 2.9 - 3.3 |
| Капуста | 5.2 - 5.4 | Соевое молоко | 7.0 |
| Каракатица | 6.3 | Соевый соус | 4.4 - 5.4 |
| Карп | 6.0 | Соус Карри | 6.0 |
| Картофель | 5.6 - 6.0 | Соус Чили | 2.8 - 3.7 |
| Кетчуп | 3.9 | Спаржа | 6.0 - 6.7 |
| Кислая капуста | 3.4 - 3.6 | Сыр | 4.8 - 6.4 |
| Кленовый сироп | 4.6 - 5.5 | Томатный сок | 4.1 - 4.6 |
| Клубника, земляника | 3.0 - 3.9 | Тунец | 5.9 -6.1 |
| Клубничный (земляничный) джем | 3.0 - 3.4 | Турнепс (репа) | 5.2 - 5.6 |
| Клюквенный сок | 2.3 - 2.5 | Тыква | 4.8 - 5.2 |
| Кокос | 5.5 - 7.8 | Уксус | 2.4 - 3.4 |
| Кокосовое молоко | 6.1 - 7.0 | Уксус яблочный | 3.1 |
| Крабовое мясо | 6.5 - 7.0 | Устрицы | 5.7 - 6.2 |
| Красный перец | 4.6 - 5.2 | Финики | 6.5 - 8.5 |
| Креветки | 6.8 - 7.0 | Фруктовое желе | 2.8 - 3.4 |
| Крекеры | 6.5 - 8.5 | Фруктовый джем | 3.5 - 4.0 |
| Крыжовник | 2.8 - 3.1 | Фруктовый коктейль | 3.6 - 4.0 |
| Кукуруза | 5.9 - 7.3 | Херес | 3.4 |
| Курага( сушеные абрикосы) | 3.4 - 3.8 | Хрен | 5.4 |
| Лайм | 1.8 - 2.0 | Чай | 7.2 |
| Лаймовый сок | 2.0 - 2.4 | Черника | 3.1 - 3.4 |
| Лимоны | 2.2 - 2.4 | Шпинат | 5.5 - 6.8 |
| Лимонный сок | 2.0 - 2.6 | Яблоки | 3.3 - 3.9 |
| Лосось | 6.1 - 6.3 | ||
| Лук-порей | 5.5 - 6.2 |
Таблица. Значения pH оснований, щелочей (растворы)
Значения pH для некоторых распространенных оснований и щелочей приведены в таблице ниже.
| Основания, щелочи | Нормальность раствора | pH |
| Аммиак /Ammonia | н. | 11.5 |
| Аммиак /Ammonia | 0.1 н. | 11.1 |
| Аммиак /Ammonia | 0.01 н. | 10.6 |
| Ацетат натрия / Sodium acetate | 0.1 н. | 8.9 |
| Барбитал - натрий / Barbital sodium | 0.1 н. | 9.4 |
| Бензойнокислый натрий /Sodium benzoate | 0.1 н. | 8.0 |
| Бикарбонат калия / Potassium bicarbonate | 0.1 н. | 8.2 |
| Бикарбонат натрия /Sodium bicarbonate | 0.1 н. | 8.4 |
| Гидроокись железа /Ferrous hydroxide | насыщенный | 9.5 |
| Гидроокись калия / Potassium hydroxide | н. | 14.0 |
| Гидроокись калия / Potassium hydroxide | 0.1 н. | 13.0 |
| Гидроокись калия / Potassium hydroxide | 0.01 н. | 12.0 |
| Гидроокись кальция /Calcium hydroxide | насыщенный | 12.4 |
| Гидроокись натрия / Sodium hydroxide | н. | 14.0 |
| Гидроокись натрия / Sodium hydroxide | 0.1 н. | 13.0 |
| Гидроокись натрия / Sodium hydroxide | 0.01 н. | 12.0 |
| Карбонат кальция / Calcium carbonate | насыщенный | 9.4 |
| Метасиликат натрия / Sodium metasilicate | 0.1 н. | 12.6 |
| Оксид магнияия / Magnesia | насыщенный | 10.5 |
| Пироборнокислый натрий (Бура)/ Borax | 0.01 н. | 9.2 |
| Сесвикарбонат натрия / Sodium sesquicarbonate | 0.1 н. | 10.1 |
| Тринатрийфосфат / Trisodium phosphate | 0.1 н. | 12.0 |
| Углекислый калий / Potassium carbonate | 0.1 н. | 11.5 |
| Углекислый натрий / Sodium carbonate | 0.1 н. | 11.6 |
| Уксуснокислый калий / Potassium acetate | 0.1 н. | 9.7 |
| Цианид калия / Potassium cyanide | 0.1 н. | 11.0 |
Таблица значений PH кислот. (Растворов).
В таблице представлены серная, уксусная и другие распространенные кислоты.pH- это мера активности ионов водорода в растворах, и, таким образом, их кислотности или щелочности. Таким образом, в таблице ниже указана кислотность некоторых обычных кислот.
| Кислота | Нормальность раствора | pH |
| Азотная / Nitric | 0.1н. | 1.0 |
| Алюминиевые квасцы / Alum | 0.1 н. | 3.2 |
| Бензойная / Benzoic | 0.1 н. | 3.0 |
| Борная / Boric | 0.1 н. | 5.2 |
| Винная / Tartaric | 0.1 н. | 2.2 |
| Желудочный сок / Stomach Acid | 1 | |
| Лимонная / Citric | 0.1н. | 2.2 |
| Лимонный сок / Lemon Juice | 2 | |
| Молочная / Lactic | 0.1 н. | 2.4 |
| Муравьиная / Formic | 0.1 н. | 2.3 |
| Мышьяковистая / Arsenious | насыщенный | 5.0 |
| Оксиянтарная (яблочная) / Malic | 0.1 н. | 2.2 |
| Ортофосфорная / Orthophosphoric | 0.1 н. | 1.5 |
| Салициловая / Salicylic | насыщенный | 2.4 |
| Серная / Sulfuric | н. | 0.3 |
| Серная / Sulfuric | 0.1 н. | 1.2 |
| Серная / Sulfuric | 0.01 н. | 2.1 |
| Сернистая / Sulfurous | 0.1 н. | 1.5 |
| Сероводородная / Hydrogen sulfide | 0.1 н. | 4.1 |
| Трихлороуксусная / Trichloracetic | 0.1 н. | 1.2 |
| Угольная (Углеродная) / Carbonic | насыщенный | 3.8 |
| Уксус столовый (3-15%) / Vinegar | 3 | |
| Уксусная / Acetic | 2.4 | |
| Уксусная / Acetic | 0.1 н. | 2.9 |
| Уксусная / Acetic | 0.01 н. | 3.4 |
| Хлористоводородная / Hydrochloric | н. | 0.1 |
| Хлористоводородная / Hydrochloric | 0.1 н. | 1.1 |
| Хлористоводородная / Hydrochloric | 0.01 н. | 2.0 |
| Цианистоводородная (синильная) / Hydrocyanic | 0.1 н. | 5.1 |
| Щавелевая / Oxalic | 0.1 н. | 1.3 |
| Янтарная / Succinic | 0.1н. | 2.7 |
meandr.org
1.7. Водородный показатель среды растворов – pH.
Водородный показатель – рН – это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
pН = – lg[H+]
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni – сила водорода, или pondus hydrogenii – вес водорода.
Несколько меньшее распространение получила обратная pH величина – показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
рОН = – lg[OH–]
В чистой воде при 25°C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10-7моль/л, это напрямую следует из константы автопротолиза воды Кw, которую иначе называют ионным произведением воды:
Кw = [H+] · [OH–] =10–14 [моль2/л2] (при 25°C)
рН + рОН = 14
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания – наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH–] говорят, что раствор является кислым, а при [OH–] > [H+] – щелочным.
Определение рН
Для определения значения pH растворов широко используют несколько способов.
1) Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы – органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах – либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы (см. Таблица 1, занятие 2).
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
2) Аналитический объёмный метод – кислотно-основное титрование – также даёт точные результаты определения общей кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности – момент, когда титранта точно хватает, чтобы полностью завершить реакцию, – фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред (Табл. 2).
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем.
3) Использование специального прибора – pH-метра – позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов, отличается удобством и высокой точностью, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
С помощью рН-метра измеряют концентрацию ионов водорода (pH) в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных систем непрерывного контроля технологических процессов, в т. ч. в агрессивных средах.
рН-метр незаменим для аппаратного мониторинга pH растворов разделения урана и плутония, когда требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.
Прибор может использоваться в лабораториях стационарных и передвижных, в том числе полевых, а также клинико-диагностических, судебно-медицинских, научно-исследовательских, производственных, в том числе мясо-молочной и хлебопекарной промышленности.
Последнее время pH-метры также широко используются в аквариумных хозяйствах, контроля качества воды в бытовых условиях, земледелия (особенно в гидропонике), а также – для контроля диагностики состояния здоровья.
Таблица 2. Значения рН для некоторых биологических систем и других растворов
| Система (раствор) | рН |
| Двенадцатиперстная кишка | 7,0 – 7,8 |
| Желудочный сок | 1,6 – 1,8 |
| Кровь человека | 7,35 – 7,45 |
| Ликвор | 7,5 |
| Моча | 4,8 – 7,5 |
| Мышечная ткань | 6,7 – 6,8 |
| Панкреатический сок | 8,3 |
| Пот | 4,0 – 8,0 |
| Почки | 6,6 – 6,9 |
| Протоплазма клеток | 6,4 – 7,0 |
| Связки | 7,2 |
| Слёзы | 7,4 |
| Слюна | 6,35 – 6,85 |
| Тонкая кишка | 6,2 – 7,3 |
| Молоко | 6,6 – 6,9 |
| Морская вода | 8,0 |
| Белок куриного яйца | 8,0 |
| Апельсиновый сок | 2,6 – 4,4 |
| Томатный сок | 4,3 |
| Кофе | 5,0 |
| Чай | 5,5 |
studfiles.net
1.7. Водородный показатель среды растворов – ph
Водородный показатель – рН – это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
pН = – lg[H+]
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni – сила водорода, или pondus hydrogenii – вес водорода.
Несколько меньшее распространение получила обратная pH величина – показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
рОН = – lg[OH–]
В чистой воде при 25°C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10-7моль/л, это напрямую следует из константы автопротолиза воды Кw, которую иначе называют ионным произведением воды:
Кw = [H+] · [OH–] =10–14 [моль2/л2] (при 25°C)
рН + рОН = 14
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания – наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH–] говорят, что раствор является кислым, а при [OH–] > [H+] – щелочным.
Определение рН
Для определения значения pH растворов широко используют несколько способов.
1) Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы – органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах – либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы (см. Таблица 1, занятие 2).
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
2) Аналитический объёмный метод – кислотно-основное титрование – также даёт точные результаты определения общей кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности – момент, когда титранта точно хватает, чтобы полностью завершить реакцию, – фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред (Табл. 2).
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем.
3) Использование специального прибора – pH-метра – позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов, отличается удобством и высокой точностью, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
С помощью рН-метра измеряют концентрацию ионов водорода (pH) в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных систем непрерывного контроля технологических процессов, в т. ч. в агрессивных средах.
рН-метр незаменим для аппаратного мониторинга pH растворов разделения урана и плутония, когда требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.
Прибор может использоваться в лабораториях стационарных и передвижных, в том числе полевых, а также клинико-диагностических, судебно-медицинских, научно-исследовательских, производственных, в том числе мясо-молочной и хлебопекарной промышленности.
Последнее время pH-метры также широко используются в аквариумных хозяйствах, контроля качества воды в бытовых условиях, земледелия (особенно в гидропонике), а также – для контроля диагностики состояния здоровья.
Таблица 2. Значения рН для некоторых биологических систем и других растворов
| Система (раствор) | рН |
| Двенадцатиперстная кишка | 7,0 – 7,8 |
| Желудочный сок | 1,6 – 1,8 |
| Кровь человека | 7,35 – 7,45 |
| Ликвор | 7,5 |
| Моча | 4,8 – 7,5 |
| Мышечная ткань | 6,7 – 6,8 |
| Панкреатический сок | 8,3 |
| Пот | 4,0 – 8,0 |
| Почки | 6,6 – 6,9 |
| Протоплазма клеток | 6,4 – 7,0 |
| Связки | 7,2 |
| Слёзы | 7,4 |
| Слюна | 6,35 – 6,85 |
| Тонкая кишка | 6,2 – 7,3 |
| Молоко | 6,6 – 6,9 |
| Морская вода | 8,0 |
| Белок куриного яйца | 8,0 |
| Апельсиновый сок | 2,6 – 4,4 |
| Томатный сок | 4,3 |
| Кофе | 5,0 |
| Чай | 5,5 |
studfiles.net
Водородный показатель (pH)
В начало
Содержание ионов водорода (гидроксония – h4O+) в природных водах определяется в основном количественным соотношением концентраций угольной кислоты и ее ионов:
CO2 + h3О Û H+ + HCO-3Û 2 H+ + CO32-.
Для удобства выражения содержания водородных ионов была введена величина, представляющая собой логарифм их концентрации, взятый с обратным знаком:
pH = -lg[H+].
Для поверхностных вод, содержащих небольшие количества диоксида углерода, характерна щелочная реакция. Изменения pH тесно связаны с процессами фотосинтеза (при потреблении CO2 водной растительностью высвобождаются ионы ОН-). Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Гидролиз солей тяжелых металлов играет роль в тех случаях, когда в воду попадают значительные количества сульфатов железа, алюминия, меди и других металлов:
Fe2+ + 2h3O Þ Fe(OH)2 + 2H+.
Значение pH в речных водах обычно варьирует в пределах 6,5 – 8,5, в атмосферных осадках 4,6 – 6,1, в болотах 5,5 – 6,0, в морских водах 7,9 – 8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина pH для большинства речных вод составляет 6,8 – 7,4, летом 7,4 – 8,2. Величина pH природных вод определяется в некоторой степени геологией водосборного бассейна.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения величина pH не должна выходить за пределы интервала значений 6,5 – 8,5.
Величина pH воды – один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины pH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В водоеме можно выделить несколько этапов процесса его закисления. На первом этапе рН практически не меняется (ионы бикарбоната успевают полностью нейтрализовать ионы Н+). Так продолжается до тех пор, пока общая щелочность в водоеме не упадет примерно в 10 раз до величины менее 0,1 моль/дм3.
На втором этапе закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года. О таких водоемах говорят как об умеренно кислых. На этом этапе закисления происходят значительные изменения в видовом составе живых организмов.
На третьем этапе закисления водоема рН стабилизируется на значениях рН<5 (обычно рН 4,5), даже если атмосферные осадки имеют более высокие значения рН. Это связано с присутствием гумусовых веществ и соединений алюминия в водоеме и почвенном слое.
Природные воды в зависимости от рН рационально делить на семь групп.
Таблица. Группы природных вод в зависимости от рН
|
Группа |
рН |
Примечание |
|
Сильнокислые воды |
<3 |
результат гидролиза солей тяжелых металлов (шахтные и рудничные воды) |
|
Кислые воды |
3–5 |
поступление в воду угольной кислоты, фульвокислот и других органических кислот в результате разложения органических веществ |
|
Слабокислые воды |
5–6,5 |
присутствие гумусовых кислот в почве и болотных водах (воды лесной зоны) |
|
Нейтральные воды |
6,5–7,5 |
наличие в водах Ca(HCO3)2, Mg(HCO3)2 |
|
Слабощелочные воды |
7,5–8,5 |
наличие в водах Ca(HCO3)2, Mg(HCO3)2 |
|
Щелочные воды |
8,5–9,5 |
присутствие Na2CO3 или NaHCO3 |
|
Сильнощелочные воды |
9,5 |
присутствие Na2CO3 или NaHCO3 |
Измерение рН при контроле качества природной и питьевой воды проводится практически повсеместно. Для определения рН используют рН-метрию и визуальную колориметрию: рН-метрия предполагает измерение водородного показателя с помощью стационарных (лабораторных) приборов – рН-метров, в то время как визуально-колориметрическое определение проводят с использованием портативных тест-комплектов, основанных на реакции универсального или комбинированного индикатора с водородными ионами, сопровождающейся изменением окраски раствора. Точность измерения водородного показателя с помощью рН-метра может быть высока (до 0,1 единицы рН и менее), с помощью визуально-колориметрических тест-комплектов – около 0,5 единицы рН.
В некоторых случаях – для быстрого анализа неизвестных растворов используется рН-индикаторная бумага, имеющая точность определения рН не более 1, что недостаточно для выполнения анализа природной и питьевой воды. Ниже приводится визуально-колориметрический метод определения рН как наиболее простой и доступный.
icolog.ru
Водородный показатель: рН | Акваловер
Многие пособия и статьи по гидрохимии утверждают, что водородный показатель, или активная реакция, или рН — основная характеристика воды.Эту характеристику иногда еще называют показателем полезности воды.
Термин ввел в обиход датский химик Сорен Петр Лауриц Соренсен (1868-1939), хотя и до него встречались упоминания о силе или потенциале воды.
Не только вода, но и любая жидкость имеет свой показатель рН. Когда мы сдаем кровь на анализ, то одним из результатов этого анализа будет показатель рН крови.
Водородный показатель — это мера активности ионов водорода в растворе.
 Многие часто ошибочно называют нейтральный показатель рН «нулевым». Нулевая рН — это концентрированная кислота. И жидкости, с которыми мы сталкиваемся ежедневно, не могут иметь нулевой водородный показатель.Так, например, средний pH пива: 4,0-4,5; вина: 3,3–3,6; кофе-5,0; молока-6,7.
Многие часто ошибочно называют нейтральный показатель рН «нулевым». Нулевая рН — это концентрированная кислота. И жидкости, с которыми мы сталкиваемся ежедневно, не могут иметь нулевой водородный показатель.Так, например, средний pH пива: 4,0-4,5; вина: 3,3–3,6; кофе-5,0; молока-6,7.
Активная реакция воды характеризует ее готовность вступать во взаимодействие с окружающими ее клетками: нейтральная вода не взаимодействует с окружающими ее веществами; кислая — активно взаимодействует с клетками; щелочная — промывает клетки, раскрывает их. Щелочная вода — питательная среда для развития вирусов и бактерий.
А что же с водородным показателем в аквариуме?
В жизни рыб и растений этот показатель играет гораздо бОльшую роль, чем в жизни людей или наземных животных.
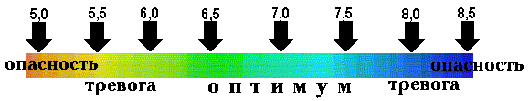
Водородный показатель жидкости может иметь значения от 0 до 14. Рыбы и водные растения могут жить в диапазоне значений 5-9.5.Для комфортной же жизни и размножения большинству видов гидробионтов требуется диапазон значений рН: 6-8.
Аквариум — это живой организм, и рН в нем постоянно меняется, поэтому его обязательно необходимо регулярно отслеживать. Водородный показатель — нестабильная величина.
На уровень водородного показателя в биотопе влияют такие факторы как, исходные данные воды, наличие углекислоты, которая образуется вследствие выделений рыб и других органических остатков (например, несъеденного корма), количество растений, частота подмен воды, интенсивность и длина светового дня и другие факторы.По этим причинам, в целом, значение рН в аквариуме обычно со временем понижается (вода киснет). И при отсутствии других внешних факторов, за месяц может упасть на 1,5-2 градуса.
Кроме того, показатель рН может и колебаться в течение суток: если он сильно колеблется, то это очень опасно.Например, в аквариумах с изначально мягкой (кисловатой) водой и низкой карбонатной жесткостью (буферностью) при ярком солнечном освещении может резкое изменение рН в щелочную сторону. Последствия для рыб могут быть катастрофическими: вплоть до летального исхода. Погибнуть от такого могут и растения.Усиливают ежесуточные колебания водородного показателя слабая аэрация и фильтрация аквариума.
колеблется, то это очень опасно.Например, в аквариумах с изначально мягкой (кисловатой) водой и низкой карбонатной жесткостью (буферностью) при ярком солнечном освещении может резкое изменение рН в щелочную сторону. Последствия для рыб могут быть катастрофическими: вплоть до летального исхода. Погибнуть от такого могут и растения.Усиливают ежесуточные колебания водородного показателя слабая аэрация и фильтрация аквариума.
Резкое изменение значения рН называют еще буферным опрокидыванием.
Это можно сравнить разве что с человеком, которого посадили на супер скоростной самолет, и катают из одной точки планеты в другую, при этом, высаживая в противоположных географических зонах: пожил один день в Антарктиде, и сразу же на пару дней — в пустыню Сахара, а после нее — под проливные тропические дожди в Индию.Понятно, что ни один организм не успеет приспособиться к таким резко меняющимся условиям окружающей среды.
Водородный показатель в аквариуме можно и нужно замерять, а также влиять на него, меняя в большую или меньшую сторону.
Разные виды рыб имеют различную устойчивость к колебаниям показателя рН в биотопе, также как и разные рыбы, внутри одного вида, по состоянию своего здоровья и иммунитета, имеют различную устойчивость к колебаниям этого показателя.

www.aqualover.ru
Водородный показатель
 Водородный показатель воды — это всем известный параметр pH, который характеризуется активностью ионов водорода и гидроксида и определяет щелочную или кислую реакцию воды. Обычно, химическая формула воды записывается как h3O, но существует и другой способ рассмотреть эту формулу - НОН, где положительно заряженный ион водорода H+ связан с отрицательно заряженным ионом гидроксида OH- . Это означает, вода имеет свойства как кислой, так и щелочной природы, которые по существу компенсируют друг друга. H+ + (OH)- = НОН = h3O = вода.
Водородный показатель воды — это всем известный параметр pH, который характеризуется активностью ионов водорода и гидроксида и определяет щелочную или кислую реакцию воды. Обычно, химическая формула воды записывается как h3O, но существует и другой способ рассмотреть эту формулу - НОН, где положительно заряженный ион водорода H+ связан с отрицательно заряженным ионом гидроксида OH- . Это означает, вода имеет свойства как кислой, так и щелочной природы, которые по существу компенсируют друг друга. H+ + (OH)- = НОН = h3O = вода.
Уровень pH измеряется по шкале от 0 до 14. Среда считается кислой, если pH находится в диапазоне от 0 до 7, где 0 - наиболее кислая реакция. Щелочные значения находятся в диапазоне от 7 до 14. Считается, что рН 7, является нейтральным (например, дистиллированная вода). Шкала рН, как и шкала Рихтера, является логарифмической. Это означает, что каждый шаг (например, от 5 до 6) представляет собой изменение в десять раз рН вещества. Реакция воды с рН 5, в 10 раз более кислая, чем воды с рН 6.
Считается, что рН чистой воды равен 7, но питьевая вода и вода из природных источников демонстрирует различный диапазон рН, поскольку она содержит растворенные минералы и газы. Показатель рН воды из поверхностных источников обычно составляет от 6,5 до 8,5, в то время как рН грунтовых вод находится в диапазоне от 6 до 8,5.
Вода с рН менее 6,5 считается кислой. Эта вода естественно мягкая и, как правило, вызывает коррозию. Она может содержать ионы металлов, таких как медь, железо, свинец, марганец и цинк. Ионы металлов могут быть токсичными и придавать воде металлический привкус. Кислая вода может вызывать выщелачивание металлов из труб и арматур и вызвать эстетическое проблемы, такие как окрашивание белья или сине-зеленые пятна на раковинах и сливах.
Вода с рН выше, чем 8,5 считается щелочной. Часто эта вода жесткая, содержащая ионы, которые могут образовывать накипь в трубах и бытовых приборах, снижать эффективность электрических водонагревателей и придавать воде характерный привкус.
Природные факторы, влияющие на рН:
- Карбонат кальция – может вступать в реакцию с ионами водорода или ионами гидроксида, которые изменяют рН воды. Присутствие этого минерала в воде не изменяет рН значительно, но служит буфером для различных кислот, попавших в воду по пути ее следования.
- Сосновые или еловые леса - разложения игл этих деревьев добавляет кислотность в почву, а также влияет на кислотность близлежащих водных потоков.
- Грунтовые воды, просачиваясь через почву, минерализуются, и рН может быть несколько выше (7-8).
- Осадки, выпадая, растворяют в себе газы, содержащиеся в воздухе, такие как диоксид углерода, и образуют слабую кислоту. Естественная среда дождя и снега слегка кисла. Осадки обычно имеют рН между 5 и 6.
- Время года - осенью, когда листья и травы попадают в воду и разлагаются, уровень рН более кислый.
- Фотосинтез и дыхание - в процессе фотосинтеза растения удаляют углекислый газ из воды. Это может повысить рН в воде. Поскольку для фотосинтеза необходим солнечный свет, рН воды будет самым высоким в середине дня, и низким перед восходом солнца.
Человеческие факторы, которые влияют на рН:
- Кислотные дожди - серная кислота (производится путем промышленного сжигания угля) и азотная кислота (содержится в автомобильных выхлопах) являются главными факторами, способствующими выпадению кислотных дождей.
- Источники загрязнения - сброс промышленных загрязнителей непосредственно в воду может повлиять на рН воды. Изменение рН воды может изменить поведение других химических веществ в воде. Химическое изменение состава воды может повлиять растения и животных, обитающих в воде. Например, аммиак при попадании в воду с более кислой средой безвреден для рыб. Однако, когда рН увеличивается аммиак становится токсичным. Кроме того, более низкое значение рН будет способствовать более легкому растворению в воде тяжелых металлов, таких как кадмий, свинец и хром. Многие тяжелые металлы становятся токсичными при растворении в воде.
- Добыча - дождевая вода, которая имеет естественно кислую среду, проходя через почву, содержащую различные минералы, нейтрализуется. Добыча и истощение почвенных ресурсов может способствовать попаданию кислот в водный источник и в ряде случаев рН может достигать токсичных уровней.Воздействие высоких значений рН приводит к раздражению глаз, кожи и слизистых оболочек. Раздражение глаз и обострение кожных заболеваний чаще связывают с уровнем рН больше, чем 11. У чувствительных людей может возникнуть проблемы с желудочно-кишечном трактом. Воздействие воды с низким значением рН также может привести к подобным эффектам. Значение рН ниже 4, вызывает покраснение и раздражение глаз. Уровень рН ниже 2,5, вызывает необратимые и обширные повреждения эпителия. Кроме того, поскольку рН может влиять на степень коррозии металлов, а также эффективности дезинфекции, он может иметь и косвенное влияние на здоровье. Хотя рН обычно не имеет прямого влияния на потребителей воды, это один из самых важных эксплуатационные параметров качества воды. Пристальное внимание к контролю уровня рН необходимо на всех этапах водоподготовки для обеспечения удовлетворительного обеззараживания и качества воды. Для эффективной дезинфекции с хлором, рН должно быть предпочтительно меньше, чем 8. Уровень рН воды при входе в систему водораспределения необходимо контролировать, чтобы минимизировать коррозию водопроводных магистралей и труб в системах хозяйственно-питьевого водоснабжения. Невыполнение этого требования может привести к загрязнению питьевой воды и к отрицательному воздействию на ее вкус, запах и внешний вид.
Значение рН воды может быть измерено с помощью трех различных методов, рН-метра с зондом, лакмусовой бумаги, специальных комплектов. Причину изменения уровня рН (чрезмерное содержание кислотных или щелочных ионов) помогут определить лабораторные исследования.
Используют два метода нейтрализации рН: фильтры, нейтрализующие кислоту, и насосы с системой впрыскивания химического раствора нейтрализующего кислоту. Нейтрализующий кислоту фильтр использует кальцит или карбонат кальция (известняк) для нормальной коррекции рН, но может также включать смесь оксид магния и кальцит, если рН является очень низким. Так как вода поглощает эти минералы, проходя через фильтр, щелочность и жесткость воды будет увеличиваться. Жесткость воды легко устраняется с помощью процесса ионного обмена. Вариант с насосом больше подходит для скважин, в этом случае вода смешивается в специальном баке с кальцинированной содой. Насос вводит химический раствор с высоким рН в систему бытового трубопровода, где он реагирует с водой с низким рН и нейтрализует рН. Необходимо отметить, что нейтрализация рН с помощью кальцинированной соды немного увеличивает содержание натрия в воде, что может вызвать некоторые проблемы со здоровьем у людей, поддерживающим рацион с пониженным содержанием натрия. При выборе метода нейтрализации рН необходимо учитывать уровни общего содержания в воде растворенных твердых веществ и диоксида углерода. Например, фильтры, нейтрализующие кислоту, не столь эффективны в повышении рН, когда вода содержит чрезмерные уровни растворенных твердых веществ или двуокиси углерода. Если уровень рН воды также больше, чем 8,5, вы можете уменьшить последствия чрезмерной щелочной среды, установив либо специальное ионообменное устройство, предназначенное для снижения щелочности, или насосную систему, которая впрыскивает слабый раствор кислоты. Эта процедура является более сложной и требует подробной консультации со специалистом.
filteropt.ru









