Строение молекул воды и их ассоциаты. Строение и функции молекулы воды
|
Вода — одно из наиболее замечательных веществ, известных человеку. Она — единственное природное вещество, встречающееся в больших количествах в трех состояниях: твердом, жидком и газообразном. Из всех распространенных жидкостей вода — наиболее универсальный растворитель, жидкость с максимальными величинами поверхностного натяжения, диэлектрической постоянной, теплоты парообразования и наивысшей (после аммиака) теплотой плавления. В отличие от большинства веществ вода, замерзая при низком давлении, расширяется. Эти специфические свойства воды связаны с особым строением ее молекулы. Химическая формула воды Н20 обманчиво проста. В молекуле воды ядра атомов водорода расположены несимметрично по отношению к ядру атома кислорода и электронам. Если атом кислорода находится в центре тетраэдра, центры масс двух атомов водорода будут в углах тетраэдра, а центры зарядов двух пар электронов займут два других угла (рис. 3.1). Таким образом, четыре электрона располагаются на возможно наибольшем расстоянии как от ядра атома кислорода, так и от ядер атомов водорода, при котором они еще притягиваются ядром атома кислорода. Другие шесть электронов молекулы воды расположены так: четыре электрона находятся в положении, обеспечивающем химическую связь между ядрами атомов кислорода и водорода, а два других расположены вблизи ядра атома кислорода. Ассиметричное расположение атомов молекулы воды обусловливает неравномерное распределение электрических зарядов в ней, что делает молекулу воды полярной. Такое строение молекулы воды обусловливает притяжение молекул воды друг к другу в результате образования между ними водородных связей. Расположение атомов водорода и кислорода внутри образовавшихся агрегатов молекул воды сходно с расстановкой атомов кремния и кислорода в кварце. Это относится ко льду и в меньшей мере к жидкой воде, агрегаты молекул которой всегда находятся в стадии перераспределения. При охлаждении воды ее молекулы группируются в агрегаты, которые постепенно увеличиваются и становятся все более устойчивыми по мере приближения к температуре 4° С, когда вода достигает максимальной плотности. При этой температуре вода еще не имеет жесткой структуры и наряду с длинными цепочками ее молекул существует большое количество отдельных молекул воды. При дальнейшем охлаждении цепочки молекул воды растут за счет присоединения к ним свободных молекул, в результате чего плотность воды уменьшается. Когда вода превратится в лед, все ее молекулы входят в более или менее жесткую структуру в виде незамкнутых цепочек, образующих кристаллы.  Рис. 3.1. Строение молекулы воды. Взаимное проникновение атомов водорода и кислорода. Ядра двух атомов водорода и две пары электронов находятся в углах тетраэдра: в центре расположено ядро атома кислорода. Высокие величины поверхностного натяжения и теплоты парообразования воды объясняются тем, что для отделения молекулы воды от группы молекул требуется относительно большая затрата энергии. Стремление молекул воды устанавливать водородные связи и их полярность объясняют необычно высокую растворяющую способность воды. Некоторые соединения, такие, как сахара и спирты, удерживаются в растворе благодаря водородным связям. Соединения, обладающие высокой степенью ионизации вводе, например хлористый натрий, удерживаются в растворе вследствие того, что ионы с противоположными зарядами нейтрализуются группами ориентированных молекул воды. Другая особенность молекулы воды состоит в том, что как атомы водорода, так и атомы кислорода могут иметь различные массы при одинаковом заряде ядра. Разновидности химического элемента с различными атомными весами называются изотопами этого элемента. Молекула воды обычно образуется водородом с атомным весом 1 (Н1) и кислородом с атомным весом 16 (О16). Более 99% атомов воды относится к этим изотопам. Кроме того, существуют следующие изотопы: Н2, h4, О14, О15, О17 О18, О19. Многие из них скапливаются в воде в результате ее частичного испарения и вследствие своей большой массы. Изотопы Н3, О14, О15, О19 радиоактивны. Наиболее распространен из них тритий Н3, образующийся в верхних слоях атмосферы под воздействием космических лучей. Этот изотоп накопился также в результате ядерных взрывов за последние несколько лет. На основании этих и других фактов относительно изотопов путем анализа изотопного состава воды можно частично раскрыть историю некоторых природных вод. Так, содержание тяжелых изотопов в поверхностных водах свидетельствует о длительном испарении воды, которое происходит, например, в Мертвом море, Большом Соленом озере и в других бессточных водоемах. Повышенное содержание трития в подземных водах могло бы означать, что эти воды метеорного происхождения с большой скоростью циркуляции, потому что период полураспада этого изотопа всего лишь 12,4 лет. К сожалению, изотопный анализ слишком дорог и по этой причине не может быть широко применен в исследованиях природных вод. В табл. 3.1 приведены некоторые данные об изотопах водорода и кислорода. Таблица 3.1 Относительная распространенность и периоды полураспада изотопов водорода и кислорода
|
Строение молекулы воды
К.х.н. О.В. Мосин
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В АНАЛИЗЕ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ
Если нам захочется посмотреть, как устроена молекула воды, то придется в первую очередь вспомнить ее состав. Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода h3O (формула воды). В молекуле воды главное действующее лицо - атом кислорода. Вспомним его энергетическую диаграмму (рисунок слева):
Два неспаренных р-электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s-электронами атомов водорода.
Рис. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода (рисунок справа):
Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды которую можно условно изобразить еще так:
Рис. Молекула воды имеет угловую форму (ниже слева)
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород - кислород не прямой (90°), а немного больше - 104,5°. Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода - положительный. Поэтому и вся молекула воды тоже попадает в отряд "химических полярников" - веществ, молекулы которых представляют собой электрические диполи.
Строение молекулы воды Н2О можно проанализировать с помощью метода молекулярных орбиталей (МО). Схема молекулярных орбиталей молекулы воды приведена ниже.
Рис. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Для построения схемы молекулярной орбитали молекулы воды Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (Подробнее см. Г.Грей "Электроны и химическая связь",М., изд-во "Мир", 1967, с.155-62 и G.L.Miessier, D.A.Tarr, "Inorganic Chemistry", Prantice Hall Int.Inc., 1991, p.153-57).
В формировании суммарной молекулярной орбитали воды принимают участие отдельные атомные орбитали водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад атомных орбиталей атомов водорода и кислорода в образование общей молекулярной орбитали молекулы воды разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях атомных орбиталей. Взаимодействие (перекрывание) 1sатомной орбитали водорода, 2sи 2рzатомной орбитали кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей молекулярной орбиталей.
Рис. Перекрывание 2s(а), 2px- (б) и 2pя(в) орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Из этих данных и умозаключений можно сделать следующие выводы.
1. Молекула Н2О диамагнитна.
2. Электроны на связывающих 2а1 и 1b1 орбиталях обеспечивают связи ОН, а на несвязывающих (3а1 и 1b2) орбиталях соответствуют свободным электронным парам в молекуле Н2О, как это описывается в рамках метода валентных связей.
3. Принципиальным отличием метода молекулярных орбиталей от метода валентных связей является разная энергия ионизации занятых молекулярных орбиталей, составляющая (в эВ) 27.3 (2а1), 16.2 (1b1), 14.5 (3а1) и 12.6 (1b2), соответственно.
4. Метод молекулярных связей (в отличие от метода валентных связей) позволяет оценить разницу в энергиях молекулярных орбиталей. В частности, существенным является различие в энергии двух несвязывающих орбиталей 3а1 и 1b2. Это связано с различной природой орбиталей - 1b2 локализована на атоме кислорода, тогда как 3а1 образована с участием атомной орбитали водорода и кислорода и не является локализованной. Локализация электронов на 1b2 молекулярной орбитали приводит к тому, что отрицательный заряд в молекуле Н2О сосредоточен вблизи атома кислорода, а положительный - вблизи атомов водорода. Таким образом, молекула Н2О оказывается полярной (дипольный момент μ = l. q = 1.84D). Это соответствует и простым соображениям электроотрицательности: связывающие электроны смещаются к более электроотрицательному атому.
Так как у молекулы Н2О в образовании связей принимают в основном участие 2р-орбитали кислорода и 1s-орбитали водорода, то можно ожидать, что угол НО- Н должен быть близким к 90о. Однако из эксперимента следует, что этот угол равен 104.5о. Причина такого различия заключается в том, что этот угол соответствует минимуму энергии. Согласно квантово-механическим расчетам, энергия молекулы зависит не только от энергии молекулярных орбиталей и числа электронов на них, но и от валентного угла НО- Н. В приближении метода валентных связей увеличение угла НО- Н от 90о (характерного для взаимодействия р-орбиталей) до 104.5о связано с взаимным отталкиванием положительно заряженных атомов водорода.
При переходе от Н2О к другим двухатомным молекулам Н2S, h3Se и h3Te диаграммы молекулярных орбиталей изменяются, что обусловлено увеличением энергий исходных АО халькогенов: Е3s = -20.7 эВ; Е3р = -12.0 эВ; Е4s = 20.8 эВ; Е4р = 11.9 эВ. Поэтому растет участие ns-атомных орбиталей халькогена в образовании молекулярных орбиталей. При этом несвязывающий характер орбиталей nb2 сохраняется, а связывающий характер орбиталей 2а1 усиливается. В целом, по мере увеличения энергии атомных орбиталей nsи nруменьшается разность сумм энергий молекулярных и атомных орбиталей, которые характеризуют прочность молекул Н2Э. Вклады nратомных орбиталей атомов халькогенов в энергию молекулярной орбитали уменьшаются, и соответственно понижается локализация электронов на атомах и полярность молекул. Вероятно, благодаря этому уменьшаются валентные углы НЭ- Н в молекулах халькогенов. Именно так, с точки зрения теории молекулярных орбиталей, объясняется понижение устойчивости молекул h3S, h3Sе, h3Te по сравнению с молекулой Н2О.
К.х.н. О.В. Мосин
www.o8ode.ru
Строение молекул воды и их ассоциаты
разное
«Мир чарующий и фантастический», — такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Итак, молекула воды (1h316O) состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
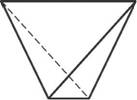
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его — сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, — по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно — в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром O2- (рис. 1.5а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра — ядра O2-. Каждый из оставшихся
А - угол между связями O-H;
Б - расположение полюсов заряда;
|
|
|
Рис. 1.5. Строение молекулы воды |
В - внешний вид электронного облака молекулы воды.
Двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра — протоны — оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким ди - польным моментом — 1,87дебая1. Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.
Во многом благодаря этому, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
В пресных природных водах — речных, озерных — содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном — 18, а в Красном море — около 40 г/л. В среднем в 1 л океанской воды растворено 34...35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно — натрия и кальция), на 10% — из сульфатов (натрия, калия и магния), на 1% — из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) — до 80%. Сульфатов (натрия, кальция и магния) — около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода — до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты — растворимые соединения типа белков, сахаров, спиртов, углеводородов и т. п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
| Дебай — внесистемная единица электрического дипольного момента молекул, обозначается Д. 1Д = 1-10 ед. СГСЭ = 3,33564-10-" Кл-м. |
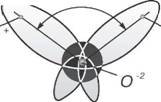
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества»
^ Кислород J Водород
— Химическая связь Водородная связь
|
|
Рис. 1.6. Схема объединения молекул воды
— ассоциаты. Оказывается, полностью соответствует формуле Н20 лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (h30)x.
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
X h3O ~ (h30)x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес - кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоци - атов (рис. 1.6).
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные рои довольно стабильного состава. Пространства между роями заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподоб - ной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры — нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Как идентифицировать оригинальную батарею на iPhone Батарея iPhone 5 – один из ключевых элементов культового гаджета, позволяющий пользователям долгое время оставаться на связи. Речь ищет о литий-ионном аккумуляторе емкостью1440 mAh. …
Сегодня многие владельцы домашних животных не утруждают себя приготовлением классической вареной еды для любимцев, а просто наполняют мисочки пушистиков сухими кормами, которые стали так популярны.
Квалифицированные инженеры, работающие в компании «Дом Экологии», советуют владельцам частных домов либо коттеджей заказать услугу по установке автономной канализации, которая требует минимального обслуживания. Уже многие клиенты, посетившие раздел http://www.osk-ekoline.com.ua/avtonomnaja-kanalizacija-polijetilen.html, смогли …
msd.com.ua
Особенности строения молекулы воды и способы изменения ее свойств
Н. В. ВАСИЛЬЕВАЮжно-Уральский государственный университет, Челябинск
ОСОБЕННОСТИ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ И СПОСОБЫ ИЗМЕНЕНИЯ ЕЕ СВОЙСТВ
Вода является не только наиболее распространенным, не только самым необходимым для жизни, но и одним из наиболее исследованных веществ на Земле. Сложно недооценить влияние воды на качество пищевых продуктов. В состав одних ее вводят для растворения кристаллических веществ, тогда как, являясь основным сырьевым компонентом других, она обусловливает их качество. Содержание воды в продуктах существенно влияет на вкус, питательность и консистенцию продукта. Изменение химического состава, структуры и свойств воды может значительно изменить качество и сохраняемость товаров. Однако на сегодня, не существует единой признанной модели строения воды, которая бы описывала все ее аномальные свойства.
На создание моделей, объясняющих удивительные свойства воды, направляли свои усилия многие ученые. Но общей характерной чертой большинства моделей воды служит недооценка структуры молекулы Н2О и возможной динамики ее изменения в процессе молекулярного взаимодействия.
С современных позиций строения атома электронные облака молекул воды расположены в форме неправильного тетраэдра. Атом кислорода оказывается при этом в центре, а два атома водорода - в противоположных углах одной из граней куба [3]. Межъядерные расстояния О-Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды, две электронные пары образуют ковалентные связи О-Н, а остальные четыре электрона представляют собой две не поделенных электронных пары.
Для объяснения аномальных свойств воды в жидком состоянии учеными созданы различные модели ее структуры. В основе многочисленных моделей жидкая вода рассматривается как кристаллическое вещество (жидкие кристаллы). Упорядоченное (кристаллическое) расположение частиц воды в жидком состоянии доказано экспериментально [12].
Представляет особый интерес модель структуры жидкой воды в виде мерцающих кластеров, состоящих из соединенных водородными связями молекул, плавающих в более или менее «свободной» воде. Кластер – это надмолекулярный комплекс, содержащий множество молекул.
Кластеры постоянно существуют в текучей жидкости, непрерывно образуясь и разрушаясь в соответствии со случайными тепловыми изменениями в микроучастках жидкости. Американские ученые определили время полужизни кластера как 10-10 - 10-11 с, что соответствует времени релаксационных процессов в воде. Это время в 100-1000 раз больше периода молекулярных колебаний.
Возникновение водородной связи в молекуле воды объясняется свойством атома водорода взаимодействовать с сильно электроотрицательным элементом, например с кислородом другой молекулы. Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной оболочки. Поэтому он не испытывает отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается и может вступить с ней во взаимодействие [3].
В классической теории структуры воды существование максимума плотности при t = 4°С объясняется тем, что при этой температуре преобладающая часть молекул воды связана в кварцеподобную структуру, а при других температурах они имеют тридимитоподное кристаллическое строение, соответствующее меньшей плотности [4].
Во все времена ученые пытались изучить аномальные свойства воды и различные способы их изменений. При этом было установлено что, подвергаясь различным внешним воздействиям: температура, давление и др., вода может приобрести совершенно новые свойства. Особенно ярко это проявляется при действии на воду различных излучений. Существуют различные способы изменения свойств воды. Обычно эти процессы называют активацией.
Все методы активации можно свести к энергетическому воздействию на молекулы воды. В литературе не существует единой теории активационных процессов. Обычно каждый из них рассматривается в той из областей науки и техники, где он используется. Выделяют наиболее распространенные методы активации: магнитная, механическая, ультразвуковая, термическая, активация наносекундными электромагнитными импульсами и электрохимическая.
Магнитная обработка воды заключается в пропускании потока воды через магнитное поле. В общем случае действие магнитного поля на движущуюся воду сводится к действию сил Лоренца на заряженные частицы. Отмечается, что действие магнитных полей с напряженностью 105 - 106 А/м дает энергетическое воздействие порядка 5•10-8 – 5•10-9 Дж [5].
Существующие установки для омагничивания воды обычно включают и различные способы механического воздействия на воду: перемешивание, распыление, многократное прохождение через магнитное поле, смену направления действия поля и т.д. Очевидно, что в этих установках происходит и механическое воздействие на воду. Поэтому более точное название метода должно быть магнитно-механический способ активации.
Процесс омагничивания воды не имеет признанной теории и результаты обработки не всегда повторяются. Возникшие новые свойства воды часто не имеют объяснения.
Значительное количество исследований посвящено изучению влияния магнитных полей на изменение свойств воды. Рассмотрим некоторые из них.
В работе [6] отмечается зависимость режима магнитной обработки воды от её химического состава, скорости движения на участке омагничивания и конструктивных особенностей омагничивающих аппаратов.
В. И. Миненко, С. М. Петров, М. Н. Минц [9, 10] считают, что магнитная обработка воды приводит к изменению её структуры, поверхностного натяжения, вязкости, электросопротивления, магнитной восприимчивости, диэлектрической проницаемости и других физических свойств.
Под действием магнитного поля изменяются свойства чистой воды и водных растворов, но наибольшее влияние магнитное поле оказывает на ионы, магнитная восприимчивость которых значительно повышает восприимчивость молекул воды. На изменение свойств воды под влиянием магнитных полей указывается в работах [9, 10].
Многие исследователи [7, 8] считают, что магнитное поле оказывает влияние на структуру воды. Некоторые из них предполагают, что эти процессы происходят в результате изменений водородных связей между молекулами воды.
В работах Н. Н. Непримерова, У. Ш. Ахмерова [14] развивается идея о влиянии магнитного поля на воду через изменение её «ядерной структуры». Предполагается, что магнитная обработка воды изменяет ориентацию ядерных спинов водорода в молекулах воды, которая может быть параллельной (ортомодификация) и антипараллельной (парамодификация). Энергия перехода одной модификации воды в другую в сотни раз меньше, чем энергия, необходимая для разрыва связей. Авторы считают энергетически не обоснованными объяснения свойств омагниченной воды изменениями в системе водородных связей или переориентацией молекул, так как для осуществления этих процессов необходима энергия в несколько тысяч калорий на моль.
Опубликованные данные настолько противоречивы, что их зачастую трудно систематизировать.
В настоящее время выделяют четыре группы гипотез процесса омагничивания воды [5]: влияние на карбонатный состав воды, влияние на общий солевой состав, влияние на структуру воды, влияние на состояние водной системы в целом.
Ни одна из рассматриваемых гипотез не имеет строгого теоретического обоснования и не дает оценок изменения свойств омагниченной воды, которые получены в экспериментах. Также недостатком способа омагничивания воды является отсутствие разделения свойств получаемой воды и разнородность получаемых результатов.
Механическая активация может быть двух видов: статическая и динамическая. Статическая активация связана с повышением давления. Ее вероятные последствия - уменьшение межмолекулярных пустот, увеличение времени жизни кластеров и их количества. Динамическая активация (перемешивание), наоборот, приводит к быстрому разрушению кластеров и уменьшению их количества. Динамическая активация имеет наибольшее распространение в природе при падении дождевых капель [12]. Механическая активация не получила широкого применения и в литературных источниках имеется немногочисленный экспериментальный материал для данного способа активации.
Обработка воды ультразвуковыми колебаниями также может быть отнесена к механической динамической активации. Когда происходит импульсное или периодическое механическое воздействие на воду, в результате чего в ней возникают ультразвуковые колебания. В литературе описываются различные эффекты, которые происходят в воде при обработке ее ультразвуком. Но недостатком данного способа активации является недолговечность используемых установок.
Термическая активация приводит к увеличению скорости движения молекул, более быстрому разрушению кластеров. Если в воде имеются примеси других веществ, то они более быстро реагируют между собой и образующимися в воде частицами.
Вопросами термической активации воды посвящено достаточно большое количество работ, но ни одна из рассматриваемых гипотез не имеет строгого теоретического обоснования и не дает оценок изменения свойств полученной воды.
Использование наносекундных электромагнитных импульсов для активации воды является новым способом, что свидетельствует о недостаточной изученности происходящих процессов. Предложение об использовании несинусоидальных электромагнитных импульсов для активации водных растворов впервые было сделано в работе [13].
Характерной особенностью несинусоидального электромагнитного поля является использование однополярных импульсов тока. Это приводит к отсутствию осциллирующих колебаний в излучаемом поле. Следствием этого является наличие характерного пространственно-временного направления действия силы за время одного импульса.
Сравнение экспериментальных результатов приведенных в литературе показывает, что при облучении воды наносекундными электромагнитными импульсами изменяются ее физические и химические характеристики. Характер изменений - уменьшение удельного электрического сопротивления и увеличение диэлектрической постоянной - совпадают с их изменениями при радиолизе воды. Это позволяет сделать заключение о возникновении гидратированных электронов при облучении воды электромагнитными импульсами [13]. Недостатком данного метода является высокая стоимость оборудования, применяемого для обработки воды.
В процессе электрохимической активации за счет униполярного электрохимического воздействия происходит направленное безреагентное изменение рН, окислительно-восстановительного потенциала и других физико-химических параметров растворов или воды в диапазонах часто более широких, чем это достижимо при химическом регулировании. Изученные литературные данные свидетельствуют о воспроизводимости полученных результатов. В настоящее время авторами [1, 2] приводится ряд установок для получения анолита и католита, широко описаны свойства получаемой воды, но основные параметры обработки воды остаются неизвестными.
Преимуществом данного метода является невысокая величина затрат на изготовление установки для обработки воды, незначительные энергозатраты, а также наличие строгого теоретического обоснования и оценок свойств электрохимически активированной воды и повторяемость получаемых результатов. Нельзя не указать положительную сторону метода разделение анолита и католита при активации воды, а, следовательно, и их свойств.
Остальные способы активации (магнитная, механическая, термическая, наносекундные электромагнитные импульсы) не имеют четкой теоретической базы и не нашли широкого применения.
Вопрос о природе метастабильного состояния воды и разбавленных водных растворов после электрохимического воздействия является одним из центральных для исследования механизма процессов активации и до настоящего времени не решен окончательно, что отнюдь не мешает широкому практическому использованию электрохимически активированных жидкостей для производства пищевых продуктов.
Литература
1. Бахир В. М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. – М.: ВНИИИМТ, 1999. – 84 с.
2. Прилуцкий В. И., Бахир В. М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия: - М.: ВНИИИМТ АО НПО «Экран», 1997. – 228 с.
3. Возная Н. Ф. Химия воды и микробиология: Учеб. пособие для вузов. - М.: Высш. Школа, 1979. –340 с.
4. Синюков В. В. Вода известная и неизвестная. - М.: Знание, 1987. – 176 с.
5. Миненко В. И. Электромагнитная обработка воды в теплоэнергетике. – Харьков: ХГУ, 1981. – 96 с.
6. Голгер Ю. Я., Классен В. И. К термодинамической теории влияния структурных изменений жидкости на смачивание и флотационное прилипание. // Тезисы докладов ко второму Всесоюзному семинару «Вопросы теории и практики магнитной обработки воды», М.,1969.
7. Иванова Г. М., Махнев Ю. М. Изменение структуры воды и водных растворов под действием магнитного поля. // Тезисы докладов ко второму Всесоюзному семинару «Вопросы теории и практики магнитной обработки воды», М.,1969.
8. Кисловский Л. В. Метастабильные структуры в водных растворах. // Тезисы докладов ко второму Всесоюзному семинару «Вопросы теории и практики магнитной обработки воды», М.,1969.
9. Миненко В. И., Петров С. М., Минц М. Н. Магнитная обработка воды. Харьков, Харьковское кн. Издательство, 1962. – 125 с.
10. Миненко В. И., Петров С. М. О физико-механических основах магнитной обработки воды. «Теплотехника», 1962, №9.
11. Жук Н. П. Курс теории коррозии и защиты металлов. М.: Металлургия, 1976. - 472 с.
12. Зацепина Г. Н. Физические свойства и структура воды. – 2-е изд., перераб. – М.: Изд-во МГУ, 1987. – 171с.
13. Разработка теории и исследование возможностей создания технических устройств для излучения электромагнитных волн на основе сред с заряженными кластерами. Отчет по НИР № гос.рег. 01.960.009493, Челябинск, ЧГТУ.
14. Непримеров Н. Н., Ахмеров У. Ш., Бильдюкевич А. Л. К вопросу о механизме действия магнитных полей на водную систему. // Тезисы докладов и сообщений Всесоюзного научного семинара по проблеме «Магнитная обработка воды в процессах обогащения полезных ископаемых», М., 1966.
l.120-bal.ru