Строение и свойства воды, её функции в растении. Строение воды функции и строение
Строение молекулы воды и её роль в клетке
Строение молекулы воды и её роль в клетке.
Вода – один из важнейших факторов внешней среды, от которого зависит здоровье людей
Самое распространённое вещество на Земле - вода. Её содержание колеблется в широких пределах: в клетках эмали зубов вода составляет по массе около 10%, а в клетках развивающегося зародыша – более 90%.
В состав человеческого тела входит около 65% воды. Это значит, что во взрослом человеке, который в среднем весит 70 кг, примерно 46 кг приходится на воду. Особенно богаты ею ткани молодого организма: в теле трехмесячного человеческого плода – 95% воды, у новорожденного ребенка – 70% (многие ученые одной из причин старения считают понижение способности белков организма связывать большие количества жидкости). Вода входит в состав всех органов и тканей человека; даже такая плотная ткань, как кость, содержит около 20% воды, в печени, мышцах, мозге – 70–80%, в крови – около 80%.
Организм человека находится в состоянии постоянного обмена веществ с окружающей его средой. Различные неорганические и органические вещества непрерывно поступают в организм, претерпевают там многообразные превращения, а «отработанные», ненужные выводятся наружу, в окружающую среду.Обмен веществ – один из главных признаков жизни. Существуют разные виды обмена веществ – углеводный, белковый, жировой и т.д. Обмен веществ включает в себя, конечно, и обмен воды. Совокупность процессов всасывания воды в желудке и кишечнике, распределение ее между тканями организма и выделение через почки, легкие, кожу – в этом и состоит сущность водного обмена.Клетки и межклеточные вещества живых тканей представляют собой сложные системы, отдельные части которых содержат в качестве необходимого компонента воду. Почему же именно ее?Вода – прекрасный растворитель для множества веществ живого организма, среда, в которой протекает большинство химических реакций, связанных с обменом веществ. При ее участии, с помощью водного обмена, происходит терморегуляция, т.е. регулируются процессы теплоотдачи и теплопродукции. С водой удаляются из организма ненужные ему продукты обмена, иногда микробы, их токсины и т.п.Многие ученые считают, что человеческая жизнь, в известном смысле, представляет собой борьбу за воду. Почему же вода обладает такими свойствами? Это можно объяснить, исходя из строения молекулы воды.
Н2О – молекулярная формула,Н–О–Н – структурная формула, – электронная формула, характеризующая ковалентную полярную связь.
– электронная формула, характеризующая ковалентную полярную связь.
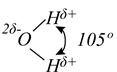
Молекула воды имеет угловое строение: представляет собой равнобедренный треугольник с углом при вершине 104,5°.Молекулярная масса воды в парообразном состоянии равна 18 г/моль. Однако молекулярная масса жидкой воды оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, вызванная водородными связями. При замерзании вода расширяется (так как образуется много водородных связей), но лед легче воды, плавает на её поверхности, самая «тяжелая вода» при температуре +40 , что спасает жизнь водным обитателям зимой.

Молекула полярна: кислородный атом несёт частичный отрицательный заряд, а два водородных – частично положительные заряды. Это делает молекулу воды диполем. Поэтому при взаимодействии молекул воды между ними устанавливаются водородные связи, которые влияют на физические свойства воды.Из-за высокой полярности молекул вода является растворителем других полярных соединений, не имея себе равных. В воде растворяется больше веществ, чем в любой другой жидкости. Именно поэтому в водной среде клетки осуществляется множество химических реакций. Вода растворяет продукты обмена веществ и выводит их из клетки и организма в целом.
По отношению к воде различают:
Гидрофильные вещества – хорошо растворимые в воде вещества.
Гидрофобные вещества – плохо растворимые в воде вещества.
Вода обладает большой теплоемкостью, т.е. способностью поглощать теплоту. При минимальном изменении ее собственной температуры выделяется или поглощается значительное количество теплоты. Благодаря этому она предохраняет клетку от резких изменений температуры. Поскольку на испарение воды расходуется много теплоты, то, испаряя воду, организмы могут защищать себя от перегрева (например, при потоотделении).Вода обладает высокой теплопроводностью. Такое свойство создает возможность равномерно распределять теплоту между тканями тела.Вода является одним из основных веществ природы, без которого невозможно развитие органического мира растений, животных, человека. Там, где она есть, – есть жизнь.
Задание №2
Работая с текстом, найдите ответы на вопросы
1.Химическая формула воды –
2.Структурная формула -
3.Электронная формула воды
4.Вид химической связи
5.Число сигма связей
6.Угол связи в молекуле воды
7.Диполь –
8.Гидрофильные и гидрофобные вещества
9.Высокая теплопроводность и теплоемкость объясняется
10.Самая «тяжелая вода» при температуре
11.Биологические функции воды в клетке.
gigabaza.ru
Строение и свойства воды, её функции в растении. — КиберПедия
Вода является основным компонентом большинства растительных клеток и тканей. Содержание воды в клетках варьирует в зависимости от типа клеток и физиологических условий. Например, в корне моркови содержится около 85 % воды, тогда как молодые листья салата на 95 % состоят из воды.
В некоторых сухих семенах и спорах содержание воды составляет всего лишь 10 %; однако, для того чтобы они стали метаболически активными, содержание воды в них должно существенно увеличиться.
Вода является средой, в которой происходит диффузия растворенных соединений по клеткам растения; представляет собой вещество, необычайно удобное для регуляции температуры; служит растворителем необходимым для протекания многих биохимических реакций; наконец, вода довольно мало сжимаема при давлениях, существующих в организме, что подчеркивает ее роль в поддержании структуры растения.
Минеральные вещества, необходимые для роста, и органические соединения, синтезируемые в ходе фотосинтеза – все они транспортируются по растению в виде водных растворов. У активно растущих растений существует непрерывный водный поток из почвы через тело растения к листьям, где вода испаряется в основном через устьица.
Вода представляет собой один из необходимых метаболитов, т.е. непосредственно участвует в метаболизме. Она служит источником кислорода, выделяемого в ходе фотосинтеза, и водорода, используемого для восстановления углекислого газа. При образовании АТФ – важного макроэргического соединения – из АДФ и фосфата происходит отщепление воды, иными словами, подобное фосфорилирование есть не что иное, как процесс дегидратации, происходящий в водном растворе в биологических условиях; вода участвует в реакциях гидролиза. Таким образом, знание уникальных свойств воды имеет громадное значение для общего понимания физиологии растений.
Если оба атома водорода заменить на атомы дейтерия (2Н), то мы получим тяжелую воду, или окись дейтерия с молекулярной массой 20.
В воду можно также ввести атом трития (3Н), который радиоактивен и имеет период полураспада 12,4 г. Такая вода оказалась полезным инструментом в изучении скорости ее диффузии в тканях растений. Возможно пометить воду замещая обычный изотоп воды 16О на тяжелый изотоп 18О. Этот тип метки был использован для доказательства того, что кислород, выделяемый в ходе фотосинтеза, происходит из воды, а не из углекислого газа.
Физические свойства воды. Без воды жизнь на нашей планете не могла бы существовать. Вода не только необходимый компонент живых клеток, но для многих еще и среда обитания.
Важное свойство воды – ее полная прозрачность для лучей видимой части спектра, что позволяет солнечным лучам достигать хлоропластов, находящихся в клетках листьев, а также растений погруженных в толщу воды.
Свойства воды необычны и связаны главным образом с малыми размерами молекул, с полярностью и со способностью последних соединяться друг с другом водородными связями. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы несет небольшой положительный заряд, а другой – отрицательный. Такую молекулу называют диполем.
Сильные взаимодействия между молекулами воды обусловлены структурой молекул этого соединения. Расстояние между ядром кислорода и ядрами одного из двух атомов водорода равно примерно 0,099 нм, а угол между связями Н-О-Н равен примерно 105о. Атом кислорода обладает сильной электроотрицательностью и стремиться оттянуть электроны от атомов водорода. Благодаря этому на атоме кислорода возникает частично отрицательный заряд (d–) в то время как два атома водорода приобретают положительный заряд (d+). Несущие положительный заряд атомы водорода испытывают электростатическое притяжение со стороны отрицательно заряженных атомов кислорода соседних молекул воды (рис. 4.1).
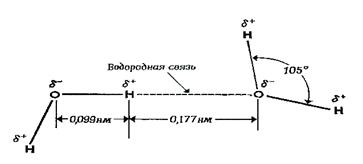 |
| Рис. 4.1. Водородная связь между двумя полярными молекулами воды: δ+ – очень маленький положительный заряд; δ–– очень маленький отрицательный заряд |
Это приводит к возникновению водородных связей между молекулами воды, энергия которых составляет около 4,8 ккал/моль.
В результате такого связывания молекул воды друг с другом возникает большая упорядоченность в водных растворах. Действительно, на отдельных участках жидкая вода приобретает почти кристаллическую структуру, что чрезвычайно важно, поскольку может играть определенную роль во взаимодействиях и ориентации молекул в водных растворах.
Вода обладает большой теплоемкостью. Удельной теплоемкостью воды называют количество теплоты, которое необходимо, чтобы поднять температуру 1 кг воды на 1о С. Большая теплоемкость означает, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры. Объясняется это тем, что значительная часть энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды.
Большая теплоемкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью и опасность нарушения этих процессов от резких отклонений температур грозит им столь сильно. Это очень важно, поскольку вода служит для многих клеток и организмов средой обитания и в этом случае необходимо сохранение постоянства условий произрастания.
Испарение воды требует довольно значительных количеств энергии. Это опять таки объясняется наличием водородных связей. Именно в силу этого температура кипения воды – вещества со столь малыми молекулами – необычайно высока.
Энергия, необходимая молекулам воды для испарения черпается из их окружения. Таким образом, испарение сопровождается охлаждением. Потери тепла при испарении воды являются одним из основных приемов регуляции температуры у наземных растений.
Как известно, вода при температуре 0 оС и ниже переходит в твердое состояние – образуется лед. При этом выделяется значительное количество энергии. Это уменьшает вероятность замерзания содержащей клетками жидкости. С другой стороны, для плавления (таяния) льда необходимо сравнительно большое количество энергии (скрытая теплота плавления есть мера тепловой энергии, необходимая для расплавления твердого вещества). Кристаллики льда весьма пагубны для живых систем, если они образуются внутри клетки.
Плотность воды от +4 до 0 оС понижается, поэтому лед легче воды и в воде не тонет. Вода – единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твердом.
Поскольку лед плавает в воде, он образуется при замерзании сначала на ее поверхности и лишь под конец в придонных слоях. Если бы замерзание шло в обратном порядке, то жизнь в пресноводных водоемах вообще не могла бы существовать.
Еще одной важной физической характеристикой воды является необычайно высокая диэлектрическая проницаемость (D), что является следствием молекулярной структуры. Высокая диэлектрическая проницаемость воды делает электрические силы между растворенными в ней заряженными веществами относительно слабыми.
Диэлектрическая проницаемость воды равна 80,2 при 20 оС и 78,4 при 25 оС. Для неполярной жидкости – гексана D = 1,87. Следовательно, электрическое притяжение для таких ионов, как Na+ и Cl–, в гексане больше (80,2/1,7) в 43 раза, чем в воде. Значительно более сильное притяжение в гексане, чем в воде, уменьшает степень ионизации NaCl по сравнению с диссоциацией этой соли в водном растворе, т. е. вода является хорошим растворителем для заряженных частиц.
Из всех жидкостей самое большое поверхностное натяжение у воды (поверхностное натяжение – результат действующих между молекулами сил на поверхности раздела фаз).
73. Когезия и адгезия, уникальные свойства воды, роль воды в жизни растений.Притяжение между молекулами воды, наблюдаемое в жидкой фазе, обычна называют когезией, и притяжение между жидкой водой и твердой фазой, например стенками тонкой трубочки или капилляра – адгезией. Когда взаимодействие вода – стенка оказывается значительным, говорят, что стенки смачиваются. Напротив, когда межмолекулярные когезионные силы внутри жидкости значительно больше, чем адгезия между жидкостью и материалом стенки, верхний уровень жидкости в капилляре оказывается ниже уровня поверхности свободного раствора. Такое понижение уровня характерно для жидкой ртути в стеклянном капилляре. В случае воды в стеклянных капиллярах или в сосудах ксилемы притяжение между молекулами воды и стенками велико и поэтому жидкость поднимается.
Капиллярное поднятие имеет важное значение для физиологии водообмена растений. Тем не менее, количественные характеристики этого процесса показали, что для поднятия воды до вершины дерева высотой 30 м за счет капиллярной силы, сосуды должны иметь радиус 0,5 · 10-4 см. Эти размеры значительно меньше, чем в действительности. Более того, элементы проводящей системы не соприкасаются с воздушной средой своим верхним концом, и поэтому сосуды ксилемы не подобны капилляру.
Большое количество пор в стенках сосудов ксилемы образуют сетку маленьких извилистых капилляров, которые не только способствуют поднятию воды, но и способствуют поддержанию воды в просветах сосуда. Следовательно, клеточная стенка могла бы действовать как эффективный фитиль, поднимая воду за счет множества пор, хотя фактическая скорость такого движения вверх далеко недостаточна для восполнения воды, которая теряется в процессе испарения.
Значительные величины когезии и адгезии, характерные для молекул воды, играют важную роль в живых клетках, а также, при движении воды по сосудам ксилемы.
Как мы уже отметили в разделе физико-химические свойства протоплазмы, вода в клетке находится в двух состояниях: свободной и связанной (4,5 % от всей воды), причем последняя может быть нескольких видов. В вакуолях вода удерживается относительно низкомолекулярными соединениями (осмотически связанная) и большая часть воды находиться в свободном состоянии. В клеточной стенке часть молекул воды находиться в адсорбированном состоянии на поверхности фибрилл клеточной стенки. Вода тут связывается, главным образом, целлюлозой, гемицеллюлозой, пектиновыми веществами, т. е. коллоидно-связанная вода. Кроме того, в клеточной стенке есть свободная вода (в порах). В цитоплазме имеется свободная, коллоидно- и осмотически связанная вода. Вода, которая находится на расстоянии 1 нм от поверхности белковой молекулы связана сильно. Осмотически связанная вода цитоплазмы – это вода связанная с ионами.
Физиологическое значение свободной и связанной воды разное. С одной стороны, интенсивность физиологических процессов зависит в первую очередь от содержания свободной воды. С другой стороны, наблюдается положительная корреляция между содержанием связанной воды и устойчивостью клеток к неблагоприятным факторам.
На уровне целого растения выделяют конституционную воду(химически связанная), гидрационную, резервную, заполняющую водосборные полости (вакуоли и др. клеточные компартменты) и интерстициальную, которая выполняет транспортные функции в апопласте и проводящих путях.
Одним из главных факторов естественного отбора, влияющих на видообразование, является недостаток воды. С этим фактором связано распространение некоторых растений, имеющих подвижные гаметы. Все наземные растения приспособлены к тому, чтобы добывать и сберегать воду; в крайних своих проявлениях – у ксерофитов – такого рода приспособления представляются подлинным чудом «изобретательности» природы.Функции воды: Обеспечивает поддержание структуры высокое содержание водыпротоплазме).Служит растворителем и средой для диффузии. Участвуют в реакциях гидролиза. Служит средой, в которой происходит оплодотворение.Обеспечивает распространение семян, гамет и т. д.( для растений - Обуславливает осмос и тургесцентность (от которых зависит: рост, поддержание структуры, движения устьиц и т. п.). Обеспечивает транспирацию, а также транспорт неорганических ионов и органических молекул. Обеспечивает прорастание семян – набухание, разрыв семенной кожуры и дальнейшее развитие.
cyberpedia.su
| Раздел 1. Молекулярный уровень организации живого Тема 2. Химическая организация клетки. Элементный состав клеток. Неорганические вещества: вода и минеральные соли 1. Основные вопросы теории Молекулярный уровень организации живого Это самый низкий уровень организации живого, представленный отдельными молекулами органических и неорганических веществ, входящих в состав клеток организма. Жизнь можно представить как организационную иерархию вещества. В живых существах элементы образуют очень сложные органические молекулы, из которых в свою очередь состоят клетки, а из тех – целый организм. Жизнедеятельность всех живых систем проявляется во взаимодействии молекул различных химических веществ. Элементный состав клетки В составе живой природы обнаружено более 80 химических элементов, 27 из них выполняют определенные функции.
Некоторые организмы – интенсивные накопители определенных элементов: бактерии способны накапливать марганец, морские водоросли – йод, ряска – радий, моллюски и ракообразные – медь, позвоночные – железо. Каждый из химических элементов выполняет важную функцию в клетке.
Уникальное строение воды, её свойства и роль в живой природе
Читайте также: ©2015 megaobuchalka.ru Все права защищены авторами материалов. | Почему 3458 студентов выбрали МегаОбучалку... Система поиска информации Мобильная версия сайта Удобная навигация Нет шокирующей рекламы |

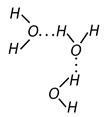 … – водородная связь.
… – водородная связь.










