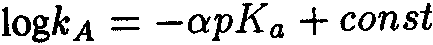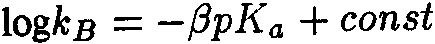Каталитическая функция белков: примеры. Основные функции белков. Каталитическая функция воды
|
Ключевым моментом научного раскрытия жизнеобразующей функции воды является изучение ее роли в химических и более сложных биохимических процессах, составляющих основу жизни. В связи с этим возникает важная и ответственная задача изучения физико-химического механизма, определяющего ранее неизвестное фундаментальное качество воды — ее каталитические свойства. Такой подход впервые научно объясняет разнообразные чудесные влияния разных вод на жизненные процессы. Но что такое каталитические свойства воды, и почему они до сих пор не привлекали пристального внимания исследователей? Традиционно вода считалась всего лишь пассивной средой (чистой либо чем-то загрязненной), в которой варится «бульон жизни». Известно, что вода окружает макромолекулы и биологические ткани и формирует их пространственную структуру, за счет своей высокой полярности она вызывает диссоциацию на ионы растворенных в ней солей, вода растворяет многие органические соединения. В отношении же протекающих в ней биохимических реакций вода продолжает рассматриваться в качестве обычного растворителя, подобно многим другим органическим растворителям, которые в определенных случаях могут включаться в химические реакции как простые реагенты, но не как катализаторы, ускоряющие биохимические процессы. Мы выдвигаем новое положение, согласно которому вода — активный участник, катализатор (ускоритель) биохимических процессов, причем каталитическая функция воды имеет действительно фундаментальный характер и принципиальным образом раскрывает роль воды в формировании биогеосферы нашей планеты на всех этапах ее развития. Явление катализа в химии широко известно, оно заключается в способности определенных соединений — катализаторов (ферментов — в живых организмах) — резко снижать энергетические барьеры и увеличивать скорости химических и биохимических реакций. Природой созданы удивительные соединения — ферменты, которые обеспечивают гигантское ускорение биохимических реакций — до 1011 раз! Можно с уверенностью говорить о том, что не будь ферментов — не было бы и жизни в современной высокоорганизованной форме. Однако явление катализа оставалось малоизученным на уровне фундаментальных физико-химических процессов. Катализ в водных системах является, как мы уже отмечали, частным случаем разработанной нами новой общей теории катализа. Эта теория, объясняющая механизмы каталитических реакций, в том числе и ферментативных биохимических реакций в воде, впервые рассматривает последовательный перенос двух элементарных частиц — электрона и протона [1]. В традиционной, общепринятой теории кислотно-основного катализа основополагающим элементарным процессом считается перенос протона [2]. Эти воззрения восходят к первым работам Ж. Н. Бренстеда (J. N. Bronsted) и К. Педерсена [3, 4], в которых установлен каталитический закон в виде простых выражений для кислоты:
где
Уравнения (3.1а) и (3.16) обычно представляют в линейной логарифмической форме:
Линейные зависимости (3.2а) и (3.26) получены для ряда систем и большого числа кислот и оснований, но эти зависимости не являются универсальными. В работах Р.П.Белла [5, 6], по-видимому, впервые было выдвинуто положение, согласно которому в основе кислотно-основного катализа лежит перенос протона, причем широко распространено мнение, что «разрыв ковалентной связи происходит намного легче, если одна из участвующих в реакции молекул находится в протонированном состоянии» [2]. В рамках общего кислотно-основного катализа трактуется и биологический ферментативный катализ, чрезвычайно высокая эффективность которого объясняется большой концентрацией кислот и оснований в активном центре фермента и правильной ориентацией реагирующих групп [2]. Принципиально иной подход к механизму кислотно-основного катализа развит в наших работах [1, 7—11], где показано, что в основе каталитической, как и всякой другой химической реакции, лежит перенос (возбуждение) электрона, а перенос протона или водородная связь облегчают, катализируют перенос электрона. Мы полагаем, что перенос протона, или протонирование молекулы, сам по себе не вызывает разрыва химической связи, а действительный разрыв связи наступает только в результате последующего переноса (возбуждения) электрона, приводящего к образованию химически активных радикальных частиц. Перенос протона (или водородная связь) и перенос электрона в электронновозбужденном состоянии совместно определяют фундаментальный электронно-протонный эффект, суть которого заключается в огромном снижении энергии электронновозбужденных состояний молекулярных комплексов (ассоциатов) вплоть до термических значений в результате взаимосвязи движений (переносов) электрона и протона. Подробнее об этом читайте в моих книгах, в частности, в книге "Вода — родник жизни". | ||
Каталитическая функция белков: примеры. Основные функции белков
Белки представляют собой природные органические соединения, которые обладают высокомолекулярным строением. Молекула данных веществ является неразветвляющимся полимером. Белки построены из 20 аминокислот. Именно они представляют структурную минимальную единицу молекулы – мономер. Все составляющие белка соединены между собой полипептидной, по-другому - карбамидной, связью в достаточно длинные цепи. При этом молекулярная масса может составлять от нескольких тысяч и до миллионов атомных частиц.
Каким может быть белок
Чтобы определить основные функции белка, стоит разобраться в строении подобных веществ. На данный момент существует две разновидности этого важного для человека компонента: фибриллярные и глобулярные. Различают их в основном благодаря разнице в строении белковой молекулы.
Глобулярное вещество прекрасно растворяется не только в воде, но и в солевых растворах. При этом молекула такого белка обладает шарообразной формой. Такую хорошую растворимость можно легко объяснить расположением заряженных остатков аминокислот, которые окружены гидратной оболочкой, на поверхности глобулы. Именно это и обеспечивает такие хорошие контакты с различными растворителями. Стоит отметить, что в группу глобулярных компонентов входят все ферменты, а также практически все биологически активные белки.
Что касается фибриллярных веществ, то их молекулы обладают волокнистой структурой. Каталитическая функция белков очень важна. Поэтому сложно представить ее выполнение без вспомогательных веществ. Фибриллярные белки не растворяются ни в солевых растворах, ни в обычной воде. Их молекулы располагаются параллельно в полипептидных цепях. Такие вещества участвуют в процессах образования некоторых структурных элементов соединительных тканей. Это эластины, кератины, коллагены.
Особую группу составляют сложные белки, которые состоят не только из аминокислот, но и нуклеиновых кислот, углеводов и прочих веществ. Все эти компоненты играют особую роль. Особое значение имеет каталитическая функция белков. Помимо этого, вещества подобного плана являются дыхательными пигментами, гормонами, а также надежной защитой для любого организма. Биосинтез белка осуществляется на рибосомах. Этот процесс определяется при трансляции кодом нуклеиновых кислот.
Каталитическая функция белков
Катализ разнообразных химических веществ – это самая главная функция белков. Подобные процессы осуществляются ферментами. Это белки, которые обладают каталитическими специфическими свойствами. Каждый из подобных веществ может осуществлять одну или же несколько похожих реакций. Катализируют ферменты процесс расщепления сложных молекул, а также их синтез. По-другому эти реакции называют катаболизмом и анаболизмом. Каталитическая функция белков подразумевает также репарацию и репликацию ДНК, а также матричный синтез РНК.
Что такое катализ
Уже к 2013 году учеными было выявлено чуть более 5 тысяч ферментов. Подобные вещества способны влиять на ход практически любых биохимических реакций. Чтобы стала более понятной каталитическая функция белков, стоит разобраться, что же такое катализ. С греческого языка это понятие переводится как "прекращение". Катализ представляет собой изменение скорости протекания любой химической реакции. Происходит это под действием определенных соединений. Ферментами выполняется каталитическая функция белков. Примеры этого явления встречаются в повседневной жизни постоянно. Просто человек этого не замечает.
Пример каталитической функции
Чтобы понять, как действуют ферменты, стоит рассмотреть несколько примеров. Итак, в чем заключается каталитическая функция белков. Примеры:
- При фотосинтезе рибулезобифосфаткарбоксилаза осуществляет катализ фиксации СО2.
- Перекись водорода расщепляется до кислорода и воды.
- ДНК синтезирует ДНК-полимераза.
- Амилаза способна расщепляет до мальтозы крахмал.
- Деградация угольной кислоты: СО2 + Н2О НСО3 + Н+.
Каталитическая функция белков заключается в ускорении любых химических превращений. К подобным реакциям относится синтез, распад веществ, перенос отдельных атомов или электронов от одного компонента к другому.
Транспортная функция
Жизнедеятельность любой клетки должна поддерживаться различными веществами, которые являются для них не только строительным материалом, но и своеобразной энергией. Биологические функции белков включают и транспортную. Именно эти компоненты поставляют в клетки все важные вещества, ведь мембраны построены из нескольких слоев липидов. Именно здесь и находятся различные белки. При этом гидрофильные участки все сосредоточены на поверхности, а хвостики - в толще мембран. Такое строение не позволяет проникать внутрь клеток очень важным веществам – ионам щелочных металлов, аминокислотам и сахарам. Белки переносят все эти компоненты внутрь клеток для их питания. Например, гемоглобин транспортирует кислород.
Рецепторная
Основные функции белка обеспечивают не только питание клеток живых организмов, но и помогают распознать сигналы, которые поступают из внешней среды и соседних клеток. Самый яркий пример такого явления – рецепторы ацетилхолина, который расположен на мембране около межнейронных контактов. Сам процесс очень важен. Белки выполняют рецепторную функцию, их взаимодействие с ацетилхолином проявляется специфическим образом. В результате внутрь клетки передается сигнал. Однако спустя некоторое время нейромедиатор обязательно должен быть удален. Только в этом случае клетка сможет получить новый сигнал. Именно эту функцию выполняет один из ферментов – ацетилхолтнэстераза, который выполняет расщепление до холина и ацетата гидролизацетилхолина.
Защитная
Иммунная система любого живого существа способна отвечать на появление в организме чужеродных частиц. В данном случае срабатывает защитная функция белка. В организме происходит выработка большого количества лимфоцитов, которые способны наносить вред патогенным бактериям, макромолекулам, раковым клеткам и прочее. Одна из групп данных веществ осуществляет выработку особых белков - иммуноглобулинов. Происходит выделение данных веществ в кровеносную систему. Иммуноглобулины распознают чужеродные частицы и образуют высоко специфический комплекс определенной стадии уничтожения. Так осуществляется защитная функция белка.
Структурная
Функции белка в клетке протекают незаметно для человека. Некоторые вещества имеют по большей части структурное значение. Подобные белки обеспечивают механическую прочность отдельных тканей в организмах. Прежде всего, это коллаген. Это основной компонент внеклеточного матрикса всех соединительных тканей в живом организме.
Стоит отметить, что у млекопитающих коллаген составляет примерно 25 % от общей массы белков. Синтез данного компонента происходит в фибробластах. Это основные клетки любой соединительной ткани. Первоначально образуется проколлаген. Это вещество является предшественником и проходит химическую обработку, которая состоит в окислении до гидроксипролина остатков пролина, а также до гидрксилина остатков лизина. Коллаген образуется в виде трех пептидных цепей, скрученных в спираль.
Это не все функции белков. Биология - достаточно сложная наука, которая позволяет определить и распознать множество явлений, протекающих в организме человека. Каждая функция белка играет особую роль. Так, в эластичных тканях, например в легких, стенках кровеносных сосудов и коже имеется эластин. Этот белок способен растягиваться, а затем возвращаться к исходной форме.
Двигательные белки
Мышечные сокращения – это процесс, при котором происходит превращение энергии, запасенной в молекулах АТФ в виде пирофосфатных макроэргических связей, именно в механическую работу. В данном случае функции белка в клетке выполняют миозин и актин. Каждый из них имеет свои особенности.
Миозин обладает необычайным строением. Этот белок состоит из нитевидной достаточно длиной части – хвоста, а также из нескольких глобулярных головок. Выделяется миозин, как правило, в виде гексамера. Этот компонент образуется несколькими совершенно одинаковыми полипептидными цепями, каждая из которых обладает молекулярной массой в 200 тысяч, а также 4 цепями, молекулярная масса которых составляет всего 20 тысяч.
Актин представляет собой глобулярный белок, который обладает способностью полимеризоваться. При этом вещество образует достаточно длинную структуру, которую принято называть F-актином. Только в таком состоянии компонент может нормально взаимодействовать с миозином.
Примеры основных функций белков
Ежесекундно в клетках живого организма протекают всевозможные процессы, которые невозможны были бы без белков. Примером рецепторной функции подобных веществ может послужить сообщение клеткам адренорецептором о присоединении адреналина. Под воздействием света происходит разложение родопсина. Подобное явление запускает реакцию и возбуждает палочку.
Что касается структурной функции, то лучшим примером в данном случае может послужить действие коллагена. Это вещество придает соединительным тканям больше упругости.
Примером транспортной функции является перенос гемоглобином кислорода по всему живому организму.
В заключение
Это все основные биологические функции белков. Каждая из них очень важна для живого организма. При этом определенная функция выполняется соответствующим белком. Отсутствие подобных компонентов может привести к нарушению работы определенных органов и систем в организме.
fb.ru
Что выполняет в клетке каталитическую функцию | Рекомендации специалистов
 » Рекомендации специалистов
» Рекомендации специалистов
Функции белка в организме
Белки в живых организмах выполняют множество важных функций. Поэтому в организмах существует множество различных белков.
Ферментативная функция белков заключается в том, что они служат катализаторами различных химических реакций, протекающих в организме. Ферментативную функцию по-другому называют каталитической. При катализе происходит ускорение химических реакций, причем это ускорение может быть даже в миллионы раз.
Белков-ферментов тысячи, каждый из них обслуживает свою химическую реакции или группу схожих реакций. По типу обслуживаемых реакций ферменты делят на классы. Например, оксидоредуктазы катализируют окислительно-восстановительные реакции, гидролазы обеспечивают гидролиз химических связей и т. д. Реакцию катализирует не вся молекула фермента, а только ее так называемый активный центр. Он включает часть молекулы, которая связывает субстрат (молекулу, которая подвергается превращению), и несколько аминокислот (часто не вместе расположенных), которые обеспечивают саму реакцию.
Белки выполняют структурную функцию. Они входят в состав клеточных мембран и органоидов, межклеточного вещества (белки коллаген и эластин), волос, ногтей и т. п. (кератин).
Двигательная функция белков заключается в сокращении мышц (актин и миозин), обеспечении движения клеток, их ресничек и жгутиков.
Существуют белки, которые обеспечивают перенос различных веществ как внутри клетки, так и по всему организму. Такие белки обеспечивают транспортную функцию. Они легко связываются с субстратом, когда его концентрация высока, и легко высвобождают его при низкой концентрации. К транспортным белкам относится гемоглобин. В легких он связывает кислород и высвобождает углекислый газ, а в тканях наоборот.
Ряд белков, входящих в состав мембран клеток, обеспечивают транспорт малых молекул через мембрану. Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Регуляторная и сигнальная функции белков разнообразны. Многие внутриклеточные процессы (клеточный цикл, транскрипция и трансляция, активация или подавление активности других белков и т. д.) регулируются белками.
Многие гормоны — это белки, переносимые кровью. Когда гормон связывается с определенным рецептором, то клетка получает сигнал, в результате чего в ней запускается ответная реакция. Гормоны регулируют концентрации веществ, процесс роста, период размножения и др.
Клетки взаимодействуют между собой посредством сигнальных белков, которые передаются через межклеточное вещество. Например, такие сигналы могут стимулировать или подавлять рост клеток. Таким образом обеспечивается согласованность работы клеток той или иной системы органов.
Выделяют рецепторную функцию белков. Белки-рецепторы могут находиться как в цитоплазме, так и в мембранах. Когда на рецептор действует химическое вещество или физический стимул (свет, давление и др), то он изменяется. Это изменение молекулы передается в другие части клетки, посредством катализа определенной реакции, прохождения ионов или связывания молекул-посредников.
Защитная функция белков также весьма разнообразна. Коллаген и кератин обеспечивают не только структурную функцию, но и физическую защиту организма. Также физически организм защищают фибриногены и тромбины, свертывающие кровь в местах ранения (контакта с воздухом).
Белки обеспечивают химическую защиту, связывая и расщепляя чужеродные токсины или вырабатывая свои (для защиты от других организмов).
Защитными белками являются антитела, которые обезвреживают микроорганизмы и чужеродные белки. Так белки обеспечивают иммунную защита.
Если в организме возникает дефицит углеводов и жиров, то белки, распадаясь до конечных продуктов, могут выполнять энергетическую функцию .
Белки могут запасаться как источник энергии и источник аминокислот (например, в яйцеклетках). Это запасающая функция белков .
http://scienceland.info/biology10/protein-functions
Проверьте знания с помощью приводимых ниже тестов. Каталитическую функцию в живых клетках выполняют белки, называемые (1)
Каталитическую функцию в живых клетках выполняют белки, называемые …(1). Белковые катализаторы бывают …(2) и …(3). Белковая часть называется …(4), а небелковая - …(5). Если связь небелковой части с белковой прочная, то в этом случае её называют …(6), а если связь непрочная, то …(7). Небелковая часть отвечает за …(8), а белковая за …(9) и …(10) катализатора. Уникальная комбинация аминокислотных остатков, обеспечивающая взаимодействие фермента с субстратом, называется …(11).
Зависимость скорости ферментативной реакции от концентрации субстрата выражается уравнением Михаэлиса-Ментен …(12), где #965; - …(13), #965;мах - …(14), Км - …(15), [S] - …(16).
На активность ферментов оказывают влияние следующие факторы: …(17), …(18), …(19), …(20), …(21). Концентрация субстрата, при которой скорость реакции равна половине максимальной, называется …(22), она характеризует …(23) фермента к субстрату. Низкие температуры вызывают …(24) денатурацию, высокие - …(25). Оптимальная температура, при которой активность фермента …(26), лежит в интервале …(27) температур. Оптимальным рН является рН, при котором активность фермента …(28). Для большинства ферментов она находится в …(29) среде.
Различают ингибирование ферментов 2-х типов – обратимое и необратимое. Обратимое ингибирование может быть…(30) и …(31). Ингибирование, при котором увеличивается константа Михаэлиса, но не изменяется максимальная скорость реакции, называется…(32).Ингибирование, которое не отменяется увеличением концентрации субстрата, называется …(33).Ингибирование, при котором не изменяется константа Михаэлиса, но снижается максимальная скорость реакции, называется…(34).Ингибирование, которое может быть отменено увеличением концентрации субстрата, называется …(35).
Выделяют 6 классов ферментов - …(36),…(37), …(38), …(39), …(40) и …(41).
Все биохимические реакции сопровождаются изменениями энергии, так что термин биоэнергетика можно применить ко всей биохимии. Однако центральной проблемой биоэнергетики является выяснение механизма, с помощью которого энергия, освобождаемая при окислении субстратов (или при поглощении света), может использоваться для катализа энергозависимых процессов – синтеза АТФ из АДФ и фосфата, переноса ионов через мембрану против градиента их концентрации. Большая часть АТФ синтезируется в ферментных комплексах, расположенных в мембранах определенных классов. К таким «сопрягающим» мембранам в эукариотических клетках относится внутренняя мембрана митохондрий. Механизмы синтеза АТФ и транспорта ионов в этих мембранах весьма близки. Это позволяет выделить изучение их в отдельную область биохимии, называемую энергетическим сопряжением или биоэнергетикой.
Дыхательная цепь характеризуется последовательно протекающими окислительно-восстановительными реакциями. Роль переносчиков электронов при этом выполняют НАД+, ФАД, KoQ, цитохромы. Большая часть участвующих в этом процессе ферментов локализована в наружной стороне внутренней мембраны митохондрий, и, по меньшей мере, одни из них пронизывают мембрану насквозь. Эти ферменты действуют последовательно, будучи организованы в функциональные единые системы. Ферменты располагаются в цепи в соответствии с уменьшением величины отрицательных окислительно-восстановительных потенциалов их коферментов и простетических групп. Сравнивая величины окислительно-восстановительных потенциалов, можно выявить этапы, на которых перепад энергии достаточно велик для образования химической связи АДФ и фосфата.
4.1. Изменение стандартной свободной реакции.
Глюкоза + фруктоза = сахароза + вода равно +5,5 ккал/ моль. Если эта реакция сопряжена с гидролизом АТФ, то изменение стандартной свободной энергии суммарной реакции равно –1,5 ккал/моль. Какая из этих реакций может происходить самопроизвольно?
4.2. Образование длинной, запасающей энергию, макромолекулы гликогена из мономеров глюкозы описывается реакцией:
где n – количество молекул глюкозы, составляющих полимерную молекулу гликогена. Изменение стандартной свободной энергии этой реакции равно + 5 ккал/моль. Сколько потребуется молей АТФ, чтобы присоединить один моль глюкозы к одному молю гликогена? Можно считать процесс обратимым и абсолютно эффективным.
4.3. Реально полное уравнение полимеризации гликогена имеет вид: Глюкоза +2 АТФ + гликоген = гликоген n+1 + 2АДФ + 2 фосфат.
Сколько калорий на 1 моль теряется при осуществленииэтойреакции?
4.4. Обсудите вопрос о возможности сопряжения реакции фосфорилирования АДФ со следующими реакциями:
фосфоенолпируват + вода = пируват + фосфат + 12 ккал/моль;
глюкозо-6-фосфат + вода = глюкоза + фосфат + 3,3 ккал/моль.
Напишите реакции, подтверждающие Ваше мнение.
4.5. В какую сторону сдвинется равновесие реакции сукцинат « фумарат при взаимодействиисо следующими редокс-системами:
а) Г–SH/Г – S – S – Г, б) цитохром dFе 2+ / цитрохром dFe 3+ ?
4.6. В какую сторону сдвинется равновесие реакции пируват « лактат при взаимодействии со следующими редокс-системами:
а) аскорбат/дегидроаскорбат; б) НАДН/НАД + ?
4.7. КоэффициентР/0 при окислении большинства субстратов равен 3, при окислении сукцината – 2, а при окислении аскорбата – 1. На каких участках дыхательной цепи происходит сопряжение процесса переноса электронов с фосфорилированием АДФ?
4.8. Ротенон ингибирует окисление большинства субстратов, но не влияет на окисление сукцината и аскорбата. Антимицин А не влияет на окисление сукцината, но ингибирует окисление аскорбата, соли цианистой кислоты ингибируют окисление любых субстратов, в том числе и аскорбата. Какие звенья дыхательной цепи блокируются ротеноном, актимицином А и солями цианистой кислоты?
4.9. Как изменится интенсивность дыхания при отсутствии АДФ и неорганического фосфата в межмембранной жидкости и избытке АТФ в матриксе митохондрий? Объясните причину этого изменения, исходя из основных постулатов хемоосмотической гипотезы механизма окислительного фосфорилирования.
4.10. Синтезирующаяся в митохондриях АТФ выкачивается наружу при одновременном накачивании внутрь митохондрий АДФ и неорганического фосфата. Обсудите электрохимические механизмы этой закономерности. Какой процесс должен сопутствовать перемещению АТФ, АДФ и фосфата через внутреннюю мембрану митохондрий?
4.11. Добавление валиномицина к суспензии дышащих митохондрий в среде, содержащей ионы калия, обеспечивает перенос этих ионов из межмембранного пространства в матрикс. Антибиотик нигерицин обусловливает перенос протонов в матрикс в обмен на ионы калия, выходящие в межмембранное пространство. Как изменится дыхание и фосфорилирование АДФ в присутствии: а) валиномицина, б) нигерицина, в) обоих ионофоров?
4.12. Некоторые соединения, представляющие собой слабые липофильные кислоты (трифторметоксикарбонилцианидфенилгидразон, 2,4-динитро-фенол и др.), могут мигрировать через липидную мембрану как в ионизированной, так и в неионизированной форме. Другие вещества (дициклогексилкарбодиимид, олигомицин) реагируют с F1 или F0, блокируя перенос протонов через мембрану. Как соединения этих типов влияют на окислительно-восстановительные процессы и фосфорилирование АДФ? Объясните механизм их действия с позиции хемиосмотической теории.
http://lektsii.org/8-63318.html
Функции белков в организме.
Общая характеристика белков.
Белки – это высокомолекулярные органические, азотсодержащие соединения, состоящие из аминокислот.
Белки – наиболее сложные соединения живых систем. Не только каждый вид живого, но и каждый орган, каждый тип клеток обладает своим специфическим набором белков.Наконец, каждый индивидуум отличается от подобных своего вида собственным набором белков (биохимическая индивидуальность ). Эта индивидуальность поддерживается всеми живущими организмами. При внедрении в организм чужих белков образуются защитные вещества (антитела ) и разрушают чужие белки. Однако имеется и общность между определенными белками одного и того же вида, которая позволяет проводить обмен белками (например, переливание крови).
В количественном отношении они занимают первое место среди всех содержащихся в живой клетке макромолекул. В организме человека белки составляют примерно 1/5 часть, или 20 % массы, а в пересчете на сухой вес - 45%. Содержание белков в разных тканях различно, так в мышцах и печени содержится до 22 % белка, в мозге – 11 %, в жировой ткани – 6 %.
Свое название белки получили от белого цвета куриного яйца, на примере которого изучались их свойства. В 1838 г. Н. Мульдер назвал белки протеинами (от греч. protos - первый, важный). Это же название принято в международной номенклатуре.
Белки занимают первое место среди макромолекул не случайно, ведь там где есть белки, отмечены признаки жизни и наоборот там где есть жизнь, обнаруживаются белки.
Функции белков в организме.
Белки, входящие в состав организма человека, отличаются большим
разнообразием состава, структуры, местом расположения и соответственно функциями.
Белки выполняют следующие функции в организме:
1. Каталитическая или ферментативная функция. Одна из основных функций белков. В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами и ускоряют все биохимические процессы в организме. Практически все они являются по своей химической природе белками.
2. Структурная или пластическая функция. Еще одна из важнейших функций белков. Мембраны всех клеток и субклеточных единиц представляют собой бислой: белки и фосфолипиды, т.е. белки играют большую роль в формировании всех клеточных структур. Эту функцию выполняют, например следующие белки: кератин – составляет основу волос и ногтей, коллаген – главный белок соединительной ткани.
3. Сократительная функция. Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят и изменение форм клеток и субклеточных частиц.
4. Транспортная функция. Перенос различных веществ по крови и в пределах клетки. Например, альбумины переносят по крови ВЖК, лекарственные вещества, билирубин; гемоглобин переносит кислород и углекислый газ, другие белки транспортируют липиды, стероиды, витамины и т.д.
5. Защитная функция. В процессе эволюции в организме выработан механизм узнавания и связывания «чужих» молекул с помощью белков-антител, которые являются белковой фракцией гамма-глобулинов; кроме этого ряд белков, например, альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови; белки свертывающей (фибриноген, протромбин и др.) и противосвертывающей системы предотвращают свертывание крови в нормальных условиях и наоборот образуют сгустки крови при повреждениях сосудов.
6. Регуляторная функция. Среди молекул-регуляторов важное место принадлежит регуляторам белковой природы, таким как гормоны, 50% которых имеют белковую природу; белки-гистоны, кислые белки играют роль в регуляции процесса трансляции в биосинтезе белка; белки крови альбумины играют большую роль в создании и поддержании онкотического и осмотического давления крови; белки входя в состав белковой и гемоглобиновой буферных систем участвуют в поддержании рН крови и т.д.
7. Рецепторная функция. Избирательное связывание различных регуляторов-гормонов, биогенных аминов, простогландинов, медиаторов, циклических мононуклеотидов, протекает с помощью белков-рецепторов на мембранах клетки.
8. Опорная или механическая функция. Прочность соединительной, хрящевой и костной ткани за счет белков – коллагена, эластина, фибронектина.
9. Энергетическая функция. 1 г. белка, окисляясь до конечных продуктов – мочевины, углекислого газа и воды, дает 4,1 ккал энергии.
http://studopedia.ru/17_133046_funktsii-belkov-v-organizme.html
Комментариев пока нет!
formula-zdorovja.ru
Каталитическая функция - Большая Энциклопедия Нефти и Газа, статья, страница 1
Каталитическая функция
Cтраница 1
Каталитические функции, осуществляемые при участии восстановленных форм никотинамидных коферментов ( НАДФ-Н), лежат в основе жизненных процессов - в синтезе первичного органического вещества из двуокиси углерода, воды, минеральных солей, фосфора, азота с поглощением квантов света солнечной энергии. Процесс фотосинтеза осуществляется в клетках зеленых частей растений и сопровождается выделением молекулярного кислорода в атмосферу. Возможно, и к этому имеются серьезные основания, весь или почти весь кислород атмосферы Земли образовался за счет реакции фотосинтеза. [1]
Каталитические функции многих комплексных соединений могут проявляться только при наличии свободных мест в координационной сфере. [2]
Каталитические функции некоторых типов соединений, вероятно, могут быть приписаны их химическим и физическим свойствам. [3]
Каталитическую функцию выполняют неионизированные пиридиновые ядра, однако электростатическое притяжение отрицательно заряженЕого аниона субстрата к поликатиону частично ионизированного поливинилпиридина ускоряет реакцию. Скорость реакции в зависимости от доли ионизированных звеньев пиридина проходит через максимум, соответствующий 75 % неионизированных групп. [4]
Непосредственными каталитическими функциями обладает не вся молекула фермента; активны лишь отдельные функциональные группы фермента, так называемый активный центр. Конфигурация и электрические свойства фермента в целом определяют его способность акцептировать определенный субстрат. Если субстрат акцептируется, то одна из его связей оказывается расположенной как раз над активным центром. [5]
Такие каталитические функции во многих случаях может выполнять сама среда, в которой происходит взаимодействие наблюдаемых частиц. Этот тезис менее справедлив для газофазных реакций, где предварительное взаимодействие частиц из-за особенностей их газофазного состояния осуществляется в незначительной степени. Но это достаточно важно ( а иногда и крайне важно) для реакций в конденсированной фазе - жидкой или твердой. [6]
Кофермент обусловливает каталитические функции в химической реакции. [7]
Флавопротеиды проявляют более разнообразные каталитические функции, чем пи-ридиннуклеотиды. Это выражается в том, что для них приемлемыми субстратами и акцепторами электронов является гораздо большее число веществ. [8]
В процессе риформинга каталитические функции дегидрирования - гидрирования и изомеризации строго сбалансированы. Изменение активности любой из них заметно влияет на состав продуктов и их качество. Для компенсации изменений в функции металла ( Pt, Pt-Re и др.) изменения в силе и количестве кислотных центров контролируются содержанием ионов СГ на поверхности оксида алюминия. [9]
Таким образом, каталитические функции ионов металлов переходного типа довольно отчетливо делятся на две группы в соответствии с механизмом действия. [10]
Характер проявляемой пиридоксальфосфатом каталитической функции определяется природой фермента, в сочетании с которым он действует. Так, из схемы (8.17) следует, что пиридоксальфосфат служит коферментом в таких процессах, как декар-боксилирование, трансаминирование, рацемизация и синтез аминокислот. [11]
Это вызывает усиление каталитических функций белков и выделение ионов кальция, активирующего белки. Белки катализируют разложение АТФ и, следовательно, выделение энергии. [13]
Кофактор, выполняя каталитическую функцию, должен оставаться химически неизменным в результате катализируемой реакции. Если же в роли кофактора выступает истинно простетическая группа, то она осуществляет весь каталитический цикл, будучи присоединенной к одной и той же молекуле фермента. В ряде случаев, однако, кофакторы вступают в более сложные взаимодействия, будучи связующим звеном между двумя ферментами и обеспечивая тем самым образование единой ферментной системы. Такие кофакторы принято называть кофер-ментами. [14]
У простых ферментов каталитическую функцию осуществляют непосредственно белки. В реакции с субстратом принимает участие не вся полипептидная цепь, а всего лишь несколько аминокислотных остатков, как правило, расположенных на значительном удалении друг от друга в полипептидной цепи. В процессе формирования третичной структуры происходит их сближение и стабилизация при помощи дисульфидных или множественных слабых связей. Денатурация нарушает связи, стабилизирующие третичную структуру, активный центр разрушается, и каталитические свойства фермента полностью или частично подавляются. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Каталитические действие воды - Справочник химика 21
Вода. Отделение от воды механических примесей. Дистилляция воды. Строение молекулы воды и ее полярность. Химические реакции с участием воды. Гидратация. Каталитическое действие воды. [c.160]Скорость разложения перекиси водорода в значительной степени зависит от концентрации раствора. Это обусловлено каталитическим действием воды (гомогенный катализ). [c.288]
Большое значение имеет каталитическое действие воды. Многие реакции протекают только в присутствии следов воды и совсем не идут без нее. Так, например, хлор при полном отсутствии влаги не действует на железо, гремучая смесь без следов влаги не, взрывает, в сухом виде h3S и SO2 не вступают в реакцию, В некоторых случаях вода является каталитическим ядом, например для железа при синтезе аммиака. [c.142]Опыт 9. Каталитическое действие воды (опыт проводите под тягой ). В фарфоровый тигель или чашку насыпьте небольшое количество сухого порошка цинка и примерно такое же количество мелко растертого иода. Смесь перемешайте стеклянной палочкой. Убедитесь, что при этом реакция соединения цинка с иодом практически не протекает. Перенесите сосуд со смесью под тягу и добавьте из пипетки 1—3 капли воды. Наблюдайте бурно протекающую экзотермическую реакцию [c.90]
Исключительное значение имеет каталитическое действие воды. Многие реакции чрезвычайно ускоряются от присутствия следов воды и совсем не идут без нее. [c.162]
Здесь Шо — каталитическое действие воды, которое складывается из каталитического действия ионов ОН и молекул воды, так что [c.331]
Здесь мы пренебрегли каталитическим действием воды. [c.332]
Если раскрытие цикла осуществляется при каталитическом действии воды, т. е. происходит гидролитическая полимеризация, то при этом число образующихся активных центров, на которых происходит рост цепи, пропорционально первоначальной концентрации воды или катализатора. При присоединении мономера к активным центрам образуется полимер с очень узким молекулярно-массовым распределением. Для достижения такого распределения необходимо обрывать реакцию до получения полимера с высокой молекулярной массой, поскольку по мере протекания основной реакции создаются условия для реакций обмена между полимерными цепями, и распределение молекулярных масс приближается к наиболее вероятному. [c.70]
Необходимо, однако, подчеркнуть, что совпадение макрокинетического закона реакции в приведенных выше примерах с формулой (3, 21), полученной из формальной схемы гомогенно-каталитической реакции, нельзя рассматривать как доказательство правильности отвечающего этой схеме механизма реакции в применении к рассмотренным реакциям. Это прежде всего относится к реакции горения СО, из механизма которого, в частности, следует, что каталитическое действие воды связано с тем, что она участвует в образовании весьма активных форм вещества — атомов Н и О и радикалов ОН. Это не имеет ничего общего с прямым взаимодействием молекул СО и Н2О [135, 463]. [c.44]
Интересно, однако, что присутствие Нг действует весьма ускоряющим образом на окисление СО кислородом не только тогда, когда водорода в исходной газовой смеси много, но и при очень малых его количествах если бы водород действовал на окисление СО так, как это следует из данного выше определения понятия сопряженных реакций, то вскоре после начала процесса должно было бы наступить прекращение индуктивного его действия потому, что малое количество Нг исчезло бы, превратившись в воду. На самом же деле ничтожная примесь водяного пара действует так же, как и свободный водород, ускоряющим образом на окисление СО при этом действие это оказывается прямо пропорциональным парциальной упругости Н2О. Ясно, что здесь имеет место не только химическая индукция водорода, но и каталитическое действие воды. [c.62]
Обычно ступенчатая полимеризация протекает между поли-функциональными соединениями, одно из которых содержит подвижный водородный атом, а другое легко присоединяет его. Каталитическое действие воды и водных растворов кислот и щелочей при ступенчатой полимеризации циклических соединений, например капролактама, объясняется именно наличием подвижного водородного атома. [c.27]
Относительно каталитического действия воды в сравнении с действием кислотных катализаторов Маттес указывает, что скорость превращения при полимеризации лактама с бензойной кислотой сначала больше скорости полимеризации лактама только с водой. Через 48 час. наступает обратное явление. Это обстоятельство, согласно теории присоединения радикала, объясняется тем, что скорость реакции лактама и полимера с бензойной кис- [c.29]
Написать уравнение реакции, имея в виду, что она протекает в две стадии (образование PJ, под каталитическим действием воды и разложение PJ избытком воды с образованием HJ). [c.160]
Каталитическое окисление аммиака кислородом воздуха в присутствии платины и оксида хрома (III) — см. опыт 123. Гетерогенный катализ с диоксидом марганца — см. опыт 185. Каталитическое действие воды при взаимодействии алюминия с иодом — см. опыт 58. [c.236]
Под влиянием факторов, действующих в условиях эксплуатации агрегата, происходит изменение физикохимических свойств масла, обычно характеризуемое понятием старение масла. Старение происходит ири контакте масла с воздухом, каталитическом действии воды, металлов и окислении. В результате окисления повышаются плотность и вязкость масла, ухудшается его деэмульгирующая способность, образуются растворимые в масле, а также летучие кислые коррозионноактивные продукты. [c.24]
Совершенно ясно, что активные центры О и О3 сами по себе не могут принимать участия в реакции, обусловливающей каталитическое действие воды, в противном случае вода должна была бы сильно влиять на положение верхнего предела. [c.74]
Полимеризация циклов, образованных в результате взаимодействия сильных дипольных групп. Примером может служить полимеризация капролактама в присутствии аминокапроновой кислоты, которая образуется в результате каталитического действия воды на капролактам. Эта реакция протекает ступенчато и может быть представлена схемой [c.153]
Поскольку колебательная энергия возбужденных мо.лекул СОа легко передается молекулам Н О (что подтверждается опытами по дисперсии и поглощению ультразвука), то это приводит к рассеянию энергии, что вряд ли может способствовать ускорению реакции. Поэтому предлагаемый автором третий механизм каталитического действия воды является дискуссионным. (Прим. ред.) [c.143]
Во многих случаях введение катализатора вызывает цепную реакцию. Например, окисление СО при каталитическом действии воды связано с развитием реакционных цепей, в которых участвуют ионы гидроксила и водорода. [c.218]
Скорость реакции образования мочевины достаточно велика, особенно при высоких температурах и в первые часы нагревания карбамата аммония (благодаря каталитическому действию воды, образующейся в процессе реакции). Затем эта скорость замедляется вследствие отрицательного действия избытка воды, остающейся почти целиком в жидкой фазе. Отсюда следует, что повышение выходов мочевины может быть достигнуто при снижении парциального давления [c.238]
При замещении обменных катионов в цеолитах процесс обычно имеет промежуточную стадию, соответствующую, вероятно, замещению на промежуточный подвижный ион (протон) [31]. Для реализации такого механизма необходимо, чтобы некоторое достаточно малое некомпенсированное число внешних катионов могло удаляться без разрушения кристаллической структуры минерала. Данный механизм энергетически благоприятен, так как при наличии вакансии в промежуточной стадии сохраняется общая электронейтральность кристаллической решетки. Значительное каталитическое действие воды при ионообменных реакциях, вероятно, как раз и можно связать с промежуточным замещением на протон, коэффициент диффузии которого намного выше, чем любого другого иона. [c.104]
Повышение температуры ускоряет реакции вследствие активации реагирующих молекул, путем повышения запаса их энергии, за счет подводимого извне тепла. Сущность ускоряющего действия катализаторов заключается в понижении энергии активации химической реакции или же в протекании реакции по ценному механизму т участием каталйзаторов (см. гл. V). Понижение энергии активаций происходит в результате изменения реакционного пути. Каталитическая реакция протекает с участием катализатора иным путем, через ряд стадий, которые требуют меньшей энергии активации, чем общая реакция без катализатора. Общее уменьшение энергии активации может быть весьма значительным. Когда введение катализатора вызывает цепную реакцию, ускорение достигается благодаря появлению богатых энергией частиц в процессе самой реакции. Например, каталитическое действие воды на окисление окиси углерода происходит путем развития реакционных цепей с участием гидроксилов и атомов водорода. [c.167]
Что касается комплекса НзО, то для объяснения каталитического действия воды на реакцию окисления водорода В. В. Воеводским [41] был предложен механизм, в котором роль гипотетического процесса Н2 Ч- Н2О = Н3О + Н играет процесс НО2 + Н2О = Н2О2 + ОН, являющийся обращением процесса, наблюдающегося в разряде в парах воды [643]. [c.106]
Каталитическое действие воды в данной реакции объясняется сле-5уюшим образом [c.186]
Большая часть остальных элементов находится в природе в виде сульфидов или в связанном с ними состоянии. Большинство сульфидов очень мало растворимо в воде — еще менее, чем окислы. Следовательно, отложения сульфидов могли образоваться в результате взаимодействия окислов и соединений серы в геологическую эпоху. Есть веские доказательства того, что в первобытном состоянии Земля состояла из веществ, располагавшихся слоями по плотности. Ближе к центру Земли находились относительно чистые, плотные металлы с порядковыми номерами, близкими к железу. Менее плотные сульфиды образовывали следующий за металлами слой, а далее располагался слой, состоявший в основном из еще менее плотных окислов. Позднее вулканические извержения через трещины во внешнем слое выносили сульфиды на поверхность, где они реагировали с окислами (часто при каталитическом действии воды) и образовывали существующие в настоящее время серные руды. Мы не будем останавливаться на этой теме более подробно, но и так ясно, что обнаруживаемые в нашу эпоху природные залежи относптельно чистых химических веществ (руды) и их процентное содержание в залежах должны учитываться любой теорией, объясняющей происхождение Земли. [c.171]
Удивительно, что безводный тиосульфат натрия тоже является реакционноспособным соединением. Это объясняется неизбежным присутствием следов воды, образующихся при взаимодействии галогеноводоролных кислот с тиосульфатом. Реакция является типичным примером каталитического действия воды. [c.411]
Полимеризация капролактама протекает чрезвычайно медленно. Она может быть ускорена добавлением воды . На основании каталитического действия воды можно прийти к заключению, что образование полимера представляет собой настоящий поликог. [c.24]
Гидрохлорирование ацетиленовых соединений, содержащих такие заместители как СООН, HgOH, H l, идет в присутствии Hg lj несколько легче, чем незамещенных а-ацетиленов. Так, при 50° С присоединение НС1 к пропину-1 не заканчивается за 2 дня [86], тогда как с пропаргиловым спиртом реакция проходит за 40 мин. [127]. В качестве катализаторов наряду Hg lj 86, 89, 127—130] пользуются хлоридами меди в сочетании с галогенидом щелочного металла или аммония [129, 131—134], Zn [135]. Отмечено каталитическое действие воды [86]. В единичных случаях реакции ведут в отсутствие катализатора [91, 136]. а-Хлорвиниловые эфиры получают действием эфирного раствора НС1 на алкоксиацетилен [136] по схеме [c.23]
Основной причиной старения трансформаторных масел в эксплуатации является окисление углеводородов, составляющих эти масла, кислородом воздуха. Этому процессу способствуют повышенные температуры, каталитическое действие водьи, металлических поверхностей и пр. [c.59]
Т. е. нет различия в составе мономера и макромолекул полимера. Однако в отличие от цепной полимеризации ступенчатая протекает через образование промежуточных вполне устойчивых соединений— ДИ-, три-, тетра-, нента-, гексамеров и т. д., а поэтому молекулярная масса полимера нарастает со временем. В реакции ступенчатой полимеризации могут участвовать не только однородные, но и разнородные молекулы мономера. Примером может служить полимеризация е-капролактама в присутствии е-амннокапро-новой кислоты, которая образуется в результате каталитического действия воды на е-капролактам [c.56]
Вода играет положительную роль при синтезе полиамидов по эмульсионному и межфазному способам. Она способствует диффузии диаминов из водной в органическую фазу (зону реакции), отводу хлористого водорода из этой зоны, повышает поверхностное натяжение на границе раздела фаз и т. д. Показано [48], что в водноорганических системах, содержащих хорошо смешивающиеся с водой органические жидкости, резкое уменьшение содержания воды в органической фазе эмульсионной системы приводит к снижению молекулярной массы полиамида. Этот факт приходится связывать с каталитическим действием воды. Предполагаемый механизм катализа [49] сводится к образованию комплекса, в котором облегчено протекание заключительной стадии ацилирования (распад а-комплекса и отщепление галогенводо-рода) [c.50]
Здесь сн и Сон — концентрации ионов водорода и ионов гидроксила ки и кои — константы каталитического действия ионов водорода и гидроксила, а ко обычно называется константой каталитического действия воды. Ниже мы будем обозначать ее через к . Добавляя к раствору сильно диссоциирующую кислоту, анион которой не оказывает каталитического действия, можно уменьпхить копцентрацию ионов гидроксила до такой степени, что последний член уравнения (27) не будет играть роли. Тогда [c.570]
Вода. Отделение от воды механиче1ских примесей. Дестилляция воды. Строение молекулы воды и ее полярность. Химические реакции с участием воды. Гидратация. Каталитическое действие воды. Перекись водорода. Структура молекулы. Химическая характеристика перекиси водорода. Методы получения. Перекиси металлов. Понятие о надкислотах. [c.153]
chem21.info
Что это такое? Плюсы-минусы [2018]

Сегодня хозяйки все чаще отказываются от ручного мытья духовки
Духовка – настоящий помощник каждой хозяйки. Но после приготовления пищи в ней часто остается копоть, жир, потеки, справиться с которыми порой очень сложно. Поэтому при покупке новой духовки многие обращают внимание на дополнительные возможности самоочистки, вариантов которой много. Рассмотрим каталитическую очистку духовки.
Содеражание:

Бесконтактная очистка духового шкафа обеспечит эффективность и щадящий подход
Что такое каталитическая очистка?
- Катализ – процесс, ускоряющий химические реакции. Что касается духового шкафа, то тут происходит более стремительное превращение жиров, которые образуются в процессе готовки в воду и сажу. Это возможно за счет того, что внутренняя часть прибора покрыта специальным составом. Собственно очистка происходит автоматически, в момент разогрева до +200-250 °С. То есть даже при готовке на такой температуре духовка самоочищается.
Важно! После подобной процедуры только останется удалить сажу, если она есть. При этом нельзя использовать абразивные средства, они могут повредить специфическую поверхность.

Оставшийся пепел собираем мягким лоскутом
Структура покрытия каталитических духовок:
- Жиропоглощающая эмаль с порами.
- Катализатор. В его роли выступают оксид марганца, кобальта, меди или церия. Частицы его заполняют поры эмали и в процессе разогрева помогают распадаться жирам, которые оседают на поверхностях.
- Абсорбент с наночастицами.
Данная очистка безвредна для человека, и результаты использования духовки с подобной функцией удивляют и радуют хозяек.

Автоматизированный процесс обеспечит легкость в уходе за кухонной техникой
Особенности бытового прибора
Дно духовки рассматриваемого типа имеет нестандартную поверхность. Она необходима для того, чтобы от некоторых продуктов не пострадала эмаль.
Это касается:
- сахара. В процессе выпекания пирожков есть риск, что он расплавится и потечет на эмаль;
- молочных продуктов.
Важно! Если любой из этих продуктов попал на поверхность, подобные загрязнения нужно убирать самостоятельно при помощи мягкой губки и специального моющего средства.

Не затягивайте с мытьем духового шкафа во избежание повреждений поверхности
Для продления срока эксплуатации производители рекомендуют использовать жиропоглощающий фильтр. Его следует периодически чистить, причем это легко можно сделать в посудомоечной машине.
На заметку! Поверхности шкафа имеют не безграничный срок использования – примерно через 5 лет их придется менять. Это можно сделать как самостоятельно, так и обратившись к специалисту сервисного центра.

Стенки духовки чувствительны к химическим средствам, поэтому сильные нажатия приводят к быстрому расходу катализирующего вещества
Важно! При покупке стоит обращать внимание на модели, которые имеют двухсторонний слой специальной эмали. После того как одна износилась, стенки можно развернуть и использовать еще столько же.

Практически все современные кухни имеют встроенные плиты с автоматической очисткой
Некоторые модели духовых шкафов, имеющие функцию каталитической очистки:

Правильный уход за техникой позволит повысить срок ее службы до номинального
Рекомендации по использованию
Столь необычная духовка требует соблюдения определенных правил эксплуатации:
- К каталитическому покрытию следует относиться предельно бережно – нельзя использовать жесткие губки и абразивные чистящие средства.
- Если на поверхность попал сахар, его нужно как можно быстрее убрать, не дожидаясь, пока начнет действовать каталитическая очистка.
- Процесс очистки от сложных жиров может занять 2-3 цикла, поэтому если с первого раза он весь не ушел, не следует пытаться очистить духовку другим методом.
- Соблюдать сроки замены поверхностей.
- Не все поверхности покрыты рассмотренным выше составом, чаще всего это боковые и задняя стенки, иногда вентилятор.

Такую систему очистки необходимо применять примерно раз в 3 готовки
Преимущества и недостатки
| Процесс очистки происходит автоматически. Не нужно дополнительно запускать его, причем он происходит во время приготовления пищи, что экономит время. |
| Специфическая каталитическая эмаль может использоваться в любых духовых шкафах, независимо от типа потребляемой энергии. |
| Практически все производители предлагают одинаковое качество. Собственно очистка будет зависеть разве что от степени изогнутости поверхностей прибора. |
| Многие бренды выпускают такие модели духовок. |
| Относительно доступная цена. |

Процесс очистки нельзя прерывать, а также оставлять внутри противень или сетку
| Если сравнивать с другими духовками, имеющими функцию самоочистки, этот тип самый менее эффективный. Если на самоочищающуюся поверхность попадает сахар или молочные продукты, она теряет свою способность. |
| Так как эмаль нанесена не на все поверхности, без ручной чистки все же не обойтись, к тому же спектр доступных к использованию средств ограничен. Противень, гриль и другие съемные элементы необходимо чистить вручную. |
| На дно, дверцы с внутренней стороны не наносится каталитическая эмаль. |
| Показывает эффективность только при регулярном использовании, то есть готовить нужно при температуре не менее +200 градусов. |
| Необходимость замены пластин с каталитическим напылением каждые 4-5 лет. |

Если стенки сменные, их необходимо перевернуть через 4-5 лет
Вывод
Духовку с функцией каталитической очистки следует приобретать тем, кто планирует готовить часто. В другом случае ее положительные качества не будут так ощутимы.
happymodern.ru
Каталитические свойства воды - Справочник химика 21
Касаясь вопроса о возможной активности данного катализатора, важно заметить, что само по себе существование химически ненасыщенных центров на поверхности твердого вещества еще не гарантирует каталитической активности. Если эти активные центры обладают достаточно большой свободной энергией, они будут стабилизироваться за счет образования перманентных химических связей либо с реагирующими веществами, либо с любыми примесями, что эквивалентно отравлению катализатора . Для того чтобы обладать эффективными каталитическими свойствами, ненасыщенные (или активные) центры должны образовывать слабые или лабильные связи с реагирующими веществами. Это — веское обоснование каталитических свойств воды (действующей как растворитель), заключающихся в облегчении протекания ионных реакций. [c.532] С целью выяснения природы каталитической активности цеолита HY в реакции окисления бензилового спирта исследовано влияние на активность катализатора различных факторов степени обмена ионов Na на Н в исходном NaY, адсорбции пиридина и воды, предварительной термообработки водородом [259]. Показано, что каталитическая активность цеолита HY, под которой подразумевается суммарный выход бензальдегида и бензойной кислоты, уменьшается на 60% при обработке цеолита водородом при 500° С в течение 15 ч. Это явление аналогично дезактивирующему влиянию высокотемпературной водородной обработки цеолита в реакциях гидрирования, о чем говорилось выше. При обмене 40-60% ионов Na в цеолите происходит заметное увеличение выхода продуктов окисления, а также бензилового эфира и толуола. Пиридин вызывает снижение каталитической активности цеолита HY, а введение в реакционную систему воды увеличивает выход бензилового эфира и снижает выход продуктов окисления. Изучено влияние температуры прокаливания цеолита HY на его каталитические свойства. Оказалось, что предварительное прокаливание при 450°С приводит к повышенной активности катализатора в образовании бензилового эфира, а выход бензальдегида увеличивается с повьпцением температуры прокаливания в интервале 500-550°С. Эти результаты указывают, по-видимому, на то, что реакция дегидратации бензилового спирта осуществляется на бренстедовских кислотных центрах, а его окисление происходит с участием льюисовских центров. [c.107]Каталитические свойства катализаторов восстанавливаются регенерацией лишь в том случае, если их изменения обусловлены закоксовыванием. Однако катализатор моЖет теря ть свои свойства и по другим причинам. Так, вследствие постепенной потери галогена может снижаться кислотная функция катализатора. Это может происходить также из-за связывания кислотных активных центров с азотистыми основаниями. Дегалогенирование катализатора резко усиливается водой, содержащейся в сырье. Для поддержания кислотной функции на должном уровне (в зависимости от типа катализатора) вводят галогенсодержащие, соединения (например, дихлорэтан) в газо-сырьевой поток перед каждым реактором (а также при регенерации катализатора). [c.150]
Каталитические свойства воды (опыт под тягой ). Приготовить два одинаковых цилиндра с покровными стеклами. В одном из них сжечь небольшое количество серы. Другой цилиндр наполнить сухим сероводородом из аппарата Киппа (газ для сушки пропускать через склянки, наполненные зерненым хлористым кальцием). Поставить один цилиндр на другой отверстия.ми друг к другу, вынуть стекла и перемешать газы. Наблюдаются ли какие-нибудь изменения Слегка сдвинув верхний цилиндр, вылить в нижний цилиндр несколько капель воды иэ пипетки и вновь тщательно перемешать газы. Наблюдать образование на стенках цилиндров светложелтого налета серы. Составить уравнение реакции. Какова роль воды в этой реакции [c.159]
Так как реакция восстановления сольватированными электронами происходит ие непосредственно на поверхности электрода, то его каталитические свойства перестают играть заметную роль. Исключается также или сводится до минимума возможность образования металлоорганических соединений с участием металла электрода, изменяется природа промежуточных продуктов и т. д. Вопрос об изменении природы промежуточных продуктов рассматривался в литературе довольно подробно в связи с реакцией выделения водорода. Речь шла о водных средах, где, по указанным выше причинам, восстановление через промежуточное образование сольватированных (гидратированных) электронов не очень вероятно, хотя и возможно. Эти рассуждения имеют, однако, более общее значение, так как могут быть отнесены практически к любым протонным средам, а также к апро-тонным, содержащим протонодонорные добавки (вода, спирты и т. д.), необхо- [c.444]
Для оценки катализаторов важны три фактора, относящиеся к активным центрам число центров в единице массы, соотношение числа центров В и L и кислотная сила катализатора. Теоретически число центров В связано с числом центров L в цеолите, но на практике имеется много факторов (степень кристалличности, уровень обмена, тип катиона), искажающие эту закономерность. Соотношение числа центров В kL зависит от условий предварительной обработки цеолита. Обычно нагрев катализаторов до температуры 700 С приводит к исчезновению центров В при одновременном увеличении числа центров L. Эти превращения сопровождаются отщеплением воды и, есг конечная температура не превышает предельной величины, то центры В можно регенерировать путем добавления воды при низкой температуре. На практике это означает, что соотношение числа центров В и L, так же как и все каталитические свойства, связанные с этим соотношением, зависят от условий проведения процесса в реакторе. [c.110]
Введение на поверхность катализатора поливалентных катионов, обладающих сильным поляризующим действием, стабилизирует ОН-группы и делает их более устойчивыми к термообработке. Поэтому катионные формы более активны, чем декатионированные, и промотируются водой в более жестких условиях. Наличие в структуре цеолита поливалентных катионов влияет на каталитические свойства протонизированных ОН-групп, чем объясняется некоторое снижение энергии активации. [c.59]
Для более глубокого исследования адсорбции воды в цеолите в общем случае недостаточно знания структурных параметров полостей цеолитов. Особенно это касается дефектов решетки, таких, как льюисовские и бренстедовские центры, которые не определяются из рентгеновских данных, но имеют решающее значение для сорбционных и каталитических свойств цеолитов. [c.40]
На основе использования адсорбционно-каталитических свойств углеродных материалов разработаны, апробированы в опытном масштабе и предложены для промышленного применения новые эффективные процессы очистки сточных вод и технологических растворов от сульфида натрия, фенола, аммиака, анилина и других компонентов. [c.87]
Каталитические свойства ионов металлов в реакциях молекулярного кислорода играют особо важную роль в биологических системах. Именно каталитический эффект позволяет объяснить окисление ионов Сг + и Ре + в воде, насыщенной кислородом (в воде, свободной от кислорода, они устойчивы). [c.478]
Простые вещества. В компактном состоянии рутений — серовато-белый, осмий — серебристо-белый металлы с плотнейшей гексагональной структурой, твердые, хрупкие и тугоплавкие. Химически чистый родий имеет вид светло-серого порошка. Сплавленный, он напоминает алюминий. Дисперсный порошок родия черного цвета называется родиевой чернью. При сплавлении родия с цинком и дальнейшей обработке сплава соляной кислотой получают взрывчатый родий. Причиной взрыва является каталитическое свойство родия взрывать смесь адсорбированных газов (водорода и кислорода). Коллоидальный родий, полученный диспергированием чистого металла в воде или восстановлением из растворов его солей, обладает еш,е большими каталитическими свойствами, чем родиевая чернь. Компактный иридий — серебристо-белый металл, подобно родию имеет структуру гранецентрированного куба, очс иь твердый и хрупкий. Платина и палладий — серовато-белые блестящие мягкие металлы. Платина легко прокатывается и вытягивается в проволоку, палладий поддается ковке, обладает большей вязкостью, чем платина. [c.403]
В химии долгое время придерживались взгляда, согласно которому кислотные свойства раствора должны быть связаны с присутствием в нем ионов водорода. Ионы водорода обусловливают определенную окраску индикаторов, эти же ионы вызывают и ряд каталитических эффектов, в частности ускоряют процессы гидролиза, мутаротации глюкозы и др. Однако в дальнейшем было выяснено, что каталитические свойства присущи не только ионам водорода, но и молекулам кислот, иону гидроксила и даже молекуле воды. [c.247]
Таким образом, меняя содержание воды в среде фенол-ацетон, можно регулировать кислотно-каталитические свойства 113804 в очень широком диапазоне. Это позволяет сделать вывод о нецелесообразности поиска и применения в промышленности других гомогенных кислотных катализаторов, значительно уступающих серной кислоте как по стоимости, так и технологичности (необходимость регенерации, токсичность и т. д.). [c.297]
Нитрид галлия представляет собой порошок серого или желтоватого цвета, с водой не взаимодействует, устойчив на воздухе до 700° разлагается лри нагревании с раствором щелочи плотность 6,1 г/сж . Нитрид галлия обладает полупроводниковыми, люминесцентными и каталитическими свойствами, в связи с чем его использование перспективно в ряде областей техники [1—3]. [c.22]
На всех применяемых катализаторах в той или иной степени идет дегидратация циклогексанола с образованием циклогексена и воды Исследование факторов, определяющих дегидрирующие и дегидратирующие свойства различных катализаторов, показало, что чистая окись цинка является катализатором дегидрирования. Добавки кислот и соединений хлора повышают дегидратирующее действие, а добавка щелочи снижает [26] При температуре выше 400°С метод приготовления катализатора не влияет, на его каталитические свойства. [c.115]
Ионообменные и каталитические свойства алюмосиликатных центров в Н+-форме рассматриваются ниже в гл. 6. Так называемые синтетические цеолиты , т. е. гели, приготовляемые путем реакции между силикатом и алюминатом натрия, сохраняющие натриевую форму, были использованы для воды, но оказались нестабильными при низких значениях pH и, в общем, не пригодными для катионного обмена. [c.800]
В составе титанового катализатора обязательно присутствие конституционной воды с удалением воды он так же, как и алюмосиликат, теряет свои каталитические свойства. [c.50]
Улучшению каталитических свойств цеолита способствует обмен аммонийной формы на трехвалентные катионы редкоземельных элементов (РЗЭ). Полноте ионообмена способствует ведение этой гидротермальной стадии при повышенных температурах (230 С) в автоклаве под давлением. Деалюминирование и последующее де-гидроксилирование протекают при 200-600 С. Активация в присутствии Nh4 или паров воды при температурах выше 750 С дает цеолит, стабильный при температурах выше 700 С. Его называют ультраста-бильным цеолитом. [c.104]
Работа посвящена экспериментальному исследованию адсорбционных и каталитических свойств углеродньге материалов и нанесенных на углерод катализаторов в процессах каталитического окисления веществ различной природы в водной фазе кислородом при повыщенных температурах и давлениях. Использованы как модельные растворы (хлор-, и азотсодержащие соединения), так и реальные стоки нефтехимических производств (- сернистые соединения), коксохимии (- аммиак, сернистые соединения), сточные воды щоколадной фабрики, спиртовых производств (- кислородсодержащие соединения), и другие. Исходные концентрации загрязняющих примесей были от 0.1 до 60 г/л, pH = 6.0 14. [c.87]
Алюмогедь (активный оксид алюминия)—частично гидратированный оксид алюминия. Воды в нем 1—3%, 5уд= 170-+300 м /г. Получают его из чистого гидроксида алюминия, который активируют азотной кислотой, а затем нагревают при 450Х. При 500°С активный у-оксид превращается в неактивную а-модификацию. Промышленность выпускает активный оксид алюминия двух сортов А-1 и А-2. Оксид алюминия А-1 содержит макропоры, насыпная плотность 0,4—0,5 г/см , А-2 не содержит макропоры, насыпная плотность 0,55—0,8 г/см . Это полярный специфический сорбент, но менее пористый, чем силикагель. Кроме того, он обладает меньшим поляризующим действием, чем силикагель. С повышением температуры колонки его каталитические свойства возрастают, что невыгодно и хроматографии. Применяя оксид алюминия, дезактивированный 2 Уо воды, можно значительно уменьшить удерживаемый объем высококипящих веществ и осуществить десорбцию легко-кипящих компонентов без нагрева колонки. Перед заполнением колонки оксид алюминия прокаливают до постоянной массы при 200—300°С. [c.170]
Гидриды рубидия и цезия чрезвычайно химически активные соединения. Они разлагают воду (бурно) и этанол, выделяя водород и образуя соответственно гидроокиси и алкоголяты. Уже под действием паров воды воздуха МеН окисляются, воспламеняясь. Самовоспламенение наблюдается в атмосфере фтора и хлора при этом образуются MeF и МеС1. При нагревании с азотом и аммиаком образуют амиды, с фосфором — фосфиды, с ацетяленом — ацетилиды. Обладая не только сильными восстановительными, но и каталитическими свойствами, они находят применение в реакциях конденсации и полимеризации [10]. [c.106]
Каталитическая активность N2864 в эквимольном растворе ацетона и фенола меняется приблизительно в 1000 раз [15] в зависимости от содержания воды [от 0.3 до 2.3% (мае.)]. Симбатность изменений кислот-но-каталитических свойств 1 2804 и константы скорости разложения ГПК подтверждается кинетическими данными [9]. [c.295]
Аномально высокие кислотно-каталитические свойства серной кислоты в смеси фенол—ацетон объясняются тем, что молекулы ацетона и фенола связаны за счет образования устойчивых ассоциатов фенол—ацетон, фенол—фенол, тримеров и полимеров фенола. Такие ассоциаты практически не используют Н2804, т.е. молекулы кислоты находятся в растворе в недиссоциированном состоянии. Известно, что именно недиссо-циированная молекула Н28О4 характеризуется аномально высокой кислотностью (Яо = -11.2) [19]. Недиссоциированная молекула кислоты обусловливает сильные кислотно-каталитические свойства данной каталитической системы и соответственно низкие значения Яц. Небольшие добавки воды к смеси фенол—ацетон приводят к диссоциации кислоты, образованию частиц в НзО и Н804 , кислотно-каталитические свойства которых слабее, чем свойства недиссоциированной молекулы кислоты. Дальнейшее увеличение содержания воды в растворителе должно приводить [c.296]
Условный ряд катионных иммобилизованных катализаторов начинается от простейшей Н-кислоты воды. В этой связи заметим, что, хотя концепция нанесенных катализаторов сформировалась как направление для металлокомплексных систем [106], нанесенные катализаторы были известны гораздо раньше. Твердые кислоты минерального происхождения с поверхностными льюисовскими и бренстедовскими центрами, по существу, являются первым примером иммобилизованных систем, на которых была установлена зависимость кислотно-каталитических свойств от природы носителя [40]. Хотя при формировании иммобилизованных катализаторов используются различные способы фиксации кислотного компонента - от пропитки, импрегнирования, интерколяции до химического ковалетного связывания, можно проследить общий характер влияния носителя на поведение катализатора. Являясь основанием или имея в своем составе места разной степени основности, подложка вступает с катализатором в кислотно-основные взаимодействия, зависящие от химической и физической природы компонентов. Благодаря наличию спектра кислотных (основных) свойств компонентов происходит отбор кислотно-основных взаимодействий в соответствии с известной концепцией жестких и мягких кислот и оснований (ЖМКО) [107]. В итоге подложка выступает как макролиганд, увеличивающий размеры ионов и стабилизирующий их. Как следствие, имеет место повышение кислотной силы и каталитической активности систем. [c.55]
Аналогично, другой традиционно используемый катализатор - серная кислота -проявляет каталитические свойства как комплексно-связанное соединение, например на сульфатах металлов [109, 110], так и в виде ковалентно присоединенных к матрице сульфогрупп, т.е. полимерных сульфокислот [114-117]. В обоих случаях чем больше количество связанной кислоты (80зН-групп) и чем сильнее ее связь с матрицей, тем выше кислотно-каталитическая активность. Обпще представления о характере действия таких катализаторов можно проиллюстрировать на примере сульфированных сополимеров стирола с дивинилбензолом. Как и для любой твердой матрицы, и в этом случае существенную роль играет проницаемость полимерной сетки, определяемая степенью сшивки, набухаемостью, размером гранул, а также другими факторами. Химическая сторона каталитического действия сульфока-тионитов связана с наличием сетки водородных связей, кооперативных эффектов и формированием ассоциатов - центров повышенной локальной концентрации кислотных групп [182,183]. Наличие остаточной воды обеспечивает необходимую подвижность протонов, динамический характер сетки и наблюдаемое в эксперименте соотношение активности и селективности действия. Встраивание субстрата в сетку предпочтительнее, чем простое взаимодействие его с поверхностью [184-186]. Учитывая низкую полярность олефинов, например изобутилена, можно предположить электрофильные превращения его в присутствии сульфокислот через промежуточное образование спирта и последующее встраивание в сетку матрицы. Ниже приведены возможные структурные элементы полимерных сульфокислот [c.57]
Общая тенденция увеличения каталитических свойств катионных систем полимеризации в присутствии подходящих сокатализаторов соблюдается и для нанесенных кислот Льюиса. Это проявляется, например, в существенном повышении кислотных свойств (до уровня суперкислот) и активности соединений SbF5, BF3 и других, включенных в графит, в присутствии протонодонорных добавок [154]. Реальные активные центры нанесенных кислот представляют динамическое сочетание льюисовских и бренстедовских центров, возникающих в процессе термообработки каталитических систем в присутствии воды, например для системы AIF3II носитель (Н2О) [128] [c.61]
Следовательно, кислотно-каталитические свойства растворимых аквакомплексов КпА1С1з п, характеризующихся низкой кислотной силой, проявляются при непосредственном участии мономера (субстрата) в качестве координирующей добавки. В процессе координации происходит взаимная ориентация аквакомплекса с мономером с последующей одновременной активацией связи воды и разрыхлением 71-связи олефина. Существенно, что в процессе кооперативного взаимодействия мономера с аквакомплексом происходит значительное увеличение бренстедовской кислотной силы комплекса, достигающее свойств сильной кислоты. Перенос протона не является, однако, лимитирующей стадией и согласован во времени с формированием противоиона, чему способствует предварительная координация воды с кислотой Льюиса. Можно утверждать, что формирование противоиона, в свою очередь, содействует переносу протона, т.е. в случае растворимых катионных систем возможен кооперативный механизм возбуждения [18,208-210. [c.83]
Получение аммиака за счет азота каменного угля зависит в значительной мере от характера проведения процесса коксования. Образующийся при коксовании аммиак под действием высокой температуры печи разлагается на свои составные части. На скорость разложения температура влияет таким образом, что чем выше она, тем больше скорость, и тем больше, конечно, доля разложившегося аммиака. По Майеру и Альтмайеру, предельная оптимальная температура образования аммиака в печи—около 800 С. Но разложение аммиака зависит также от каталитических свойств поверхности раскаленного угля, внутренней поверхности железной печи, в которой уголь подвергается нагреву, а также от продолжительности нахождения аммиака в соприкосновении с ними и присутствия в газовой смеси окиси углерода, двуокиси углерода—СО и СОг и других газов и паров воды. [c.20]
Распыленные металлы в воде, т. е. ух коллоидальные растворы. обладают сильными каталитическими свойствами. Они также теряют способность каталитического действия в присутстии некоторых веществ. Бредиг нашел между ними и органическими ферментами, в отношении их каталитических свойств и воздействия на них каталитических ядов, большое сходство. [c.106]
ИССЛЕДОВАНИЕ В. ИЯНИЯ РЕАКЦИОННОЙ ВОДЫ КОНВЕРСИИ МЕТАНОЛА НА КАТАЛИТИЧЕСКИЕ СВОЙСТВА ЦЕОЛИТНЫХ КАТАЛИЗАТОРОВ [c.40]
Рябов Ю. В., Ерофеев В. Я. Исследование влияния реакционной воды конверсип метанола на каталитические свойства цеолитных катализаторов. ......................... 40 [c.176]
ИССЛЕДОВАНИЕ ВЛИЯНИЯ РЕАКЦИОННОЙ ВОДЫ КОНВЕРСИИ МЕТАНОЛА НА КАТАЛИТИЧЕСКИЕ СВОЙСТВА ЦЕОЛИТОВЫХ КАТАЛИ-ЗАТОРОВ/Рлбов 10. В., Ерофеев В, И. // Структура растворов п дисперсий Свойства коллоидных систем и нефтяных растворов полимеров.— Новосибирск Наука. Сиб. отд-ние, 1989. [c.179]
chem21.info

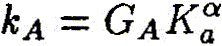
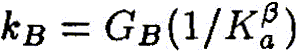
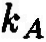 ,
,
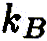 — константы скорости реакции,
— константы скорости реакции,
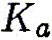 — константа диссоциации кислоты,
— константа диссоциации кислоты,
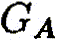 ,
,
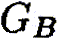 —константы; индексы
—константы; индексы
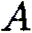 и
и
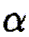 относятся к кислоте,
относятся к кислоте,
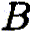 и
и
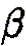 — к основанию.
— к основанию.