Чистые вещества и смеси. Способы разделения смесей. Дистиллированная вода смесь или чистое вещество
Чистые вещества и смеси. Способы разделения смесей
В нашей статье мы рассмотрим, что такое чистые вещества и смеси, способы разделения смесей. В повседневной жизни их использует каждый из нас. А встречаются ли вообще в природе чистые вещества? И как отличить их от смесей?
Чистые вещества и смеси: способы разделения смесей

Чистыми называют вещества, которые содержат частицы только определенного вида. Ученые считают, что в природе их практически не существует, поскольку все они, хоть и в ничтожных долях, содержат примеси. Абсолютно все вещества также являются растворимыми в воде. Даже если погрузить в эту жидкость, к примеру, серебряное кольцо, ионы этого металла перейдут в раствор.
Признаком чистых веществ являются постоянство состава и физических свойств. В процессе их образования происходит изменение количества энергии. Причем она может как увеличиваться, так и уменьшаться. Разделить чистое вещество на отдельные составляющие можно только с помощью химической реакции. К примеру, только дисциллированная вода обладает типичной для этого вещества температурой кипения и замерзания, отсутствием вкуса и запаха. А разложить ее кислород и водород можно только путем электролиза.
А чем отличаются от чистых веществ их совокупности? Ответить на этот вопрос нам поможет химия. Способы разделения смесей являются физическими, поскольку они не приводят к изменению химического состава веществ. В отличие от чистых веществ, смеси имеют непостоянный состав и свойства, а разделить их можно физическими методами.
Что такое смесь
Смесью называют совокупность индивидуальных веществ. Ее примером является морская вода. В отличие от дисциллированной, она обладает горьким или соленым вкусом, кипит при более высокой, а замерзает при более низкой температуре. Способы разделения смесей веществ являются физическими. Так, из морской воды можно добыть чистую соль путем выпаривания и последующей кристаллизации.

Виды смесей
Если добавить в воду сахар, через некоторое время его частички растворятся и станут невидимыми. В результате их невозможно будет отличить невооруженным глазом. Такие смеси называют однородными, или гомогенными. Их примерами также являются воздух, бензин, бульон, духи, сладкая и соленая вода, сплав меди и алюминия. Как видите, однородные смеси могут находиться в разных агрегатных состояниях, но чаще всего встречаются жидкости. Их также называют растворами.
В неоднородных, или гетерогенных смесях можно различить частицы индивидуальных веществ. Железные и деревянные опилки, песок и поваренная соль являются их типичными примерами. Неоднородные смеси также называют взвесями. Среди них различают суспензии и эмульсии. В состав первых входит жидкость и твердое вещество. Так, эмульсией является смесь воды и песка. Эмульсией называют совокупность двух жидкостей с разной плотностью.
Существуют неоднородные смеси и со специальными названиями. Так, примером пены является пенопласт, а к аэрозолям относятся туман, дым, дезодоранты, освежители воздуха, антистатики.

Способы разделения смесей
Безусловно, многие смеси обладают более ценными свойствами, чем отдельно взятые индивидуальные вещества, входящие в их состав. Но даже в быту возникают ситуации, когда их необходимо разделить. А в промышленности на этом процессе основаны целые производства. К примеру, из нефти в результате ее переработки получают бензин, газойль, керосин, мазут, соляровое и машинное масло, ракетное топливо, ацетилен и бензол. Согласитесь, выгоднее использовать эти продукты, чем бездумно сжигать нефть.
Теперь давайте разберемся, существует ли такое понятие, как химические способы разделения смесей. Допустим, из водного раствора соли нам необходимо получить чистые вещества. Для этого смесь необходимо нагреть. В результате вода превратится в пар, а соль кристаллизируется. Но при этом не произойдет превращения одних веществ в другие. Это значит, что основой данного процесса являются физические явления.
Способы разделения смесей зависят от агрегатного состояния, способности к растворимости, разнице в температуре кипения, плотности и состава ее компонентов. Рассмотрим каждый из них более подробно на конкретных примерах.
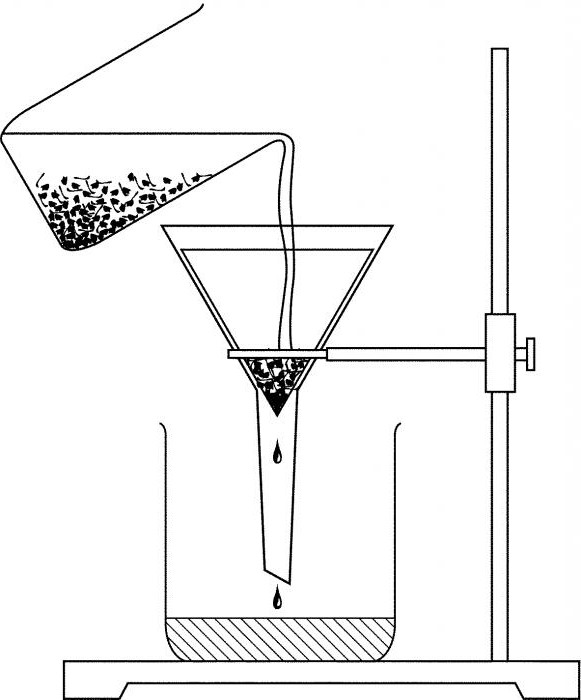
Фильтрование
Этот способ разделения подходит для смесей, в состав которых входят жидкость и нерастворимое в нем твердое вещество. К примеру, вода и речной песок. Эту смесь необходимо пропустить через фильтр. В результате чистая вода свободно пройдет через него, а песок останется.
Отстаивание
Некоторые способы разделения смесей основаны на действии силы тяжести. Таким образом на чистые вещества можно разложить суспензии и эмульсии. Если в воду попало растительное масло, такую смесь сначала необходимо взболтать. Потом оставьте ее на некоторое время. В результате вода окажется на дне сосуда, а масло в виде пленки будет покрывать ее.
В лабораторных условиях для отстаивания используют делительную воронку. В результате ее работы более плотная жидкость сливается в сосуд, а легкая остается.
Отстаивание характеризуется низкой скоростью протекания процесса. Необходимо определенное время, чтобы сформировался осадок. В промышленных условиях этот способ осуществляют в специальных конструкциях, которые называются отстойники.
Действие магнитом
Если в состав смеси входит металл, то ее можно разделить при помощи магнита. К примеру, отделить железные и деревянные опилки. Но все ли металлы обладают такими свойствами? Вовсе нет. Для этого способа подойдут только смеси, содержащие ферромагнетики. Кроме железа к ним относятся никель, кобальт, гадолиний, тербий, диспрозий, гольмий, эрбий.

Дистилляция
Это название в переводе с латинского языка означает "стекание каплями". Дистилляция представляет способы разделения смесей, основанные на разнице в температурах кипения веществ. Таким образом, даже в домашних условиях можно разделить спирт и воду. Первое вещество начинает испаряться уже при температуре 78 градусов по Цельсию. Касаясь холодной поверхности пары спирта конденсируются, переходя в жидкое состояние.
В промышленности таким способом получают продукты переработки нефти, душистые вещества, чистые металлы.

Выпаривание и кристаллизация
Эти способы разделения смесей подходят для жидких растворов. Вещества, которые входят в их состав, отличаются температурой кипения. Таким образом, можно получить кристаллы соли или сахара из воды, в которой они растворены. Для этого растворы нагревают и выпаривают до насыщеного состояния. В этом случае кристаллы осаждаются. Если же необходимо получить чистую воду, тогда раствор доводят до кипения с последующей конденсацией паров на более холодной поверхности.

Способы разделения газовых смесей
Газообразные смеси разделяют лабораторными и промышленными способами, поскольку этот процесс требует наличия специального оборудования. Сырьем природного происхождения является воздух, коксовый, генераторный, попутный и природный газ, представляющий собой совокупность углеводородов.
Физические способы разделения смесей, находящихся в газообразном состоянии следующие:
- Конденсация - это процесс постепенного охлаждения смеси, в ходе которого происходит конденсация ее составляющих. При этом в первую очередь в жидкое состоние переходят высококипящие вещества, которые собираются в сепараторах. Таким образом получают водород из коксового газа, а также отделяют аммиак из непрореагировавшей части смеси.
- Сорбирование - это поглощение одних веществ другими. Этот процесс имеет противоположные составляющие, между которыми в ходе реакции устанавливается равновесие. Для прямого и обратного процесса необходимы различные условия. В первом случае это сочетание высокого давления и низкой температуры. Такой процесс называют сорбцией. В обратном случае используют противоположные условия: низкое давление при высокой температуре.
- Мембранное разделение - способ, при котором используют свойство полупроницаемых перегородок избирательно пропускать молекулы различных веществ.
- Дефлегмация - процесс конденсации высококипящих частей смесей в результате их охлаждения. При этом температура перехода в жидкое состояние отдельных компонентов должна отличаться в значительной степени.
Хроматография
Название этого способа можно перевести как "пишу цветом". Представьте, что в воду добавлены чернила. Если опустить в такую смесь конец фильтровальной бумаги, она начнет впитываться. При этом вода будет поглощаться быстрее чернил, что связано с разной степенью сорбируемости этих веществ. Хроматография является не только способом разделения смесей, но и методом изучения таких свойств веществ, как диффузия и растворимость.
Итак, мы познакомились с такими понятиями, как "чистые вещества" и "смеси". Первые представляют собой элементы или соединения, состоящие только из частиц определенного вида. Их примерами являются соль, сахар, дисциллированная вода. Смеси - это совокупность индивидуальных веществ. Для их разделения используют ряд методов. Способ их разделения зависит от физических свойств его составляющих. К основным из них относятся отстаивание, выпаривание, кристаллизация, фильтрование, дистилляция, действие магнитом и хроматография.
fb.ru
Разделение смесей. Очистка веществ. Фильтрование.
Чистые вещества и смеси
Мы живем среди химических веществ. Мы вдыхаем воздух, а это смесь газов (азота, кислорода и других), выдыхаем углекислый газ. Умываемся водой - это еще одно вещество, самое распространенное на Земле. Пьём молоко - смесь воды с мельчайшими капельками молочного жира, и не только: здесь еще есть молочный белок казеин, минеральные соли, витамины и даже сахар, но не тот, с которым пьют чай, а особый, молочный - лактоза. Едим яблоки, которые состоят из целого набора химических веществ - здесь и сахар, и яблочная кислота, и витамины... Когда прожеванные кусочки яблока попадают в желудок, на них начинают действовать пищеварительные соки человека, которые помогают усваивать все вкусные и полезные вещества не только яблока, но и любой другой пищи. Мы не только живем среди химических веществ, но и сами из них состоим. Каждый человек - его кожа, мышцы, кровь, зубы, кости, волосы построены из химических веществ, как дом из кирпичей. Азот, кислород, сахар, витамины - вещества природного, естественного происхождения. Стекло, резина, сталь – это тоже вещества, точнее, материалы (смеси веществ). И стекло, и резина - искусственного происхождения, в природе их не было. Совершенно чистые вещества в природе не встречаются или встречаются очень редко.
Каждое вещество всегда содержит определенное количество примесей. Вещество, в котором почти нет примесей, называют чистым. С такими веществами работают в научной лаборатории, школьном химическом кабинете. Заметим, что абсолютно чистых веществ не существует.
Индивидуальное чистое вещество обладает определённым набором характеристических свойств (постоянными физическими свойствами). Только чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь - целостная система, состоящая из разнородных компонентов».
Смесями являются почти все природные вещества, продукты питания (кроме соли, сахара, некоторых других), многие лекарственные и косметические средства, товары бытовой химии, строительные материалы.
Признаки сравнения | Чистое вещество | Смесь |
Состав | Постоянный | Непостоянный |
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Каждое вещество, содержащееся в смеси, называют компонентом.
Существуют однородные и неоднородные смеси.

Добавим небольшую порцию сахара в стакан с водой и будем перемешивать, пока весь сахар не растворится. Жидкость будет иметь сладкий вкус. Таким образом, сахар не исчез, а остался в смеси. Ho его кристалликов мы не увидим, даже рассматривая каплю жидкости в мощный микроскоп. Приготовленная смесь сахара и воды является однородной в ней равномерно перемешаны мельчайшие частицы этих веществ.
Большинство металлических сплавов - также однородные смеси. Например, в сплаве золота с медью (его используют для изготовления ювелирных украшений) отсутствуют красные частицы меди и желтые частицы золота.
Из материалов, которые являются однородными смесями веществ, изготовляют много предметов разнообразного назначения.
К однородным смесям принадлежат все смеси газов, в том числе и воздух. Существует немало однородных смесей жидкостей.
Однородные смеси еще называют растворами, даже если они твердые или газообразные.
Приведём примеры растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
Вам известно, что мел не растворяется в воде. Если его порошок всыпать в стакан с водой, то в образовавшейся смеси всегда можно обнаружить частицы мела, которые видны невооруженным глазом или в микроскоп.
К неоднородным смесям относятся большинство минералов, почва, строительные материалы, живые ткани, мутная вода, молоко и другие продукты питания, некоторые лекарственные и косметические средства.
В неоднородной смеси физические свойства компонентов сохраняются. Так, железные опилки, смешанные с медными или алюминиевыми, не теряют способности притягиваться к магниту.
Некоторые виды неоднородных смесей имеют специальные названия: пена (например, пенопласт, мыльная пена), суспензия (смесь воды с небольшим количеством муки), эмульсия (молоко, хорошо взболтанные растительное масло с водой), аэрозоль (дым, туман).
Способы разделения смесей
В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Существует много методов разделения смесей. Их выбирают, учитывая тип смеси, агрегатное состояние и различия в физических свойствах компонентов.

Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных и гомогенных смесей.
Пример смеси | Способ разделения |
Суспензия - смесь речного песка с водой | Отстаивание Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. В лаборатории это можно сделать с помощью делительной воронки. Нефть или растительное масло образует верхний, более легкий слой. В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке. |
Смесь песка и поваренной соли в воде | Фильтрование Разделение гетерогенных смесей с помощью фильтрования основано на различной растворимости веществ в воде и на различных размерах частиц. Через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие. Способ фильтрования - это основа работы бытовой техники, например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов - респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру - герою произведения Ильфа и Петрова - удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»). |
Смесь порошка железа и серы | Действие магнитом или водой Порошок железа притягивался магнитом, а порошок серы - нет. Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно. |
Раствор соли в воде - гомогенная смесь | Выпаривание или кристаллизация Вода испаряется, а в фарфоровой чашке остаются кристаллы соли. При выпаривании воды из озер Эльтон и Баскунчак получают поваренную соль. Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества. Если вещество, например сахар, разлагается при нагревании, то воду испаряют неполностью - упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара. Иногда требуется очистить от примесей растворители с меньшей температурой кипения, например воду от соли. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой. В специальных приборах - дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей. В домашних условиях можно сконструировать такой дистиллятор. Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с tкип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти. |
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография.
Если подвесить полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но граница подъема краски отстает от границы подъема воды. Так происходит разделение двух веществ: воды и красящего вещества в чернилах.
С помощью хроматографии русский ботаник М. С. Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Для различных целей необходимы вещества с различной степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно предварительно прокипятить. А в химических лабораториях для приготовления растворов и проведения опытов, в медицине необходима дистиллированная вода, максимально очищенная от растворенных в ней веществ. Особо чистые вещества, содержание примесей в которых не превышает одной миллионной процента, применяются в электронике, в полупроводниковой, ядерной технике и других точных отраслях промышленности.
examchemistry.com
урок № 4 - ХИМИЯ!FOREVER!
Чистые вещества и смеси.Способы разделения смесей.
Мы живем среди химических веществ. Мы вдыхает воздух, а это смесь газов (азота, кислорода и других), выдыхаем углекислый газ. Умываемся водой - это еще одно вещество, самое распространенное на Земле. Пьём молоко - смесь воды с мельчайшими капельками молочного жира, и не только: здесь еще есть молочный белок казеин, минеральные соли, витамины и даже сахар, но не тот, с которым пьют чай, а особый, молочный - лактоза. Едим яблоки, которые состоят из целого набора химических веществ - здесь и сахар, и яблочная кислота, и витамины... Когда прожеванные кусочки яблока попадают в желудок, на них начинают действовать пищеварительные соки человека, которые помогают усваивать все вкусные и полезные вещества не только яблока, но и любой другой пищи. Мы не только живем среди химических веществ, но и сами из них состоим. Каждый человек - его кожа, мышцы, кровь, зубы, кости, волосы построены из химических веществ, как дом из кирпичей. Азот, кислород, сахар, витамины – вещества природного, естественного происхождения. Стекло, резина, сталь – это тоже вещества, точнее, материалы (смеси веществ). И стекло, и резина - искусственного происхождения, в природе их не было. Совершенно чистые вещества в природе не встречаются или встречаются очень редко.
Чем же отличаются чистые вещества от смесей веществ?
Индивидуальное чистое вещество обладает определённым набором характеристических свойств (постоянными физическими свойствами).
Сравните свойства дистиллированной и морской воды

Только чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему?
Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными.
Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Сравнительная характеристика смеси и чистого вещества
Признаки сравнения | Чистое вещество | Смесь |
Состав | Постоянный | Непостоянный |
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Смеси отличаются друг от друга по внешнему виду.
Классификация смесей показана в таблице:

Приведём примеры суспензий (речной песок + вода), эмульсий (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
В суспензиях видны частицы твердого вещества, в эмульсиях – капельки жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах компоненты не различимы, они являются однородными (гомогенными) смесями.
Способы разделения смесей
В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей

Эти способы основаны на различиях в физических свойствах компонентов смеси.
Разделение смеси нерастворимых веществ.
Разделение смеси воды и растительного масла.
способы разделения однородных и неоднородных смесей
I.Для закрепления выполните упражнение:
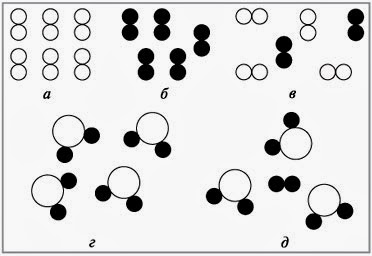
1.Определите, где на рисунке изображено простое вещество, сложное вещество или смесь.
II. Задания для закрепления
1) Поработайте с тренажёрами №1-4
Тренажёр №1. Чистые вещества и смеси
Тренажёр №2. Смеси
Тренажёр №3. Смеси в природе
Тренажёр №4. Смеси в сельском хозяйстве
2) Решите задачу:
Дана смесь сахара, речного песка и железных опилок. Предложите способ разделения этой смеси.3) Творческое задание:
Подготовьте электронную презентацию на тему "Чистые вещества и смеси, которые нас окружают", используя Тренажёр №1
химия 8 - 1 четверть темы уроков
sites.google.com
1.4. Чистые вещества и смеси
Чистое вещество содержит частицы только одного вида. Примерами могут служить серебро (содержит только атомы серебра), серная кислота и оксид углерода (IV) (содержат только молекулы соответствующих веществ). Все чистые вещества имеют постоянные физические свойства, например, температуру плавления (Тпл) и температуру кипения (Ткип).
Вещество не является чистым, если содержит какое-либо количество одного или нескольких других веществ – примесей.
Загрязнения понижают температуру замерзания и повышают температуру кипения чистой жидкости. Например, если в воду добавить соль, температура замерзания раствора понизится.
Смеси состоят из двух или более веществ. Почва, морская вода, воздух – все это примеры различных смесей. Многие смеси могут быть разделены на составные части – компоненты – на основании различия их физических свойств.
Различают гомогенные (однородные) и гетерогенные (неоднородные) смеси. Особенностью гомогенной смеси является то, что между компонентами такой смеси не наблюдается поверхности раздела. В этом случае говорят, что данная смесь является однофазной (фаза часть системы отделенная от других частей видимой поверхностью раздела). В пределах одной фазы физические свойства компонентов сохраняются постоянными. К гомогенным системам относятся истинные растворы (размер частиц растворенного вещества соотносится с размерами частиц растворителя и составляет ≤10-9м).
Особенностью гетерогенной смеси является то, что мы можем наблюдать поверхность раздела между ее компонентами. При переходе из одной фазы компонента в другую его свойства резко изменяются. Гетерогенные смеси иначе называются дисперсные системы. Дисперсные системы состоят из дисперсионной среды (растворитель, непрерывная фаза) и дисперсной фазы (растворенного вещества или прерывистой фазы)
К гетерогенным смесям относятся дисперсные системы (размер частиц растворенного вещества значительно превышает размер частиц растворителя и составляет ≥10-9м). Смеси, в которых размер частиц вещества составляет 10-7 -10-9 м, относятся к коллоидным системам.
К дисперсным системам относятся:
- суспензии, смесь, состоящая из твердой и жидкой фазы (обозначение Т/Ж; Т- дисперсная фаза, Ж – дисперсионная среда)
- эмульсии, смесь из 2-х и более несмешивающихся жидкостей (обозначение – Ж/Ж. Дисперсная фаза и дисперсионная среда жидкости различающиеся по плотности и температурам кипения).
Более подробно данные системы будут рассмотрены в теме растворы и дисперсные системы.
1.5. Методы разделения смесей
Традиционными методами, которые используются в лабораторной практике с целью разделения смесей на отдельные компоненты, являются:
фильтрование,
декантация (в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка),
разделение с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка (в том числе фракционная перегонка),
хроматография,
возгонка и другие.
Фильтрование. Для отделения жидкостей от взвешенных в ней мелких твердых частиц применяют фильтрование (рис.37), т.е. процеживание жидкости через мелкопористые материалы – фильтры, которые пропускают жидкость и задерживают на своей поверхности твердые частицы. Жидкость, прошедшая через фильтр и освобожденная от находившихся в ней твердых примесей, называется фильтратом.
В лабораторной практике часто применяют гладкие и складчатые бумажные фильтры (рис.38), сделанные из непроклеенной фильтровальной бумаги.
Для фильтрования горячих растворов (например, с целью перекристаллизации солей), применяют специальную воронку для горячего фильтрования (рис.39) с электрическим или водяным обогревом).
Часто применяют фильтрование под вакуумом. Фильтрование под вакуумом используют для ускорения фильтрования и более полного освобождения твердой фазы от жидкой. Для этой цели собирают прибор для фильтрования под вакуумом (рис.40). Он состоит из колбы Бунзена, фарфоровой воронки Бюхнера, предохранительной склянки и вакуум-насоса (обычно водоструйного).
В случае фильтрования суспензии малорастворимой соли кристаллы последней могут быть промыты дистиллированной водой на воронке Бюхнера для удаления с их поверхности исходного раствора. Для этой цели используют промывалку (рис.41).
Декантация. Жидкости могут быть отделены от нерастворимых твердых частиц декантацией (рис.42). Этот метод можно применять, если твердое вещество имеет большую плотность, чем жидкость. Например, если речной песок добавить в стакан с водой, то при отстаивании он осядет на дно стакана, потому что плотность песка больше, чем воды. Тогда вода может быть отделена от песка просто сливанием. Такой метод отстаивания и последующего сливания фильтрата и называется декантацией.
Центрифугирование. Для ускорения процесса отделения очень мелких частиц, образующих в жидкости устойчивые суспензии или эмульсии, используют метод центрифугирования. Этим методом можно разделить смеси жидких и твердых веществ, различающихся по плотности. Разделение проводится в ручных или электрических центрифугах (рис.43).
Разделение двух несмешивающихся жидкостей, имеющих различную плотность и не образующих устойчивых эмульсий, можно осуществить с помощью делительной воронки (рис.44). Так можно разделить, например, смесь бензола и воды. Слой бензола (плотность = 0,879 г/см3)располагается над слоем воды, которая имеет большую плотность ( = 1,0 г/см3). Открыв кран делительной воронки, можно аккуратно слить нижний слой и отделить одну жидкость от другой.
Выпаривание (рис.45) – этот метод предусматривает удаление растворителя, например, воды из раствора в процессе нагревания его в выпарительной фарфоровой чашке. При этом выпариваемая жидкость удаляется, а растворенное вещество остается в выпарительной чашке.
Кристаллизация – это процесс выделения кристаллов твердого вещества при охлаждении раствора, например, после его упаривания. Следует иметь в виду, что при медленном охлаждении раствора образуются крупные кристаллы. При быстром охлаждении (например, при охлаждении проточной водой) образуются мелкие кристаллы.
Перегонка - метод очистки вещества основанный на испарении жидкости при нагревании с последующей конденсацией образовавшихся паров. Очистка воды от растворенных в ней солей (или других веществ, например, красящих) перегонкой называется дистилляцией, а сама очищенная вода – дистиллированной.
Фракционная перегонка (дистилляция) (рис.46) применяется для разделения смесей жидкостей с различными температурами кипения. Жидкость с меньшей температурой кипения закипает быстрее и раньше проходит через фракционную колонку (или дефлегматор). Когда эта жидкость достигает верха фракционной колонки, то попадает в холодильник, охлаждается водой и через аллонж собирается в приемник (колбу или пробирку).
Фракционной перегонкой можно разделить, например, смесь этанола и воды. Температура кипения этанола 780С, а воды 1000С. Этанол испаряется легче и первым попадает через холодильник в приемник.
Возгонка – метод применяется для очистки веществ, способных при нагревании переходить из твердого состояния в газообразное, минуя жидкое состояние. Далее пары очищаемого вещества конденсируются, а примеси, не способные возгоняться, отделяются.
studfiles.net











