1.4.2. Определение карбонатной жёсткости воды. Жесткость воды карбонатная
Карбонатная жесткость воды: определение и вычисление

Представить себе жизнь без воды сегодня невозможно. Любой человек использует ее каждый день, не обходится без воды и производство. Во многих технологических процессах воду используют постоянно. Производство микросхем, даже абразивные чистки применяют воду с завидным постоянством. И можно смело утверждать, что без качественной воды сегодня не продержаться на рынке. Что касается обычных потребителей, то вода плохого качества влияет на здоровье. Негативно влияет. Снижает качество обработки продуктов и многое-многое другое.
В чем причина плохого качества воды? Что делает ее жесткой? Сразу нужно уточнить, что варианты загрязнения могут быть самыми разными. От банальной грязи и твердых примесей, до невидимых органических примесей, которые могут сделать воду вирусоносной, жесткой или железистой.
Способов смягчения жесткой воды на сегодня идентифицировано несколько. Что вообще понимают под термином «жесткость»? Это такая характеристика воды, которая подразумевает под собой наличие в воде определенного размера включений солей кальция и магния.
Карбонатная жесткость воды подразумевает наличие в воде карбонатных солей. Это как раз и есть соли кальция и магния. Жесткость может быть и сульфатной. Но в большинстве случаев встречается именно карбонатная. А это практически 98 процентов случаев. Потому и будем уделять карбонатной жесткости воды больше всего внимания.
Итоговое содержание солей в воде именуют жесткостью. Даже если быть совсем точной, то это общая жесткость. Для жизни это один из самых важных факторов. Для производства также есть большое значение в этом показателе. Для тех, кто держит аквариум, карбонатная жесткость воды также является важным показателем. Т.к. в очень некачественной воде рыбы жить не смогут. Данный показатель подвергается постоянному контролю. Даже пресную воду следует различать по жесткости.
Общую жесткость делят на два подвида постоянную и временную. Эти виды также могут называться карбонатной, то есть временной и некарбонатной, то есть постоянной.
Карбонатную жесткость воды образуют гидрокарбонаты и карбонаты кальция и магния, о которых говорилось выше, при показателе кислотно-щелочного баланса, равного 8,3. Некарбонатную жесткость образуют кальциевые и магниевые соли сильнодействующих кислот.
Соли, образующие жесткость, ведут себя по-разному в воде. Одни при нагреве выпадают в осадок, другие полностью растворяются. Это и послужило признаком иерархии. Соли, которые создавали малорастворимый осадок, создали временную жесткость, то есть устранимую. Те же соли, которые растворялись в воде, образовали постоянную жесткость.
Более или менее с начальными понятиями определились. Теперь рассмотрим более подробно про снижение жесткости воды и узнаем, какие вещества и как образуют столь нужную нам для рассмотрения карбонатную жесткость воды.
Временная жесткость воды присутствует вместе с двухвалентными катионами кальция, магния и железа, а также бикарбонатных и гидрокарбонатных анионов. Стоит такую воду нагреть, и гидрокарбонаты разлагаются. На смену им приходят – малорастворимый карбонатный осадок, вода и углекислый газ.
Когда говорят об устранении жесткости в воде, то имеют в виду именно карбонатную жесткость воды. Ее можно устранить из воды, т.к. ее составляющие вступают в реакцию. Это временное явление и даже прокипятив воду, жесткость можно убрать, правда, тогда все прелести такой воды в виде накипи осядут на стенках оборудования.
Ну и постоянная жесткость остается в воде и после кипячения. Источники ее создания, это сульфаты, силикаты, хлориды и нитраты. На постоянную жесткость нельзя повлиять. Правда, при устранении карбонатной жесткости воды уменьшается количество и постоянной.
Что понимают под временной и постоянной жесткостью мы разобрались. Какие же на сегодня существуют варианты устранения карбонатной жесткости? Можно ли без лишних расходов сделать это в домашних условиях? И почему так вредная некачественная вода?
О накипи можно слагать легенды. Каждый из нас лицезрел ее на стенках чайника, кастрюль, не знал как с ней справится, когда она покрывает прочным слоем сеточку крана. Чего и говорить, но жесткая вода в домашних условиях, одна из самых больших проблем любой хозяйки. Времени на устранение уходит очень много, денег при этом не меньше, и бытовые приборы страдают от устранения налета не меньше, чем от самой накипи.
Но кроме бытовых проблем, данные методы устранения жесткости воды доставляют огромное количество неприятностей промышленности. Котельные, металлургия, микроэлектроника, химическая промышленность, теплоэнергетика. Все эти отрасли обойтись без качественной воды не могут. Качественная вода предполагает в дальнейшем производство качественной продукции.
И естественно очистка воды является главным производственным элементом в пищевой промышленности. Нельзя произвести вкусную и полезную воду, когда ее плохо очистили. Поэтому что дома в своей квартире, что на промышленном производстве умягчению воды следует уделять достаточно внимания.
Кроме умягчения можно бороться просто с накипью. Для этого достаточно устранять налет своевременно. Но проводить такие процедуры нужно постоянно и использовать для этого агрессивные средства или специальные механические приборы, которые позволят очистить даже самый толстый слой накипи.
Способы определения карбонатной жесткости воды
Как и у каждой чистки, у очищения накипи есть масса недостатков. Мало того, что расходы на приобретение средств становятся постоянными и не малыми, так еще и бытовые приборы не так просто чистить. Да и поверхности никогда уже не будут по-прежнему гладкими. И естественно с каждым устранением накипи, поверхность будет становиться все более испорченной, а новые отложения будут образовываться быстрее. Может начать развиваться коррозия. Чтобы этого не произошло, давайте узнаем какие применяются способы для определения карбонатной жесткости воды.
Что у самой воды, что у накипи есть несколько особенностей, делающих их образование крайне неприятным. Некачественная вода плохо растворяет моющие средства. И это притом, что мы все моем в воде. Такая особенность вызывает резкое увеличение расходов и мыла с порошком и воды. Вода сегодня стоит немало, чтобы постоянно платить за определение карбонатной жесткости воды.
Что же касается непосредственно накипи, то она почти не проводит тепло. И из-за этого все беды. Образовываясь на топливных поверхностях и элементах, она просто полностью блокирует нормальную работу любого нагревательного прибора. В результате происходят необратимые вещи. Если не убирать такой налет своевременно.
Таблица. Виды и способы определения жесткости воды
| Состав исходной воды | Вид жесткости | Способ определения жесткости воды | |
| катионы кальция | анионы магния | ||
| Са Mg | С плюсом | Карбонатная или некарбонатная | Химический анализ |
| Са Mg | С минусом
| Постоянная или временная | Тест-полоска для определения жесткости |
| Са Mg | Положительный заряд
| Временная, карбонатная и в малой степени общая | Специализированная лаборатория |
Если вы пренебрегли каким либо способом, приведённым в таблице, вы можете лишиться своего дорогостоящего оборудования. Каждый из приведенных в таблице способов определения карбонатной жесткости воды крайне важен!
Во-первых, ухудшается работа любого оборудования или бытового прибора. КПД резко идет вниз. Из-за того, что накипь плохо нагревается, приходится расходовать в разы больше топлива, электричества, мощности с целью хоть как то нагреть воду. Для промышленности такая особенность накипи выливается в огромные расходы. Прибор постепенно покрывается накипью, пока поверхность практически полностью прекращает передавать тепло воде. Тогда срабатывает система защиты. Прибор самопроизвольно отключается, с целью защитить себя от перегрева. Получив такой сигнал, приступить к очистке поверхностей следует немедленно.
.jpg) Накипи ведь много не надо. Из стадии легкий известковый налет она быстро переходит в стадию твердый известковый камень, который так легко не уберешь. И когда поверхности покрыты вот таким камнем и происходит перегорание прибора. Иногда это может выглядеть как взрыв или трещина, в чем тоже мало приятного. Трубы в водопроводе разрывает и протирает по этой причине.
Накипи ведь много не надо. Из стадии легкий известковый налет она быстро переходит в стадию твердый известковый камень, который так легко не уберешь. И когда поверхности покрыты вот таким камнем и происходит перегорание прибора. Иногда это может выглядеть как взрыв или трещина, в чем тоже мало приятного. Трубы в водопроводе разрывает и протирает по этой причине.
Возиться с постоянным устранением налета, особенно в промышленности чрезвычайно накладно. Существует ряд способов, как справиться с повышенной жесткостью воды не повредив всю систему. Средства от накипи не дешевые. Как и вызов бригады для очистки. Подвергать таким нагрузкам поверхности постоянно тоже нельзя. Какой же путь избрать? Как наиболее эффективно бороться с карбонатной жесткостью воды?
Сразу скажу, что определение карбонатной жесткости воды в домашних условиях невозможно. Единственный, так сказать, кустарный вариант доступен только для очищения очень малого количества воды. И это вода будет скорее лечебной, чем просто умягченной. Многие ведь считают, что умягчители воды – дорогое удовольствие. Сегодня, к счастью это не так. Грамотность населения и просвященность в сфере очистки воды с каждым годом растет и потому между производителями фильтров для воды увеличивается конкуренция. И в ценах на подобные очистительные приборы наметилась положительная динамика к снижению.
Но вернемся к определению карбонатной жесткости воды в домашних условиях. Единственный материал, который позволит вам действительно получить качественную воду, это кремний. Все, что вам для этого нужно, это купить кусочек кремния и настоять на нем воду в течении недели. Вода получается мягкой, еще и снабженной всевозможными полезными веществами. Все полезные свойства кремния еще не изучены до конца, в будущем его планирует плотно использовать медицина. Но для очищения воды в домашних условиях, его достаточно, только для небольших обьемов.
Если же вы хотите поставить определение жесткости воды на поток, то вам нужен не просто умягчитель, вам нужна водоподготовка. Обойтись одним фильтром проблематично. Вода для быта и вода для потребления несколько разные инстанции и требования к качеству немного отличаются.
Для максимальной защиты предприятия или семьи дома потребуется, как минимум два умягчителя воды. Причем один должен чистить всю воду, априори. Другой будет проводить дополнительную очистку, которая поможет получить качественную питьевую воду. Для общих целей больше всего подходят, да и их чаще всего, и используют ионообменный фильтр для воды и электромагнитный умягчитель воды АкваЩит. Для получения вкусной питьевой воды лучше всего подойдет обратный осмос или фильтр-кувшин. Если уж совсем экономично.
Для специальной очистки, которая нужна в той же фармакологии или микроэлектронике используют микро или нанофильтрацию. Из последовательного соединения всех этих приборов и складывается водоподготовка. Часто, когда обрабатывают первичную воду, такую систему дополнительно оснащают механическими фильтрами, обеззараживателями, кондиционерами и обезжелезивателями. Тогда чистка идет сто процентная. От А до Я.
В быту из всех фильтров больше всего сегодня помогают избавиться от карбонатной жесткости воды электромагнитные приборы АкваЩит. Еще совсем недавно самыми прогрессивными очистителями считались магнитные устройства. Но в процессе эксплуатации было выявлена уйма недостатков, которые очень быстро привели к закату «звезды» магнитного устройства. Тогда собственно и изобрели электромагнитный прибор, как улучшенный вариант магнита.
Ионообменный фильтр хоть и считается одним из самых старых способов понижения жесткости воды, но тем не менее сегодня по прежнему занимает лидирующие позиции. Хотя в работе он довольно затратный. Его фильтрующая смола после полного забивания солями жесткости требует замены или восстановления. Стоит сменный картридж не то, чтобы дорого, но и не дешево. Менять при этом фильтр приходится раз в квартал.
Как вычислить карбонатную жесткость воды?
Теперь зададимся вопросом: как вычислить карбонатную жесткость воды? Вот лишь несколько способов, как это можно сделать:
- Сделать химический анализ на жесткость;
- Отдать исходную воду в лабораторию;
- Купить специальный тест-полоску, которая покажет точную жесткость питьевой воды;
- Обратиться к специалистам за помощью в определении жесткости воды.
Если это крупное промышленное предприятие, вычислить жесткость воды можно и иными способами. Смолу придется восстанавливать путем постоянных промывок с помощью сильносоленого раствора. Потом появляются проблемы с устранением отходов, которые к тому же сильно соленные и требуют доочистки для утилизации. Но умягчает воду такой прибор намного лучше любых других. Как эконом вариант, этот прибор для вычисления карбонатной жесткости необходим и незаменим.
Электромагнитный прибор заслужил море комплиментов при использовании в быту, а также на предприятиях теплоэнергетики. У него масса плюсов, которые выгодно выделяют его из основной массы умягчителей.
Вычислить карбонатную и некарбонатную жесткость воды можно по следующей формуле Ca2+ + 2HCO3- = CaCO3↓ + h3O + CO2↑ или же такой H+ + HCO3- <–> h3CO3 <–> CO2 + h3O
При всей компактности и удобстве, электромагнитный прибор в состоянии не просто связать карбонатную жесткость воды, он отлично поможет избавиться от старой накипи, застрявшей на стенках. И сделает это крайне осторожно и очень качественно. Достаточно проработать прибору месяц, как слой накипи на стенках уменьшиться значительно. Вам даже достаточно будет замерить слой накипи перед установкой прибора и спустя месяц. Разница будет ощутимой. И при этом за месяц, вам к прибору даже не придется притрагиваться. Полное отсутствие обслуживания также является немаловажным плюсом данного прибора для вычисления жесткости воды. И никакого привыкания к влиянию электромагнитных волн.
Акващит прекрасно сотрудничает с любыми поверхностями, ему не важно, из чего сделаны трубы, а также все равно с какой скоростью течет вода и холодная она, или горячая. Не работает такой прибор только с неподвижной водой. АкваЩит прекрасно уменьшает жесткость воды не меняя химический состав жидкости. Но поскольку он сам устраняет осадок, то стоячая вода ему не страшна.
При монтаже прибора следует помнить, что ставить его нужно только на чистую внутри трубу. С остатками старой накипи прибор справится, а вот сразу пробиться через нее не сможет. Поэтому место установки следует обязательно чистить.
Мы рассмотрели все варианты классификаций карбонатной жесткости воды, а также узнали как вычислить и как определить карбонатную жесткость. С нею сегодня есть масса возможностей справится. При этом достаточно недорогих. Так, что с целью защитить себя от вредного влияния некачественной воды лучше продумайте варианты установки системы подготовки воды заранее.
vodopodgotovka-vodi.ru
1.4.2. Определение карбонатной жёсткости воды
Для определения карбонатной жёсткости титруют некоторый объем исследуемой воды стандартным раствором соляной кислоты в присутствии индикатора метилового оранжевого. При этом протекают реакции с гидрокарбонатами:
Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2↑ + 2h3O;
Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2↑ + 2h3O;
и карбонатами:
CaCO3 + 2HCl = CaCl2 + CO2↑ + h3O;
MgCO3 + 2HCl = MgCl2 + CO2↑ + h3O.
При достижении точки эквивалентности, когда прореагируют все карбонаты и гидрокарбонаты, индикатор меняет окраску с желтой на оранжевую.
Поскольку содержание карбонатов обычно во много раз меньше, чем содержание гидрокарбонатов, а именно присутствие последних определяет наличие у воды временной жёсткости, такое определение иногда называют определением временной жёсткости. При этом предполагают, что содержание карбонатов настолько мало, что их вкладом в постоянную жёсткость можно пренебречь.
1.4.3. Определение общей жёсткости воды
При определении общей жёсткости используют метод титрования, который называется комплексонометрическим методом, так как в нем используются вещества с общим названием комплексоны. Один из комплексонов, наиболее широко применяемый — трилон Б (это торговая марка, под которой впервые был выпущен этот химический продукт). Он представляет производное органической кислоты, в составе молекулы которого присутствуют два атома водорода, способные замещаться на атомы металла. Не рассматривая строения молекулы трилона Б, используем ее общепринятое условное обозначение: h3Y.
Определение основано на том, что ионы кальция и магния образуют растворимые комплексные соединения с Трилоном Б:
Ca2+ + h3Y → [CaY] + 2H+;
Mg2+ + h3Y → [MgY] + 2H+.
В качестве индикаторов используют реактивы, которые дают с определяемыми ионами характерно окрашенные соединения. При достижении точки эквивалентности, когда почти все ионы Ca2+ и Mg2+ связываются с трилоном Б в комплексы и их концентрация в растворе резко уменьшается, окраска раствора меняется. Титрование необходимо проводить в слабощелочной среде (для связывания образующихся ионов водорода), поэтому к титруемому раствору кроме индикатора добавляют так называемый буферный раствор, который обеспечивает постоянство величины pH (при осуществлении данного титрования добавляют аммиачный буферный раствор, который поддерживает постоянство pH в пределах 8…10 единиц).
2. Экспериментальная часть
Содержание работы:
1. Методом кислотно-основного титрования определить карбонатную жёсткость водопроводной воды.
2. Методом комплексонометрического титрования определить общую жёсткость водопроводной воды.
3. По экспериментальным данным сделать вывод об уровне жёсткости исследованной воды и рассчитать величину постоянной жёсткости.
Опыт 1. Определение карбонатной жёсткости
В две конические колбы налить по 100 мл исследуемой (водопроводной) воды (отмерив ее мерным цилиндром), добавить 5-6 капель раствора индикатора метилового оранжевого. Одна из колб является контрольной, т.е. используется, чтобы заметить изменение окраски раствора в другой колбе при титровании. Записать начальный уровень титранта в бюретке.
Перед титрованием убеждаются, что в бюретке достаточно раствора, а стеклянный носик полностью заполнен жидкостью. Пузырьки воздуха из носика выдавливают потоком жидкости, повернув трубку носика вверх под углом около 45°. Выпускное устройство бюретки представляет резиновую трубку со стеклянным шариком внутри. Для вытекания жидкости слегка оттягивают большим и указательным пальцем стенку трубки от шарика, чтобы между ними образовался просвет. Наполняют бюретку через воронку, после чего воронку вынимают из верхнего отверстия; если этого не сделать, во время титрования с воронки может стечь оставшийся в ней раствор, и измерение объема окажется неточным.
При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Во вторую колбу из бюретки прибавлять 0,1 н. раствор соляной кислоты до перехода окраски индикатора из желтой в оранжевую (получаемый цвет, скорее, можно назвать персиковым).
Поверхность жидкости в бюретке представляется широкой вогнутой полосой (мени́ск). Отсчет значений по шкале производят по нижнему краю мениска, глаз наблюдателя должен находиться на уровне мениска. Титрант из бюретки сначала приливают достаточно быстро, непрерывно перемешивая содержимое колбы вращательными движениями. На шарик надавливают левой рукой, а колбу держат и перемешивают правой рукой. Титрование проводят стоя! За окраской раствора наблюдают, подложив под колбу лист белой бумаги для лучших условий наблюдения. По мере приближения к концу титрования, о чем можно судить по появлению в центре колбы «облачка» розовой окраски, тут же исчезающего при дальнейшем перемешивании, титрант приливают уже по каплям. Раствор должен изменить цвет от прибавления одной определенной капли; в этот момент розовое «облачко» не исчезнет, а распространится по всему раствору.
Чтобы убедиться в отсутствии значительных случайных ошибок при выполнении титрования и при отмеривании объема титруемого раствора, титрование повторяют два-три раза и рассчитывают среднюю величину Vстанд, которую в дальнейшем используют для расчетов.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить (можно использовать «контрольную колбу»). Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить карбонатную жёсткость Жкарб исследуемой воды (в ммоль экв/л) по формуле:
 ,
,
где СHCl — молярная концентрация эквивалента (нормальность) раствора соляной кислоты; VHCl — объем соляной кислоты, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Опыт 2. Определение общей жёсткости
Титрование проводят в присутствии индикатора «хром темно-синий». В коническую колбу налить 25 мл исследуемой воды и добавить дистиллированной воды до общего объема 100 мл (отмерять цилиндром). Добавить 5 мл аммиачного буферного раствора и 5-7 капель раствора индикатора хрома темно-синего; при этом раствор приобретает винно-красную окраску.
Записать начальный уровень титранта в бюретке. При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Из бюретки по каплям прибавлять 0,1 н. раствор трилона Б до изменения окраски раствора от винно-красной до синевато-сиреневой.
В отличие от титрования в первом опыте, где реакция протекает практически мгновенно, взаимодействие трилона Б с кальцием и магнием требует некоторого заметного промежутка времени. Чтобы не пропустить момент достижения точки эквивалентности, титрант с самого начала титрования добавляют отдельными каплями с интервалом в две-три секунды, внимательно наблюдая, не меняется ли окраска титруемого раствора. Если приливать титрант быстрее, то некоторое количество его попадет в уже оттитрованный раствор, который еще не успел поменять окраску; в результате раствор будет перетитрован, а объем пошедший на титрование — завышен.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить. Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить общую жёсткость Жобщ исследуемой воды (в ммоль экв/л) по формуле:
 ,
,
где СТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; VТрБ — объем трилона Б, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
По полученным данным сделать вывод об уровне жёсткости исследованной воды.
Пренебрегая вкладом карбонатов в величину постоянной жёсткости и считая, что в данном случае временная жёсткость воды совпадает с карбонатной жёсткостью, т.е. Жкарб = Жвр, рассчитать постоянную жёсткость воды по разности между общей и временной жёсткостью.
Жпост = Жобщ – Жвр.
studfiles.net
ОПРЕДЕЛЕНИЕ КАРБОНАТНОЙ ЖЕСТКОСТИ ВОДЫ
Цель работы
Определение общей щелочности воды, вызванной гидрокарбонат- и карбонат-ионами.
Общие сведения
Карбонатная жесткость (общая щелочность) природной воды вызвана присутствием в ней анионов слабых кислот: НСО3-, СОз2-, HS-, HSiO3-, S1O32- и анионами органических кислот, гидролизую-щихся с образованием гидроксил-ионов. В большинстве природных вод щелочность вызывается присутствием гидрокарбонатов и карбонатов щелочных и щелочноземельных металлов, а в сернистых водах еще и гидросернистыми соединениями.
Определение производят методом нейтрализации. Метод заключается в том, что бикарбонаты (двууглекислые соли) разлагаются при добавлении в воду соляной кислоты, в результате чего соли, образующие щелочность воды, нейтрализуются
Са(НСО3)2 + 2 НС1 = Са С12+ 2Н2О + 2СО2
Mg(HCO3)2 + 2НС1= MgCl2 + 2Н2О + 2СО2
Момент нейтрализации узнают по изменению окраски воды при добавлении индикатора. Если вода содержит ион СОз2-, то от прибавления фенолфталеина она окрашивается в розовый цвет (рН =8.3). Когда вода от фенолфталеина не окрашивается, а от метилового оранжевого приобретает желтую окраску, то в ней содержится только ион НСО3-.
Аппаратура, приборы, реактивы и растворы
Колба коническая.
0,1%-ный раствор фенолфталеина.
0,1 н раствор соляной кислоты.
0,1%-ный раствор метилового оранжевого.
Бюретка.
Пипетка или мерная колба.
Ход определения (вариант 1)
В коническую колбу помещают 50-100 мл исследуемой воды, прибавляют 7-8 капель 0,1%-ного раствора фенолфталеина и осторожно при непрерывном перемешивании титруют раствором соляной кислоты до обесцвечивания раствора. Измеряют объем израсходованной кислоты, добавляют 3-4 капли 0,1%-ного раствора метилового оранжевого и продолжают титровать тем же раствором HCI до перехода окраски из желтой в золотисто-розовую (оранжевую).
Содержание ионов СОз2- и НСОз- рассчитывают по формуле:
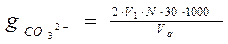 , мг/л
, мг/л
 , мг/л
, мг/л
где V1 - объем раствора соляной кислоты, израсходованный на титрование аликвоты с фенолфталеином, мл;
V2 — объем раствора соляной кислоты (считая от начала титрования), израсходованный на титрование аликвоты с метиловым оранжевым, мл; Va - аликвота исследуемой воды, мл; N - нормальность раствора соляной кислоты, г-экв/л; 30 - эквивалентная масса СОз2-; 61 - эквивалентная масса НСО3- ; 1000 - пересчетный коэффициент в мг-экв/л.
Ход определения (вариант 2)
Отмеривают пипеткой или колбой 50 или 100 мл исследуемой воды (Va) в коническую колбу на 250 мл, прибавляют 4 капли 0.1% раствора метилового оранжевого и титруют воду на белом фоне по каплям 0.1 н раствором соляной кислоты при постоянном перемешивании до перехода окраски жидкости из желтой в слабо-розовую (золотисто-оранжевую), объем (V1). Рассчитывают содержание НСОз- по формуле:
 , мг/л
, мг/л
Лабораторная работа № 3
ТРИЛОНОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЕ ОБЩЕЙ
ЖЕСТКОСТИ
Цель работы
Определение общей жесткости воды, вызванной солями кальция и магния, с применением трилона Б и хромогена черного (смеси ЕТ-00 с NaCl) в качестве индикатора.
Общие сведения
Общая жесткость в природных водах вызывается солями кальция и магния. Различают карбонатную (устранимую) и постоянную жесткость. Карбонатная жесткость обусловлена присутствием в воде бикарбонатов кальция и магния. Если воду прокипятить, то содержащиеся в ней бикарбонаты разлагаются с образованием осадка средних солей и жесткость устраняется, поэтому ее называют устранимой.
Постоянная жесткость обусловлена присутствием в воде других растворимых солей кальция и магния (обычно сульфатных), она не может быть устранена кипячением.
Сумма постоянной и карбонатной жесткости дает общую жесткость воды. Жесткость в природных водах чаще всего определяется объемным комплексонометрическим методом.
Комплексообразование основано на том, что вещество, содержащееся в стандартном растворе, образует с анализируемым катионом прочное комплексное соединение, растворимое в воде. Связывание определяемого иона в комплекс тем полнее, чем прочнее этот комплекс, т.е. чем меньше константа его нестойкости. Наиболее широко применяется комплексон, называемый трилоном Б - это кислая двунатриевая соль этилендиииаминтетрауксусной кислоты (Na2h3Tr).
Процесс образования комплекса можно представить уравнением реакции:
Са2+ + Na2h3Tr = Na2 (CaTr ) + 2Н+
Если в раствор, содержащий ионы кальция и магния, ввести индикатор, дающий цветные соединения с этими ионами, то при добавлении трилона Б к такому окрашенному раствору произойдет изменение окраски в эвивалентной точке. Трилон Б свяжет ионы кальция и магния в прочный комплекс. В качестве индикаторов применяются: для общей жесткости - хромоген черный (ЕТ-00), а для кальция -мурексид.
Определению жесткости рассматриваемым методом мешает присутствие двухвалентных меди, цинка и марганца. При наличии в воде марганца, к пробе воды, до введения реактивов, прибавляют 5 капель 1 % раствора солянокислого гидроксиламина. Медь и цинк удаляют прибавлением к раствору 1 мл 2 % раствора сульфида натрия, после чего, не отделяя осадка сульфидов, титруют раствор трилоном Б как обычно.
infopedia.su
1.4.2. Определение карбонатной жёсткости воды
Для определения карбонатной жёсткости титруют некоторый объем исследуемой воды стандартным раствором соляной кислоты в присутствии индикатора метилового оранжевого. При этом протекают реакции с гидрокарбонатами:
Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2↑ + 2h3O;
Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2↑ + 2h3O;
и карбонатами:
CaCO3 + 2HCl = CaCl2 + CO2↑ + h3O;
MgCO3 + 2HCl = MgCl2 + CO2↑ + h3O.
При достижении точки эквивалентности, когда прореагируют все карбонаты и гидрокарбонаты, индикатор меняет окраску с желтой на оранжевую.
Поскольку содержание карбонатов обычно во много раз меньше, чем содержание гидрокарбонатов, а именно присутствие последних определяет наличие у воды временной жёсткости, такое определение иногда называют определением временной жёсткости. При этом предполагают, что содержание карбонатов настолько мало, что их вкладом в постоянную жёсткость можно пренебречь.
1.4.3. Определение общей жёсткости воды
При определении общей жёсткости используют метод титрования, который называется комплексонометрическим методом, так как в нем используются вещества с общим названием комплексоны. Один из комплексонов, наиболее широко применяемый — трилон Б (это торговая марка, под которой впервые был выпущен этот химический продукт). Он представляет производное органической кислоты, в составе молекулы которого присутствуют два атома водорода, способные замещаться на атомы металла. Не рассматривая строения молекулы трилона Б, используем ее общепринятое условное обозначение: h3Y.
Определение основано на том, что ионы кальция и магния образуют растворимые комплексные соединения с Трилоном Б:
Ca2+ + h3Y → [CaY] + 2H+;
Mg2+ + h3Y → [MgY] + 2H+.
В качестве индикаторов используют реактивы, которые дают с определяемыми ионами характерно окрашенные соединения. При достижении точки эквивалентности, когда почти все ионы Ca2+ и Mg2+ связываются с трилоном Б в комплексы и их концентрация в растворе резко уменьшается, окраска раствора меняется. Титрование необходимо проводить в слабощелочной среде (для связывания образующихся ионов водорода), поэтому к титруемому раствору кроме индикатора добавляют так называемый буферный раствор, который обеспечивает постоянство величины pH (при осуществлении данного титрования добавляют аммиачный буферный раствор, который поддерживает постоянство pH в пределах 8…10 единиц).
2. Экспериментальная часть
Содержание работы:
1. Методом кислотно-основного титрования определить карбонатную жёсткость водопроводной воды.
2. Методом комплексонометрического титрования определить общую жёсткость водопроводной воды.
3. По экспериментальным данным сделать вывод об уровне жёсткости исследованной воды и рассчитать величину постоянной жёсткости.
Опыт 1. Определение карбонатной жёсткости
В две конические колбы налить по 100 мл исследуемой (водопроводной) воды (отмерив ее мерным цилиндром), добавить 5-6 капель раствора индикатора метилового оранжевого. Одна из колб является контрольной, т.е. используется, чтобы заметить изменение окраски раствора в другой колбе при титровании. Записать начальный уровень титранта в бюретке.
Перед титрованием убеждаются, что в бюретке достаточно раствора, а стеклянный носик полностью заполнен жидкостью. Пузырьки воздуха из носика выдавливают потоком жидкости, повернув трубку носика вверх под углом около 45°. Выпускное устройство бюретки представляет резиновую трубку со стеклянным шариком внутри. Для вытекания жидкости слегка оттягивают большим и указательным пальцем стенку трубки от шарика, чтобы между ними образовался просвет. Наполняют бюретку через воронку, после чего воронку вынимают из верхнего отверстия; если этого не сделать, во время титрования с воронки может стечь оставшийся в ней раствор, и измерение объема окажется неточным.
При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Во вторую колбу из бюретки прибавлять 0,1 н. раствор соляной кислоты до перехода окраски индикатора из желтой в оранжевую (получаемый цвет, скорее, можно назвать персиковым).
Поверхность жидкости в бюретке представляется широкой вогнутой полосой (мени́ск). Отсчет значений по шкале производят по нижнему краю мениска, глаз наблюдателя должен находиться на уровне мениска. Титрант из бюретки сначала приливают достаточно быстро, непрерывно перемешивая содержимое колбы вращательными движениями. На шарик надавливают левой рукой, а колбу держат и перемешивают правой рукой. Титрование проводят стоя! За окраской раствора наблюдают, подложив под колбу лист белой бумаги для лучших условий наблюдения. По мере приближения к концу титрования, о чем можно судить по появлению в центре колбы «облачка» розовой окраски, тут же исчезающего при дальнейшем перемешивании, титрант приливают уже по каплям. Раствор должен изменить цвет от прибавления одной определенной капли; в этот момент розовое «облачко» не исчезнет, а распространится по всему раствору.
Чтобы убедиться в отсутствии значительных случайных ошибок при выполнении титрования и при отмеривании объема титруемого раствора, титрование повторяют два-три раза и рассчитывают среднюю величину Vстанд, которую в дальнейшем используют для расчетов.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить (можно использовать «контрольную колбу»). Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить карбонатную жёсткость Жкарб исследуемой воды (в ммоль экв/л) по формуле:
 ,
,
где СHCl — молярная концентрация эквивалента (нормальность) раствора соляной кислоты; VHCl — объем соляной кислоты, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Опыт 2. Определение общей жёсткости
Титрование проводят в присутствии индикатора «хром темно-синий». В коническую колбу налить 25 мл исследуемой воды и добавить дистиллированной воды до общего объема 100 мл (отмерять цилиндром). Добавить 5 мл аммиачного буферного раствора и 5-7 капель раствора индикатора хрома темно-синего; при этом раствор приобретает винно-красную окраску.
Записать начальный уровень титранта в бюретке. При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Из бюретки по каплям прибавлять 0,1 н. раствор трилона Б до изменения окраски раствора от винно-красной до синевато-сиреневой.
В отличие от титрования в первом опыте, где реакция протекает практически мгновенно, взаимодействие трилона Б с кальцием и магнием требует некоторого заметного промежутка времени. Чтобы не пропустить момент достижения точки эквивалентности, титрант с самого начала титрования добавляют отдельными каплями с интервалом в две-три секунды, внимательно наблюдая, не меняется ли окраска титруемого раствора. Если приливать титрант быстрее, то некоторое количество его попадет в уже оттитрованный раствор, который еще не успел поменять окраску; в результате раствор будет перетитрован, а объем пошедший на титрование — завышен.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить. Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить общую жёсткость Жобщ исследуемой воды (в ммоль экв/л) по формуле:
 ,
,
где СТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; VТрБ — объем трилона Б, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
По полученным данным сделать вывод об уровне жёсткости исследованной воды.
Пренебрегая вкладом карбонатов в величину постоянной жёсткости и считая, что в данном случае временная жёсткость воды совпадает с карбонатной жёсткостью, т.е. Жкарб = Жвр, рассчитать постоянную жёсткость воды по разности между общей и временной жёсткостью.
Жпост = Жобщ – Жвр.
studfiles.net
О карбонатной жесткости воды - переписка
Сначала приведу определение жесткости воды в Химической энциклопедии:
ЖЕСТКОСТЬ ВОДЫ, совокупность св-в воды, обусловленная наличием в ней преим. катионов Са2+ (кальциевая жесткость воды) и Mg2+ (магниевая жесткость воды). Сумма концентраций Са2+ и Mg2+ наз. общей жесткостью воды. Она складывается из карбонатной (временной, устраняется кипячением) и некарбонатной (постоянной) жесткости воды. Первая вызвана присутствием в воде гидрокарбонатов Са и Mg [при кипячении разлагаются на СаСО3 и Mg(OH)2 с выделением СО2], вторая - наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов. В СССР жесткость воды выражают в ммоль экв/л: карбонатная жесткость отвечает той части катионов Са2+ и Mg2+, к-рая эквивалентна содержащимся в воде анионам НСО3-, некарбонатная - анионам SO42-, NO3- и др. (1 ммоль экв/л соответствует 20,04 мг/л катионов Са2+ или 12,16 мг/л катионов Mg2+).
Казалось бы все здесь изложено четко и понятно. Однако некоторых дотошных сограждан, включая моих коллег, порой смущает такое соображение: как можно говорить, например, о карбонатной жесткости речной воды, когда там может вовсе не быть карбонатов, а лишь бикарбонаты да еще и в присутствии свободной угольной кислоты. Тем не менее в сотнях подобных случаях говорят о такой карбонатной жесткости воды при отсутствии в этой воде карбонатов. Вот фрагменты из моей переписки:
Доброго времени суток, Николай Григорьевич!
У нас с Валентиной Алексеевной возник вопрос, на который мы не смогли на данный момент дать для себя вразумительный ответ. Понятие "карбонатная жесткость" не дает нам спокоя. Как она определяется, рассчитывается? В РД 34.22.503-88 "МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО СТАБИЛИЗАЦИОННОЙ ОБРАБОТКЕ ОХЛАЖДАЮЩЕЙ ВОДЫ В ОБОРОТНЫХ СИСТЕМАХ ОХЛАЖДЕНИЯ С ГРАДИРНЯМИ ОКСИЭТИЛИДЕНДИФОСФОНОВОЙ КИСЛОТОЙ" расчет основывается именно на карбонатной жесткости. Не могли бы Вы изложить свое мнение касательно этого показателя, если, конечно, будет время?
Добрый вечер! Попытаюсь ответить на ваш вопрос о карбонатной жесткости.
К сожалению, РД составляют такие же, как мы, технологи, и редко бывает, чтобы чего-то не нахомутали. Но пойдем далее.
Понятия жесткость, щелочность и производные от них не являются научными, а придуманы для технологов, чтобы им проще было рассуждать на пальцах. Щелочность – это то, что титруется сильной кислотой до рН, при котором индикатор меняет окраску. В общем случае щелочность дают бикарбонаты, карбонаты, анионы кремнекислоты и органики. Для простоты технологи считают (и не сильно ошибаются), что в добавочной и циркуляционной водах присутствуют только бикарбонаты, а общая щелочность воды равна бикарбонатной и равна концентрации в воде ионов НСО3 в мг-экв/л. Жесткость – это сумма ионов кальция и магния в мг-экв/л. Если щелочность и жесткость равны, то жесткость называют карбонатной. Если не равны, то карбонатной жесткостью называют меньшу часть из них, то есть ту часть, которая отвечает сумме соединений Ca(HCO3)2 и Mg(HCO3)2. Если жесткость меньше или равна щелочности, то вся она будет карбонатной. Если жескость больше, то только равная щелочности часть жесткости будет называться карбонатной. А часть жесткости, равная разнице Жобщ-Жкарб, называется некарбонатной жескостью, которая, пренебрегая мелкими деталями, считается равной сумме анионов сильных кислот (практически сульфатов и хлоридов) за вычетом содержания ионов натрия (все концентрации в мг-экв/л).
Обычная ситуация - это когда жесткость больше щелочности. Когда покисляют циркводу серной кислотой, то часть бикарбонатов переходит в Н2СО3 и в виде СО2 переходит в атмосферный воздух. Таким образом, при подкислении циркводы понижаются одновременно и карбонатная щелочность и карбонатная жесткость, а часть бикарбонатных ионов заменяются сульфат-ионами. Отложения в цирксистеме (в основном на поверхностях теплообменных аппаратов) образуются преимуществеенно из карбонатов кальция. Кальция больше, чем магния, и если забыть о "мелких" деталях, то можно считать, что процесс осаждения соединений жесткости определяется содержанием в циркводе Ж(НСО3)2, то есть содержанием карбонатной жесткости или содержанием карбонатной щелочности - по-крестьянски можно говорить и так и так.
Считается, с некоторым приближением, что для каждой циркводы есть своя предельная карбонатная жесткость, при которой жесткостные отложения еще не образуются. Понизить карбонатную жесткость циркводы можно и подкислением и увеличением размера продувки цирксистемы и тем и другим разом. Но можно еще и увеличить предельно допустимую карбонатную жесткость за счет разных корректирующих добавок. В частности, за счет ввода в циркводу ОЭДФК, которая обладает способностью образовывать комплексные соединения с катионами жесткости и этим препятствовать осаждению жесткостных соединений. Разные органические соединения, присутствующие в воде, тоже обладают аналогичной способностью, хотя и в меньше мере, чем ОЭДФК. Это все для рассуждения "на пальцах", что в общем-то и достаточно для практических целей. Но если, например, взять и ввести в цирксистему CaCl2, то карбонатная жесткость циркводы может и не измениться, а вот предельная карбонатная жесткость, при которой будут выпадать отложения жесткости, станет меньше. Но... соотношение разных компоненнтов в исходной добавочной воде обычно меняется не очень существенно, поэтому считается, что для каждого конкретного источника добавочной воды есть своя характерная величина - предельно допустимая карбонатная жесткость циркводы. По этой же причине (примерного постоянства соотношения разных ингредиентов в исходной воде) предельной карбонатной жесткости может отвечать вполне определенная величина предельно допустимых хлоридов, или щелочности, или электропроводности циркводы. Последнюю величину можно использовать для автоматического регулирования величины продувки цирксистемы.
Найденную экспериментально норму на предельно допустимую величину можно немного понизить (ужесточить) по здравому смыслу, учитывая, что соотношения компонентов исходной добавочной воды все же не строго постоянно. Кроме того, надо иметь ввиду, что приведенные выше рассуждения относятся к процессам интенстивного образования отложений, что можно обнаружить по балансу и по сравнению кратностей типа Clц/Clд и Жц/Жд, о чем я уже ранее писал. И еще надо иметь ввиду, что предельно допустимая карбонатная жесткость циркводы может повышаться в зависимости от дозы ОЭДФК. Но увеличение дозы дает существенный эффект только (насколько мне помниться) до некоторого предела, сверх хоторого она уже не дает большой дополнительный эффект. Поэтому иногда целесообразны сочетания, вроде одновременного подкисления циркводы и ввода в нее ОЭДФК.
Творческих и прочих вам успехов! 22.06.11 Протасов Н.Г.
P.S. Пожалуй без некоторых уточнений нам не обойтись. В добавочной воде содержанием карбонат-ионов (СО3) можно пренебречь. В циркуляционной воде их может быть не много, но именно они определяют выпадение CaCO3. В этой связи можно говорить о карбонатной и бикарбонатной щелочности или о карбонатной и бикарбонатной жесткости. Может быть какие-нибудь умники до этого уже и доросли. И даже где-то записали, хотя бы потому, что люди ищут разные способы зарабатывать себе на хлеб. Но раньше за карбонатную жесткость принимали общую щелочность, если она меньше, чем общая жесткость, не учитывая в ней соотношение карбонатов и бикарбонатов. То есть, карбонатная жесткость интерпретировалась, как я перед этим написал (других интерпретаций я не помню). Но в более общем случае могут возникнуть разные нюансы. Например, если подкислить циркводу дымовыми газами, где много СО2, то получится такой фокус: общая щелочность не изменится (потому что при титровании растворенная углекислота снова дотитруется до Н2СО3), а вот щелочность по фенолфталеину станет меньше. При этом не изменится и карбонатная жесткость, раз не изменилась общая щелочность, но увеличится количество НСО3 ионов, понизится рН, уменьшится количество СО3 ионов и уменьшится выпадение в осадок или в отложения СаСО3. Соотношение карбонат и бикарбонат ионов зависит от рН. Иногда его приводят в книгах. Ну а более детально эти процессы, включая осаждение, рассчитываются на основе теории ионных равновесий, что не для слабонервных. А для практических целей, если вы не собираетесь общаться с дымовыми газами, достаточно тех простых представлений, которые я перед этим описал. Как говорил когда-то наш покойный Озеров (Валентина его возможно помнит): излишнее знание рождает скорбь. А та примитивная интерпретация карбонатной жесткости, которую я приводил, стала настолько общепринятой и привычной, что расшифровкой этого термина в методиках по обработке циркводы обычно и не занимались.
Честно сказать, мне не очень нравятся собственные разъяснения, но вы ведь все равно не будете рассчитывать процессы на основе теории ионных равновесий. И я не буду. Хотя бы потому, что не знаю всех компонентов цирксистемы и всех их констант, к тому же зависящих от разных факторов, в особенности от температуры. Потом, каждый неточно определенный фактор вносит свою погрешность и на практике чем больше пытаешься учесть в расчетах факторов, тем более ошибочен результат. Я слишком хорошо это знаю, потому что стат.обработкой данных занимался профессионально. Если заранее известны поправки на влияние разных факторов, то из этого что-то выходит, но если несколько факторов пытаешься определить экспериментально в реальных условиях, а не на стенде, то из этого получается только сплошная чушь. Знание в общем-то вещь полезная, но в наших работах бывает гораздо полезнее обходиться простыми представлениями и здравым смыслом. Поэтому я уже и писал раньше, что надо определять простые вещи: хлориды, жесткость, щелочность и не мудрить. Во всяком случае, прежде всего не мудрить, а если что получится по простым прикидкам, то для понта можно и в добавок помудрить.
Еще раз повторю: можно различать, например, карбонатную и бикарбонатную жесткость и трудно против этого возразить, если кто-то из вас настаивает на подобных нюансах. Но в принятой терминалогии я этих нюансов пока что не встречал. Вот Смирный тоже как-то начал рассуждать, что концентрациия аммиака в Nh4 это не то, что концентрация в Nh5OH. Я сказал, что не надо морочить этим голову - принято считать на Nh4 и все дела!
Спите спокойно и не старайтесь перемудрить докторов наук.
27.06.2011, 06:59
Здравствуйте, Николай Григорьевич!
Отдельное спасибо за прояснение понятия "карбонатная жесткость". Теперь оно предстало перед моими глазами намного яснее (сказать что на 100% не могу, но "я не волшебник, я только учусь"!).
algoritmist.ru
Постоянная и карбонатная жесткость воды
Невозможно сегодня найти потребителя, который бы не пользовался водой. Каждому человеку нужна вода, чтобы жить. А чтобы прожить подольше, вода должна быть чистой и мягкой. Да и бытовые приборы только скажут «Спасибо» своему хозяину за использование хорошей воды. Виной всему жесткость. Но как выяснилось, она тоже бывает разной. Так как не потеряться в дебрях постоянной и карбонатной жесткости воды?
Тест-комплект для определения постоянной и карбонатной жесткости воды
Так уж получилось, что жесткость в воде определяет количество катионов двух солей всего лишь. В воде почти не бывает излишков алюминия или молибдена. Зато в чести кальций и магний. При всем при этом, данный вид солей в воде должен присутствовать всегда. Удалять постоянную и карбонатную жесткость полностью означает навредить своему здоровью. В отношении оборудования, можно лишь отметить, что некоторые производственные процессы требуют именно такую пустую воду.
Итак, классы жесткости можно поделить на такие составляющие: (см. таблицу)
| Вид жесткости | Определение |
| Общая | Сумма ионов кальция и второй соли магния или общая сумма постоянной и временной жесткостей |
| Карбонатная | Различные виды карбонатных примесей в воде при кислотно-щелочном балансе не ниже 8,3 |
| Некарбонатная | Соли серной, иногда азотной или соляной кислот |
Для определения данных видов солей и их концентрации в воде используют специальные тест-комплекты. Особенность каждого вида жестковатости состоит в том, что общую устранить полностью не получится, некарбонатную удалить нельзя вообще. В результате работать можно только с карбонатной жесткостью. Таким образом, постоянная и карбонатная жесткость воды понятия не тождественные. Одно понятие шире, другое уже.
Побороться с временной известковостью можно самыми разными путями – умягчение, кипячение, замораживание. Каждый потребитель выбирает сам. Но на территории России пока все еще преобладает не борьба с известковостью, а борьба с накипью, что в корне не правильно. Тест-комплект поможет определить, с каким видом жесткости вы столкнулись.
Первое, что страдает от устранения накипи, а не высокого показателя жесткости, это, естественно, здоровье человека. По степени жесткости питьевая вода тоже может меняться, да и в разных районах ее порог различен. О том, какая жесткость в конкретной воде, можно узнать двумя способами:
- Позвонить поинтересоваться на очистную станцию и станцию подачи воды;
- Купить тест-комплект;
- Провести анализ воды своими силами
Высокий порог известковости в воде негативно влияет на пищеварение. Способствует образованию камней в почках и поджелудочной железе. Она негативно скажется на состоянии кожи и волос. Сухость, аллергии и т.п.
Проблема с оптимальным показателем известковости состоит из подтверждений оптимальному показателю содержания таких солей в воде. В официальном коммюнике Всемирная организация здравоохранения говорила, что хоть и выявлена связь между показателем известковости в воде и сердечными заболеваниями, но говорить об опасности пока рано. Тоже самое, говорится о вреде слишком мягкой воды.
Зато польза от постоянной и карбонатной жесткости известна во всех других областях жизнедеятельности. С мягкой водой улучшается качество стирки, вещи выглядят лучше, ярче. Стирального порошка идет меньше, да и мыла тоже. Это не говоря уже о вкусе кофе и чая. Тест-комплект состоит из нескольких наборов. С таким методом устранения жесткости воды они становятся более насыщенными и яркими.
Максимальный эффект от умягчения
Побороть постоянную и карбонатную жесткость воды можно с помощью умягчения. Для этой процедуры используют специально разработанные приборы-очистители, которые называются умягчающими установками. Наибольшей популярностью при всей расходной части, пользуются ионообменные материалы. Такие материалы хороши тем, что меняют свой натрий на соли жесткости без каких-либо дополнительных манипуляций.
Расходы при обслуживании таких материалов есть и немалые. Во-первых, сама смола со временем полностью отдает свой натрий и практически не умягчает воду. Чтобы запустить этот процесс снова, нужно выполнить ряд манипуляций. Для этого промышленные умягчающие комплексы снабжены в обязательном порядке баком восстановления. В бытовых приборах, использовать другие химикаты нельзя, т.к. большинство воды используется для питьевых целей. В данном случае картридж со смолой просто меняется, ничего не восстанавливая. Это не дешево, но надежно.
Умягчать воду можно и своими силами. Можно настоять ее на кусочке кремния. Выход воды будет малым, но зато вода будет даже не просто мягкой, а лечебной. Но три литра воды за неделю, далеко не та производительность, которая нужна среднестатистической семье, даже из двух человек.
Второй доступный вариант – воду закипятить. Делается вроде бы просто, довольно быстро. Но в этом случае весь известковый налет останется на поверхностях кастрюли или чайника. Что опять же приводит к тем же проблемам очистки поверхностей, и все бытовое оборудование, все равно остается без защиты.
Потому ручными способами умягчить воду точно не получится. Совсем не те объемы, да и последствий сильно много. И опять под влияние попадает здоровье человека. Для организма все-таки лучше вода с неразрушенной структурой, с природным включением солей жесткости.
Человек не может прожить ни без магния, ни без кальция. Потому убирать постоянную и карбонатную жесткость воды в полном объеме нельзя. Магний способствует нормальному углеводному обмену. С его помощью продуцируются белки, аккумулируется и освобождается энергия. Он же способствует нервному успокоению, помогает расслабить сердечные мышцы. Без магния в достаточном количестве человек может стать истериком, может развиться гипертония и другие сердечные заболевания.
Кальций тоже вносит свою значительную лепту в здоровье. Это и костно-мышечная система, и сердце, и даже правильная секреция инсулина. Даже мужчинам стоит задуматься о том, что они пьют. Ведь отсутствие кальция в нормальном количестве, это потенциальное мужское бесплодие.
Таким образом, крайне важно, соблюдать баланс включений жесткости в воде. Но при этом важно и удалять излишки. Главное, прийти к пониманию, что в современных условиях, без системы умягчения воды в хозяйстве не обойтись.ochistka-vody.com
Общая и карбонатная жесткость воды

Чтобы сделать воду мягкой, а значит полезной для человеческого организма, нужно устранить из нее две соли. Но убирать придется не полностью, т.к. по совместительству эти соли являются важнейшими минералами для человеческого организма. Потому крайне важно понимать и ориентироваться в понятиях общей и карбонатной жесткости воды.
Методы определения общей и карбонатной жесткости
Некачественная вода в водопроводе, прежде всего, характеризуется высоким порогом именно известковости. Потом при нагреве все это выпадает в осадок, и устранить все это богатство со стенок оборудования и сантехники бывает чрезвычайно трудно. Причина тому кроется в излишнем содержании в воде важных для человеческого организма минералов. Если говорить о здоровье, то присутствие кальция как то больше известно обычному потребителю. Давайте узнаем самые популярные методы определения общей и карбонатной жесткости воды. Он больше знает, на что он влияет. А вот с магнием больше вопросов.
Ниже в таблице представлены органы и системы организма на которые влияют оба важных минерала.
|
| Кальций | Магний |
| Системы организма | Кости Зубы Ногти Мышцы Клеточные мембраны(способность фильтровать ненужное) | Нервы Сердце Психологическое состояние Обмен веществ Костный мозг Сосуды Сахар в крови |
Так, что работать с некачественной водой нужно, но очень осторожно. Нельзя необдуманно пить кипяченную и дистиллированную воду. Таким поступком человек махом может лишить себя способность нормально мыслить и возвысит риск поломки костей. Общая и карбонатная жесткость воды играют здесь свою роль. Можно смело сказать, что для определения жесткости воды потребителя будет интересовать исключительно карбонатная. Потому что только она является устранимой. Общая же при этом тоже понизится. Но об этом чуть позже.
Итак, недостаток минералов – это вред для организма. Но и переизбыток приведет к болезням. Только работать известь будет не на стенках оборудования уже. А на стенках желудка, почек, печени и т.д. К сожалению, далеко не все потребители обращают внимание на жесткость воды. И причина тому, медленное вредное действие солей. Камни в почках не образуются за один день. Им нужно несколько лет, и, как правило, человек думает, что это не плохая вода, а неправильный режим питания и т.д. О качестве воды зачастую просто не вспоминают.
Большинство потребителей обращают внимание на плохую воду только тогда, когда чайник перегорит. Потребуется поломка стиральной машинки, чтобы человек решился на покупку умягчающего прибора. Надежда на русский авось не пропадает. Но просвященность россиян в вопросах определения общей и карбонатной жесткости воды все же в последнее время имеет тенденцию к положительному продвижению. Спрос на умягчающие установки постепенно растет.
Что хочет видеть потребитель, когда он решается на покупку тест-комплекта?
- Полное отсутствие накипи на стенках оборудования;
- Простоту применения;
- Не помешает дешевизна установки;
- Удобное или минимальное обслуживание
Таким образом, и рынок предоставляет потребителю именно то, что он хочет видеть. Либо недорого, но достаточно хлопотно, либо по средней цене, но без проблем. Стремление определить известковость в воде вполне понятно. Именно она образует самый неприятный момент при работе с такой водой – осадок в виде накипи на стенках. И если бы он не мешал работе приборов, то потребитель бы не переживал об его устранении. Но это покрытие работает, как блокиратор. Из-за него тепло не передается в воду. Оно практически полностью остается внутри поверхности. При этом электричество или любое другое топливо расходуется пачками, чтобы хоть как то нагреть поверхность. На выходе получается поломка оборудования. Трещины, разрывы труб и все из-за изоляционной накипи, которая и скорость передачи воды по трубам резко снижает, и сопротивление поверхностей увеличивает. Даже тонкий слой накипи ведет к плачевным последствиям.
С каким видом жесткости следует побороться?
Кроме вышеперечисленного минуса воды, есть еще и другие эффекты. Стирка в такой воде выходит совсем не такой, как хотелось бы. Вещи получаются блеклыми, какой-то странный налет делает их еще и жесткими. Правда, такой эффект возможен и при чрезмерном использовании стирального порошка. Но чаще всего, это реакция жесткой воды, стирального порошка и грязи. Когда все три составляющих встречаются внутри тканей, то разойтись они уже не могут. Жесткость блокирует. Нужно намного дольше полоскать белье, чтобы вымыть этот букет из тканей.
 То есть первое к чему приводит некачественная вода, это дополнительный расход воды и плохая растворимость порошков. Причем расход воды увеличивается процентов на тридцать, а количество используемых моющих средств растет процентов на двадцать пять. Вот здесь на примере можно и показать, что такое общая и карбонатная жесткость воды.
То есть первое к чему приводит некачественная вода, это дополнительный расход воды и плохая растворимость порошков. Причем расход воды увеличивается процентов на тридцать, а количество используемых моющих средств растет процентов на двадцать пять. Вот здесь на примере можно и показать, что такое общая и карбонатная жесткость воды.
У известковости есть две составляющих постоянная и переменная. Из воды устранить полностью можно только переменную, то есть карбонатную. Она вступает в реакцию с другими веществами, может выпадать в осадок. Она хоть как-то реагирует, постоянная жесткость – это то, что останется в воде навсегда, и с ней ничего не сделаешь. Но она осадок вредный и не образует. Соединение того и другого дает воде общую жестковатость. Потому борясь с накипью, человек должен понимать, что устраняет он именно карбонатный вид известковости.
Лучшим способом устранения жесткости воды является химическая ионная смола или безреагентная фильтрующая крайне чувствительная мембрана. Естественно, каждый вид преград для жесткости и стал в дальнейшем основой для создания того или иного метода умягчения воды. Но со временем худшие варианты отсеялись, остались только хорошие и минимально расходные, на сколько это возможно.
При этом порог известковости может измеряться разным видом воды. Ведь даже мягкость в воде бывает разной. Она может быть питьевой, а может быть технической. Второй вариант более применяют в промышленности.
Что касается приборов, которые помогут уменьшить общую и карбонатную жесткость воды, то лучшим умягчителем считается реагентный смоляной картридж. Хотя у него масса недостатков, но обеспечить хорошую мягкую воду может лучше всего именно он. Секрет его популярности при появлении таких сильных конкурентов, как ультрафильтрация, это то что фильтрующая основа работает непосредственно с солями жесткости. И устраняет именно их в нужном количестве. В процессе работы прибора происходит реакция смены ионов. Вредные кальций и магний меняются местами с полезным натрием. Происходит все естественным путем, без какого-либо стимула. Другие методы обработок подразумевают применение насосов, электричества. Здесь же все идет естественным путем, что и дает возможность по-прежнему держать пальму первенства среди всех умягчающих установок именно ионообменным смолам.
filtryvodi.ru


















