Содержание
особенности и способы ее умягчения
Качество водоснабжения – предмет постоянного внимания, обсуждаемый как дома, так и на промышленных предприятиях. Приобретая фильтр «Гейзер» для жесткой воды, необходимо понимать, что минерализация не всегда является исключительно причиной множества проблем.
Самый очевидный пример – морская вода, пить которую не приходит в голову даже при сильной жажде. После морских ванн на теле остается солевой налет. Пляжные полотенца теряют привычную мягкость. Да и сам термин «жесткая» применительно к жидкости возник из-за свойства ткани грубеть после полоскания в море.
Однако присутствие тех же минеральных солей придает воде вкус. С жидкостью в организм человека попадают необходимые микроэлементы. Поэтому выбирать метод и степень умягчения следует осмысленно, исходя из характеристик и способов использования воды.
Жесткость – интегральный показатель содержания в воде солей щелочноземельных металлов, преимущественно кальция и магния. Складывается она из двух составляющих. Постоянная жесткость определяется присутствием солей серной, соляной и азотной кислоты. Временная – складывается из суммы содержания гидрокарбонатов, а также карбонатов Mg и Ca. При уровне pH выше 8,3 либо нагревании эти компоненты образуют накипь на стенках или выпадают в осадок. Поскольку именно гидрокарбонаты определяют вкусовые качества, разница между родниковой и кипяченой водой ощутима при первом же глотке.
Складывается она из двух составляющих. Постоянная жесткость определяется присутствием солей серной, соляной и азотной кислоты. Временная – складывается из суммы содержания гидрокарбонатов, а также карбонатов Mg и Ca. При уровне pH выше 8,3 либо нагревании эти компоненты образуют накипь на стенках или выпадают в осадок. Поскольку именно гидрокарбонаты определяют вкусовые качества, разница между родниковой и кипяченой водой ощутима при первом же глотке.
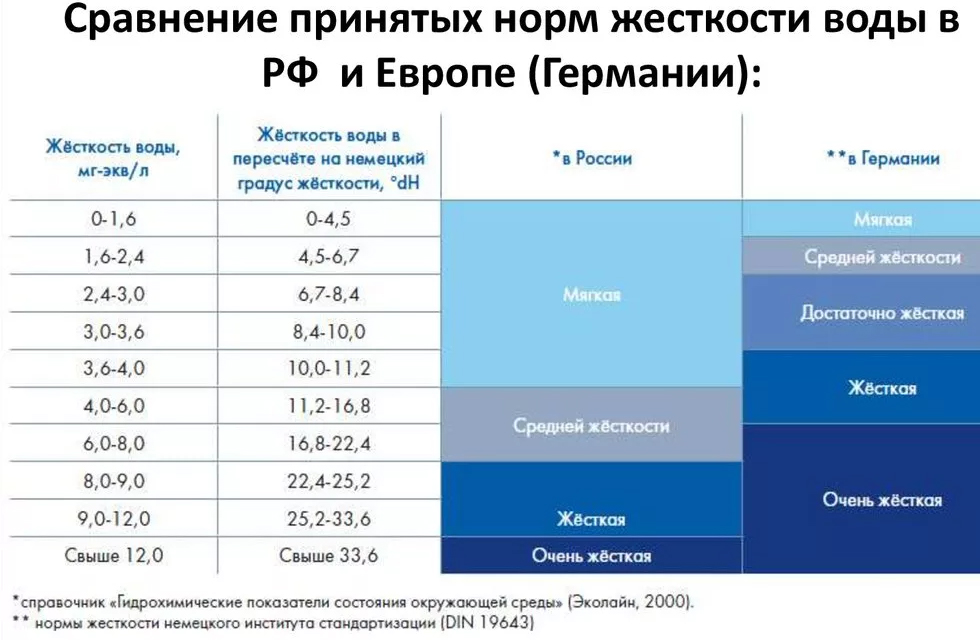
Российский СанПиН 2.1.4.1074-01 определяет допустимую величину жесткости при питьевом водоснабжении равной 7 мг-экв/л. Но градации для мягкой и высокоминерализованной воды не установлены однозначно, и существенно отличаются не только в разных странах, но даже в пределах одного государства.
Таблица 1. Классификации жесткости воды в России, Германии, США
В России чаще используется четырехступенчатая классификация жесткости в зависимости от содержания в воде солей (мг-экв/л):
- мягкая – 0-1,5;
- оптимальная – 1,5-2;
- жесткая – 2-5;
- сверхжесткая – 5-7.

При превышении допустимого значения поступающая к потребителю вода считается технической.
Зависимость жесткости от источника водоснабжения
Значение жесткости может существенно варьироваться даже в пределах одного региона. Чаще всего это зависит от типа водозабора. В пресных поверхностных водоемах и реках вода мягче вследствие постоянной подпитки от тающего снега и атмосферных осадков. Для них характерны сезонные колебания, зависящие от режима питания водных объектов.
Подземные воды в большей степени обогащены солями, содержащимися в водоносных горизонтах. Их концентрация мало зависит от времени года и количества осадков. Скважинные водозаборы отличает повышенная жесткость и постоянство химического состава.
Пределы и особенности умягчения
Необходимость удаления избыточных солей даже при пользовании централизованными источниками водоснабжения очевидна. Негативное влияние жесткой воды проявляется уже при концентрациях 3-7 мг-экв/л, которые считаются допустимыми. Это следует учитывать, выбирая фильтр для питьевой воды.
Это следует учитывать, выбирая фильтр для питьевой воды.
Для бытовой техники и внутридомовых инженерных сетей это чревато рядом серьезных проблем:
- снижением КПД, сокращением срока службы посудомоечных и стиральных машин из-за образования накипи на нагревательных элементах;
- уменьшением пенообразования при применении моющих средств;
- ускоренным износом сантехнических приборов и запорно-регулировочной арматуры из-за известковых отложений;
- сокращением сечения в теплообменниках котлов, водонагревателях и радиаторах автономного отопления;
- поломкой циркуляционных насосов;
- увеличением расхода электроэнергии.
Для человека снижается эффективность гигиенических процедур, обезжиривается и пересыхает кожа, повышается риск развития мочекаменной болезни, растет вероятность заболеваний сосудов и костной системы.
Но и полное обессоливание воды несет определённые проблемы. В частности, в технической сфере жесткость менее 2 мг-экв/л чревата усилением коррозийного воздействия теплоносителя на элементы систем обогрева. Поэтому при использовании умягчителей важно выбивать технологию, которая гарантирует на выходе воду с оптимальной жесткостью.
Поэтому при использовании умягчителей важно выбивать технологию, которая гарантирует на выходе воду с оптимальной жесткостью.
Методы умягчения
Мягкую воду получают несколькими способами. Наиболее древний из них – термоумягчение, или кипячение. Однако этот метод устраняет лишь временную жесткость, и применяется преимущественно в быту. Гораздо больше востребованы технологии мембранной очистки, ионного обмена и реагентного умягчения. Они отличаются глубиной, селективностью очистки, сферой применения – используются для обработки питьевой или исключительно технической воды.
Ионный обмен
Ионообменное умягчение – классическая технология, при которой жесткость устраняется замещением ионов кальция и магния исходной воды нейтральными катионами натрия. В коттеджных и промышленных системах водоочистки ионообменная установка умягчения воды – обязательный элемент водоподготовки. В качестве загрузки здесь работают катионообменные смолы, которые входят также в состав многокомпонентных смесей Ecotar, применяемых в фильтрах комплексной очистки Aquachief.
В фильтрах-кувшинах для корректировки жесткости служит ионообменный волокнистый материал «Каталон». В бытовых стационарных системах водоочистки умягчение осуществляется при помощи традиционных картриджей с катионообменной смолой (БС), а также инновационного материала «Арагон 2» с интегрированной в полимер ионообменной смолой. Выбор моделей для мягкой, жесткой и сверхжесткой воды позволяет получать из любой исходной жидкости фильтрат с оптимальными характеристиками.
Мембранная очистка
Обратный осмос – самый кардинальный способ изменения характеристик воды, который позволяет получать полностью обессоленное химическое соединение. Метод основан на продавливании жидкости через полупроницаемую мембрану с пористостью 0,0001 мкм. Преграда проницаема лишь для молекул H2O и некоторых газов.
Технология в чистом виде используется как промышленная водоочистка в ряде производственных процессов, медицине, при переработке стоков. Питьевая вода на последнем этапе обратноосмотической очистки может обогащаться природными минералами для восстановления оптимального солевого баланса.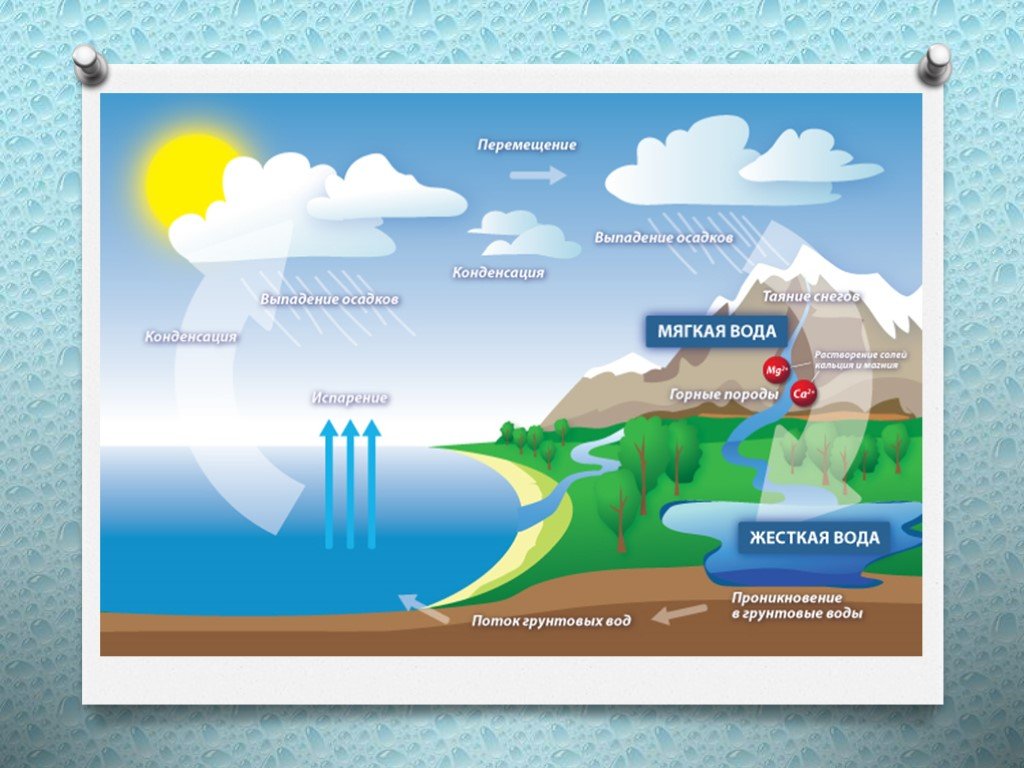 Применение наномембран с размером пор 0,001 микрометра снижает жесткость на 70-80%, но сохраняет естественный баланс минералов. Предпочтение той или иной технологии определяется химическим составом исходной жидкости и областью применения очищенной воды.
Применение наномембран с размером пор 0,001 микрометра снижает жесткость на 70-80%, но сохраняет естественный баланс минералов. Предпочтение той или иной технологии определяется химическим составом исходной жидкости и областью применения очищенной воды.
Реагентное умягчение
Механизм снижения жесткости основан на свойствах ряда химических веществ вступать в реакцию с солями кальция и магния. В результате образуются нерастворимые карбонаты и сульфаты, выпадающие в осадок. Ранее в качестве реагента применялись гашеная известь или кальцинированная сода. В настоящее время смягчение жесткой воды чаще всего выполняется фильтром с полифосфатной загрузкой.
Этот способ нельзя использовать в линии питьевого водоснабжения, но он весьма эффективен при установке в трубопровод подачи холодной воды к стиральной и посудомоечной машинам. Связывание солей жесткости препятствует появлению накипи на нагревательных элементах, сокращает расход электричества, повышает эффективность работы бытовой техники.
Чтобы не ошибиться с выбором метода умягчения и типом фильтра, проконсультируйтесь с нашими специалистами. Чистая вода с оптимальным минеральным составом – залог здоровья потребителя и долгой работы линий водоснабжения и бытовой техники, поэтому лучше не пренебрегать водоподготовкой.
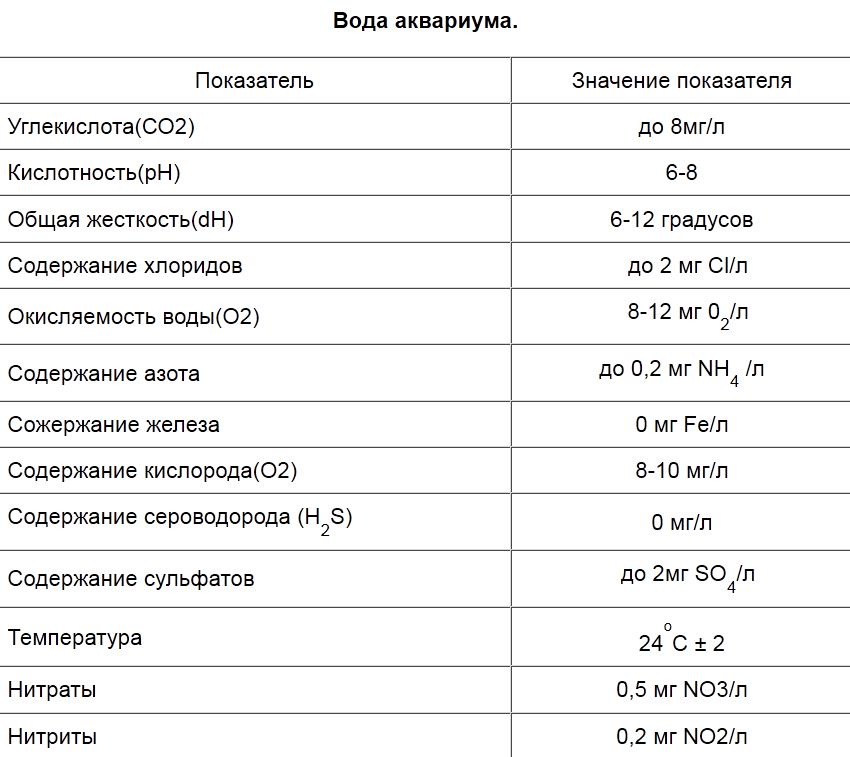
Параметры воды в рифовом аквариуме
Каким должен быть химический состав воды в морском рифовом аквариуме?
Изменение каких параметров воды может привести к гибели его обитателей, а каких – лишь ухудшит их настроение?
Вопрос сложный, но только до того времени, пока вы в нем не разберетесь.
Потом уже все просто.
Оцениваются по следующим показателям:
- температура
- соленость
- щелочность
- карбонатная жесткость
- кальций
Самыми критическими, которые надо мониторить постоянно, являются температура, соленость, кальций и щелочность.
Для остальных параметров достаточно периодического контроля.
Температура
Температура воды в аквариуме влияет на всех его обитателей.
Рассмотрим варианты развития событий при высокой температуре воды и при ее понижении.
Увеличение температуры
Последствия:
- Ускоряется метаболизм животных.
- Увеличивается потребление кислорода (О2), углекислого газа, питательных веществ.
- Увеличивается количество продуктов жизнедеятельности.
- Ускоряется рост водорослей и кораллов.
- Замедляется растворимость кислорода, что при отключении электричества и прекращении принудительной подачи воздуха неизбежно приведет к необратимым последствиям.
Понижение температуры
Последствия:
- Замедляется метаболизм.
- Повышается количество растворенного в воде кислорода вследствие уменьшения его потребления.
- Погибшие организмы разлагаются медленнее.
- Жизнедеятельность более стабильна.
- Медленный рост, но порой более яркая окраска гидробионтов.

В природе кораллы комфортно чувствуют себя при температуре воды 27-30 оС. В аквариуме рекомендуем поддерживать температуру на уровне 26-29 оС, не допуская резких скачков и высоких, критических значений.
Это обеспечит стабильную, успешную жизнь вашего рифового аквариума.
Соленость
Уровень солености – это количество соли, полученное в результате выпаривания 1 л воды. Соленость измеряется в частях на тысячу (ppt), промилле (‰). Можно использовать шкалу Practical Salinity Scale (практической солености) и определять соленость по электропроводности воды (мСим/см).
Настоящая морская вода имеет соленость примерно 35 ppt или проводимость 53 мСим/см. Поэтому для рифового аквариума оптимальная соленость должна быть такой же, т.е. около 35.
Неизбежное испарение воды из аквариума ведет к повышению уровня солености. Но какое-то количество соли уходит вместе с пеной при работе пеноотделителей. Нельзя допускать как снижения уровня солености ниже критических отметок, так и его повышения. И особенно важно это делать в рифовом аквариуме. Для кораллов труднопереносимы даже небольшие (2-3%) изменения солевого баланса.
И особенно важно это делать в рифовом аквариуме. Для кораллов труднопереносимы даже небольшие (2-3%) изменения солевого баланса.
рН
Строгий мониторинг параметра рН в морском аквариуме необходим по следующим причинам. Во-первых, для каждого вида беспозвоночных оптимален конкретный уровень рН, снижение которого ниже рекомендуемого неизбежно замедлит кальцификацию их скелетов. PН природной морской воды составляет 7,6–8,5. Для морского рифового аквариума допустимо от 7,7 до 8,6.
Резкий рост уровня рН не так критичен, как резкое его понижение.При использовании жесткой воды уровень рН непременно повышается, следствием чего (при pH 8,2 и выше) является осадок кальция на оборудовании аквариума. Требуется контроль за показателями кальция и щелочности (быть не такими низкими, чтобы замедлить кальцификацию, но и не такими высокими, чтобы вести к кальцинированию оборудования).
Щелочность
На показатель жесткости рН напрямую влияет щёлочность воды, уровень которой в рифовом аквариуме возможен в рамках 3- 5 мэкв/л. В правильные морские рифы устанавливают кальциевый реактор с применением углекислого газа, для поддержания щелочности на должном уровне.
В правильные морские рифы устанавливают кальциевый реактор с применением углекислого газа, для поддержания щелочности на должном уровне.
Контролировать и регулировать уровень щелочности необходимо постоянно при помощи специальных добавок. Советуем держать щелочность чуть выше природных показателей.
Быстро скорректировать уровень щелочности можно с помощью обыкновенной соды.
Карбонатная жесткость
От 12 до 18 dКН – это оптимальный уровень карбонатной жесткости в морском аквариуме.
Кальций
Оптимальный показатель кальция не ниже 360 ppm. Снижение показателя кальция, так же, как и снижение рН, ведет к замедлению роста кораллов и других беспозвоночных. Но это не означает, что, если увеличить концентрацию кальция, можно добиться ускоренного роста кораллов.
Кальций быстро усваивается населением рифа (кораллами, известковыми водорослями, тридакнами и т.д.). Нельзя допускать одновременного снижения до нижней границы нормы рН, щелочности и кальция. При значительном снижении кальция поможет добавление хлорида кальция.
При значительном снижении кальция поможет добавление хлорида кальция.
В воде морского аквариума требуется контролировать уровень магния и фосфатов.
Магний влияет на баланс кальция и щёлочности. Магний также используется кораллами для построения скелетов.
Требуемая концентрация магния 1250-1400 ppm.
Фосфаты, уровень более 0,03 ppm-вызывает бурный рост водорослей.
Продолжение следует.
Морской аквариум – стал доступен широкому потребителю и вышел из разряда чего то экзотического и не досягаемого.
С уважением к Вам и вашему дому!
18.5: Мировой океан — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 91308
Вопросы для обсуждения
- Что такое жесткая вода?
- В чем разница между временной и постоянной жесткостью воды?
- Как превратить жесткую воду в мягкую?
- Как производить деионизированную воду?
Вода — самый важный ресурс.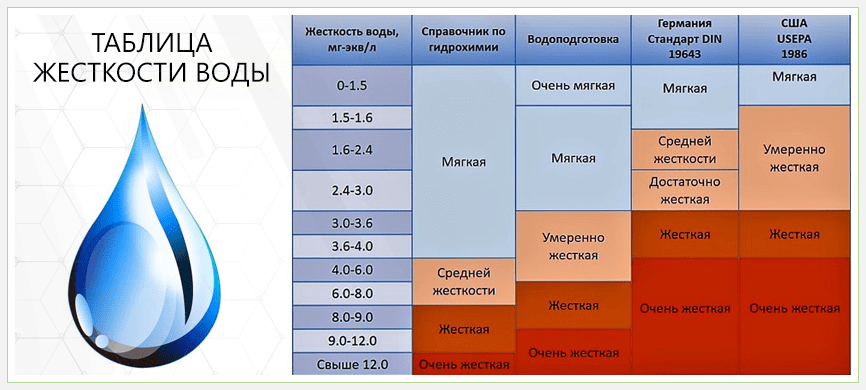 Без воды жизнь невозможна. С химической точки зрения вода, H 2 O, представляет собой чистое соединение, но на самом деле вы редко пьете, видите, прикасаетесь или используете чистую воду. Вода из различных источников содержит растворенные газы, минеральные вещества, органические и неорганические вещества.
Без воды жизнь невозможна. С химической точки зрения вода, H 2 O, представляет собой чистое соединение, но на самом деле вы редко пьете, видите, прикасаетесь или используете чистую воду. Вода из различных источников содержит растворенные газы, минеральные вещества, органические и неорганические вещества.
Гидросфера
Вся водная система, окружающая планету Земля, называется гидросферой . Он включает пресноводные системы, океаны, атмосферный пар и биологические воды. Северный Ледовитый, Атлантический, Индийский и Тихий океаны покрывают 71% поверхности Земли и содержат 97% всей воды. Менее 1 % приходится на пресную воду, а 2-3 % — на ледяные шапки и ледники. Антарктический ледяной щит размером почти с континент Северная Америка. Эти воды определяют нашу погоду и климат, прямо или косвенно влияя на нашу повседневную жизнь. Они охватывают 3,35×10 8 км 2 . Четыре океана имеют общий объем 1,35×10 9 км 3 .
- Солнечный свет тускнеет на 1/10 на каждые 75 м в океане, и люди едва видят свет ниже 500 м. Температура почти всех глубин океана составляет 4°С (277 К).
- Средняя глубина океана составляет 4 км, а самая глубокая точка Марианской впадины составляет 10 912 м (35 802 фута), что сопоставимо с высотой горы Эверест 8,8 км.
Гидросферные процессы — это шаги, по которым циркулирует вода на планете Земля. К этим процессам относятся сублимация льда, испарение жидкости, перенос влаги воздухом, дождем, снегом, речными, озерными и океанскими течениями. Все эти процессы связаны с физическими и химическими свойствами воды, и многие государственные учреждения созданы для изучения и регистрации связанных с ними явлений. Изучение этих процессов называется гидрология
Среди планет Земля единственная, на которой есть твердые, жидкие и газообразные воды. Эти условия как раз подходят для жизни, жизненно важной частью которой является вода. Вода является самым распространенным веществом в биосфере Земли. Подземные воды являются важной частью водной системы. Когда пар охлаждается, образуются облака и дождь. Часть дождя просачивается через почву в нижележащие породы. Вода в скалах подземные воды , которые движутся медленно.
Вода является самым распространенным веществом в биосфере Земли. Подземные воды являются важной частью водной системы. Когда пар охлаждается, образуются облака и дождь. Часть дождя просачивается через почву в нижележащие породы. Вода в скалах подземные воды , которые движутся медленно.
Горная порода, содержащая значительное количество воды, называется водоносным горизонтом . Ниже уровня грунтовых вод водоносный горизонт заполнен (или насыщен) водой. Над уровнем грунтовых вод находится ненасыщенная зона. В некоторых регионах имеется два или более зеркала грунтовых вод. Эти зоны обычно разделены водонепроницаемым материалом, таким как валун и глина. Подземные воды можно вывести на поверхность путем бурения ниже уровня грунтовых вод и откачать. Количество воды, которое можно откачать, зависит от структуры водоносного горизонта. Небольшое количество воды хранится в плотных слоях гранита, но большое количество воды хранится в слоях водоносных слоев известняка. В некоторых районах есть подземные реки. 9{-8.35}\)
В некоторых районах есть подземные реки. 9{-8.35}\)
Общие ионы, присутствующие в природной воде
Гидрология также изучает взаимодействие твердых и растворенных веществ в воде и с водой. В этой ссылке подробно приведены составы морской воды, состав атмосферы, составы дождя и снега, составы речных и озерных вод. В таблице \(\PageIndex{1}\) перечислены основные ионы, присутствующие в морской воде. Состав варьируется в зависимости от региона, глубины, широты и температуры воды. Воды в устьях рек содержат меньше солей. Если ионы используются живым организмом, их содержание варьируется в зависимости от популяций организмов.
Частицы пыли и ионы, присутствующие в воздухе, являются центрами зарождения капель воды. Так, дождевые и снеговые воды также содержат такие ионы: Ca 2+ , Mg 2+ , Na + , K + , NH 4 + . Эти катионы уравновешены анионами HCO 3 — , SO 4 — , NO 2 — , Cl — — , NO 3 . pH дождя составляет от 5,5 до 5,6. Дождевые и снеговые воды со временем становятся речной или озерной водой. Когда выпадают дождевые или снеговые воды, они взаимодействуют с растительностью, верхним слоем почвы, коренными породами, руслом реки и дном озера, растворяя все, что растворяется. Также процветают бактерии, водоросли и водные насекомые. Растворимость неорганических солей определяется кинетикой и равновесием растворения. Наиболее распространенные ионы в озерной и речной воде такие же, как и в дождевой воде, но в более высоких концентрациях. pH этих вод зависит от русла реки и дна озера. Природные воды содержат растворенные минералы. Воды, содержащие Ca 9Ионы 0044 2+ и Mg 2+ принято называть жесткой водой .
pH дождя составляет от 5,5 до 5,6. Дождевые и снеговые воды со временем становятся речной или озерной водой. Когда выпадают дождевые или снеговые воды, они взаимодействуют с растительностью, верхним слоем почвы, коренными породами, руслом реки и дном озера, растворяя все, что растворяется. Также процветают бактерии, водоросли и водные насекомые. Растворимость неорганических солей определяется кинетикой и равновесием растворения. Наиболее распространенные ионы в озерной и речной воде такие же, как и в дождевой воде, но в более высоких концентрациях. pH этих вод зависит от русла реки и дна озера. Природные воды содержат растворенные минералы. Воды, содержащие Ca 9Ионы 0044 2+ и Mg 2+ принято называть жесткой водой .
Жесткая вода
Минералы обычно растворяются в естественных водоемах, таких как озера, реки, родники и подземные водные пути (грунтовые воды). Карбонат кальция, CaCO 3 , является одним из наиболее распространенных неорганических соединений в земной коре. Это ингредиент как для кальцита, так и для арагонита. Эти два минерала имеют разную кристаллическую структуру и внешний вид. На этой фотографии показаны кристаллы типичного кальцита. 9{-9}\]
Это ингредиент как для кальцита, так и для арагонита. Эти два минерала имеют разную кристаллическую структуру и внешний вид. На этой фотографии показаны кристаллы типичного кальцита. 9{-9}\]
Из произведения растворимости мы можем (см. пример 1) оценить молярную растворимость как 7,1×10 -5 M или 7,1 мг/л (7,1 ppm CaCO 3 в воде). Растворимость увеличивается по мере снижения pH (повышения кислотности). Это усугубляется, когда вода насыщена двуокисью углерода, CO 2 . Насыщенный раствор CO 2 содержит угольную кислоту, которая способствует растворению за счет реакции:
\[H_2O + CO_2 \rightleftharpoons H_2CO_3\] 9-\]
Из-за этих реакций некоторые природные воды содержат более 300 частей на миллион карбонатов кальция или их эквивалентов.
Углекислый газ в природной воде создает интересное явление. Дождевая вода насыщена CO 2 и растворяет известняки. При потере СО 2 из-за изменения температуры или вытекания капель воды происходит обратная реакция. Однако образовавшееся твердое вещество может быть менее стабильной фазой, называемой арагонитом, которая имеет ту же химическую формулу, но другую кристаллическую структуру, чем у кальцита.
Однако образовавшееся твердое вещество может быть менее стабильной фазой, называемой арагонитом, которая имеет ту же химическую формулу, но другую кристаллическую структуру, чем у кальцита.
Дождь растворяет карбонат кальция в результате двух реакций, показанных выше. Вода уносит с собой ионы, глотает сквозь трещины скал. Достигнув потолка пещеры, капля долго болтается там, прежде чем упасть. За это время улетучивается углекислый газ и повышается рН воды. Начинают появляться кристаллы карбоната кальция. Кальцит, арагонит, сталактит и сталагмит — это четыре распространенных твердых вещества, встречающихся при образовании пещер.
Природные воды содержат ионы металлов. Вода, содержащая кальций, магний и их противоанионы, называется 9.-\]
вода, содержащая ионы Ca 2+ , Mg 2+ и CO 3 2- , называется временной жесткой водой , потому что жесткость можно устранить кипячением. Кипячение вызывает обратную реакцию, вызывая отложения в трубах и накипь в котлах.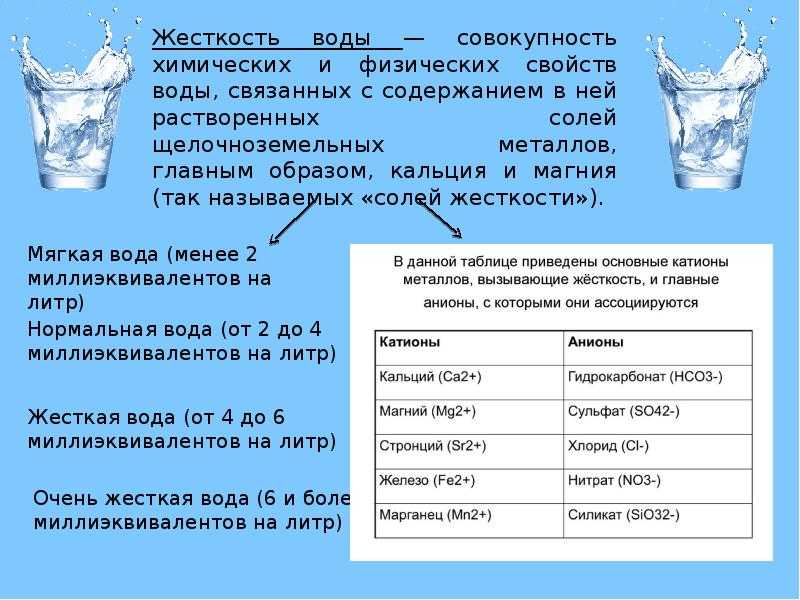 Отложения снижают эффективность теплообмена в котлах и уменьшают расход воды в трубах. Таким образом, временная жесткая вода должна быть умягчена перед тем, как она попадет в котел, бак горячей воды или систему охлаждения. Количество ионов металлов, которое можно удалить при кипячении, называется 9.0042 временная жесткость
Отложения снижают эффективность теплообмена в котлах и уменьшают расход воды в трубах. Таким образом, временная жесткая вода должна быть умягчена перед тем, как она попадет в котел, бак горячей воды или систему охлаждения. Количество ионов металлов, которое можно удалить при кипячении, называется 9.0042 временная жесткость
После кипячения остаются ионы металлов за счет присутствия хлорид-ионов, сульфат-ионов, нитрат-ионов и достаточно высокой растворимости MgCO 3 . Количество ионов металлов, которое не может быть удалено кипячением, называется постоянной жесткостью . Общая твердость представляет собой сумму временной и постоянной твердости. Жесткость часто выражают эквивалентностью количества ионов кальция в растворе. Таким образом, водоподготовка является важной темой. Стоимость рынка очистки воды оценивается в 30 миллиардов долларов. 9{2-} + \rightarrow CaCO_{3(s)}\]
При этой обработке необходимое количество Ca(OH) 3 эквивалентно временной жесткости плюс жесткость по магнию.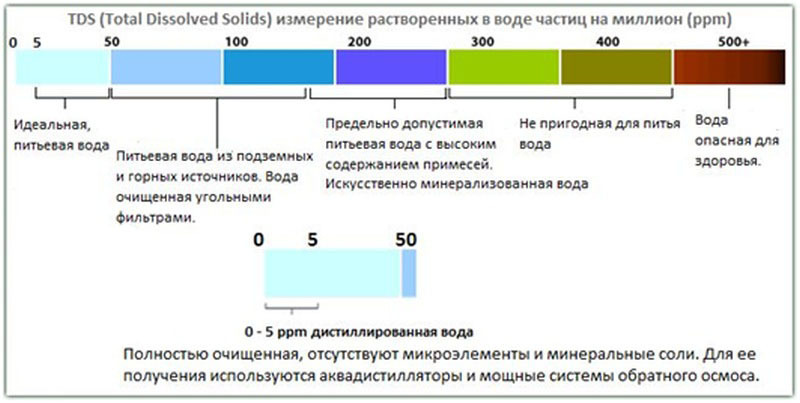 Требуемое количество карбоната натрия эквивалентно постоянной жесткости. Таким образом, известково-содовое умягчение эффективно, если определены как временная, так и общая жесткость. Ион натрия останется в воде после обработки. Уровень pH воды также довольно высок в зависимости от количества используемой извести и карбонатов натрия.
Требуемое количество карбоната натрия эквивалентно постоянной жесткости. Таким образом, известково-содовое умягчение эффективно, если определены как временная, так и общая жесткость. Ион натрия останется в воде после обработки. Уровень pH воды также довольно высок в зависимости от количества используемой извести и карбонатов натрия.
Комплексообразование
Добавление комплексообразователя для образования растворимых комплексов с Ca 2+ и Mg 2+ предотвращает образование твердого вещества. Одним из комплексообразователей является трифосфат натрия Na 3 PO 4 , который продается как Calgon и т. д. Фосфат является комплексообразователем. Другие комплексообразователи, такие как Na 2 H 2 ЭДТА, также могут быть использованы, но комплексообразователь ЭДТА 4- образует прочные комплексы с переходными металлами. Это вызывает проблему коррозии, если только трубы системы не изготовлены из нержавеющей стали.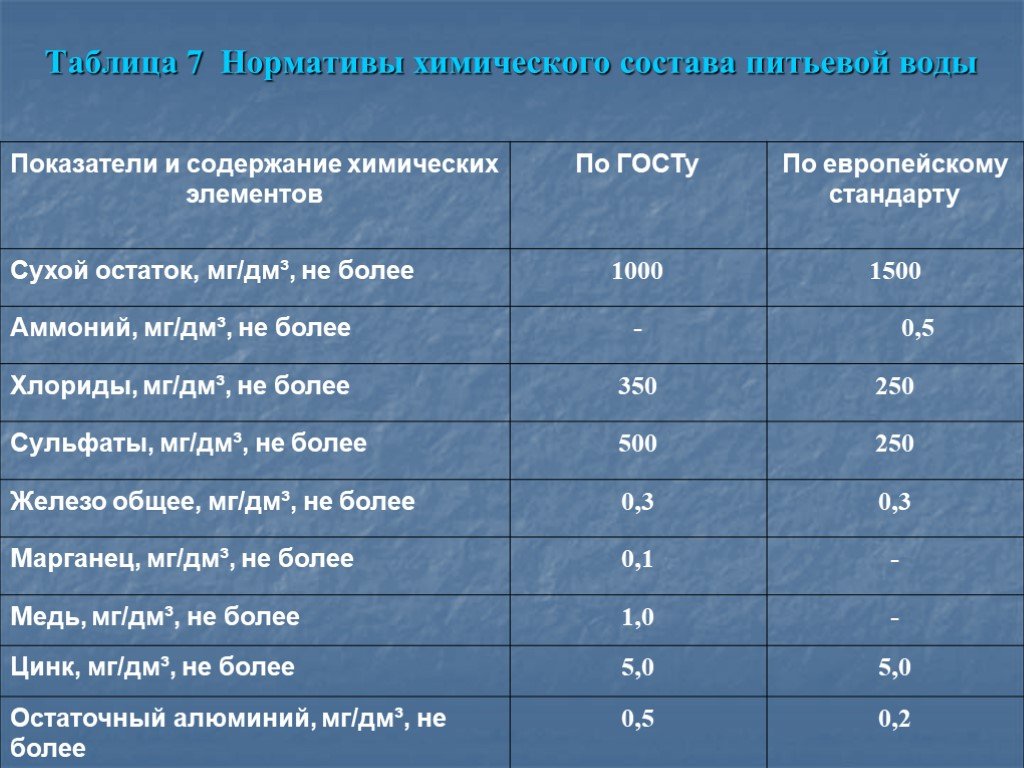
Ионный обмен
Сегодня в большинстве умягчителей воды используются цеолиты и технология ионного обмена для смягчения жесткой воды. Цеолиты представляют собой группу гидратированных кристаллических алюмосиликатов, обнаруженных в некоторых вулканических породах. Тетраэдрически координированные атомы алюминия и кремния образуют тетраэдрические группы AlO 4 и SiO 4 . Они соединяются друг с другом, разделяя атомы кислорода, образуя структуры клеточного типа, как показано справа. Эта диаграмма и следующая структурная диаграмма взяты из введения в цеолиты. Существует много видов цеолитов, некоторые из которых были недавно синтезированы.
Кристаллическая структура цеолитов любого типа содержит большие клетки. Клетки соединены друг с другом, образуя каркас с множеством полостей и каналов. В этих полостях и каналах могут задерживаться как положительные, так и отрицательные ионы, как показано ниже.
Для каждого кислорода, который не является общим в тетраэдрических группах AlO 4 и SiO 4 , на группе остается отрицательный заряд. Эти отрицательные заряды уравновешиваются за счет захвата ионов щелочных и щелочноземельных металлов. Когда захватывается больше катионов, ионы гидроксида и хлорида остаются в полостях и каналах цеолитов.
Эти отрицательные заряды уравновешиваются за счет захвата ионов щелочных и щелочноземельных металлов. Когда захватывается больше катионов, ионы гидроксида и хлорида остаются в полостях и каналах цеолитов.
Для приготовления цеолита для обработки воды их замачивают в концентрированном растворе NaCl. Полости захватывают столько ионов натрия, сколько могут вместить. После обработки цеолит обозначается как Na-цеолит. Затем солевой раствор сливают, а цеолит промывают водой для удаления лишней соли. Когда через них протекает жесткая вода, ионы кальция и магния захватываются цеолитом Na. На каждый захваченный Ca 2+ или Mg 2+ высвобождается два иона Na + . Очищенная вода содержит достаточно высокую концентрацию Na + ионы, но низкие концентрации Mg 2+ и Ca 2+ . Таким образом, цеолитный ионообмен превращает жесткую воду в мягкую.
Чистая вода путем ионного обмена
В большинстве случаев смолы представляют собой полистирол с функциональными -SO 3 H-группами, присоединенными к полимерной цепи для катионообменной смолы, и с функциональной группой -N(CH 3 ) 3 + прикреплен к цепи для анионообменной смолы.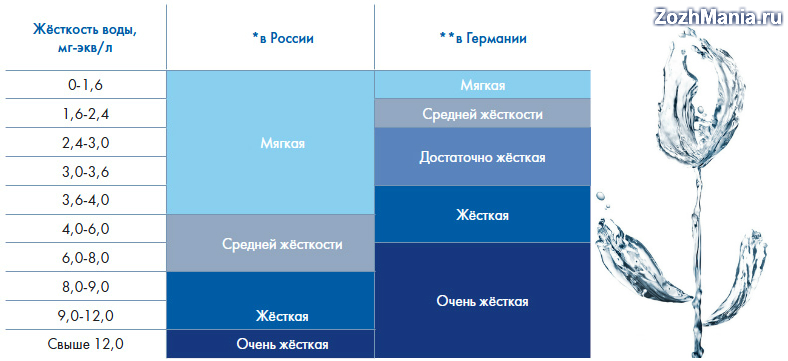 Подготовить смолу для изготовления 9{+} + OH- <=> h3O}\]
Подготовить смолу для изготовления 9{+} + OH- <=> h3O}\]
Таким образом, ионный обмен обеспечивает чистую воду для удовлетворения лабораторных требований.
Система фильтрации воды обратного осмоса
Этот метод также можно использовать для подготовки воды для бытовых и лабораторных нужд. Этот метод обсуждался в Очистка сточных вод
Магнитная очистка воды
Ниже приведен список компаний, продающих магнитные устройства для магнитной обработки воды . Все устройства основаны на результатах некоторых исследований, показывающих, что, когда вода проходит через магнитное поле, карбонат кальция выпадает в осадок в виде арагонита, а не обычного кальцита. Например, К.Дж. Кроненберг опубликовал статью в IEEE Transactions on Magnetics (Том Mag-21, № 5, сентябрь 1985 г., страницы 2059-2061). и заявил следующее:
Было обнаружено, что способ кристаллизации минерального содержимого воды изменился от дендритного, связанного с субстратом, к форме отдельных дискообразных кристаллов после того, как вода прошла через ряд магнитных полей. Прежний дефицит зародышей кристаллизации в воде превратился в обилие зародышей в воде. Уменьшение количества кристаллов, связанных с подложкой, использовалось как количественная мера магнитного эффекта.
Прежний дефицит зародышей кристаллизации в воде превратился в обилие зародышей в воде. Уменьшение количества кристаллов, связанных с подложкой, использовалось как количественная мера магнитного эффекта.
Многие компании производят различные устройства для магнитной обработки воды и утверждают, что их устройства помогут очистить трубы и бойлеры за небольшие деньги или бесплатно. Мне еще предстоит протестировать одно из этих устройств на соответствие его заявлению, но мои предварительные тесты показывают, что постоянный магнит мало влияет на отложения карбоната кальция временной жесткой воды. Эффект очистки, о котором они заявляют, вероятно, сильно преувеличен.
Пример \(\PageIndex{1}\)
Из произведения растворимости, показанного для растворения карбоната кальция, 9{-5}\; M\]
Концентрация 7,1×10 -5 M эквивалентна 7,1 мг/л (7,1 ppm CaCO 3 в воде).
ОБСУЖДЕНИЕ
В системе могут присутствовать другие ионы и другие условия равновесия в дополнение к упомянутому здесь равновесию. В реальном мире проблемы более сложны.
В реальном мире проблемы более сложны.
Упражнение \(\PageIndex{1}\)
При кипячении 1,0 л воды образуется 10 мг твердого CaCO3. Какова временная жесткость воды?
- Ответить
10 частей на миллион
Авторы и авторство
18.5: Мировой океан используется в соответствии с недекларированной лицензией, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги

Управление жесткостью морской воды
Значение минералов в воде
19 июня 2018 г.
Природные минералы в наземных водах
Содержание минералов в наземных источниках воды, муниципальных или частных, увеличивается естественным образом, когда дождевая вода «просачивается» через коренные породы в окрестностях. Обычными минералами в большинстве регионов Великобритании являются соли кальция и магния. Когда минералы растворяются в породе, они действуют как «буфер» для pH. Они улучшают вкусовые качества, полезность и могут противодействовать коррозии. Коррозия может привести к:
- Повышенному содержанию тяжелых металлов
- Точечные утечки
- Неисправное оборудование, напр. паровые печи
Приготовление воды на шельфе
Многие морские установки в Северном море оснащены установками для опреснения воды в форме обратного осмоса или испарительных конденсаторов. Эта бортовая возможность позволяет обеспечить независимость подачи воды от погодных условий, в отличие от традиционной бункеровки. При производстве опресненной воды из морской воды образуется «мягкая вода» (пермеат) с очень низким содержанием минералов и, как правило, с низким pH. Хорошо управляемый процесс позволяет получать очень чистую воду, поскольку удаляются твердые частицы и бактерии.
Эта бортовая возможность позволяет обеспечить независимость подачи воды от погодных условий, в отличие от традиционной бункеровки. При производстве опресненной воды из морской воды образуется «мягкая вода» (пермеат) с очень низким содержанием минералов и, как правило, с низким pH. Хорошо управляемый процесс позволяет получать очень чистую воду, поскольку удаляются твердые частицы и бактерии.
Исторически сложилось так, что опреснительные установки в основном использовались для технического водоснабжения. В настоящее время такая вода также используется для питья, приготовления пищи, стирки и уборки. Таким образом, пермеат повторно минерализуется, имитируя процесс прохождения дождевой воды через коренную породу.
Добавление минералов
Добавление минералов из отвердителя может использоваться для компенсации мягкости. Однако, если добавить слишком много, это может вызвать чрезмерное поглощение минералов (жесткая вода), что может привести к образованию накипи и закупорке.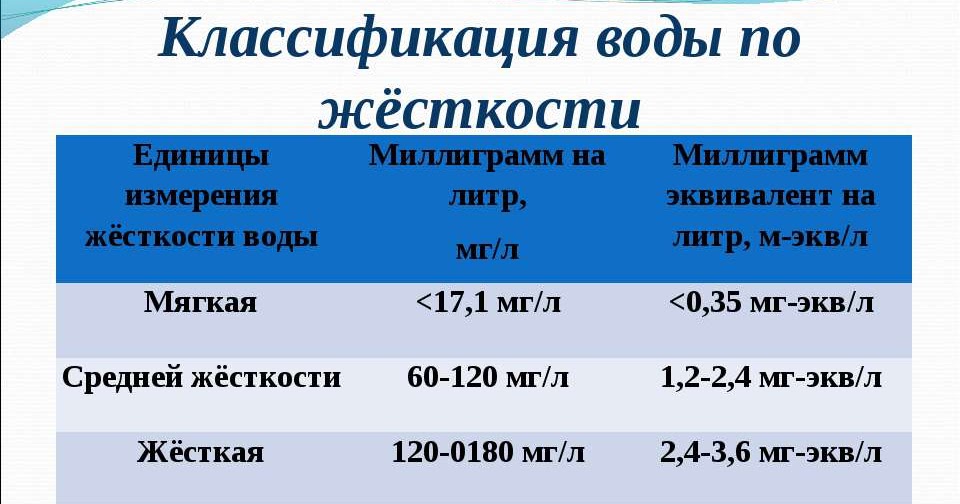
Балансировка воды, полученная обратным осмосом, может быть достигнута несколькими способами, но для этого требуется хорошая конструкция системы и план управления. Подходы к адаптации процесса повторного отверждения к состоянию пермеата включают:
- Минерал для повторного отверждения – выбор различных типов и размеров зерна для воздействия на площадь поверхности, контактирующей с водой.
- Предварительная закачка углекислого газа – Закачка углекислого газа в пермеат перед фильтром повторного отверждения. Это временно еще больше подкисляет воду и позволяет повторно затвердевающим минералам растворяться более эффективно.
- Достаточное время контакта с минералом – Регулируемый расход воды через камеру повторного затвердевания, где минерал всегда должен быть заполнен до максимального уровня.
- Без повторного отверждения Уплотнение – Повторно отвердевающий минерал может уплотняться, что снижает его эффективность.
 Некоторые фильтрующие камеры имеют функцию обратной промывки для уменьшения уплотнения. Там, где это невозможно, следует полностью заменить уплотненный минерал.
Некоторые фильтрующие камеры имеют функцию обратной промывки для уменьшения уплотнения. Там, где это невозможно, следует полностью заменить уплотненный минерал. - Контроль общей жесткости на месте – Контроль на выходе холодной воды, т.к. на выходе горячей воды снижена жесткость. В идеале общая жесткость должна быть выше 60 мг/л, как указано в Руководстве по санитарии судов Всемирной организации здравоохранения, 3-е издание, 2011 г. и потенциальная коррозионная активность воды. Он учитывает такие параметры, как pH, электропроводность, кальций, бикарбонат и температура.
Другие добавки к воде, такие как фосфаты, могут снизить коррозионную активность при осторожном использовании. Тем не менее, следует использовать и контролировать поставки, одобренные Инспекцией питьевой воды.
В то время как химический состав воды является одним из факторов, важно помнить, что другие факторы в совокупности влияют на условия внутри водопровода, не говоря уже о материале конструкции.

Консультации экспертов
Наши аудиты установленных установок по опреснению воды предоставят вам экспертные рекомендации по техническому обслуживанию системы и улучшениям мониторинга для обеспечения надежного качества воды на шельфе. Кроме того, программа регулярного мониторинга может позволить отслеживать изменения качества воды с течением времени и предоставлять своевременные предупреждения для облегчения принятия решений. По мнению регулирующих органов, полезная вода должна соответствовать ряду стандартов, прежде чем ее можно будет объявить безопасной для питья, приготовления пищи или мытья. Любой сбой может привести к болезни, дорогостоящему простою и юридическим последствиям.
Мы также тесно сотрудничаем со специалистами Intertek по коррозии, чьи оценки на конкретных участках могут определить возможную причину любых проблем с коррозией в вашей системе питьевой воды и оптимизировать действия по устранению. Пожалуйста, свяжитесь с нами, если вы хотите узнать больше.





 Некоторые фильтрующие камеры имеют функцию обратной промывки для уменьшения уплотнения. Там, где это невозможно, следует полностью заменить уплотненный минерал.
Некоторые фильтрующие камеры имеют функцию обратной промывки для уменьшения уплотнения. Там, где это невозможно, следует полностью заменить уплотненный минерал.