Содержание
Свойства калия и его взаимодействие с водой
[Deposit Photos]
Калий — девятнадцатый элемент периодической таблицы Менделеева, относится к щелочным металлам. Это простое вещество, которое при нормальных условиях пребывает в твердом агрегатном состоянии. Закипает калий при температуре 761 °С. Температура плавления элемента — 63 °С. Калий имеет серебристо-белую окраску с металлическим блеском.
Химические свойства калия
Калий — элемент, обладающий высокой химической активностью, поэтому его нельзя хранить на открытом воздухе: щелочной металл моментально вступает в реакцию с окружающими веществами. Этот химический элемент относится к I группе и IV периоду таблицы Менделеева. Калий обладает всеми характерными для металлов свойствами.
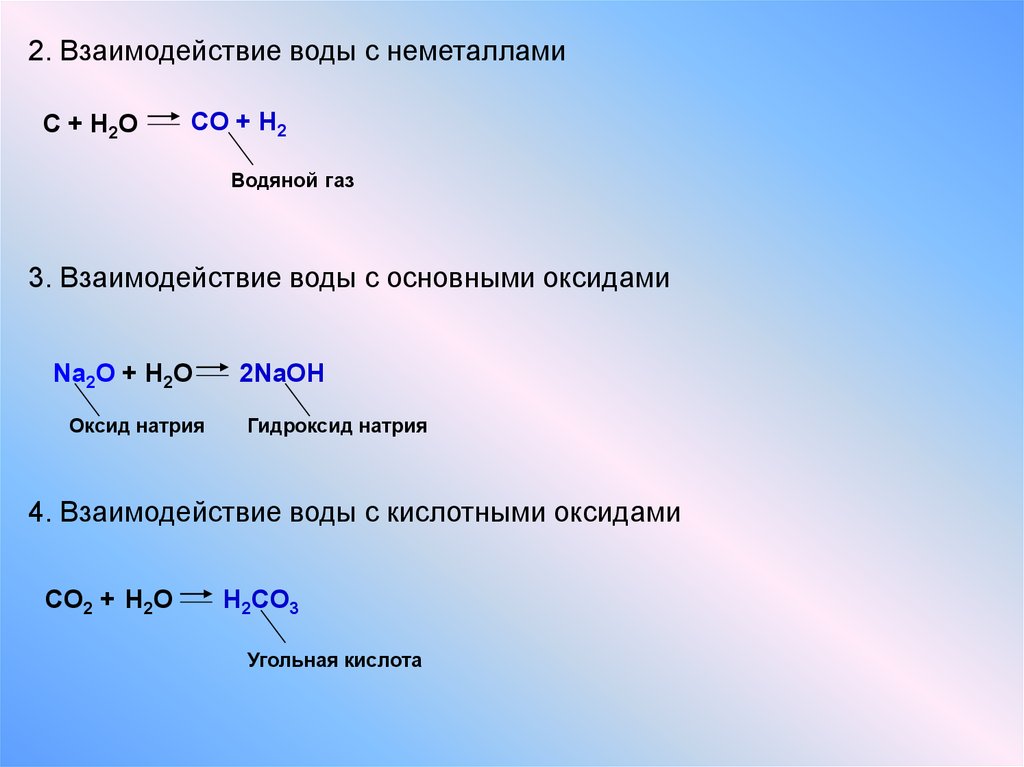
Он взаимодействует с простыми веществами, к которым относятся галогены (бром, хлор, фтор, иод) и фосфор, сера, азот и кислород. Взаимодействие калия с кислородом называется окислением. В течение этой химической реакции кислород и калий расходуются в молярном соотношении 4:1, в результате чего образуется оксид калия в количестве двух частей. Такое взаимодействие можно выразить уравнением реакции:
Взаимодействие калия с кислородом называется окислением. В течение этой химической реакции кислород и калий расходуются в молярном соотношении 4:1, в результате чего образуется оксид калия в количестве двух частей. Такое взаимодействие можно выразить уравнением реакции:
4К + О₂ = 2К₂О
Во время горения калия наблюдается пламя ярко-фиолетового цвета.
Такое взаимодействие считается качественной реакцией на определение калия. Реакции калия с галогенами называются в соответствии с названиями химических элементов: это фторирование, иодирование, бромирование, хлорирование. Такие взаимодействия являются реакциями присоединения. Пример — реакция между калием и хлором, в результате которой образуется хлорид калия. Для проведения такого взаимодействия берут два моля калия и один моль хлора. В результате образуется два моля калия:
2К + СІ₂ = 2КСІ
Молекулярное строение хлорида калия
[Wikimedia]
При горении на открытом воздухе калий и азот расходуются в молярном соотношении 6:1. В результате такого взаимодействия образуется нитрид калия в количестве двух частей:
В результате такого взаимодействия образуется нитрид калия в количестве двух частей:
6К + N₂ = 2K₃N
Соединение представляет собой кристаллы зелено-черного цвета.
С фосфором калий реагирует по такому же принципу. Если взять 3 моля калия и 1 моль фосфора, получится 1 моль фосфида:
3К + Р = К₃Р
Калий реагирует с водородом, образуя гидрид:
2К + Н₂ = 2КН
Все реакции присоединения происходят при высоких температурах
Взаимодействие калия со сложными веществами
К сложным веществам, с которыми вступает в реакцию калий, относятся вода, соли, кислоты и оксиды. Так как калий — активный металл, он вытесняет атомы водорода из их соединений. Пример — реакция, происходящая между калием и соляной кислотой. Для ее проведения берется по 2 моля калия и кислоты. В результате реакции образуется 2 моля хлорида калия и 1 моль водорода:
2К + 2НСІ = 2КСІ + Н₂
Более детально стоит рассмотреть процесс взаимодействия калия с водой. Калий бурно взаимодействует с водой. Он движется по поверхности воды, его подталкивает выделяющийся водород:
Он движется по поверхности воды, его подталкивает выделяющийся водород:
2K + 2H₂O = 2KOH + H₂↑
В ходе реакции в единицу времени выделяется много тепла, что приводит к воспламенению калия и выделяющегося водорода. Это очень интересный процесс: при контакте с водой калий мгновенно воспламеняется, фиолетовое пламя потрескивает и быстро передвигается по поверхности воды. В конце реакции происходит вспышка с разбрызгиванием капель горящего калия и продуктов реакции.
Реакция калия с водой
[Wikimedia]
Основной конечный продукт реакции калия с водой — гидроксид калия (щелочь). Уравнение реакции калия с водой:
4K + 2H₂O + O₂ = 4KOH
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
При неправильном проведении эксперимента можно получить ожог щелочью. Для реакции обычно используют кристаллизатор с водой, в который помещают кусочек калия. Как только водород прекращает горение, многие хотят заглянуть в кристаллизатор. В этот момент происходит завершающая стадия реакции калия с водой, сопровождающаяся слабым взрывом и разбрызгиванием образовавшейся горячей щелочи. Поэтому в целях безопасности стоит держаться на некотором расстоянии от лабораторного стола, пока реакция не завершится полностью. Здесь вы найдете самые зрелищные опыты, которые можно проводить с детьми дома.
Как только водород прекращает горение, многие хотят заглянуть в кристаллизатор. В этот момент происходит завершающая стадия реакции калия с водой, сопровождающаяся слабым взрывом и разбрызгиванием образовавшейся горячей щелочи. Поэтому в целях безопасности стоит держаться на некотором расстоянии от лабораторного стола, пока реакция не завершится полностью. Здесь вы найдете самые зрелищные опыты, которые можно проводить с детьми дома.
Строение калия
[Deposit Photos]
Атом калия состоит из ядра, в котором содержатся протоны и нейтроны, и электронов, вращающихся вокруг него. Количество электронов всегда равно количеству протонов, находящихся внутри ядра. При отсоединении электрона или при присоединении к атому он перестает быть нейтральным и превращается в ион. Ионы делятся на катионы и анионы. Катионы обладают положительным зарядом, анионы — отрицательным.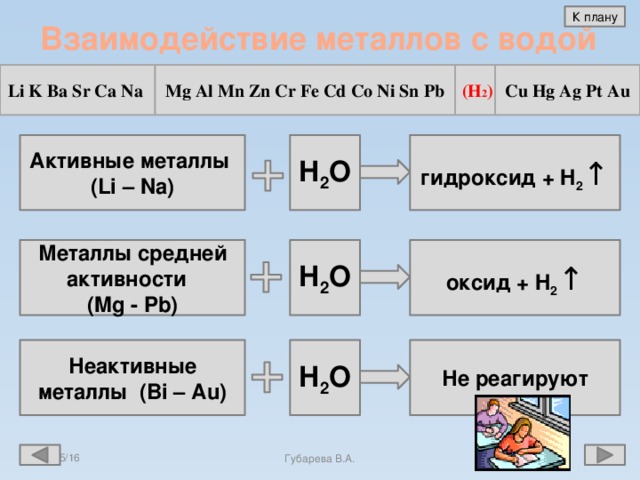 При присоединении к атому электрона он превращается в анион; если же один из электронов покидает свою орбиту, нейтральный атом превращается в катион.
При присоединении к атому электрона он превращается в анион; если же один из электронов покидает свою орбиту, нейтральный атом превращается в катион.
Порядковый номер калия в периодической таблице Менделеева — 19. Значит, протонов в ядре химического элемента находится тоже 19. Вывод: электронов вокруг ядра расположено 19. Количество протонов в структуре атома определяется так: от атомной массы отнять порядковый номер химического элемента. Вывод: в ядре калия находится 20 протонов. Калий принадлежит к IV периоду, имеет 4 «орбиты», на которых равномерно располагаются электроны, пребывающие в постоянном движении. На первой «орбите» расположены 2 электрона, на второй — 8; на третьей и на последней, четвертой «орбите», вращается 1 электрон. Этим объясняется высокий уровень химической активности калия: его последняя «орбита» не заполнена полностью, поэтому элемент стремится соединиться с другими атомами. В результате электроны последних орбит двух элементов станут общими.
каковы квантовые причины реакции натрия с водой? / Хабр
Если поместить кусочек натрия в воду, можно вызвать бурную, часто взрывную реакцию
Иногда мы узнаём что-то в начале жизни и просто принимаем, как данность, что мир работает именно так. К примеру, если бросить кусочек чистого натрия в воду, можно получить легендарную взрывную реакцию. Как только кусочек намокнет, реакция заставляет его шипеть и разогреваться, он прыгает по поверхности воды и даже выдаёт язычки пламени. Это, конечно, просто химия. Но не происходит ли чего-то ещё на фундаментальном уровне? Именно это и хочет узнать наш читатель Семён Стопкин из России:
К примеру, если бросить кусочек чистого натрия в воду, можно получить легендарную взрывную реакцию. Как только кусочек намокнет, реакция заставляет его шипеть и разогреваться, он прыгает по поверхности воды и даже выдаёт язычки пламени. Это, конечно, просто химия. Но не происходит ли чего-то ещё на фундаментальном уровне? Именно это и хочет узнать наш читатель Семён Стопкин из России:
Какие силы управляют химическими реакциями, и что происходит на квантовом уровне? В частности, что происходит, когда вода взаимодействует с натрием?
Реакция натрия с водой — это классика, и у неё есть глубокое объяснение. Начнём с изучения прохождения реакции.
Первое, что нужно знать о натрии — на атомном уровне у него всего на один протон и один электрон больше, чем у инертного, или благородного газа, неона. Инертные газы не реагируют ни с чем, и всё из-за того, что все их атомные орбитали полностью заполнены электронами. Эта сверхстабильная конфигурация рушится, когда вы переходите на один элемент далее в периодической таблице Менделеева, и это происходит со всеми элементами, демонстрирующими похожее поведение. Гелий сверхстабилен, а литий чрезвычайно активен химически. Неон стабилен, а натрий активен. Аргон, криптон и ксенон — стабильны, но калий, рубидий и цезий — активны.
Гелий сверхстабилен, а литий чрезвычайно активен химически. Неон стабилен, а натрий активен. Аргон, криптон и ксенон — стабильны, но калий, рубидий и цезий — активны.
Причина заключается в дополнительном электроне.
Таблица Менделеева рассортирована по периодам и группам согласно количеству свободных и занятых валентных электронов — а это первейший фактор в определении химических свойств элемента
Когда мы изучаем атомы, мы привыкаем считать ядро твёрдым, мелким, положительно заряженным центром, а электроны — отрицательно заряженными точками на орбите вокруг него. Но в квантовой физике этим дело не заканчивается. Электроны могут вести себя, как точки, в особенности если выстрелить в них другой высокоэнергетической частицей или фотоном, но если их оставить в покое, они расплываются и ведут себя, как волны. Эти волны способны самонастраиваться определённым образом: сферически (для s-орбиталей, содержащих по 2 электрона), перпендикулярно (для p-орбиталей, содержащих по 6 электронов), и далее, до d-орбиталей (по 10 электронов), f-орбиталей (по 14) и т. д.
д.
Орбитали атомов в состоянии с наименьшей энергией находятся вверху слева, и при продвижении вправо и вниз энергии растут. Эти фундаментальные конфигурации управляют поведением атомов и внутриатомными взаимодействиями.
Заполняются эти оболочки из-за принципа запрета Паули, запрещающего двум одинаковым фермионам (например, электронам) занимать одно и то же квантовое состояние. Если в атоме электронная орбиталь заполнилась, то единственное место, где можно разместить электрон — это следующая, более высокая орбиталь. Атом хлора с удовольствием примет дополнительный электрон, поскольку ему не хватает всего одного для заполнения электронной оболочки. И наоборот, атом натрия с удовольствием отдаст свой последний электрон, поскольку он у него лишний, а все остальные заполнили оболочки. Поэтому натрий хлор так хорошо и получается: натрий отдаёт электрон хлору, и оба атома находятся в энергетически предпочтительной конфигурации.
Элементы первой группы периодической таблицы, особенно литий, натрий, калий, рубидий и т. д. теряют свой первый электрон гораздо легче всех остальных
д. теряют свой первый электрон гораздо легче всех остальных
На самом деле количество энергии, необходимое для того, чтобы атом отдал свой внешний электрон, или энергия ионизации, оказывается особенно низкой у металлов с одним валентным электроном. Из чисел видно, что гораздо легче забрать электрон у лития, натрия, калия, рубидия, цезия и т.п., чем у любого другого элемента
Кадр из анимации, демонстрирующей динамическое взаимодействие молекул воды. Отдельные молекулы H2O имеют V-образную форму и состоят из двух атомов водорода (белые), соединённых с атомом кислорода (красные). Соседние молекулы H2O кратковременно реагируют друг с другом через водородные связи (бело-голубые овалы)
Так что же происходит в присутствии воды? Вы можете представлять себе молекулы воды как крайне стабильные — H2O, два водорода, связанные с одним кислородом. Но молекула воды чрезвычайно полярная — то есть, с одной стороны молекулы H2O (со стороны, противоположной двум водородам) заряд получается отрицательным, а с противоположной — положительным. Этого эффекта достаточно для того, чтобы некоторые молекулы воды — порядка одной на несколько миллионов — распадались на два иона — один протон (H+) и ион гидроксила (OH—).
Этого эффекта достаточно для того, чтобы некоторые молекулы воды — порядка одной на несколько миллионов — распадались на два иона — один протон (H+) и ион гидроксила (OH—).
В присутствии большого количества чрезвычайно полярных молекул воды одна из нескольких миллионов молекул распадётся на ионы гидроксила и свободные протоны — этот процесс называется автопротолиз
Последствия этого довольно важны для таких вещей, как кислоты и основания, для процессов растворения солей и активизации химических реакций, и т.п. Но нас интересует, что происходит при добавлении натрия. Натрий — этот нейтральный атом с одним плохо держащимся внешним электроном — попадает в воду. А это не просто нейтральные молекулы H2O, это ионы гидроксила и отдельные протоны. Важны нам прежде всего протоны — они и подводят нас к ключевому вопросу:
Что энергетически предпочтительнее? Иметь нейтральный атом натрия Na вместе с отдельным протоном H+, или ион натрия, потерявший электрон Na+ вместе с нейтральным атомом водорода H?
Ответ прост: в любом случае электрон перепрыгнет с атома натрия на первый же встречный отдельный протон, который попадётся ему на пути.
Потеряв электрон, ион натрия с удовольствием растворится в воде, как делает ион хлора, приобретя электрон. Гораздо более выгодно энергетически — в случае натрия — чтобы электрон спарился с ионом водорода
Именно поэтому реакция происходит так быстро и с таким выходом энергии. Но это ещё не всё. У нас получились нейтральные атомы водорода, и, в отличие от натрия, они не выстраиваются в блок отдельных атомов, связанных вместе. Водород — это газ, и он переходит в ещё более энергетически предпочтительное состояние: формирует нейтральную молекулу водорода H2. И в результате образуется много свободной энергии, уходящей в разогрев окружающих молекул, нейтральный водород в виде газа, который выходит из жидкого раствора в атмосферу, содержащую нейтральный кислород O2.
Удалённая камера снимает вблизи главный двигатель Шатла во время тестового прогона в космическом центре имени Джона Стенниса. Водород — предпочтительное топливо для ракет благодаря его низкому молекулярному весу и избытку кислорода в атмосфере, с которым он может реагировать
Если накопить достаточное количество энергии, водород и кислород тоже вступят в реакцию! Это яростное горение выдаёт водяной пар и огромное количество энергии. Поэтому при попадании кусочка натрия (или любого элемента их первой группы периодической таблицы) в воду случается взрывной выход энергии. Всё это происходит из-за переноса электронов, управляемого квантовыми законами Вселенной, и электромагнитных свойств заряженных частиц, составляющих атомы и ионы.
Поэтому при попадании кусочка натрия (или любого элемента их первой группы периодической таблицы) в воду случается взрывной выход энергии. Всё это происходит из-за переноса электронов, управляемого квантовыми законами Вселенной, и электромагнитных свойств заряженных частиц, составляющих атомы и ионы.
Энергетические уровни и волновые функции электронов, соответствующие различным состояниям атома водорода — хотя почти такие же конфигурации присущи всем атомам. Уровни энергии квантуются кратно постоянной Планка, но даже минимальная энергия, основное состояние, имеет две возможные конфигурации в зависимости от соотношения спинов электрона и протона
Итак, повторим, что происходит, когда кусочек натрия падает в воду:
- натрий немедля отдаёт внешний электрон в воду,
- где он поглощается ионом водорода и формирует нейтральный водород,
- эта реакция высвобождает большое количество энергии, и разогревает окружающие молекулы,
- нейтральный водород превращается в молекулярный водородный газ и поднимается из жидкости,
- и, наконец, при достаточном количестве энергии атмосферный кислород вступает с водородным газом в реакцию горения.

Металлический натрий
Всё это можно просто и элегантно объяснить при помощи правил химии, и именно так это часто и делают. Однако правила, управляющие поведением всех химических реакций, происходит из ещё более фундаментальных законов: законов квантовой физики (таких, как принцип запрета Паули, управляющий поведением электронов в атомах) и электромагнетизм (управляющий взаимодействием заряженных частиц). Без этих законов и сил не будет никакой химии! И благодаря им каждый раз, уронив натрий в воду, вы знаете, чего следует ожидать. Если вы ещё не поняли — нужно надевать защиту, не брать натрий руками и отходить подальше, когда начинается реакция!
Итан Сигель – астрофизик, популяризатор науки, автор блога Starts With A Bang! Написал книги «За пределами галактики» [Beyond The Galaxy], и «Трекнология: наука Звёздного пути» [Treknology].
ЧаВо: если Вселенная расширяется, почему не расширяемся мы; почему возраст Вселенной не совпадает с радиусом наблюдаемой её части .
5.11: Взаимодействие с водой — LibreTexts по биологии
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 4226
- Майкл В. Климковски и Мелани М. Купер
- Университет Колорадо в Боулдере и Университет штата Мичиган
Мы можем получить представление о гидрофильной, гидрофобной/гидроапатической и амфипатической природе молекул по их поведению, когда пытаемся растворить их в воде. Молекулы, такие как сахара (углеводы), спирты и большинство аминокислот, в основном гидрофильны. Они легко растворяются в воде. Молекулы, такие как жиры, очень гидрофобны (гидроапатичны) и практически не растворяются в воде. Так почему же разница? Чтобы ответить на этот вопрос, мы должны четко понимать, что мы имеем в виду, когда говорим, что молекула растворима в воде. Мы рассмотрим это с двух точек зрения. Во-первых, как выглядит раствор на молекулярном уровне, во-вторых, как раствор ведет себя с течением времени. Для начала нам нужно понять, как выглядит вода сама по себе. Из-за своей способности создавать и отдавать множественные электростатические взаимодействия типа водородных связей в тетраэдрическом расположении молекулы воды образуют динамическую трехмерную сеть межмолекулярных взаимодействий. В жидкой воде электростатические взаимодействия типа Н-связи между молекулами разрываются и быстро образуются.
Мы рассмотрим это с двух точек зрения. Во-первых, как выглядит раствор на молекулярном уровне, во-вторых, как раствор ведет себя с течением времени. Для начала нам нужно понять, как выглядит вода сама по себе. Из-за своей способности создавать и отдавать множественные электростатические взаимодействия типа водородных связей в тетраэдрическом расположении молекулы воды образуют динамическую трехмерную сеть межмолекулярных взаимодействий. В жидкой воде электростатические взаимодействия типа Н-связи между молекулами разрываются и быстро образуются.
Чтобы вставить молекулу А, известную как растворенное вещество, в эту сеть, вы должны разорвать некоторые электростатические взаимодействия типа водородных связей между молекулами воды, известной как растворитель. Если молекулы A могут вступать в электростатические взаимодействия типа водородной связи с молекулами воды, то есть если они гидрофильны, то суммарное влияние на свободную энергию системы будет незначительным. Такая молекула растворима в воде. Итак, что определяет растворимость растворенного вещества. Согласно оценке первого порядка, каждая молекула растворенного вещества должна иметь вокруг себя по крайней мере один слой молекул воды, иначе она будет вынуждена взаимодействовать с другими молекулами растворенного вещества. Если количество этих взаимодействующих молекул растворенного вещества достаточно велико, растворенное вещество больше не будет находиться в растворе. В некоторых случаях агрегаты молекул растворенного вещества могут, поскольку они достаточно малы, оставаться в растворе во взвешенном состоянии. Это ситуация, известная как коллоид. В то время как раствор состоит из отдельных молекул растворенного вещества, окруженных молекулами растворителя, коллоид состоит из агрегатов молекул растворенного вещества в растворителе. Мы могли бы предсказать, что при прочих равных условиях (нереалистичное предположение) чем больше молекула растворенного вещества, тем ниже ее растворимость. Вы могли бы сгенерировать аналогичное правило для размера частиц в коллоиде.
Итак, что определяет растворимость растворенного вещества. Согласно оценке первого порядка, каждая молекула растворенного вещества должна иметь вокруг себя по крайней мере один слой молекул воды, иначе она будет вынуждена взаимодействовать с другими молекулами растворенного вещества. Если количество этих взаимодействующих молекул растворенного вещества достаточно велико, растворенное вещество больше не будет находиться в растворе. В некоторых случаях агрегаты молекул растворенного вещества могут, поскольку они достаточно малы, оставаться в растворе во взвешенном состоянии. Это ситуация, известная как коллоид. В то время как раствор состоит из отдельных молекул растворенного вещества, окруженных молекулами растворителя, коллоид состоит из агрегатов молекул растворенного вещества в растворителе. Мы могли бы предсказать, что при прочих равных условиях (нереалистичное предположение) чем больше молекула растворенного вещества, тем ниже ее растворимость. Вы могли бы сгенерировать аналогичное правило для размера частиц в коллоиде.
Теперь мы можем обратиться к концептуально более сложной ситуации — поведению гидрофобной молекулы растворенного вещества в воде. Такая молекула не может вступать с водой в электростатические взаимодействия типа Н-связи, поэтому при ее введении в воду общее количество электростатических взаимодействий типа Н-связи в системе уменьшается — энергия системы увеличивается (помните, образование связи снижает потенциальная энергия). Однако оказывается, что большая часть этого изменения «энтальпии», условно обозначаемого как ΔH, компенсируется ван-дер-ваальсовыми взаимодействиями (то есть электростатическими взаимодействиями, отличными от водородных связей) между молекулами. Как правило, чистый энтальпийный эффект минимален. Что-то еще должно происходить, чтобы объяснить нерастворимость таких молекул.
Обратимся к энтропии: В жидкой воде молекулы обычно находятся в состоянии, при котором максимальное количество существующих электростатических взаимодействий типа Н-связи. А поскольку эти взаимодействия имеют четкую, примерно тетрагональную геометрию, их наличие ограничивает возможную ориентацию молекул друг относительно друга. Это ограничение фиксируется, когда вода замерзает; это основа образования кристаллов льда, почему плотность воды увеличивается перед замерзанием и почему лед плавает в жидкой воде 164 . В отсутствие гидрофобной молекулы растворенного вещества существует множество эквивалентных способов, которыми молекулы жидкой воды могут взаимодействовать для создания этих геометрически заданных ориентаций. Но присутствие молекулы растворенного вещества, которая не может образовывать электростатические взаимодействия типа водородных связей, ограничивает это число до гораздо меньшего числа конфигураций, которые приводят к максимальному образованию водородных связей между молекулами воды. Конечным результатом является то, что молекулы воды располагаются ограниченным числом способов вокруг каждой молекулы растворенного вещества; они находятся в более упорядоченном, то есть в более невероятном состоянии, чем в отсутствие растворенного вещества.
А поскольку эти взаимодействия имеют четкую, примерно тетрагональную геометрию, их наличие ограничивает возможную ориентацию молекул друг относительно друга. Это ограничение фиксируется, когда вода замерзает; это основа образования кристаллов льда, почему плотность воды увеличивается перед замерзанием и почему лед плавает в жидкой воде 164 . В отсутствие гидрофобной молекулы растворенного вещества существует множество эквивалентных способов, которыми молекулы жидкой воды могут взаимодействовать для создания этих геометрически заданных ориентаций. Но присутствие молекулы растворенного вещества, которая не может образовывать электростатические взаимодействия типа водородных связей, ограничивает это число до гораздо меньшего числа конфигураций, которые приводят к максимальному образованию водородных связей между молекулами воды. Конечным результатом является то, что молекулы воды располагаются ограниченным числом способов вокруг каждой молекулы растворенного вещества; они находятся в более упорядоченном, то есть в более невероятном состоянии, чем в отсутствие растворенного вещества. Конечным результатом будет уменьшение энтропии (обозначенной как ΔS), меры вероятности состояния. ΔS будет отрицательным по сравнению с расположением молекул воды в отсутствие растворенного вещества.
Конечным результатом будет уменьшение энтропии (обозначенной как ΔS), меры вероятности состояния. ΔS будет отрицательным по сравнению с расположением молекул воды в отсутствие растворенного вещества.
Как это влияет на то, является ли растворение молекулы в воде термодинамически благоприятным или неблагоприятным. Оказывается, энергия взаимодействия (ΔH) большинства растворенных веществ в растворителе близка к 0, так что разница заключается в ΔS. Имея в виду, что ΔG = ΔH — TΔS, если ΔS отрицательно, то -T ΔS будет положительным. ΔG термодинамически благоприятной реакции по определению отрицательна. Отсюда следует, что реакция:
\[\text{вода} + \text{раствор} \rightleftharpoons\text{раствор (вода + раствор)}\]
будет термодинамически неблагоприятным; реакция пойдет влево. То есть, если мы начнем с раствора, он отделится так, что растворенное вещество будет удалено из воды. Как это произошло? Молекулы растворенного вещества объединяются друг с другом. Это снижает их воздействие на воду, поэтому ΔS для агрегации положителен. Если растворенным веществом является масло, и мы смешиваем его с водой, масло отделится от воды за счет увеличения энтропии, связанного с минимизацией взаимодействия растворенного вещества с водой. Этот же основной процесс оказывает решающее влияние на макромолекулярные структуры.
Если растворенным веществом является масло, и мы смешиваем его с водой, масло отделится от воды за счет увеличения энтропии, связанного с минимизацией взаимодействия растворенного вещества с водой. Этот же основной процесс оказывает решающее влияние на макромолекулярные структуры.
Вопросы для размышления:
- Учитывая то, что вы знаете о воде, почему лед менее плотный, чем жидкая вода?
- Марка модели, связывающая растворимость молекулы с гидрофильной поверхностью с объемом молекулы?
- Используйте свою модель, чтобы предсказать влияние на растворимость, если ваша молекула с гидрофильной поверхностью имеет гидрофобную внутреннюю часть.
- При каких условиях энтропийные эффекты могут влиять на взаимодействие между двумя молекулами растворенного вещества?
Авторы и авторство
Эта страница под названием 5.11: Interacting with Water распространяется по незаявленной лицензии, ее авторами, ремиксами и/или кураторами являются Майкл В. Климковски и Мелани М. Купер.
Климковски и Мелани М. Купер.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Майкл Климковски и Мелани Купер
- Показать оглавление
- нет
- Теги
- Биоосновы
Молекула воды и ее взаимодействия | Вода: очень краткое введение
Фильтр поиска панели навигации
Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы
Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать
ЦитироватьРазрешения
Делиться
- Твиттер
- Подробнее
Cite
Finney, John,
‘The water molecule and its interactions’
,
Water: A Very Short Introduction
, Very Short Introductions
(
Oxford,
2015;
online edn,
Oxford Academic
, 27 августа 2015 г.
), https://doi.org/10.1093/actrade/9780198708728.003.0002,
, по состоянию на 5 ноября 2022 г.
Выберите формат
Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации
Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Oxford AcademicВода: очень краткое введение Очень краткое введениеФизическая химияКнигиЖурналы
Термин поиска на микросайте
Advanced Search
Abstract
В статье «Молекула воды и ее взаимодействия» обсуждаются структурные и электрические свойства молекулы воды. Молекула воды состоит из двух атомов водорода, соединенных ковалентными связями с одним атомом кислорода. Молекулы воды взаимодействуют друг с другом через тип взаимодействия, называемый водородной связью. Тетраэдрическое расположение четырех молекул воды вокруг центральной является ключом к пониманию воды. Он помогает объяснить структуру воды в ее различных состояниях, ее свойства и то, как она взаимодействует с другими видами молекул, позволяя исследовать свойства и поведение широкого спектра химических, физических и биологических систем, в которых участвует вода. .
Молекула воды состоит из двух атомов водорода, соединенных ковалентными связями с одним атомом кислорода. Молекулы воды взаимодействуют друг с другом через тип взаимодействия, называемый водородной связью. Тетраэдрическое расположение четырех молекул воды вокруг центральной является ключом к пониманию воды. Он помогает объяснить структуру воды в ее различных состояниях, ее свойства и то, как она взаимодействует с другими видами молекул, позволяя исследовать свойства и поведение широкого спектра химических, физических и биологических систем, в которых участвует вода. .
Ключевые слова:
атомная теория, двуокись углерода, Джон Дальтон, водород, водородная связь, молекула, тетраэдрический угол, вода
Предмет
Физическая химия
Серия
Краткие введения
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.